I. Реакции, в которых вода играет роль окислителя. Химические свойства вода
строение и какова критическая температура
Основное вещество, которое позволяет существовать жизни на планете – это вода. Она необходима в любом состоянии. Изучение свойств жидкости привело к образованию целой науки – гидрологии. Предмет изучения большинства ученых – это физические и химические свойства воды. Они понимают под этими свойствами: критические температуры, кристаллическую решетку, примеси и другие индивидуальные особенности химического соединения.
...
Вконтакте
Google+
Мой мир
Изучение
Формула воды известна каждому школьнику. Это три простых знака, но содержатся они в 75% от общей массы всего на планете.
Н2О – это два атома водорода и один — кислорода. Структура молекулы имеет эмпирическую форму, поэтому свойства жидкости такие многообразные, несмотря на простой состав. Каждая из молекул находится в окружении соседей. Они связаны одной кристаллической решеткой.
Простота строения позволяет жидкости существовать в нескольких агрегатных состояниях. Ни одно вещество на планете не может этим похвастаться. Н2О очень подвижна, она уступает в этом свойстве лишь воздуху. Каждый осведомлен о круговороте воды, о том, что после испарения ее с поверхности земли, где-то далеко проходит дождь или снег. Климат регулируется именно благодаря свойствам жидкости, которая может отдавать тепло, а сама при этом практически не изменяет свою температуру.
Физические свойства
Н2О и ее свойства зависят от многих ключевых факторов. Основные из них:
- Кристаллическая решетка. Строение воды, а точнее ее кристаллической решетки, обусловлено агрегатным состоянием. Она имеет рыхлое, но очень прочное строение. Снежинки показывают решетку в твердом состоянии, а вот в привычном – жидком, у воды нет четкости в строении кристаллов, они подвижны и изменчивы.
- Строение молекулы – шар. Но влияние земного притяжения заставляет воду принимать форму сосуда, в котором находится. В космосе она будет геометрически правильной формы.
- Реагирует вода с другими веществами, в том числе с теми, кто обладает неразделенными электронными парами, среди них спирт и аммиак.
- Обладает высокой теплоемкостью и теплопроводностью, быстро нагревается и долго не остывает.
- Еще со школы известно, что температура кипения — 100 градусов Цельсия. В жидкости появляются кристаллы при понижении до +4 градусов, а вот лед образуется при еще большем снижении. Температура кипения зависит от давления, в которое поместить Н2О. Есть эксперимент, при котором температура химического соединения достигает 300 градусов, при этом жидкость не кипит, а плавит свинец.
- Еще одним важным свойством является поверхностное натяжение. Формула воды позволяет ему быть очень прочным. Ученые выяснили, чтобы разорвать его потребуется сила с массой больше 100 тонн.
Интересно! Н2О, очищенная от примесей (дистиллированная), не может проводить ток. Это свойство оксида водорода появляется лишь при наличии растворенных в нем солей.

Другие особенности
Лед – это уникальное состояние, которое свойственно оксиду водорода. Он образует рыхлые связи, которые легко деформируются. Кроме того, расстояние между частицами значительно увеличивается, делая плотность льда намного ниже жидкости. Это позволяет водоемам не промерзать полностью в зимний период, сохраняя жизнь под слоем льда. Ледники – большой запас пресной воды.
Интересно! У Н2О есть уникальное состояние, которое называется явлением тройной точки. Это когда она находится сразу в трех своих состояниях. Возможно это условие, лишь при температуре 0,01 градус и давлении 610 Па.
Химические свойства
Основные химические свойства:
- Разделяют воду по жесткости, от мягкой и средней — до жесткой. Этот показатель зависит от содержания солей магния и калия в растворе. Есть также такие металлы, которые находятся в жидкости постоянно, а от некоторых можно избавиться кипячением.
- Окисление и восстановление. Н2О влияет на процессы, изучаемые в химии, происходящие с другими веществами: одни она растворяет, с другими вступает в реакцию. Исход любого эксперимента зависит от правильного выбора условий, при которых он проходит.
- Влияние на биохимические процессы. Вода основная часть любой клетки, в ней как в среде, происходят все реакции в организме.
- В жидком состоянии впитывает в себя газы, которые неактивны. Их молекулы располагаются между молекулами Н2О внутри полостей. Так образуются клатраты.
- При помощи оксида водорода образуются новые вещества, которые не связаны с окислительно-восстановительным процессом. Речь идет о щелочах, кислотах и основаниях.
- Еще одна характеристика воды — это способность образовывать кристаллогидраты. Оксид водорода при этом остается в неизменном виде. Среди обычных гидратов можно выделить медный купорос.
- Если через соединение пропустить электрический ток, то можно разложить молекулу на газы.

Важность для человека
Очень давно люди поняли неоценимое значение жидкости для всего живого и планеты в целом. Без нее человек не может прожить и недели. Какого же полезное действие от этого самого распространенного на Земле вещества?
- Самое главное применение — это наличие в организме, в клетках, где проходят все важнейшие реакции.
- Образование водородных связей благоприятно сказывается на живых существах, ведь при изменении температуры жидкость в теле не замерзает.
- Человек давно применяет Н2О в бытовых нуждах, кроме приготовления пищи, это: стирка, уборка, купание.
- Ни один промышленный завод не может работать без жидкости.
- Н2О – источник жизни и здоровья, она является лекарством.
- Растения используют ее на всех этапах своего развития и жизни. С ее помощью они производят кислород, такой необходимый для жизни живых существ, газ.
Кроме самых очевидных полезных свойств, их имеется еще очень много.

Важность воды для человека
Критическая температура
У Н2О, как и у всех веществ, есть температура, которая называется критической. Критическая температура воды определяется методом ее нагрева. До 374 градусов по Цельсию жидкость называют паром, она еще может превратиться обратно в привычное жидкое состояние, при определенном давлении. Когда температура вышей этой критической отметки, то вода как химический элемент, превращается в газ безвозвратно.
Применение в химии
Большой интерес у химиков Н2О вызывает благодаря основному своему свойству – умению растворять. Часто ученые ею очищают вещества, чем создают благоприятные условия для проведения экспериментов. Во многих случаях она является средой, в которой можно провести опытные испытания. Кроме того, Н2О сама участвует в химических процессах, влияя на тот или иной химический эксперимент. Она соединяется с неметаллическими и металлическими веществами.
Три состояния
 Вода предстает перед людьми в трех состояниях, называемых агрегатными. Это жидкость, лед и газ. Вещество одно и то же по составу, но разное по свойствам. У
Вода предстает перед людьми в трех состояниях, называемых агрегатными. Это жидкость, лед и газ. Вещество одно и то же по составу, но разное по свойствам. У
мение перевоплощаться – очень важная характеристика воды для всей планеты, таким образом, происходит ее круговорот.
Сравнивая все три состояния, человек чаще видит химическое соединение все же в жидком виде. Вода не имеет вкуса и запаха, а то, что ощущается в ней, это из-за наличия примесей, растворенных в ней веществ.
Основные свойства воды в жидком состоянии — это: огромная сила, позволяющая точить камни и рушить скалы, а также возможность принимать любую форму.
Мелкие частицы при замерзании сокращают скорость своего движения и увеличивают дистанцию, поэтому структура льда пористая и по плотности ниже жидкости. Лед применяется в холодильных установках, для различных бытовых и промышленных целей. В природе лед несет лишь разрушения, выпадая в виде града или лавины.
Газ – еще одно состояние, который образуется, когда не достигается критическая температура воды. Обычно при температуре больше 100 градусов, или испаряясь с поверхности. В природе это облака, туманы и испарения. Большую роль искусственное газообразование сыграло в техническом прогрессе в 19 веке, когда были изобретены паровые двигатели.
Количество вещества в природе
75% — такая цифра покажется огромной, но это вся вода на планете, даже та, которая находится в разных агрегатных состояниях, в живых существах и органических соединениях. Если же учесть лишь жидкое, то есть воду, находящуюся в морях и океанах, а также в твердую – в ледниках, то процент становится 70,8%.
Распределение процентного содержания примерно такое:
- моря и океаны – 74,8%
- Н2О пресных источников, распределенная неравномерно по планете, в ледниках составляет — 3,4%, а в озерах, болотах и реках лишь 1,1%.
- На подземные источники приходится примерно 20,7% от всего количества.
Характеристика тяжелой воды
Природное вещество – водород встречается в виде трех изотопов, в таком же количестве форм есть и кислород. Это позволяет выделять кроме обычной питьевой воды еще дейтериевую и тритиевую.
Дейтериевая имеет самую устойчивую форму, она встречается во всех природных источниках, но в очень малом количестве. Жидкость с такой формулой обладает рядом отличий от простой и легкой. Так, образование кристаллов в ней начинается уже при температуре 3,82 градуса. А вот температура кипения немного выше — 101,42 градуса Цельсия. У нее больше плотность и способность к растворению веществ значительно снижена. Кроме того, ее обозначают другой формулой (D2O).
Живые системы реагируют на такое химическое соединение плохо. Лишь некоторые виды бактерий смогли в нем приспособиться к жизни. Рыбы и вовсе не выдержали такого эксперимента. В организме человека, дейтерий может находиться несколько недель, а после выводится, не причиняя вреда.
Важно! Пить дейтериевую воду – нельзя!
Уникальные свойства воды. Химия – просто.
Химические свойства воды
Вывод
Широкое применение тяжелая вода нашла в ядерной и атомной промышленности, а обычная — в повсеместном.
Вконтакте
Google+
uchim.guru
Вода
Физические и химические свойства
Физические и химические свойства воды определяются химическим, электронным и пространственным строением молекул Н2O.
Атомы Н и О в молекуле Н20 находятся в своих устойчивых степенях окисления, соответственно +1 и -2; поэтому вода не проявляет ярко выраженных окислительных или восстановительных свойств. Обратите внимание: в гидридах металлов водород находится в степени окисления -1.
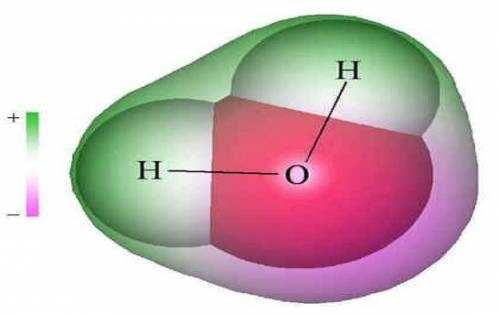
Молекула Н2O имеет угловое строение. Связи Н-O очень полярны. На атоме О существует избыточный отрицательный заряд, на атомах Н - избыточные положительные заряды. 8 целом молекула Н2O является полярной, т.е. диполем. Этим объясняется тот факт, что вода является хорошим растворителем для ионных и полярных веществ.
Наличие избыточных зарядов на атомах Н и О, а также неподеленных электронных пар у атомов О обусловливает образование между молекулами воды водородных связей, вследствие чего они объединяются в ассоциаты. Существованием этих ассоциатов объясняются аномально высокие значения т. пл. и т. кип. воды.
Наряду с образованием водородных связей, результатом взаимного влияния молекул Н2O друг на друга является их самоионизация:в одной молекуле происходит гетеролитический разрыв полярной связи О-Н, и освободившийся протон присоединяется к атому кислорода другой молекулы. Образующийся ион гидроксония Н3О+ по существу является гидратированным ионом водорода Н+ • Н2O, поэтому упрощенно уравнение самоионизации воды записывается так:
Н2O ↔ H+ + OH-
Константа диссоциации воды чрезвычайно мала:
Это свидетельствует о том, что вода очень незначительно диссоциирует на ионы, и поэтому концентрация недиссоциированных молекул Н2O практически постоянна:
В чистой воде [Н+] = [ОН-] = 10-7 моль/л. Это означает, что вода представляет собой очень слабый амфотерный электролит, не проявляющий в заметной степени ни кислотных, ни основных свойств.Однако вода оказывает сильное ионизирующее действие на растворенные в ней электролиты. Под действием диполей воды полярные ковалентные связи в молекулах растворенных веществ превращаются в ионные, ионы гидратируются, связи между ними ослабляются, в результате чего происходит электролитическая диссоциация. Например: HCl + Н2O - Н3O+ + Сl-
(сильный электролит)
(или без учета гидратации: HCl → Н+ + Сl-)
Ch4COOH + h3O ↔ Ch4COO- + H+ (слабый электролит)
(или Ch4COOH ↔ Ch4COO- + H+)
Согласно теории кислот и оснований Брёнстеда-Лоури, в этих процессах вода проявляет свойства основания (акцептор протонов). По той же теории в роли кислоты (донора протонов) вода выступает в реакциях, например, с аммиаком и аминами:
Nh4 + h3O ↔ Nh5+ + OH-
Ch4Nh3 + h3O ↔ Ch4Nh4+ + OH-
Окислительно-восстановительные реакции с участием воды
Эти реакции возможны только с сильными восстановителями, которые способны восстановить ионы водорода, входящие в состав молекул воды, до свободного водорода.
1) Взаимодействие с металлами
а) При обычных условиях Н2О взаимодействует только со щел. и щел.-зем. металлами:
2Na + 2Н+2О = 2NaOH + H02↑
Ca + 2Н+2О = Ca(OH)2 + H02↑
б) При высокой температуре Н2О вступает в реакции и с некоторыми другими металлами, например:
Mg + 2Н+2О = Mg(OH)2 + H02↑
3Fe + 4Н+2О = Fe2O4 + 4H02↑
в) Al и Zn вытесняют Н2 из воды в присутствии щелочей:
2Al + 6Н+2О + 2NaOH = 2Na[Al(OH)4] + 3H02↑
2) Взаимодействие с неметаллами, имеющими низкую ЭО (реакции происходят в жестких условиях)
C + Н+2О = CO + H02↑ («водяной газ»)
2P + 6Н+2О = 2HPO3 + 5H02↑
В присутствии щелочей кремний вытесняет водород из воды:
Si + Н+2О + 2NaOH = Na2SiO3 + 2H02↑
3) Взаимодействие с гидридами металлов
NaH + Н+2 O = NaOH + H02↑
Cah3 + 2Н+2О = Ca(OH)2 + 2H02↑
4) Взаимодействие с угарным газом и метаном
CO + Н+2O = CO2 + H02
2Ch5 + O2 + 2Н+2 O = 2CO2 + 6H02
Реакции используются в промышленности для получения водорода.
ти реакции возможны только с очень сильными окислителями, которые способны окислить кислород СО С. О. -2, входящий в состав воды, до свободного кислорода O2 или до пероксид-анионов [O2]2-. В исключительном случае (в реакции с F2) образуется кислород со c o. +2.
1) Взаимодействие с фтором
2F2 + 2Н2O-2 = O02 + 4HF
или:
2F2 + Н2O-2 = O+2F2 + 2HF
2) Взаимодействие с атомарным кислородом
Н2O-2 + O• = Н2O-2
3) Взаимодействие с хлором
При высокой Т происходит обратимая реакция
2Cl2 + 2Н2O-2 = O02 + 4HCl
Под действием электрического тока или высокой температуры может происходить разложение воды на водород и кислород:
2Н+2O-2 = 2H02↑ + O02↑
Термическое разложение - процесс обратимый; степень термического разложения воды невелика.
I. Гидратация ионов. Ионы, образующиеся при диссоциации электролитов в водных растворах, присоединяют определенное число молекул воды и существуют в виде гидратированных ионов. Некоторые ионы образуют столь прочные связи с молекулами воды, что их гидраты могут существовать не только в растворе, но и в твердом состоянии. Этим объясняется образование кристаллогидратов типа CuSO4 • 5h3O, FeSO4• 7Н2O и др., а также аквакомплексов: [Cr(h3O)6]CI3, [Pt(h3O)4]Br4 и др.
I. Гидролиз солей
Обратимый гидролиз:
а) по катиону соли
Fe3+ + Н2O = FeOh3+ + Н+; (кислая среда. рН
б) по аниону соли
СО32- + Н2O = НСО3- + ОН-; (щелочная среда. рН > 7)
в) по катиону и по аниону соли
Nh5+ + СН3СОО- + Н2O = Nh5OH + СН3СООН (среда, близкая к нейтральной)
Необратимый гидролиз:
Al2S3 + 6Н2O = 2Аl(ОН)3↓ + 3h3S↑
II. Гидролиз карбидов металлов
Al4C3 + 12Н2O = 4Аl(ОН)3↓ + 3Ch5↑ нетан
СаС2 + 2Н2O = Са(ОН)2 + С2Н2↑ ацетилен
III. Гидролиз силицидов, нитридов, фосфидов
Mg2Si + 4Н2O = 2Mg(OH)2↓ + Sih5↑ силан
Ca3N2 + 6Н2O = ЗСа(ОН)2 + 2Nh4↑ аммиак
Cu3P2 + 6Н2O = ЗСu(ОН)2 + 2РН3↑ фосфин
IV. Гидролиз галогенов
Cl2 + Н2O = HCl + HClO
Вr2 + Н2O = НВr + НВrО
V. Гидролиз органических соединений
Классы органических веществ | Продукты гидролиза (органические) |
Галогеналканы (алкилгалогениды) | Спирты |
Арилгалогениды | Фенолы |
Дигалогеналканы | Альдегиды или кетоны |
Алкоголяты металлов | Спирты |
Галогенангидриды карбоновых кислот | Карбоновые кислоты |
Ангидриды карбоновых кислот | Карбоновые кислоты |
Сложные зфиры карбоновых кислот | Карбоновые кислоты и спирты |
Жиры | Глицерин и высшие карбоновые кислоты |
Ди- и полисахариды | Моносахариды |
Пептиды и белки | α-Аминокислоты |
Нуклеиновые кислоты | Азотсодержащие гетероциклы, пентозы (рибоза или дезоксирибоза) |
examchemistry.com
Вода, химические свойства - Знаешь как
Страницы Список страниц 17 18 19 20 21 · · · 45
Содержание страницы
§ 50. Вода
Важнейшими производными кислорода являются его соединения с водородом — вода Н2О и перекись водорода Н2О2.Рассмотрим оба соединения и в первую очередь наиболее распространенное из них — воду.О строении молекулы воды и полярном характере связи между атомами водорода и кислорода говорилось в.§ 6, гл. I. Молекулярный вес воды равен 18. В газообразном состоянии (в виде пара) вода легче воздуха, средний молекулярный вес которого 29. Однако в обычных условиях вода — это жидкость, которая обладает значительно большей плотностью. Это объясняется тем, что молекулы воды объединены (ассоциированы) между собой дополнительно особым видом связи — водородной связью.
Водородная связь названа так потому, что обязательно требует наличия иона водорода. В молекуле воды, где общие электронные пары сильно смещены к кислороду, атомы водорода практически лишены электронов и представляют собой оголенное ядро. Такое ядро (у водорода это протон) притягивается электронными оболочками атомов кислорода соседних молекул, и образуется связь между молекулами. В отличие от остальных видов химической связи, обозначаемых в структурных формулах черточками, водородная связь обозначается пунктиромВодородная связь отличается от химической. Она намного слабее последней. Однако водородную связь нельзя считать просто межмолекулярным сцеплением, она намного прочнее.Водородная связь может возникать не только между молекулами воды. Она часто встречается в органических веществах.
■ 30. Объясните механизм образования водородной связи.31. Перечислите известные вам типы химической связи.32. По какому типу химической связи построена молекула воды?33. Чем вызвана ассоциация молекулы воды? (См. Ответ)
По физическим свойствам вода — это жидкость, не имеющая цвета, вкуса и запаха.Наибольшую плотность (1 г/см3) вода имеет при 4°. При понижении и повышении температуры плотность воды уменьшается (поэтому лед плавает на воде). Темпера-тура плавления льда 0° и кипения воды 100° являются основными точками стоградусной шкалы температур. Вода является прекрасным растворителем жидкостей, газов и твердых веществ. Вода очень плохо проводит электрический ток. Удельная теплоемкость воды самаябольшая среди всех твердых и жидких веществ; она
Вода в природеВода очень широко распространена в природе. Примерно 3/4 поверхности земного шара заняты водой. Это океаны, моря, наземные текучие пресные воды, озера, пресные и соленые, ледники, подземные воды, водяной пар; постоянно в большем или меньшем количестве присутствующий в атмосфере, а также кристаллизационная вода, входящая в состав кристаллогидратов.Поскольку вода является хорошим растворителем, в природных водах всегда содержатся в растворенном виде разнообразные вещества. Морская вода содержит в растворенном состоянии множество различных солей, в том числе хлорид натрия NaCl, сульфат магния MgSO4 и др., которые придают eй горько-соленый вкус. Подземные воды, протекающие по горным породам, растворяют различные вещества, и эти растворы, выходящие на поверх-ность, называются минеральными источниками.
Особенно много минеральных источников на Кавказе. Воды углекислых источников улучшают пищеварение и кровообращение. В этих водах растворен под давлением углекислый газ. Сернистые воды в Мацесте и Пятигорске бывают холодными и горячими,, содержат сульфиды и сероводород. Сероводородные ванны понижают кровяное давление, улучшают работу сердца. Железистые воды Железноводска, Липецка рекомендуются для принятия Внутрь при малокровии. Известковые воды Кисловодска применяются при заболеваниях почек, Воды теплых источников Забайкалья и Туркестана используются в натуральном виде для ванн при общей слабости организма, нервных заболеваниях, кожных болезнях и пр.Если подземные воды находятся вблизи очагов вулканической деятельности, то вода выходит на поверхность горячей в виде так называемых гейзеров. Считают, что в глубинах земной коры имеется огромное количество горячей воды. Ее можно использовать как очень дешевый источник тепловой энергии.
Вода является средой для жизни водных организмов, но она; необходима решительно всем живым организмам, которые без воды не могут существовать. Протоплазма любой клетки представляет собой коллоидный раствор белка в воде. В составе тела человека находится 65% воды. Если организм человека потеряет 20% воды, то изменения, происходящие в клетках, становятся необратимыми, и человек погибает. Без пищи человек может прожить 30-40 суток, а без воды,— не более 7 суток. Жизнь растений без воды также невозможна. Вода для зеленых растений является необходимым компонентом для фотосинтеза.
■ 34. В какой состоянии и где вода встречается в природе? Запишите это в тетрада.
35. Что представляют собой минеральные источники состав состав их воды, каково применение в медицине? (См. Ответ)
§ 51. Химические свойства воды
Вода является безразличным окислом. Вода — чрезвычайно слабый электролит, диссоциирующий по схеме:Н2О ⇄ Н+ + ОН—Некоторые наиболее активные металлы (Na, К, Са, Ва, Аl) могут вытеснять из воды водород:2Na + 2Н2O = 2NaOH + h3↑2Na + 2Н+ + 2OH— = 2Na+ + 2OН— + h3↑2Na + 2H+ = 2Na+ + h3↑Раскаленное железо разлагает воду с выделением водорода и образованием окалины:3Fe + 4Н2O = Fe3O5 + 4Н2
перегретый парЭлементы, обладающие более сильными, чем кислород, окислительными свойствами, например хлор, вытесняют кислород из воды:Cl02 + h3O-2 = 2HCl-1 + [O0] Cl02 + 2е— → 2Сl-1О-2 — 2e— → O0Раскаленный уголь разлагает воду, образуя водяной газ, представляющий собой в основном смесь водорода с окисью углеродаС + Н2О =СО + Н2Вода может реагировать с основными и кислотными окислами, образуя основания и кислоты, г Выделение тепла при растворении в воде едких щелочей и серной кислоты объясняется также происходящими между водой и этими веществами химическими реакциями присоединения воды.Вода может вступать в реакцию с солями, образуя кристаллогидраты. Например, медный купорос, имеющий голубой цвет, является продуктам соединения белого сульфата меди с водой по-уравнению:CuSO4 + 5h3O = СuSO4 = 5h3O + Q
Вода является веществом, весьма стойким химически, однако может разлагаться под действием электрического тока.Вода активно вступает в реакции гидролиза со сложными неорганическими и органическими веществами.
■ 36. Почему воду относят к числу безразличных окислов? (См. Ответ)37. Вполне ли правильно выражение «натрий растворяется в воде»?38. Напишите уравнения реакций взаимодействия с водой основных и кислотных окислов. С какими из них вода не реагирует?39. Для какой дели воду подвергают электролизу?40. Вода реагирует с солями с образованием кристаллогидратов. Напишите уравнение реакции образования кристаллогидрата. Какого иного характера взаимодействие возможно между водой и солями?41. В сосуд с 200 г воды поместили 9,2 г натрия. Какое вещество при этом образовалось? Растворимо ли оно? Если растворимо, то какова его процентная концентрация в полученном растворе?42. К 50 г 30% серной кислоты добавили 5 г серного ангидрида. Какой стала концентрация серной кислоты?43. Среди перечисленных в § 52 свойств воды укажите те, которые можно использовать для получения водорода.44. Какой объем водорода может быть получен при взаимодействии 5 кг железа с перегретым паром, если 10% веса железа прихо-дится на окалину, а 20% полученного водорода теряются?45. Сколько окиси меди можно восстановить водородом, полученным в предыдущей задаче? (См. Ответ)
Вода, входящая в состав кристаллов, называется кристаллизационной водой. Она химически связана с веществом и придает кристаллу соответствующие свойства. Например медный кynopoc,CuSО4 · 5h3O в виде кристаллогидрата с пятью молекулами воды имеет ярко-голубую окраску, которую он теряет при прокаливании вследствие удаления кристаллизационной воды (рис. 45). Природный гипс CaSО4 · 2h3О при слабом нагревании отделяет одну молекулу воды, превращаясь в соединение состава 2CaSО4 · h3O, называемое полуводным гипсом. Этот гипс обладает способностью «схватываться», т. е. при смешивании с водой присоединять к себе недостающую молекулу воды и затвердевать, образуя двуводный гипс CaSО4 · 2h3О:2CaSО4 · h3O + 3h3O = 2(CaSO4 · 2h3O)Эта реакция нашла широкое применение в медицине при наложении гипсовых повязок.Однако если гипс прокалить до полного удаления водыCaSO4 · 2h3O2= CaSO4 + 2Н2O
Рис. 45. Обезвоживание медного купороса1- медный купорос2- выделяемая при нагревании вода
то реакция становится необратимой и вода к сульфату кальция больше не присоединяется.Кристаллогидраты — это химические соединения соли с водой. Их причисляют к комплексным соединениям. Можно назвать еще много кристаллогидратов, например глауберову сольNa2SО4 · 10h3O, железный купорос FeSО4 · 7h3Ои др.
■ 46. Сколько нужно взять воды и кристаллогидрата Na2SO4 · 10h3O, чтобы приготовить 200 г 3% раствора сульфата натрия? (См. Ответ)47. В лаборатории для абсолютирования спирта применяют безводный сульфат меди, с которым кипятят спирт, пока сульфат меди не приобретет голубую окраску. Какая реакция происходит При этом? Насколько увеличится вес 25 г сульфата меди, если считать, что 75% сульфата превратилось в медный купорос?Сколько процентов воды содержалось в спирте, если абсолютированию подверглось 150 г спирта.48. 20 a FеSО4 · 7h3O растворили 180 г воды. Какова концентрация полученного раствора?49. Что такое двуводный гипс, полуводный гипс? Какое применение они находят в медицине?50. Какая вода называется кристаллизационной? (См. Ответ)
53. Способы очистки природных вод
Природная вода не всегда удовлетворяет всем требованиям, которые к ней предъявляются человеком. Поэтому для различных целей вода подвергается разной обработке.Питьевая йода должна быть частой, прозрачной, без запаха и не содержать болезнетворных бактерий. Природная вода, предназначенная для питья, поступает на водоочистительные станции городского водопровода, где ока проходит через систему очистных сооружений (рис. 46). Сначала она проходит через металлические фильтры для
Рис. 46. Система очистных сооружений водоочистительной станции.1-фильтр; 2-отстойник; 3-смесители; 4 — перекачка; 5 — засос воды; 6 — хлорирование; 7 —осадок; 8 — добавление квасцов
очистки от механических примесей, затем поступает в отстойники, где постепенно оседают загрязняющие ее мелкие частицы. Для ускорения их оседания в отстойники обычно добавляют коагулянт — вещество, заставляющее взвеси и коллоидные частицы коагулировать и оседать. В качестве коагулянта применяется хлорид алюминия AlCl3 или сульфат алюминия Al2(SO4)3.После отстаивания вода фильтруется через песок, костный уголь и тканевые фильтры, после чего в ней остаются растворимые соли и микроорганизмы, среди которых могут оказаться болезнетворные бактерии. Для их уничтожения в воду добавляют немного хлорной воды в количестве, которое убивает бактерий, но безвредно для человека. После этого вода поступает в так называемые резервуары чистой воды, где выдерживается некоторое время для того, чтобы полностью проявилось действие хлора. Очищенная вода по водопроводу поступает к потребителям.

Рис. 47. Прибор для перегонки воды.1- колба Вюрца с водой; 2-водяной холодильник Либиха: 3 — алонж; 4- сосуд-приёмник для дистиллированной, воды; 5 — термометр.
В сельских местностях обычно вода не проходит такой сложной системы очистки, а берется прямо из колодцев или других природных водоемов. Такую воду необходимо кипятить, а в случае массовых желудочно-кишечных заболеваний в нее нужно добавлять небольшое количество раствора хлорной извести.
В химических лабораториях и медицине применяется дистиллированная вода. Для полного удаления солей воду перегоняют в так называемых перегонных кубах. Принцип перегонки воды можно наблюдать на лабораторной установке (рис. 47). Вода кипит в колбе . Получающийся, пар по газоотводной трубке поступает в водяной холодильник Либиха 2, где пар конденсируется и стекает через алонж 3 в сосуд-приемник 4. Полученная вода называется дистиллированной. Она совершенно не содержит солей и ее вредно применять для питья. Дистиллятор устроен по тому же принципу (рис. 48).
Рис. 48. Дистиллятор
■ 51. Что такое дистилляция и для каких целей используют дистиллированную воду? 52. Какие требования предъявляют к питьевой воде? 53. Каким образом можно очистить воду: а) от механических загрязнений; б) от растворенных солей; в) от коллоидных частиц? (См. Ответ)
§ 54. Перекись водорода
Перекись водорода — более богатый кислородом окисел по сравнению с водой. Формула перекиси h3О2, но это не значит, что в данном соединении кислород одновалентен. В молекуле перекиси водорода между двумя атомами кислорода имеется одна общая электронная пара. Соединенные таким образом атомы кислорода содержатся не только в перекиси водорода, но и в любой другой перекиси и называются «перекисной цепочкой»Наличие перекисной цепочки делает молекулу не-прочной. Действительно, при самых незначительных воздействиях — хранении в освещенном помещении, нагревании, действии катализатора МnО2 — перекись водо-рода разлагается, превращаясь в воду, с выделением кислорода2Н2О2 = 2Н2O + О2Эта реакция может сопровождаться взрывом.30% раствор перекиси водорода носит название пергидроля.При попадании на кожу он может причинить сильные ожоги. Чистая перекись водорода имеет плотность 1,46 г/с3 и температуру замерзания —1,7°. Раствор перекиси водорода имеет кислую реакцию, что дает основание рассматривать ее как весьма слабую двухосновную кислоту.Некоторые перекиси металлов, например Na2O2; ВаО2, можно рассматривать не только как окислы, но и как своеобразные соли перекиси водорода. Из этих соединений можно получить перекись водорода действием более сильной кислоты:ВаО2 + h3SO4 = BaSO4 + h3O2
О поведении перекиси водорода в окислительно-восстановительных реакциях говорится в § 32. При взаимодействии с органическими веществами перекись водорода ведет себя как окислитель. Безводная перекись водорода вызывает ожоги и самовоспламенение горючих материалов. При ожогах перекисью водорода на коже появляется характерное белое пятно» а затем может образоваться язва. Мерой первой помощи, как и при ожогах кислотами, является промывание большим количеством воды.
Перекись водорода применяют как дезинфицирующее средство в медицине для полосканий, промываний и как кровоостанавливающее средство в виде 3% раствора. Кроме того, ее используют для отбеливания волос, шерсти, шелка, рога и т. д. Перекись водорода используют также для реставрации картин, написанных свинцовыми белилами, которые постепенно темнеют на воздухе, так как под действием сероводорода воздуха в краске образуется сульфид свинца черного цвета. Перекись водорода окисляет сульфид свинца в сульфат но схеме:PbS + h3O2 → PbSO4 + h3OТакие картины протирают слабым раствором перекис» водорода.Хранить перекись водорода следует в склянках темного стекла в прохладном помещении, в темноте, чтобы замедлить постоянно идущий распад.
■ 54. Приведите примеры реакций, в которых перекись водорода проявляла бы свойства окислителя. (См. Ответ)
55, Приведите примеры реакций, в которых перекись водорода проявляла бы свойства восстановителя.
56. Где и как следует хранить перекись водорода в лабораторий? Почему?57. Каковы меры первой помощи при ожогах перекисью водорода?
58. В присутствии двуокиси марганца из перекиси водорода можно получить кислород. Нарисуйте прибор, в котором можно использовать этот процесс.
59. Сколько граммов перекиси бария потребуется для получения 5 молей чистой перекиси водорода?60. Перекись водорода диссоциирует по типу кислот. Напишите уравнение двуступенчатой диссоциации этой кислоты.
61. Где и как применяется перекись водорода в как это связано с её свойствами? (См. Ответ)
§ 55. Воздух
Наша планета окружена воздухом, который необходим для дыхания всем живущим на земле существам. За сутки человек пропускает через свои легкие около 13 000 л воздуха.Воздушная оболочка земли носит название атмосферы (от слов «атмос» — воздух, «сфайра» — шар). В воздухе содержится 78% (объемных) азота, 21% кислорода, 0,96%
Рис. 49. Диаграмма состава воздуха
Инертных газов, главным образом аргона и неона, а так же гелия, криптона и ксенона, 0,03—0,04% двуокиси углерода и 0,01% водорода. Состав воздуха приведен на рис. 49. Средний молекулярный вес воздуха равен 29 у. е.Помимо этого, в состав атмосферы входят случайные примеси, а также переменные составляющие — водяной пар, окислы азота, озон, а также пыль и местные загрязнения воздуха, возникающие Иногда при интенсивной работе предприятий в определенном районе, а также при работе транспорта.
Количество пыли в воздухе может быть очень велико, особенно в больших городах. Пыль нарушает прозрачность воздуха и способствует образованию туманов, так как на пылинках конденсируются капельки воды. В воздухе могут находиться различные микроорганизмы. Среди них могут быть и болезнетворные. Отсюда ясно, какое значение имеет очистка воздуха в городах, как,важно следить за тем, чтобы воздух не загрязняли Промышленные предприятия и транспорт.Для очистки воздуха внутри помещений применяются специальные аппараты кондиционирования воздуха: его фильтруют, увлажняют до нужного состояния, избавляют от пыли и бактерий и поддерживают наиболее благоприятную температуру.1 м3 воздуха при 0° весит 1,293 кг, с увеличением высоты плотность воздуха становится меньше. При —193° воздух переходит в жидкое состояние. Поскольку воздух— это смесь газов с разными температурами кипения, его можно разделить на составные части по температурам кипения или, как говорят, подвергнуть фракционной перегонке.
Широко используется энергия сжатого воздуха, который получают повышением давления атмосферного воздуха с помощью компрессоров. При вдувании сжатого воздуха в домну подача кислорода увеличивается и горение становится более интенсивным.Жидкий воздух представляет собой голубоватую мутную жидкость. Голубую окраску придает ему жидкий кислород, а мутным он бывает потому, что при температуре жидкого воздуха углекислота становится твердой. Если ее отфильтровать, то воздух будет прозрачным.Под влиянием низкой температуры жидкого воздуха некоторые тела приобретают особые, совершенно новые свойства. Например, свинец приобретает упругость стали, ртуть становится настолько твердой, что изготовленным из нее молотком можно забивать гвозди, резина становится хрупкой, как стекло, и от удара разбивается на части. Многие металлы при температуре жидкого воздуха приобретают свойства сверхпроводимости. Если возбудить в металлическом кольце электрический ток, то подключенный к нему гальванометр очень долго будет показывать наличие электрического тока.
Интересно, что большая часть бактерий в жидком воздухе не погибает, а погружается в состояние анабиоза.Если пропитать жидким воздухом горючий материал, который в обычном воздухе либо не воспламеняется, либо горит очень слабо, например опилки или угольный порошок, то при поджигании они моментально сгорают с выделением большого количества газов, поэтому жидкий воздух широко применяют при взрывных работах. Для этого картонные патроны набивают опилками, укладывают во взрывные камеры, пропитывают жидким возду-хом и поджигают. Происходит сильный взрыв. Если взрыв не произошел, то через некоторое время воздух из патрона испаряется, и он снова становится безопасным в отличие от любой другой взрывчатки.
Получают жидкий воздух при высоком давлении и низкой температуре.Сжатый воздух используется в пневматических приборах и различном пневматическом оборудовании, а так-же при кессонных работах. Кессон — это огромный воз-духо- и водонепроницаемый бетонный ящик, внутри ко-торого могут находиться несколько человек. С одной стороны кессон открыт. Его опускают открытой стороной в воду до самого дна, укрепляют грузом, чтобы он не всплывал, и сжатым воздухом вытесняют из него воду. Для вытеснения воды давление воздуха в кессоне доводят до 4 атм. При таком давлении воздух в большом количестве растворяется в крови. При резком уменьшении давления, например при подъеме на поверхность, избыток его быстро выходит из крови в виде пузырьков, которые могут закупорить кровеносные сосуды и даже дойти до сердца. В тяжелых случаях эта так называемая кессонная болезнь может привести к смертельному исходу. Поэтому подъем из кессона осуществляется постепенно, чтобы раствоеренный воздух выходил небольшими порциями.
■ 61. Правильно ля называть воздух смесью газов? Дайте обоснованный ответ. (См. Ответ)62. Какой объем воздуха будет израсходован на сжигание 31 г. фосфора.63. Какой объем займут при нормальных условиях 2 кг воздуха?64. Перечислите, где применяется воздух в технике. (См. Ответ)
19
18 20
znaesh-kak.com
Вода и ее физические и химические свойства
Вода ( оксид водорода) – простейшее устойчивое соединение водорода с кислородом. Молекулярная масса воды 18,0160. На водород приходится 11,19% по массе, а на кислород – 88,81%. В природе существует три изотопа водорода – легкий водород Н1, дейтерий D (Н2) и тритий (Н3) и три изотопа кислорода –О16, О17, О18. Искусственно получены еще два изотопа водорода и шесть изотопов кислорода. Теоретически пять изотопов водорода и девять изотопов кислорода могут образовать 135 разновидностей молекул воды, из которых устойчивыми являются девять, включая стабильные изотопы. В природной воде на долю Н1/2О16 приходится 99,75% по массе, на долю Н1/2О18 – 0,2%, на Н1/2О17 – 0,04% и на Н1Н2О16 – примерно 0,093% . остальные пять разновидностей присутствуют в ничтожных количествах.
Молекула воды имеет угловое строение. Ядра атомов образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине -–ядро атома кислорода. Межъядерное расстояние О-Н близко к 0,1 нм, а расстояние между ядрами атомов водорода равно примерно 0,15 нм. Структурная формула воды имеет вид:
. .
Н : О : Н
. .
Восемь электронов внешнего электронного слоя атома кислорода образуют четыре электронные пары, две из которых создают ковалентные связи О-Н, а две другие представляют собой неподеленные электронные пары. Вследствие смещения электронов, образующих связи О-Н, к атому кислорода атомы водорода приобретают эффективные положительные заряды. Неподеленные электронные пары также смещены относительно ядра атома кислорода и создают два отрицательных полюса.
Измерения молекулярной массы жидкой воды (18,016) показали, что она выше молекулярной массы воды в парообразном состоянии; это свидетельствует об ассоциации молекул – объединении их в сложные агрегаты. Это явление подтверждается и аномально высокими значениями температур плавления и кипения воды. Ассоциация молекул воды обусловлена образованием водородных связей. В твердом состоянии атом кислорода каждой молекулы воды образуют две водородные связи с соседними молекулами.
Чистая природная вода - жидкость без запаха, вкуса и цвета. По сравнению с другими химическими соединениями вода обнаруживает необычные отклонения по ряду физических свойств – плотности, удельной теплоемкости, вязкости и др.
При нагревании воды происходит разрыв водородных связей и уменьшается степень ассоциации молекул воды. Большое значение имеет и тот факт, что вода обладает аномально высокой теплоемкостью – 4,18 ДЖ/(г*К). Высокая теплоемкость воды есть следствие расхода части теплоты на разрыв водородных связей. В природных условиях вода медленно остывает и медленно нагревается, являясь регулятором температуры на Земле.
Температура кипения воды находится в прямой зависимости от давления – чем оно выше, тем выше температура кипения.
Вязкость (способность жидкости оказывать сопротивление различным формам движения) воды закономерно изменяется в зависимости от температуры : уменьшается с ее возрастанием. С повышением концентрации растворенных в воде солей вязкость воды увеличивается. В тоже время действие давления на вязкость воды довольно специфично: с понижением температуры при умеренном давлении вязкость снижается.
Поверхностное натяжение воды с увеличением температуры уменьшается. Такое поверхностное натяжение обеспечивает подъем уровня воды в капиллярной трубке диаметром 0,1 мм на 15 см при t=18 оС. При добавлении солей поверхностное натяжение воды возрастает, но незначительно.
Вследствие асимметрического строения молекула воды обладает резко выраженным дипольным характером, т.е. в молекуле не совпадают центры тяжести положительных и отрицательных зарядов. Дипольный характер молекул воды способствует образованию так называемых продуктов присоединения: к молекулам воды присоединяются молекулы веществ ионного строения или же не ионного, но с выраженным дипольным характером.
Относительная диэлектрическая постоянная воды равна 80 – это очень высокая величина, чем и объясняется такая большая ионизирующая сила воды.
Оптические свойства воды оцениваются по ее прозрачности, которая в свою очередь зависит от длины волны луча, проходящего через воду.
Вода - термически устойчивое вещество. Она выдерживает нагревание до температуры 1000оС и лишь при температуре выше 1000оС частично разлагается на водород и кислород. Термическое разложение (диссоциация) воды протекает с поглощением теплоты, а согласно принципу Ле Шателье, чем выше температура, тем больше степень диссоциации.
Вода – весьма реакционно способное вещество. Она реагирует с оксидами многих металлов ( Na2O, CaO и др.) и неметаллов ( Cl2O, CO2 и др.), образуя кристаллогидраты с некоторыми солями [Al2(SO4)3*18h3O], вступает во взаимодействие с активными металлами (Na,K и др).
Вода - катализатор многих химических реакций, и иногда для прохождения реакции необходимо хотя бы ее следы.
Обладая дипольным характером, вода является растворителем. Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более компонентов. Наиболее распространенными являются жидкие растворы, когда одним из компонентов системы является жидкость, а из всех жидких растворов первостепенное значение имеют водные растворы. Энергия образования молекул воды высока, она составляет 242кДж/моль. Этим объясняется устойчивость воды в природных условиях. Устойчивость в сочетании с электрическими характеристиками и молекулярным строением делают воду практически универсальным растворителем для многих веществ.
Химически чистая вода очень плохо проводит электрический ток, но все же обладает некоторой электропроводностью, так как она способна в очень незначительной степени диссоциировать на ионы водорода и гидоксил-ионы: Н2О Н+ + ОН-
Так как скорость химической реакции прямо пропорциональна действующим массам, т.е. концентрациям реагирующих веществ, поэтому можно написать:
V1= k1[h3O]иv2= k2[H+]*[OH-]
Для воды и разбавленных растворов при неизменной температуре произведение концентраций ионов водорода и гидроксил-ионов есть величина постоянная. Растворы, в которых концентрация ионов водорода и гидоксил-ионов одинаковы, называются нейтральными растворами. Если в растворе [H+] > [OH-] и, следовательно , [H+] > [10 –7] моль/л, то такой раствор называется кислым, а если [H+] < [10-7] моль/л, то раствор называется щелочным. Большинство химических элементов образует более растворимые соединения в кислых средах и менее растворимые в нейтральных. Некоторые элементы образуют легкорастворимые соединения в щелочных растворах. Так, двухвалентное железо может находиться в растворе в менее кислых водах, чем трехвалентное. Гидроксиды магния выпадают из раствора только в сильнощелочных водах. Важной характеристикой миграционной способности элементов является «рН начала выпадения гидроксида». То есть та величина рН раствора, при которой из раствора начинается выпадение гидроксида данного элемента. Эта величина зависит как от свойств самого элемента, так и от условий внешней среды. Например, для большинства элементов с повышением температуры рН осаждения гидроксида повышается. Поэтому в ландшафтах жаркого климата миграционная способность элементов в водной среде может быть более высокой, чем в условиях низких температур.
Среди аномальных свойств воды, играющих важную роль в поддержании жизни на нашей планете, следует отметить:
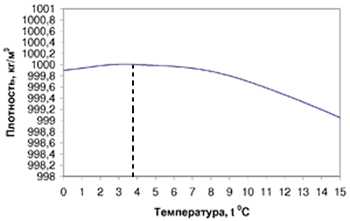
Аномальный вид температурной зависимости плотности воды. Максимум плотности воды наблюдается при температуре около 4оС. Благодаря этому с наступлением морозов поверхностный слой воды охлаждается до 4оС и как более тяжелый опускается на дно водоема, вытесняя более теплые и легкие слои на поверхность. В дальнейшем, когда весь водоем охладится до 4оС, будет охлаждаться только поверхностный слой , который, как более легкий, будет оставаться на поверхности водоема. Лед и покрывающие его снег являются хорошей защитой водоема от промерзания, так как обладают малой теплопроводностью (теплопроводность снега при плотности 0,1 г/см3 соответствует теплопроводности шерсти, а при плотности 0,2 г/см3 – теплопроводности бумаги). Все это в целом способствует сохранению жизни в водоемах в зимнее время.
Теплоемкость воды. Величина теплоемкости воды выше, чем у всех твердых и жидких веществ, за исключением жидкого аммиака и водорода. Благодаря огромной теплоемкости, океаны сглаживают колебания температуры, и перепад температур от экватора до полюса составляет всего 30оС.
Теплота плавления. Значение теплоты плавления воды, равное 6,012 кДж/моль, является наиболее высоким среди твердых и жидких тел, за исключением аммиака и водорода. Благодаря высокой теплоте плавления, на Земле сглаживаются сезонные переходы: весну и осень можно рассматривать как фазовый переход воды. Сравнительно легко нагреваясь или охлаждаясь до 0оС, вода, снег и лед для перехода в другое фазовое состояние требуют значительных расходов энергии. Поэтому эти переходы обычно растягиваются во времени. Следует отметить, например, что при замерзании 1 м3 воды выделяется столько же тепла, сколько при сжигании примерно 10 кг угля.
Теплота испарения. Наибольшее значение теплоты испарения приводит к тому, что большая часть солнечной энергии, достигающей Земли, расходуется на испарение воды, препятствуя перегреву ее поверхности. При конденсации паров воды в атмосфере происходит выделение этой энергии, которая может переходить в кинетическую энергию воздуха, вызывая ураганные ветры.
Поверхностное натяжение. Максимальное, за исключением ртути, поверхностное натяжение воды приводит к появлению ряби и волн на водной поверхности уже при слабом ветре. В результате этого резко возрастает площадь водной поверхности и интенсифицируются процессы теплопередачи между атмосферой и гидросферой. С высоким поверхностным натяжение воды связаны и капиллярные силы, благодаря действию которых вода способна подниматься на высоту до 10-12 метров от уровня грунтовых вод.
Диэлектрическая постоянная. Диэлектрическая постоянная имеет аномально высокое значение. Это определяет самую большую растворяющую способность воды по отношению к веществам с полярной и ионной структурой. Поэтому в природе нет химически чистой воды. Мы всегда имеем дело с ее растворами.
studfiles.net