Аномальные свойства воды: причины, значение. Аномальные свойства воды
Аномальные свойства воды - Вода
Академическая наука до сих пор не смогла дать рациональное объяснение всем аномальным свойствам воды.
Целый ряд свойств воды выпадает из общих закономерностей и правил таких наук как физика и химия. Эти свойства не соответствуют законам «периодической системы», разработанной гениальным ученым-химиком Дмитрием Ивановичем Менделеевым.
Про общие физические и химические свойства воды, мы писали в нашем материале – Химические и физические свойства воды, термины и определения.
В этом же материале, мы кратко перечислим основные аномальные свойства воды.
Аномальные свойства воды. Замерзание и кипение
Температуры замерзания и кипения воды не соответствуют общим закономерностям и законам химии. Так мы знаем, что вода в реальной жизни замерзает при 0°C, а кипит при 100°C, в то время как в соответствии с общими правилами химии эти процессы должны проходить при -90°C (минус девяносто) и -70°C (минус 70) соответственно.
Уникальные термические свойства воды
Вода имеет уникальную по своей величине аномальную теплоемкость равную 4,18 кДж (кг-К). Это означает, что вода медленно охлаждается и медленно нагревается.
Вода является эффективным регулятором температур, она ограничивает резкие перепады температур. Более подробно с этим ее свойством вы можете ознакомиться в нашей статье – Удельная теплоемкость воды, или почему мы такие, какие есть.
Температурная яма
Наибольшая скорость нагрева и охлаждения воды происходит в так называемой «температурной яме», которая образуется вследствие того, что в районе 37 °C теплоемкость у воды наименьшая.
Как мы видим, температура человеческого тела 36,6 °C близка к этому значению.
Эффект Мпембы – эффект горячей воды
Удивительно, но факт – горячая вода замерзает быстрее холодной, что противоречит логике и общему восприятию вещей.
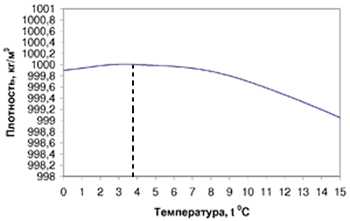
Температура воды + 3,98 °C
Как мы уже отметили выше, температура + 3,98 °C, является для воды важным значением. При понижении температуры до этого уровня вода ведет себя в соответствии с общими законами и правилами этих наук. При дальнейшем понижении температуры у воды начинают проявляются ее аномальные свойства.
При температуре + 3,98 °C у воды плотность имеет наибольшее значение, а объем наименьший.
Объем и плотность
Еще одним важным для всех нас является ее аномальное свойство при замерзании увеличиваться в объеме, тем самым уменьшая свою плотность. Уточним, что до + 3,98 °C вода ведет в соответствии с общими законами химии и физики, а далее проявляются ее аномальные свойства.
 Поверхностное натяжение
Поверхностное натяжение
Еще одним удивительным и во многом аномальным свойством воды является ее поверхностное натяжение.
Хорошо всем известный пример демонстрирует, как аккуратно положенная на воду металлическая швейная игла плавает на ее поверхности, что во многом удивительно. Ведь плотность метала гораздо больше плотности воды.
Вся жизнь на Земле своим существованием во многом обязано именно этому свойству воды.
Вода – отличный растворитель
Вода является отличным растворителем, она удивительно легко растворяет большое количество самых разнообразных веществ и газов. И что тоже весьма важно, так же легко их отдает. Например, благодаря именно этому свойству после дождя мы чувствуем удивительную свежесть – дождь очищает воздух.
Вода и магнитное поле
Под воздействием магнитного поля у воды меняется ее способность к растворению веществ, изменяется скорость, проходящих в ней, химических реакций.
Аномальные свойства воды еще раз подтверждают общеизвестное высказывание – удивительное рядом.
Аномальные свойства воды, или удивительное рядом
Сен 22, 2015 14:34 Watermanvodamama.com
Аномальные свойства воды: причины, значение :: SYL.ru
Люди привыкли к воде и считают ее обычным веществом. Они часто воспринимают ее как нечто само собой разумеющееся до тех пор, пока засуха не начнет угрожать посевам и запасам питьевой воды, или сильное наводнение не создаст угрозу жизни и имуществу. Многие не осознают, что структура воды и ее аномальные свойства обеспечивают существование жизни на Земле.
Один из ранних греческих философов, Фалес Милетский (640-546 гг. до н. э.), исследовал универсальный характер воды. Он считал ее основным элементом, из которого рождается все. Обилие воды было очевидным, но Фалес заметил, что она является единственным веществом, естественным образом присутствующим на Земле одновременно в трех разных состояниях: твердом, жидком и газообразном. В холодный зимний день снег и лед покрывают поля, рядом течет река, а над головой плывут облака.
Формы материи
Все вещества существуют в трех различных состояниях, которые зависят от температуры и давления. Твердые тела обладают определенной формой и имеют кристаллическую внутреннюю структуру. По этому определению вещество, подобное стеклу, будет считаться высоковязкой жидкостью, поскольку оно не обладает кристаллическим строением. Твердые тела склонны противостоять внешним воздействием. Они могут быть преобразованы в жидкость путем нагрева. Температура замерзания воды при давлении в 1 атмосферу равна 0 °С, ниже которой она существует в виде льда.
Жидкость, в отличие от твердого тела, не обладает твердостью и не имеет определенной формы. У нее есть объем, и она принимает форму сосуда, в котором хранится. Внешнее воздействие вынуждает ее течь. Вода представляет собой жидкость между температурами замерзания и кипения (100 °С). Жидкости могут переходить в газообразную фазу при нагреве выше точки кипения.
Газ не имеет ни формы, ни определенного объема. Он принимает форму и занимает объем сосуда, в котором находится. Газ расширяется и сжимается с изменением температуры и давления и способен легко диффундировать в другие газы.

Точки кипения и замерзания
Аномальными свойствами воды являются ее необычно высокие температуры кипения и замерзания по сравнению с другими соединениями с аналогичной молекулярной структурой. Другие подобные вещества в обычных условиях являются газами. Ожидается, что вода с ее более низкой молекулярной массой, чем аналогичные соединения, должна иметь более низкие температуры кипения и замерзания. Однако из-за полярной природы ее молекулы и водородных связей температура ее кипения равна 100 °C, а замерзания – 0 °C. Для сравнения, соответствующие значения у сероводорода h3S равны -60 °C и -84 °C, у селеноводорода h3Se этот показатель составляет -42 °C и -64 °C и у теллуроводорода -2 °C и -49 °C.
Твердая фаза
Как правило, с понижением температуры вещества становятся более плотными, и вода не является исключением. Ее плотность при 25 °C составляет 0,997 г/мл и увеличивается с до максимальной (1 г/мл) при T = 4 °C. В метрической системе измерения килограмм определяется как масса 1 л воды с максимальной плотностью. Между 4 °C и точкой замерзания 0 °C происходит удивительная вещь, которая наблюдается у очень небольшого числа веществ. Вода постепенно расширяется, становясь менее плотной. Плотность льда при 0 °C составляет около 0,917 г/мл. Молекулы воды образуют кристаллы в форме тетраэдра (четырехсторонней фигуры, каждая грань которой представляет собой равносторонний треугольник). Поскольку плотность твердой фазы меньше, чем жидкой, лед плавает. При замораживании объем воды увеличивается на 1%.
Очень важно, что лед расширяется и плавает на поверхности. Из-за этого зимой лопаются водопроводы и появляются выбоины на дорогах. Замерзание и таяние воды в значительной степени ответственно за разрушение скал и образование почв. Кроме того, если бы озера и потоки замерзали снизу вверх, то водная жизнь вообще перестала бы существовать, а климатические и погодные условия резко изменились.

Теплоемкость
Еще одним аномальным свойством воды является ее чрезвычайно высокая способность поглощать тепло без значительного повышения температуры. Например, летнее солнце на пляже нагревает песок до такой степени, что становится невозможно по нему ходить. Вода при этом остается прохладной. Оба вещества поглощают равное количество тепловой энергии, но температура песка выше. Пустой железный котелок, висящий над огнем, быстро раскалится докрасна, но если он заполнен водой, то его нагрев происходит постепенно. Высокая теплоемкость воды делает ее хорошей охлаждающей жидкостью в конденсаторах и автомобильных радиаторах, предотвращающих двигатели от перегрева. Ее значение в 5 раз превышает теплоемкость песка и примерно в 10 раз – железа.
Умеренный климат в прибрежных районах является результатом поглощения в течение дня огромного количества солнечной тепловой энергии водой и медленного высвобождения ее ночью. Внутренние районы вдали от побережья обычно испытывают гораздо более высокие экстремальные температуры. Огромные океаны на Земле (около 75% площади поверхности) отвечают за смягчение климата на нашей планете, поддерживая существование жизни.
Теплота плавления и испарения
С теплоемкостью связана теплота фазового перехода. Это количество тепловой энергии, поглощаемой или высвобождаемой веществом, которое изменяется в фазе (от жидкого до твердого состояния, или наоборот, и от жидкого до газообразного, или наоборот) без изменения температуры. Необычайно высокие значения удельной теплоты плавления (332,4 кДж/кг) и испарения (2256,2 кДж/кг) – очередные аномальные физические свойства воды. При замерзании выделяется такое же количество тепла, которое поглощается в процессе плавления.

Практическим примером использования удельной теплоты плавления воды является использование льда для охлаждения напитков в изолированном кулере. В процессе таяния лед поглощает тепловую энергию напитков, сохраняя их прохладными. Емкость с водой в теплице в холодную зимнюю ночь смягчит температуру в помещении из-за тепла, выделяемого при замерзании. Конденсация пара высвобождает то же количество тепла, которое поглощается в процессе испарения. Удельная теплота испарения в 5 раз превышает теплоту, необходимую для повышения температуры от 0 до 100 °C. Аномальное свойство воды хранить большое количество накопленной тепловой энергии делает паровое отопление эффективным. В процессе конденсации пар высвобождает накопленную тепловую энергию. Дневная гроза в жаркий летний день – еще один пример высвобождения тепловой энергии в верхних слоях атмосферы при конденсации горячего влажного воздуха. Даже ураган является примером влияния перераспределения огромного количества тепловой энергии, поглощенной тропическими океанами.
Системы испарительного охлаждения работают наоборот. Вода в процессе испарения поглощает тепловую энергию из воздуха, охлаждая его.
Универсальный растворитель
Растворитель способен растворять другое вещество с образованием гомогенной смеси (раствора) на молекулярном уровне. Еще одним аномальным свойством воды в химии благодаря ее полярной природе является ее способность растворять другие полярные соединения – соли, спирты, карбоксильные соединения и т. д. В воде растворяется больше веществ, чем в любом другом растворителе. В ней можно найти более половины известных химических элементов, некоторые в высоких концентрациях, а другие – только в следовых количествах. Например, концентрация насыщения хлорида натрия составляет около 36 г на 100 мл, а карбоната кальция – около 0,0015 г. Способность воды растворять вещество зависит от его химического состава, силы химических связей элементов, температуры и рН.
Неполярные соединения, в том числе большинство углеводородов, растворяются в низких или следовых количествах. Например, масла, как правило, плавают на поверхности воды.

Поверхностное натяжение
К аномальным свойствам воды относят и ее самое высокое (после ртути) поверхностное натяжение по сравнению с любой другой жидкостью. Это сила притяжения молекул, расположенных под поверхностью и тех, которые находятся на границе раздела жидкость-воздух. Она удерживает воду от растекания. Полярные соединения, как правило, имеют гораздо более высокое поверхностное натяжение, чем неполярные. И вода не является исключением. При 20 °С данный показатель равен 0,07286 Н/м (у этилового спирта – 0,0228 Н/м).
Без внешнего воздействия капля h3O принимает форму сферы, поскольку эта фигура обладает наименьшей площадью поверхности на единицу объема. Капли дождя являются крошечными пулями, которые при длительном воздействии разрушают горные породы. По этой же причине объекты, более тяжелые, чем вода, могут удерживаться на ее поверхности. Насекомые способны ходить по ней, а лезвие бритвы – плавать.
Водородная связь определяет аномальное свойство воды смачивать большинство поверхностей. Такие вещества считаются гидрофильными. Вода способна подниматься по стенкам стакана и других емкостей. Другие вещества, такие как масла, жиры, воск и синтетика (полипропилен и т. д.), не намокают. Они являются гидрофобными. Мембранные фильтровальные картриджи с размером пор менее 1 мкм изготавливают из гидрофобных полимеров с помощью смачивающих агентов, снижающих поверхностное натяжение воды, чтобы последняя могла проникнуть и оставаться в них. Это явление называется капиллярным эффектом. Он отвечает за движение воды в почве и по корням растений и крови по кровеносным сосудам.

Аномальные свойства воды и их значение для жизни
h3O является неотъемлемым компонентом существования всего живого. Это объясняет недавний интерес к обнаружению воды в других частях Вселенной. Все известные биохимические процессы происходят в водной среде. Большинство живых существ содержат 70–80% h3O по весу.
Кроме того, вода играет значительную роль в процессе фотосинтеза. Растения используют лучистую энергию солнца для превращения воды и углекислого газа в углеводы: 6CO2 + 6h3O + 672 ккал → C6h22O6 + 6O2. Фотосинтез – самая основная и важная химическая реакция на Земле. Он поставляет питательные вещества, прямо или косвенно, всем живым организмам и является основным источником атмосферного кислорода.
Аномальные свойства воды и их причины
Способность элементов формировать соединения зависит от способности их атомов отдавать или принимать электроны. Элементы первого типа становятся положительно заряженными ионами (катионами), а второго – отрицательно заряженными анионами.
Способность элемента взаимодействовать с другими элементами для образования соединений называется валентностью. Она соответствует количеству полученных или отданных электронов. Для неорганических соединений алгебраическая сумма валентных чисел элементов равна нулю. Электростатическое притяжение противоположно заряженных ионов с образованием соединения называется ионной связью.
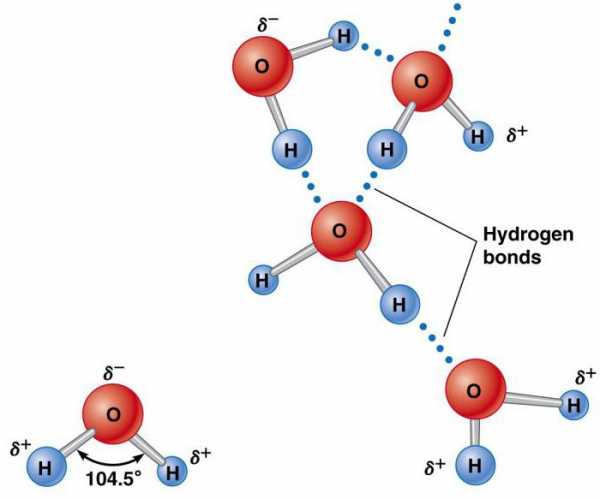
Элементы, которые образуют воду (водород и кислород), существуют отдельно в молекулах h3 и O2, содержащих по два атома. Они удерживаются вместе благодаря обмену электронной парой в химической связи, называемой ковалентной. Она намного сильнее ионной. Два атома, удерживаемые вместе ковалентной связью, образуют намного более устойчивую молекулу, чем ее составные части. В ней водород объединяется кислородом посредством общих электронных пар. Это уникальное распределение электронов в образованном химическом соединении заставляет атомы H располагаться по отношению к O под углом 104,5°.
Аномальные физические свойства воды объясняются ее структурой и химической связью.
Атом кислорода оказывает относительно сильное воздействие на общую пару электронов, в результате чего атомы водорода становятся электроположительными, а атом кислорода – электроотрицательной областью. Поскольку положительно и отрицательно заряженные участки распределены неравномерно по отношению к центральной точке, молекула воды является полярной.
Такая ее природа заставляет ее становиться электростатически привлекательной для других молекул h3O, а также ионов и контактных поверхностей с заряженными участками. Электроположительные атомы водорода притягиваются к электроотрицательным атомам кислорода соседних молекул воды. Это явление называется водородной связью. Ее прочность составляет всего около 10% ковалентной, но она отвечает за большинство аномальных физических свойств воды. К ним относятся высокие температуры замерзания и кипения, теплоемкость, удельная теплота плавления и испарения, растворимость и поверхностное натяжение.
Водородная связь отвечает за поддержание целостности молекулы h3O во время химических реакций. В то время как другие соединения подвергаются ионизации, сама вода сохраняет свою химическую целостность. Лишь относительно небольшое число молекул ионизируется в водород и гидроксильные ионы. Поэтому h3O является относительно плохим проводником электрического тока. Специфическое сопротивление теоретически чистой воды составляет 18,3 МОм∙см, в то время как питьевая имеет удельное сопротивление менее 10 000 Ом∙см. Таким образом можно легко проверить чистоту h3O.
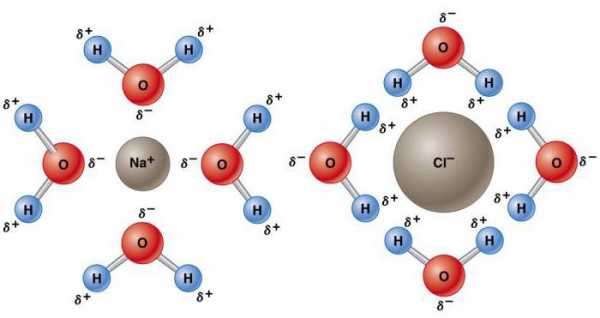
Аномальные свойства воды объясняются наличием водородных связей, из-за которых имеет место низкая плотность льда. Вдоль них при замерзании располагаются молекулы, что приводит к расширению вещества. По этой причине лед плавает на поверхности воды. Повышенное давление снижает температуру плавления. Давление, создаваемое лезвием конька, топит лед, создавая слой, обеспечивающий изящное скольжение. Даже при чрезвычайно низких температурах высокое давление ослабляет кристаллическую решетку. Это является причиной того, что огромные ледяные массы, такие как ледники, постепенно движутся.
Дипольный момент
Полярная природа молекулы воды заставляет ее ориентироваться в электрическом или магнитном поле. Электроотрицательный атом кислорода выстраивается к положительному полюсу, а электроположительные атомы водорода – в направлении отрицательного. Вода имеет исключительно большой дипольный момент, представляющий собой произведение расстояния между зарядами, умноженное на величину заряда.
Диэлектрическая проницаемость является еще одним свойством, связанным с дипольным моментом. Молекулы воды путем выравнивания в электрическом поле стремятся нейтрализовать его и создать устойчивость к передаче электростатического заряда. Диэлектрическая проницаемость вещества определяется ε в уравнении F = Q1∙Q2/ε∙r2, где F – сила между двумя зарядами Q, разделенная расстоянием r в среде.
По мере увеличения диэлектрической проницаемости сила между зарядами уменьшается. Высокая диэлектрическая постоянная уменьшает силу притяжения ионов, что объясняет аномальные химические свойства воды растворять самые разнообразные вещества.
Заключение
Для людей вода – это обычное вещество, которое часто принимается как должное. Несмотря на то что аномальные свойств воды объясняются на атомном уровне, ее значение действительно велико. Очевидно, что она необходима для существования жизни на Земле. Аномальные свойства воды, кратко говоря, позволяют ей служить медиатором химических и биохимических процессов, формировать нашу природную среду и участвовать в создании климата и погоды.
www.syl.ru
Аномальные свойства воды
РОЛЬ ВОДЫ В БИОСФЕРНЫХ ПРОЦЕССАХ
Вода — самое распространенное вещество на Земле, изначально существовавшее на нашей планете.
Молекулы воды, состоящие из двух атомов водорода и одного атома кислорода, образуют исключительно устойчивое химическое соединение, которое может существовать в самых разных условиях — в космосе, на поверхности Земли и в ее мантии. Атомы водорода и кислорода существуют в виде нескольких нуклидов. Стабильных нуклидов водорода два — обычный водород 1Н, или протий, и тяжелый водород 2Н, или дейтерий (их соотношение в природе 6700:1). Стабильных нуклидов кислорода три — 1бО, 17О и 18О (их соотношение в природе - 99,759 % ; 0,037 % ; 0,204 %). Обычная природная вода, содержащая нуклиды 1Н и 1бО, составляет 99,73 % гидросферы Земли.
Вода — одна из наиболее важных жизнеобеспечивающих природных сред, образовавшихся в результате эволюции Земли. Она составная часть биосферы, обладает целым рядом аномальных свойств, определяемых структурой ее молекул и влияющих на протекающие в экосистемах физико-химические и биологические процессы.
Аномальные свойства воды
Как известно, свойства простых и сложных веществ находятся в зависимости от их относительной молекулярной массы. С этой точки зрения вода должна быть подобна химическим соединениям водорода с другими элементами VI группы периодической системы химических элементов Д. И. Менделеева: серой (h3S), селеном (h3Se) и теллуром (Н2Те), т. е. кипеть при -70 °С и замерзать при -90 °С (пунктир на рисунке).
Если бы вода обладала такими свойствами, то на Земле она могла бы существовать только в виде пара. Однако вода, в отличие от приведенных веществ, имеет очень высокие температуры замерзания (0 °С) и кипения (100 °С). Это позволяет ей существовать на нашей планете во всех агрегатных состояниях (водяной пар атмосферы, Мировой океан, ледники), что имеет большое значение для геологических, климатических и биологических процессов на Земле.
В отличие от большинства веществ, плотность которых с понижением температуры увеличивается, вода имеет наибольшую плотность при 4 °С (р = 1000 кг/м3), выше и ниже этой температуры она меньше. Плотность воды при 0 °С равна 999,968 кг/м3, тогда как плотность льда при этой температуре — 916,8 кг/м3. Поэтому при замерзании водоемов лед не опускается на дно, а глубокие водоемы вообще не промерзают до дна, за счет чего в них сохраняется жизнь.
Вода обладает уникальными тепловыми характеристиками во всех ее агрегатных состояниях — очень высокими теплотой плавления льда, теплотой испарения и теплоемкостью. Из всех природных твердых и жидких веществ вода обладает наибольшей теплоемкостью: удельная теплоемкость воды при нормальных условиях составляет 4,19 кДжДкг • град). Это делает воду, при том ее количестве, которое имеется на Земле, планетарным аккумулятором тепла, а с учетом круговорота воды, охватывающего все подразделения биосферы, и планетарным переносчиком тепла.
Вода — мощный тепловой стабилизатор, обеспечивающий устойчивый климат на планете в течение тысячелетий. Парниковый эффект, обусловленный присутствием в атмосфере водяного пара и углекислого газа, обеспечивает среднегодовую температуру у поверхности Земли порядка 15 °С, при этом на долю водяного пара приходится 60 % теплового излучения, отражаемого земной поверхностью. Уменьшение содержания водяного пара в атмосфере наполовину вызвало бы понижение температуры у поверхности Земли до катастрофического значения -5 °С. К счастью, в отличие от углекислого газа, содержание которого в атмосфере за счет антропогенных выбросов возрастает (происходит усиление парникового эффекта), содержание водяного пара в атмосфере, обусловленное глобальным геобиохимическим круговоротом воды в биосфере, достаточно стабильно.
Вода — среда жизни
В ходе эволюции вода создала окружающую нас природу, живой мир, да и самого человека: именно водная среда (Мировой океан) могла обеспечить все требования к возникновению и развитию жизни. Она стала тем «питательным бульоном», в котором 3,5 млрд лет назад при специфических внешних условиях зародилась жизнь на Земле.
Вода обеспечивает существование жизни на нашей планете: сложнейшие биохимические реакции в клетках животных и растительных организмов могут протекать только при наличии воды. Все живые существа на Земле содержат воду в большем или меньшем количестве, в среднем около 70-80 %, т. е. на 3/4 состоят из воды. С химической точки зрения живое вещество — это водный раствор, и почти все процессы, обеспечивающие его жизнедеятельность, сводятся к химическим реакциям в водном растворе.
По солевому составу кровь человека и морская вода очень близки. Кровь человека составляет десятую часть от всей жидкости в его теле (в среднем 5 л крови, из них 3,5 л — жидкая составляющая — плазма) и обеспечивает возможность обмена веществ в организме. Одна из ее главных функций, подобно воде в природе, — транспортная (перенос кислорода, питательных веществ, шлаков). Для поддержания жизни человек должен получать около 2,5 л воды в сутки (непосредственно и с пищей). В среднем за всю жизнь человек потребляет и выделяет около 75 т воды, а все человечество — почти четвертую часть годового стока всех рек мира. Без воды человек не проживет и недели, погибнет от жажды. Обезвоживание организма приводит к серьезным нарушениям функционирования различных органов. Человек тяжело переносит потерю 5 % воды, а обезвоживание на 15-25 % приводит к необратимым изменениям в организме и к смерти.
Как известно, кислород атмосферы, играющий исключительно важную роль в функционировании всех аэробных живых организмов, в том числе и человека, — биогенного происхождения. Более 150 млрд. тонн кислорода поставляют ежегодно в атмосферу фитопланктон и наземные растения за счет фотосинтеза — важнейшего биохимического процесса на нашей планете. С помощью масс-спектрометрии и с использованием изотопной разновидности воды Н218О было доказано, что источником кислорода при фотосинтезе служит вода:
nCO2 + nh318O ® [Ch3O]n + n18O2
Было также установлено, что более точное итоговое уравнение фотосинтеза имеет вид:
nCO2 + 2nh318O ® [Ch3O]n + n18O2
откуда следует, что в процессе фотосинтеза вода не только используется, но и образуется.
Одновременно с образованием первичных гидросферы и атмосферы на Земле зародился геологический круговорот воды. Этот планетарный круговорот воды продолжается до сих пор, в нем участвует и живая природа, теперь он имеет геобиохимический характер. «Любое проявление природной воды — глетчерный лед, безмерный океан, почвенный раствор, гейзер, минеральный источник — составляет единое целое, прямо или косвенно, но глубоко связанное между собой», — считал В. И. Вернадский.
Круговорот воды в природе — это непрерывный процесс движения и обмена водой между различными составляющими гидросферы. Примерно за 3000 лет вся современная масса гидросферы испаряется, т. е. интенсивность возобновления воды достаточно велика. Обладая в миллион раз меньшей массой воды, чем масса гидросферы, живые организмы, главным образом растения, пропускают ее через себя (за время порядка 1 млн. лет). Таким образом, природная вода — это тоже продукт жизнедеятельности живых организмов. В круговороте воды на суше доминирующая роль принадлежит растениям, 2/3 осадков образуются за счет транспирации — испарения с поверхности листьев растений. «Вся масса воды, — писал В. И. Вернадский, — и в жидкой, и в газообразной, и в твердой форме находится в непрерывном движении, переполнена действенной энергией, сама вечно меняется и меняет все окружающее... Картина видимой природы определяется водой...»
ВОДНЫЕ РЕСУРСЫ ПЛАНЕТЫ
Велика роль воды в истории человеческой цивилизации. Вся практическая (хозяйственная) деятельность человека с самой глу бокой древности связана с использованием воды. Вода — ценнейший природный ресурс, и нет ни одной отрасли хозяйства, где она не использовалась бы.
Вода — один из важнейших техногенных источников получения энергии, прежде всего электрической. В настоящее время пятая часть вырабатываемой в мире электроэнергии приходится на гидроэлектростанции, при этом следует заметить, что и на тепловых электростанциях (в том числе и на АЭС) именно вода, превращенная в пар, вращает турбины и связанные с ними электрогенераторы.
Похожие статьи:
poznayka.org
Аномальные свойства воды
Вопрос № 21
Аномальные свойства воды
Огромная роль воды в жизни человека и природы послужила причиной того, что она была одним из первых соединений, привлекших внимание ученых. Глубокие философские обобщения привели человечество к необходимости познания физической и химической природы воды. Тем не менее, изучение воды еще далеко не закончено.
Раскрыть ее секреты до конца еще не удалась никому. Человечество упорно в длительном борении за истину, объединяя знания поколений, постепенно открывало все новые и новые специфические особенности этой загадочной жидкости, «сока Жизни».
В 1783 году выдающиеся экспериментаторы Генри Кавендиш (1731-1810) и Антуан Лавуазье (1743-1794) установили, что вода состоит из двух газов: водорода и кислорода и соотношение их выражается формулой Н2 0.
Все достижения современной цивилизации во многом обусловлены использованием и изучением воды. Достаточно назвать водяной пар и паровую машину Джемса Уатта.
Исследование химического состава воды привело к открытию Генри Кавендишем водорода “горячего воздуха”, рождающего воду, к созданию Джонам Дальтонам атомной теории вещества.
Открытие химического состава молекулы воды послужило началом бурному росту науки о биологической роли воды, об ее лечебно-профилактическом использовании.
Вода выступала катализаторам развития многих фундаментальных научных дисциплин. Вспомним также о ее причастности к ядерной физике в виде тяжелой и сверхтяжелой воды. В настоящее время наступила эра всеобщего изучения роли воды в нормальных и патологических процессах жизни, которую можно назвать эрой водной биологии и медицины.
Современному представлению о строении молекулы воды и водных растворов предшествовал бурный период научных и экспериментальных изысканий, подчас противоречивых и трудно воспроизводимых.
Это и химическая теория Д.И. Менделеева, и теория непрерывности газового и жидкого состояния Ван-дер-Ваальса, и гидрольная теория У. Рамзая и Дж. Шильдса, и рентгенографический метод исследования Лауэ, и постулат Дебая о близости структуры жидкого состояния воды к твердой фазе на границе температурного раздела лед-вода и ряд других теорий. Однако, в конце концов основные черты строения молекулы воды были расшифрованы. Как же сейчас мы представляем себе строение воды?
Начнем с элементарного — со строения молекулы воды, состоящей из двух атомов водорода (Н1 ) и одного атома кислорода (О18 ). Оказывается, все многообразие свойств воды и необычность их проявления, в конечном счете, определяются физической природой этих атомов и способом их объединения в молекулу. В отдельно рассматриваемой молекуле воды ядра водорода и кислорода так расположены друг относительно друга, что образуют как бы равнобедренный треугольник — со сравнительно крупным ядром кислорода в вершине и двумя мелкими ядрами водорода у основания (рис. 1, а).
Puc. 1. Строение молекулы воды:
а) — угол между связями О-Н, б) — структура электронного облака молекулы, в) — расположение полюсов заряда.
Электронное облако молекулы, образованное пятью парами электронов, схематически распределено так (рис. 1, б), что внутренняя пара окружает ядро кислорода, две внешние пары неравномерно поделены между ядрами кислорода и водорода, тяготея больше к кислороду, а остальные две пары кислород не делит с водородом, и их заряды остаются частично нескомпенсированными. Таким образом, в молекуле воды оказывается четыре полюса зарядов: два отрицательных за счет избытка электронной плотности у кислородных пар электронов и два положительных — вследствие недостатка электронной плотности у несколько оголенных ядер водорода — протонов.
Эти заряды можно условно представить расположенными в вершинах частично искаженного тетраэдра (рис. 1, в). Вследствие такой асимметричности распределения электрических зарядов молекула воды обладает ярко выраженными полярными свойствами: она является диполем с высоким дипольным моментом — 1,87 Дебая. На рис. 2 показана схема образования молекулы воды.
Рис. 2. Образование молекулы воды.
Как видно на рис. 2, у одного атома кислорода и двух атомов водорода (а) появляются общие электроны, образующие прочную ковалентную связь (б). Если два протона водорода молекулы воды вращаются в одну сторону, то вода называется параводой, в разные стороны — ортоводой.
В обыкновенной воде 3/4 ортоводы. Ряд ученых предполагает, что соотношение орто- и параводы в клетке имеет регуляторное значение. Если строение молекулы воды в общих чертах установлено, то структура воды по-прежнему остается загадкой.
Исследуя воду и, особенно ее водные растворы, ученые раз за разом убеждались, что вода обладает ненормальными — аномальными свойствами, присущими только ей, ее Величеству — Воде, подарившей нам Жизнь и возможность мыслить. Мы даже и не подозреваем, что столь привычные и естественные свойства воды в природе, в различных технологиях, наконец, в обыденной жизни нашей являются уникальными и неповторимыми.
Ученые согласны в том, что вода является одним из самых трудных объектов исследования, так как, прежде всего в воде всегда есть примеси и что она обладает кооперативным характером взаимодействия ее молекул.
В рамках микроскопического подхода структура воды отличается относительно беспорядочным динамически меняющимся расположением молекул, а высокая плотность обуславливает сильное межмолекулярное взаимодействие, осуществляемое посредством водородных связей.
Таким образом, вода представляет собой сложную ассоциированную жидкость с тетраэдрической сеткой молекул, соединенных водородными связями.
В результате теплового движения молекул эта сетка подвержена спонтанной перестройке.
В трехмерной сетке водородных связей размещены флуктуационные микрообъемы молекул воды, обладающие сравнительно малой энергией теплового движения и более высокой степенью структурного упорядочения. Это — микрокластеры.
В то же время вокруг микрокластеров в макрообъеме ассоциированной среды с повышенной энергией теплового движения молекул Н2 0 наблюдается большая степень структурной беспорядочности, то есть более низкий уровень структурного упорядочения.
Вещества — аналоги воды, молекулы которых по химическому составу похожи на воду, — h3 S, h3 Se, h3 Te, то есть соединения водорода и серы, водорода и селена, водорода и теллура и так далее, при комнатной температуре находятся в газообразном состоянии. Казалось бы, вода, сохрани она такие же свойства, должна бы закипать при температуре -70°С, а превращаться в лед при -90 °С. Эти условия вряд ли бы способствовали развитию жизни на Земле, ведь она должна была бы существовать в интервале температур от -70 °С до -90 °С (рис.3). В таком холоде разве возможна жизнь?
Иначе говоря, если бы вода — гидрид кислорода Н2 О — была бы нормальным мономолекулярным соединением, таким, например, как ее аналоги по шестой группе Периодической системы элементов Д.И.Менделеева — гидрид серы h3 S, гидрид селена h3 Se, гидрид теллура h3 Te, то в жидком состоянии вода существовала бы в пределах от минус 95 °С до минус 70 °С, а не такая, какая реально существует сейчас. Нетрудно понять, что в этом случае биологической жизни на Земле не могло бы существовать. На рис.3 показаны необычные точки замерзания и кипения воды по сравнению с другими жидкостями.
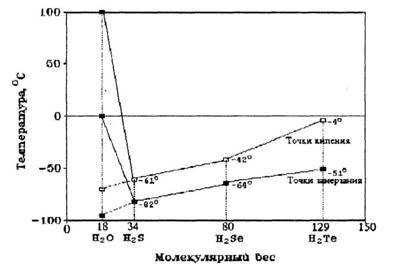
Рис. 3. Аномалии точек кипения и замерзания воды по сравнению с другими соединениями водорода.
Но, к счастью для нас и для всего живого на свете вода обладает аномальными свойствами.
Вода «не признает» периодических закономерностей, характерных для бесчисленного множества соединений на Земле и в Космосе, а следует своим, еще не вполне понятным для науки законам, подарившим нам удивительный «мир Жизни».
«Ненормальные» температуры плавления (0 °С) и кипения (+100 °С) воды далеко не единственная ее аномальность.
Для всей биосферы исключительна важной особенностью воды является ее способность при замерзании увеличивать, а не уменьшать свой объем, то есть уменьшать плотность.
Действительно, при переходе любой жидкости в твердое состояние молекулы располагаются теснее, а само вещество, уменьшаясь в объеме, становится плотнее. Да, для любой из необозримо разных жидкостей, но не воды. Вода и здесь представляет исключение.
При охлаждении вода сначала ведет себя как и другие жидкости: постепенно уплотняясь, уменьшает свой объем. Такое явление можно наблюдать до +3,98 °С. Затем, при дальнейшем снижении температуры до 0 °С, вся вода замерзает и расширяется в объеме. В результате удельный вес льда становится меньше воды и лед плавает. Если бы лед не всплывал, а тонул, то все водоемы (реки, озера, моря) промерзли бы до дна, испарение бы резко сократилось, все пресноводные животные и растения погибли бы. Жизнь на Земле стала бы невозможной.
Вода — единственная жидкость на Земле, лед которой не тонет за счет того, что его объем на 1/11 больше объема воды.
Еще одно удивительное свойство воды — ее огромное поверхностное натяжение. Благодаря тому, что круглые шарики воды очень упруги, идет дождь, выпадает роса.
Что же это за удивительная сила, которая сохраняет капли росы, а поверхностный слой воды в любой лужице делает эластичным и относительно прочным?
Известно, что если стальную иголку осторожно положить на поверхность воды, налитой в блюдце, то иголка не тонет. А ведь удельная масса металла значительно больше, чем у воды. Молекулы воды связаны силой поверхностного натяжения, которая позволяет им подниматься вверх по капиллярам, преодолевая силу земного притяжения. Без этого свойства воды жизнь на Земле была бы также невозможна.
mirznanii.com
Аномальные свойства воды. Теплоемкость воды
Аномальные свойства воды
Вода является легчайшим соединением подгруппы кислорода. Самыми высокими у воды характеристиками оказываются как раз те, которые по сути должны быть самыми низкими: температура кипения и температура замерзания, теплота парообразования, теплота плавления и т.д.
Аномальные свойства воды до сих пор изучаются и анализируются учеными всего мира. Одна только аномальная теплоемкость воды говорит о многом. Вода получила широкое применение в качестве охладителя, и объясняется это не только доступностью этого сырья для промышленных целей, но и относительной дешевизной. Однако причина теплоемкости лежит в физических особенностях воды, которая поглощает огромное количество теплоты, сама же при этом совершенно не нагревается. Стоит отметить, что удельная теплоемкость воды в 5 раз выше, нежели теплоемкость песка и в 10 раз выше, чем теплоемкость железа. Именно благодаря способности воды накапливать достаточно большие запасы тепловой энергии сглаживают резкие колебания температуры на земной поверхности. Причем это совершенно не связано с временами года. За счет такого уникального свойства вода считается основным регуляэнетором теплового режима на нашей планете.
Теплоемкость воды аномальна во многих случаях. При разных температурах получается совершенно разная удельная теплоемкость и при этом характер температурного изменения теплоемкости достаточно своеобразен. Теплоемкость снижается по мере того, как увеличивается температура (это интервал от 0 до 37°С), дальнейшее увеличение температуры приводит к увеличению удельной теплоемкости. Самый минимальный показатель удельной теплоемкости воды обнаружен при температуре 36,79°С. Что самое интересное – это норма для человеческого организма! И температура в 36-27 оС считается нормой даже у многих теплокровных живых организмов. Оказывается, что такая температура дает толчок для микрофазовых превращений в системе «вода-лед». Уже установлено, что в период изменения температуры от 0 до 100оС вода проходит последовательно пять превращений. Температурные границы таких превращений – 0, 15, 30, 45, 60 и 100°С. Для нормальной жизнедеятельности теплокровных живых существ температура должна быть от 30 до 45оС. Некоторые виды организмов приспособились к нормальной жизни при более низких температурных показателях, к примеру, рыбы, бактерии, насекомые могут размножаться и существовать в диапазоне температур от 23 до 25 градусов. Для весеннего пробуждения семян эффективной считается температура в 5-10°С.
Еще одним аномальным явлением воды является высокое поверхностное напряжение. Именно благодаря этому некоторые виды насекомых могут беспроблемно передвигаться по водной глади. А что уже говорить о свойстве, благодаря которому вода достигает крон деревьев, высота которых может превышать несколько десятков метров. Не уникально ли? Оказывается вода обладает мощнейшей капиллярной силой, которая и является «курьером» питательных веществ к древесным кронам.
Аномальность воды проявляется буквально во всем. К примеру, если у большинства жидкостей плотность с понижением температуры постепенно увеличивается, то у воды максимальная плотность стоит на отметке в 4 градуса Цельсия, а уже при дальнейшем снижении температуры плотность снова начинает убывать. Это поистине уникальное свойство воды – так как если бы плотность воды увеличивалась в зависимости от понижения температуры, то в зимнее время года мелкие водоемы попросту замерзали бы до самого дна. А так благодаря этому свойству жизнь в реках и озерах даже зимой идет полным ходом.
А что уже говорить о свойствах святой воды? Многие до сих пор не верят в существование такой воды, однако исследования, проводимые как европейскими, так и американскими учеными подтверждают факт существования целебных свойств у воды, набранной во время Крещенских праздников. Аномальные свойства воды до сих пор изучаются учеными всего мира. Даже несмотря на то, что по своей структуре вода не имеет чего-то особенного и необъяснимого, но многие ее явления даже сегодня остаются загадочными и необъяснимыми.
www.watermap.ru
Доклад - Аномальные свойства воды
Вопрос № 21
Аномальные свойства воды
Огромная роль воды в жизни человека и природы послужила причиной того, что она была одним из первых соединений, привлекших внимание ученых. Глубокие философские обобщения привели человечество к необходимости познания физической и химической природы воды. Тем не менее, изучение воды еще далеко не закончено.
Раскрыть ее секреты до конца еще не удалась никому. Человечество упорно в длительном борении за истину, объединяя знания поколений, постепенно открывало все новые и новые специфические особенности этой загадочной жидкости, «сока Жизни».
В 1783 году выдающиеся экспериментаторы Генри Кавендиш (1731-1810) и Антуан Лавуазье (1743-1794) установили, что вода состоит из двух газов: водорода и кислорода и соотношение их выражается формулой Н2 0.
Все достижения современной цивилизации во многом обусловлены использованием и изучением воды. Достаточно назвать водяной пар и паровую машину Джемса Уатта.
Исследование химического состава воды привело к открытию Генри Кавендишем водорода “горячего воздуха”, рождающего воду, к созданию Джонам Дальтонам атомной теории вещества.
Открытие химического состава молекулы воды послужило началом бурному росту науки о биологической роли воды, об ее лечебно-профилактическом использовании.
Вода выступала катализаторам развития многих фундаментальных научных дисциплин. Вспомним также о ее причастности к ядерной физике в виде тяжелой и сверхтяжелой воды. В настоящее время наступила эра всеобщего изучения роли воды в нормальных и патологических процессах жизни, которую можно назвать эрой водной биологии и медицины.
Современному представлению о строении молекулы воды и водных растворов предшествовал бурный период научных и экспериментальных изысканий, подчас противоречивых и трудно воспроизводимых.
Это и химическая теория Д.И. Менделеева, и теория непрерывности газового и жидкого состояния Ван-дер-Ваальса, и гидрольная теория У. Рамзая и Дж. Шильдса, и рентгенографический метод исследования Лауэ, и постулат Дебая о близости структуры жидкого состояния воды к твердой фазе на границе температурного раздела лед-вода и ряд других теорий. Однако, в конце концов основные черты строения молекулы воды были расшифрованы. Как же сейчас мы представляем себе строение воды?
Начнем с элементарного — со строения молекулы воды, состоящей из двух атомов водорода (Н1 ) и одного атома кислорода (О18 ). Оказывается, все многообразие свойств воды и необычность их проявления, в конечном счете, определяются физической природой этих атомов и способом их объединения в молекулу. В отдельно рассматриваемой молекуле воды ядра водорода и кислорода так расположены друг относительно друга, что образуют как бы равнобедренный треугольник — со сравнительно крупным ядром кислорода в вершине и двумя мелкими ядрами водорода у основания (рис. 1, а).
Puc. 1. Строение молекулы воды:
а) — угол между связями О-Н, б) — структура электронного облака молекулы, в) — расположение полюсов заряда.
Электронное облако молекулы, образованное пятью парами электронов, схематически распределено так (рис. 1, б), что внутренняя пара окружает ядро кислорода, две внешние пары неравномерно поделены между ядрами кислорода и водорода, тяготея больше к кислороду, а остальные две пары кислород не делит с водородом, и их заряды остаются частично нескомпенсированными. Таким образом, в молекуле воды оказывается четыре полюса зарядов: два отрицательных за счет избытка электронной плотности у кислородных пар электронов и два положительных — вследствие недостатка электронной плотности у несколько оголенных ядер водорода — протонов.
Эти заряды можно условно представить расположенными в вершинах частично искаженного тетраэдра (рис. 1, в). Вследствие такой асимметричности распределения электрических зарядов молекула воды обладает ярко выраженными полярными свойствами: она является диполем с высоким дипольным моментом — 1,87 Дебая. На рис. 2 показана схема образования молекулы воды.
Рис. 2. Образование молекулы воды.
Как видно на рис. 2, у одного атома кислорода и двух атомов водорода (а) появляются общие электроны, образующие прочную ковалентную связь (б). Если два протона водорода молекулы воды вращаются в одну сторону, то вода называется параводой, в разные стороны — ортоводой.
В обыкновенной воде 3/4 ортоводы. Ряд ученых предполагает, что соотношение орто- и параводы в клетке имеет регуляторное значение. Если строение молекулы воды в общих чертах установлено, то структура воды по-прежнему остается загадкой.
Исследуя воду и, особенно ее водные растворы, ученые раз за разом убеждались, что вода обладает ненормальными — аномальными свойствами, присущими только ей, ее Величеству — Воде, подарившей нам Жизнь и возможность мыслить. Мы даже и не подозреваем, что столь привычные и естественные свойства воды в природе, в различных технологиях, наконец, в обыденной жизни нашей являются уникальными и неповторимыми.
Ученые согласны в том, что вода является одним из самых трудных объектов исследования, так как, прежде всего в воде всегда есть примеси и что она обладает кооперативным характером взаимодействия ее молекул.
В рамках микроскопического подхода структура воды отличается относительно беспорядочным динамически меняющимся расположением молекул, а высокая плотность обуславливает сильное межмолекулярное взаимодействие, осуществляемое посредством водородных связей.
Таким образом, вода представляет собой сложную ассоциированную жидкость с тетраэдрической сеткой молекул, соединенных водородными связями.
В результате теплового движения молекул эта сетка подвержена спонтанной перестройке.
В трехмерной сетке водородных связей размещены флуктуационные микрообъемы молекул воды, обладающие сравнительно малой энергией теплового движения и более высокой степенью структурного упорядочения. Это — микрокластеры.
В то же время вокруг микрокластеров в макрообъеме ассоциированной среды с повышенной энергией теплового движения молекул Н2 0 наблюдается большая степень структурной беспорядочности, то есть более низкий уровень структурного упорядочения.
Вещества — аналоги воды, молекулы которых по химическому составу похожи на воду, — h3 S, h3 Se, h3 Te, то есть соединения водорода и серы, водорода и селена, водорода и теллура и так далее, при комнатной температуре находятся в газообразном состоянии. Казалось бы, вода, сохрани она такие же свойства, должна бы закипать при температуре -70°С, а превращаться в лед при -90 °С. Эти условия вряд ли бы способствовали развитию жизни на Земле, ведь она должна была бы существовать в интервале температур от -70 °С до -90 °С (рис.3). В таком холоде разве возможна жизнь?
Иначе говоря, если бы вода — гидрид кислорода Н2 О — была бы нормальным мономолекулярным соединением, таким, например, как ее аналоги по шестой группе Периодической системы элементов Д.И.Менделеева — гидрид серы h3 S, гидрид селена h3 Se, гидрид теллура h3 Te, то в жидком состоянии вода существовала бы в пределах от минус 95 °С до минус 70 °С, а не такая, какая реально существует сейчас. Нетрудно понять, что в этом случае биологической жизни на Земле не могло бы существовать. На рис.3 показаны необычные точки замерзания и кипения воды по сравнению с другими жидкостями.
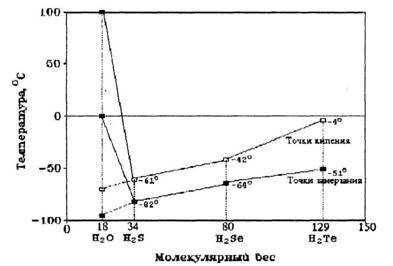
Рис. 3. Аномалии точек кипения и замерзания воды по сравнению с другими соединениями водорода.
Но, к счастью для нас и для всего живого на свете вода обладает аномальными свойствами.
Вода «не признает» периодических закономерностей, характерных для бесчисленного множества соединений на Земле и в Космосе, а следует своим, еще не вполне понятным для науки законам, подарившим нам удивительный «мир Жизни».
«Ненормальные» температуры плавления (0 °С) и кипения (+100 °С) воды далеко не единственная ее аномальность.
Для всей биосферы исключительна важной особенностью воды является ее способность при замерзании увеличивать, а не уменьшать свой объем, то есть уменьшать плотность.
Действительно, при переходе любой жидкости в твердое состояние молекулы располагаются теснее, а само вещество, уменьшаясь в объеме, становится плотнее. Да, для любой из необозримо разных жидкостей, но не воды. Вода и здесь представляет исключение.
При охлаждении вода сначала ведет себя как и другие жидкости: постепенно уплотняясь, уменьшает свой объем. Такое явление можно наблюдать до +3,98 °С. Затем, при дальнейшем снижении температуры до 0 °С, вся вода замерзает и расширяется в объеме. В результате удельный вес льда становится меньше воды и лед плавает. Если бы лед не всплывал, а тонул, то все водоемы (реки, озера, моря) промерзли бы до дна, испарение бы резко сократилось, все пресноводные животные и растения погибли бы. Жизнь на Земле стала бы невозможной.
Вода — единственная жидкость на Земле, лед которой не тонет за счет того, что его объем на 1/11 больше объема воды.
Еще одно удивительное свойство воды — ее огромное поверхностное натяжение. Благодаря тому, что круглые шарики воды очень упруги, идет дождь, выпадает роса.
Что же это за удивительная сила, которая сохраняет капли росы, а поверхностный слой воды в любой лужице делает эластичным и относительно прочным?
Известно, что если стальную иголку осторожно положить на поверхность воды, налитой в блюдце, то иголка не тонет. А ведь удельная масса металла значительно больше, чем у воды. Молекулы воды связаны силой поверхностного натяжения, которая позволяет им подниматься вверх по капиллярам, преодолевая силу земного притяжения. Без этого свойства воды жизнь на Земле была бы также невозможна.
Ни одно вещества на Земле не обладает такой способностью поглощать тепло, как вода. Для превращения в пар 1г воды требуется 537 калории тепла. Конденсируясь, пар возвращает эти 537 калорий в окружающую среду.
Ни одно вещество в мире не поглощает и не отдает среде столько тепла, сколько вода. Теплоемкость воды в 10 раз больше теплоемкости стали и в 30 раз больше ртути. Вода сохраняет тепло на Земле.
С поверхности морей, океанов, суши испаряется за год 520000 кубических километров воды, которые, конденсируясь, отдают много тепла холодным и полярным регионам.
Не обладай вода такой уникальной способностью поглощать и отдавать тепло, климат Земли оказался бы непригодным для существования человека. В высоких широтах тогда царил бы нестерпимый холод, а в низких — солнце испепелило бы все живое.
Благодаря наземному Мировому океану атмосфера представляет собой надежное теплое одеяло, укрывающее тело планеты и защищающее его от космического холода. Подземный океан снабжает Землю теплом из внутренних источников планеты.
Ни одна жидкость не поглощает газы с такой жадностью, как вода. Но она их также легко отдает.
Дождь растворяет в себе все ядовитые газы атмосферы. Вода — ее мощный природный фильтр, очищающий атмосферу от всех вредных и ядовитых газов.
Еще одно удивительное свойство воды проявляется при воздействии на нее магнитного поля. Вода, подвергнутая магнитной обработке, меняет растворимость солей и скорость химических реакций.
Магнитная вода не только не дает накипи в котлах, но и срывает ранее образовавшиеся отложения, повышает прочность бетона, ускоряет его застывание, увеличивает процент выхода обогащенной руды.
Ряд удивительных свойств воды связан с ее теплоемкостью. Легче всего вода нагревается и быстрее всего охлаждается в своеобразной “температурной яме”, соответствующей +37 °С, температуре человеческого тела (рис. 4).
Как видно из рис.4, теплоемкость воды своих минимальных значений достигает около +37 °С. Это нормальная температура тела человека. Именно при температуре 36,6-37оС сложнейшие реакции обмена веществ в организме человека наиболее интенсивны. Значит, при этой температуре организм человека находится в наивыгоднейшем энергетическом состоянии.
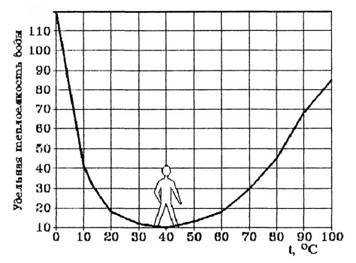
Рис. 4. Температурная зависимость удельной теплоемкости воды.
Вода в организме человека составляет 70-90%. от веса тела. Не обладай вода такой теплоемкостью, как сейчас, обмен веществ в теплокровных и холоднокровных организмах был бы невозможен.
В клетках живых организмов различают “объемную” и “связанную” воду. Первая — вода, с которой мы имеем дело в повседневной жизни. В ней растворен цитозоль клетки. Под “связанной” водой мы понимаем воду, связанную с биологическими молекулами, мембранами.
В живых клетках обычная вода, будучи связанной с мембранами, неизвестным образом превращается в воду со структурой льда. И она уже не во власти незыблемых законов физики — все ее свойства коренным образом меняются. Диэлектрическая проницаемость, например, уменьшается в десять раз, а теплопроводность возрастает в семьдесят раз и тому подобное.
Любая живая клетка имеет наружную и внутреннюю биологические мембраны. Это как бы избирательно проницаемая стенка, ограждающая содержимое клетки, ее органоиды от повреждения. На поверхности биологических образований молекулы воды подвергаются структурно -функциональной упорядоченности, образуют так называемую клатратную пленку — кристаллогидрат со строго ориентированными дипольными моментами молекул воды.
В самой клатратной пленке, размещенной, к примеру, на поверхности клеточной мембраны, процессы обмена между молекулами воды осуществляются с частотой десять тысяч раз в секунду, в то время как с окружающей объемной водой молекулы Н2 О меняются местами с частотой в два раза меньшей.
Это приводит к тому, что растворенным в воде примесям термодинамически невыгодно находиться в клатратных слоях воды, поэтому они предпочитают объемную воду.
Итак, будучи связанной с живой материей и защищая ее, клатраты сами защищены невидимым барьером от разрушающего действия на них объемной воды с растворенными в ней вредными и ядовитыми веществами. И чем толще и крепче клатратная прослойка, тем более стабильны термодинамические и биологические условия функционирования отдельной молекулы и клетки организма.
В связанной воде все молекулы Н2 О имеют по четыре водородные связи и обеспечивают оптимальную скорость миграции протонов и электронов -эту основу обмена веществ в живых системах.
Основа структуры всех биомолекул — водородные связи. Водородные связи биомолекул и воды, по Сент-Дьердьи, образуют матрицу жизни, по которой движутся в процессе обмена веществ протоны и электроны.
Водородные связи — не только матрица, но и существенный элемент в строительстве всего живого. Все сказанное выше, говорит о том, что обыкновенная вода — самое необыкновенное вещество в природе.
Обнаружена и изучается универсальная система водно-структурной регуляции жизненными процессами. Структура воды и растворенные в ней вещества (анионы и катионы) определяют и регулируют строение и функции макромолекул клетки и низкомолекулярных биорегуляторов, сборку и функционирование организмов и клеток, тканей, органов и систем органов, наконец, целого организма.
Она действует как на субмолекулярном и молекулярном, так и на более высоких уровнях организации живой материи, вплоть до биосферного. Она определяет миграцию протонов и электронов в клетках, структуру мембран, функции ДНК, РНК, белков, низкомолекулярных регуляторов, сборку клеточных структур, оплодотворение, эмбриональное развитие, зрелое функционирование организма, его управляющие, регуляторные и гомеостатические системы, его старение и смерть.
Важным элементом системы водно-структурной регуляции является соотношение пара- и ортоводы. Гипотезу об этом развивает в своей содержательной книге Б.З.Фрадкин. Автор книги «Белые пятна безбрежного океана» Б.Э.Фрадкин в 1976 году писал о загадках воды: «Мы вправе рассматривать воду как необъятную самостоятельную область познания — безбрежный океан, усыпанный белыми пятнами загадок. И едва удается раскрыть одну загадку, как появляется две, десять новых, еще более невероятных».
Учитывая огромную роль воды в жизни человечества и отмечая пуск нового водопровода, жители города Новороссийска в 1974 году, как сообщала газета “Известия” 24 марта 1974 года, разработали памятник воде. Если он был воздвигнут, то этим актом люди выразили свое преклонение перед этим чудом природы — обыкновенной и вместе с тем необыкновенной водой.
СПИСОК ЛИТЕРАТУРЫ
1. Арабаджи В. И. Загадки простой воды. — М.: «Знание», 2003г.
2. Ахматов М.В. Вода, которую мы пьём. — М.: 2006г.
3. Петрянов И.В. Самое необыкновенное вещество в мире — М.: «Педагогика», 2005г.
www.ronl.ru
Малоизвестное о воде
(для любознательных)
«Вода – это жизнь» - это высказывание мы знаем с детства, но не всегда придаем значение тому, что нас окружает постоянно, без чего мы не можем обойтись.
А Вы знаете, что такое “ВОДА” ?
“Вода, у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое”.
Антуан де Сент-Экзюпери.
Сначала я приведу несколько примеров из истории, чтобы Вы поняли, что этот вопрос не такой уж и простой!
Согласно хроникам, в 1472 году аббат Карл Гастинстингс был по ложному доносу схвачен и допрошен по делу о наведении болезни на некую уважаемую женщину. Заключённому в темницу аббату каждый день давали лишь кусок сухого хлеба и ковш гнилой зловонной воды. Через 40 дней тюремщик заметил, что за это время преподобный Карл не только не потерял, но казалось, приобрёл здоровье и силу, что только убедило инквизиторов в связи аббата с нечистой силой. Позже, под жестокими пытками Карл Гастинстингс сознался, что над гнилой водой, которую ему приносили он читал молитву, благодаря Господа за ниспосланные ему испытания. После чего вода становилась мягкой на вкус, свежей и прозрачной.
В истории известны случаи изменения структуры воды посредством воздействия мысли. К примеру, зимой 1881 года корабль «Лара» следовал рейсом из Ливерпуля в Сан-Франциско. На третий день пути на корабле начался пожар. Среди покинувших судно был капитан Нейл Кери. Потерпевшие бедствие стали испытывать муки жажды, которые возрастали с каждым часом. Потом, когда они после мучительного скитания по морю благополучно достигли берега, капитан, человек весьма трезвого отношения к действительности в следующих словах описал то, что спасло их: «Мы мечтали о пресной воде. Мы стали воображать, как вода вокруг шлюпки из голубой морской превращается в зеленоватую пресную. Я собрался с силами и зачерпнул её. Когда я попробовал, она оказалась пресной».
Кратко о воде с точки зрения биохимии
 Вода – наиболее распространенное на Земле вещество. Ее количество достигает 1018 тонн, и она покрывает приблизительно четыре пятых земной поверхности. Вода занимает 70% поверхности Земли. Столько же (70%) её в организме человека. Эмбрион почти целиком (95%) состоит из воды, в теле новорожденного её – 75%. Лишь в старости количество воды в организме человека – 60%.. Это единственное химическое соединение, которое в природных условиях существует в виде жидкости, твердого вещества (лед) и газа (пары воды). Вода играет жизненно важную роль в промышленности, и быту; она совершенно необходима для поддержания жизни. Из 1018 т воды на Земле на пресную воду приходятся всего лишь 3%, из которых 80% недоступны для использования, поскольку представляют собой лед, образующий полярные шапки. Пресная вода оказывается доступной человеку в результате участия в гидрологическом цикле, или круговороте воды в природе. Ежегодно в круговорот воды, в результате ее испарения и выпадения осадков в виде дождя или снега, вовлекается приблизительно 500 000 км3 воды. По теоретическим подсчетам максимальное количество пресной воды, доступное для использования, составляет приблизительно 40 000 км3 в год. Речь идет о той воде, которая стекает с поверхности земли в моря и океаны.
Вода – наиболее распространенное на Земле вещество. Ее количество достигает 1018 тонн, и она покрывает приблизительно четыре пятых земной поверхности. Вода занимает 70% поверхности Земли. Столько же (70%) её в организме человека. Эмбрион почти целиком (95%) состоит из воды, в теле новорожденного её – 75%. Лишь в старости количество воды в организме человека – 60%.. Это единственное химическое соединение, которое в природных условиях существует в виде жидкости, твердого вещества (лед) и газа (пары воды). Вода играет жизненно важную роль в промышленности, и быту; она совершенно необходима для поддержания жизни. Из 1018 т воды на Земле на пресную воду приходятся всего лишь 3%, из которых 80% недоступны для использования, поскольку представляют собой лед, образующий полярные шапки. Пресная вода оказывается доступной человеку в результате участия в гидрологическом цикле, или круговороте воды в природе. Ежегодно в круговорот воды, в результате ее испарения и выпадения осадков в виде дождя или снега, вовлекается приблизительно 500 000 км3 воды. По теоретическим подсчетам максимальное количество пресной воды, доступное для использования, составляет приблизительно 40 000 км3 в год. Речь идет о той воде, которая стекает с поверхности земли в моря и океаны.
 Свойства воды уникальны. Прозрачная жидкость без запаха, вкуса и цвета (молекулярная масса – 18,0160, плотность – 1 г/см3; уникальный растворитель, способна окислять почти все металлы и разрушать твёрдые горные породы). Попытки представить воду как ассоциированную жидкость с плотной упаковкой молекул воды, подобно шарикам какой-либо емкости, не соответствовали элементарным фактическим данным. В этом случае удельная плотность воды должна была бы быть не 1 г/см3, а более 1,8 г/см3.
Свойства воды уникальны. Прозрачная жидкость без запаха, вкуса и цвета (молекулярная масса – 18,0160, плотность – 1 г/см3; уникальный растворитель, способна окислять почти все металлы и разрушать твёрдые горные породы). Попытки представить воду как ассоциированную жидкость с плотной упаковкой молекул воды, подобно шарикам какой-либо емкости, не соответствовали элементарным фактическим данным. В этом случае удельная плотность воды должна была бы быть не 1 г/см3, а более 1,8 г/см3.
Сферические капли воды имеют наименьшую (оптимальную) поверхность объёма. Поверхностное натяжение равно 72,75 дин/см. Удельная теплоёмкость воды выше, чем у большинства веществ. Вода поглощает большое количество теплоты, при этом мало нагреваясь.
Второе важное доказательство в пользу особой структуры молекулы воды состояла в том, что в отличие от других жидкостей вода – это было уже известно – обладает сильным электрическим моментом, составляющим ее дипольную структуру. Поэтому нельзя было представить наличие весьма сильного электрического момента молекулы воды в симметрической конструкции двух атомов водорода относительно атома кислорода, расположив все входящие в нее атомы по прямой линии, т.е. Н-О-Н.
Структура воды в живом организме во многом напоминает структуру кристаллической решетки льда. И именно этим объясняются сейчас уникальные свойства талой воды, долгое время сохраняющей структуру льда. Талая вода гораздо легче обычной вступает в реакцию с различными веществами, и организму не надо тратить добавочную энергию на перестройку ее структуры.
В жидком виде связи соседних молекул воды образуют непостоянные и быстротечные структуры. В замёрзшем виде каждая молекула льда жёстко связана с четырьмя другими.
Доктором биологический наук С.В.Зениным были обнаружены стабильные долгоживущие кластеры воды. Оказалось, что вода представляет собой иерархию правильных объёмных структур. В основе, которых лежат кристаллоподобные образования, состоящие из 57 молекул. А это приводит к появлению структур более высокого порядка в виде шестигранников, состоящих из 912 молекул воды. Свойства кластеров зависят от соотношения выступающих на поверхность кислорода с водородом. Конфигурация реагирует на любое внешнее воздействие и примеси. Между гранями элементов кластеров действуют кулоновские силы притяжения. Это позволяет рассматривать структурированное состояние воды в виде особой информационной матрицы.
Неразгаданные свойства воды
 Вода всегда представляла собой большую загадку для человеческого ума. Много непостижимого нашему разуму остается еще в свойствах и действиях воды. Наблюдая за текущим или струящимся потоком воды, человек может снимать свое нервное и психическое напряжение. Чем это вызвано? Насколько известно, вода не содержит никаких веществ, способных дать такой эффект. Ученые утверждают, что вода обладает способностью принимать и передавать любую информацию, сохраняя ее в неприкосновенности. В воде растворено прошлое, настоящее, будущее. Эти свойства воды широко использовались и используются в магии и целительстве. До сих пор еще существуют народные целители и целительницы, «нашептывающие на воду», излечивающие этим болезни. Текущая вода постоянно забирает энергию Космоса и в чистом виде отдает ее в окружающее околоземное пространство, где она поглощается всеми живыми организмами, располагающимися в пределах досягаемости потока, поскольку образованное текущей водой биополе постоянно увеличивается за счет отдаваемой энергии. Чем быстрее движется водный поток, тем сильнее это поле. Под воздействием этой силы происходит выравнивание энергетической оболочки живых организмов, закрываются «пробои» в невидимой простому человеку оболочке тела (ауре), организм исцеляется.
Вода всегда представляла собой большую загадку для человеческого ума. Много непостижимого нашему разуму остается еще в свойствах и действиях воды. Наблюдая за текущим или струящимся потоком воды, человек может снимать свое нервное и психическое напряжение. Чем это вызвано? Насколько известно, вода не содержит никаких веществ, способных дать такой эффект. Ученые утверждают, что вода обладает способностью принимать и передавать любую информацию, сохраняя ее в неприкосновенности. В воде растворено прошлое, настоящее, будущее. Эти свойства воды широко использовались и используются в магии и целительстве. До сих пор еще существуют народные целители и целительницы, «нашептывающие на воду», излечивающие этим болезни. Текущая вода постоянно забирает энергию Космоса и в чистом виде отдает ее в окружающее околоземное пространство, где она поглощается всеми живыми организмами, располагающимися в пределах досягаемости потока, поскольку образованное текущей водой биополе постоянно увеличивается за счет отдаваемой энергии. Чем быстрее движется водный поток, тем сильнее это поле. Под воздействием этой силы происходит выравнивание энергетической оболочки живых организмов, закрываются «пробои» в невидимой простому человеку оболочке тела (ауре), организм исцеляется.
Аномальные свойства воды
Первое аномальное свойство воды – аномалия точек кипения и замерзания: Если бы вода – гидрид кислорода – Н2О была бы нормальным мономолекулярным соединением, таким, например, как ее аналоги по шестой группе Периодической системы элементов Д.И. Менделеева гидрид серы Н2S, гидрид селена Н2Se, гидрид теллура Н2Те, то в жCидком состоянии вода существовала бы в диапазоне от минус 90oС до минус 70oС. При таких свойствах воды жизни на Земле не существовало бы.
“Ненормальные” температуры плавления и кипения воды далеко не единственная аномальность воды. Для всей биосферы исключительно важной особенностью воды является ее способность при замерзании увеличивать, а не уменьшать свой объем, т.е. уменьшать плотность. Это вторая аномалия воды, которая именуется аномалией плотности. На это особое свойство воды впервые обратил внимание еще Г. Галилей. При переходе любой жидкости (кроме галлия и висмута) в твердое состояние молекулы располагаются теснее, а само вещество, уменьшаясь в объеме, становится плотнее. Любой жидкости, но не воды. Вода и здесь представляет собой исключение. При охлаждении вода сначала ведет себя как и другие жидкости: постепенно уплотняясь, она уменьшает свой объем. Такое явление можно наблюдать до +4°С (точнее до +3,98°С). Именно при температуре +3,98°С вода имеет наибольшую плотность и наименьший объем. Дальнейшее охлаждение воды постепенно приводит уже не к уменьшению, а к увеличению объема. Плавность этого процесса вдруг прерывается и при 0°С происходит резкий скачок увеличения объема почти на 10%! В это мгновение вода превращается в лед. Уникальная особенность поведения воды при охлаждении и образовании льда играет исключительно важную роль в природе и жизни. Именно эта особенность воды предохраняет от сплошного промерзания в зимний период все водоемы земли – реки, озера, моря и тем самым спасает жизнь.
В отличие от пресной воды морская вода при охлаждении ведет себя иначе. Замерзает она не при 0°С, а при минус 1,8-2,1°С – в зависимости от концентрации растворенных в ней солей. Имеет максимальную плотность не при + 4°С, а при -3,5°С. Таким образом она превращается в лед, не достигая наибольшей плотности. Если вертикальное перемешивание в пресных водоемах прекращается при охлаждении всей массы воды до +4°С, то в морской воде вертикальная циркуляция происходит даже при температуре ниже 0°С. Процесс обмена между верхними и нижними слоями идет непрерывно, создавая благоприятные условия для развития животных и растительных организмов.
Все термодинамические свойства воды заметно или резко отличаются от других веществ.
Наиболее важная из них – аномалия удельной теплоемкости. Аномально высокая теплоемкость воды делает моря и океаны гигантским регулятором температуры нашей планеты, в результате чего не происходит резкого перепада температур зимой и летом, днем и ночью. Континенты, расположенные вблизи морей и океанов, обладают мягким климатом, где перепады температуры в различные времена года бывают незначительными.
Мощные атмосферные потоки, содержащие огромное количество теплоты, поглощенное в процессе парообразования, гигантские океанические течения играют исключительную роль в создании погоды на нашей планете.
 Аномалия теплоёмкости заключается в следующем: При нагревании любого вещества теплоемкость неизменно повышается. Да, любого вещества, но не воды. Вода – исключение, она и здесь не упускает возможности быть оригинальной: с повышением температуры изменение теплоемкости воды аномально; от 0 до 37°С она понижается и только от 37 до 100°С теплоемкость все время растет. В пределах температур, близких к 37°С, теплоемкость воды минимальна. Именно эти температуры – область температур человеческого тела, область нашей жизни. Физика воды в области температур 35-41°С (пределы возможных, нормально протекающих физиологических процессов в организме человека) констатирует вероятность достижения уникального состояния воды, когда массы кристаллической и объемной воды равны друг другу и способность одной структуры переходить в другую максимальная. Это замечательное свойство воды предопределяет равную вероятность течения обратимых и необратимых биохимических реакций в организме человека и обеспечивает “легкое управление” ими.
Аномалия теплоёмкости заключается в следующем: При нагревании любого вещества теплоемкость неизменно повышается. Да, любого вещества, но не воды. Вода – исключение, она и здесь не упускает возможности быть оригинальной: с повышением температуры изменение теплоемкости воды аномально; от 0 до 37°С она понижается и только от 37 до 100°С теплоемкость все время растет. В пределах температур, близких к 37°С, теплоемкость воды минимальна. Именно эти температуры – область температур человеческого тела, область нашей жизни. Физика воды в области температур 35-41°С (пределы возможных, нормально протекающих физиологических процессов в организме человека) констатирует вероятность достижения уникального состояния воды, когда массы кристаллической и объемной воды равны друг другу и способность одной структуры переходить в другую максимальная. Это замечательное свойство воды предопределяет равную вероятность течения обратимых и необратимых биохимических реакций в организме человека и обеспечивает “легкое управление” ими.
Общеизвестна исключительная способность воды растворять любые вещества. И здесь вода демонстрирует необычные для жидкости аномалии, и в первую очередь аномалии диэлектрической постоянной воды. Это связано с тем, что ее диэлектрическая постоянная (или диэлектрическая проницаемость) очень велика и составляет 81, в то время как для других жидкостей она не превышает 10. В соответствии с законом Кулона сила взаимодействия двух заряженных частиц в воде будет в 81 раз меньше, чем, например, в воздухе, где эта характеристика равна единице. В этом случае прочность внутримолекулярных связей уменьшается в 81 раз и под действием теплового движения молекулы диссоциируют с образованием ионов. Необходимо отметить, что из-за исключительной способности растворять другие вещества вода никогда не бывает идеально чистой.
Следует упомянуть еще об одном удивительной аномалии воды – исключительно высоком поверхностном натяжении. Из всех известных жидкостей только ртуть имеет более высокое поверхностное натяжение. Это свойство проявляется в том, что вода всегда стремится сократить свою поверхность. Некомпенсированные межмолекулярные силы наружного (поверхностного) слоя воды, вызванные квантовомеханическими причинами, создают внешнюю упругую пленку. Благодаря пленке многие предметы, будучи тяжелее воды, не погружаются в воду. Если, например, стальную иголку осторожно положить на поверхность воды, то иголка не тонет. А ведь удельный вес стали почти в восемь раз больше удельного веса воды. Всем известна форма капли воды. Высокое поверхностное натяжение позволяет воде иметь шарообразную форму при свободном падении.
Поверхностное натяжение и смачивание являются основой особых свойств воды и водных растворов, названого – капиллярностью. Капиллярность имеет огромное значение для жизни растительного, животного мира, формирования структур природных минералов и плодородия земли. В каналах, которые во много раз уже человеческого волоса, вода приобретает удивительные свойства. Она становится более вязкой, уплотняется в 1,5 раза, а замерзает при минус 80-70°С.
Причиной сверханомальности капиллярной воды являются межмолекулярные взаимодействия, тайны которых еще далеко не раскрыты.
Ученым и специалистам известна так называемая поровая вода. В виде тончайшей пленки она устилает поверхность пор и микрополостей пород и минералов земной коры и других объектов живой и неживой природы. Связанная межмолекулярными силами с поверхностью других тел, эта вода, как и капиллярная вода, обладает особой структурой.
Таким образом, аномальные и специфические свойства воды играют ключевую роль в ее многообразном взаимодействии с живой и неживой природой. Все эти необычные особенности свойств воды настолько “удачны” для всего живого, что делает воду незаменимой основой существования жизни на Земле.
sekretzdorovja.com