Химические свойства воды. Применение воды. Химические свойства воды
Химические свойства воды. 6 основных типов химических реакций для воды.
Химические свойства воды. 6 основных типов химических реакций для воды. ( хороший обзор Новосибирского Университета)Давайте вспомним все уже известные нам реакции, в которых участвует вода. Для этого вновь напишем уравнения встречавшихся ранее реакций и систематизируем их. Оказывается, вода – весьма активное в химическом отношении вещество.
1) Вода реагирует со многими металлами с выделением водорода:
2Na + 2h3O = h3 + 2NaOH (бурно)
2K + 2h3O = h3 + 2KOH (бурно)
3Fe + 4h3O = 4h3 + Fe3O4 (только при нагревании)
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + h3O = h3 + CO (при сильном нагревании)
Ch5 + 2h3O = 4h3 + CO2 (при сильном нагревании)
2) Электролиз. Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.
3) Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
|
SO2 |
+ |
h3O |
= |
h3SO3 |
|
сернистая кислота |
|
SO3 |
+ |
h3O |
= |
h3SO4 |
|
серная кислота |
|
CO2 |
+ |
h3O |
= |
h3CO3 |
|
угольная кислота |
4) Некоторые оксиды металлов также могут вступать в реакции соединения с водой. Примеры таких реакций мы уже встречали:
|
CaO |
+ |
h3O |
= |
Ca(OH)2 |
|
гидроксид кальция (гашеная известь) |
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует. Мы уже встречались с такими оксидами. Это ZnO, TiO2, Cr2O3, из которых приготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней.
5) Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом. Например:
|
CuSO4 |
+ |
5 h3O |
= |
CuSO4.5h3O |
|
вещество белого цвета (безводный сульфат меди) |
кристаллогидрат (медный купорос),синие кристаллы |
Приведем другие примеры образования гидратов:
h3SO4 + h3O = h3SO4.h3O (гидрат серной кислоты)
NaOH + h3O = NaOH.h3O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью, например, удаляют водяные пары из влажного атмосферного воздуха.
6) Фотосинтез . Особая реакция воды– синтез растениями крахмала (C6h20O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
6n CO2 + 5n h3O = (C6h20O5)n + 6n O2 (при действии света)
tehtab.ru
Физические и химические свойства воды.
В течение многих веков люди представить себе не могли, чем на самом деле является вода и как она образовалась на планете. Вплоть до 19 столетия люди не знали, что на самом деле вода является химическим элементом. Считалось, что она – обычный химический элемент. Сравнительно недавно было открыто, что вода – это химический элемент, формула которого – Н2О.
Химические свойства воды зависят от физической природы ее атомов, а также способов их объединения в молекулу и последующей группировки образовавшихся молекул. Так как она постоянно контактирует с различными веществами, вода является раствором с очень сложным составом. Более того, она проявляется себя как прекрасный растворитель, так как она способна растворить и жидкости, и твердые тела, и газы.
Особенно хорошо свойства такого растворителя проявляют себя в морской воде, так как она может растворить практически все вещества. Примерно семьдесят элементов периодической системы можно обнаружить в ее составе. В морской и океанской воде можно обнаружить даже редкие радиоактивные элементы. Наиболее часто встречаемые вещества в составе воды – это хлор, натрий, сера, калий, магний, кальций, стронций, бром, углерод и бор.
На сегодняшний день исследователи раскрывают все более сложные и тонкие механизмы организации водной массы. Ее считают наиболее трудным соединением из всех веществ, известных физикам и химикам. По химическому составу вода может и не различаться, но при этом она будет иметь различное влияние на организм человека, так как формировалась она в определенных условиях.
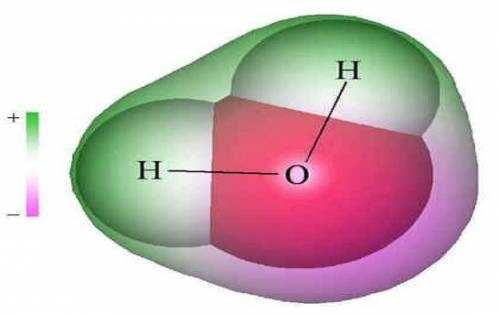
Химические свойства воды также зависят о ее молекулярной структуры. В частности, молекула воды состоит из трех атомов, которые сформированы в виде равнобедренного треугольника. В его вершине находится атом кислорода, тогда как в основании лежат два атома водорода. При этом валентный угол соединения НОН равняется 104,31°.
Есть также некоторые физические и химические свойства воды, которые идут вразрез с принципами таблицы Менделеева. В частности, наиболее высокими характеристиками у воды являются те, которые по сути своей должны быть гораздо ниже. Это касается температуры замерзания и кипения, теплоты плавления и парообразования.
Температура замерзания и кипения у гидридных элементов кислородной подгруппы по мере облегчения соединения снижается. Если бы такая закономерность действовала на воду, то она закипала бы при глубоко отрицательном температурном значении, при -70°С, а замерзала бы при -90°С. Это, в свою очередь, спровоцировало бы отсутствие воды на Земле, так как она не смогла бы содержаться ни в жидком, ни в твердом состоянии. Единственно возможный вариант – это газообразное состояние.
Касательно теплоты парообразования можно сказать, что для испарения воды, нагретой до 100°С, необходимо в 6 раз больше тепла, чем для нагрева аналогичной массы воды до 80°С.
С каждой минутой миллион тонн воды в гидросфере испаряется от солнечного тепла. В результате такого воздействия в атмосфере постоянно содержится огромное количество теплоты, которое эквивалентно тому, что выработали бы 40 тысяч мощнейших электростанций.
Такие уникальные физические и химические свойства воды позволяют широко использовать ее в производственной деятельности. В частности, на металлургических производствах в большинстве своем используется кипяток для охлаждения. Такой, казалось бы, парадоксальный поступок объясняется тем, что охлаждение происходит за счет теплоты парообразования. При этом отпадает необходимость в сооружении лишних градирен.
Конечно, кипяток в качестве охладителя можно использовать только на тех объектах, где температура нагрева превышает показатель в 100°С.
Уникальные физико-химические свойства воды позволяют использовать ее в сельском хозяйстве, и не только для полива растений. К примеру, когда поздней весной случаются внезапные заморозки, угрожающие цветущим деревьям, садоводы проводят так называемое дождевание сада. Пелена мелких брызг окутывает собой мерзнущие деревья. Также капли воды покрывают сами цветы. Затем она быстро превращается в лед и укрывает собой цветы, отдавая им свое тепло.
Как видим, вода, химические свойства которой еще не изучены в полной мере, – это уникальнейшее соединение, которое поддерживает все живое на планете и является неотъемлемой частью человеческого быта.
fb.ru
Химические свойства воды
Из химических свойств воды особенно важны способность её молекул диссоциировать (распадаться) на ионы и способность растворять вещества разной химической природы.
Роль воды как главного и универсального растворителя определяется прежде всего полярностью её молекул и, как следствие, её чрезвычайно высокой диэлектрической проницаемостью. Разноимённые электрические заряды, и в частности ионы, притягиваются друг к другу в воде в 80 раз слабее, чем притягивались бы в воздухе. Силы взаимного притяжения между молекулами или атомами погружённого в воду тела также слабее, чем в воздухе. Тепловому движению в этом случае легче разбить молекулы. Оттого и происходит растворение, в том числе многих труднорастворимых веществ: капля камень точит.
Лишь в незначительной степени протекает электролитическая диссоциация (автодиссоциация воды) по схеме:
Н2О Н+ + ОН-
Однако, приведённое уравнение условное: не может существовать в водной среде лишённый электронной оболочки протон Н+. Он сразу гидратируется водой до катионов оксония Н3О+. Однако для простоты записи обычно используется обозначение Н+.
По Бренстенду такая реакция называется автопротолизом воды:
Н2О + Н2О Н3О+ + ОН-
Электролитическая диссоциация воды – причина гидролиза солей слабых кислот и оснований. Степень электролитической диссоциации заметно возрастает при повышении температуры.
Образование воды из элементов по реакции:
Н2 + 1/2 О2Н2О -242 кДж/моль для пара
-286 кДж/моль для жидкой воды
При низких температурах в отсутствии катализаторов происходит крайне медленно, но скорость реакции резко возрастает при повышении температуры, и при 5500 С она происходит со взрывом. При понижении давления и повышении температуры равновесие сдвигается влево.
Под действием ультрафиолетового излучения происходит фотодиссоциация воды на ионы Н+ и ОН-.
Вода окисляется атомарным кислородом:
Н2О + О Н2О2
При взаимодействии с F2 образуется НF, а также О2 ;О3 ; Н2О2 ; F2О и другие соединения. С остальными галогенами при низких температурах вода реагирует с образованием смеси кислот Н Гал. и Н Гал. О.
При обычных условиях с водой взаимодействует до половины растворённого в ней СI2 и значительно меньшие количества Br2 и J2. При повышенных температурах СI2 и Br2 разлагают воду с образованием Н Гал. и О2.
При пропускании паров воды через раскалённый уголь она разлагается и образуется так называемый водяной газ:
Н2О + С СО + Н2
При повышенной температуре в присутствии катализатора вода реагирует с СО; СН4 и другими углеводородами, например:
Н2О + СО СО2 + Н2
Н2О + СН4СО + 3Н2
Эти реакции используют для промышленного получения водорода.
Фосфор при нагревании с водой под давлением в присутствии катализатора окисляется в метафосфорную кислоту:
6Н2О + 3Р 2НРО3 + 5Н2
Вода взаимодействует со многими металлами с образованием Н2 и соответствующего гидроксида. Со щелочными и щелочно-земельными металлами (кроме Мg) эта реакция протекает уже при комнатной температуре. Менее активные металлы разлагают воду при повышенной температуре, например, Мg и Zn – выше 1000 С; Fe – выше 6000С :
2Fe + 3h3O Fe2O 3 + 3h3
При взаимодействии с водой многих оксидов образуются кислоты или основания.
Вода может служить катализатором, например, щелочные металлы и водород реагируют с CI2 только в присутствии следов воды.
Иногда вода – каталитический яд, например, для железного катализатора при синтезе Nh4.
Способность молекул воды образовывать трёхмерные сетки водородных связей позволяет ей давать с инертными газами, углеводородами, СО2 , CI2 , (Ch3)2O , CHCI3 и многими другими веществами газовые гидраты.
studfiles.net
Урок 28. Химические свойства воды – HIMI4KA
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.

При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).

При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота h3CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты h4PO4 (рис. 110):

Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты h3CO3 и h4PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
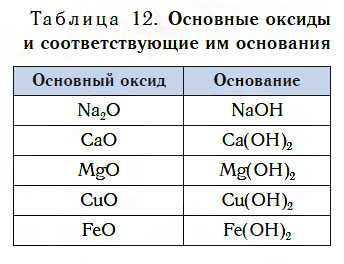
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 28. Химические свойства воды
5 (100%) 2 voteshimi4ka.ru
Лекция "ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ" - ХиМуЛя.com
|
ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ |
ЗАПОМНИТЕ!!!
Щелочные металлы – это I группа, А - главная подгруппа – Li, Na, K, Rb, Cs, Fr
Щелочно-земельные металлы – это II группа, А – главная подгруппа (Be, Mg не относятся) – Ca, Sr, Ba, Ra
n I
Основания – это сложные вещества с общей формулой Ме(ОН)n
ОН – гидроксильная группа, с валентностью (I)
Щёлочи – это растворимые в воде основания (см. ТАБЛИЦУ РАСТВОРИМОСТИ)
I n
Кислоты – это сложные вещества с общей формулой Нn (КО)
(КО) – кислотный остаток
V-VII
Кислотный оксид – неМех Оу и Мех Оу
I, II
Основные оксиды – Мех Оу
I. Взаимодействие воды с металлами.
В зависимости от активности металла, реакция протекает при различных условиях и образуются разные продукты.
1). Взаимодействие с самыми активными металлами, стоящими в периодической системе в I А и I I А группах (щелочные и щелочно-земельные металлы) и алюминий. В ряду активности эти металлы расположены до алюминия (включительно)
Реакция протекает при обычных условиях, при этом образуется щелочь и водород.
I I
2Li + 2 h3O = 2 Li OH + h3 (протекает реакция замещения)
HOH гидроксид
лития
I I I
Ba + 2 h3O = Ba (OH)2 + h3
2 Al + 6 h3O = 2 Al (OH)3 + 3 h3
гидроксид
алюминия
ОН – гидроксогруппа, она всегда одновалентна
ВЫВОД – активные металлы - Li, Na, K, Rb, Cs, Fr, Ca, Sr, Ba, Ra + Al – реагируют так
| Me + h3O = Me(OH)n + h3 (р. замещения) основание |
2) Взаимодействие с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Реакция протекает только с парообразной водой, т.е. при нагревании.
При этом образуются: оксид этого металла и водород.
I I I I
Fe + h3O = FeO + h3 (протекает реакция замещения)
оксид
железа
Ni + h3O = NiO + h3
(Валентность металла можно легко определить по ряду активности металлов, над их символом стоит значение, например +2, это означает, что валентность этого металла равна 2).
ВЫВОД – металлы средней активности, стоящие в ряду активности до (Н2) – Be, Mg, Fe, Pb, Cr, Ni, Mn, Zn – реагируют так
| Me + Н2О = Мех Оу + Н2 (р. замещения) Оксид металла |
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + h3O = нет реакции
I I. Взаимодействие с оксидами (основными и кислотными)
С водой взаимодействуют только такие оксиды, которые при взаимодействии с водой дают растворимый в воде продукт (кислоту или щелочь).
1). Взаимодействие с основными оксидами.
С водой взаимодействуют только основные оксиды активных металлов, которые расположены в в I А и I I А группах, кроме Ве и Mg (оксид алюминия не реагирует, т.к. он амфотерный). Реакция протекает при обычных условиях, при этом образуется только щелочь.
I I I
Na2O + h3O = 2 NaOH BaO + h3O = Ba (OH)2 (протекает реакция соединения)
| I h3O + ОСНОВНЫЙ ОКСИД = Ме(ОН)m (р. соединения) Щёлочь Al2O3 + h3O = нет реакции BeO + h3O = нет реакции MgO + h3O = нет реакции |
2) Взаимодействие кислотных оксидов с водой.
Кислотные оксиды реагируют с водой все. Исключение составляет только SiO2.
При этом образуются кислоты. Во всех кислотах на первом месте расположен водород, поэтому уравнение реакции записывают так:
SO3 + h3O = h3SO4 P2O5 + h3O = 2 HPO3
SO3 холодная
+ h3 O P2O5
h3SO4 + h3 O
h3P2O6
P2O5 + 3 h3O = 2 h4 PO4
Горячая
P2O5
+ H6 O3
H6 P2O8
Обратите внимание, что в зависимости от температуры воды при взаимодействии с Р2 О5 образуются разные продукты.
| h3O + КИСЛОТНЫЙ ОКСИД = Hn A (р. соединения) Кислота Внимание! SiO2 + h3O = нет реакции |
IV Взаимодействие воды c неметаллами
Примеры: Cl2 + h3O = HCl + HClO
t
C + h3O = CO + h3
уголь угарный газ
t
Si + 2h3O = SiO2 + 2h3 .
sites.google.com
Химические свойства воды. Применение воды.
8 кл. Химия Урок№____ ____________
Тема: Химические свойства воды. Применение воды.
Цель урока : познакомить учащихся с химическими свойствами воды; совершенствовать навыки написания уравнений химических реакций, определять тип химических реакций; развивать умения работать с опорным конспектом, текстом учебника; развивать познавательную деятельность через химический эксперимент, навыки взаимопомощи и самоконтроля.
Тип урока: комбинированный
Ход урока:
I. Организационный момент.
II. Проверка домашнего задания
III. Актуализация опорных знаний
Самостоятельная работа: «ДА» или «НЕТ, так как…»
Планета Земля покрыта водой на 70%.
Формула воды – Н3О.
Воду можно обеззараживать хлором, озоном и различными микроорганизмами.
В 200 граммах воды содержится 15% соли, что составляет 20 грамм
Это формула массовой доли растворённого вещества:
w=m(раств. вещ-ва)/ m ( раствора)
Это формула массовой доли растворённого вещества:
w(Э) = Ar(Э )/ Mr (соединения)
Прибор для разложения воды называется озонатором.
Плотность воды ровна 0,92 г/см3.
Температура кипения воды ровна 100 градусов.
Получение сложных веществ из более простых называется анализом.
Ответы:
ДА.
НЕТ, так как Н2О
НЕТ, микроорганизмами нельзя.
Нет, так как 200г - 100%
хг - 15% х= 30 грамм
ДА.
НЕТ, так как это формула нахождения массовой доли элемента в соединении.
НЕТ, так как прибор называется эвдиометром.
НЕТ, так как плотность воды равна 1 г/см3
ДА.
НЕТ, так как называется синтезом.
5 – за 10 вопросов 4 – за 6-9 вопросов 3 – за 1 – 5 вопросов
IV.Мотивация учебной и познавательной деятельности учащихся (сообщение темы и цели урока)
Подготовка к восприятию нового материала.
Проблемный вопрос. Сушеные овощи и фрукты дольше
сохраняются, если в закрытый полиэтиленовый пакет с ними
поместить сухой оксид кальция в пакетике из неплотной бумаги
или ткани.
Дайте объяснение этому приему с химической точки
зрения. На этот вопрос мы ответим, изучив химические свойства
воды.
V. Изучение нового материала
Химические свойства воды определяются особенностями ее строения. Вода довольно устойчивое вещество, она начинает разлагаться на водород и кислород при нагревании по крайней мере до 1000°С ( происходит термическая диссоциация) или под действием ультрафиолетового излучения (фотохимическая диссоциация).
Вода относится к химически активным соединениям. Например, реагирует с фтором. Хлор при нагревании или на свету разлагает воду с выделением атомарного кислорода:
h3O + Cl2 = HCl + HClO (НСlО = НСl + О)
При обычных условиях она взаимодействует с активными металлами:
2h3O + Ca = Ca(ОН)2 + h3
2h3O + 2Na = 2NaOH + h3
Вода вступает в реакцию и со многими неметаллами. Например, при взаимодействии с атомарным кислородом образуется пероксид водорода:
h3O + O = h3O2
Многие оксиды реагируют с водой, образуя основания и кислоты:
CO2 + h3O = h3CO3
CaO + h3O = Ca(OH)2
При взаимодействии с некоторыми солями образуются кристаллогидраты. При нагревании они теряют кристаллизационную воду:
Na2CO3 + 10h3O = Na2CO3*10h3O.
Вода также разлагает большинство солей (так называемый гидролиз).
Благородные металлы с водой не реагируют.
Хим св-ва воды:
1. разложение эл. током.
Н2О Электрический ток Н2 + О2
2 взаимодествие с металлами
А)Н2О + Ме (до Al) => Ме(ОН)х + Н2
(гидроксид)
t0
Б)Н2О + Ме (от Mn до h3) => МехОу + Н2
(оксид)
3 взаимодействие с оксидами Ме
Н2О + оксид Ме (до Mg) => Ме(ОН)х
(гидроксид)
4 взаимодействие с кислотными оксидами
Н2О + кислотный оксид => кислота
Демонстрация химических свойств воды.
- взаимодействие воды с натрием
- взаимодействие воды с оксидом кальция
- взаимодействие воды с оксидом фосфора (V)
Уравнения реакций записываются в конспект.
VI. Закрепление изученного материала.
Допишите уравнения химических реакций:
CaO + h3O = ____________
_________ + h3O = h4PO4;
K + ___________ = KOH + h3;
Zn + h3O = ________ + h3;
C + h3O = _________ + h3;
h3O + _________ = NaOH;
SO3 + _________ = h3SO4 ;
h3O эл. ток _____ + _______
Дидактическая игра. В каждой таблице найдите прямую линию – горизонтальную, вертикальную, диагональ, – которая пересекает все три клетки с веществами, взаимодействующими с водой.
VII Подведение итогов, оценивание
VIII Домашнее задание: выучить п. 35, на странице 132 выполнить:
infourok.ru
Физико-химические свойства воды | Вода и ее значение
Многие столетия люди не знали, что представляет собой вода, и как появилась она на планете. До XIX века люди не знали, что вода - химическое соединение. Ее считали обычным химическим элементом. После этого свыше ста лет все и всюду считали, что вода - соединение, описываемое единственно возможной формулой h3O.
В 1932 году мир облетела сенсация: кроме обычной воды, в природе существует еще и тяжелая вода. Сегодня известно, что изотопных разновидностей воды может быть 135. Состав воды, даже полностью освобожденной от минеральных и органических примесей, сложен и многообразен. Такое непростое это "простейшее соединение" - вода.
Всё многообразие свойств воды и необычность их проявления определяется, в конечном счете, физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул. Постоянно соприкасаясь со всевозможными веществами, вода фактически всегда представляет собой раствор различного, зачастую очень сложного состава. Она проявляет себя, как универсальный растворитель. Ее растворяющему действию, в той или иной мере, подвластны и твердые тела, и жидкости, и газы.
Исследователи раскрывают все более тонкие и сложные механизмы "внутренней организации" водной массы. Изучение воды дает все новые факты, углубляя и усложняя наши представления об окружающем мире. Развитие этих представлений помогает нам понять свойства воды и особенности взаимодействия ее с другими веществами.
Воду считают самым трудным из всех веществ, изучаемых физиками и химиками. Химический состав вод может быть одинаков, а их воздействие на организм разным, потому что каждая вода формировалась в конкретных условиях. И если жизнь - это одушевленная вода, то, также как и жизнь, вода многолика и характеристики ее бесконечны.
Вода, на первый взгляд, простое химическое соединение водорода и кислорода, но именно она является универсальным растворителем значительного количества веществ, поэтому в природе химически чистой воды нет. Особенно ярко свойства растворителя проявляются в морской воде, в ней растворяются почти все вещества. Около семидесяти элементов Периодической системы содержатся в ней в обнаруживаемых количествах. Даже редкие и радиоактивные элементы находятся в водах морей и океанов. В наибольшем количестве содержатся хлор, натрий, магний, сера, кальций, калий, бром, углерод, стронций, бор. Одного только золота растворено в водах океана по 3 кг на душу населения Земли.
По содержанию растворенных в ней веществ вода делится на 3 класса: пресная, соленая и рассолы. Наибольшее значение в быту имеет пресная вода. Хотя вода покрывает три четверти поверхности Земли и запасы ее огромны и постоянно поддерживаются кругооборотом воды в природе, проблема обеспечения пресной водой во многих районах земного шара не решена и с развтием научно-технического прогресса обостряется.
Природная вода не бывает совершенно чистой. Наиболее чистой является дождевая вода, но и она содержит незначительные количества различных примесей, которые захватывает из воздуха.
Наличие в воде различных веществ свидетельствует о ее высокой растворяющей способности. Это основное свойство воды. Вся практическая деятельность человека, с самой глубокой древности, связана с использованием воды и водных растворов и для приготовления пищи и для других житейских надобностей.
Роль воды в жизни нашей планеты удивительна и, как ни странно, раскрыта еще не до конца. Океаны, покрывающие Землю, являются единым огромным своеобразным термостатом, который летом не дает Земле перегреваться, а зимой постоянно снабжает континенты теплом. Водная поверхность планеты поглощает избыток углекислого газа в атмосфере, иначе Земля бы перегрелась из-за "парникового эффекта".
Интересно и, оказывается, очень важно, что, в отличие от других веществ, вода при замерзании не уплотняется, а расширяется. Молекулы льдоподобной воды расположены таким образом, что между ними возникают большие пустоты, а поэтому лед рыхлообразный, то есть легче, чем жидкая вода, и поэтому не тонет. Представим себе на минуту, что вода не обладала бы этим чрезвычайно редким свойством. Что могло бы произойти? В этом случае жизнь на нашей планете не могла бы даже возникнуть. Лед, едва появившись на поверхности водоема, как любое другое твердое вещество, тут же погружался бы на дно, и тогда промерзли бы насквозь не только пруды и реки, но и океаны.
|
Молекулярная структура воды. Анализ данных, полученных из спектров поглощения, показал, что три атома в молекуле воды образуют равнобедренный треугольник с двумя атомами водорода в основании и кислородом в вершине: Валентный угол HOH равен 104,31°. Атомы водорода так глубоко "внедрены" в атом кислорода, что молекула оказывается почти сферической. |
Температура замерзания и таяния воды 0° С, а кипения - 100° С. Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей. Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Чистая вода - плохой проводник электричества.
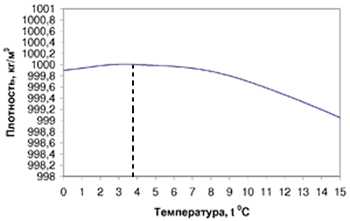
Сжимаемость воды очень мала. Плотность воды максимальна при 4° С. Это объясняется свойствами водородных связей ее молекул. Если оставить воду в открытой емкости, то она постепенно испарится - все ее молекулы перейдут в воздух. В то же время вода, находящаяся в плотно закупоренном сосуде испаряется лишь частично, т.е. при определенном давлении водяных паров между водой и воздухом, находящимся над ней, устанавливается равновесие. Давление паров в равновесии зависит от температуры и называется давлением насыщенного пара (или его упругостью). При обычном давлении 760 мм рт.ст. вода кипит при 100° С, а на высоте 2900 м над уровнем моря атмосферное давление падает до 525 мм рт.ст. и температура кипения оказывается равной 90° С. Испарение происходит даже с поверхности снега и льда, именно поэтому высыхает на морозе мокрое белье. Вязкость воды с ростом температуры быстро уменьшается и при 100° С оказывается в 8 раз меньше, чем при 0° С.
Основные физико-химические свойства воды влияют на все процессы, в которых вода принимает участие. Наиболее важны, на наш взгляд, следующие свойства.
1. Поверхностное натяжение - это степень сцепления молекул воды друг с другом. Органические и неорганические соединения растворяются в жидких средах, содержащих воду, поэтому поверхностное натяжение потребляемой нами воды имеет большое значение. Любая жидкость в организме содержит воду и, так или иначе, участвует в реакциях. Вода в организме играет роль растворителя, обеспечивает транспортную систему и служит средой обитания наших клеток. Поэтому, чем ниже поверхностное натяжение, соответственно, выше растворяющая способность воды, тем лучше вода выполняет свои основные функции. В том числе и роль транспортной системы. Поверхностное натяжение определяет смачиваемость воды и ее растворяющие свойства. Чем ниже поверхностное натяжение, тем выше растворяющие свойства, тем выше текучесть. Все три величины - поверхностное натяжение, текучесть и растворяющая способность - связаны между собой.
2. Кислотно-щелочное равновесие воды. Основные жизненные среды (кровь, лимфа, слюна, межклеточная жидкость, спинномозговая жидкость и др.) имеют слабощелочную реакцию. При сдвигах их в кислую сторону, меняются биохимические процессы, организм закисляется. Это ведет к развитию болезней.
3. Окислительно-восстановительный потенциал воды. Это способность воды вступать в биохимические реакции. Она определяется наличием свободных электронов в воде. Это очень важный показатель для организма человека.
4. Жесткость воды - наличие в ней различных солей.
5. Температура воды определяет скорость протекания биохимических реакций.
6. Минерализация воды. Наличие в воде макро- и микроэлементов необходимо для жизнедеятельности организма человека. Жидкости организма представляют собой электролиты, восполняемые минералами, в том числе и за счет воды.
7. Экология воды - химическое загрязнение и биогенное загрязнение. Чистота воды - наличие в ней примесей, бактерий, солей тяжелых металлов, хлора и др.
8. Структура воды. Вода представляет собой жидкий кристалл. Диполи молекулы воды ориентируются в пространстве определенным образом, соединяясь в структурные конгломераты. Это позволяет жидкости составлять единую биоэнергоинформационную среду. Когда вода находится в состоянии твердого кристалла (льда), молекулярная решетка жестко ориентирована. При таянии разрываются жесткие структурные молекулярные связи. И часть молекул, высвобождаясь, образует жидкую среду. В организме вся жидкость структурирована особым образом.
9. Информационная память воды. За счет структуры кристалла происходит запись информации, исходящей от биополя. Это одно из очень важных свойств воды, имеющее большое значение для всего живого.
10. Хадо - волновая энергетика воды.
www.coral-club34.ru