Физические свойства воды. Свойства вода
Свойства воды
Вода в природе существует в твердом, жидком и парообразном состоянии. Это единственное вещество, которое мы можем наблюдать в трех агрегатных состояниях.
При переходе из жидкого состояния в твердое другие вещества сжимаются, так как уменьшается расстояние между молекулами; вода же ведет себя совсем наоборот.

Она при замерзании теряет плотность и поднимается на поверхность вместо того, чтобы идти на дно. Образовавшийся слой льда препятствует проникновению холодного воздуха. В результате вода подо льдом получает возможность сохранять тепло и не превращаться в лед. Поэтому даже если температура воздуха достигла отметки - 50 градусов по Цельсию, подо льдом все равно всегда около нуля. И жизнь продолжается!
Значение поверхностного натяжения воды больше, чем у любой другой жидкости. Именно это свойство влияет на процесс образования дождевых капель, а, стало быть, и на круговорот воды в природе. В противном случае пары воды, поднявшись в небо и обратившись в облака, не смогли бы так легко и просто превратиться в капли, чтобы затем пролиться дождем на землю.
Наибольшая температура кипения среди всех веществ, встречающихся в природе в жидком виде - опять у воды: около ста градусов по Цельсию. Это обстоятельство способствует замедлению процессов испарения и помогает избежать больших потерь воды.
Молекула воды не может возникнуть так, чтобы к атому кислорода прицепилось с двух противоположных сторон по атому водорода. Напротив, атом кислорода присоединяется к двум атомам водорода, в результате чего последние составляют положительно заряженный полюс молекулы, а атом кислорода, находясь на противоположной стороне, составляет отрицательно заряженный полюс. Образуются двухполюсные молекулы воды, которые начинают группироваться друг с другом, притягиваясь разными полюсами.
Еще одно удивительное свойство воды заключается в следующем. В одной группе с кислородом в периодической системе химических элементов находятся сера (S), селен (Se) и теллурий (Te). Тем не менее, соединения этих элементов с водородом даже близко не напоминают воду. Например, сероводород - h3S - это газ с неприятным запахом тухлых яиц. Да и другие соединения в нормальных условиях находятся в газообразном состоянии. Их молекулы тяжелее молекулы воды: у h3S молекулярный вес - 34, у h3Sе - 81, у h3Те - 130. Вода же обладает молекулярным весом 18, а при этом не газ, а жидкость.
По сравнению с другими жидкостями вода обладает наивысшим показателем электрического сопротивления. В водной среде сила притяжения наэлектризованных частиц друг к другу достаточно слаба, поэтому ионизированные частицы солей прекрасно растворяются в воде, хотя большинство этих солей имеет слабую растворимость в органических жидкостях.
Образовавшиеся в атмосфере дождевые капли, начав свое движение, приходят в соприкосновение с кислородом, азотом и углекислым газом, которые растворяются в них. Мельчайшие твердые частички, находящиеся в атмосфере, также оказываются в плену у дождевых капель.
В воде повышается кислотность при смешивании с углекислым газом: она становится более сильным растворителем. А когда в атмосфере становится много оксида серы и азота (эти соединения образуются в результате сжигания топлива), кислотность воды растет еще больше. В итоге месте с дождевыми каплями на землю попадают растворы кислот. В такой среде растворяются и те вредные вещества, которые раньше не могли смешаться с дождевыми каплями. А значит, возникает опасность отравления и растений, и животных, и человека.

Кислотные дожди опасны и для водоемов. От них гибнут обитатели рек и озер, а вода становится непригодной для питья. В местах с очень плохой экологической обстановкой уничтожаются целые леса. Так, например, произошло в Карабаше, городе на Урале, который по праву считают самым грязным населенным пунктом планеты.
Самые главные свойства воды в картинках
www.da-voda.com
Физические свойства воды
> Физические свойства воды
- Состояние (ст.усл.): жидкость
- Плотность: 0,9982 г/куб.см
- Динамическая вязкость (ст.усл.): 0,00101 Па•с (при 20°C)
- Кинематическая вязкость (ст.усл.): 0,01012 кв.см/с (при 20°C)
Термические свойства воды:
- Температура плавления: 0°C
- Температура кипения: 99,974°C
- Тройная точка: 0,01 °C, 611,73 Па
- Критическая точка: 374°C, 22,064 MПа
- Молярная теплоёмкость(ст.усл.): 75,37 Дж/(моль•К)
- Теплопроводность(ст.усл.): 0,56 Вт/(м•K)
Агрегатные состояния воды:
- Твёрдое - лёд.
- Жидкое - вода.
- Газообразное - водяной пар.
При атмосферном давлении вода замерзает (превращается в лёд) при температуре в 0°C и кипит (превращается в водяной пар) при температуре 100°C.
При снижении давления температура плавления воды медленно растёт, а температура кипения - падает.
При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01°C. Такое давление и температура называются тройной точкой воды.
При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки льда падает со снижением давления.
При росте давления температура кипения воды растёт, плотность водяного пара в точке кипения тоже растёт, а жидкой воды - падает.
При температуре 374°C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают.
При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
Так же возможны метастабильные состояния - пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0°C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Вода обладает рядом необычных особенностей:
- При таянии льда, его плотность увеличивается (с 0,9 до 1 г/куб.см). Почти у всех остальных веществ при плавлении плотность уменьшается.
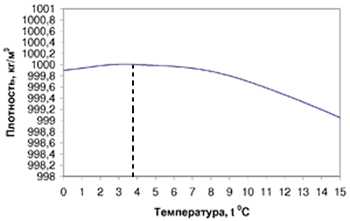
- При нагревании от 0°C до 4°C (точнее 3,98°C), вода сжимается. Благодаря этому могут жить рыбы в замерзающих водоёмах: когда температура падает ниже 4°C, более холодная вода, как менее плотная остаётся на поверхности и замерзает, а под льдом сохраняется положительная температура.
- Высокая температура и удельная теплота плавления (0°C и 333,55 кДж/кг), температура кипения (100°C) и удельная теплота парообразования (2250 КДж/кг), по сравнению с соединениями водорода с похожим молекулярным весом.
- Высокая теплоёмкость жидкой воды.
- Высокая вязкость.
- Высокое поверхностное натяжение.
- Отрицательный электрический потенциал поверхности воды.
Все эти особенности связаны с наличием водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а также того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода - каждый в одной, а атом кислорода - в двух; в таком состоянии молекулы находятся в кристалле льда. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4°С этот эффект становится слабее, чем тепловое расширение. При испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные - атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Чистая (не содержащая примесей) вода - хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония h4O+) и гидроксильных ионов HO - составляет 0,1 мкмоль/л. Но поскольку вода - хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60% парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Понравилось? Поделись с друзьями!Please enable JavaScript to view the comments powered by Disqus.blog comments powered bywww.vodainfo.com
Свойства воды | Магия воды
Октябрь 02, 2012
Вода — не только самое распространенное, но и самое удивительное вещество в природе. Данное утверждение основывается на присущих ей физических химических и уникальных свойствах, обеспечивающих то исключительное положение, которое она занимает в биосфере.
 Ученые в результате многочисленных научных экспериментов доказали, что именно воде принадлежит ведущая роль в эволюции геологических процессов и зарождении жизни на планете. Огромное количество воды в связанном состоянии присутствует в недрах Земли, в частности в некоторых минералах и горных породах. Основные ее запасы сосредоточены в мантии земной коры — около 15 млрд. км³.
Ученые в результате многочисленных научных экспериментов доказали, что именно воде принадлежит ведущая роль в эволюции геологических процессов и зарождении жизни на планете. Огромное количество воды в связанном состоянии присутствует в недрах Земли, в частности в некоторых минералах и горных породах. Основные ее запасы сосредоточены в мантии земной коры — около 15 млрд. км³.
Вода в свободном состоянии содержится в жидких средах нашего организма — крови, лимфе, пищеварительных соках и межклеточном пространстве. В тканях она присутствует в связанном виде, поэтому при повреждении или рассечении органа не выводится. Вода является основной средой организма человека, в которой осуществляется все виды обмена веществ и протекают ферментативные биохимические реакции.
Вода (окись водорода, h3O) — соединение водорода с кислородом, устойчивое в обычных условиях. Эта жидкость не обладает ни цветом, ни запахом, ни вкусом. Голубоватый цвет она имеет только в слоях большой толщины, например в океанах и морях. Молекулярная масса воды (18,016 а.е.м.) распределяется следующим образом: водород — 11,9%, кислород — 88,81%.
Свойства воды определяются особенностями ее строения. Молекула воды имеет 3 ядра, составляющие равнобедренный треугольник. В его основании находятся протоны водорода, а на вершине — атом кислорода.
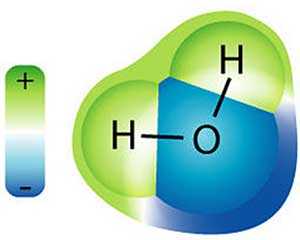
Электроны в молекуле воды располагаются таким образом, что образуют по 2 парных полюса противоположных зарядов: атомы водорода создают 2 положительных полюса, а атомы кислорода — 2 отрицательных.
Высокая полярность молекулы воды позволяет атомам кислорода притягивать атомы водорода соседних молекул и образовывать по 4 водородные связи, что четко прослеживается в кристаллах льда. Структура последних имеет гексагональную решетку, в которой находится множество пустот. При плавлении льда соседние молекулы Н2О заполняют пустоты, что приводит к повышению плотности. Дальнейшее нагревание усиливает движение молекул. Происходит расширение пустот и уменьшение плотности.
Вода в природе существует в жидком, твердом (лед) и газообразном (пар) состоянии. При переходе из твердой формы в жидкую плотность молекулы воды вопреки ожидаемому эффекту возрастает, а не уменьшается. Максимума плотность воды достигает при 4℃, когда вес единицы объема воды превышает тот же показатель при 0℃. При дальнейшем нагревании плотность воды уменьшается. В случае снижения температуры вода медленно опускается на дно, а на ее поверхности образуется лед. Так как его плотность ниже, он поднимается вверх, но за его нижней чертой всегда находится вода.
Еще одно уникальное свойство воды — высокая теплоемкость. Она имеет наибольшую теплоемкость среди всех жидкостей. Этим объясняется медленное остывание воды в течение осени и длительное нагревание в весенний период. Данное свойство воды связано с другой ее функцией — регуляцией температуры на планете.
Ученые установили, что теплоемкость воды снижается при нагревании от 0 до 37℃, а далее этот параметр, напротив, возрастает. Следовательно, самая оптимальная температура, при которой вода быстро нагревается и охлаждается, составляет 37℃, что почти соответствует нормальной температуре тела человека. Объяснения данному факту пока нет, но связь с терморегуляцией человеческого организма очевидна. Предполагается, что в этом состоит защитная функция воды, которая направлена на устранения воздействия высокой температуры.
В зависимости от происхождения, молекулярного состава или особенностей применения выделяются основные и особые типы воды. К первым относятся подземные и сточные воды, талая, пресная, морская, минеральная, тяжелая, легкая, дистиллированная, дождевая вода и др. А особые типы воды окружены ореолом таинственности и обусловлены наличием каких-либо уникальных свойств. Речь идет о святой и структурированной, живой и мертвой воде.
Поделиться ссылкой в социальных сетях
www.filoli.ru
Как используют люди свойства воды? Свойства и состояния воды
Многим известно, что благодаря воде зародилась жизнь на планете Земля. Именно это вещество ищут ученые на Марсе, чтобы доказать, что и здесь присутствует фауна и флора. Человек сегодня не может представить себе существования без воды. Все благодаря чудодейственным свойствам этого материала.
Вода в природе
Вода представляет собой жидкость без запаха и вкуса. Цвета этот природный материал практически также не имеет. В глубоких слоях вода может иметь голубоватый оттенок. Это одно из наиболее распространенных веществ в природе, без которого не может обойтись ни одно существо. Удивительно, гидросфера занимает более 70% всей биосферы.
 Вода – это минерал, с помощью которого сегодня организуется промышленность, строятся дома, а также существуют электростанции. Ученые выяснили, что вода является замечательным растворителем. Поэтому найти в природе идеально чистое вещество невозможно. Чаще встречается жидкость с различными примесями органических и неорганических материалов. Существует огромное количество разновидностей воды. Все они нашли свое применение в жизнедеятельности человека. Как используют люди свойства воды, будет описано ниже.
Вода – это минерал, с помощью которого сегодня организуется промышленность, строятся дома, а также существуют электростанции. Ученые выяснили, что вода является замечательным растворителем. Поэтому найти в природе идеально чистое вещество невозможно. Чаще встречается жидкость с различными примесями органических и неорганических материалов. Существует огромное количество разновидностей воды. Все они нашли свое применение в жизнедеятельности человека. Как используют люди свойства воды, будет описано ниже.
Свойства воды
Природный минерал может существовать в трех формах – в твердом, жидком и парообразном состоянии. Наиболее распространенной является именно жидкость. Свойства воды напрямую зависят от ее состояния. При замерзании вещество теряет свою плотность и поднимается на поверхность. Благодаря этому вода подо льдом всегда сохраняет свою температуру. Даже если температура воздуха опустилась ниже 40 градусов по Цельсию, подводные живые организмы продолжат свое существование.
 Рассматривая свойства и состояния воды, нельзя не вспомнить про поверхностное натяжение. Этот показатель значительно выше, нежели у любой другой жидкости. Именно благодаря этому могут образовываться дождевые капли. Поверхностное натяжение является одним из основных показателей, которые влияют на круговорот воды в природе. Мы можем воочию наблюдать свойства воды. Опыты можно проводить в домашних условиях. Это очень интересно и увлекательно. Все что нужно сделать, это набрать воду в стаканчик до края и бросать поочередно в нее монетки или другие мелкие предметы. Можно заметить, что вода не выливается сразу за края емкости, а образует небольшую горку. Это происходит благодаря силе поверхностного натяжения.
Рассматривая свойства и состояния воды, нельзя не вспомнить про поверхностное натяжение. Этот показатель значительно выше, нежели у любой другой жидкости. Именно благодаря этому могут образовываться дождевые капли. Поверхностное натяжение является одним из основных показателей, которые влияют на круговорот воды в природе. Мы можем воочию наблюдать свойства воды. Опыты можно проводить в домашних условиях. Это очень интересно и увлекательно. Все что нужно сделать, это набрать воду в стаканчик до края и бросать поочередно в нее монетки или другие мелкие предметы. Можно заметить, что вода не выливается сразу за края емкости, а образует небольшую горку. Это происходит благодаря силе поверхностного натяжения.
Температура кипения
Все жидкости, которые существуют в природе, имеют свою температуру кипения. Не исключением является и вода. Этот материал обладает наивысшей температурой кипения. Эти теплофизические свойства воды имеют огромное значение в существовании всего живого. Жидкость может кипеть при температуре около 100 градусов по Цельсию. Этот показатель может немного меняться в зависимости от того, какие примеси добавлены в воду. Именно температура кипения напрямую влияет на процессы испарения. Тем выше этот показатель, тем меньше потери воды в природе.
Теплофизические свойства воды широко используются также и в быту. Во время кипения в воде погибают различные болезнетворные микроорганизмы. Благодаря этому процессу можно очистить жидкость от различных примесей. Кипяченая вода может беспрепятственно употребляться в пищу. Такую жидкость используют также для обработки медицинских инструментов и ран.
Вода в теплоэнергетике
Люди уже на протяжении многих столетий ищут природные источники энергии. Таким источником может стать обычная вода. Неслучайно это вещество сегодня широко используется в теплоэнергетике. Этот материал играет сразу две роли – теплоносителя и рабочего тела. Для того чтобы произвести один мегаватт электроэнергии, необходимо использовать около 30 кубических метров воды в секунду. Жидкость используется также для охлаждения турбины конденсатора энергоблока. Получается, что без воды невозможно было бы и наладить доступ к электричеству, а многие здания бы попросту не отапливались.
 Во второй половине XX века 50% электричества вырабатывалось именно гидроэлектростанциями. Это позволяло людям нормально организовывать быт, а экологическая ситуация оставалась на уровне. Использование воды человеком не иссякаемо, если он делает все правильно. Наличие большого количества автомобилей, выхлопы с различных заводов и фабрик приводят к тому, что количество чистой воды уменьшается. Сегодня уже гораздо меньше электроэнергии вырабатывается благодаря воде.
Во второй половине XX века 50% электричества вырабатывалось именно гидроэлектростанциями. Это позволяло людям нормально организовывать быт, а экологическая ситуация оставалась на уровне. Использование воды человеком не иссякаемо, если он делает все правильно. Наличие большого количества автомобилей, выхлопы с различных заводов и фабрик приводят к тому, что количество чистой воды уменьшается. Сегодня уже гораздо меньше электроэнергии вырабатывается благодаря воде.
Химия и вода
Если рассматривать химические свойства воды, то в первую очередь приходит на ум возможность жидкости растворять другие вещества. Именно вода является основным реагентом во многих химических реакциях. Это свойство широко используется в быту, а также производстве. Вода – это особое транспортное средство, которое позволяет перемещать продукты химической реакции из одного технологического аппарата в другой. В окружающую среду жидкие отходы попадают также в виде суспензий и растворов. Химическая промышленность просто не смогла бы существовать без воды.
 В быту также можно легко отследить свойства воды как растворителя. Стоит отметить, что возможность растворять отдельные вещества зависит от температуры воды. Многие замечали, что жирную посуду легко удается отмыть в теплой воде. А вот низкая температура такой возможности не дает. В быту также можно заметить, как в воде растворяются такие общеизвестные продукты, как соль, сахар и сода. Чай – это водный раствор, который является не только полезным, но и еще и вкусным.
В быту также можно легко отследить свойства воды как растворителя. Стоит отметить, что возможность растворять отдельные вещества зависит от температуры воды. Многие замечали, что жирную посуду легко удается отмыть в теплой воде. А вот низкая температура такой возможности не дает. В быту также можно заметить, как в воде растворяются такие общеизвестные продукты, как соль, сахар и сода. Чай – это водный раствор, который является не только полезным, но и еще и вкусным.
Вода в медицине
Очень распространено использование воды человеком в медицинских целях. Здесь вода чаще всего также выступает в качестве растворителя. Также она может использоваться в виде лекарственного средства и вспомогательного вещества для осуществления гигиены и санитарии. За последние годы значительно вырос уровень медицинского обслуживания. Количество населения планеты также с каждым годом увеличивается. Это приводит к тому, что возрастает необходимость водопотребления в медицинских целях.
 Для лечения многих недугов используются свойства жидкой воды. Конечно, вещество применяется не в чистом виде. С участием воды изготавливаются различные лекарства, растворы и суспензии. А температуру кипения жидкости используют для обработки медицинских инструментов и формы.
Для лечения многих недугов используются свойства жидкой воды. Конечно, вещество применяется не в чистом виде. С участием воды изготавливаются различные лекарства, растворы и суспензии. А температуру кипения жидкости используют для обработки медицинских инструментов и формы.
Многие медикаменты действуют эффективно только лишь при употреблении достаточного количества жидкости. Об этом всегда можно прочитать в инструкции по применению лекарства. Вода играет роль транспортного средства, позволяя медикаменту быстрее добраться до нужного органа.
Вода в сельском хозяйстве
Невозможно себе представить сельское хозяйство без жидкости. Как используют люди свойства воды в этой сфере? Вещество помогает доставить полезные микроэлементы и минералы до клеток животных и растений. Вода является обязательным участником различных обменных реакций, а также процесса фотосинтеза. Кроме того, с помощью жидкости регулируется температура животных и растений. Мало кто знает, что объемы воды, которые используются для полива растений, а также содержания скота, не уступают промышленным объемам.
Для того чтобы качественно выращивать овощи и фрукты, необходимо грамотно организовать полив. Во многих случаях не обойтись без специалистов. Только профессионал может наладить работу таким образом, чтобы вода доставлялась до каждого растения на участке. Надеяться только лишь на дождь – это значит загубить угодья.
Как используют люди свойства воды в косметологии
Ни одно косметологическое средство не может быть изготовлено без воды. Но в этой сфере чаще всего используется особая термальная вода, которая обладает свойствами омоложения и восстановления кожи. В состав жидкости из термальных источников входят микроэлементы и минералы, которые могут восстановить здоровье кожи и волос любого типа.
 Чистая вода также используется в косметологии в качестве растворителя. С помощью жидкости готовят различные кремы, маски и шампуни. Косметика нередко готовится также и в домашних условиях. Перед приготовлением продукции необходимо изучить свойства воды кратко. Необходимо строго следовать рецепту, чтобы косметика получилась действительно качественной и полезной.
Чистая вода также используется в косметологии в качестве растворителя. С помощью жидкости готовят различные кремы, маски и шампуни. Косметика нередко готовится также и в домашних условиях. Перед приготовлением продукции необходимо изучить свойства воды кратко. Необходимо строго следовать рецепту, чтобы косметика получилась действительно качественной и полезной.
Вода в быту
Как используют люди свойства воды в домашних условиях? Здесь жидкость выступает чаще всего в качестве продукта питания, а также средства гигиены и санитарии. Вода может выступать также участником различных химических реакций, которые происходят при приготовлении пищи. Широко используются теплоэнергетические свойства жидкости. К примеру, в питании используется чаще всего кипяченая вода.
 Теплообеспечение многоквартирных домов также организуется благодаря воде. Жидкость, нагреваясь до нужной температуры, может в течение продолжительного времени поддерживать тепло в домах.
Теплообеспечение многоквартирных домов также организуется благодаря воде. Жидкость, нагреваясь до нужной температуры, может в течение продолжительного времени поддерживать тепло в домах.
Еще в начальной школе малыши начинают изучать свойства воды. 2 класс – это время, когда дети начинают знакомство с одним из важных веществ в природе. Задача учителя – научить ребенка экономить водные ресурсы, чтобы продлить жизнь на планете.
fb.ru
Вода и её свойства
ГЛАВНЫЙ СОСТАВИТЕЛЬ РЕФЕРАТА
ПЕТРУНИНА
АЛЛА
БОРИСОВНА
МУНИЦИПАЛЬНАЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ
СРЕДНЯЯ ШКОЛА №4
по химии на тему:
“Вода и её свойства”
Выполнила :
ученица 11 ”Б” класса
Петрунина Елена
ПЕНЗА 2001г.
Вода – вещество привычное и необычное. Известный советский ученый академик И.В.Петрянов свою научно – популярную книгу о воде назвал “Самое необыкновенное вещество в мире”. А доктор биологических наук Б.Ф.Сергеев начал свою книгу “Занимательная физиология” с главы о воде – “Вещество, которое создало нашу планету”.
Ученые правы: нет на Земле вещества более важного для нас, чем обыкновенная вода, и в то же время не существует другого такого же вещества, в свойствах которого было бы столько противоречий и аномалий, сколько в её свойствах.
Почти ¾ поверхности нашей планеты занято океанами и морями. Твёрдой водой – снегом и льдом – покрыто 20% суши. Из общего количества воды на Земле, равного 1 млрд. 386 млн. кубических километров, 1 млрд. 338 млн. кубических километров приходится на долю солёных вод Мирового океана, и только 35 млн. кубических километров приходится на долю пресных вод. Всего количества океанической воды хватило бы на то, чтобы покрыть ею земной шар слоем более 2,5 километров. На каждого жителя Земли приблизительно приходится 0,33 кубических километров морской воды и 0,008 кубических километров пресной воды. Но трудность в том, что подавляющая часть пресной воды на Земле находится в таком состоянии, которое делает её труднодоступной для человека. Почти 70% пресных вод заключено в ледниковых покровах полярных стран и в горных ледниках, 30% - в водоносных слоях под землёй, а в руслах всех рек содержатся одновременно всего лишь 0,006% пресных вод.
Молекулы воды обнаружены в межзвёздном пространстве. Вода входит в состав комет, большинства планет солнечной системы и их спутников.
Изотопный состав. Существуют девять устойчивых изотопных разновидностей воды. Содержание их в пресной воде в среднем следующее: 1 Н216 О – 99,73%, 1 Н218 О – 0,2%,
1 Н217 О – 0,04%, 1 h3 Н16 О – 0,03%. Остальные пять изотопных разновидностей присутствуют в воде в ничтожно малых количествах.
Строение молекулы. Как известно, свойства химических соединений зависят от того, из каких элементов состоят их молекулы, и изменяются закономерно. Воду можно рассматривать как оксид водорода или как гидрид кислорода. Атомы водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи О – Н 0,957 нм; валентный угол Н – О – Н 104o 27’ .
mirznanii.com