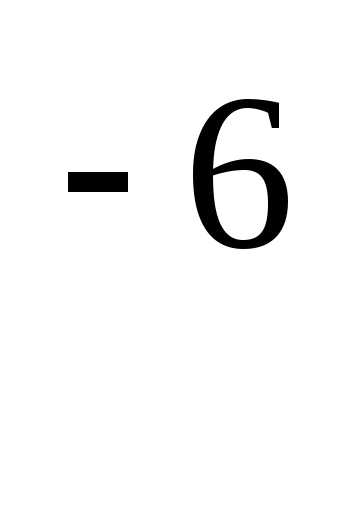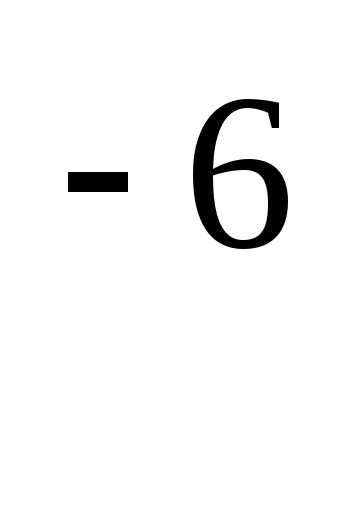Лабораторная работа «Определение качества питьевой воды и его гигиеническая оценка» Задания студенту:. Свойства воды лабораторная работа
Вода. Состояние воды. Свойства воды. Берегите воду! Занятие ОБЖ. Безопасность на воде. Лабораторная работа №2
Тема: Вода. Состояние воды. Свойства воды. Берегите воду! Занятие ОБЖ. Безопасность на воде. Лабораторная работа №2 Цели: 1. Формировать знания учащихся о свойствах и состояниях воды значении её в природе и жизни человека, познакомить с экологическими проблемами водных ресурсов земли. 2. Способствовать развитию внимания, воображения, памяти учащихся; устной речи. 3. Воспитывать в детях бережное отношение к воде; научить экономить и ценить её; развивать стремление охранять водоемы от загрязнения. Тип урока: комбинированный Оборудование: компьютер, презентация, для опытов – стакан, вода, глина, сахар. Ход урока: 1. Организационно психологический момент. Психологический настрой. - Создадим друг другу хорошее настроение. Подарите улыбки друг другу и мне, а я улыбнусь вам. Я желаю, чтобы хорошее настроение сохранилось на протяжении всего урока. 2. Определение темы урока. Загадка. Меня пьют, меня льют. Всем нужна я, Кто я такая? Мы говорим: она течёт; Мы говорим: она играет; Она бежит всегда вперёд, Но никуда не убегает. Я и туча, и туман, И ручей, и океан, И летаю, и бегу, И стеклянной быть могу! (Вода) Именно о воде мы и будем сегодня читать сказку. Постановка учебной задачи. Сообщение по теме урока. - Да, ребята, речь пойдет о воде. И сегодня мы с вами отправимся в путешествие по нашей реке Ишим. Поговорим о значении воды в жизни человека, о её экологическом состоянии, свойствах которые имеет вода. Первый остров «Интересно, но факт» -Воду пьют леса и поля. Без неё не могут жить ни звери, ни птицы, ни люди. Но вода не только поит, но ещё и кормит. По морям и океанам днём и ночью плывут тысячи рыболовных судов. - Вода «добывает» электрический ток, работая на электростанциях. Моет всех людей, города, машины, дороги. - Без воды не замесить тесто для хлеба, не приготовить бетон для стройки, не сделать ни бумагу, ни ткань для одежды, ни резину, ни металл, ни конфеты, ни лекарств – ничего не сделать без воды. Вода - самая загадочная жидкость на Земле. Певцы древних степных народов – акыны - воспевали её, поэты посвящали ей удивительные строки. А ученые по сей день, как и сотни лет назад, не могут дать точного ответа, на простой вопрос - Что такое ВОДА? - Французский писатель Антуан де Сент Экзюпери, ответил на этот вопрос так: «Вода! У тебя нет ни вкуса, ни запаха, ни цвета, тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое! Нельзя сказать, что ты необходима для жизни: ты сама - ЖИЗНЬ. Ты наполняешь нас невыразимой радостью…ты,- самое большое богатство на свете! » Учитель. Вот она, какая вода! Но всё это стало доступно человеку только после того, как он хорошо изучил свойства этого вещества. 5. Исследовательская деятельность. Мы с вами продолжаем путешествие. Второй остров «Исследование». Перед вами лежит таблица «Свойства воды» Сейчас мы с вами узнаем, какими свойствами обладает вода. А для этого проведем опыты. Свойства воды Прозрачность Цвет Запах Форма Текучесть Опыт 1. Как можно проверить прозрачность воды? в стакан с водой опустить какой-нибудь предмет, ложку. Ложка видна. Вывод: вода прозрачна. В таблицу заносят данные – ПРОЗРАЧНА. Опыт 2. Какого цвета вода? Для определения цвета воды. Налейте в один стакан молоко, а в другой - воду. Сравни. Вывод: вода бесцветна. Вы увидите , что молоко белое а вода… В таблицу заносят данные – БЕСЦВЕТНА. Опыт 3. Каков запах воды? Чем пахнет чистая вода? Понюхай чистую воду, и мандарин, и сделай вывод. Вывод: вода не имеет запаха. В таблицу заносят данные – НЕ ИМЕЕТ ЗАПАХА. Она принимает запах того вещества, которое в нее положили или налили. Опыт 4. Имеет ли вода форму? Вода налита в разные сосуды: стакан, ваза. Какую форму принимает вода? Вывод: у воды нет определенной формы. В таблицу заносят данные – У ВОДЫ НЕТ ОПРЕДЕЛЕННОЙ ФОРМЫ. Она принимает форму того сосуда, в которого ее налили. Опыт Одно из свойств воды - текучесть. Что произойдет с водой, если вылить её из посуды? Можно ли воду из одного стакана перелить в другой? Вывод: вода текуча. В таблицу заносят данные – ВОДА ТЕКУЧА. Ученик говорит свойства воды. 6. Систематизация и углубление знаний о свойстве воды. 1) Учитель: Вода еще хороший растворитель. Но не все вещества растворяются в воде. -Сейчас я стаканы с водой я насыплю соль. Наблюдайте, что будет происходить. - Какого цвета была вода в ваших стаканах сначала? (Бесцветной). - А какого цвета стала теперь? - О чём это говорит? (вода растворила соль). - А теперь я добавлю в другой стакан мел. Размешайте. Что вы заметили? - Что твердые вещества в воде не растворяются. (Вода - хороший растворитель). 2) Учитель: Вода в природе может находиться в трёх состояниях. - Кроме жидкого состояния вода в природе находится еще и в твердом - лед, снег, град, и в газообразном - пар, радуга, облака. Как же вода переходит из одного состояния в другое? - Когда температура воздуха опускается ниже отметки 0 градусов - вода переходит из жидкого состояния - в твердое, т.е. замерзает. - Когда температура воздуха поднимается выше отметки 0 градусов, вода медленно начинает переходить из жидкого состояния в газообразное, и чем выше температура, тем быстрее она испаряется. Состояния воды: Жидкое - дождь, реки, роса. Твердое - град, снег, иней, лед. Газообразное – пар. Ученик делает вывод. Проводя опыты можно сделать вывод: Что вода прозрачна, бесцветна, не имеет запаха, нет определенной формы, что вода текуча, вода-растворитель, вода бывает в жидком, твердом и газообразном состояние. 7. Физминутка Третий остров «Подумай и ответь». 8. Работа с учебником. Сейчас мы прочтем рассказ о значении воды в природе. Открываем учебник на странице 30. Вы видите рассказ. Сейчас я его прочту, а вы внимательно послушайте и подумайте над таким вопросом: Какую роль играет вода для растений? Животных? Человека? (чтение текста учителем) (ответы детей на поставленный ранее вопрос). Анализ прочитанного. (Учитель) Природа не может существовать без воды. Даже наше тело состоит из воды больше чем наполовину. Вода входит в состав крови, которая разносит питательные вещества по всему организму. Можно сделать вывод: Что без воды всё живое на земле погибнет. 9. Работа в тетради. Открываем тетрадь на стр. 14. У вас в тетради есть таблица. Давайте ее заполним. 1. Что вы узнали о воде, о ее свойствах? Запишите. 2. Выберите правильный ответ и подчеркните его? 10. Подведение итога урока. Оценивание.Вот и закончилось наше путешествие по нашей реке Ишим. У вас тоже есть капелька, расскажите, что нового вы узнали о воде и свойствах воды. А потом мы по капельке соберем одну большую каплю, потому что воду надо беречь и заботиться о ее чистоте. Продолжите предложение: - урок понравился, мне было интересно; - много узнал на уроке, хочу найти дополнительный материал по изученной теме; - мало узнал на уроке, только время потерял; - урок не понравился, мне было скучно. 11. Домашнее задание: стр. 30-36 читать, нарисуй рисунок в тетради на тему «Берегите воду»
СКАЗКА О ВОДЕ
Жила-была Вода, и однажды надумала она сделать Природу красивой. Вода решила отправиться по свету и понаблюдать за Природой. Она превратилась в маленький Ручеек и потекла по Земле. Со временем Ручеек становился все шире и шире, все больше и сильнее. Вскоре Ручеек превратился в Реку и потек не быстро, как ручей, а медленно и важно, как течет настоящая река. Вдруг ярко засветило Солнце, Река высохла и стала Паром. Пар поднялся высоко-высоко и спросил у Солнца: - Солнце, зачем ты меня высушило? Солнце и отвечает: - Не бойся, я помогу тебе сделать всем добро! Пар спрашивает: - Солнце, скажи, как мне сделать Природу красивой? Солнце улыбнулось и ответило: - Ты сам догадайся, а я только подскажу. Растениям и деревьям нужен дождь! Пар воскликнул: - Точно! Спасибо тебе, Солнце! И обернулся Пар Дождиком. Полил он все вокруг и любуется: все деревья, и кусты вновь зацвели, птицы запели свои веселые песенки, даже в пустынях появились оазисы. Все люди и животные радостно закричали: - Спасибо тебе, Дождик! А Дождик собрался вновь в звонкий Ручеек и потек, весело побежал по земле. Ему было очень радостно и приятно, что он сделал что-то хорошее для Матушки-Природы. Ручеек был очень доволен. Дальше он побежал очищать Моря и Океаны от соли. Ручеек добрался до Моря и крикнул ему: - Здравствуй, Море! Море ответило: - Привет, звонкий Ручеек! Чего ты хочешь? Ручеек сказал: -Можно взять у тебя немного соли в пищу людям? Море задумалось: - Ладно, Ручеек, вот тебе моя соль. Используй ее, как хочешь. Ручеек обрадовано ответил: - Да, хорошо! Спасибо тебе, Море! Они попрощались, и Ручеек отдал соль в пищу людям, чтобы они были здоровыми, а потом принял свой первоначальный облик. Вода обратилась к Природе и сказала: - Природа, я сделала тебя красивой, я сделала людей здоровыми, я помогла Морю избавиться от лишней соли. Я выполнила свое предназначение. Природа отвечает: - Спасибо тебе, Вода, я тебе очень благодарна! На том и разошлись. Вода, выполнив свое предназначение, вернулась к себе домой и стала спокойно жить и делать добро всему миру.
kopilkaurokov.ru
«Вода. Свойства воды, значение воды. Растворимые и нерастворимые вещества. (Лабораторная работа)» - Начальная школа - В помощь учителю - Учительские университеты
Учитель начальных классов школы №10 с.Чапаево Илийского района Алматинской области Алексеева Людмила Николаевна.ТЕМА: «Вода. Свойства воды, значение воды. Растворимые и нерастворимые вещества. (Лабораторная работа)»
ЦЕЛИ: 1) Ознакомление детей с водой, с её ролью в жизни человека, со свойствами воды. 2) Развитие познавательной активности во время изучения нового материала. 3) Воспитание бережного отношения к воде.
ЗАДАЧИ: 1.Расширить и углубить представление учеников о воде и ее свойствах. 2. Развитие познавательной активности во время изучения нового материала. Развить навыки практической и самостоятельной деятельности. Развивать коммуникативные навыки, умение работать в сотрудничестве. 3.Воспитывать бережное отношение к природе.
ОБОРУДОВАНИЕ: Презентация «Вода», глобус, атрибуты для опытов.
ХОД УРОКА I. Организационный момент. . Мы – умные! Мы – дружные! Мы – внимательные! Мы – старательные! Мы отлично учимся! Все у нас получится.
2. Актулизация знаний Слайд 1. Цветок, лебедь, водопад, бабочка, берёза. - Назовите объекты. - Как можно назвать одним словом? (Природа) - Какой объект лишний и почему? ( Лишняя – вода, т.к. это относится к неживой природе, все остальное – объекты живой природы)
Попробуйте отгадать загадки, приготовленные ребятами. Слайд 2 С неба звезды падают, Лягут на поля. Пусть под ними скроется Чёрная земля. Много-много звездочек Тонких как стекло; Звёздочки холодные, А земле тепло. (Снежинки) Слайд 3 Прозрачен, как стекло, А не вставишь в окно. (Лёд) Слайд 4 Седой дедушка у ворот Всем глаза заволок. (Туман) Слайд 5 Я и туча, и туман, И ручей, и океан, И летаю, и бегу, И стеклянной быть могу. (Вода) - Загадки такие разные, а что их всех объединяет? ( Все загадки о воде) - Как вы думаете, о чем мы будем говорить на уроке? - В каких состояниях бывает вода в природе?
Слайды 6,7,8,9. - Рассмотрите репродукции картин. Иван Константинович Айвазовский. Чёрное море. Федор Александрович Васильев. Облака. Исаак Ильич Левитан. Туман. Борис Михайлович Кустодиев. Зима. - Нравятся картины? -Что вы видите? - Какие состояния воды изобразили художники? Слайд 10 Состояния воды
Жидкое Газообразное Твёрдое Слайд 11 Соедините предметы с состоянием воды в природе. II. Сообщение темы и целей урока. Отгадав загадку, вы узнаете, о чём пойдёт речь на нашем уроке. С горы, сбегая без труда, она гремит как гром. В морозный день она тверда - руби хоть топором. Нагрей ее - и к небесам она взлетит тогда, Теперь ты мне ответишь сам: зовут ее… (Вода)
Ребята, послушайте высказывание писателя Антуана де Сент- Экзюпери о воде: «…, у тебя нет ни вкуса, ни цвета, ни запаха, тебя не возможно описать, тобой наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима для жизни: ты сама жизнь. Ты наполняешь нас радостью, которую не объяснить нашими чувствами. С тобой возвращаются к нам силы, с которыми мы уже простились. По твоей милости в нас вновь начинают бурлить высокие родники нашего сердца. Ты самое большое богатство на свете.» На уроке нам предстоит путешествие в царство Воды.
III. Раздел «Вода – чудо природы» А теперь поговорим о свойствах воды. Вода – это вещество обыкновенное и хорошо знакомое нам всем.
Сейчас вам предстоит выполнить исследовательскую работу. Каждая группу будет работать за своим столом.
Для начала давайте вспомним правила безопасности при проведении опытов. Слайд 12 Работа под руководством взрослого. Вставать с рабочего места и ходить по классу запрещается. Наблюдение, обсуждения, выводы делаются совместно, уважая мнение каждого и участников других групп.
Практическая работа Выявляем основные свойства воды.
1.Два стакана. В одном - вода, в другом - молоко. Сравните их. Какого цвета молоко? А вода? (Вывод: вода бесцветна) 2.Посмотрите через молоко на открытку, а затем через воду (Вывод: вода прозрачна). 3.Понюхайте воду. Чувствуете ли вы запах? (Вывод: вода не имеет запаха) 4.Сделайте из стакана глоток воды. Имеет ли она вкус (Вывод: вода не имеет вкуса) 5.Налейте немного воды на картонку. Наклоните ее. Что произошло? (Вывод: вода текуча) 6. Вода не имеет формы.
(После каждого опыта ученики делают вывод, учитель показывает свойство воды на слайде 13,14,15,16)
Физминутка. Слайд 17
IV. Раздел «Вода -- растворитель» Сегодня мы, как настоящие исследователи, будем проводить опыты, но чтобы начать работу нам нужно ответить на три важных вопроса: Объяснить значение слова “растворитель”? А может веществом – растворителем быть вода? Все ли вещества растворяются в воде? Это мы сейчас проверим.
Лабораторная работа 1 опыт: как вы думаете, какие в воде вещества растворимые, а какие нет? Положи в стакан с водой соль (сахар, соду) и размешай. Понаблюдай, что происходит. Исчезла ли соль? Да, она растворилась в воде. Соль-рассол, сахар-сироп.
Вода – хороший растворитель, но не все вещества растворимы в воде.
2 опыт: Теперь в другой стакан с водой ложи глины (песка) помешай. Частицы глины будут плавать в воде, которая помутнеет. Почему так получилось? Глина перемешалась с водой, но не растворилась в воде. Вывод – растворимые вещества- невидимые, прозрачные в воде; нерастворимые- мутная вода, осадок или всплывает. Слайд 18 3 опыт: В стакане вода, по краям стакана пузырьки, воздух растворился в воде.
Вода – растворитель. Она растворяет даже некоторые металлы (серебро…). Многие старые люди пили чай с серебряной ложкой. Это старое народное средство, которым залечивали наружные раны и лечили желудочно-кишечные заболевания. Это серебряная вода. Ее можно получить в домашних условиях. Опустите в стакан с водой серебро. Через некоторое время мельчайшие частицы серебра растворяться. Желаю всем долгих лет жизни.
V. Раздел«Вода – сама жизнь» - Каким цветом обозначена вода на нашей планете? (Вода – голубым, синим, лед – белым) - Посмотрите, сколько воды на нашей планете! С водой мы встречаемся каждый день. (Глобус) - Кому нужна вода? ( Растениям, животным, людям)
Слайд 19. Вода
Животные Растения Человек
- Правильно, растения, животные, люди – все содержит воду. А, значит, они постоянно нуждаются в пополнении. «Сок жизни» - так называл воду итальянский художник Леонардо да Винчи. И это правда, ведь вода нужна для питания растений. Что может произойти, если мы не будем поливать растения? А нужна ли вода человеку? (Без воды человек может прожить всего 3 дня, в то время как без пищи 30-50 дней. Человек на 65% состоит из воды.)
Слайд 20. Беседа по картинкам о роли воды. - Какую работу выполняет вода на каждой из этих картинок? 1) Вода «кормит»: по морям и океанам днем и ночью плывут рыболовецкие суда. 2) Вода «добывает» электрический ток, работает на электростанциях. 3) Вода моет людей, города, машины, дороги. 4) Вода – это самая большая и удобная дорога 5) Без воды нельзя замесить тесто для хлеба, приготовить бетон, сделать бумагу, ткань, резину, конфеты, лекарства. - Вот она какая, вода!
- Какая нужна всем вода? (Чистая) - От кого зависит, чистая или грязная вода будет на планете? (От человека) - Скажите, нужно ли беречь воду? - Скажите, зачем беречь воду, ведь её столько много? - Что человек должен делать, чтобы сохранить чистую воду? (Строить очистные сооружения, бережно относиться к окружающей нас природе, не допускать экологических катастроф)
Слайд 21,22 Если руки наши в ваксе, Если на нос сели кляксы, Кто тогда нам первый друг, Снимет грязь с лица и рук? Без чего не может мама Ни готовить, ни стирать, Без чего, мы скажем прямо, Человеку умирать? Чтобы лился дождик с неба, Чтоб росли колосья хлеба, Чтобы плыли корабли, Чтоб варились кисели, Чтобы не было беды – Жить нельзя нам без… воды! Слайд 23
Вода в природе – вещество самое главное. Есть такая арабская пословица: «Где вода иссякла, там страна приходит в упадок». Как вы её понимаете?
Слайд 24. 1-й чтец. Безбрежная ширь океана И тихая заводь пруда, Струя водопада и брызги фонтана – И всё это только вода. 2-й чтец. Высокие гребни вздымая, Бушует морская вода И топит, как будто играя, Большие морские суда. 3-й чтец. В кружево будут одеты Деревья, кусты, провода, И кажется сказкою это, А, в сущности – только вода. Вывод: Беречь воду это означает беречь жизнь, здоровье, красоту окружающего мира. Цифры о воде: 22 марта – всемирный день воды.
VI. Раздел «Закрепление». Блиц-турнир Где быстрее испаряется вода? (в лесу, в поле, в пустыне или в море) Куда направляется испарившаяся влага? Всегда ли вода жидкая?
Из книги рекордов Гиннеса А знаете ли вы, что … Самая крупная капля дождя выпала в Америке в 1953 году, ее размер равен 9 см. Самый сильный дождь шел целых 12 месяцев с 1 августа 1860 по 31 июля 1861 года. Самое глубокое озеро - Байкал. Его глубина 1 км 940м.
VII. Итог урока. Слайд 25 Что нового узнали? Что было интересного? Молодцы, ребята! Я вами очень довольна.
VIII. Домашнее задание. Слайд 26 С. 45-47, ответить на вопросы
collegy.ucoz.ru
Лабораторная работа «Определение качества питьевой воды и его гигиеническая оценка» Задания студенту:
Ознакомиться с методами лабораторного анализа воды.
Получив пробу воды, записать паспортные данные пробы.
Провести анализ исследуемой воды на определение ее органолептических (запах, вкус, прозрачность, цветность) и физико-химических (реакции воды, общей жесткости воды, содержания аммиака, нитритов, нитратов, хлоридов и окисляемости воды) свойств.
Составить заключение о пригодности использования воды для питьевых целей на основании сравнения полученных данных с гигиеническими нормативами.
Решить ситуационную задачу по оценке источника нецентрализованного хозяйственно-питьевого водоснабжения и качества воды в нем. Дать заключение о возможности использования его в качестве источника питьевого водоснабжения, предложить необходимые мероприятия для улучшения качества воды.
Методика работы
1. Определение органолептических свойств воды
Определение запаха и вкуса воды
Запах воды определяется при обычной температуре (20С) и при нагревании до 60С. Колбу емкостью 150-200 мл наполнить на ⅔ исследуемой водой. Накрыв ее часовым стеклом, интенсивно встряхнуть и затем, быстро открыв, определить запах воды по характеру (хлорный, землистый, гнилостный, болотный, нефтяной, аптечный, ароматический, неопределенный) и по интенсивности. Количественно запах оценивается по пятибалльной шкале (табл. 22). При определении запаха воды руки и одежда исследователя не должны иметь посторонних запахов (духов и проч.), воздух помещения должен быть чистым. При централизованной системе водоснабжения допускается запах воды, предназначенной для питья, не более 2-х баллов при 20С и 60С и не более 3-х баллов - при нецентрализованной (местной) системе водоснабжения. Специфические запахи, появляющиеся при хлорировании, не должны превышать 1 балл.
Вкус воды определяется только при уверенности, что она безопасна (отсутствуют ядовитые вещества и бактериальное загрязнение). Полость рта ополаскивается 10 мл исследуемой воды и, не проглатывая ее, определяют вкус(«солоноватый», «горький», «кислый», «сладкий»), привкус может быть «рыбный», «металлический», «неопределенный». Интенсивность привкуса также оценивается в баллах (табл.22).
Таблица 22
Шкала интенсивности запаха и привкуса питьевой воды
| Интенсивность запаха или привкуса | Описание интенсивности запаха | Баллы |
| Никакого | Запах или привкус не ощущается | 0 |
| Очень слабая | Запах или привкус ощущается только в лаборатории опытным аналитиком | 1 |
| Слабая | Запах или привкус ощущается, если обратить на него внимание | 2 |
| Заметная | Запах или привкус легко обнаруживается | 3 |
| Отчетливая | Запах или привкус обращает на себя внимание и делает воду неприятной для питья | 4 |
| Очень сильная | Запах или привкус настолько сильный, что делает воду непригодной для питья | 5 |
Определение прозрачности воды
Прозрачность воды зависит от количества механических взвешенных нерастворимых в воде частичек (мути), химических соединений (например, гидрата окиси железа) или присутствия микроорганизмов и фитопланктона.
Прозрачность воды определяется обычно по высоте столба воды, через которую можно прочитать текст, напечатанный стандартным шрифтом Снеллена. Высота столба воды, измеряемая в сантиметрах, указывает на степень ее прозрачности. Исследуемую воду взболтать и налить доверху в специальный градуированный стеклянный цилиндр высотой 30 см с плоским дном и выпускным краном у дна, на который надет резиновый наконечник с зажимом. Под цилиндр на высоте 4 см от его дна поместить шрифт Снеллена и попытаться различить буквы через столб воды в цилиндре. Если вода мутная и шрифт прочесть не удается, то с помощью зажима на резиновом наконечнике цилиндра нужно постепенно сливать воду в чашку Петри до тех пор, пока буквы шрифта станут различимыми. Отметить высоту столба воды в цилиндре, при которой возможно чтение шрифта Снеллена. Питьевая вода должна иметь прозрачность не ниже 30 см. При прозрачности 20-30 см высоты водного столба вода признается слабо мутной, 10-20 см – мутной, менее 10 см – очень мутной.
Степень прозрачности воды можно характеризовать также ее обратной величиной - мутностью. Количественно мутность определяется с помощью специального прибора - мутномера, в котором исследуемую воду нужно сравнить с эталонным раствором, приготовленным из инфузорной земли или каолина на дистиллированной воде. Мутность воды выражается в миллиграммах взвешенного вещества на 1 л воды.
Определение цветности воды
Цветность воды зависит от присутствия растворенных в воде химических веществ, имеющих цвет, либо от наличия в воде микроорганизмов. В соответствии с гигиеническими требованиями питьевая вода не должна иметь цветность и содержать различимых невооруженным глазом водных организмов и поверхностную пленку.
Определение цветности можно проводить с помощью фотоколориметра, но наиболее простым способом является визуальная оценка с помощью шкалы цветности, при этом цветность воды измеряется в условных градусах цветности. Шкала цветности представляет набор цилиндров объемом 100 мл, заполненных эталонным раствором окрашивающего вещества различного разведения. В качестве эталонных растворов используют хромово-кобальтовый раствор. Исходный хромово-кобальтовый эталонный раствор (0,0875 г двухромовокислого калия K2Cr2O7 и 2 г сернокислого кобальта CoSO4 на 1 л дистиллированной воды с добавлением 1 мл химически чистой серной кислоты h3SO4 удельного веса 1,84) имеет максимальную цветность - 500 цветности. Разведение исходного эталонного раствора бесцветным водным раствором h3SO4 в соотношениях, приведенных в таблице 23 дает шкалу цветности.
Таблица 23
studfiles.net
"Конспект урока познания мира по теме :"Вода.Свойства воды.Лабораторная работа."
-Поприветствуйте гостей, повернитесь к соседу по парте, улыбнитесь ему, пожелайте удачи на уроке
- Я вам всем желаю на уроке новых знаний, новых открытий.
-Вашему вниманию я предлагаю просмотреть видео и определить тему нашего урока.
Слайд 1
Тема: Вода. Свойства воды
-В парах обсудите2 мин.и ответьте на вопрос
- Что я знаю о воде?
Проверка задания
Все, кто отвечал. успешно справился с заданиями, возьмите по капельке воды за каждое задание.
-Как вы думаете, мы всё знаем о воде?
Сегодня нам предстоит расширить свои знания и узнать
Слайд 2:
1.Что же такое вода?
2.Открыть какими свойствами она обладает.
3.В каких состояниях бывает в природе.
-Сегодня наш урок пройдёт в форме исследовательской деятельности. Вы станете исследователями, а чтобы вам было легче справиться с заданиями, будете работать в группах.
Выясним, кто такие исследователи.
Ну а теперь при помощи экспериментов мы попробуем исследовать свойства воды.
Во время выполнения эксперимента не забываем в карточке отмечать свойства воды.
1)Проведите исследование
2)Обсудите в группе
3)Сформулируйте вывод
4)Подготовьтесь рассказать всему классу.
Проверка задания.
Слайд 3 по щелчку
Заслушивание групп.
Вода-растворитель.
-Все кто отвечали могут взять по капельке воды.
-Кто самостоятельно смог сделать вывод во время эксперимента взять капельку.
Сделайте вывод
Состояния воды
Каждой группе.
дается карточка с ситуацией. Прочитать ,обсудить, сделать вывод.
Слайд 4
Проверка задания
Кто самостоятельно смог ответить на вопрос может взять капельку.
Загадки.
-Распределить на группы в зависимости от состояния воды.
На дворе переполох:C неба сыплется горох. Съела шесть горошин Нина, У неё теперь ангина.
Град
Шумит он в поле и в саду, A в дом не попадёт.И никуда я не иду, Покуда он идёт.
Дождь
Он как алмаз:И твёрд, и чист,На солнышке сверкает,Но пригревать начнут лучи, 0н тут же тает.
Лёд
Молоко над рекой плыло,Ничего не видно было. Растворилось молоко – Стало видно далеко.
Туман
Он слетает белой стаейИ сверкает на лету.Он звездой прохладной тает На ладони и во рту.
Снег
Он без рук, он без ногИз земли пробиться смог Нас он летом, в самый зной Ледяной поит водой.
Родник
Пушистая вата Плывёт куда-то. Чем вата ниже, Тем дождик ближе
ОБЛАКА
Сделать вывод.
Слайд 5-7
-Кто может определить в каком состоянии вода- капелька
_-Как человек использует разные состояния воды?
Слайд 8-9
На ваших листах есть небольшой тест.
Выберите верные утверждения и выделите их цветом .
Проверьте.
Если у Вас получилось слово- тест выполнен правильно.
Слайд 10
Проверка по ключу.
ЗНАЧЕНИЕ
Слайд 11
- А вот какое значение воды для человека, животных это тема нашего следующего урока.
Слайд 12
5-6 капель –Молодцы, вы отлично поработали
4- капель- Вы хорошо поработали
Те, у кого меньшее кол-во капель, нужно внимательно прочитать материал дома
Дом. задание на выбор.(по уровню сложности)
На белой карточке
1.Ответить на вопросы.
1.перечислить свойства воздуха.
2.В каком состоянии в природе встречается вода?
Найти и записать пословицы и поговорки со словом вода.
На синей карточке..
Разгадай кроссворд
1 – вода постоянно совершает в природе.
2, 3, 4 – различные состояния воды.
5 – условие, при котором вода может менять своё состояние
На голубой карточке
Составить пятистишие на тему «Вода»
1.Вода
2.какая?(2 слова)
3.действия(3 слова)
4.фраза,выражение.
5.вывод(1 слово)
-Для чего нам нужно знать свойства воды и в каких состояниях бывает в природе вода?
Соедините капли в своей группе и пофантазируйте что у Вас может получится.
kopilkaurokov.ru
Лабораторная работа «Физические свойства и химический состав подземных вод»
СОДЕРЖАНИЕ
Стр.
| Введение | |
| 1 Основы гидрогеологии | |
| 1.1 Лабораторная работа «Состав и свойства подземных вод» | |
| 1.2 Лабораторная работа «Построение карт гидроизогипс. Определение направления фильтрационного потока» | |
| 1.3 Лабораторная работа «Определение параметров водоносных горизонтов по данным откачек из скважин. Расчеты водопритоков к скважинам и горным выработкам» | |
| 2 Основы инженерной геологии | |
| 2.1 Лабораторная работа «Определение водных свойств грунтов» | |
| 2.2 Лабораторная работа «Вычисление классификационных показателей грунтов» | |
| 3 Инженерно-геологическая карта. Построение инженерно-геологических разрезов. Оценка инженерно-геологических условий территории | |
| 3.1 Лабораторная работа «Построение геологической колонки буровой скважины» | |
| 3.2 Лабораторная работа «Построение инженерно-геологического разреза по данным буровых скважин» | |
| Список литературы | |
| Приложение А | |
| Приложение Б | |
| Приложение В | |
| Приложение Г | |
| Приложение Д |
ВВЕДЕНИЕ
Лабораторные занятия по курсу «Гидрогеология и инженерная геология» представляют собой весьма важную и сложную часть этого курса. Они имеют своей задачей ознакомить студентов специальности 050706 – «Геология и разведка месторождений полезных ископаемых» с условиями формирования химического состава подземных вод, основами расчетов, определяющих движение подземных вод в естественных условиях и при откачках воды из скважин. В методических указаниях изложены сведения об инженерно-геологических и гидрогеологических картах и разрезах. Даны основные приемы гидрогеологической и инженерно-геологической оценки территорий месторождений полезных ископаемых.
ОСНОВЫ ГИДРОГЕОЛОГИИ
Лабораторная работа «Физические свойства и химический состав подземных вод»
1.1.1 Теоретическая часть
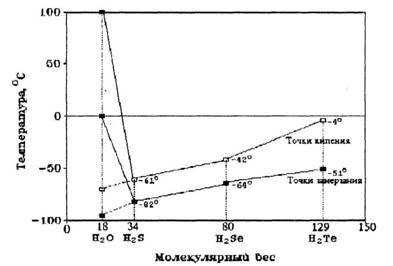
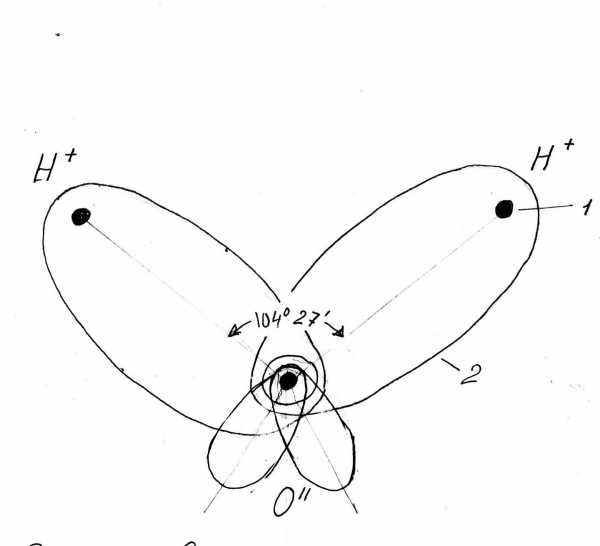
Свойства и химический состав подземных вод
Вода представляет собой химическое соединение водорода (11,11%) и кислорода (88,89%). Показателями физического состояния и свойств подземных вод служат: температура, прозрачность, цвет, запах, вкус, плотность, сжимаемость, вязкость, электропроводность, радиоактивность.
Состав подземных вод отражает историю геологического развития Земли, условия взаимодействия их с горными породами, органическим веществом, микроорганизмами газами, характер и интенсивность антропогенных воздействий на геологическую среду.
В природных водах в той или иной степени рассеяния присутствует более 60 из известных устойчивых элементов периодической системы Д.И. Менделеева. В состав подземных вод входят: ионы, недиссоциированные молекулы, коллоиды, органические вещества и микроорганизмы, нерастворенные взвешенные частицы, газы.
Среди ионов различают: макрокомпоненты, включающие элементы и комплексные соединения, составляющие основу подземных вод; микрокомпоненты, включающие элементы или соединения в количестве менее 10, редко 100 мг/л; ультрамикрокомпоненты (Rb, Au, Hg), содержание которых редко превышает 0,1 мг/л.
Макрокомпоненты (О, Ca, Mg, Na, K, Cl, S) составляют основную часть минерального состава природных вод. В пресных водах содержится свыше 90-95% макрокомпонентов, в высокоминерализованных более 99%. Микрокомпоненты (Li, B, F, Ti, V, Cr, Mn, Co, Ni, Cu, Zn, Ba) не определяют химический тип воды, однако оказывают значительное влияние на специфические особенности их состава.
Типизация и классификация подземных вод по химическому составу производится по макрокомпонентам. В одной из классификаций (О.А. Алехина) подземные воды разделены на классы, группы и типы в зависимости от преобладающих ионов и соотношений между главными ионами (Приложение В).
Воды первого типа – маломинерализованные, второго – мало- и среднеминерализованные (подземные воды, воды рек и озер), третьего типа – сильноминерализованные (воды океанов, морей, реликтовые воды), четвертого типа – кислые.
Из недиссоциированных соединений в подземных водах распространены SIO2, Fe2 O3, Al2O3, из газов – O2, h3S, CO2, h3, Ch5 и тяжелые углеводороды (этан, пропан, бутан).
Для выявления химического состава выполняют химические анализы подземных вод (полевые, сокращенные, полные и специальные). Выбор типа анализа определяется целевым назначением и требуемой точностью определений.
Сумма минеральных веществ, выделенных из воды при помощи химических анализов, определяет ее химическую минерализацию. Величину минерализации оценивают по сухому остатку, получаемому путем выпаривания и высушивания пробы воды или по сумме ионов, определенных химическим анализом. Общая минерализация подземных вод изменяется от нескольких десятков мг на литр до 650 г/л.
Содержание компонентов выражается в миллиграммах на литр и процентах, содержание обменного комплекса и жесткость воды - в миллиграмм-эквивалентахна литр. Принимая эквивалентное содержание суммы катионов и анионов за 100%, можно найти процентное содержание каждого иона.
При сопоставлении целого ряда анализов, выяснении генезиса вод удобно выражать анализы в виде предложенного Н.И. Толстихиным графика–квадрата, иногда комбинированного с треугольником Ферре (Приложение Г).
В практике производственных лабораторий для обозначения единичных химических анализов широко используются формулы М.Г. Курлова, И.Ю. Соколова.
Формула Курлова записывается в виде псевдодроби:
А; М рH; Т; Q,
где А - специфический элемент, содержащийся в воде, мг/л; М - общая минерализация, г/л; Т - температура воды, оС; Q - расход источника (дебит скважины), м3/сут.
Анионы и катионы выражают в процентах в убывающем порядке их содержания; ионы с содержанием менее 10 в формуле не учитываются.
Оценка качества воды для питьевых целей производится по ГОСТ 2874-82, определяющим пределы допустимых концентраций (ПДК) тех или иных компонентов в воде. В качестве предельно допустимой, принимается концентрация отдельных компонентов, которая полностью исключает вредное воздействие на организм человека.
Органические примеси установливаются по окисляемости - количество кислорода или марганциево-кислого калия, расходуемого на окисление этих примесей. В питьевой воде окисленность должна быть не более 10 мг/л.
О концентрации микроорганизмов судят по результатам анализов, определяющих количество бактерий в данном объеме жидкости. Общее количество бактерий в 1 см3 воды не должно превышать 100. Наиболее важный показатель бактериальной чистоты воды - коли-титр-количество воды, содержащее одну кишечную палочку.Для водоснабжения пригодна вода с коли-титром 300.
Жесткость воды
Жесткостью оценивается возможность использования воды для хозяйственно-питьевых целей. Она зависит от присутствия Ca2+ и Mg2+. Различают общую жесткость, связанную с содержанием в воде всех солей кальция и магния; карбонатную (временную), связанную с наличием бикарбонатов кальция и магния; постоянную, остающуюся после удаления бикарбонатов. Жесткость воды оценивают в мг экв/л Ca и Mg. 1 мг экв/л соответствует содержанию 20,04 мг/л Ca или 12,16 мг/ л Mg.Жесткость природных вод изменяется от нескольких до десятков сотен мг экв/л.
Щелочность воды
Наличие в воде гидратов натрия, карбонатов и бикарбонатов натрия определяет ее щелочность. Различают гидратную, карбонатную, бикарбонатную, фосфатную и силикатную щелочности.
Концентрация иона водорода (pH воды)
Концентрацией водородных ионов оценивается степень кислотности воды. При нейтральной реакции воды рН = 7, при кислой - меньше 7, при щелочной - больше 7. Для выражения концентрации водородных ионов принято пользоваться логарифмом концентрации их (т.е количества грамм эквивалентов этого иона в 1 л воды), взятым с обратным знаком :
pН= - lg(Н+)
Оценка агрессивных свойств воды
Агрессивной является вода, содержащая сверх допустимого количества сульфаты и агрессивную углекислоту. Разрушающее действие вода может оказывать на бетон в виде: кристаллизации в бетоне новых соединений с увеличением его объема или выщелачивания из бетона его составных частей, растворимых в воде. И то и другое приводит к разрушению бетона.
Сульфатная агрессия наблюдается при наличии в воде сульфатов SО42- свыше 250 мг/л и одновременном содержании иона Cl- свыше 1000 мг/л. При этом в бетоне образуется гипс с увеличением объема в 2-3 раза и сульфат-алюминат кальция – бетонная бациллас увеличением объема в 2,5 раза.
При углекислой агрессии происходит растворение и выщелачивание извести CaSO4, составляющей основу цемента.
Агрессивность выщелачивания – агрессия по временной (бикарбонатной) жесткости. Если содержание щелочи меньше 1,5 мг экв/л, происходит растворение и вымыв из бетона извести.
Общекислотная агрессия обусловлена низкими значениями водородного показателя рН (менее 7 при временной жесткости менее 8,6 мг экв/л и менее 6-7 при временной жесткости более 8,6 мг экв/л), вызывающее усиленное растворение извести.
Магнезиальная агрессия приводит к разрушению бетона при проникновении в него воды с содержанием Mg +2 ,более 1000 мг экв/л.
1.1.2 Задания для лабораторных работ
Задание 1
Химическим анализом установлена приведенная концентрация водородных ионов. Определите рН и наименование воды по его значению в соответствии с вариантом таблицы 1.
Таблица 1 - Исходные данные к заданию 1
| № варианта | ||||||||||
| Концентрация водородных ионов, г-моль/л | 10-5 | 10-6 | 10-8 | 10-10 | 10-3 | 10-2 | 10-3 | 10-6 | 10-9 | 10-8 |
| 10-7 | 10-9 | 10-4 | 10-5 | 10-6 | 10-7 | 10-9 | 10-5 | 10-4 | 10-2 | 10-9 |
Пример решения задачи для варианта № 0
Дано:
Н+ = 10-5г-моль/л
Найти: рН, наименование воды
Решение:
Для выражения концентрации водородных ионов принято пользоваться логарифмом концентрации их, взятым с обратным знаком pН= - lg (Н+), следовательно pН= - lg (10-5) = 5.
Для ответа используйте классификацию воды по значению водородного показателя (приложение А).
Вывод: по величине pH - вода кислая.
Задание 2
Используя результаты химического анализа подземной воды, приведенные в таблице 2, определите ее класс, группу и тип по классификации О.А. Алекина и номер воды по графику-квадрату Н.И. Толстихина.
Таблица 2 - Исходные данные к заданию 2
| № варианта | Содержание ионов, мг экв/л | |||||
| HCO3- | SO42- | Cl- | Na+ | Ca2+ | Mg2+ | |
| 5,79 | 2,62 | 4,74 | 10,74 | 0,40 | 2,14 | |
| 5,00 | 1,56 | 1,64 | 5,22 | 2,46 | 0,46 | |
| 6,32 | 10,42 | 1,86 | 3,67 | 12,29 | 2,60 | |
| 2,31 | 3,67 | 5,14 | 2,42 | 6,07 | 2,63 | |
| 2,87 | 0,12 | 0,39 | 0,26 | 2,30 | 0,82 | |
| 2,45 | 4,11 | 0,54 | 5,62 | 3,21 | 0,68 | |
| - | 3,43 | 60,69 | 52,94 | 1,23 | 5,10 | |
| 5,79 | 2,45 | 1,65 | 3,21 | 2,13 | 3,422 | |
| 2,62 | 6,51 | 6,24 | 2,13 | 4,12 | 3,54 | |
| 4,74 | 4,32 | 2,34 | 1.24 | 2,56 | 2,45 | |
| 15,25 | 4,32 | 3,12 | 5,22 | 0,87 | 0,98 | |
| 2,30 | 2,34 | 3,12 | 3,72 | 1,28 | 0,76 | |
| 2,86 | 5,24 | 0,96 | 2,34 | 2,69 | 1,25 | |
| - | 4,12 | 60,68 | 51,23 | 5,43 | 4,91 | |
| 6,33 | 1,26 | 1,23 | 0,34 | 5,23 | 2,13 | |
| 2,56 | 2,34 | 3,24 | 5,34 | 4,90 | 2,14 | |
| 5,46 | 3,42 | 6,45 | 3,56 | 5,01 | 1,24 | |
| 4,78 | 1,32 | 2,34 | 5,12 | 4,32 | 5,12 | |
| 3,65 | 1,53 | 5,43 | 3,21 | 1,09 | 2,34 | |
| 7,65 | 2,31 | 6,12 | 4,21 | 1,34 | 1,80 | |
| 2,55 | 3,12 | 2,67 | 1,23 | 2,09 | 1,09 |
Пример решения задачи для варианта № 0
Дано:
HCO3- = 5,79 мг экв/л;
SO42- = 2,62 мг экв/л;
Cl- = 4,74 мг экв/л;
Na+= 10,74 мг экв/л;
Ca2+ = 0,40 мг экв/л;
Mg2+ = 2,14 мг экв/л;
Найти: наименование воды по классификации О.А. Алекина и номер воды по графику-квадрату Н.И. Толстихина
Решение:
Выразите химический состав воды в % экв. Сумма катионов и анионов каждая в отдельности принимается равной 100%. Далее рассчитывается % экв каждого аниона и катиона.
Сумма анионов-13,15 мг экв/л – 100%, 5,79 мг экв/л HCO3- равен 5,79 ´ 100% и разделить на 13,15. Равно 44%. Данные заносят в таблицу 3.
Таблица 3 – Химический состав подземных вод
| Анионы | Содержание | Катионы | Содержание | ||||
| мг/л | мг-экв/л | %-экв | мг/л | мг-экв/л | %-экв | ||
| HCO3- | 5,79 | Na+ | 10,74 | ||||
| SO42- | 2,62 | Ca2+ | 0,40 | ||||
| Cl- | 4,74 | Mg2+ | 2,14 | ||||
| итого | 13,15 | итого | 13,28 |
Затем по приложениям В, Г определите наименование и номер.
Вывод: по классификации О.А. Алекина вода относится к классу - гидрокарбонатной, группе – натриевой, I типа (HCO3-> Ca2+ + Mg2+). По Н.И. Толстихину № 58.
Задание 3
Запишите приведенные ниже в таблице 4 результаты химического анализа подземной воды в виде формулы М.Г. Курлова. Определите вид жесткости и дайте наименование воды с учетом информации, полученной в результате химического анализа.
Таблица 4 - Исходные данные к заданию 3
| № варианта | Сухой остаток | рН | Температура,оС | Содержание ионов, мг/л | |||||
| HCO3- | SO42- | Cl- | Na+ | Ca2+ | Mg2+ | ||||
| 7,3 | |||||||||
| 8,3 | |||||||||
| 7,6 | |||||||||
| 8,4 | - | ||||||||
| 7,9 | |||||||||
| 7,0 | |||||||||
| 6,6 | |||||||||
| 3,1 | - | ||||||||
| 2,3 | |||||||||
| 4,5 | |||||||||
| 6,4 | |||||||||
| 7,5 | |||||||||
| 8,6 | |||||||||
| 9,7 | |||||||||
| 8,5 | |||||||||
| 7,6 | |||||||||
| 8,5 | - | ||||||||
| 4,5 | |||||||||
| 3,7 | |||||||||
| 8,4 | |||||||||
| 4,6 |
Пример решения задачи для варианта № 0
Дано:
М = 1000 мг/л;
рН= 7,3;
Т = 12 оС;
HCO3- = 930 мг/л;
SO42- = 76 мг/л;
Cl- = 24 мг/л;
Na+= 81,09 мг/л;
Ca2+ = 194 мг/л;
Mg2+ = 45 мг/л;
Найти: вид жесткости, написать формулу Курлова, наименование воды
Решение:
Теоретические суммы анионов и катионов, выраженные в мг-экв форме должны быть равны, поэтому для решения задачи необходимо пересчитать данные анализа из мг/л в мг-экв/л, используя пересчетные коэффициенты (приложение Б). Результаты вычислений записывают в таблицу 5 и суммируют содержание катионов и анионов. Далее выражают химический состав воды в % -экв форме.
Таблица 5 – Химический состав подземных вод
| Анионы | Содержание | Катионы | Содержание | ||||
| мг/л | мг-экв/л | %-экв | мг/л | мг-экв/л | %-экв | ||
| HCO3- | 15,25 | Na+ | 4,05 | ||||
| SO42- | 1,58 | Ca2+ | 9,68 | ||||
| Cl- | 0,68 | Mg2+ | 3,70 | ||||
| итого | 17,51 | итого | 17,43 |
Формула М.Г. Курлова представляет собой дробь (ложную), в числителе которой записывают анионный состав воды (в %-экв) в убывающем порядке, а в знаменателе- катионный. Запись ионов с содержанием менее 10 %-экв не производится. Перед дробью записывают содержание газов и специфических элементов, если они имеются в воде и общую минерализацию М в г/л, после дроби указывают температуру воды и дебит источника или скважины. Название воды записывают через черточку: сначала анионный, затем катионный составы.
В данном случае формула имеет вид:
М1,0 tº12, pH 7,3
Общую жесткость определяют как сумму катионов кальция и магния, выраженных в мг-экв/л: 9,68+3,70=13,38 мг-экв/л. По этому показателю вода классифицируется как очень жесткая (приложение А).
Учитывая общую минерализацию, химический состав, содержание ионов водорода (рН), температуру и вычисленную жесткость, окончательно дают воде наименование по приложению А.
Вывод: вода пресная, гидрокарбонатная кальциево-натриево-магниевая, холодная, щелочная, очень жесткая.
megalektsii.ru
Лабораторная работа №1 Изучение физических свойств жидкости.
Цель работы: освоение техники измерения плотности, теплового расширения, вязкости и поверхностного натяжения жидкостей.
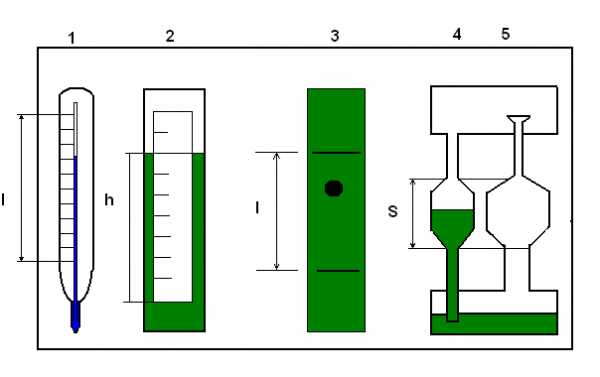
Схема устройства.
1 – термометр;
2 - ареометр;
3 – вискозиметр;
4 - капиллярный вискозиметр;
5 – сталагмометр.
Определение коэффициента теплового расширения жидкости.
Порядок выполнения работы:
1) Подсчитать общее число градусных делений 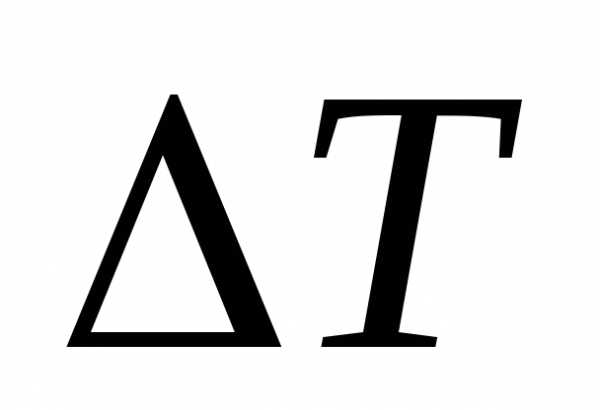 в шкале термометра измерить расстояниеl между крайними штрихами шкалы.
в шкале термометра измерить расстояниеl между крайними штрихами шкалы.
2) Вычислить приращение объема термометрической жидкости , гдеr- радиус капилляра термометра.
3) С учетом начального (при 00С) объема термометрической жидкости W - значение коэффициента теплового расширения и сравнить его со значением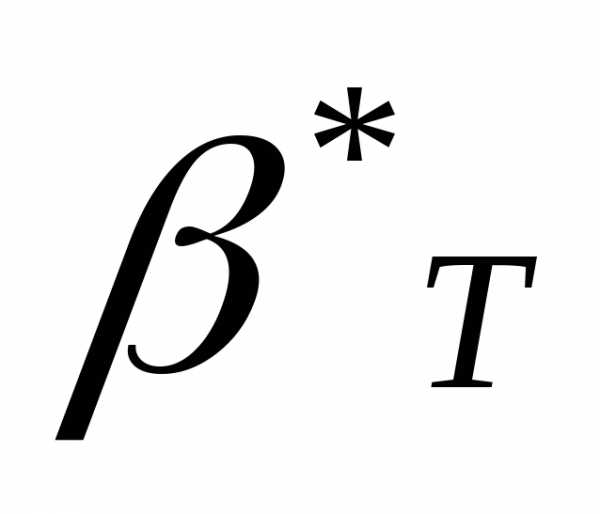 . Значение используемых величин занести в таблицу.
. Значение используемых величин занести в таблицу.
1) Число делений 52
2) r=0,01 см.
3)
| Жидкость |
|
|
|
|
|
| Вода пресная | 998 | 0,49 | 0,15 | 1,01 | 73 |
| Спирт этиловый | 790 | ,78 | 1,10 | 1,52 | 23 |
| Масло: | |||||
| Автол М-8В | 900 | 0,60 | 0,64 | 300 | 25 |
| Индустриальное 20 | 900 | 0,72 | 0,73 | 110 | 25 |
| Трансформаторное | 890850 | 0,60 | 0,70 | 30 | 25 |
| АМГ-10 | 0,76 | 0,83 | 20 | 25 |
Жидкость в термометре – автол.
| Вид жидкости | r ,см | W,см3 |
| L, см |
|
|
|
| Спирт | 0,01 | 0,0274 | 27,4.10-3 | 5 | 15,7*10-4 | 0,573 | 0,64 |
Измерение плотности жидкости ареометром. Порядок выполнения работы:
1) Измерить глубину погружения h ареометра по миллиметровой шкале на нем.
2) Вычислить плотность жидкости по формуле где т иd –масса и диаметр ареометра. Эта формула получена путем приравнивания силы тяжести ареометра G=mg и выталкивающей (архимедовой) силы PA=pgw , где объем погруженной части ареометра W= ( d2/4)h.
d2/4)h.
3) Сравнить опытные значения плотности р со справочным значением р* . Значение используемых величин свести в таблицу.
| Вид жидкости | m, г | d, см | h ,см |
|
|
| Вода | 5,5 | 1,1 | 6 | 0,9 | 0,998 |
Определение вескости вискозиметром Стокса. Порядок выполнения работы:
1) Повернуть устройство №1 в вертикальной плоскости на 1800 и зафиксировать секундомером время t прохождения шариком расстояния l между двумя метками в приборе 3. Шарик должен падать по оси емкости без соприкосновения со стенками. Опыт выполнить 3 раза, а затем определить среднеарифметическое значение времени t.
2) Вычислить опытное значение кинематического коэффициента вязкости жидкости , гдеg - ускорение свободного падения; d, D - диаметры шарика и цилиндрической емкости; p, pш - плотности жидкости и материала шарика;
3)Сравнить опытным путем значение коэффициента вязкости 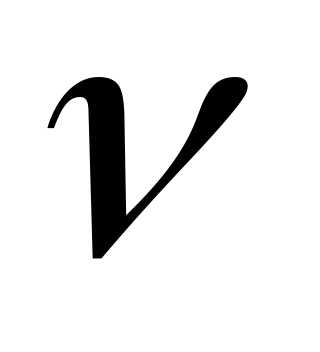 с табличным значением
с табличным значением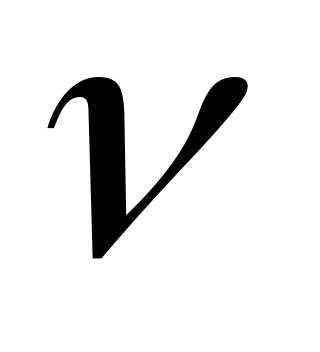 * . Значения используемых величин свести в таблицу.
* . Значения используемых величин свести в таблицу.
| Вид жидкости |
кг/м3 | t,с | l,м | d,м | D,м |
кг/м3 |
|
|
| М-8В | 900 | 17 | 0,07 | 0,008 | 0,02 | 982 | 300·10 | 300·10 |
studfiles.net

 кг/м3
кг/м3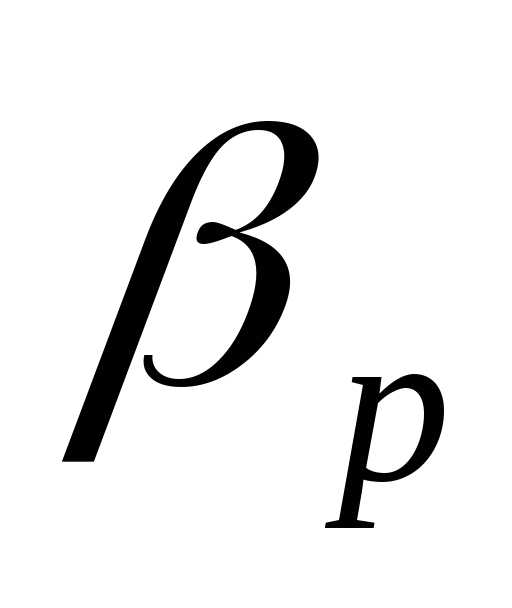 МПа-1
МПа-1 С-1
С-1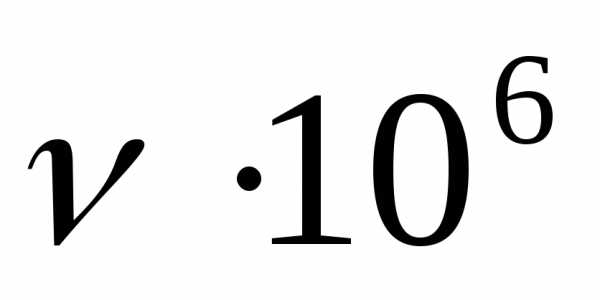 м2/с
м2/с Н/м
Н/м T, 0С
T, 0С W, см3
W, см3 , 0С-1
, 0С-1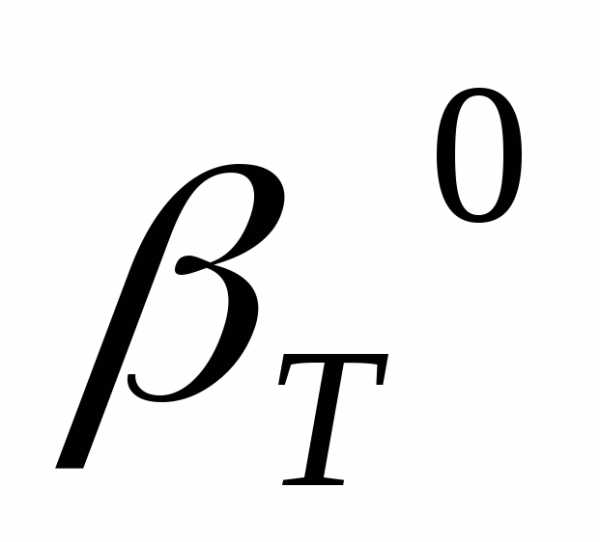 С-1
С-1 ,г/см3
,г/см3 ,г/см3
,г/см3 ,
, ш,
ш, ,м2/с
,м2/с *м2/с
*м2/с