Что такое бром? Химический элемент бром: формула, свойства. Бромная вода химические свойства
ее свойства и особенности :: SYL.ru
Бром - вещество, которое, как и ртуть, при комнатной температуре находится в жидком состоянии. Оно очень токсично, но широко используется в химической промышленности и лабораториях. Относится к группе галогенов, но более слабое, чем хлор. При прохождении через воду образует раствор под названием бромная вода.
Бром и приготовление бромной воды
Сам элемент - это красно-бурая жидкость с сильным, неприятным запахом. Дышать ею не стоит, так как можно отравиться, да и желание такое вряд ли у кого возникнет. Об этом свойстве говорит уже само название, ведь бром в переводе с древнегреческого означает "вонючка", "вонючий".

Молекула двухатомная, и ее формула - Br2. Сам элемент был найден в 1826 году и принес славу своему первооткрывателю - молодому преподавателю Антуану Балару. Распространен бром повсеместно, но больше всего его в морской воде и соленых озерах. Используется в производстве и лабораториях не само вещество, а его раствор, который легко приготовить.
Готовят раствор бромной воды только в вытяжном шкафу из-за ядовитости паров. Для этого берут бром в объеме один миллилитр и заливают в воду (дистиллированную, иначе получится много ненужных примесей) объемом 250 миллилитров, интенсивно мешая стеклянной палочкой. Бромная вода готова. Хранить ее нужно только в темном стекле, герметично закрыв. Будьте осторожны, так как, соприкасаясь с кожей, бром вызывает сильнейшие и болезненные ожоги. Если контакт произошел, срочно промойте пораженное место водой.
Состав бромной воды
Содержатся в этой жидкости не только молекулы брома (Br2), но и бромсодержащие кислоты HBrO и HBr. Именно присутствие первой (бромноватистая кислота) заставляет раствор хранить в темном стекле, так как на свету она разлагается, выделяя кислород.
Свойства химические и физические
По внешнему виду бромная вода - оранжево-желтая жидкость, взявшая от основного вещества его неприятный запах. Температура, при которой раствор замерзает, довольно низкая. Еще при -20°C она жидкая.

Как и все галогеновые растворы, вода бромная является отличным окислителем, но более слабым, чем раствор хлора. Окисляет она металлы и многие органические соединения, в том числе фенолы. А добавление в нее еще брома приводит к уменьшению pH.
Применение
Применяют бромную воду в промышленных лабораториях. Одной из качественных реакций на непредельные углеводороды является именно взаимодействие алкенов и алкинов с раствором бромной воды. В результате этого состав обесцвечивается. Разрывая двойные и тройные связи, бром присоединяется, образуя бромистые соединения.
Происходит обесцвечивание бромной воды и при реакции с непредельными маслами. В них также присутствуют двойные и тройные связи. Взаимодействие с бромной водой йодистого калия приводит к обесцвечиванию первого и постепенному выделению молекул свободного йода (I2). Можно провести с бромной водой качественную реакцию на присутствие CuCl, при добавлении небольшого количества аммиачного раствора произойдет покраснение.

В медицине бромную воду применяют при производстве препаратов. Раньше существовала легенда, что солдатам в пищу добавляют бром, чтобы снизить потенцию. Но оснований для этого утверждения нет никаких, так как вещества, содержащие бром, не оказывают на мужскую силу никакого влияния. Они просто действуют на нервную систему как успокаивающее и мягкое снотворное.
Но применяя лекарственные вещества, содержащие бром, следует быть весьма аккуратными, так как длительный прием может вызвать такую болезнь, как бромизм. Основные симптомы заболевания - общий упадок сил, сопровождающийся сыпью на коже и отсутствием аппетита. Для нормализации состояния нужно срочно вывести из организма активное вещество. Для этого прописывают большое количество жидкости и пищу с большим содержанием солей.
Применяется бромная вода и в строительстве - на разных этапах производства веществ, защищающих от пламени ткани, древесину, стройматериалы. Еще эти вещества называют антипиренами. Бромную воду и бромиды применяют в полетах, для окисления ракетного топлива, при добыче нефти, в сельском хозяйстве (производство пестицидов и инсектицидов).
www.syl.ru
История открытия:К открытию брома привели исследования французского химика А. Балара, который в 1825 году, действуя хлором на водный раствор, полученный после промывания золы морских водорослей, выделил темно-бурую дурно пахнущую жидкость. Эту жидкость он назвал муридом (от лат. muria -рассол) и послал сообщение о своем открытии в Парижскую академию наук. Комиссия назвала новый элемент бромом в связи с тем, что у брома тяжелый, неприятный запах паров (от греческого brwmoz - зловоние). Нахождение в природе, получение:Содержание брома в земной коре (1,6*l0-4% по массе) оценивается в 1015-1016 т. Бром - постоянный спутник хлора. Бромистые соли (NaBr, KBr, MgBr2) встречаются в отложениях хлористых солей (в поваренной соли до 0,03%, в калийных солях - сильвине и карналлите - до 0,3%), а также в морской воде (0,065%), рапе соляных озёр (до 0,2%) и подземных рассолах, обычно связанных с соляными и нефтяными месторождениями (до 0,1%). Исходным сырьём для промышленноого получения брома служат морская вода, озёрные и подземные, содержащие бром в виде бромид-иона. Бром выделяют при помощи хлора и отгоняют из раствора водяным паром или воздухом. Из получаемой бромовоздушной смеси бром улавливают химическими поглотителями. Для этого применяют растворы бромистого железа. Из полученных полупродуктов бром выделяют действием хлора или кислоты. Далее бром отделяют от воды и очищают от примеси хлора дистилляцией.В лабораториях также используют процессы, основанные на окислении бромидов:6KBr + K2Cr2O7 + 7h3SO4 = 3Br2 + Cr2(SO4)3 + 4K2SO4 + 7h3O Физические свойства:Бром - единственный неметалл, жидкий при комнатной температуре. Простое вещество представляет собой тяжелую красно-бурую жидкость с неприятным запахом (плотность при 20°C - 3,1 г/см3, температура кипения +59,82°C), пары брома имеют желто-бурый цвет. При температуре -7,25°C бром затвердевает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском. В воде бром растворим лучше других галогенов (3,58 г/100 г Н2О при 20°С) - "бромная вода". Значительно лучше растворим бром в органических растворителях, чем пользуются для извлечения его из водных растворов. Химические свойства:Бром является сильным окислителем, он непосредственно реагирует почти со всеми неметаллами (за исключением инертных газов, кислорода, азота и углерода) и многими металлами:2P + 3Br2 = 2PBr3; 2Al + 3Br2 = 2AlBr3В водной среде бром окисляет нитриты до нитратов, аммиак до азота, иодиды до свободного иода, серу и сульфиты до серной кислоты:2Nh4 + 6Br2 = N2+ 6HBr; 3Br2 + S + 4h3O = 6HBr + h3SO4При взаимодействии брома с растворами щелочей образуются соответствующие бромиды и гипобромиты (на холоду) или броматы:Br2 + 2NaOH = NaBr + NaBrO + h3O (при t 2 + 6NaOH = 5NaBr + NaBrO3 + 3h3O Для брома характерны соединения с нечетными степенями окисления: -1, +1, +3, +5, +7. Важнейшие соединения:Бромоводород HBr - ядовитый бесцветный газ с резким запахом, дымящий на воздухе из-за взаимодействия с парами воды. Хорошо растворим в воде: при 0° C в одном объеме воды растворяется 612 объемов бромоводорода. Раствор - сильная одноосновная бромоводородная кислота. Соли - бромиды бесцветные кристаллы, хорошо растворимые в воде (нерастворим AgBr, бледно-желтого цвета). Оксид брома(I) Br2O., газ коричневого цвета. Образуется при действии брома на HgO в CCl4. Свойства ...Бромноватистая кислота HBrO- сильный окислитель. Образуется при растворении брома в воде, под действием света разлагается на HBr и кислород; обладает слабыми кислотными свойствами, существует только в растворе. Соли - гипобромиты, KBrO, NaBrO - получены в свободном состоянии в виде кристаллогидратов. Все они очень неустойчивы, при нагревании (или подкислении растворов) распадаются на бромид и бромат: 3КВrO = 2KBr + KBrO3Бромиты, соли неизвестной даже в растворе бромистой кислоты HBrO2 - образуются при окислении гипобромитов бромом в щелочной среде: Ba(BrO)2 + 2Br2 + 4KOH = Ba(BrO2)2 + 4KBr + 2h3OБромноватая кислота, HBrO3 - концентрированный раствор представляет собой бесцветную сиропоообразную жидкость. Соли - броматы. Бромноватая кислота и броматы являются сильными окислителями: 2S + 2NaBrO3 = Na2SO4 + Br2+ SO2Бромная кислота HBrO4 существует в водных растворах с концентрацией, не превышающей 6 моль/л. Несмотря на то, что HBrO4 - самый сильный окислитель среди кислородных кислот брома, реакции с ее участием протекают очень медленно. Трехфторид брома, BrF3 - красная жидкость с т. кип. 126°C , образуется в результате прямой реакции брома с фтором. С водой и органическими веществами взаимодействует со взрывом. По отношению к неорганическим соединениям ведет себя как сильный фторирующий агент. Применение:Бром и его соединения широко применяются в основном органическом синтезе. Бромид серебра AgBr применяется в фотографии как светочувствительное вещество. Соединения брома используются для создания антипиренов - добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам. Пентафторид брома иногда используется как очень мощный окислитель ракетного топлива. 1,2-дибромэтан применяют как антидетонирующую добавку в моторном топливе. Растворы бромидов используются в нефтедобыче. В медицине бромид натрия и калия применяют как успокаивающие средства. Биологическая роль и токсичность:Бром в виде простого вещества ядовит. Жидкий бром вызывает трудно заживающие ожоги. Пары брома в концентрации 1 мг/м3 вызывают раздражение слизистых оболочек, кашель, головокружение и головную боль, а в более высокой (>60 мг/м3) - удушье и смерть. В организме человека бром, в виде бромид-ионов, участвует в регуляции деятельности щитовидной железы, так как является конкурентным ингибитором иода. Петрова М.А., Пухова М.С.ХФ ТюмГУ, 572 группа. Источники:Неорганическая химия: В 3 т./ Под ред. Ю.Д. Третьякова. Т.2/ - М.: "Академия", 2004.Энциклопедия "Кругосвет": http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/BROM.htmlСайт "WebElements": http://webelements.narod.ru/elements/Br.htm | |
| КонТрен – Химия для школьников, студентов, учителей ...подготовка к экзаменам и олимпиадам |
www.kontren.narod.ru
Химические свойства брома, уравнения реакций :: SYL.ru
Бром – это химически активный неметалл, относящийся к группе галогенов, которые являются энергичными окислителями. Он активно применяется в различных сферах, включая медицину, промышленность, производство оружия. Химические свойства брома многочисленны, и сейчас о них стоит вкратце рассказать.

Общая характеристика
Данное вещество при нормальных условиях представляет собой красно-бурую жидкость. Она едкая, тяжелая, имеет неприятный запах, который немного напоминает йодный. Жидкость ядовитая, но про токсичные свойства химического элемента брома будет рассказано чуть позже. Общие характеристики можно выделить в следующий перечень:
- Атомная масса составляет 79,901 … 79,907 г/моль.
- Электроотрицательность равна 2.96 по шкале Полинга.
- Электродный потенциал нулевой.
- Всего шесть степеней окислений – 0, -1, +1, +3, +5 и +7.
- Энергия ионизации составляет 1142,0 (11,84) кДж/моль.
- Плотность равна 3,102 (25 °C) г/см³ при нормальных условиях.
- Температура кипения и плавления составляет 58,6 °C и −7,25 °C соответственно.
- Удельная теплота испарения и плавления равна 29,56 и 10,57 кДж/моль.
- Показатели молярной теплоемкости и объема равны 75,69 Дж/(K•моль) и 23,5 см³/моль соответственно.
Интересно, что название этого элемента с древнегреческого переводится как «зловоние». И кто знает, как пахнут бромовые растворы, понимает, о чем речь. Запах у него действительно не из приятных.

Основные химические свойства
Данное вещество существует в виде 2-атомных молекул Br2. Если увеличить температуру до 800 °C, то станет заметна их диссоциация на атомы. Чем выше будут градусы, тем интенсивнее будет осуществляться данный процесс.
К основным химическим свойствам брома стоит отнести его способность растворяться в воде. Это, конечно, характерно для всех галогенов, но он лучше остальных взаимодействует с Н2О. Растворимость составляет 3,58 грамм на 100 миллилитров воды при температуре в 20 °C.
Получающийся в итоге этой реакции раствор именуют бромной водой. У нее есть целый ряд специфических особенностей.
Бромная вода
На свету она постепенно выделяет кислород. Это возникает из-за того, что бромноватистая кислота, входящая в состав данного раствора, начинает разлагаться. Жидкость, кстати, имеет характерный желто-оранжевый цвет.
Бромную воду используют для проведения реакции, которая в виде формулы выглядит так: Br2 + Н2О → HBr + HBrO. Как можно видеть, в результате образуются такие вещества, как бромоводородная и неустойчивая бромноватистая кислоты.
Раствор является очень мощным окислителем. Бромная вода способна воздействовать на такие металлы, как никель, кобальт, железо, марганец и хром. Еще ее применяют в химическом синтезе определенных препаратов органического происхождения и при анализах. Также бромная вода задействуется при идентификации алкенов. Когда она вступает с ними в реакцию, то обесцвечивается. Кстати, особенность бромной воды в том, что она не замерзает даже при -20 °С.
А готовят ее обычно так: в 250 миллилитров дистиллированной воды добавляют бром в количестве 1 мл, интенсивно при этом перемешивая компоненты. Процесс осуществляется в вытяжном шкафу. Хранят раствор в емкости, выполненной из стекла темного цвета.

Другие реакции брома
Важно оговориться, что этот активный неметалл во всех отношениях смешивается с большинством органических растворителей. Чаще всего вследствие данного процесса их молекулы бромируются.
По своей химической активности данный элемент находится между хлором и иодом. С этими веществами он тоже взаимодействует. Вот, например, реакция с раствором иодида, вследствие которой образуется свободный иод: Br2 + 2Kl → I2 + 2KBr. А при воздействии на бромиды хлора появляется свободный бром: Cl2 + 2KBr → Br2 + 2KCl.
Со многими другими веществами рассматриваемый элемент тоже взаимодействует за счет своих химических свойств. Реакция брома с серой дает S2Br2. При взаимодействии с фосфором появляются PBr3 и PBr5. Это все бинарные неорганические соединения. Кроме перечисленных элементов, неметалл также взаимодействует с селеном и теллуром.
Но вот с чем бром не реагирует непосредственно, так это с азотом и кислородом. Зато с галогенами взаимодействует. А его реакции с металлами дают бромиды - MgBr2, CuBr2, AlBr3 и т.д.
И, конечно, рассказывая про физические и химические свойства брома, нельзя не упомянуть, что существуют также вещества, являющиеся устойчивыми к его действию. Это платина и тантал, а еще в какой-то мере свинец, титан и серебро.

Двойные и тройные связи
С веществами, которым они свойственны, также способен взаимодействовать обсуждаемый элемент. И, рассказывая про химические свойства брома, уравнения реакций данного типа тоже стоит рассмотреть. Вот одно из таковых: С2Н4 + Br2 → C2h5BR2. Это взаимодействие с этиленом. Ему как раз и свойственна двойная связь.
Интересно, что когда бром смешивается с растворами щелочей, карбоната калия или натрия, то результатом становится образование соответствующих броматов и бромидов (солей). Вот уравнение, демонстрирующее это: 3Br2 + 3Na2CO3 → 5NaBr + NaBrO3 + 3СО2.
И да, перечисляя важнейшие химические свойства брома, нельзя не упомянуть, что в жидком состоянии он легко взаимодействует с золотом. Результатом становится образование трибромида (AuBr3). А реакция выглядит следующим образом: 2Au + 3Br2 → 2AuBr3.

Токсичность
Химические свойства брома обусловливают его опасность для человеческого организма. Даже если его концентрация в воздухе превышает отметку в 0,001 % по объему, то возникают головокружение, раздражение слизистых оболочек, кровотечение из носа, а иногда даже удушье и спазмы дыхательных путей.
Смертельная доза для человека составляет всего 14 мг/кг перорально. Если возникло отравление бромом, то нужно:
- Вызвать «Скорую».
- Вывести потерпевшего на свежий воздух.
- Расстегнуть сдавливающую одежду.
- Постараться успокоить его.
- Промыть кожу водой, если вещество попало на покровы. Протереть после этого спиртом.
- Дать пострадавшему молоко с добавлением небольшого количества соды. Она нейтрализует действие брома.
- Промыть желудок, если вещество попало в организм через рот. Давать пить воду, но маленькими порциями, рекомендуется предложить сорбенты для уменьшения степени всасываемости.
Бром действительно опасное вещество. Его даже используют в производстве боевых отравляющих припасов.
Работа с бромом
Поскольку химические свойства брома обусловливают его токсичность, то люди, которые вынуждены с ним контактировать, используют специальные перчатки, противогазы и спецодежду.
Хранят вещество в толстостенной таре из стекла. Ее, в свою очередь, хранят в емкостях с песком. Он помогает защитить тару от разрушения, которое может возникнуть из-за встряхивания.
Кстати, из-за очень высокой плотности вещества бутылки с ним нельзя брать за горло. Оно легко может оторваться. А последствия от разлитого токсичного брома, да еще в таком количестве, катастрофичны.

Применение
Напоследок пару слов о том, как и где используют бром. Можно выделить следующие сферы и области применения:
- Химия. Бром задействован в органическом синтезе, а его раствором определяют качество непредельных соединений.
- Промышленность. С добавлением брома делают антипирены, которые придают пожароустойчивость таким материалам, как текстиль, древесина и пластик. А еще из него раньше активно изготавливали 1.2-дибромэтан, который был главной составляющей этиловой жидкости.
- Фотография. Бромид серебра используется как светочувствительное вещество.
- Ракетное топливо. Пентафторид брома – его мощный окислитель.
- Нефтедобыча. В этой сфере используются бромидные растворы.
- Медицина. Бромиды калия и натрия используют в качестве успокаивающих средств.
Так что каким бы токсичным ни было это вещество для человеческого организма, в некоторых сферах оно незаменимо.
www.syl.ru
Краткая характеристика соединений брома и йода
Физические свойства
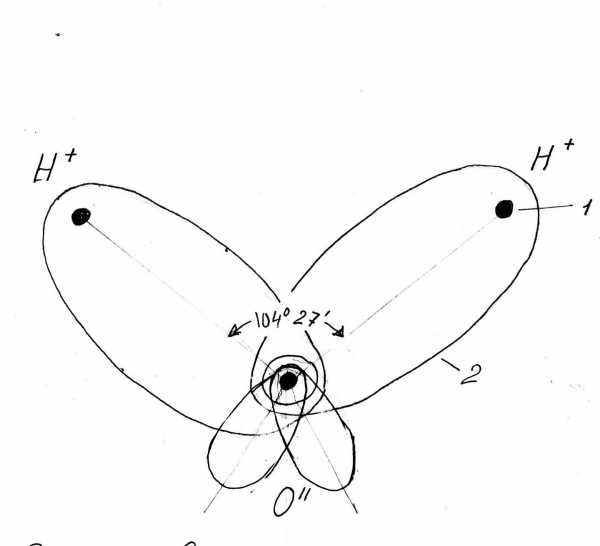
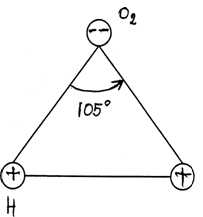
Вr2 при обычной температуре - буровато-коричневая тяжелая жидкость, образующая ядовитые пары красно-бурого цвета с резким запахом. Растворимость в воде брома выше, чем у хлора. Насыщенный раствор Вr2 в воде называют «бромной водой».
Свободный I2 при обычной температуре-черно-серое с фиолетовым оттенком твердое вещество, имеет заметный металлический блеск. Йод легко возгоняется, обладает своеобразным запахом (пары йода, как и брома, очень ядовиты). Растворимость I2 в воде наименьшая среди всех галогенов, но он хорошо растворяется в спирте и других органических растворителях.
Способы получения
1. Бром и йод извлекают из морской воды, подземных рассолов и буровых вод, где они содержатся в виде анионов Вr- и I-. Выделение свободных галогенов осуществляют с помощью различных окислителей, чаще всего пропускают газообразный хлор:
2NaI + Cl2 = I2 + 2NaCl
2NaBr + Cl2 = Br2+ 2NaCI
2. В лабораторных условиях для получения Br2 и I2 используют, например, следующие реакции:
2NaBr + МnO2 + 2h3SO4 = Br2↓ + MnSO4 + Na2SO4 + 2Н2O
бНВг + 2h3SO4 = 3Br2↓ + S↓ + 4Н2O
2HI + h3SO4 = I2↓ + SO2↑ + 2Н2O
Химические свойства
По химическим свойствам бром и йод сходны с хлором. Различия связаны, главным образом, с условиями протекания реакций. Отметим некоторые важные особенности химических реакций с участием Br2 и I2.
Бром - жидкость, в отличие от газообразного Cl2, поэтому концентрация молекул в нем выше. Этим объясняется более сильное окисляющее действие жидкого брома. Например, при соприкосновении с ним железа и алюминия происходит возгорание даже при обычной температуре.
Бромная вода имеет желто-бурую окраску, которая быстро исчезает, если растворенный Br2 прореагирует с каким-либо веществом. «Обесцвечивание бромной воды» - тест на присутствие в растворе целого ряда неорганических и органических веществ.
Газообразные и растворенные в воде SO2 и h3S, а также растворимые сульфиты и сульфиды обесцвечивают бромную воду:
Br2 + SO2 + 2Н2O = 2НВr + h3SO4
Br2 + Na2SO3 + Н2O = 2HBr + Na2SO4
Br2 + h3S = 2НВr + S↓
3Br2 + Na2S + ЗН2O = 6HBr + Na2SO3
Качественная реакция на непредельные органические соединения - обесцвечивание бромной воды:
R-CH=CH-R' + Br2 → R-CHBr-CHBr-R'
Фенол и анилин легко взаимодействуют с бромной водой, причем продукты реакций не растворяются в органических растворителях, поэтому образуют осадки:
С6Н5ОН + ЗBr2 → С6Н2Вг3ОН↓ + ЗНВr
С6Н5Nh3 + ЗВr2 → С6h3Br3Nh3↓ + ЗНВr
Анионы I- очень легко окисляются как сильными, так и слабыми окислителями:
2I--2e- → I2
Обнаружить выделяющийся I2 даже в малых количествах можно с помощью крахмального раствора, который приобретает характерную грязно-синюю окраску в присутствии I2. Иод-крахмальная реакция используется при проведении не только качественного анализа, но и количественного.
Атомы иода имеют более низкие значения энергии сродства к электрону и ЭО по сравнению с другими галогенами. С другой стороны, проявление некоторой металличности у йода объясняется существенным снижением энергии ионизации, благодаря чему его атомы гораздо легче отдают электроны. В реакциях с сильными окислителями йод ведет себя как восстановитель, например:
I2 + I0HNO3 = 2НIO3 + 10NO2 + 4Н2O
I2 + 5Н2O2 = 2НIO3 + 4Н2O
I2 + 5Cl2 + 6Н2O = 2НIO3 + 10HCl
Бромоводород и йодоводород
НВr и HI по физическим и химическим свойствам очень сходны с HCl, поэтому следует обратить внимание только на практически важные отличия, которые необходимо учитывать при получении этих веществ.
Молекулы НВr и HI менее устойчивы, чем HCl, поэтому синтез их из простых веществ затруднен вследствие обратимости реакции (особенно в случае HI).
Н2 + I2 → 2HI
HCI получают действием конц. h3SO4 на хлориды (например, твердый NaCl). Бромоводород и йодоводород таким образом не удается получить, поскольку они окисляются конц. h3SO4 до свободных галогенов:
2КВг + 2h3SO4 = Вr2↑ + SO2↑ + 2Н2O + K2SO4
6KI + 4h3SO4 = 3I2 + S + 4Н2O + 3K2SO4
1) из бромидов и йодидов
Необходимо вытеснять НВr и HI из их солей нелетучей неокисляющей ортофосфорной кислотой
КВг + h4PO4 = НВr↑ + КН2PO4
2) гидролиз галогенидов неметаллов
KI + h4PO4 = HI↑ + КН2PO4
3) восстановление свободных галогенов в водных растворах
РВr3 + ЗН2O = h4PO3 + ЗНВr↑
РI3 + ЗН2O = h4PO3 + 3HI↑
Br2 + SO2 + 2Н2O = 2НВr↑ + h3SO4
l2 + h3S = 2HI↑ + S↓
4Br2 + BaS + 4Н2O = 8HBr↑ + BaSO4
examchemistry.com
Что такое бром? Химический элемент бром: формула, свойства :: SYL.ru
Жидкость красно-бурого цвета, с резким специфическим запахом, плохо растворимая в воде, но растворяющаяся в бензоле, хлороформе, сероуглероде и других органических растворителях. Такой ответ можно дать на вопрос: "Что такое бром?" Соединение относится к группе наиболее активных неметаллов, реагируя со многими простыми веществами. Оно является сильно токсичным: вдыхание его паров раздражает дыхательные пути, а попадание на кожу вызывает тяжелые, длительно не заживающие ожоги. В нашей статье мы изучим его физические свойства, а также рассмотрим химические реакции, характерные для брома.

Что такое бром?
Главная подгруппа седьмой группы – место положения элемента в периодической системе химических элементов. На последнем энергетическом слое атома находится два s-электрона и пять p-электронов. Как и все галогены, бром имеет значительное сродство к электрону. Это значит, что он легко притягивает в свою электронную оболочку отрицательные частицы других химических элементов, становясь анионом. Молекулярная формула брома – Br2. Атомы соединяются между собой с помощью совместной пары электронов, такой тип связи называется ковалентной. Она также является неполярной, располагаясь на одинаковом расстоянии от ядер атомов. Ввиду достаточно большого радиуса атома – 1,14A°, окислительные свойства элемента, его электроотрицательность и неметаллические свойства становятся меньше, чем у фтора и хлора. Температура кипения, наоборот, повышается и составляет 59,2 °C, относительная молекулярная масса брома равна 180. В свободном состоянии из-за высокой активности элемент как простое вещество не встречается. В природе его можно обнаружить в связанном состоянии в виде солей натрия, магния, калия, особенно высоко их содержание в морской воде. Некоторые виды бурых и красных водорослей: саргассум, фукус, батрахоспермум, содержат большое количество брома и йода.

Реакции с простыми веществами
Для элемента характерно взаимодействие со многими неметаллами: серой, фосфором, водородом:
Br2 + h3 = 2HBr
Однако бром непосредственно не реагирует с азотом, углеродом и кислородом. Большинство металлов легко окисляются бромом. Пассивны к действию галогена лишь некоторые из них, например, свинец, серебро и платина. Реакции с бромом более активных галогенов, таких, как фтор и хлор, проходят быстро:
Br2 +3 F2 = 2 BrF3
В последней реакции степень окисления элемента равна +3, он выступает в роли восстановителя. В промышленности бром получают окислением бромоводорода более сильным галогеном, например, хлором. Основными источниками сырья для получения соединения служат подземные буровые воды, а также сильно концентрированный раствор соляных озер. Галоген может взаимодействовать со сложными веществами из класса средних солей. Так, при действии бромной воды, имеющей красно-бурую окраску, на раствор сульфита натрия, мы наблюдаем обесцвечивание раствора. Это происходит по причине окисления бромом средней соли – сульфита до сульфата натрия. Сам же галоген восстанавливается, переходя в вид бромоводорода, не имеющего цвета.

Взаимодействие с органическими соединениями
Молекулы Br2 способны к взаимодействию не только с простыми, но и со сложными веществами. Например, реакция замещения проходит между ароматическим углеводородом бензолом и бромом при нагревании, в присутствии катализатора – бромида трехвалентного железа. Она заканчивается образованием бесцветного соединения, не растворимого в воде – бромбензола:
C6H6 + Br2 = C6H5Br + HBr
Простое вещество бром, растворенное в воде, используется в качестве индикатора для определения наличия в молекуле органических веществ непредельных связей между атомами углерода. Такой качественной реакцией находят в молекулах алкенов или алкинов пи-связи, от которых зависят основные химические реакции указанных углеводородов. Соединение вступает в реакции замещения с предельными углеводородами, при этом образуя производные метана, этана и других алканов. Известна реакция присоединения частиц брома, формула которых Br2, к непредельным веществам с одной или двумя двойными, или с тройной связью в молекулах, например, к таким, как этен, ацетилен или бутадиен.
СН2=СН2 + Br2 = Ch3Br - Ch3Br
С указанными углеводородами может реагировать не только простое вещество, но и его водородное соединение – HBr.
Особенности взаимодействия галогена с фенолом
Органическое вещество, состоящее из бензольного ядра, связанного с гидроксильной группой, – это фенол. В его молекуле прослеживается взаимное влияние групп атомов друг на друга. Поэтому реакции замещения с галогенами у него протекают значительно быстрее, чем у бензола. Причем для процесса не требуется нагревание и присутствие катализатора. Сразу три атома водорода в молекуле фенола замещаются радикалами брома. В результате реакции образуется трибромфенол.

Кислородные соединения брома
Продолжим изучение вопроса, что такое бром. Взаимодействие галогена с холодной водой приводит к получению бромноватистой кислоты HBrO. Она является более слабой, чем соединение хлора, за счет снижения ее окислительных свойств. Еще одно соединение – бромноватая кислота, может быть получено путем окисления бромной воды хлором. Ранее в химии считали, что у брома не может быть соединений, в которых он мог бы проявлять степень окисления +7. Однако окислением бромноватого калия была получена соль – бромат калия, а из нее – и соответствующая кислота – HBrO4. Ионы галогенов имеют восстановительные свойства: при действии молекул HBr на металлы последние окисляются катионами водорода. Поэтому с кислотой взаимодействуют только те металлические элементы, которые стоят в ряду активности до водорода. В результате реакции образуются средние соли – бромиды, и выделяется свободный водород.
Применение соединений брома
Высокая окислительная способность брома, масса которого достаточно велика, широко используется в аналитической химии, а также в химии органического синтеза. В сельском хозяйстве препараты, содержащие бром, применяют в борьбе с сорняками и насекомыми – вредителями. Антипирены – вещества, предотвращающие самовозгорание, используют для пропитки строительных материалов, пластмассы, ткани. В медицине давно известно тормозящее действие солей: бромида калия и натрия - на прохождение биоэлектрических импульсов по нервным волокнам. Их применяют при лечении расстройств нервной системы: истерии, неврастении, эпилепсии. Учитывая сильную токсичность соединений, дозировка препарата должна контролироваться врачом.
В нашей статье мы выяснили, что такое бром, и какие физические и химические свойства для него характерны.
www.syl.ru
Минимальная и максимальная степень окисления брома. Химические свойства брома
Среди всех химических элементов-неметаллов есть особый ряд - галогены. Эти атомы получили свое название за особые свойства, которые они проявляют в химических взаимодействиях. К ним относятся:
- йод;
- хлор;
- бром;
- фтор.
Хлор и фтор - это ядовитые газы, обладающие сильной окислительной способностью. Йод при нормальных условиях представляет собой кристаллическое вещество темно-фиолетового цвета с выраженным металлическим блеском. Проявляет свойства восстановителя. А как выглядит четвертый галоген? Каковы свойства брома, образуемые им соединения и характеристики как элемента, и как простого вещества? Попробуем разобраться.

Бром: общая характеристика элемента
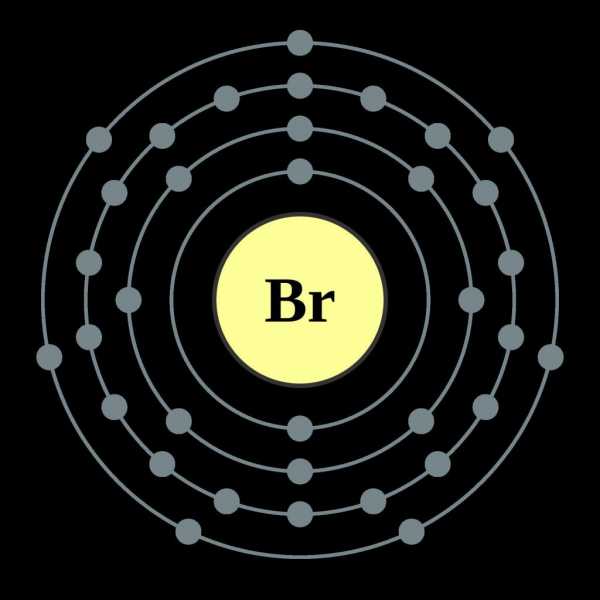
Как частица периодической системы, бром занимает ячейку под порядковым номером 35. Соответственно, в составе его ядра 35 протонов, а электронная оболочка вмещает такое же количество электронов. Конфигурация внешнего слоя: 4s2p5.
Располагается в VII группе, главной подгруппе, входит в состав галогенов - особой по свойствам группы химических элементов. Всего известно около 28 различных изотопных разновидностей данного атома. Массовые числа варьируются от 67 до 94. Устойчивых и стабильных, а также преобладающих по процентному содержанию в природе известно два:
- бром 79 - его 51%;
- бром 81 - его 49%.
Средняя атомная масса элемента равна 79,904 единицы. Степень окисления брома варьируется от -1 до +7. Проявляет сильные окислительные свойства, однако уступает в них хлору и фтору, превосходя йод.
История открытия
Открыт данный элемент был позже своих коллег по подгруппе. К тому моменту уже было известно о хлоре и йоде. Кто же совершил это открытие? Можно назвать сразу три имени, так как именно столько ученых практически одновременно сумели синтезировать новый элемент, оказавшийся впоследствии рассматриваемым атомом. Эти имена:
- Антуан Жером Балар.
- Карл Левиг.
- Юстус Либих.
Однако официальным "отцом" считается именно Балар, так как он первым не только получил и описал, но и отправил на научную конференцию химиков новое вещество, представляющее собой неизведанный элемент.
Антуан Балар занимался исследованием состава морской соли. Проводя над ней многочисленные химические опыты, он в один из дней пропускал через раствор хлор и увидел, что образуется какое-то желтое соединение. Приняв это за продукт взаимодействия хлора и йода в растворе, он стал дальше исследовать полученный продукт. Подверг следующим обработкам:
- воздействовал эфиром;
- вымочил в гидроксиде калия;
- обработал пиролюзитом;
- выдержал в сернокислой среде.
В результате он получил летучую буровато-красную жидкость с неприятным запахом. Это и был бром. Затем он провел тщательное исследование физических и химических характеристик этого вещества. После отправил доклад о нем, описал свойства брома. Название, которое Балар дал элементу, было мурид, однако оно не прижилось.
Сегодняшнее общепринятое имя этого атома бром, что в переводе с латыни означает "вонючий", "зловонный". Это вполне подтверждается свойствами его простого вещества. Год открытия элемента - 1825.

Возможные степени окисления брома
Таковых можно назвать несколько. Ведь, благодаря своей электронной конфигурации, бром может проявлять как окислительные, так и восстановительные свойства, с явным преобладанием первых. Всего можно выделить пять возможных вариантов:
- -1 - низшая степень окисления брома;
- +1;
- +2;
- +3;
- +5;
- +7.
В природе встречаются только те соединения, в составе которых элемент в отрицательном значении. +7 - максимальная степень окисления брома. Ее он проявляет в составе бромной кислоты HBrO4 и ее солей броматов (NaBrO4). Вообще данная степень окисления брома встречается крайне редко, так же как и +2. А вот соединения с -1; +3 и +5 - очень распространенные и имеют значение не только в химической промышленности, но и в медицине, технике и других отраслях хозяйства.
Бром как простое вещество
При обычных условиях рассматриваемый элемент представляет собой двухатомную молекулу, однако является не газом, а жидкостью. Очень ядовитой, дымящей на воздухе и издающей крайне неприятный запах. Даже пары в низкой концентрации способны вызывать ожоги на коже и раздражение слизистых оболочек тела. Если же превысить допустимую норму, то возможно удушье и смерть.
Химическая формула данной жидкости - Br2. Очевидно, что символ образован от греческого названия элемента - bromos. Связь между атомами одинарная, ковалентная неполярная. Радиус атома относительно большой, поэтому бром вступает в реакции достаточно легко. Это позволяет широко использовать его в химических синтезах, часто как реактив на качественное определение органических соединений.
В виде простого вещества в природе не встречается, так как легко улетучивается в виде красновато-бурого дыма, обладающего разъедающим действием. Только в форме различных многокомпонентных систем. Степень окисления брома в соединениях различного рода зависит от того, с каким именно элементом идет реакция, то есть с каким веществом.

Физические свойства
Данные характеристики можно выразить несколькими пунктами.
- Растворимость в воде - средняя, но лучше, чем у других галогенов. Насыщенный раствор называют бромной водой, она имеет красновато-бурый цвет.
- Температура кипения жидкости - +59,2 0С.
- Температура плавления -7,25 0С.
- Запах - резкий, неприятный, удушливый.
- Цвет - красновато-бурый.
- Агрегатное состояние простого вещества - тяжелая (с высокой плотностью), густая жидкость.
- Электроотрицательность по шкале Поллинга - 2,8.
Данные характеристики сказываются на способах получения данного соединения, а так же налагают обязательства для соблюдения крайней осторожности при работе с ним.
Химические свойства брома
С точки зрения химии, бром ведет себя двояко. Проявляет и окислительные, и восстановительные свойства. Как и все другие элементы, принимать электроны он способен от металлов и менее электроотрицательных неметаллов. Восстановителем же он является с сильными окислителями, такими как:
- кислород;
- фтор;
- хлор;
- некоторые кислоты.
Естественно, что и степень окисления брома при этом варьируется от -1 до +7. С чем же конкретно способен вступать в реакции рассматриваемый элемент?
- С водой - в результате образуется смесь кислот (бромоводородная и бромноватистая).
- С различными йодидами, так как бром способен вытеснять йод из его солей.
- Со всеми неметаллами напрямую, кроме кислорода, углерода, азота и благородных газов.
- Почти со всеми металлами как сильный окислитель. Со многими веществами даже с воспламенением.
- В реакциях ОВР бром часто содействует окислению соединений. Например, сера и сульфиты превращаются в сульфат-ионы, йодиды в йод, как простое вещество.
- С щелочами с образованием бромидов, броматов или гипоброматов.
Особое значение имеют химические свойства брома, когда он входит в состав кислот и солей, им образованных. В этом виде очень сильны его свойства, как окислителя. Гораздо ярче выражены, чем у простого вещества.

Получение
То, что рассматриваемое нами вещество важное и значимое с точки зрения химии, подтверждает факт его ежегодной добычи в количестве 550 тысяч тонн. Страны-лидеры по этим показателям:
- США.
- Китай.
- Израиль.
Промышленный способ добычи свободного брома основан на обработке соляных растворов озер, скважин, морей. Из них выделяется соль нужного элемента, которая переводится в подкисленную форму. Ее пропускают через мощный поток воздуха или водяного пара. Таким образом, формируется газообразный бром. Затем обрабатывают его кальцинированной содой и получают смесь натриевых солей - бромидов и броматов. Их растворы подкисляют и на выходе имеют свободное жидкое вещество.
Лабораторные способы синтеза основаны на вытеснении брома из его солей хлором, как более сильным галогеном.
Нахождение в природе
В чистом виде рассматриваемое нами вещество в природе не встречается, так как это дымящая на воздухе легколетучая жидкость. В основном входит в состав соединений, в которых проявляется минимальная степень окисления брома -1. Это соли бромоводородной кислоты - бромиды. Очень много этого элемента сопровождает природные соли хлора - сильвины, карналлиты и прочие.
Минералы самого брома были открыты позже, чем он сам. Самых распространенных из них три:
- эмболит - смесь хлора и брома с серебром;
- бромаргинит;
- бромсильвинит - смесь калия, магния и брома со связанной водой (кристаллогидрат).
Также данный элемент входит обязательно в состав живых организмов. Его недостаток приводит к возникновению различных заболеваний нервной системы, расстройств, нарушению сна и ухудшению памяти. В более худших случаях грозит бесплодием. Рыбы, морские обитатели способны накапливать бром в значительных количествах в виде солей.
В земной коре массовое содержание его достигает 0,0021%. Много содержит морская вода и в целом гидросфера Земли.

Соединения брома с низшей степенью окисления
Какая степень окисления у брома в его соединениях с металлами и водородом? Самая низшая, которая возможна для данного элемента - минус один. Именно эти соединения и представляют самый большой практический интерес для человека.
- HBr - бромоводород (газ), или бромоводородная кислота. В газообразном агрегатном состоянии не имеет цвета, однако очень резко и неприятно пахнет, сильно дымит. Обладает разъедающим действием на слизистые оболочки тела. Хорошо растворяется в воде, формируя кислоту. Она, в свою очередь, относится к сильным электролитам, является хорошим восстановителем. Легко переходит в свободный бром при действии серной, азотной кислот и кислорода. Промышленное значение имеет как источник бромид-иона для образования солей с катионами металлов.
- Бромиды - соли вышеуказанной кислоты, в которых степень окисления брома так же равна -1. Практический интерес представляют: LiBr и KBr.
- Соединения органической природы, содержащие бромид-ион.
Соединения с высшей степенью окисления
К таковым относится несколько основных веществ. Степень окисления высшая брома равна +7, значит в этих соединениях он как раз ее и должен проявлять.
- Бромная кислота - HBrO4. Самая сильная из всех известных для данного элемента кислот, однако при этом и самая устойчивая к атакам сильных восстановителей. Это объясняется особым геометрическим строением молекулы, которая в пространстве имеет форму тетраэдра.
- Перброматы - соли выше обозначенной кислоты. Для них так же характерна максимальная степень окисления брома. Они являются сильными окислителями, благодаря чему и находят применение в химической промышленности. Примеры: NaBrO4, KBrO4.

Применение брома и его соединений
Можно обозначить несколько областей, в которых бром и его соединения находят непосредственное применение.
- Производство красителей.
- Для изготовления фотоматериалов.
- В качестве лекарственных средств в медицине (соли брома).
- В автомобильной промышленности, а именно как добавка в бензины.
- Используют как пропитку для понижения уровня воспламеняемости некоторых органических материалов.
- При изготовлении буровых растворов.
- В сельском хозяйстве при изготовлении защитных от насекомых опрыскивателей.
- В качестве дезинфектора и обеззараживателя, в том числе, для воды.
Биологическое действие на организм
Как избыток, так и недостаток брома в организме имеют весьма неприятные последствия.

Еще Павлов первым определил влияние этого элемента на живых существ. Опыты на животных доказали, что длительное недополучение ионов брома приводит к:
- нарушению работы нервной системы;
- расстройству половой функции;
- выкидышам и бесплодию;
- уменьшению роста;
- снижению уровня гемоглобина;
- бессоннице и так далее.
Избыточное накапливание в органах и тканях приводит к подавлению работы головного и спинного мозга, различным наружным заболеваниям кожи.
fb.ru
Мир химии: Всё о броме.
 Бром был последним из галогенов, который был открыт химиками. Это событие произошло осенью 1885 года в одной из лабораторий Гейдельберского университета , которой руководил профессор Л.Гмелин. Один из студентов принес своему учителю колбу, в которой находилась какая-то жидкость бурого цвета. Этим студентом был К.Левиг, который рассказал профессору, что изучал состав одной из минеральных вод, и что он пропустил через воду хлор и раствор приобрел бурую окраску. Это вещество он выделил из раствора с использованием эфира. Это и был бром. Л.Гмелин заинтересовался работами студента и попросил его приготовить побольше данного вещества, чтобы детально изучить его свойства. Для этой работы требовалось длительное время, а у молодого студента его как раз и не было. Пока К.Левиг получал новые порции брома, в одном из научных химических журналов была опубликована статья, автором которой являлся А.Балар, который работал препаратором в в одной из фармацевтических школ во французском городке Монпелье. Он в статье писал, что изучая с 1824 года болотную растительность, проводил различные эксперименты. И ему удалось получить вещество бурого цвета. Также он исследовал золу, полученную из морских водорослей. Когда он на золу действовал хлорной водой, то раствор разделялся на два слоя, верхний приобретал бурую окраску, а нижний -синий. Он предположил что внизу находится иод, который давал с крахмалом типичную окраску. А вот что же находилось в верхнем слое? Он думал, что образовалось соединение хлора и иода, но выделить его не удалось.Он выдвинул гипотезу, что это есть новый неизвестный химический элемент.
Бром был последним из галогенов, который был открыт химиками. Это событие произошло осенью 1885 года в одной из лабораторий Гейдельберского университета , которой руководил профессор Л.Гмелин. Один из студентов принес своему учителю колбу, в которой находилась какая-то жидкость бурого цвета. Этим студентом был К.Левиг, который рассказал профессору, что изучал состав одной из минеральных вод, и что он пропустил через воду хлор и раствор приобрел бурую окраску. Это вещество он выделил из раствора с использованием эфира. Это и был бром. Л.Гмелин заинтересовался работами студента и попросил его приготовить побольше данного вещества, чтобы детально изучить его свойства. Для этой работы требовалось длительное время, а у молодого студента его как раз и не было. Пока К.Левиг получал новые порции брома, в одном из научных химических журналов была опубликована статья, автором которой являлся А.Балар, который работал препаратором в в одной из фармацевтических школ во французском городке Монпелье. Он в статье писал, что изучая с 1824 года болотную растительность, проводил различные эксперименты. И ему удалось получить вещество бурого цвета. Также он исследовал золу, полученную из морских водорослей. Когда он на золу действовал хлорной водой, то раствор разделялся на два слоя, верхний приобретал бурую окраску, а нижний -синий. Он предположил что внизу находится иод, который давал с крахмалом типичную окраску. А вот что же находилось в верхнем слое? Он думал, что образовалось соединение хлора и иода, но выделить его не удалось.Он выдвинул гипотезу, что это есть новый неизвестный химический элемент. А.Балар выделил жидкость красно-бурого цвета, точно такую же, как и К. Левиг. Балар решил назвать его мурид, что в переводе с латинского значит "рассол". Друзья посоветовали ему отправить статью, точнее, отчет в Парижскую академию наук. Отчет был назван «Мемуар об особом веществе, содержащемся в морской воде». В работе было вынесено предположение, что это вещество похоже на галогены хлор и иод. В академии была создана специальная комиссия, которая проверила на самом ли деле получен новый химический элемент. Члены комиссии подтвердили , что это так и есть на самом деле. Но только они предложили назвать данный химический элемент "бром", что в переводе означает зловонный, из-за неприятного запаха жидкости.
БРОМ (Bromum, Br) – элемент 17 (VIIa) группы периодической системы, атомный номер 35, относительная атомная масса 79,904. Природный бром состоит из двух стабильных изотопов: 79Br (50,69 ат.%) и 81Br (49,31 ат.%), а всего известно 28 изотопов с массовыми числами от 67 до 94. В химических соединениях бром проявляет степени окисления от –1 до +7, в природе встречается исключительно в степени окисления –1.
История открытия.
Вплотную к открытию брома практически одновременно подошли сразу трое ученых, но официально признанным первооткрывателем суждено было стать только одному из них.В 1825 молодой французский химик Антуан Жером Балар (Antoine-Jérôme Balard), работавший препаратором в Фармакологической школе при университете небольшого южного городка Монпелье, приступил к своим первым самостоятельным научным исследованиям. С древнейших времен Монпелье был знаменит своими соляными промыслами. Для добычи соли на берегу моря вырывали бассейны и заполняли их морской водой. После того, как под действием солнечных лучей вода испарялась, выпавшие кристаллы соли вычерпывали, а оставшийся маточный раствор (рапу) возвращали обратно в море.
Руководитель Балара, профессор Жозеф Англада (Joseph Anglada), поручил ему изучить химический состав сливаемого рассола и прибрежных морских водорослей. Действуя на рапу различными реактивами, Болар заметил, что при пропускании через нее хлора раствор приобретает интенсивный желтый цвет. Аналогично окрашивал хлор и щелочной экстракт золы водорослей. Вначале Балар предположил, что наблюдаемая окраска вызвана присутствием в исследуемых образцах иода, который, реагируя с хлором, и образует неизвестное вещество. Для начала он экстрагировал его последовательно эфиром и водным гидроксидом калия. Обработав полученный щелочной раствор пиролюзитом (MnO2) в сернокислой среде, Балар выделил неприятно пахнущую красно-бурую жидкость и попробовал разделить ее на составные части. Когда все попытки не принесли результата, стало ясно, что это новый элемент. Определив плотность и температуру кипения жидкости, а также изучив ее важнейшие химические свойства, 30 ноября 1825 Балар отправил доклад о своих опытах в Парижскую академию наук. В нем, в частности, для нового элемента было предложено название «мурид» (от латинского слова «muria» – рассол).
Для проверки сообщения была назначена комиссия из трех химиков: Луи Вокелена (Louis Nicolas Vauquelin), Луи Тенара (Louis Jacques Thénard) и Жозефа Гей-Люссака. Повторив описанные эксперименты, они подтвердили выводы Балара, но название «мурид» признали неудачным, т.к. что соляная кислота называлась тогда acidum muriaticum – муриевой (от гипотетического элемента мурия), а ее соли – муриатами и употребление столь похожих названий «мурид» и «мурий» могло вызвать недоразумения. Согласно рекомендации номенклатурного комитета при академии наук новый элемент было предложено назвать бромом от греческого brwmoV – зловонный. В России название «бром» утвердилось не сразу, в течение долгого времени для элемента № 35 использовались названия «вром», «мурид», и «вромид».Позднее выяснилось, что впервые элементарный бром получил не Балар а студент известного немецкого химика Леопольда Гмелина Карл Левиг (Carl Jacob Löwig, Leopold Gmelin), который в 1825 в Гейдельбергском университете выделил его из воды источника в Крейцнахе. Пока он приготовлял большее количество препарата для исследования, появилось сообщение Балара.
Вплотную к открытию брома подошел и знаменитый немецкий химик Юстус Любих, точно так же, как и Балар, принявший его за соединение хлора и иода.
Можно сказать, что открытие брома лежало на поверхности, и французский химик Шарль Жерар (Charles Frédéric Gerhardt) сказал даже, что «Не Балар открыл бром, а бром открыл Балара».
В природе бром почти всегда встречается вместе с хлором в виде изоморфной примеси в природных хлоридах (до 3% в сильвине KCl и карналлите KCl·MgCl2·6h3O). Собственные минералы брома: бромаргирит AgBr, бромсильвинит KMgBr3·6h3O и эмболит Ag(Br, Cl) – встречаются редко и промышленного значения не имеют. Они были открыты гораздо позже элементарного брома (бромаргирит – в Мексике, в 1841). Кларк (среднее содержание в земной коре) брома в земной коре составляет 2,1·10–4%.
Большое количество брома содержится в гидросфере Земли (около 3/4 от имеющегося в земной коре): в океанах (6,6·10–3%), соляных озерах, подземных рассолах и грунтовых водах. Наибольшая концентрация растворенных бромидов – около 6 мг/л – отмечена в воде Мертвого моря, а общее количество брома в нем оценивается в 1 млрд. тонн. Вместе с брызгами соленой воды соединения брома попадают в атмосферу.
Бром есть и в живых организмах. Содержание брома в живой фитомассе составляет 1,6·10–4%. В человеческом теле средняя концентрация брома составляет около 3,7 мг/кг, большая часть его сосредоточена в мозге, печени, крови и почках. Среди неорганических анионов, входящих в состав крови бромид-ион занимает пятое место по количеству после хлорида, гидрокарбоната, фосфата и сульфата; его концентрация в плазме крови находится в пределах 20–150 мкмоль/л. Некоторые животные, грибы и растения (прежде всего бобовые), способны накапливать бром, особенно много его в морских рыбах и водорослях.
Получение брома.
Промышленное производство брома началось в 1865 на базе Страссфуртского соляного месторождения в Германии, двумя годами позже бром стали добывать в США, в штате Вирджиния. В 1924 на борту судна «Этила» была продемонстрирована возможность добычи брома из морской воды, а в 1934 организовано промышленное производство, основанное на этом методе. В России первый бромный завод был построен в 1917 на соляном озере Сакское.Все промышленные способы получения брома из соляных растворов основаны на его вытеснении хлором из бромидов:
MgBr2 + Cl2 = MgCl2 + Br2
При получении брома методом выдувания исходное сырье (рапу соляных озер, попутные воды нефтяных скважин, морскую воду) подкисляют серной кислотой до pH»3,5 и обрабатывают избыточным количеством хлора. Затем рассол, содержащий растворенный бром, подают в верхнюю часть колонны, заполненной небольшими керамическими кольцами. Раствор стекает по кольцам, а навстречу ему продувают мощную струю воздуха, при этом бром переходит в газовую фазу. Бромовоздушную смесь пропускают через раствор карбоната натрия:
3Na2CO3 + 3Br2 = 5NaBr + NaBrO3 + 3CO2Для выделения брома из полученной смеси бромида и бромата натрия, ее подкисляют серной кислотой:
5NaBr + NaBrO3 + 3h3SO4 = 3Na2SO4 + 3Br2 + 3h3O
Если содержание бромидов в исходном сырье достаточно велико, то вместо воздуха экономически выгоднее использовать водяной пар.
Другие предложенные способы извлечения брома из хлорированного рассола: экстракция углеводородами или адсорбция ионообменными смолами – не получили широкого распространения.
Часть используемых в промышленности растворов бромидов (в США до 35%) отправляют на повторную переработку с целью получения дополнительных количеств брома.
Мировое производство брома (по данным на 2003) составило около 550 тыс. тонн в год, большая часть его производится в США (39,4%), Израиле (37,6%), и Китае (7,7%).
В лаборатории бром можно получить взаимодействием бромидов с подходящим окислителем, например перманганатом калия или диоксидом марганца, в кислой среде.
MnO2 + 2h3SO4 + 2NaBr = Br2 + MnSO4 + Na2SO4
Выделившийся бром отделяют экстракцией неполярными растворителями или перегонкой с водяным паром.
Простое вещество.
Бром – единственный неметалл, жидкий при комнатной температуре. Элементный бром представляет собой тяжелую красно-бурую жидкость с неприятным запахом (плотность при 20° C – 3,1 г/см3, температура кипения +59,82° C), пары брома имеют желто-бурый цвет. При температуре –7,25° C бром затвердевает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском.В твердом, жидком и газообразном состоянии бром существует в виде двухатомных молекул Br2, заметная диссоциация на атомы начинается только при 800° C, диссоциация происходит и под действием света. Элементный бром является сильным окислителем, он непосредственно реагирует почти со всеми неметаллами (за исключением инертных газов, кислорода, азота и углерода) и многими металлами, эти реакции зачастую сопровождаются воспламенением (например, с фосфором, сурьмой, оловом):2S + Br2 = S2Br2
2P + 3Br2 = 2PBr3; PBr3 + Br2 = 2PBr5
2Al + 3Br2 = 2AlBr3
Ni + Br2 = NiBr2
Многие металлы медленно реагируют с безводным бромом из-за образования на их поверхности пленки бромида, нерастворимого в броме. Из металлов наиболее устойчивы к действию брома (даже при повышенных температурах и в присутствии влаги) серебро, свинец, платина и тантал. Золото, в отличие от платины, легко реагирует с ним, образуя AuBr3.
В водной среде бром окисляет нитриты до нитратов, аммиак до азота, иодиды до свободного иода, серу и сульфиты до серной кислоты:
2Nh4 + 6Br2 = N2+ 6HBr3Br2 + S + 4h3O = 6HBr + h3SO4
Бром умеренно растворим в воде (3,58 г в 100 г при 20° C), при охлаждении этого раствора до 6° C из него выпадают гранатово-красные кристаллы клатратного гидрата брома состава 6Br2·46h3O. Растворимость брома существенно возрастает при добавлении бромидов за счет образования прочных комплексных соединений:
KBr + Br2 = KBr3
В водном растворе брома («бромной воде») существует равновесие между молекулярным бромом, бромид-ионом и оксокислотами брома:
Br2 + h3O = HBr + HBrO
В насыщенном растворе бром диссоциирован на 0,85%, в 0,001-молярном – на 17%.
При хранении бромной воды на свету она постепенно разлагается с выделением кислорода из-за фотолиза бромноватистой кислоты:
2HOBr + hv = 2HBr + O2При взаимодействии брома с растворами щелочей образуются соответствующие бромиды и гипобромиты (на холоду) или броматы:
Br2 + 2NaOH = NaBr + NaBrO + h3O (при t < 0° C)
3Br2 + 6NaOH = 5NaBr + NaBrO3 + 3h3O
Вследствие высокой химической активности брома, для его транспортировки используются цистерны с внутренней свинцовой или никелевой обкладкой. Малые объемы брома хранят в стеклянной посуде.
Соединения брома.
Известны химические соединения брома, в которых он может проявлять степени окисления –1, 0, +1, +3, +5 и +7. Наибольший практический интерес представляют вещества, содержащие бром в степени окисления –1, к ним относятся бромоводород, а также неорганические и органические бромиды. Соединения брома в положительных степенях окисления представлены, в основном, кислородными кислотами брома и их солями; все они являются сильными окислителями.Бромоводород HBr, представляет собой ядовитый (ПДК = 2 мг/м3) бесцветный газ с резким запахом, дымящий на воздухе из-за взаимодействия с парами воды. При охлаждении до –67° C бромоводород переходит в жидкое состояние. HBr хорошо растворим в воде: при 0° C в одном объеме воды растворяется 612 объемов бромоводорода, в растворе HBr диссоциирует на ионы:
HBr + h3O = h4O+ + Br–
Водный раствор HBr называется бромоводородной кислотой, она относится к числу сильных кислот (pKa = –9,5). В HBr бром имеет степень окисления –1 и поэтому бромоводородная кислота проявляет восстановительные свойства, она окисляется концентрированной серной кислотой и кислородом воздуха (на свету):
h3SO4 + 2HBr = Br2 + SO2+ 2h3O4HBr + O2 = 2Br2 + 2h3O
При взаимодействии с металлами, а также с оксидами и гидроксидами металлов бромоводородная кислота образует соли – бромиды:
HBr + KOH = KBr + h3O
В промышленности бромоводород получают прямым синтезом из элементов в присутствии катализатора (платины или активированного угля) h3 + Br2 = 2HBr и, в качестве побочного продукта, при бромировании органических соединений:
В лаборатории HBr может быть получен при действии концентрированной фосфорной кислоты на бромиды щелочных металлов при нагревании:
NaBr + h4PO4 = Nah3PO4 + HBr
Удобным лабораторным методом синтеза HBr является также взаимодействие брома с бензолом или декалином в присутствии железа:
C10h28 + Br2 = C10h27Br + HBr
Бромоводород применяется для получения бромидов и некоторых органических соединений брома.
Бромид калия KBr – бесцветное кристаллическое вещество, хорошо растворимое в воде (65 г в 100 г воды при 20° C), tпл = 730° C. Бромид калия применяется при изготовлении фотоэмульсий и в качестве противовуалирующего вещества в фотографии. KBr хорошо пропускает инфракрасные лучи и поэтому служит материалом для изготовления линз для ИК-спектроскопии.
Бромид лития LiBr, представляет собой бесцветное гигроскопичное вещество (tпл = 552° C), хорошо растворимое в воде (63,9% при 20° C). Известен кристаллогидрат LiBr·2h3O. Бромид лития получают при взаимодействии водных растворов карбоната лития и бромоводородной кислоты:
Li2CO3 + 2HBr = 2LiBr + h3O + CO2Бромид лития применяют при лечении психических заболеваний и хронического алкоголизма. Из-за высокой гигроскопичности LiBr используется как осушающее вещество в системах кондиционирования воздуха и для обезвоживания минеральных масел.
Бромноватистая кислота HOBr относится к слабым кислотам, она существует лишь в разбавленных водных растворах, которые получают взаимодействием брома с суспензией оксида ртути:
2Br2 + 2HgO + h3O = HgO·HgBr2Ї + 2HOBr
Соли бромноватистой кислоты называются гипобромитами, они могут быть получены взаимодействием брома с холодным раствором щелочи (см. выше), при нагревании щелочных растворов гипобромиты диспропорционируют:
3NaBrO = 2NaBr + NaBrO3
Степени окисления брома +3 соответствует бромистая кислота HBrO2, которая в настоящее время не получена. Известны только ее соли – бромиты, которые можно получить окислением гипобромитов бромом в щелочной среде:
Ba(BrO)2 + 2Br2 + 4KOH = Ba(BrO2)2 + 4KBr + 2h3O
Бромноватая кислота HBrO3 получена в растворах при действии разбавленной серной кислоты на растворы ее солей – броматов:
Ba(BrO3)2 + h3SO4 = 2HBrO3 + BaSO4Ї
При попытке получения растворов с концентрацией выше 30% бромноватая кислота разлагается со взрывом.
Бромноватая кислота и броматы являются сильными окислителями:
2S + 2NaBrO3 = Na2SO4 + Br2+ SO2.
Бромат калия KBrO3 – бесцветное кристаллическое вещество, растворимое в воде (в 100 г воды при 20° C растворяется 6,9 г KBrO3, при 100° C – 49,7 г). При нагревании до 434° C разлагается без плавления:
2KBrO3 = 2KBr + 3O2
Бромат калия получают электролизом растворов KBr или взаимодействием гидроксида калия с бромом и хлором:
12KOH + Br2 + 5Cl2 = 2KBrO3 + 10KCl +6h3O
KBrO3 применяется в аналитической химии в качестве окислителя при броматометрическом титровании, он входит в состав нейтрализаторов для химической завивки.
Наиболее устойчивой из оксокислот брома является бромная кислота HBrO4, которая существует в водных растворах с концентрацией, не превышающей 6 моль/л. Несмотря на то, что HBrO4 – самый сильный окислитель среди кислородных кислот брома, окислительно-восстановительные реакции с ее участием протекают очень медленно. Так, например, бромная кислота не выделяет хлор из одномолярного раствора соляной кислоты, хотя эта реакция термодинамически выгодна. Особая устойчивость иона BrO4– связана с тем, что атомы кислорода, окружая атом брома по тетраэдру, эффективно защищают его от атаки восстановителя. Растворы бромной кислоты можно получить подкислением растворов ее солей – перброматов, которые, в свою очередь, синтезируют электролизом растворов броматов, а также окислением щелочных растворов броматов фтором или фторидами ксенона:
NaBrO3 + XeF2 + 2NaOH = NaBrO4 + 2NaF + Xe+ h3OИз-за сильных окислительных свойств перброматов они были синтезированы только во второй половине 20 в. американским ученым Эваном Эпплманом (Evan H.Appelman) в 1968.
Кислородные кислоты брома и их соли могут быть использованы в качестве окислителей.
Биологическая роль и токсичность соединений брома.
Многие аспекты биологической роли брома в настоящее время еще не выяснены. В организме человека бром участвует в регуляции деятельности щитовидной железы, так как является конкурентным ингибитором иода. Некоторые исследователи полагают, что соединения брома участвуют в деятельности эозинофилов – клеток иммунной системы. Пероксидаза эозинофилов окисляет бромид-ионы до бромноватистой кислоты, которая помогает разрушать чужеродные клетки, в том числе и раковые. Недостаток брома в пище приводит к бессоннице, замедлению роста и уменьшению числа эритроцитов в крови. Ежедневное поступление брома в организм человека с пищей составляет 2–6 мг. Особенно богаты бромом рыба, злаки и орехи.Элементный бром ядовит. Жидкий бром вызывает трудно заживающие ожоги, при попадании на кожу его нужно смыть большим количеством воды или раствора соды. Пары брома в концентрации 1мг/м3 вызывают раздражение слизистых оболочек, кашель, головокружение и головную боль, а в более высокой (>60 мг/м3) – удушье и смерть. При отравлении парами брома рекомендуется вдыхать аммиак. Токсичность соединений брома менее велика, тем не менее, при длительном употреблении бромсодержащих препаратов может развиться хроническое отравление – бромизм. Его симптомы – общая вялость, появление сыпи на коже, апатия, сонливость. Бромид-ионы, поступая в организм в течение длительного времени, препятствуют накоплению иода в щитовидной железе, угнетая ее деятельность. Для ускорения выведения брома из организма назначают диету с большим содержанием соли и обильное питье.
Применение брома и его соединений.
Первым известным применением соединений брома было производство пурпурного красителя. Его добывали еще во втором тысячелетии до нашей эры из моллюсков вида «мурекс», накапливающих бром из морской воды. Процесс извлечения красителя был очень трудоемок (из 8000 моллюсков можно получить всего 1 грамм пурпура) и позволить себе носить окрашенную им одежду могли только очень богатые люди. В древнем Риме носить ее могли только представители высшей власти, поэтому он получил название «королевский пурпур». Структуру действующего начала этого красителя установили только во второй половине 19 в., им оказалось соединение брома – 6,6'– диброминдиго. Бромпроизводные индиго, синтезируемые искусственно, используются для окрашивания тканей (в основном, хлопковых) и сейчас.В 19 в. главными областями использования соединений брома были фотография и медицина.
Бромид серебра AgBr стал применяться как светочувствительный материал около 1840. Современные фотоматериалы на основе AgBr позволяют делать снимки с выдержкой 10–7 секунды. Для изготовления фотопленки на основе бромида серебра, эта соль синтезируется в водном растворе желатина, при этом выпавшие кристаллики AgBr равномерно распределяются по всему объему раствора. После застывания желатина образуется тонкодисперсная суспензия, которую тонким слоем (толщиной от 2 до 20 мкм) равномерно наносят на поверхность носителя – прозрачной пленки, изготовленной из ацетата целлюлозы. В каждом квадратном сантиметре полученного слоя содержится несколько сот миллионов зерен бромида серебра, окруженных желатиновой пленкой. При попадании света на такую фотопленку происходит фотолитическое разложение AgBr:
AgBr + hv = Ag + Br
Протеканию в фотоэмульсии обратного процесса – окисления серебра бромом, препятствует желатина. Фотолиз приводит к образованию в микрокристаллах AgBr групп атомов серебра с размерами 10–7–10–8 см, так называемых центров скрытого изображения. Для получения видимого изображения бромид серебра на засвеченных участках восстанавливают до металлического серебра. Центры скрытого изображения катализируют (ускоряют) реакцию восстановления и позволяют провести ее, практически не затронув неосвещенных кристалликов AgBr. После растворения оставшегося бромида серебра на фотопленке получается черно-белое изображение (негатив), устойчивое к действию света. Для создания позитивного изображения нужно повторить процесс, освещая (обычно) фотобумагу через пленку, на которой с негативным изображением.
Соли брома оказались очень эффективными лекарственными средствами для лечения многих нервных болезней. Знаменитый русский физиолог И.П.Павлов сказал: «Человечество должно быть счастливо тем, что располагает таким драгоценным для нервной системы препаратом, как бром». Использование KBr в медицине в качестве седативного (успокоительного) и противосудорожного средства при лечении эпилепсии началось в 1857. В то время водные растворы бромида калия и натрия были известны под общим названием «бром». В течение долгого времени механизм действия препаратов брома оставался неизвестным, считалось, что бромиды уменьшают возбудимость, действуя аналогично снотворным. Лишь в 1910 один из учеников Павлова П.М.Никифоровский экспериментально показал, что бромиды усиливают процессы торможения в центральной нервной системе. Сейчас бромиды натрия и калия практически вышли из употребления при лечении нервных заболеваний. Они были вытеснены более эффективными броморганическими препаратами.В начале 20 в. открылась новая область применения брома. С распространением автомобилей появилась нужда в больших количествах дешевого бензина, вместе с тем существующая в то время нефтяная промышленность не могла производить требуемые объемы высокооктанового горючего. Для улучшения качества топлива – уменьшения его способности к детонации в двигателе – в 1921 американский инженер Томас Мидгли (Thomas Midgley) предложил вводить в бензин дополнительный компонент – тетраэтилсвинец (Pb(C2H5)4, ТЭС). Эта добавка оказалась очень эффективной, но при ее использовании возникла новая проблема – отложения свинца в двигателях. Чтобы избежать их образования, ТЭС растворяют в бромуглеводородах – 1,2 -дибромэтане (BrCh3Ch3Br) и этилбромиде (C2H5Br), полученная смесь получила название «этиловая жидкость» (см. ОКТАНОВОЕ ЧИСЛО). Механизм ее действия заключается в том, что при совместном сгорании бромуглеводородов и ТЭС образуются летучие бромиды свинца, которые выносятся из двигателя вместе с выхлопными газами. В середине прошлого века на производство этиловой жидкости расходовалась большая часть производимого брома – 75% в 1963. Сейчас использование этиловой жидкости не соответствует современным требованиям экологической безопасности и ее мировое производство сокращается: в России, например, доля этилированного (содержащего этиловую жидкость) бензина в общем объеме автомобильного топлива составляла в 1995 более 50%, а в 2002 – 0,4%. В России использование ТЭС запрещено с 2003, а в некоторых регионах– еще раньше (в Москве – с 1993).
Теперь основной областью использования брома является производство антипиренов (от 40% мирового потребления брома). Антипирены – вещества, защищающие материалы органического происхождения от воспламенения. Их используют для пропитки тканей, изделий из древесины и пластмасс, производства негорючих красок. В качестве антипиренов применяются, в основном, ароматические бромпроизводные: дибромстирол, тетрабромфталевый ангидрид, декабромдифенилоксид, 2,4,6-трибромфенол и другие. Бромхлорметан используется в качестве наполнителя огнетушителей, предназначенных для тушения электропроводки.
Значительная часть брома (в США – 24%) в форме бромидов кальция, натрия и цинка расходуется для изготовления буровых растворов, которые закачивают в скважины для увеличения объема добытой нефти.
До 12% брома идет на синтез пестицидов и инсектицидов, используемых в сельском хозяйстве и для защиты деревянных изделий (метилбромид).
Элементный бром и его соединения применяются в процессах водоочистки и водоподготовки. Бром иногда используют для мягкой дезинфекции воды в бассейнах при повышенной чувствительности к хлору. На эти цели расходуется 7% производимого брома.
Около 17% брома расходуется на производство фотографических материалов, фармацевтических препаратов и высококачественной резины (бромбутилкаучука).
Органические соединения брома применяют для ингаляционного наркоза (галотан – 1,1,1-трифтор-2-хлор-2-бромэтан, CF3CHBrCl), в качестве обезболивающих, успокоительных, антигистаминных и антибактериальных препаратов, при лечении язвенных болезней, эпилепсии, сердечно-сосудистых заболеваний. Изотоп брома с атомной массой 82 находит применение в медицине при лечении опухолей и при изучении поведения бромсодержащих препаратов в организме.
Бромбутилкаучук получают в промышленности при неполном бромировании бутилкаучука – сополимера 97–98% изобутилена Ch3=C(Ch4)2 и ne 2–3% изопрена Ch3=C(Ch4)CH=Ch3. В этом процессе происходит бромирование только изопреновых звеньев макромолекулы каучука:
–Ch3 –C(Ch4)=CH–Ch3– + Br2 = –Ch3–CBr(Ch4) –CHBr–Ch3–
Введение брома в бутилкаучук существенно повышает скорость его вулканизации. Бромбутилкаучук не имеет запаха, не выделяет вредных веществ при хранении и переработке, он отличается высокой степенью совулканизации с ненасыщенными каучуками и лучшей, чем у бутилкаучука, адгезией к другим полимерам. Галогенированные бутилкаучуки используются для герметизации резиновых изделий из других полимеров (например, в производстве автомобильных шин), для изготовления теплостойких транспортных лент с высоким сопротивлением истиранию, резиновых пробок, химически стойких обкладок емкостей.Источники: ресурсы Интернет.
himoza1977.blogspot.ru