Курсовая работа: Аномальные свойства воды. Аномальные свойства воды реферат
Курсовая работа - Аномальные свойства воды
Вопрос № 21
Аномальные свойства воды
Огромная роль воды в жизни человека и природы послужила причиной того, что она была одним из первых соединений, привлекших внимание ученых. Глубокие философские обобщения привели человечество к необходимости познания физической и химической природы воды. Тем не менее, изучение воды еще далеко не закончено.
Раскрыть ее секреты до конца еще не удалась никому. Человечество упорно в длительном борении за истину, объединяя знания поколений, постепенно открывало все новые и новые специфические особенности этой загадочной жидкости, «сока Жизни».
В 1783 году выдающиеся экспериментаторы Генри Кавендиш (1731-1810) и Антуан Лавуазье (1743-1794) установили, что вода состоит из двух газов: водорода и кислорода и соотношение их выражается формулой Н2 0.
Все достижения современной цивилизации во многом обусловлены использованием и изучением воды. Достаточно назвать водяной пар и паровую машину Джемса Уатта.
Исследование химического состава воды привело к открытию Генри Кавендишем водорода “горячего воздуха”, рождающего воду, к созданию Джонам Дальтонам атомной теории вещества.
Открытие химического состава молекулы воды послужило началом бурному росту науки о биологической роли воды, об ее лечебно-профилактическом использовании.
Вода выступала катализаторам развития многих фундаментальных научных дисциплин. Вспомним также о ее причастности к ядерной физике в виде тяжелой и сверхтяжелой воды. В настоящее время наступила эра всеобщего изучения роли воды в нормальных и патологических процессах жизни, которую можно назвать эрой водной биологии и медицины.
Современному представлению о строении молекулы воды и водных растворов предшествовал бурный период научных и экспериментальных изысканий, подчас противоречивых и трудно воспроизводимых.
Это и химическая теория Д.И. Менделеева, и теория непрерывности газового и жидкого состояния Ван-дер-Ваальса, и гидрольная теория У. Рамзая и Дж. Шильдса, и рентгенографический метод исследования Лауэ, и постулат Дебая о близости структуры жидкого состояния воды к твердой фазе на границе температурного раздела лед-вода и ряд других теорий. Однако, в конце концов основные черты строения молекулы воды были расшифрованы. Как же сейчас мы представляем себе строение воды?
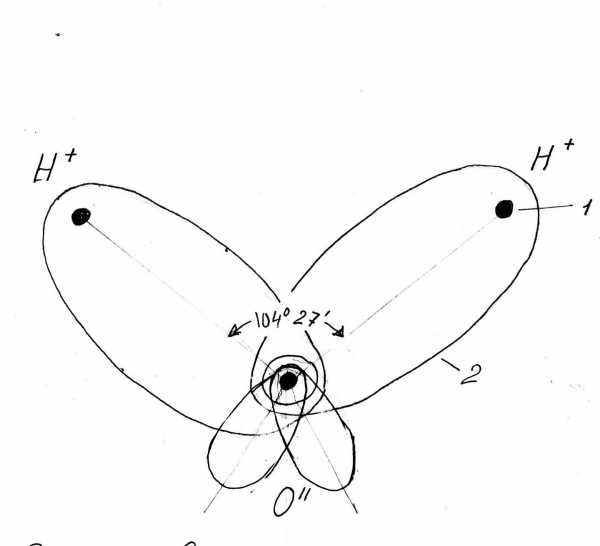
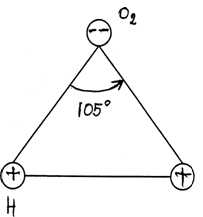
Начнем с элементарного — со строения молекулы воды, состоящей из двух атомов водорода (Н1 ) и одного атома кислорода (О18 ). Оказывается, все многообразие свойств воды и необычность их проявления, в конечном счете, определяются физической природой этих атомов и способом их объединения в молекулу. В отдельно рассматриваемой молекуле воды ядра водорода и кислорода так расположены друг относительно друга, что образуют как бы равнобедренный треугольник — со сравнительно крупным ядром кислорода в вершине и двумя мелкими ядрами водорода у основания (рис. 1, а).
Puc. 1. Строение молекулы воды:
а) — угол между связями О-Н, б) — структура электронного облака молекулы, в) — расположение полюсов заряда.
Электронное облако молекулы, образованное пятью парами электронов, схематически распределено так (рис. 1, б), что внутренняя пара окружает ядро кислорода, две внешние пары неравномерно поделены между ядрами кислорода и водорода, тяготея больше к кислороду, а остальные две пары кислород не делит с водородом, и их заряды остаются частично нескомпенсированными. Таким образом, в молекуле воды оказывается четыре полюса зарядов: два отрицательных за счет избытка электронной плотности у кислородных пар электронов и два положительных — вследствие недостатка электронной плотности у несколько оголенных ядер водорода — протонов.
Эти заряды можно условно представить расположенными в вершинах частично искаженного тетраэдра (рис. 1, в). Вследствие такой асимметричности распределения электрических зарядов молекула воды обладает ярко выраженными полярными свойствами: она является диполем с высоким дипольным моментом — 1,87 Дебая. На рис. 2 показана схема образования молекулы воды.
Рис. 2. Образование молекулы воды.
Как видно на рис. 2, у одного атома кислорода и двух атомов водорода (а) появляются общие электроны, образующие прочную ковалентную связь (б). Если два протона водорода молекулы воды вращаются в одну сторону, то вода называется параводой, в разные стороны — ортоводой.
В обыкновенной воде 3/4 ортоводы. Ряд ученых предполагает, что соотношение орто- и параводы в клетке имеет регуляторное значение. Если строение молекулы воды в общих чертах установлено, то структура воды по-прежнему остается загадкой.
Исследуя воду и, особенно ее водные растворы, ученые раз за разом убеждались, что вода обладает ненормальными — аномальными свойствами, присущими только ей, ее Величеству — Воде, подарившей нам Жизнь и возможность мыслить. Мы даже и не подозреваем, что столь привычные и естественные свойства воды в природе, в различных технологиях, наконец, в обыденной жизни нашей являются уникальными и неповторимыми.
Ученые согласны в том, что вода является одним из самых трудных объектов исследования, так как, прежде всего в воде всегда есть примеси и что она обладает кооперативным характером взаимодействия ее молекул.
В рамках микроскопического подхода структура воды отличается относительно беспорядочным динамически меняющимся расположением молекул, а высокая плотность обуславливает сильное межмолекулярное взаимодействие, осуществляемое посредством водородных связей.
Таким образом, вода представляет собой сложную ассоциированную жидкость с тетраэдрической сеткой молекул, соединенных водородными связями.
В результате теплового движения молекул эта сетка подвержена спонтанной перестройке.
В трехмерной сетке водородных связей размещены флуктуационные микрообъемы молекул воды, обладающие сравнительно малой энергией теплового движения и более высокой степенью структурного упорядочения. Это — микрокластеры.
В то же время вокруг микрокластеров в макрообъеме ассоциированной среды с повышенной энергией теплового движения молекул Н2 0 наблюдается большая степень структурной беспорядочности, то есть более низкий уровень структурного упорядочения.
Вещества — аналоги воды, молекулы которых по химическому составу похожи на воду, — h3 S, h3 Se, h3 Te, то есть соединения водорода и серы, водорода и селена, водорода и теллура и так далее, при комнатной температуре находятся в газообразном состоянии. Казалось бы, вода, сохрани она такие же свойства, должна бы закипать при температуре -70°С, а превращаться в лед при -90 °С. Эти условия вряд ли бы способствовали развитию жизни на Земле, ведь она должна была бы существовать в интервале температур от -70 °С до -90 °С (рис.3). В таком холоде разве возможна жизнь?
Иначе говоря, если бы вода — гидрид кислорода Н2 О — была бы нормальным мономолекулярным соединением, таким, например, как ее аналоги по шестой группе Периодической системы элементов Д.И.Менделеева — гидрид серы h3 S, гидрид селена h3 Se, гидрид теллура h3 Te, то в жидком состоянии вода существовала бы в пределах от минус 95 °С до минус 70 °С, а не такая, какая реально существует сейчас. Нетрудно понять, что в этом случае биологической жизни на Земле не могло бы существовать. На рис.3 показаны необычные точки замерзания и кипения воды по сравнению с другими жидкостями.
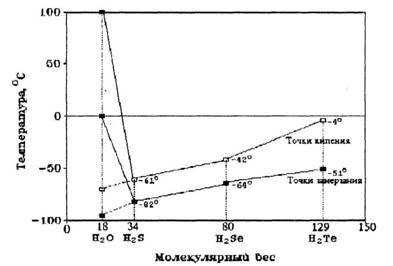
Рис. 3. Аномалии точек кипения и замерзания воды по сравнению с другими соединениями водорода.
Но, к счастью для нас и для всего живого на свете вода обладает аномальными свойствами.
Вода «не признает» периодических закономерностей, характерных для бесчисленного множества соединений на Земле и в Космосе, а следует своим, еще не вполне понятным для науки законам, подарившим нам удивительный «мир Жизни».
«Ненормальные» температуры плавления (0 °С) и кипения (+100 °С) воды далеко не единственная ее аномальность.
Для всей биосферы исключительна важной особенностью воды является ее способность при замерзании увеличивать, а не уменьшать свой объем, то есть уменьшать плотность.
Действительно, при переходе любой жидкости в твердое состояние молекулы располагаются теснее, а само вещество, уменьшаясь в объеме, становится плотнее. Да, для любой из необозримо разных жидкостей, но не воды. Вода и здесь представляет исключение.
При охлаждении вода сначала ведет себя как и другие жидкости: постепенно уплотняясь, уменьшает свой объем. Такое явление можно наблюдать до +3,98 °С. Затем, при дальнейшем снижении температуры до 0 °С, вся вода замерзает и расширяется в объеме. В результате удельный вес льда становится меньше воды и лед плавает. Если бы лед не всплывал, а тонул, то все водоемы (реки, озера, моря) промерзли бы до дна, испарение бы резко сократилось, все пресноводные животные и растения погибли бы. Жизнь на Земле стала бы невозможной.
Вода — единственная жидкость на Земле, лед которой не тонет за счет того, что его объем на 1/11 больше объема воды.
Еще одно удивительное свойство воды — ее огромное поверхностное натяжение. Благодаря тому, что круглые шарики воды очень упруги, идет дождь, выпадает роса.
Что же это за удивительная сила, которая сохраняет капли росы, а поверхностный слой воды в любой лужице делает эластичным и относительно прочным?
Известно, что если стальную иголку осторожно положить на поверхность воды, налитой в блюдце, то иголка не тонет. А ведь удельная масса металла значительно больше, чем у воды. Молекулы воды связаны силой поверхностного натяжения, которая позволяет им подниматься вверх по капиллярам, преодолевая силу земного притяжения. Без этого свойства воды жизнь на Земле была бы также невозможна.
Ни одно вещества на Земле не обладает такой способностью поглощать тепло, как вода. Для превращения в пар 1г воды требуется 537 калории тепла. Конденсируясь, пар возвращает эти 537 калорий в окружающую среду.
Ни одно вещество в мире не поглощает и не отдает среде столько тепла, сколько вода. Теплоемкость воды в 10 раз больше теплоемкости стали и в 30 раз больше ртути. Вода сохраняет тепло на Земле.
С поверхности морей, океанов, суши испаряется за год 520000 кубических километров воды, которые, конденсируясь, отдают много тепла холодным и полярным регионам.
Не обладай вода такой уникальной способностью поглощать и отдавать тепло, климат Земли оказался бы непригодным для существования человека. В высоких широтах тогда царил бы нестерпимый холод, а в низких — солнце испепелило бы все живое.
Благодаря наземному Мировому океану атмосфера представляет собой надежное теплое одеяло, укрывающее тело планеты и защищающее его от космического холода. Подземный океан снабжает Землю теплом из внутренних источников планеты.
Ни одна жидкость не поглощает газы с такой жадностью, как вода. Но она их также легко отдает.
Дождь растворяет в себе все ядовитые газы атмосферы. Вода — ее мощный природный фильтр, очищающий атмосферу от всех вредных и ядовитых газов.
Еще одно удивительное свойство воды проявляется при воздействии на нее магнитного поля. Вода, подвергнутая магнитной обработке, меняет растворимость солей и скорость химических реакций.
Магнитная вода не только не дает накипи в котлах, но и срывает ранее образовавшиеся отложения, повышает прочность бетона, ускоряет его застывание, увеличивает процент выхода обогащенной руды.
Ряд удивительных свойств воды связан с ее теплоемкостью. Легче всего вода нагревается и быстрее всего охлаждается в своеобразной “температурной яме”, соответствующей +37 °С, температуре человеческого тела (рис. 4).
Как видно из рис.4, теплоемкость воды своих минимальных значений достигает около +37 °С. Это нормальная температура тела человека. Именно при температуре 36,6-37оС сложнейшие реакции обмена веществ в организме человека наиболее интенсивны. Значит, при этой температуре организм человека находится в наивыгоднейшем энергетическом состоянии.
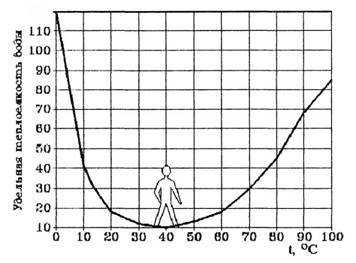
Рис. 4. Температурная зависимость удельной теплоемкости воды.
Вода в организме человека составляет 70-90%. от веса тела. Не обладай вода такой теплоемкостью, как сейчас, обмен веществ в теплокровных и холоднокровных организмах был бы невозможен.
В клетках живых организмов различают “объемную” и “связанную” воду. Первая — вода, с которой мы имеем дело в повседневной жизни. В ней растворен цитозоль клетки. Под “связанной” водой мы понимаем воду, связанную с биологическими молекулами, мембранами.
В живых клетках обычная вода, будучи связанной с мембранами, неизвестным образом превращается в воду со структурой льда. И она уже не во власти незыблемых законов физики — все ее свойства коренным образом меняются. Диэлектрическая проницаемость, например, уменьшается в десять раз, а теплопроводность возрастает в семьдесят раз и тому подобное.
Любая живая клетка имеет наружную и внутреннюю биологические мембраны. Это как бы избирательно проницаемая стенка, ограждающая содержимое клетки, ее органоиды от повреждения. На поверхности биологических образований молекулы воды подвергаются структурно -функциональной упорядоченности, образуют так называемую клатратную пленку — кристаллогидрат со строго ориентированными дипольными моментами молекул воды.
В самой клатратной пленке, размещенной, к примеру, на поверхности клеточной мембраны, процессы обмена между молекулами воды осуществляются с частотой десять тысяч раз в секунду, в то время как с окружающей объемной водой молекулы Н2 О меняются местами с частотой в два раза меньшей.
Это приводит к тому, что растворенным в воде примесям термодинамически невыгодно находиться в клатратных слоях воды, поэтому они предпочитают объемную воду.
Итак, будучи связанной с живой материей и защищая ее, клатраты сами защищены невидимым барьером от разрушающего действия на них объемной воды с растворенными в ней вредными и ядовитыми веществами. И чем толще и крепче клатратная прослойка, тем более стабильны термодинамические и биологические условия функционирования отдельной молекулы и клетки организма.
В связанной воде все молекулы Н2 О имеют по четыре водородные связи и обеспечивают оптимальную скорость миграции протонов и электронов -эту основу обмена веществ в живых системах.
Основа структуры всех биомолекул — водородные связи. Водородные связи биомолекул и воды, по Сент-Дьердьи, образуют матрицу жизни, по которой движутся в процессе обмена веществ протоны и электроны.
Водородные связи — не только матрица, но и существенный элемент в строительстве всего живого. Все сказанное выше, говорит о том, что обыкновенная вода — самое необыкновенное вещество в природе.
Обнаружена и изучается универсальная система водно-структурной регуляции жизненными процессами. Структура воды и растворенные в ней вещества (анионы и катионы) определяют и регулируют строение и функции макромолекул клетки и низкомолекулярных биорегуляторов, сборку и функционирование организмов и клеток, тканей, органов и систем органов, наконец, целого организма.
Она действует как на субмолекулярном и молекулярном, так и на более высоких уровнях организации живой материи, вплоть до биосферного. Она определяет миграцию протонов и электронов в клетках, структуру мембран, функции ДНК, РНК, белков, низкомолекулярных регуляторов, сборку клеточных структур, оплодотворение, эмбриональное развитие, зрелое функционирование организма, его управляющие, регуляторные и гомеостатические системы, его старение и смерть.
Важным элементом системы водно-структурной регуляции является соотношение пара- и ортоводы. Гипотезу об этом развивает в своей содержательной книге Б.З.Фрадкин. Автор книги «Белые пятна безбрежного океана» Б.Э.Фрадкин в 1976 году писал о загадках воды: «Мы вправе рассматривать воду как необъятную самостоятельную область познания — безбрежный океан, усыпанный белыми пятнами загадок. И едва удается раскрыть одну загадку, как появляется две, десять новых, еще более невероятных».
Учитывая огромную роль воды в жизни человечества и отмечая пуск нового водопровода, жители города Новороссийска в 1974 году, как сообщала газета “Известия” 24 марта 1974 года, разработали памятник воде. Если он был воздвигнут, то этим актом люди выразили свое преклонение перед этим чудом природы — обыкновенной и вместе с тем необыкновенной водой.
СПИСОК ЛИТЕРАТУРЫ
1. Арабаджи В. И. Загадки простой воды. — М.: «Знание», 2003г.
2. Ахматов М.В. Вода, которую мы пьём. — М.: 2006г.
3. Петрянов И.В. Самое необыкновенное вещество в мире — М.: «Педагогика», 2005г.
www.ronl.ru
Реферат: Аномальные свойства воды
Вопрос № 21
Аномальные свойства воды
Огромная роль воды в жизни человека и природы послужила причиной того, что она была одним из первых соединений, привлекших внимание ученых. Глубокие философские обобщения привели человечество к необходимости познания физической и химической природы воды. Тем не менее, изучение воды еще далеко не закончено.
Раскрыть ее секреты до конца еще не удалась никому. Человечество упорно в длительном борении за истину, объединяя знания поколений, постепенно открывало все новые и новые специфические особенности этой загадочной жидкости, «сока Жизни».
В 1783 году выдающиеся экспериментаторы Генри Кавендиш (1731-1810) и Антуан Лавуазье (1743-1794) установили, что вода состоит из двух газов: водорода и кислорода и соотношение их выражается формулой Н20.
Все достижения современной цивилизации во многом обусловлены использованием и изучением воды. Достаточно назвать водяной пар и паровую машину Джемса Уатта.
Исследование химического состава воды привело к открытию Генри Кавендишем водорода “горячего воздуха”, рождающего воду, к созданию Джонам Дальтонам атомной теории вещества.
Открытие химического состава молекулы воды послужило началом бурному росту науки о биологической роли воды, об ее лечебно-профилактическом использовании.
Вода выступала катализаторам развития многих фундаментальных научных дисциплин. Вспомним также о ее причастности к ядерной физике в виде тяжелой и сверхтяжелой воды. В настоящее время наступила эра всеобщего изучения роли воды в нормальных и патологических процессах жизни, которую можно назвать эрой водной биологии и медицины.
Современному представлению о строении молекулы воды и водных растворов предшествовал бурный период научных и экспериментальных изысканий, подчас противоречивых и трудно воспроизводимых.
Это и химическая теория Д.И. Менделеева, и теория непрерывности газового и жидкого состояния Ван-дер-Ваальса, и гидрольная теория У. Рамзая и Дж. Шильдса, и рентгенографический метод исследования Лауэ, и постулат Дебая о близости структуры жидкого состояния воды к твердой фазе на границе температурного раздела лед-вода и ряд других теорий. Однако, в конце концов основные черты строения молекулы воды были расшифрованы. Как же сейчас мы представляем себе строение воды?
Начнем с элементарного — со строения молекулы воды, состоящей из двух атомов водорода (Н1) и одного атома кислорода (О18). Оказывается, все многообразие свойств воды и необычность их проявления, в конечном счете, определяются физической природой этих атомов и способом их объединения в молекулу. В отдельно рассматриваемой молекуле воды ядра водорода и кислорода так расположены друг относительно друга, что образуют как бы равнобедренный треугольник — со сравнительно крупным ядром кислорода в вершине и двумя мелкими ядрами водорода у основания (рис. 1, а).
Puc. 1. Строение молекулы воды:
а) — угол между связями О-Н, б) — структура электронного облака молекулы, в) — расположение полюсов заряда.
Электронное облако молекулы, образованное пятью парами электронов, схематически распределено так (рис. 1, б), что внутренняя пара окружает ядро кислорода, две внешние пары неравномерно поделены между ядрами кислорода и водорода, тяготея больше к кислороду, а остальные две пары кислород не делит с водородом, и их заряды остаются частично нескомпенсированными. Таким образом, в молекуле воды оказывается четыре полюса зарядов: два отрицательных за счет избытка электронной плотности у кислородных пар электронов и два положительных — вследствие недостатка электронной плотности у несколько оголенных ядер водорода — протонов.
Эти заряды можно условно представить расположенными в вершинах частично искаженного тетраэдра (рис. 1, в). Вследствие такой асимметричности распределения электрических зарядов молекула воды обладает ярко выраженными полярными свойствами: она является диполем с высоким дипольным моментом — 1,87 Дебая. На рис. 2 показана схема образования молекулы воды.
Рис. 2. Образование молекулы воды.
Как видно на рис. 2, у одного атома кислорода и двух атомов водорода (а) появляются общие электроны, образующие прочную ковалентную связь (б). Если два протона водорода молекулы воды вращаются в одну сторону, то вода называется параводой, в разные стороны — ортоводой.
В обыкновенной воде 3/4 ортоводы. Ряд ученых предполагает, что соотношение орто- и параводы в клетке имеет регуляторное значение. Если строение молекулы воды в общих чертах установлено, то структура воды по-прежнему остается загадкой.
Исследуя воду и, особенно ее водные растворы, ученые раз за разом убеждались, что вода обладает ненормальными — аномальными свойствами, присущими только ей, ее Величеству — Воде, подарившей нам Жизнь и возможность мыслить. Мы даже и не подозреваем, что столь привычные и естественные свойства воды в природе, в различных технологиях, наконец, в обыденной жизни нашей являются уникальными и неповторимыми.
Ученые согласны в том, что вода является одним из самых трудных объектов исследования, так как, прежде всего в воде всегда есть примеси и что она обладает кооперативным характером взаимодействия ее молекул.
В рамках микроскопического подхода структура воды отличается относительно беспорядочным динамически меняющимся расположением молекул, а высокая плотность обуславливает сильное межмолекулярное взаимодействие, осуществляемое посредством водородных связей.
Таким образом, вода представляет собой сложную ассоциированную жидкость с тетраэдрической сеткой молекул, соединенных водородными связями.
В результате теплового движения молекул эта сетка подвержена спонтанной перестройке.
В трехмерной сетке водородных связей размещены флуктуационные микрообъемы молекул воды, обладающие сравнительно малой энергией теплового движения и более высокой степенью структурного упорядочения. Это — микрокластеры.
В то же время вокруг микрокластеров в макрообъеме ассоциированной среды с повышенной энергией теплового движения молекул Н20 наблюдается большая степень структурной беспорядочности, то есть более низкий уровень структурного упорядочения.
Вещества — аналоги воды, молекулы которых по химическому составу похожи на воду, — h3S, h3Se, h3Te, то есть соединения водорода и серы, водорода и селена, водорода и теллура и так далее, при комнатной температуре находятся в газообразном состоянии. Казалось бы, вода, сохрани она такие же свойства, должна бы закипать при температуре -70°С, а превращаться в лед при -90 °С. Эти условия вряд ли бы способствовали развитию жизни на Земле, ведь она должна была бы существовать в интервале температур от -70 °С до -90 °С (рис.3). В таком холоде разве возможна жизнь?
Иначе говоря, если бы вода — гидрид кислорода Н2О — была бы нормальным мономолекулярным соединением, таким, например, как ее аналоги по шестой группе Периодической системы элементов Д.И.Менделеева — гидрид серы h3S, гидрид селена h3Se, гидрид теллура h3Te, то в жидком состоянии вода существовала бы в пределах от минус 95 °С до минус 70 °С, а не такая, какая реально существует сейчас. Нетрудно понять, что в этом случае биологической жизни на Земле не могло бы существовать. На рис.3 показаны необычные точки замерзания и кипения воды по сравнению с другими жидкостями.
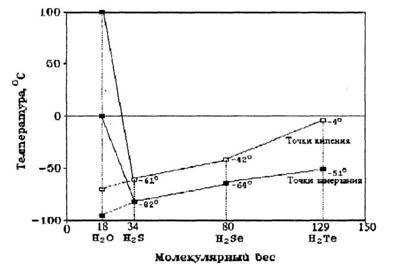
Рис. 3. Аномалии точек кипения и замерзания воды по сравнению с другими соединениями водорода.
Но, к счастью для нас и для всего живого на свете вода обладает аномальными свойствами.
Вода «не признает» периодических закономерностей, характерных для бесчисленного множества соединений на Земле и в Космосе, а следует своим, еще не вполне понятным для науки законам, подарившим нам удивительный «мир Жизни».
«Ненормальные» температуры плавления (0 °С) и кипения (+100 °С) воды далеко не единственная ее аномальность.
Для всей биосферы исключительна важной особенностью воды является ее способность при замерзании увеличивать, а не уменьшать свой объем, то есть уменьшать плотность.
Действительно, при переходе любой жидкости в твердое состояние молекулы располагаются теснее, а само вещество, уменьшаясь в объеме, становится плотнее. Да, для любой из необозримо разных жидкостей, но не воды. Вода и здесь представляет исключение.
При охлаждении вода сначала ведет себя как и другие жидкости: постепенно уплотняясь, уменьшает свой объем. Такое явление можно наблюдать до +3,98 °С. Затем, при дальнейшем снижении температуры до 0 °С, вся вода замерзает и расширяется в объеме. В результате удельный вес льда становится меньше воды и лед плавает. Если бы лед не всплывал, а тонул, то все водоемы (реки, озера, моря) промерзли бы до дна, испарение бы резко сократилось, все пресноводные животные и растения погибли бы. Жизнь на Земле стала бы невозможной.
Вода — единственная жидкость на Земле, лед которой не тонет за счет того, что его объем на 1/11 больше объема воды.
Еще одно удивительное свойство воды — ее огромное поверхностное натяжение. Благодаря тому, что круглые шарики воды очень упруги, идет дождь, выпадает роса.
Что же это за удивительная сила, которая сохраняет капли росы, а поверхностный слой воды в любой лужице делает эластичным и относительно прочным?
Известно, что если стальную иголку осторожно положить на поверхность воды, налитой в блюдце, то иголка не тонет. А ведь удельная масса металла значительно больше, чем у воды. Молекулы воды связаны силой поверхностного натяжения, которая позволяет им подниматься вверх по капиллярам, преодолевая силу земного притяжения. Без этого свойства воды жизнь на Земле была бы также невозможна.
Ни одно вещества на Земле не обладает такой способностью поглощать тепло, как вода. Для превращения в пар 1г воды требуется 537 калории тепла. Конденсируясь, пар возвращает эти 537 калорий в окружающую среду.
Ни одно вещество в мире не поглощает и не отдает среде столько тепла, сколько вода. Теплоемкость воды в 10 раз больше теплоемкости стали и в 30 раз больше ртути. Вода сохраняет тепло на Земле.
С поверхности морей, океанов, суши испаряется за год 520000 кубических километров воды, которые, конденсируясь, отдают много тепла холодным и полярным регионам.
Не обладай вода такой уникальной способностью поглощать и отдавать тепло, климат Земли оказался бы непригодным для существования человека. В высоких широтах тогда царил бы нестерпимый холод, а в низких — солнце испепелило бы все живое.
Благодаря наземному Мировому океану атмосфера представляет собой надежное теплое одеяло, укрывающее тело планеты и защищающее его от космического холода. Подземный океан снабжает Землю теплом из внутренних источников планеты.
Ни одна жидкость не поглощает газы с такой жадностью, как вода. Но она их также легко отдает.
Дождь растворяет в себе все ядовитые газы атмосферы. Вода - ее мощный природный фильтр, очищающий атмосферу от всех вредных и ядовитых газов.
Еще одно удивительное свойство воды проявляется при воздействии на нее магнитного поля. Вода, подвергнутая магнитной обработке, меняет растворимость солей и скорость химических реакций.
Магнитная вода не только не дает накипи в котлах, но и срывает ранее образовавшиеся отложения, повышает прочность бетона, ускоряет его застывание, увеличивает процент выхода обогащенной руды.
Ряд удивительных свойств воды связан с ее теплоемкостью. Легче всего вода нагревается и быстрее всего охлаждается в своеобразной “температурной яме”, соответствующей +37 °С, температуре человеческого тела (рис. 4).
Как видно из рис.4, теплоемкость воды своих минимальных значений достигает около +37 °С. Это нормальная температура тела человека. Именно при температуре 36,6-37оС сложнейшие реакции обмена веществ в организме человека наиболее интенсивны. Значит, при этой температуре организм человека находится в наивыгоднейшем энергетическом состоянии.
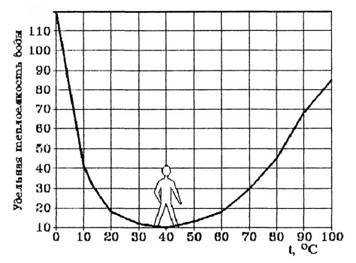
Рис. 4. Температурная зависимость удельной теплоемкости воды.
Вода в организме человека составляет 70-90%. от веса тела. Не обладай вода такой теплоемкостью, как сейчас, обмен веществ в теплокровных и холоднокровных организмах был бы невозможен.
В клетках живых организмов различают “объемную” и “связанную” воду. Первая — вода, с которой мы имеем дело в повседневной жизни. В ней растворен цитозоль клетки. Под “связанной” водой мы понимаем воду, связанную с биологическими молекулами, мембранами.
В живых клетках обычная вода, будучи связанной с мембранами, неизвестным образом превращается в воду со структурой льда. И она уже не во власти незыблемых законов физики — все ее свойства коренным образом меняются. Диэлектрическая проницаемость, например, уменьшается в десять раз, а теплопроводность возрастает в семьдесят раз и тому подобное.
Любая живая клетка имеет наружную и внутреннюю биологические мембраны. Это как бы избирательно проницаемая стенка, ограждающая содержимое клетки, ее органоиды от повреждения. На поверхности биологических образований молекулы воды подвергаются структурно -функциональной упорядоченности, образуют так называемую клатратную пленку — кристаллогидрат со строго ориентированными дипольными моментами молекул воды.
В самой клатратной пленке, размещенной, к примеру, на поверхности клеточной мембраны, процессы обмена между молекулами воды осуществляются с частотой десять тысяч раз в секунду, в то время как с окружающей объемной водой молекулы Н2О меняются местами с частотой в два раза меньшей.
Это приводит к тому, что растворенным в воде примесям термодинамически невыгодно находиться в клатратных слоях воды, поэтому они предпочитают объемную воду.
Итак, будучи связанной с живой материей и защищая ее, клатраты сами защищены невидимым барьером от разрушающего действия на них объемной воды с растворенными в ней вредными и ядовитыми веществами. И чем толще и крепче клатратная прослойка, тем более стабильны термодинамические и биологические условия функционирования отдельной молекулы и клетки организма.
В связанной воде все молекулы Н2О имеют по четыре водородные связи и обеспечивают оптимальную скорость миграции протонов и электронов -эту основу обмена веществ в живых системах.
Основа структуры всех биомолекул — водородные связи. Водородные связи биомолекул и воды, по Сент-Дьердьи, образуют матрицу жизни, по которой движутся в процессе обмена веществ протоны и электроны.
Водородные связи — не только матрица, но и существенный элемент в строительстве всего живого. Все сказанное выше, говорит о том, что обыкновенная вода — самое необыкновенное вещество в природе.
Обнаружена и изучается универсальная система водно-структурной регуляции жизненными процессами. Структура воды и растворенные в ней вещества (анионы и катионы) определяют и регулируют строение и функции макромолекул клетки и низкомолекулярных биорегуляторов, сборку и функционирование организмов и клеток, тканей, органов и систем органов, наконец, целого организма.
Она действует как на субмолекулярном и молекулярном, так и на более высоких уровнях организации живой материи, вплоть до биосферного . Она определяет миграцию протонов и электронов в клетках, структуру мембран, функции ДНК, РНК, белков, низкомолекулярных регуляторов, сборку клеточных структур, оплодотворение, эмбриональное развитие, зрелое функционирование организма, его управляющие, регуляторные и гомеостатические системы, его старение и смерть.
Важным элементом системы водно-структурной регуляции является соотношение пара- и ортоводы. Гипотезу об этом развивает в своей содержательной книге Б.З.Фрадкин. Автор книги «Белые пятна безбрежного океана» Б.Э.Фрадкин в 1976 году писал о загадках воды: «Мы вправе рассматривать воду как необъятную самостоятельную область познания — безбрежный океан, усыпанный белыми пятнами загадок. И едва удается раскрыть одну загадку, как появляется две, десять новых, еще более невероятных».
Учитывая огромную роль воды в жизни человечества и отмечая пуск нового водопровода, жители города Новороссийска в 1974 году, как сообщала газета “Известия” 24 марта 1974 года, разработали памятник воде. Если он был воздвигнут, то этим актом люди выразили свое преклонение перед этим чудом природы — обыкновенной и вместе с тем необыкновенной водой.
СПИСОК ЛИТЕРАТУРЫ
1. Арабаджи В. И. Загадки простой воды. - М.: «Знание», 2003г.
2. Ахматов М.В. Вода, которую мы пьём. - М.: 2006г.
3. Петрянов И.В. Самое необыкновенное вещество в мире - М.: «Педагогика», 2005г.
superbotanik.net
Реферат - Аномалия воды - Химия
Вода в химииВ периодической системе элементов Д.И. Менделеева кислород образует отдельную подгруппу. Она так и называется: подгруппа кислорода.
Входящие в нее кислород, сера, селен и теллур имеют много общего в физических и химических свойствах. Общность свойств прослеживается, как правило, и для однотипных соединений, образованных членами подгруппы. Однако для воды характерно отклонение от правил.
Ч/>то определяет физические свойства воды?
Из самых легких соединений подгруппы кислорода (а ими являются гидриды) вода – легчайшее. Физические характеристики гидридов, как и других типов химических соединений, определяются положением в таблице элементов соответствующей подгруппы. Так, чем легче элемент подгруппы, тем выше летучесть его гидрида. Поэтому в подгруппе кислорода самой высокой должна быть летучесть воды – гидрида кислорода.
Смачиваемость воды
Это же свойство очень явственно проявляется и в способности воды «прилипать» ко многим предметам, то есть смачивать их. При изучении этого явления установили, что все вещества, которые легко смачиваются водой (глина, песок, стекло, бумага и др.), непременно имеют в своем составе атомы кислорода. Для объяснения природы смачивания этот факт оказался ключевым: энергетически неуравновешенные молекулы поверхностного слоя воды получают возможность образовывать дополнительные водородные связи с «посторонними» атомами кислорода. Благодаря поверхностному натяжению и способности к смачиванию, вода может подниматься в узких вертикальных каналах на высоту большую чем та, которая допускается силой тяжести, то есть вода обладает свойством капиллярности.
Капиллярность воды
Капиллярность играет важную роль во многих природных процессах, происходящих на Земле. Благодаря этому вода смачивает толщу почвы, лежащую значительно выше зеркала грунтовых вод и доставляет корням растений растворы питательных веществ. Капиллярностью обусловлено движение крови и тканевых жидкостей в живых организмах.
В чем вода противоречит химии и таблице Менделеева?
Самыми высокими оказываются у воды как раз те характеристики, которые должны были бы быть самыми низкими: температуры кипения и замерзания, теплоты парообразования и плавления.
Т/>емпературы кипения и замерзания воды
Температуры кипения и замерзания гидридов элементов кислородной подгруппы графически представлены на рис. 1.7. У самого тяжелого из гидридов h3Te они отрицательны: выше 0°С это соединение газообразно. По мере перехода к гидридам более легким (h3Se, h3S) температуры кипения и замерзания все более снижаются. Сохранись и далее эта закономерность, можно было бы ожидать, что вода должна кипеть при -70°С и замерзать при -90°C. В таком случае в земных условиях она никогда не могла бы существовать ни в твердом, ни в жидком состояниях. Единственно возможным было бы газообразное (парообразное) состояние. Но на графике зависимости температуры неожиданно резкий подъем – температура кипения воды +100°С, замерзания – 0°C. Это наглядное преимущество ассоциативности – широкий температурный интервал существования, возможность осуществить все фазовые состояния в условиях нашей планеты.
Теплота парообразования воды
Ассоциативность воды сказывается и на очень высокой удельной теплоте ее парообразования. Чтобы испарить воду, уже нагретую до 100°С, требуется вшестеро больше количества теплоты, чем для нагрева этой же массы воды на 80°С (от 20 до 100°С).
Каждую минуту миллион тонн воды гидросферы испаряется от солнечного нагрева. В результате в атмосферу постоянно поступает колоссальное количество теплоты, эквивалентное тому, которое бы вырабатывали 40 тысяч электростанций мощностью 1 млрд. киловатт каждая.
Температура плавления воды
При плавлении льда немало энергии уходит на преодоление ассоциативных связей ледяных кристаллов, хотя и вшестеро меньше, чемпри испаренииводы. Молекулы Н2O фактически остаются в той же среде, меняется лишь фазовое состояние воды.
Удельная теплота плавления льда более высокая, чем у многих веществ, она эквивалентна расходу количества теплоты при нагреве того же количества воды на 80°С (от 20 до 100°С).
При замерзании воды соответствующее количество теплоты поступает в окружающую среду, при таянии льда – поглощается. Поэтому ледяные массы, в отличие от масс парообразной воды, являются своего рода поглотителями тепла в среде с плюсовой температурой.
Использование аномальных свойств воды
Аномально высокие значения удельной теплоты парообразования воды и удельной теплоты плавления льда используются человеком в производственной деятельности. Знание природных особенностей этих физических характеристик иногда подсказывает смелые и эффективные технические решения. Так, воду широко применяют в производстве как удобный и доступный охладитель в самых разнообразных технологических процессах. После использования воду можно возвратить в природный водоем и заменить свежей порцией, а можно снова направить на производство, предварительно охладив в специальных устройствах – градирнях.
На многих металлургических производствах Донбасса в качестве охладителя используют не холодную воду, а кипяток. Охлаждение идет за счет использования теплоты парообразования – эффективность процесса повышается в несколько раз, к тому же отпадает надобность в сооружении громоздких градирен. Конечно, кипяток-охладитель используют там, где нужно охладить объекты, нагретые выше 100°C. А вот пример совсем из другой области человеческой деятельности – сельского хозяйства, садоводства. Когда поздней весной внезапные ночные заморозки угрожают цветущим плодовым деревьям, опытные садоводы находят выход, кажущийся совершенно неожиданным: они проводят дождевание сада. Пелена мельчайших водных брызг окутывает замерзающие деревья. Капельки воды покрывают лепестки цветов. Превращаясь в лед, вода надевает на цветы ледяную шубу, отдавая при этом им свое тепло (335 Дж от 1 г замерзающей воды).
Аномальная теплоемкость воды
Широкое применение воды в качестве охладителя объясняется не только и не столько ее доступностью и дешевизной. Настоящую причину нужно тоже искать в ее физических особенностях. Оказывается, вода обладает еще одной замечательной способностью – высокой теплоемкостью. Поглощая огромное количество теплоты, сама вода существенно не нагревается. Удельная теплоемкость воды в пять раз выше, чем у песка, и почти в десять раз выше, чем у железа.
Способность воды накапливать большие запасы тепловой энергии позволяет сглаживать резкие температурные колебания на земной поверхности в различные времена года и в разное время суток. Благодаря этому вода является основным регулятором теплового режима нашей планеты.
Вода и температура живых существ
Интересно, что теплоемкость воды аномальна не только по своему значению. Удельная теплоемкость разная при различных температурах, причем характер температурного изменения удельной теплоемкости своеобразен: она снижается по мере увеличения температуры в интервале от 0 до 37°С, а при дальнейшем увеличении температуры – возрастает. Минимальное значение удельной теплоемкости воды обнаружено при температуре 36,79°С, а ведь это нормальная температура человеческого тела! Нормальная температура почти всех теплокровных живых организмов также находится вблизи этой точки.
Оказалось, что при этой температуре осуществляются и микрофазовые превращения в системе «жидкость – кристалл», то есть «вода – лед». Установлено, что при изменении температуры от 0 до 100°С вода последовательно проходит пять таких превращений. Назвали их микрофазовыми, так как протяженность кристаллов микроскопична, не более 0,2...0,3 нм. Температурные границы переходов – 0, 15, 30, 45, 60 и 100°С.
Температурная область жизни теплокровных животных находится в границах третьей фазы (30...45°С). Другие виды организмов приспособились к иным температурным интервалам. Например, рыбы, насекомые, почвенные бактерии размножаются при температурах, близких к середине второй фазы (23...25°С), эффективная температура весеннего пробуждения семян приходится на середину первой фазы (5...10°С).
Характерно, что явление прохождения удельной теплоемкости воды через минимум при температурном изменении обладает своеобразной симметрией: при отрицательных температурах также обнаружен минимум этой характеристики. Он приходится на – 20°С.
Если вода ниже 0°С сохраняет не замерзшее состояние, например, будучи мелкодисперсной, то около -20°С резко увеличивается ее теплоемкость. Это установили американские ученые, исследуя свойство водных эмульсий, образованных капельками воды диаметром около 5 микрон.
Водородная связь
Помимо различных гетерополярных и гомеополярных связей, существует еще один особый вид связи, который в последние два десятилетия привлекает все большее внимание химиков. Это так называемая водородная связь. Оказалось, что атом водорода может образовывать связь между двумя электроотрицательными атомами (F, О, N, реже Сl и S). Известны случаи, когда эту связь образует водородный атом, связанный с атомом углерода в соединениях типа НСХ3, где X — электроотрицательный атом или группа (например, в HCN, фторуглеводородах). Хотя в настоящее время природа водородной связи еще до конца не выяснена, однако определённое представление о ней уже можно составить.
Водородная связь образуется между электроотрицательными атомами, из которых хотя бы один имеет свободную электронную пару, например:
В/>одородная связь — глобальное явление, охватывающее всю химию
1. Сущность и природа водородной связи Первую научную трактовку водородной связи дали в 1920 году В. Латимер и В.Родебуш, работавшие в лаборатории Г. Льюиса, основоположника учения о ковалентной связи, автора теории кислот и оснований и плодотворной в органической химии концепции обобщенной электронной пары. Причину особых физических и химических свойств воды авторы объясняли наличием водородной связи, сущность которой состоит во взаимодействии атома водорода одной молекулы с электронной парой атома кислорода другой молекулы. При этом атом водорода становится одновременно связанным с двумя атомами кислорода ковалентной и водородной связью:
З/>а все последующее время вплоть до наших дней не изменился принципиальный подход к трактовке водородной связи, концепция неподелённого протона осталась незыблемой. Длительные и интенсивные исследования позволили уточнить влияние структуры соединений на склонность к образованию Н-связей, внесена определенная ясность в электронную природу последних, найдены надежные методы их идентификации. А главное — сделаны широкие обобщения по оценке влияния Н-связей на физические и химические свойства веществ. Бутлеровский тезис “структура определяет свойства” раскрывается с учетом возможности образования Н-связи и ее вклада в конкретные свойства. Ниже представлен итоговый материал по изучению вопросов, связанных с проблемой водородной связи.
По современной терминологии, образование водородной связи наступает при взаимодействии протонодонора (кислоты Бренстеда, электроноакцептора) с протоноакцептором (основанием, электронодонором). Для схематичного представления обсуждаемых процессов молекулу протонодонора обозначим А-Н (а для случаев, когда необходимо указать природу атома, ковалентно связанного с водородом, R-X-H). Протоноакцептор обозначим: В (символическое обозначение как основания в целом, так и атома с неподеленной парой электронов) или B-Y. С учетом принятой символики водородную связь можно представить как невалентное взаимодействие между группой Х-Н одной молекулы и атомом В другой, в результате которого образуется устойчивый комплекс А-Н…В с межмолекулярной водородной связью, в котором атом водорода играет роль мостика, соединяющего фрагменты А и В. Отметим, что до настоящего времени нет однозначного подхода, какую конкретно связь называть водородной. Большинство авторов к понятию водородной связи относят дополнительное взаимодействие, которое возникает между атомом водорода и электронодонором В, то есть связь Н…В. Другие авторы к понятию водородной связи относят всю цепочку Х-Н…В, то есть связь между атомами Х и В через водородный мостик. Ориентируясь на большинство, характеристики водородной связи (длина, энергия) будем относить к связи Н…В, сознавая, что образование последней не может не сказаться на состоянии ковалентной связи Х-Н.
На ранних этапах изучения водородной связи полагали, что водородный мостик образуется только между атомами с высокой электроотрицательностью (F, O, N). В последние десятилетия, когда в руках исследователей появилось более совершенное оборудование, круг атомов — партнеров по водородному связыванию значительно расширен (Cl, S и некоторые другие). В качестве атома Х может фигурировать любой атом, более электроотрицательный по сравнению с атомом водорода и образующий с последним обычную химическую связь (например, атом углерода). В роли акцептора атома водорода могут выступать как атомы с неподеленными парами электронов (в отдельных случаях даже аргон и ксенон), так и соединения, имеющие π-связи.
Такие взаимодействия наблюдаются в растворах кислот. Когда же продукт А-Н не обладает выраженной кислотностью или при отсутствии соответствующего растворителя процесс кислотно-основного взаимодействия останавливается на стадии молекулярного комплекса.
Несмотря на всеобщее признание Н-связей, в литературе так и не сформировалось единой точки зрения на природу этого явления. Вопрос до сих пор продолжает оставаться дискуссионным. Прежде чем изложить современный взгляд на природу сил, обусловливающих образование водородных связей, отметим наиболее существенные экспериментальные факты, сопровождающие этот процесс.
I. При образовании водородных связей выделяется теплота — термохимическая мера энергии Н-связи. Эту характеристику используют для калибровки спектральных методов изучения водородных связей.
II. Расстояние между соседними атомами, участвующими в образовании водородной связи, значительно меньше суммы их ван-дер-ваальсовых радиусов. Так, в воде расстояние между атомами кислорода в системе О-Н…О составляет 0,276 нм. Если принять, что длина ковалентной связи О-Н равна 0,1 нм, то длина связи Н…О составит 0,176 нм, то есть она значительно (примерно на 70%) длиннее ковалентной связи между этими атомами. Тем не менее связь Н…О оказывается значительно короче суммы ван-дер-ваальсовых радиусов, составляющих для водорода и кислорода соответственно 0,12 и 0,14 нм. Последнее обстоятельство является одним из критериев, указывающих на образование между молекулами водородных связей.
III. Водородная связь увеличивает длину связи Х-Н, что приводит к смещению соответствующей полосы валентных колебаний в ИК-спектре в сторону более низких частот. Метод ИК-спектроскопии является главным методом изучения водородной связи.
IV. При образовании водородной связи полярность связи Х-Н возрастает, что приводит к повышению дипольного момента молекулярного комплекса в сравнении с расчетными данными, полученными путем векторного сложения диполей молекул R-X-H и B-Y.
V. Протоны, участвующие в водородной связи, характеризуются более низкой электронной плотностью, поэтому они деэкранируются, что приводит к существенному смещению соответствующих резонансных сигналов в спектрах ЯМР 1Н в слабое поле. Протонный магнитный резонанс наряду с ИК-спектрами является наиболее чувствительным к образованию Н-связи.
VI. Для межмолекулярных водородных связей обнаружено смещение кислотно-основного равновесия молекулярный комплекс ионная пара вправо при повышении полярности растворителя.
Кроме указанных фиксируются и другие структурные и спектроскопические особенности водородных связей, которые используются, с одной стороны, для идентификации последних, а с другой – в расшифровке их электронной природы. Так как водородная связь возникает только в том случае, если атом водорода связан с электроотрицательным атомом, то ранее предполагалось, что природа водородной связи сводится к диполь-дипольному взаимодействию типа R-X — d-H+ d…B — d-Y, которое еще называют электростатическим взаимодействием. Такое предположение подкрепляется тем фактом, что наиболее прочные водородные связи образуются атомами водорода, связанными с наиболее электроотрицательными элементами. Более высокую прочность водородной связи по сравнению с неспецифическим диполь-дипольным взаимодействием (примерно в 10 раз) можно объяснить маленьким размером атома водорода, благодаря чему он может ближе подойти к другому диполю. Дипольная модель объясняет также линейную геометрию водородной связи, так как при линейном расположении атомов силы притяжения максимальны, а силы отталкивания минимальны.
Однако не все экспериментальные факты, фиксируемые при изучении водородных связей, можно объяснить исходя лишь из диполь-дипольного взаимодействия. Не удается заметить никакой закономерной зависимости между энергией водородной связи и дипольным моментом или поляризуемостью взаимодействующих молекул. Небольшая длина водородных связей свидетельствует о существенном перекрывании ван-дер-ваальсовых радиусов. А простая электростатическая модель не учитывает перекрывания волновых функций, перераспределения электронной плотности при сближении молекул. Решить эти вопросы можно, допустив, что водородная связь носит частично ковалентный характер за счет донорно-акцепторного взаимодействия электронодонора В с электоноакцептором А-Х-Н. Повышение электронной плотности на атоме Х происходит через посредника — водородный мостик. При этом допускается частичное заполнение несвязывающей орбитали атома водорода.
Таким образом, Н-связи образуются в результате одновременного проявления следующих сил: электростатического взаимодействия и переноса заряда. Квантово-химические расчеты показывают, что основной вклад вносит первая составляющая. В водородных связях, значительно отличающихся по энергетическим характеристикам, соотношение этих вкладов также изменяется. Есть и другие объяснения природы водородной связи, не получившие общего признания.
Заканчивая рассмотрение вопроса о природе Н-связи, можно отметить, что химику-практику легче признать существование этого феномена, чем объяснить его природу. Многообразие водородных связей является причиной отсутствия единого подхода к их трактовке. Трудно даже представить себе, что природу водородных связей в дифторид-анионе (FHF)- и в системе С-H…Cl можно объяснить с единых позиций. Одна из трудностей заложена в природе главного действующего лица — атома водорода, который не может иметь на внешней оболочке больше двух электронов. Поэтому концепция двухкоординированного атома водорода воспринимается неоднозначно. Скорее всего, единого подхода к объяснению природы Н-связи и не будет. Будет создана какая-то обобщающая модель, учитывающая вклад разных по природе сил, то есть значительно расширенный вариант того, что мы имеем в настоящее время.
2. Определение водородной связи
Связь, которая образуется между атомов водорода одной молекулы и атомом сильно электроотрицательного элемента (O, N, F) другой молекулы, называется водородной связью.
Может возникнуть вопрос: почему именно водород образует такую специфическую химическую связь?
Это объясняется тем, что атомный радиус водорода очень мал. Кроме того, при смещении или полной отдаче своего единственного электрона водород приобретает сравнительно высокий положительный заряд, за счет которого водород одной молекулы взаимодействует с атомами электроотрицательных элементов, имеющих частичный отрицательный заряд, выходящий в состав других молекул (HF, h3O, Nh4).
Рассмотрим некоторые примеры. Обычно мы изображаем состав воды химической формулой h3O. Однако это не совсем точно. Правильнее было бы состав воды обозначать формулой (h3O)n, где n = 2,3,4 и т. д. Это объясняется тем, что отдельные молекулы воды связаны между собой посредством водородных связей.
Водородную связь принято обозначать точками. Она гораздо более слабая, чем ионная или ковалентная связь, но более сильная, чем обычное межмолекулярное взаимодействие.
Наличие водородных связей объясняет увеличения объема воды при понижении температуры. Это связано с тем, что при понижении температуры происходит укрепление молекул и поэтому уменьшается плотность их «упаковки».
При изучении органической химии возникал и такой вопрос: почему температуры кипения спиртов гораздо выше, чем соответствующих углеводородов? Объясняется это тем, что между молекулами спиртов тоже образуются водородные связи.
Повышение температуры кипения спиртов происходит также вследствие укрупнения их молекул. Водородная связь характерна и для многих других органических соединений (фенолов, карбоновых кислот и др.). Из курсов органической химии и общей биологии известно, что наличием водородной связи объясняется вторичная структура белков, строение двойной спирали ДНК, т. е. явление комплементарности.
3. Виды водородной связи
Существует два вида водородной связи внутримолекулярная и межмолекулярная водородные связи. Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений. Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца. Так, муравьиная кислота и в жидком и в газообразном состоянии существует в виде димеров:
/>
а газообразный фтороводород содержат полимерные молекулы, включающие до четырех частиц HF. Прочные связи между молекулами можно найти в воде, жидком аммиаке, спиртах. Необходимые для образования водородных связей атомы кислорода и азота содержат все углеводы, белки, нуклеиновые кислоты. Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в воде. Не последнюю роль в этом играют водородные связи, образующиеся в растворе между молекулами воды и многочисленными OH-группами углеводов.
4. Энергия водородной связи
Существуют несколько подходов к характеристике водородных связей. Основной критерий – это энергия водородного связывания (R–X–H…B–Y), которая зависит как от природы атомов Х и В, так и общего строения молекул RXH и BY. Большей частью она составляет 10–30 кДж/моль, но в некоторых случаях может достигать 60–80 кДж/моль и даже выше. По энергетическим характеристикам различают сильные и слабые водородные связи. Энергия образования сильных водородных связей составляет 15–20 кДж/моль и более. К ним относят связи О–H…О в воде, спиртах, карбоновых кислотах, связи О–Н…N, N–H…O и N–H…N в соединениях, содержащих гидроксильные, амидные и аминные группы, например в белках. Слабые водородные связи имеют энергию образования менее 15 кДж/моль. Нижним пределом энергии водородной связи является 4–6 кДж/моль, например связи С–Н…О в кетонах, эфирах, водных растворах органических соединений.
Наиболее прочные водородные связи образуются в случаях, когда маленький водород (жесткая кислота) одновременно связан с двумя малыми по размеру сильно электроотрицательными атомами (жесткие основания). Орбитальное соответствие обеспечивает лучшее кислотно-основное взаимодействие и приводит к образованию более прочных водородных связей. То есть образование сильных и слабых водородных связей можно объяснить с позиций концепции жестких и мягких кислот и оснований (принцип Пирсона, принцип ЖМКО).
Энергия Н-связи возрастает с увеличением положительного заряда на атоме водорода связи Х-Н и с повышением протоноакцепторности атома В (его основности). Хотя образование водородной связи рассматривается с позиций кислотно-основного взаимодействия, однако энергия образования Н-комплексов нестрого коррелируется как со шкалой кислотности, так и со шкалой основности.
Подобная картина наблюдается и в случае меркаптанов и спиртов. Меркаптаны являются более сильными кислотами, чем спирты, однако более прочные ассоциаты образуют спирты. Причина таких кажущихся аномалий вполне объяснима, если учесть, что кислотность определятся величиной pКа по результатам полной схемы кислотно-основного взаимодействия (до образования сольватированных ионов), а образование молекулярного комплекса с Н-связью только первый этап этого процесса, не предусматривающий разрыва связи Х–Н. В инертных растворителях кислотно-основное взаимодействие обычно останавливается на стадии Н-комплекса.
Что касается основности органических соединений и их способности принимать участие в образовании Н-связи, то здесь тоже наблюдаются большие различия. Так, при одной и той же способности к образованию водородных связей степень основности аминов на 5 порядков выше, чем у пиридинов, и на 13 порядков выше, чем у замещенных карбонильных соединений.
На основе экспериментальных данных установлена линейная корреляция между степенью переноса заряда и энергией межмолекулярных Н-связей, являющаяся важным доводом в пользу донорно-акцепторной природы последних. Существенное влияние на образование водородной связи могут оказывать стерические факторы. Например, орто-замещенные фенолы менее склонны к самоассоциации, чем соответствующие мета- и пара-изомеры, полностью отсутствует ассоциация у 2,6-ди-трет.-бутилфенола. С повышением температуры количество молекулярных комплексов в смеси уменьшается, и они значительно реже встречаются в газовой фазе.
В начале курсовой было отмечено, что водородная связь занимает промежуточное положение между истинной (валентной) химической связью и слабым межмолекулярным взаимодействием. Куда ближе? Ответ неоднозначный, так как диапазон колебаний энергий Н-связей довольно широк. Если же речь идет о сильных водородных связях, способных оказывать существенное влияние на свойства веществ, то они ближе к истинным химическим связям. И это определяется не только довольно высокой энергией Н-связи, но и тем, что она локализована в пространстве, водородный мостик имеет своих “персональных” партнеров. Направление действия водородной связи также фиксировано, хотя и не столь жестко, как для истинных химических связей.
5. Водородные связи с свойства органических соединений
Водородная связь возникает при взаимодействии кислотных Х–Н и основных В групп, принадлежащих одной или разным молекулам. При объединении одинаковых молекул образуются ассоциаты, объединение разных молекул принято называть молекулярными комплексами (Н-комплексами). Такие взаимодействия составляют самый обширный класс Н-связей, называемых межмолекулярными водородными связями. Межмолекулярные взаимодействия не ограничиваются образованием бинарных комплексов, а могут приводить к структурам со множественными связями (вода, фтористый водород, спирты, фенолы, амиды, полипептиды, белки). Межмолекулярные водородные связи могут приводить к образованию цепей, колец или пространственных сеток. Аналогичные образования сохраняются и в кристаллах.
Если Н-связывание наступает в результате взаимодействия кислотного и основного фрагментов внутри одной молекулы, то образующиеся связи называют внутримолекулярными. Соединения с такими связями составляют другую большую группу соединений с водородной связью. Естественно, что образование внутримолекулярных водородных связей возможно, если структура молекулы допускает пространственное сближение фрагментов Х–Н и В до длины водородной связи. Возможность образования внутримолекулярной водородной связи не является препятствием для образования и межмолекулярных водородных связей. В качестве примера рассмотрим изомерные орто- и парагидроксибензальдегиды. Салициловый альдегид (орто-изомер) способен к образованию как внутри-, так и межмолекулярных водородных связей, тогда как для пара-изомера положение взаимодействующих групп допускает образование только межмолекулярных водородных связей
/>/>
Экспериментально довольно легко отличить внутримолекулярную водородную связь от межмолекулярной. Если спектрально фиксируется образование Н-связей, а признаков ассоциации нет, это верное указание на внутримолекулярный характер водородной связи. Кроме того, межмолекулярная Н-связь (и ее спектральное проявление) исчезает при низкой концентрации вещества в нейтральном растворителе, тогда как внутримолекулярная Н-связь в этих условиях сохраняется.
Водородные связи влияют на перераспределение электронной плотности в молекулах, что не может не отразиться на свойствах веществ. В случае слабых водородных связей изменение электронной плотности протекает в основном в пределах фрагмента Х–Н…В. С увеличением энергии водородной связи перераспределение электронной плотности затрагивает все атомы молекул, входящих в молекулярный комплекс, что в конечном итоге приводит к глубоким изменениям физических и химических свойств веществ. На свойства органических соединений оказывают значительное влияние как внутри-, так и межмолекулярные водородные связи. Влияние последних, особенно на физические свойства, является более существенным, так как межмолекулярные взаимодействия приводят к увеличению молекулярной массы со всеми вытекающими последствиями.
Теперь попытаемся ориентировочно оценить, насколько широко представлены водородные связи в органической химии. Все органические соединения за самым редким исключением содержат водород, то есть являются кислотами Бренстеда, а наиболее часто входящие в их состав элементы-органогены (O, N, S, галогены) содержат неподеленные пары электронов и могут выступать в качестве основных центров. Учитывая отмеченное, можно сказать, что большинство органических соединений потенциально способно к образованию водородных связей. По структурной формуле (природа взаимодействующих групп и их взаимное расположение) можно предсказать силу водородных связей и их характер (внутри- или межмолекулярные). При оценке взаимного влияния атомов в молекулах обязательно учитываются возможность образования водородных связей и их последующее влияние на скорость, механизм и направление реакций. Оценить влияние среды (растворителя) на ход химического процесса часто становится возможным лишь с учетом образования водородных связей. Таким образом, подготовка грамотного химика невозможна без овладения всем комплексом вопросов, связанных с водородной связью.
Рассмотрим несколько наиболее характерных примеров влияния водородных связей на свойства органических соединений. Прежде всего это так называемые прототропные процессы – превращения, связанные с переносом протона. Известно, что енольные структуры (гидроксильная группа находится при углероде с кратной связью =С–ОН) являются неустойчивыми и в органической химии часто такие формулы берут в квадратные скобки как указание на их нереальность, гипотетичность. В то же время β-дикетоны и другие 1,3-дикарбонильные соединения способны существовать в двух формах: кетонной и енольной. Для ацетоуксусного эфира эти превращения могут быть представлены схемой
О/>бразование энергетически менее выгодной енольной формы объясняется как формированием системы сопряженных связей С=С–С=О, что всегда является стабилизирующим фактором, так и тем обстоятельством, что между енольным гидроксилом и карбонильным кислородом образуется внутримолекулярная водородная связь, понижающая свободную энергию енольной формы как путем “закрепления” атома водорода у более электроотрицательного элемента, так и в результате удлинения цепи сопряжения (Н-связь включена в круговую цепь сопряжения). С учетом водородных связей не только объясняют реальность енольной структуры, но и количество этой формы в таутомерной системе. На состояние кето-енольного равновесия большое влияние оказывает природа растворителя. Максимальное количество енольной формы отмечается в нейтральных неполярных растворителях (углеводороды). В водных растворах количество енольной формы незначительно, так как вода конкурентно образует с карбонильным кислородом межмолекулярные водородные связи, разрушая стабилизирующие енольную форму внутримолекулярные водородные связи.
Карбоновые кислоты, как и спирты, могут участвовать в образовании Н-связей как в роли Н-доноров, так и Н-акцепторов. В первом случае кислотность снижается, во втором возрастает. Это ярко проявляется при ионизации двухосновных кислот: первая константа диссоциации (K1) аномально велика, а вторая (K2) аномально мала. Для объяснения наблюдаемых экспериментальных результатов кроме электронных эффектов большая роль придается вкладу Н-связей. В исходной структуре Н-связь сильно активирует карбоксильную группу, выступающую в роли Н-акцептора. В образовавшемся на первой стадии диссоциации моноанионе образуется прочная внутримолекулярная Н-связь, резко снижающая кислотность второго карбоксила:
/> Для карбоновых кислот характерно образование Н-комплексов и ассоциатов псевдоциклической структуры:
/> Межмолекулярные связи, возникающие между молекулами карбоновых кислот, настолько прочны, что даже в газообразном состоянии димерные структуры частично сохраняются. Кстати, образование димера карбоновой кислоты помогает дать ответ на давний вопрос, что в большей степени определяет прочность водородной связи – кислотность группы Х–Н или основность фрагмента В. Уксусная кислота (pKa= 4,7) по кислотности на несколько порядков уступая трихлоруксусной (pKa= 0,6), тем не менее образует более прочный димер. Основность протоноакцептора имеет приоритет перед кислотностью протонодонора.
И/>звестно, что геминальные дигидроксипроизводные являются нестабильными соединениями – дегидратируясь легко превращаются в соответствующие альдегиды или кетоны. Хлоральгидрат является одним из немногих примеров, когда структура гем-диола является стабильной. И причину этого объясняют как сильным отрицательным индукционным эффектом (-I-эффект) трихлорметильной группы, так и наличием внутримолекулярных Н-связей:
Не имея возможности остановиться на других примерах влияния водородной связи на свойства органических соединений, приведем таблицу сравнительных характеристик проявления меж- и внутримолекулярных Н-связей (табл. 1 (по [1])).
/> Образование внутри- и межмолекулярных водородных связей может существенно влиять на ход и скорость химических реакций. К сожалению, несмотря на значительное количество работ, посвященных этому вопросу, широких обобщений, которые имели бы предсказательную силу, не последовало. В самых общих чертах показано, что скорость реакций может уменьшаться или увеличиваться в зависимости от того, как при образовании Н-связи будет перераспределяться электронная плотность в реакционных центрах молекулы. Такие вопросы, как природа промежуточных продуктов или активированного комплекса, изменение термодинамических функций, влияние соседних групп, не получили должного развития. Более определенно дана оценка роли растворителя.
Известно много эмпирических подходов. Так, в реакциях алкилирования соединений, содержащих связи О–Н, S–H, N–H, введение в реакционную среду фторида калия (фторид-анион F− является самым эффективным протоноакцептором) значительно увеличивает скорости реакций и выходы продуктов алкилирования. Большая роль водородным связям отводится в реакциях, проводимых в растворителях, способных образовывать Н-связи как с исходными соединениями, так и с продуктами их взаимодействия
www.ronl.ru
Дипломная работа - Аномальные свойства воды
Вопрос № 21
Аномальные свойства воды
Огромная роль воды в жизни человека и природы послужила причиной того, что она была одним из первых соединений, привлекших внимание ученых. Глубокие философские обобщения привели человечество к необходимости познания физической и химической природы воды. Тем не менее, изучение воды еще далеко не закончено.
Раскрыть ее секреты до конца еще не удалась никому. Человечество упорно в длительном борении за истину, объединяя знания поколений, постепенно открывало все новые и новые специфические особенности этой загадочной жидкости, «сока Жизни».
В 1783 году выдающиеся экспериментаторы Генри Кавендиш (1731-1810) и Антуан Лавуазье (1743-1794) установили, что вода состоит из двух газов: водорода и кислорода и соотношение их выражается формулой Н2 0.
Все достижения современной цивилизации во многом обусловлены использованием и изучением воды. Достаточно назвать водяной пар и паровую машину Джемса Уатта.
Исследование химического состава воды привело к открытию Генри Кавендишем водорода “горячего воздуха”, рождающего воду, к созданию Джонам Дальтонам атомной теории вещества.
Открытие химического состава молекулы воды послужило началом бурному росту науки о биологической роли воды, об ее лечебно-профилактическом использовании.
Вода выступала катализаторам развития многих фундаментальных научных дисциплин. Вспомним также о ее причастности к ядерной физике в виде тяжелой и сверхтяжелой воды. В настоящее время наступила эра всеобщего изучения роли воды в нормальных и патологических процессах жизни, которую можно назвать эрой водной биологии и медицины.
Современному представлению о строении молекулы воды и водных растворов предшествовал бурный период научных и экспериментальных изысканий, подчас противоречивых и трудно воспроизводимых.
Это и химическая теория Д.И. Менделеева, и теория непрерывности газового и жидкого состояния Ван-дер-Ваальса, и гидрольная теория У. Рамзая и Дж. Шильдса, и рентгенографический метод исследования Лауэ, и постулат Дебая о близости структуры жидкого состояния воды к твердой фазе на границе температурного раздела лед-вода и ряд других теорий. Однако, в конце концов основные черты строения молекулы воды были расшифрованы. Как же сейчас мы представляем себе строение воды?
Начнем с элементарного — со строения молекулы воды, состоящей из двух атомов водорода (Н1 ) и одного атома кислорода (О18 ). Оказывается, все многообразие свойств воды и необычность их проявления, в конечном счете, определяются физической природой этих атомов и способом их объединения в молекулу. В отдельно рассматриваемой молекуле воды ядра водорода и кислорода так расположены друг относительно друга, что образуют как бы равнобедренный треугольник — со сравнительно крупным ядром кислорода в вершине и двумя мелкими ядрами водорода у основания (рис. 1, а).
Puc. 1. Строение молекулы воды:
а) — угол между связями О-Н, б) — структура электронного облака молекулы, в) — расположение полюсов заряда.
Электронное облако молекулы, образованное пятью парами электронов, схематически распределено так (рис. 1, б), что внутренняя пара окружает ядро кислорода, две внешние пары неравномерно поделены между ядрами кислорода и водорода, тяготея больше к кислороду, а остальные две пары кислород не делит с водородом, и их заряды остаются частично нескомпенсированными. Таким образом, в молекуле воды оказывается четыре полюса зарядов: два отрицательных за счет избытка электронной плотности у кислородных пар электронов и два положительных — вследствие недостатка электронной плотности у несколько оголенных ядер водорода — протонов.
Эти заряды можно условно представить расположенными в вершинах частично искаженного тетраэдра (рис. 1, в). Вследствие такой асимметричности распределения электрических зарядов молекула воды обладает ярко выраженными полярными свойствами: она является диполем с высоким дипольным моментом — 1,87 Дебая. На рис. 2 показана схема образования молекулы воды.
Рис. 2. Образование молекулы воды.
Как видно на рис. 2, у одного атома кислорода и двух атомов водорода (а) появляются общие электроны, образующие прочную ковалентную связь (б). Если два протона водорода молекулы воды вращаются в одну сторону, то вода называется параводой, в разные стороны — ортоводой.
В обыкновенной воде 3/4 ортоводы. Ряд ученых предполагает, что соотношение орто- и параводы в клетке имеет регуляторное значение. Если строение молекулы воды в общих чертах установлено, то структура воды по-прежнему остается загадкой.
Исследуя воду и, особенно ее водные растворы, ученые раз за разом убеждались, что вода обладает ненормальными — аномальными свойствами, присущими только ей, ее Величеству — Воде, подарившей нам Жизнь и возможность мыслить. Мы даже и не подозреваем, что столь привычные и естественные свойства воды в природе, в различных технологиях, наконец, в обыденной жизни нашей являются уникальными и неповторимыми.
Ученые согласны в том, что вода является одним из самых трудных объектов исследования, так как, прежде всего в воде всегда есть примеси и что она обладает кооперативным характером взаимодействия ее молекул.
В рамках микроскопического подхода структура воды отличается относительно беспорядочным динамически меняющимся расположением молекул, а высокая плотность обуславливает сильное межмолекулярное взаимодействие, осуществляемое посредством водородных связей.
Таким образом, вода представляет собой сложную ассоциированную жидкость с тетраэдрической сеткой молекул, соединенных водородными связями.
В результате теплового движения молекул эта сетка подвержена спонтанной перестройке.
В трехмерной сетке водородных связей размещены флуктуационные микрообъемы молекул воды, обладающие сравнительно малой энергией теплового движения и более высокой степенью структурного упорядочения. Это — микрокластеры.
В то же время вокруг микрокластеров в макрообъеме ассоциированной среды с повышенной энергией теплового движения молекул Н2 0 наблюдается большая степень структурной беспорядочности, то есть более низкий уровень структурного упорядочения.
Вещества — аналоги воды, молекулы которых по химическому составу похожи на воду, — h3 S, h3 Se, h3 Te, то есть соединения водорода и серы, водорода и селена, водорода и теллура и так далее, при комнатной температуре находятся в газообразном состоянии. Казалось бы, вода, сохрани она такие же свойства, должна бы закипать при температуре -70°С, а превращаться в лед при -90 °С. Эти условия вряд ли бы способствовали развитию жизни на Земле, ведь она должна была бы существовать в интервале температур от -70 °С до -90 °С (рис.3). В таком холоде разве возможна жизнь?
Иначе говоря, если бы вода — гидрид кислорода Н2 О — была бы нормальным мономолекулярным соединением, таким, например, как ее аналоги по шестой группе Периодической системы элементов Д.И.Менделеева — гидрид серы h3 S, гидрид селена h3 Se, гидрид теллура h3 Te, то в жидком состоянии вода существовала бы в пределах от минус 95 °С до минус 70 °С, а не такая, какая реально существует сейчас. Нетрудно понять, что в этом случае биологической жизни на Земле не могло бы существовать. На рис.3 показаны необычные точки замерзания и кипения воды по сравнению с другими жидкостями.

Рис. 3. Аномалии точек кипения и замерзания воды по сравнению с другими соединениями водорода.
Но, к счастью для нас и для всего живого на свете вода обладает аномальными свойствами.
Вода «не признает» периодических закономерностей, характерных для бесчисленного множества соединений на Земле и в Космосе, а следует своим, еще не вполне понятным для науки законам, подарившим нам удивительный «мир Жизни».
«Ненормальные» температуры плавления (0 °С) и кипения (+100 °С) воды далеко не единственная ее аномальность.
Для всей биосферы исключительна важной особенностью воды является ее способность при замерзании увеличивать, а не уменьшать свой объем, то есть уменьшать плотность.
Действительно, при переходе любой жидкости в твердое состояние молекулы располагаются теснее, а само вещество, уменьшаясь в объеме, становится плотнее. Да, для любой из необозримо разных жидкостей, но не воды. Вода и здесь представляет исключение.
При охлаждении вода сначала ведет себя как и другие жидкости: постепенно уплотняясь, уменьшает свой объем. Такое явление можно наблюдать до +3,98 °С. Затем, при дальнейшем снижении температуры до 0 °С, вся вода замерзает и расширяется в объеме. В результате удельный вес льда становится меньше воды и лед плавает. Если бы лед не всплывал, а тонул, то все водоемы (реки, озера, моря) промерзли бы до дна, испарение бы резко сократилось, все пресноводные животные и растения погибли бы. Жизнь на Земле стала бы невозможной.
Вода — единственная жидкость на Земле, лед которой не тонет за счет того, что его объем на 1/11 больше объема воды.
Еще одно удивительное свойство воды — ее огромное поверхностное натяжение. Благодаря тому, что круглые шарики воды очень упруги, идет дождь, выпадает роса.
Что же это за удивительная сила, которая сохраняет капли росы, а поверхностный слой воды в любой лужице делает эластичным и относительно прочным?
Известно, что если стальную иголку осторожно положить на поверхность воды, налитой в блюдце, то иголка не тонет. А ведь удельная масса металла значительно больше, чем у воды. Молекулы воды связаны силой поверхностного натяжения, которая позволяет им подниматься вверх по капиллярам, преодолевая силу земного притяжения. Без этого свойства воды жизнь на Земле была бы также невозможна.
Ни одно вещества на Земле не обладает такой способностью поглощать тепло, как вода. Для превращения в пар 1г воды требуется 537 калории тепла. Конденсируясь, пар возвращает эти 537 калорий в окружающую среду.
Ни одно вещество в мире не поглощает и не отдает среде столько тепла, сколько вода. Теплоемкость воды в 10 раз больше теплоемкости стали и в 30 раз больше ртути. Вода сохраняет тепло на Земле.
С поверхности морей, океанов, суши испаряется за год 520000 кубических километров воды, которые, конденсируясь, отдают много тепла холодным и полярным регионам.
Не обладай вода такой уникальной способностью поглощать и отдавать тепло, климат Земли оказался бы непригодным для существования человека. В высоких широтах тогда царил бы нестерпимый холод, а в низких — солнце испепелило бы все живое.
Благодаря наземному Мировому океану атмосфера представляет собой надежное теплое одеяло, укрывающее тело планеты и защищающее его от космического холода. Подземный океан снабжает Землю теплом из внутренних источников планеты.
Ни одна жидкость не поглощает газы с такой жадностью, как вода. Но она их также легко отдает.
Дождь растворяет в себе все ядовитые газы атмосферы. Вода — ее мощный природный фильтр, очищающий атмосферу от всех вредных и ядовитых газов.
Еще одно удивительное свойство воды проявляется при воздействии на нее магнитного поля. Вода, подвергнутая магнитной обработке, меняет растворимость солей и скорость химических реакций.
Магнитная вода не только не дает накипи в котлах, но и срывает ранее образовавшиеся отложения, повышает прочность бетона, ускоряет его застывание, увеличивает процент выхода обогащенной руды.
Ряд удивительных свойств воды связан с ее теплоемкостью. Легче всего вода нагревается и быстрее всего охлаждается в своеобразной “температурной яме”, соответствующей +37 °С, температуре человеческого тела (рис. 4).
Как видно из рис.4, теплоемкость воды своих минимальных значений достигает около +37 °С. Это нормальная температура тела человека. Именно при температуре 36,6-37оС сложнейшие реакции обмена веществ в организме человека наиболее интенсивны. Значит, при этой температуре организм человека находится в наивыгоднейшем энергетическом состоянии.

Рис. 4. Температурная зависимость удельной теплоемкости воды.
Вода в организме человека составляет 70-90%. от веса тела. Не обладай вода такой теплоемкостью, как сейчас, обмен веществ в теплокровных и холоднокровных организмах был бы невозможен.
В клетках живых организмов различают “объемную” и “связанную” воду. Первая — вода, с которой мы имеем дело в повседневной жизни. В ней растворен цитозоль клетки. Под “связанной” водой мы понимаем воду, связанную с биологическими молекулами, мембранами.
В живых клетках обычная вода, будучи связанной с мембранами, неизвестным образом превращается в воду со структурой льда. И она уже не во власти незыблемых законов физики — все ее свойства коренным образом меняются. Диэлектрическая проницаемость, например, уменьшается в десять раз, а теплопроводность возрастает в семьдесят раз и тому подобное.
Любая живая клетка имеет наружную и внутреннюю биологические мембраны. Это как бы избирательно проницаемая стенка, ограждающая содержимое клетки, ее органоиды от повреждения. На поверхности биологических образований молекулы воды подвергаются структурно -функциональной упорядоченности, образуют так называемую клатратную пленку — кристаллогидрат со строго ориентированными дипольными моментами молекул воды.
В самой клатратной пленке, размещенной, к примеру, на поверхности клеточной мембраны, процессы обмена между молекулами воды осуществляются с частотой десять тысяч раз в секунду, в то время как с окружающей объемной водой молекулы Н2 О меняются местами с частотой в два раза меньшей.
Это приводит к тому, что растворенным в воде примесям термодинамически невыгодно находиться в клатратных слоях воды, поэтому они предпочитают объемную воду.
Итак, будучи связанной с живой материей и защищая ее, клатраты сами защищены невидимым барьером от разрушающего действия на них объемной воды с растворенными в ней вредными и ядовитыми веществами. И чем толще и крепче клатратная прослойка, тем более стабильны термодинамические и биологические условия функционирования отдельной молекулы и клетки организма.
В связанной воде все молекулы Н2 О имеют по четыре водородные связи и обеспечивают оптимальную скорость миграции протонов и электронов -эту основу обмена веществ в живых системах.
Основа структуры всех биомолекул — водородные связи. Водородные связи биомолекул и воды, по Сент-Дьердьи, образуют матрицу жизни, по которой движутся в процессе обмена веществ протоны и электроны.
Водородные связи — не только матрица, но и существенный элемент в строительстве всего живого. Все сказанное выше, говорит о том, что обыкновенная вода — самое необыкновенное вещество в природе.
Обнаружена и изучается универсальная система водно-структурной регуляции жизненными процессами. Структура воды и растворенные в ней вещества (анионы и катионы) определяют и регулируют строение и функции макромолекул клетки и низкомолекулярных биорегуляторов, сборку и функционирование организмов и клеток, тканей, органов и систем органов, наконец, целого организма.
Она действует как на субмолекулярном и молекулярном, так и на более высоких уровнях организации живой материи, вплоть до биосферного. Она определяет миграцию протонов и электронов в клетках, структуру мембран, функции ДНК, РНК, белков, низкомолекулярных регуляторов, сборку клеточных структур, оплодотворение, эмбриональное развитие, зрелое функционирование организма, его управляющие, регуляторные и гомеостатические системы, его старение и смерть.
Важным элементом системы водно-структурной регуляции является соотношение пара- и ортоводы. Гипотезу об этом развивает в своей содержательной книге Б.З.Фрадкин. Автор книги «Белые пятна безбрежного океана» Б.Э.Фрадкин в 1976 году писал о загадках воды: «Мы вправе рассматривать воду как необъятную самостоятельную область познания — безбрежный океан, усыпанный белыми пятнами загадок. И едва удается раскрыть одну загадку, как появляется две, десять новых, еще более невероятных».
Учитывая огромную роль воды в жизни человечества и отмечая пуск нового водопровода, жители города Новороссийска в 1974 году, как сообщала газета “Известия” 24 марта 1974 года, разработали памятник воде. Если он был воздвигнут, то этим актом люди выразили свое преклонение перед этим чудом природы — обыкновенной и вместе с тем необыкновенной водой.
СПИСОК ЛИТЕРАТУРЫ
1. Арабаджи В. И. Загадки простой воды. — М.: «Знание», 2003г.
2. Ахматов М.В. Вода, которую мы пьём. — М.: 2006г.
3. Петрянов И.В. Самое необыкновенное вещество в мире — М.: «Педагогика», 2005г.
www.ronl.ru