Лекция: Физико-химические свойства воды и их значение для природных процессов. Физические свойства воды лекция
Физические свойства воды
Поиск ЛекцийКраткий текст лекции на тему
«Строение молекулы воды. Её физические и химические свойства»
Вода - драгоценный дар природы, которую академик Карпинский назвал живой кровью, которая создает жизнь там, где ее не было.
«Вода стоит особняком в истории нашей планеты, Нет природного тела, которое могло сравниться с ней по влиянию на ход основных, самых грандиозных геологических процессов» (В.И.Вернадский).
Формула воды - Н2О (предложена в 1805 г Гумбольдтом и Гей-Люсаком), т.е. состоит из 1 атома кислорода и 2-х атомов водорода .
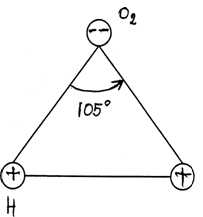
1). Молекула воды асимметрична, образует равнобедренный треугольник.
2). Молекула воды обладает полярностью, поэтому является электрическим диполем.
3). Молекулярная структура воды: вода находится в трех состояниях и осуществляет фазовые переходы.
Гидроль (пар) - состоит из одиночных молекул Н2О, поэтому водородные связи не реализуются; (Н2О)
Дигидроль (жидкость) - строение как у льда, а пустоты заполнены одиночными молекулами; (2Н2О) Тригидроль (лёд) - упорядоченное строение, гексагональная система с прочными водородными связями, имеет наибольший объем. (3Н2О)
4) Водородные связи в 10 раз прочнее, чем связи межмолекулярного взаимодействия.
5) В 1932 г. Юри и Осборн открыли, что водород и кислород имеют природные изотопы, т.е. вода имеет переменный изотопный состав и
атомы вещества с разной молекулярной массой. -
Н=1 – Н20 - протий - «легкая, живая вода», талая вода;
Н=2 - D2O - дейтерий- «тяжелая, мертвая вода», содержащая соли тяжелых металлов;
Н=3 - Т2О - тритий - «сверхтяжелая вода», образующаяся при термоядерных реакциях.
Химически чистая вода состоит по весу из 11,19% водорода и 88,81 % кислорода.
Физические свойства воды
1). Молекулы воды осуществляют переходы из одного состояния в другое (фазовые переходы). Переходы сопровождаются выделением или поглощением энергии (скрытая теплота парообразования) Испарение - из жидкости в пар - поглощение тепла. Конденсация - из пара в жидкость - выделение тепла. Замерзание - из жидкости в лед - выделение тепла. Таяние - из льда в жидкость - поглощение тепла.
Возгонка - из льда в пар (испарение с поверхности льда)- поглощение тепла. Сублимация - из пара в лед (конденсация в твердую фазу), например, иней- выделение тепла. При увеличении температуры воды скрытая теплота парообразования уменьшается.
2). При нормальном давлении температура плавления льда и замерзания воды равна 0°С. При повышении давления лед плавится при отрицательных температурах.
3). С увеличением солености понижается температура замерзания воды. Следует помнить, что при увеличении солености на 10%о температура замерзания воды понижается на 0,54°С.
4). Плотность воды в твердом состоянии меньше, чем в жидком. Следовательно, лед образуется на поверхности водоемов и не опускается на дно.
5). В диапазоне температуры воды от 0 до 4°С плотность воды не уменьшается, а увеличивается. Это аномальное свойство воды, вследствие которого образуется лед и водоемы не промерзают, потому что при температуре воды менее 4°С пресная вода становится менее плотной.
6). Аномальное изменение плотности приводит к аномальному изменению объёма воды. С увеличением температуры от 0 до 4°С объём химически чистой воды уменьшается; лишь при дальнейшем увеличении температуры объём увеличивается.
Объём льда всегда больше объема воды. Примеры в природе - морозное выветривание, образование наледей, бугров бучения и т.д.
7). Высокая удельная теплоемкость воды (ср). ср при 15°С = 4190 Дж/кгС0.
срминимальна при температуре равной 33°, увеличивается при увеличении и уменьшении температуры. Высокая сри очень высокая удельная температура плавления и испарения, что ведет к регулированию тепловых процессов на всей планете.
8). Очень малая теплопроводность. При понижении температуры и давления понижается и теплопроводность. С понижением температуры и понижением плотности уменьшается теплопроводность. Поэтому происходит медленный нагрев и охлаждение водной массы. Проявляется это свойство в том, что снег предохраняет почву от промерзания, а лед - водоемы от промерзания.
9). Вязкость воды невелика, поэтому вода подвижна. При увеличении температуры вязкость уменьшается, поэтому в холодное время года вязкость воды больше, чем в теплое.
10). Очень высокое поверхностное натяжение. Поэтому происходит:
• размыв фунтов водой;
• очень большая разрушительная деятельность дождевых капель;
• перемещение воды по порам и капиллярам в земной коре.
11). Свет частично поглощается и преломляется, поэтому проникает лишь на небольшую глубину. Именно здесь протекает фотосинтез.
12). Вода хорошо проводит звук (в 4-5 раз больше, чем в воздухе). Скорость звука увеличивается при повышении температуры воды, солености и давления.
13). Низкая электропроводность, которая увеличивается при повышении минерализации количества ионов хлора и калия.
poisk-ru.ru
Лек. 3. Вода
14
Лекция 3.
Вода, её химические и физические свойства.
Введение.
Прошлая лекция закончилась рассказом о минералах, созданных со специальными свойствами для различных нужд людей, животных и растений. Особенно ярко целенаправленными представляются минералы глин. Они служат для удержания воды для растений в почве, как строительный материал человеку для получения кирпича и керамики, обеспечивают устойчивость сводов в норах животных, применяются для грязелечения. Однако глины в своей полезности далеко уступают другому минералу, который называется вода. Экологическое служение его много разнообразнее.
Вода и связанные с ней единством химического состава минералы лёд и пар обладают совершенно уникальными свойствами. Заметим, что лёд и пар суть другие минералы. Минералом в геологии называется однородное физическое тело постоянного химического состава с постоянными ему присущими физическими свойствами. Люди выделили и назвали минералы задолго до появления химии. Они для практических и ритуальных целей выделили минералы по сочетанию признаков и свойств: цвету, блеску, степени прозрачности, твердости, ковкости и другим. Только тысячелетия спустя было установлено, что каждый минерал кроме постоянства признаков и свойств обладает постоянством химического состава. По свойствам и признакам три минерала пар, вода и лёд различны. Потому это три минерала. Будем говорить преимущественно о воде. Свойства воды и ее назначение столь многообразны, что не только в одной лекции, но и в нескольких лекциях их нельзя полностью осветить. Тем более, что они еще не достаточно раскрыты наукой.
Вода обязательно применяется в некоторых таинствах Православной Церкви, в воде Иордана крестил Иоанн Предтеча. Она была освящена погружением Иисуса Христа в Иордан. И ранее в ветхозаветной церкви вода применялась для ритуальных омовений.
Химический состав, строение молекулы воды.
В молекуле воды химически связаны два атома водорода с одним атомом кислорода. Её химическая формула Н2О. Расположение ядер атомов таково, что ни образуют равнобедренный треугольник с углом 104о 27’ при вершине (рис. 3-1).
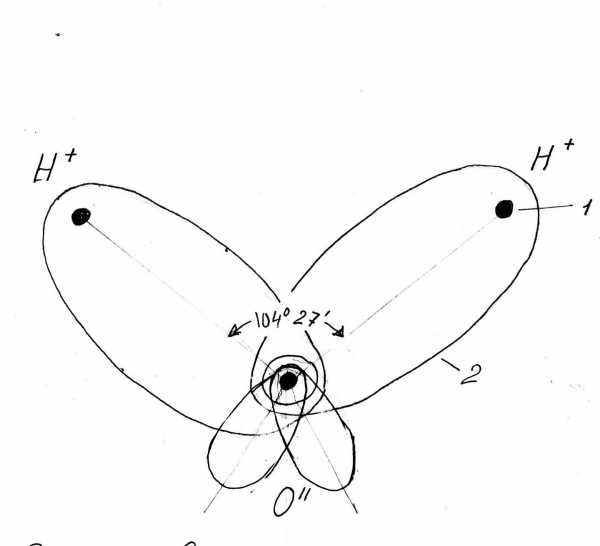
Рис. 3-1. Строение молекулы воды. 1 – ядра атомов кислорода и водорода; 2 – орбиты пар электронов, вращающихся вокруг ядер.
Вокруг них вращаются 5 пар электронов. Одна из этих пар вращается вокруг ядра кислорода. Она показана на рисунке небольшим кружком, охватывающим нижнюю жирную точку. Две пары охватывают и связывают ядро кислорода О с двумя ядрами водорода H. Их орбиты показаны двумя большими эллипсами. Ещё две пары электронов вращаются по двум эллиптическим орбитам у ядра кислорода. Последние две пары создают слабые отрицательные заряды в нижней части фигуры молекулы. В верхней части её, напротив, имеются слабые положительные заряды, созданные не полностью компенсированными положительными зарядами ядер водорода. Таким образом, у молекулы воды имеются 4 вершины, из которых две имеют положительный заряд и две имеют отрицательный. Нижняя пара эллипсов и верхняя пара эллипсов расположены в разных плоскостях, что сложно показать на рис. 3-1. Эти плоскости взаимно перпендикулярны. Поэтому прямая, проведенная через полюса молекулы с положительными зарядами, перпендикулярна к прямой, проведенной через полюса с отрицательными зарядами. Они не пересекаются, так как расположены по разные стороны молекулы. Условно на рис. 3-2 показано пространственное расположение зарядов в виде тетраэдра – пирамиды, грани которой суть равные между собой равносторонние треугольники. Такое строение молекулы воды создаёт её особые свойства, к рассмотрению которых мы переходим.
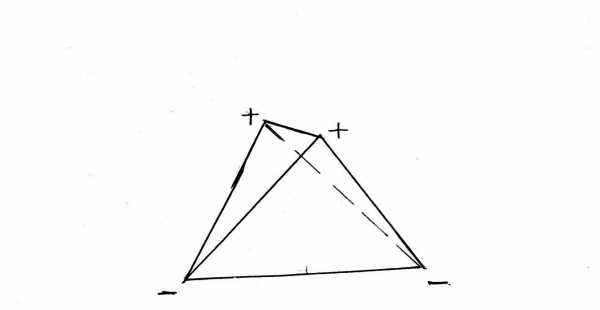
Рис 3-2.Модель молекулы воды в вида тетраэдра. Четырёх полюса зарядов на молекулы расположены в вершинах тетраэдра.
Химические и физико-химические свойства воды.
Вода это универсальный слабый растворитель. Молекулы воды своими зарядами «растаскивают» кристаллы солей и молекулы органических кислот на ионы. В веществе, попавшем в воду, межатомные силы ослабляются в 80 раз. Для физических тел, попавших в воду этот эффект действует только на поверхностях, контактирующих с водой. В зависимости от прочности внутренних связей в веществе, оно растворяется в воде с той или иной скоростью. Для наблюдателя эта скорость может субъективно представляться значительной или незначительной. Ни одно вещество кроме воды не обладает таким универсальным свойством растворять почти любые неорганические материалы. Есть более сильные и потому более опасные растворители. Вода, разлагая вещества на ионы, сама не разлагается. Молекула её очень устойчива. Благодаря этому вода «моет» лицо Земли, каждое животное и растение дождём и росой снаружи. Она «моет» их и внутри, выводя шлаки из организма. Вода инертный растворитель и сама не влияет на ткани, а только приносит нужное и уносит лишнее. Вода растворяет газы: несет кислород водной фауне.
В почве, в принципе, подобен воде по своему значению инертный минерал кварц SiO2. Кварцевый песок образует инертный «скелет» почвы и «растворяет» в себе гумус, глинистые минералы микроорганизмы и воду. Всё это «растворённое» взаимодействует с корнями растений и между собой, находясь в порах между песчинками. Песчинки прочны и химически инертны. Они создают каркас, обеспечивают водо- и газопроницаемость почвы. В воздухе подобен воде азот N инертные газы гелий He, аргон Ar. В них с необходимой для человека, животных и растений концентрацией «растворены» кислород и углекислый газ.
Выше мы сказали о строении молекулы воды. Сейчас пойдёт речь о строении воды в её жидкой массе. Молекулы воды не разделяются на ионы. Напротив, в статичной массе воды они соединяются в цепи и решетчатые структуры. В жидкой воде существуют жидкие кристаллы. Вернёмся к структуре молекулы воды, тетраэдру с четырьмя электрически заряженными вершинами (рис. 3-2). В броуновском беспорядочном медленном движении молекулы воды встречаются противоположно заряженными вершинами. При этом они слабо соединяются между собой, гася заряды. Ядра водорода приближаются к относительно свободным электронам кислорода и временно скрепляются с ними. Эти связи называются водородными. Они в несколько раз слабее ковалентных, действующих внутри молекулы (рис.3-1) и не разрушают молекул. Водородные связи легко разрушаются при механических воздействиях в бурном турбулентном потоке или при интенсивном нагревании воды, тем более при её кипении. Тетраэдрическая фигура молекулы воды позволяет каждой молекуле образовать четыре связи с другими молекулами. Благодаря этому молекула может ассоциироваться с одной, двумя, тремя или четырьмя молекулами в пары (рис.3-3), цепи, плоские и пространственные решетки. Такие соединения, в принципе, подобны твёрдым кристаллам минералов и называются жидкими кристаллами.
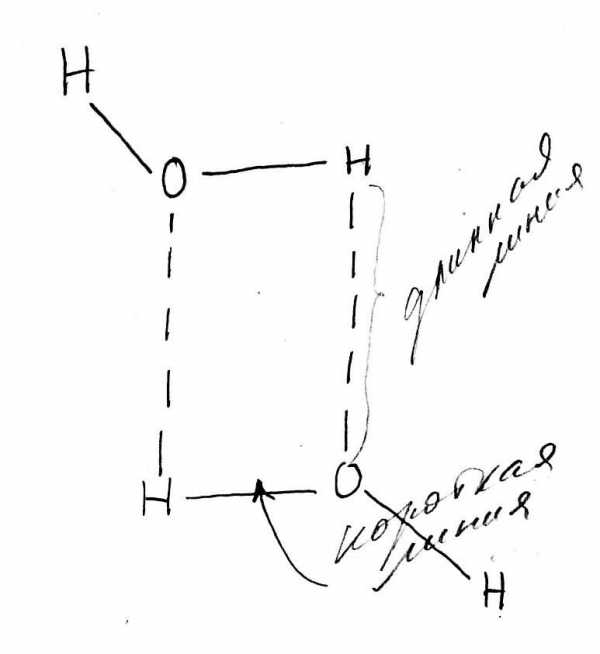
Рис. 3-3. Две молекулы воды с ковалентными (сплошная линия) и водородными (пунктир) связями.
Структурированная в жидкие кристаллы вода имеет как бы резервную, «зачехленную», способность к растворению. Она медленно растворяет погруженное вещество, но стоит её взболтать или согреть, например, в теплокровном организме, как водородные связи разрушаются и вода активизируется. Жидкие кристаллы формируются в холодной спокойной воде, где броуновское движение замедленно и нет механического перемешивания. Такие условия имеются в неглубоких водоносных горизонтах подземных вод, до 1000 м от поверхности земли. По песчаным слоям вода движется со скоростью порядка 1см/сутки. Подземные воды в виде источников, ключей, спокойно вытекают на поверхность и выносят жидкие кристаллы. В водопадах и при разогреве жидкие кристаллы разрушаются. Много жидких кристаллов в свежей талой воде. Не потому ли животные пьют холодную воду?
Пространственная решетка жидких кристаллов воды имеет пустоты внутри себя. В пустотах могут располагаться ионы растворенного неорганического вещества или целые органические молекулы. Реально можно убедиться в существовании пустот следующим простейшим экспериментом. В неполный стакан воды можно насыпать сахар (органическое вещество) или поваренную соль (неорганическое вещество), наполнив тем его до краев. Когда твердое вещество растворится, то раствор снова не будет доставать краев сосуда, как это было до заполнения его сахаром (солью). Проще этот опыт проделать с неполным сосудом воды, отметив на стенке уровень воды до высыпания растворимого вещества. Помешиванием легко можно растворить вещество и убедиться, что уровень раствора установится на прежней отметке. Твердое вещество вошло в пространство между молекулами воды. При этом плотность раствора станет больше чем плотность пресной воды.
Особенно значительно для биосферы и значительно для нас, желающих видеть мудрость Творца, что пустоты жидких кристаллов иногда создаются по форме подобными форме сложных биологически активных молекул, например, молекул ДНК, несущих генетический код организма. В организме вокруг молекул ДНК возникает защитный каркас из молекул воды, «футляр» по форме молекулы. Если же защищаемая длинная закрученная молекула ДНК все-таки будет повреждена каким-либо излучением или механическим воздействием, то защитный жидкий кристалл раскрывается в месте повреждения, что служит сигналом для биологических систем, отвечающих за восстановление жизненно необходимой молекулы ДНК.
Итак, главные химические свойства воды:
1). Устойчивое соединение, потому является надежной не разрушаемой базой для жизни.
2). Вода – универсальный растворитель газов и твердых частиц, благодаря чему доставляет питательные вещества в организмы и уносит вещества-шлаки из них.
3). Вода плохо растворяет органические вещества с большой молекулярной массой. Потому она не разрушает живые ткани организмов, но служит им.
4). Растворимость веществ в воде зависит от температуры – она снижается с охлаждением воды. Разогретая в организме вода выносит много веществ, охлаждается вне организма, осаждает вещества в водоемы, испаряется и после конденсации вновь готова принять порцию загрязнителей.
5). Для растений вода служит строительным материалом при создании (фотосинтезе) органических веществ, которые за тем от растений получает всё живое.
Теперь коснёмся физико-химических свойств воды. Она образует плёнки на заряженных малых частицах твердого вещества или капельках иной вязкой жидкости. Образуются коллоидные растворы - золи и гели. В зависимости от концентрации они могут иметь различную вязкость. Такими растворами, например, являются золи молоко и сметана, а также гели - глинистые растворы, хлебное тесто. Без этих гелей не было бы печного горшка и печёного хлеба В молоке мельчайшие капельки питательных веществ окружены молекулами воды и взвешены в коллоидном растворе. В разжиженном водой состоянии они доступны даже младенцам и сосункам-животным. Твердые частицы глины, взвешенные физико-химическими силами в водном коллоидном растворе, транспортируются в речном потоке. Минералы глин ценное сырьё для природы и человека. Вода распространяет их от мест их образования в коре выветривания горных пород к местам, где природа испытывает в них потребность. Она отлагает их на дне водоёмов. Там возникают илы со специфической жизнью. На дне прудов илы создают водоудерживающий слой. Или из коллоидного раствора (мутной воды) глинистые частицы отлагаются и на пойме, где образует почвы. Они переносится также по воздуху ветром и образуют почвы вне речных долин. В почве глинистые частицы удерживают воду электростатическими зарядами на своей поверхности. Сочетание заряженных частиц глины и зарядов на молекулах воды обеспечивает слабую связь, которую разрушают растения, питаясь водой из почвы.
Глинистые минералы вода разделяет на мельчайшие нерастворимые частицы, отделяемые от микрокристаллов глины по поверхностям кристаллической решетки. Физико-химическое взаимодействие воды с глиной является причиной многих важнейших экзогенных, то есть возникающих на поверхности земли, геологических процессов. Со строительной точки зрения большинство из них является неблагоприятными и опасными. Это оползни, набухание, усадка, дополнительная осадка сооружений и зданий при изменении влажности грунта или химического состава поровой воды в нём и другие процессы. С экологической точки зрения большинство этих процессов необходимы биосфере. Выветривание горных создаёт минеральный инертный субстрат почвы. При этом оно создаёт и растворённые в воде минеральные вещества, питательные для растений. Пучение разрыхляет почву к весеннему прорастанию семян и облегчает всходы на необрабатываемых территориях, способствует паро- и водопроницаемости почвы. Вода в грунтах и почвах исполняет две роли – полезную для людей и вредную. В последней роли она является средством научения и наказания
3.Физические свойства воды:
А) Капиллярность.
Поверхность спокойной воды исключительно гладкая, блестящая. Она выровнена на молекулярном уровне. Только ветер может нарушить ее, да ещё турбулентное течение. На поверхности воды действует поверхностное натяжение. По всей поверхности натянута сеть молекул Н2О, связанных между собой водородными связями. Эта сеть, как плёнка способствует сохранению воды в водоёме, сдерживает испарение. Только некоторые молекулы в броуновском движении имеют скорость достаточную для прорыва сквозь сеть поверхностного натяжения. Жук-водомер перемещается по этой сети. Лапки его не смачиваются водой. Вода способна смачивать большинство тел. Молекулы воды притягиваются к стеклу, к органическим тканям. Сеть поверхностного натяжения в сосуде с водой прогибается, удерживая висящие на ней молекулы воды в подобие того, как сеть гамака прогибается от собственного веса. Такая прогнутая (или выпуклая в не смачиваемом водой материале) поверхность воды называется мениском. Мениск удерживается притяжением крайних молекул воды к стенке сосуда. Сила притяжения зависит только от качества материала. Чем меньше расстояние между стенками сосуда, его диаметр, тем меньше масса воды, висящей на мениске на единицу его высоты. Потому в тонких капиллярах вода может подниматься выше, чем в более широких. Она поднимается на высоту до нескольких метров, теоретически до 10 м.
В стеблях и листьях растений имеются капилляры, по которым растворы от корня поднимаются до вершины растения; капилляр обеспечивает питание растения и его устойчивость (упругость). При недостатке воды растение становится мягким, увядает, при подаче воды может распрямиться снова. В древесных стволах также действуют капиллярные силы. Капиллярные сосуды имеются у человека и животных. Таким образом, через капиллярные свойства вода еще одним способом поддерживает жизнь растений и животных.
Капиллярная вода удерживается в глинистой и чернозёмной плодородной почве. В песчаной почве она удерживается в минимальном количестве. Капиллярная вода почвы является первоочередным питанием для корней растений. После исчерпания запаса капиллярной воды, растение начинает отбирать связанную воду от глинистых частиц. По капиллярам вода высоко поднимается к поверхности земли над уровнем грунтовых вод. В суглинистых грунтах этот подъём достигает 3-4 м. Это обеспечивает необходимую влажность в корнеобитаемом слое, но не даёт заболачивания. Болото возникает там, где уровень грунтовых вод выходит на поверхность. Там и крупные поры заполнены водой. Капиллярная же влага сочетается в почве с воздухом и не может выступать над поверхностью земли, а только увлажняет её.
Б) Теплофизические свойства воды и их экологическое значение.
Вещество h3O (лед - вода - пар) обладает высокой удельной теплотой плавления и очень высокой удельной теплотой испарения. Чтобы получить из льда 1 г воды, требуется 80 калорий или 334 Джоуля тепловой энергии (рис. 3-4). Для последующего нагревания её на 1о C требуется одна калория или 4,2 Дж/г. Для нагревания той же талой воды от 0 до 100о C требуется 100 калорий. Последующее испарение 1 г воды требует 543 калории.
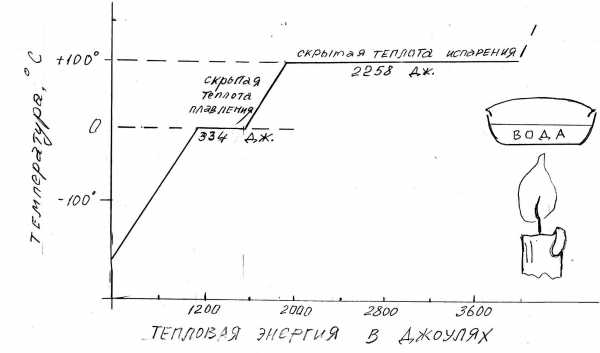
Рис. 3-4. График изменения температуры воды при нагревании с постоянной подачей теплоты.
В точке таяния 1 грамм воды поглощает без повышения температуры 332 Дж., а в точке испарения 1 грамм воды поглощает 2258 Дж., также без повышения температуры.
Таким образом, на границах фазовых переходов вода отбирает из окружающего пространства много теплоты при повышении температуры. При понижении температуры происходит обратное: конденсация водяного пара в капельки жидкости сопровождается выделением тепла 543 калорий на 1 г воды. Охлаждение воды сопровождается отдачей тепла из воды в количестве около 1 кал. на 1 г. и 1о, а замерзание сопровождается выделением около 80 кал. на 1 г.
Это свойство воды позволяет ей регулировать климат и микроклимат на поверхности Земли. Во влажных районах климат мягче, без резких переходов между днем и ночью, между зимой и летом. В сухих и потому пустынных районах этот переход значительно резче. Говорят о морском и континентальном типах климата. Мягкий климат удобен не только людям и животным. Он необходим растениям, которые, будучи прикрепленными, не могут укрыться ни от холода, ни от зноя в отличие от животных и человека.
Интересно рассмотреть, как вода защищает растение в период весенних заморозков, когда температура воздуха в предутренние часы опускается до нуля и даже ниже. В сухом воздухе температура резко опускается, может перейти ноль и также опускаться в отрицательной области.
Во влажном воздухе на некотором уровне температуры, называемым в физике “точкой росы,” начинается конденсация водяного пара с выделением 543 калорий с грамма росы. Воздух при этом обогревается, падение температуры его замедляется (рис. 3-5).
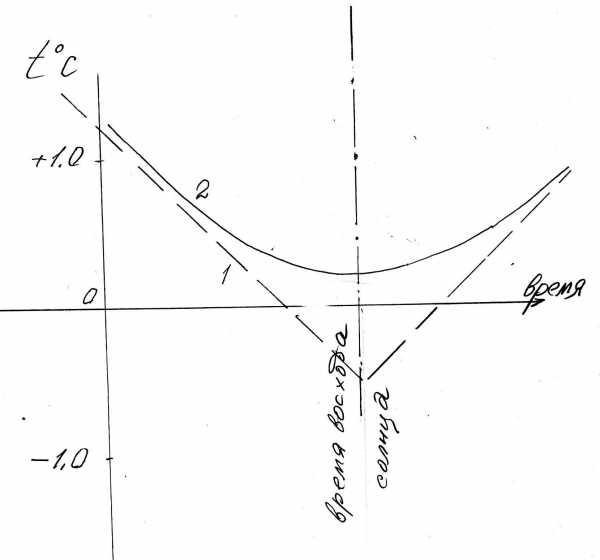
Рис. 3-5. Ход температуры над почвой при заморозке в сухом (1) и влажном (2) воздухе в ночные и утренние часы.
Если она все-таки достигнет 0ОC, то происходит образование инея, когда конденсируемые молекулы воды сразу образуют кристаллы льда. При этом выделяется еще 80 калорий на 1 г. воды. Охлаждение опять замедляется. Иней садится на растения, как и роса, и обогревает непосредственно листья и стебли. Но вот взошло Солнце. Лучи его не только освещают, но и несут тепловую энергию. Кожа наша хорошо ощущает теплоту апрельских и майских солнечных лучей восходящего солнца. Для переохлажденных растений при отрицательных температурах воздуха обогрев первыми солнечными лучами опасен, т.к. резкое расширение тканей на поверхности листа может привести к разрыву тканей, разрыву капилляров и последующему увяданию. Растения в этот момент получают солнечные ожоги.
От ожогов растения защищает вода. Иней на листе начинает таять, забирая тепло. Он превращается в росу, которая, испаряясь, отбирает еще более тепла. Кто ходил босиком по росе, тот знает, какая она холодная. Это для того, чтобы тонкие ткани травянистых растений и цветов не прогрелись при восходе солнца. Таким образом, сверкающая на траве роса не только украшает растения, но она и обогревает их, как это ни странно человеку, ощущающему холод росы. Но голая почва еще холодней.
Другой экологический аспект высокой удельной теплоты замерзания и испарения воды видим в климатической аномалии хода среднесуточных температур в течение года, что особенно существенно весной. Например, для Москвы ход среднесуточных температур не совпадает с ходом интенсивности солнечной инсоляции. Как видно из приведенных ниже значений температур, при средней инсоляции в марте средняя суточная температура воздуха -4,7градусов. При такой же инсоляции в сентябре средняя суточная температура воздуха +10,6 градусов. Минимум температур смещен на январь, хотя минимум освещенности падает на 22 декабря.
Таблица 3-1
Средние месячные климатические характеристики для Москвы.
Месяцы 1 2 3 4 5 6 7 8 9 10 11 12
Средне-
суточные -10,2 -9,6 -4,7 +4,0 11,6 15,8 18,1 16,2 10,6 4,2 -2,2 -7,6
температуры,
t C
Инсоляция ср. max ср. min
22.03 22.06 22.09 22.12
Самое холодное время зимы, Крещенские морозы почти на месяц позже, самого тёмного дня. В целом наиболее морозный период продолжается от Никольских (19 декабря) до Афанасьевских (10 февраля) и Сретенских (15 февраля) морозов. В связи с этим есть пословица: «Спиридон – Солнцеворот: солнце на лето, зима на мороз».
Минимум инсоляции близок к празднику святителя Спиридония Тримифунтского (25 декабря по гражданскому григорианскому календарю). По пословице: “ Спиридон – Солнцеворот: солнце на лето, зима на мороз” в это время начинаются сильные морозы. Январское и февральское солнце уже теплее ноябрьского и декабрьского. Смещение хода температур относительно хода инсоляции вызвано отдачей в атмосферу тепла водой рек и водоемов, охлаждаемой и замораживаемой при ноябрьском и декабрьском снижении температур воздуха. К середине декабря в России устанавливались ледовые дороги. По пословице: ”Савва мосты мостит (16 декабря), Никола гвоздем гвоздит(19 декабря)”. Последнее, я думаю, имеются в виду громкие разрывы льда при сильных Никольских морозах. Эти разрывы вызваны увеличением плотности льда при охлаждении и сокращением длины ледяного покрова.
Весеннее равноденствие – 22 марта могло бы быть концом холодного периода. Но холода у нас затягиваются на апрель, поскольку поток солнечного весеннего тепла отбирается на снеготаяние и прямое испарение снега (сублимация). В бесснежных пустынных районах Центральной Азии от Монголии до Каспия и от Арала до Персидского залива, где автору приходилось работать, смещения хода температур относительно хода инсоляции нет.
В Европейской части России задержка весны до конца снеготаяния обеспечивает резкий всплеск тепла в мае. С марта по май в Москве температура воздуха в среднем возрастает на 16,3 C, а далее с мая по июль только на 6,5 C. Устойчивая теплая погода, распускание почек и цветения отодвигается до момента длинных суток и высокого солнцестояния, до периода с минимальным риском заморозков. Тем самым сберегаются от обмораживания молодая зелень и цветы.
В) Изменение плотности воды от температуры и его экологическое значение.
Плотность всякого вещества, точнее, почти всякого, увеличивается при охлаждении. Происходит сжатие тела. Известный пример – тепловые швы на железнодорожных рельсах. Они исключают разрывы рельсов при охлаждении и сжатии стали в зимнее время, а так же исключают изгибы их при разогреве и расширении летом. Щели между рельсами расширяются зимой и почти закрываются летом. Приведенный ниже график (рис. 3-6) изменения плотности воды и льда показывает, что это вещество не подчиняется общему закону.
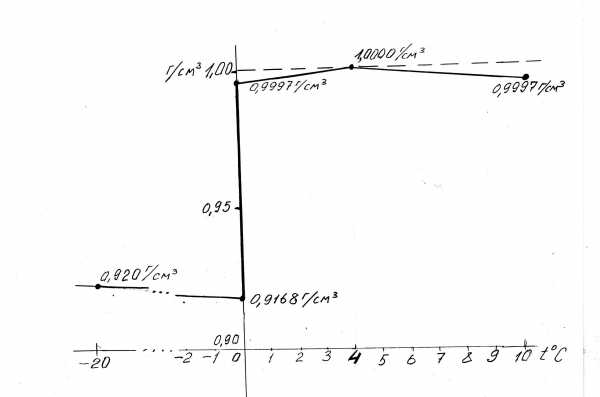
Рис. 3-6 График зависимости плотности воды от температуры
При снижении температуры воды от +10 C до 3,98о C плотность ее возрастает на 0,0003г/см3 или на 300 г/м3. При снижении температуры от 3,98о C до нуля плотность воды вопреки общему закону не возрастает, а снижается. При кристаллизации льда происходит резкое снижение плотности до 0,9168 г/см3.
При охлаждении льда восстанавливается общий закон природы. Плотность льда возрастает по мере охлаждения. Объем льда при этом сокращается. Своеобразная закономерность реализуется путем роста жидких кристаллов воды и при дальнейшем снижении температуры твердых кристаллов льда с изменением межмолекулярного пространства в жидких и твердых кристаллах.
Какое это имеет экологическое значение?
Рассмотрим водоем в умеренном и холодном климате. Зимой для сохранения жизни гидробионтов в воде на ее поверхности образуется лед, теплопроводность которого меньше теплопроводности воды. Лед не тонет только благодаря тому, что он легче воды. При нормальном для всех веществ ходе изменения плотности от температуры лед должен был бы тонуть, а водоем полностью промерзнуть за зиму. Но лёд вопреки общему закону природы легче воды и он плавает. На лед выпадает снег (тот же лед, но другой плотности), который в силу пористости имеет идеальные теплоизоляционные свойства. Лед и снег укрывают водоем от зимней стужи.
Подо льдом температура воды постепенно нарастает (рис. 3-7) к дну водоёма.
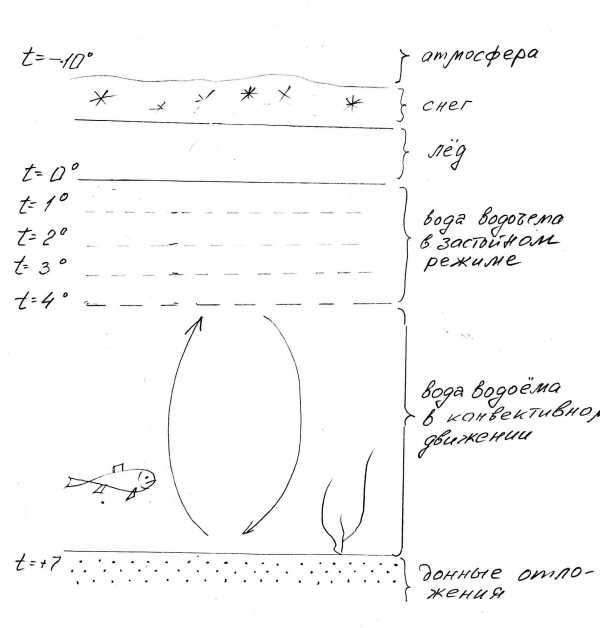
Рис. 3-7. Температура воды подо льдом в водоёме.
Подо льдом удерживаются слои воды с температурой от +1 до +3 C. Плотность воды сверху вниз нарастает, поэтому слой +1 плавает на слое +2 и так далее. На контакте со льдом находится самый лёгкий слой воды с нулевой температурой. В застойном водоеме он неподвижен и потому лед не тает, а намерзает, превращая водные преграды в гладкие дороги для миграции наземных животных и дороги для людей.
Но вернемся под воду. При температуре +4 C вода приобретает максимальную плотность и падает на дно, где находится более теплая и более легкая вода. Теплые воды вытесняются вверх. Таким образом, осуществляется конвективное перемешивание, которое обеспечивает положительные температуры в зоне обитания гидробионтов при сохранении низких температур непосредственно на границе лед-вода.
Какое значение имеет повышение плотности льда при снижении температур?
При охлаждении лед сжимается. Слой его трескается, иногда со страшным шумом наподобие выстрела. Такое происходит на великих сибирских реках, где температура воздуха опускается ниже 40 C, а лед имеет толщину много более 1 м и даже 2-х метров. Через трещины на поверхность льда выдавливается вода. Через трещины в подледное пространство мигрирует атмосферный кислород, растворяемый в изливающейся воде. Таким образом, растрескивание льда в какой-то мере предупреждает заморы рыбы.
Другой экологический аспект расширения воды при замерзании и сокращения объема льда проявляется при выветривании горных пород. Дробление их осуществляется водой, замерзающей в микротрещинах. Выветриванием извлекаются из глубинных пород микроэлементы, необходимые растениям и животным, подготовляются обновляемые тектоническими движениями участки земной коры к формированию почвы и первичной сукцессии, то есть к образованию экосистем на обновленных участках. В стабильных наземных экосистемах замерзание почвенной влаги приводит к пучению, то есть морозному расширению грунтов. При этом они разрыхляются, в них образуются поры, в которых в тёплое время года будут вода и воздух для питания корней растений.
studfiles.net
Урок химии на тему "Физические и химические свойства воды. Круговорот воды в природе"
Химические свойства водыМы рассмотрели физические свойства воды. Теперь давайте познакомимся с некоторыми ее химическими свойствами. Т.е. теми свойствами, которые она проявляет при взаимодействии с другими веществами.
Запишите себе в тетрадь “Химические свойства воды”
Реагирует с металлами
А) с активными металлами (Ме 1-а группы) при этом образуется гидроксид металла и выделяется водород
Демонстрация опыта натрия с водой
2Na + 2h3O = 2NaOH + h3
Видеофрагмент взаимодействие кальция с водой
Са + 2Н2О = Са(ОН)2 + h3
Б) Вода реагирует с менее активными металлами, стоящими в ряду напряжения до водорода. Образуется оксид металла и водород.
Zn + h3O = ZnO + h3
Реагирует с некоторыми оксидами
А) оксидами активных металлов с образованием растворимых оснований
Лабораторная работа
“Взаимодействие оксида кальция с водой”
Задание: В фарфоровую чашку насыпьте 1 г. Белого порошка оксида кальция и осторожно прилейте к нему 5-10 мл воды. Что наблюдаете? С помощью лакмусовой бумажки определите среду получившегося раствора. Запишите уравнение реакции, наблюдения и свои выводы в рабочую тетрадь.
СаО + Н2О = Са(ОН)2
Б) Вода реагирует с кислотными оксидами , образуя кислоты
СO2 + Н2О = h3СО3
Под действием постоянного электрического тока при высокой температуре 20000С вода разлагается на водород и воду.
2 Н2О = 2 Н2 + О2
На основании изученных свойств воды давайте сделаем вывод – активное ли вещество вода.
(Вода – активное вещество, т.к. вступает в реакции со многими веществами)
3. Круговорот воды в природе
Мы с вами свойства воды физические и химические. Нам осталось изучить круговорот воды в природе.
Я прочту вам сказку “Вода”, которую написал Леонардо да Винчи:
“Вода весело плескалась в родной морской стихии. Но однажды ей взбрела в голову шальная мысль добраться до самого неба. Она обратилась за помощью к огню. Своим обжигающим пламенем он обратил воду в мельчайшие капельки теплого пара, которые оказались гораздо легче воздуха.
Пар тот час устремился вверх, поднимаясь в самые высокие и холодные слои воздуха.
Оказавшись в заоблачной выси, капельки пара окоченели так, что у них зуб на зуб не попадал от холода. Чтобы согреться, они тесно прижались друг другу, став немного тяжелее воздуха, тут же попадали на землю в виде обычного дождя.
Заболев тщеславием, вода вознеслась к небу, но была изгнана оттуда.
Жаждущая земля поглотила дождь до единой капельки. И воде еще долго пришлось отбывать наказание в почве, прежде чем она, смогла возвратиться в морские просторы”.
Догадались ли вы, какие природные явления описал Леонардо да Винчи?
Давайте посмотрим, как это происходит в природе.
(ДЕМОНСТРАЦИЯ опыта “Делаем облако”)
Посмотрите, что происходит.
ОПЫТ “Делаем облако”
Налейте в трехлитровую банку горячей воды (примерно 2,5 см.). Положите на противень несколько кубиков льда и поставьте его на банку.
Воздух внутри банки, поднимаясь вверх, станет охлаждаться. Содержащийся в нем водяной пар будет конденсироваться, образуя облако.
Этот эксперимент моделирует процесс формирования облаков при охлаждении теплого воздуха. И выпадение дождя.
- Кто мне скажет, откуда берется дождь?
- Почему вода в виде дождя падает на землю?
(Оказывается, капли, нагревшись на земле, поднимаются вверх. Там им становится холодно, они жмутся друг к другу, образуя облака.
Встречаясь вместе, они увеличиваются, становятся тяжелыми и падают на землю в виде дождя.)
- Какой процесс происходит при нагревании воды? (испарение)
- Какой процесс происходит при охлаждении воды? (конденсация)
- Какие это явления физические или химические? Почему?
xn--i1abbnckbmcl9fb.xn--p1ai
Лекция - Физико-химические свойства воды и их значение для природных процессов
Вода — простейшее химическое соединение водорода с кислородом. Химически чистая вода состоит из 11,19% водорода и 88,81% кислорода (по весу). Вода — самое распространенное и самое необыкновенное вещество на Земле благодаря своим аномальным свойствам. В земных условиях только вода находится в трех физических агрегатных состояниях: твердом (лед, снег), жидком (вода) и газообразном (пар). В парообразном состоянии (при температуре 100°С) вода состоит главным образом из простых молекул, называемых гидролями (Н2О). В жидкой фазе вода представляет собой смесь гидролей (Н2О) двойных молекул — дигидролей (Н2О)2 и тройных молекул — тригидролей (Н2О)3. В твердой фазе (лед) в воде преобладают тригидро-ли (Н2О)3. Переход воды из одного состояния в другое происходит быстро и сопровождается или поглощением тепла (при испарении, таянии льда и снега) или выделением тепла (при конденсации и сублимации водяного пара, при замерзании воды), но на температуру самой воды (льда) это не влияет. При этом скачкообразно изменяются физические и химические свойства воды. Химически чистая вода при нормальном атмосферном давлении 760 мм (1013 гПа) кипит при 100 °С, замерзает при О°С (это и температура плавления льда), имеет наибольшую плотность при температуре +4 °С.
Теплоемкость. Вода — одно из самых теплоемких в природе тел. Удельной теплоемкостью вещества называется количество теплоты, необходимое для нагревания 1 кг вещества на 1 °С. Вследствие высокой теплоемкости воды океанов, морей и озер поглощают огромное количество тепла летом, являясь его мощными аккумуляторами. Зимой воды, охлаждаясь, отдают тепло в атмосферу. Этим объясняется большое умеряющее (летом охлаждающее, зимой отепляющее) влияние океанов и морей на климат прилегающих материков в умеренных и высоких широтах. В экваториально-тропических теплоэнергетических зонах вода нагревается весь год и тепло морскими течениями и воздушными потоками передается в умеренные и полярные широты. Это перераспределение тепла имеет огромное климатическое значение.
Для воды характерны высокие значения теплоты испарения (597 кал/г) и теплоты плавления (79,4 кал/г). Эти свойства очень важны для живых организмов. Высокая теплота испарения обеспечивает защиту их от перегрева, а большая теплота плавления — от переохлаждения.
Теплопроводность воды весьма незначительна. Поэтому нагревание воды в естественных водоемах происходит не столько путем молекулярной теплопроводности, сколько путем плотностной конвекции, перемешивания воды
вследствие течений и волнения. При отсутствии перемешивания воды в озерах наблюдается вертикальная термическая слоистость (стратификация). Лед и особенно снег обладают еще меньшей теплопроводностью, чем вода. Поэтому лед, возникнув на поверхности водоема, предохраняет воду от дальнейшего охлаждения, а снег — почву от промерзания, бесснежие же губит озимые культуры.
Плотность воды зависит от температуры и солености. Наибольшая плотность химически чистой воды достигается при температуре +4 °С, а выше и ниже +4 °С плотность воды уменьшается — вода становится легче. Это удивительное аномальное свойство воды по сравнению с другими жидкостями, плотность которых при понижении температуры и затвердевании увеличивается, объясняется тем, что одиночные молекулы воды Н2О (моногид-роли) могут объединяться и образовывать сложные молекулы: дигидроли и тригидроли. Они более крупные по объему, но относительно рыхлые, ажурные по структуре и поэтому более легкие. При понижении температуры воды происходит, с одной стороны, нормальное уменьшение объема и уплотнение воды, вызванное охлаждением, как у всех жидкостей, а с другой — увеличение объема и соответственно уменьшение плотности воды из-за объединения молекул воды в более сложные, но более легкие. При охлаждении воды до +4 °С преобладает первый процесс, при температуре +4 °С оба процесса уравновешиваются, поэтому плотность наибольшая, при дальнейшем охлаждении воды ниже +4 °С преобладает второй процесс. Плотностная аномалия воды имеет громадное значение для природных вод. Во-первых, при осеннем охлаждении пресных водоемов до +4 °С более холодная и плотная вода с поверхности опускается и обогащает глубинные слои кислородом, как бы подготавливая водоем к зиме. Во-вторых, вследствие этой аномалии водоемы даже в условиях сурового климата не промерзают до дна, за исключением совсем мелких, поскольку при охлаждении воды ниже +4 °С вплоть до О °С верхние слои воды становятся менее плотными, более легкими и удерживаются на поверхности. Так как молекулярная теплопроводность воды и льда невелика, верхние слои предохраняют от охлаждения ниже расположенные толщи воды; живые организмы тем самым уберегаются от гибели. Весной после таяния льда и нагревания воды в верхнем ее слое до +4 °С она становится тяжелее, плотнее и опускается вниз, обогащая глубинные слои кислородом, что очень важно для жизни, так как после зимы запасы кислорода в водоемах истощаются. Но это опускание прекращается после достижения температуры +4 °С, ибо при
последующем прогревании поверхностная вода становится легче. Таким образом, благодаря плотностной аномалии воды сохраняется жизнь в водоемах в условиях холодных и умеренных климатических поясов.
Своеобразным свойством воды является резкое увеличение ее объема при замерзании. Объем льда примерно на 10% больше по сравнению с первоначальным объемом воды. И наоборот, плавление льда сопровождается не расширением, а сжатием и уменьшением объема воды. Это аномальное свойство воды объясняется тем, что при понижении температуры воды и переходе ее через О °С происходит быстрое превращение почти всех ее молекул в тригидроли, что сопровождается скачкообразным увеличением объема льда. Увеличиваясь в объеме, лед становится менее плотным (плотность льда при замерзании воды составляет 0,91 г/см3), а значит, более легким, чем вода, и всплывает. Будучи плохим проводником тепла, лед предохраняет глубокие слои воды от замерзания. Свойство воды увеличиваться в объеме при замерзании играет огромную роль при разрушении горных пород путем физического («морозного») выветривания, поскольку, замерзая в трещинах пород, лед давит на их стенки и разрывает породу на мелкие части. Изменение объема воды при замерзании и таянии льда создает в области многолетней мерзлоты особый рельеф: бугры пучения при замерзании воды и впадины при таянии льдистых грунтов и линз льда.
Подвижность — характерное свойство жидкой воды. Движение воды происходит под действием силы тяжести, различия плотностей, под влиянием ветра, вследствие притяжения Луной и Солнцем и др. Перемешивание воды способствует выравниванию ее температуры, солености, химического состава и т. д. Велика роль движущейся воды в перераспределении тепла в океанах путем морских течений. Благодаря поверхностным текучим водам размываются, перемещаются и отлагаются огромные массы горных пород.
Термическая устойчивость воды весьма высока. Водяной пар разлагается на водород и кислород только при температуре выше 1000°С в высоких слоях атмосферы.
Поверхностное натяжение. Вода среди жидкостей, кроме ртути, обладает самым большим поверхностным натяжением. Благодаря этому свойству вода поднимается по капиллярам в грунтах, движется вверх в растениях, обеспечивая соответственно почвообразование и питание растений. Без воды земледелие было бы невозможно.
Вода — прекрасный растворитель, поэтому все воды представляют собой газосоле-
вые растворы различного химического состава и различной концентрации. Концентрация растворенных в воде веществ характеризуется соленостью, обозначается символом 5 и выражается в промилле (%о), т. е. в тысячных долях (граммах вещества на килограмм воды). Соленость пресной воды менее 1%о, остальные воды в той или иной степени соленые. Большая часть химических элементов находится в воде в виде гидратированных ионов, газы — в виде растворенных молекул. Растворимость газов в воде больше при низких температурах и повышенном давлении. Обнаружилось, что вода изменяет свою растворяющую способность под воздействием искусственно создаваемого магнитного поля. Растворяющая способность воды обусловливает химическое выщелачивание (выветривание) горных пород, обмен веществами между компонентами природы внутри географической оболочки, между сушей и океаном, между организмами и средой. Вообще минерализация воды до определенного предела — основа жизни. Химически чистая вода для жизни непригодна.
Многообразен не только химический и молекулярный, но и изотопный состав природных вод, так как кислород и водород имеют несколько изотопов. В природных условиях известны атомы водорода с атомным весом 1 (Н1 — протий), 2 (Н2=Д — дейтерий) и 3 (Н3=Т — тритий) и атомы кислорода с атомным весом 16(О16), 17(О17) и 18(О18). Из сочетания изотопов водорода Н, Д и Т и кислорода О16, О17 и О18 образуется девять видов воды. Природная вода — смесь всех этих
видов. Причем на долю обыкновенной воды Н2'О16 приходится 99,7% на Земле. Все остальные виды воды, кроме обыкновенной, называются тяжелой водой. Наиболее существенно отличается от обыкновенной тяжелая вода Н2 О16 (Д2О). Она имеет молекулярный вес 20, кипит при температуре 101,42°С, замерзает при температуре 0,8 °С, имеет максимальную плотность при 11,6 °С. Тяжелая вода нашла применение в атомной энергетике.
Способность к самоочищению —важное свойство воды. Оно осуществляется в процессе течения в реках, волнения в озерах и морях, фильтрации воды через грунт, в процессе испарения. Но при загрязнении выше определенных пределов эта способность нарушается.
Цвет воды. Вода имеет голубоватый оттенок, но в тонких слоях бесцветна. Оттенки цвета зависят от угла падения солнечных лучей, глубины проникновения света и от примесей.
Прозрачность воды определяется глубиной погружения белого диска диаметром 30 см. Прозрачность зависит от примесей. При большой прозрачности свет проникает на большую глубину, поддерживая необходимые условия для существования организмов.
Физические и химические свойства воды тесно взаимосвязаны. Особенно сильно изменяются свойства воды под влиянием температуры и давления. Удивительные свойства воды способствовали появлению и развитию жизни на Земле. Благодаря воде совершаются все процессы в географической оболочке.
www.ronl.ru