Осторожно, тяжелая вода! Свойства тяжелой воды
Тяжёлая вода
О.В.Мосин
Тяжёлая вода (оксид дейтерия) — имеет ту же химическую формулу, что и обычная вода, но вместо атомов водорода содержит два тяжёлых изотопа водорода — атомы дейтерия. Формула тяжёловодородной воды обычно записывается как: D2O или 2h3O. Внешне тяжёлая вода выглядит как обычная — бесцветная жидкость без вкуса и запаха.
По своим свойствам тяжелая вода заметно отличается от обычной воды. Реакции с тяжелой водой протекают медленнее, чем с обычной, константы диссоциации молекулы тяжёлой воды меньше таковых для обычной воды.
Молекулы тяжёловодородной воды были впервые обнаружены в природной воде Гарольдом Юри в 1932 году году. А уже в 1933 году Гильберт Льюис получил чистую тяжёловодородную воду путём электролиза обычной воды.
В природных водах соотношение между тяжёлой и обычной водой составляет 1:5500 (в предположении, что весь дейтерий находится в виде тяжёлой воды D2O, хотя на самом деле он частично находится в составе полутяжёлой воды HDO).
Тяжёлая вода токсична лишь в слабой степени, химические реакции в её среде проходят несколько медленнее, по сравнению с обычной водой, водородные связи с участием дейтерия несколько сильнее обычных. Эксперименты над млекопитающими показали, что замещение 25% водорода в тканях дейтерием приводит к стерильности, более высокие концентрации приводят к быстрой гибели животного. Однако некоторые микроорганизмы способны жить в 70%-ной тяжёлой воде) (простейшие) и даже в чистой тяжёлой воде (бактерии). Человек может без видимого вреда для здоровья выпить стакан тяжёлой воды, весь дейтерий будет выведен из организма через несколько дней. В этом отношении тяжёлая вода менее токсична, чем, например, поваренная соль.
Тяжёлая вода накапливается в остатке электролита при многократном электролизе воды. На открытом воздухе тяжёлая вода быстро поглощает пары обычной воды, поэтому можно сказать, что она гигроскопична. Производство тяжёлой воды очень энергоёмко, поэтому её стоимость довольно высока (ориентировочно 200-250 долларов за кг).
Физические свойства обычной и тяжёлой воды
| Физические свойства | D2O | h3O |
| Молекулярная масса | 20 | 18 |
| Плотность при 20°C (г/см3) | 1,1050 | 0,9982 |
| t° кристаллизации (°C) | 3,8 | 0 |
| t° кипения (°C) | 101,4 | 100 |
Свойства тяжёлой воды
Важнейшим свойством тяжёлой воды является то, что она практически не поглощает нейтроны, поэтому используется в ядерных реакторах для торможения нейтронов и в качестве теплоносителя. Она используется также в качестве изотопного индикатора в химии и биологии. В физике элементарных частиц тяжёлая вода используется для детектирования нейтрино; так, крупнейший детектор солнечных нейтрино в Канаде содержит 1 килотонну тяжёлой воды.
Российскими учёными из ПИЯВ разработаны на опытных установках оригинальные технологии получения и очистки тяжелой воды. В 1995 была введена в эксплуатацию первая в России и одна из первых в мире опытно-промышленная установка на основе метода изотопного обмена в системе вода-водород и электролиза воды (ЭВИО).
Высокая эффективность установки ЭВИО дает возможность получать тяжелую воду с содержанием дейтерия > 99,995 % ат. Отработанная технология обеспечивает высокое качество тяжелой воды, включая глубокую очистку тяжелой воды от трития до остаточной активности, позволяющей без ограничений использовать тяжелую воду в медицинских и научных целях. Возможности установки позволяют полностью обеспечить потребности российских предприятий и организаций в тяжелой воде и дейтерии, а также экспортировать часть продукции. За время работы для нужд Росатома и других предприятий России были произведены более 20 тонн тяжёлой воды и десятки килограммов газообразного дейтерия.
Существует также и полутяжёлая (или дейтериевая) вода, у которой только один атом водорода замещен дейтерием. Формулу такой воды записывают так: DHO.
Термин тяжёлая вода применяют также по отношению к воде, у которой любой из атомов заменен тяжёлым изотопом:
• к тяжёлокислородной воде (в ней лёгкий изотоп кислорода 16O замещен тяжёлыми изотопами 17O или 18O),
• к тритиевой и сверхтяжёлой воде (содержащей вместо атомов 1H его радиоактивный изотоп тритий 3H).
Если подсчитать все возможные различные соединения с общей формулой Н2О, то общее количество возможных «тяжёлых вод» достигнет 48. Из них 39 вариантов — радиоактивные, а стабильных вариантов всего девять: Н216O, Н217O, Н218O, HD16O, HD17O, HD18O, D216O, D217O, D218O. На сегодняшний день в лабораториях получены не все варианты тяжёлой воды.
Тяжелая вода играет значительную роль в различных биологических процессах. Российские исследователи давно обнаружили, что тяжелая вода тормозит рост бактерий, водорослей, грибов, высших растений и культуры тканей животных. А вот вода со сниженной до 50% концентрацией дейтерия (так называемая "бездейтериевая" вода) обладает антимутагенными свойствами, способствует увеличению биомассы и количества семян, ускоряет развитие половых органов и стимулирует сперматогенез у птиц.
За рубежом пробовали поить тяжелой водой мышей со злокачественными опухолями. Та вода оказалась по настоящему мертвой: и опухоли губила, и мышей. Различные исследователи установили, что тяжелая вода действует отрицательно на растительные и живые организмы. Подопытных собак, крыс и мышей поили водой, треть которой была заменена тяжелой водой. Через недолгое время начиналось расстройство обмена веществ животных, разрушались почки. При увеличении доли тяжелой воды животные погибали. И наоборот, снижение содержания дейтерия на 25% ниже нормы в воде, которую давали животным, благотворно сказалось на их развитии: свиньи, крысы и мыши дали потомство, во много раз многочисленнее и крупнее обычного, а яйценосность кур поднялась вдвое.
Тогда Российские исследователи взялись за "облегченную" воду. Эксперименты проводили на 3 моделях перевиваемых опухолей: карцинома легких Льюис, быстро растущая саркома матки и рак шейки матки, который развивается медленно. "Бездейтериевую" воду исследователи получали по технологии, разработанной в Институте космической биологии. В основе метода лежит электролиз дистиллированной воды. В опытных группах животные с перевитыми опухолями получали воду с пониженным содержанием дейтерия, в контрольных группах - обычную. Животные начали пить "облегченную" и контрольную воду в день перевивки опухоли и получали ее до последнего дня жизни.
Вода с пониженным содержанием дейтерия задерживает появление первых узелков на месте перевивки рака шейки матки. На время возникновения узелков других типов опухоли облегченная вода не действует. Но во всех опытных группах, начиная с первого дня измерений и практически до завершения эксперимента, объем опухолей был меньше, чем в контрольной группе. К сожалению, хотя тяжёлая вода и тормозит развитие всех исследованных опухолей, жизнь экспериментальным мышам она не продлевает.
И тогда раздались голоса в пользу полного изъятия дейтерия из употребленной в пищу воды. Это привело бы к ускорению обменных процессов в организме человека, а, следовательно, к увеличению его физической и интеллектуальной активности. Но вскоре возникли опасения, что полное изъятие из воды дейтерия приведет к сокращению общей длительности человеческой жизни. Ведь известно, что наш организм почти на 70% состоит из воды. И в этой воде 0,015% дейтерия. По количественному содержанию (в атомных процентах) он занимает 12-е место среди химических элементов, из которых состоит организм человека. В этом отношении его следует отнести к разряду микроэлементов. Содержание таких микроэлементов как медь, железо, цинк, молибден, марганец в нашем теле в десятки и сотни раз меньше, чем дейтерия. Что же случится, если удалить весь дейтерий? На этот вопрос науке еще предстоит ответить. Пока же несомненным является тот факт, что, меняя количественное содержание дейтерия в растительном или животном организме, мы можем ускорять или замедлять ход жизненных процессов.
www.o8ode.ru
Тяжелая вода, ее получение и свойства
В далеком прошлом человек не задумывался над тем, что представляет собой вода и каково ее происхождение. Существовало мнение, что это элемент, но теперь известно, что она является химическим соединением.
В 1932 г. весь мир облетела новость, что на планете Земля кроме простой есть и тяжелая вода. Сейчас уже известно, что может быть 135 ее изотопных разновидностей.
Состав
Тяжелая вода, которая еще называется оксидом дейтерия, по химическому составу не отличается от простой обычной, но вместо атомов водорода, содержащихся в воде, в ней присутствуют 2 тяжелых изотопа водорода, так называемого дейтерия. Тяжелая вода имеет формулу 2h3O или D2O. Внешне нет различий между тяжелой и простой жидкостью, но по своим свойствам они отличаются.
Химические реакции в тяжелой воде протекает слабее, чем в обычной.
Тяжелая вода слаботоксична. Научные эксперименты показали, что замещение атомов легкого водорода дейтерием на 25%, вызывает бесплодие у животных. Если еще больше увеличить его содержание в воде, животное погибает. Однако ряд организмов выживает при 70% дейтерия (инфузория туфелька). Человек без последствий для здоровья может выпить около стакана такой жидкости. При этом дейтерий выводится из организма в течение нескольких дней.
Тяжелая вода обладает свойством накапливаться в остатке электролита, если проводится многоразовый электролиз воды. Она поглощает пары простой жидкости на открытом воздухе, т.е. она гигроскопична.
Одним из самых важных свойств данного типа воды является то, что она почти не поглощает нейтроны, а это позволяет ее применять в ядерных реакторах для процесса торможения нейтронов, а в химии ее используют как изотопный индикатор.
Тяжелая вода, получение
В 1933-1946 годах единственным методом обогащения являлся электролиз. Уже позже появились более прогрессивные технологии. Современным массовым производством во входном потоке используется жидкость, дистиллированная из электролита, с содержанием в ней тяжелой воды 0,1-0,2 %.
Первая стадия концентрирования применяет двухтемпературную противоточную сероводородную технологию изотопного обмена, концентрация на выходе тяжёлой воды составляет 5-10 %. Вторая стадия — каскадный электролиз щелочного раствора при нулевой температуре, выходная концентрация – 99,75-99,995 %.
Российскими учеными были разработаны оригинальные технологии для производства и очистки тяжелой воды. В 1995 года установка, обладающая высокой эффективностью, была введена в промышленную эксплуатацию. Производство полностью обеспечивает потребность предприятий тяжелой водой в любом объеме, а также позволяет экспортировать ее за границу.
Применение
Тяжелая вода используется в различных биологических и химических процессах. Учеными было определено, что такая жидкость препятствует развитию бактерий, грибов, водорослей, а если в ней содержится 50 % дейтерия, то приобретает антимутагенные свойства, способствует росту биологической массы и ускорению полового созревания у людей.
Европейские ученые проводили опыты на мышах со злокачественной опухолью. Тяжелая вода погубила и болезнь, и ее носителей. Было установлено, что такая вода плохо действует на растения и животных. У подопытных, которых поили тяжелой водой, разрушались почки и расстраивался обмен веществ. При высоких дозах воды животные погибали. При небольшом объеме (до 25%), животные набирали вес и приносили хороший приплод, а у кур увеличивалась яйценоскость.
Вопрос о том, что произойдет, если совершенно избавиться от дейтерия, пока остается открытым.
Сравнение свойств легкой и тяжелой воды
Ответ на вопрос о различии между природной легкой и тяжелой жидкостью зависит от того, кому он был задан.
По химическим свойствам между ними нет практически никакой разницы. В каждой из них натрий одинаково выделяет водород, при электролизе и та, и другая вода одинаково разлагается, их химические свойства тоже совпадают, потому что у них одинаковый состав.
Физические свойства этих жидкостей разные: температура кипения и замерзания у них неодинаковая, также у них разная плотность и упругость пара. Тяжелая и легкая вода разлагаются при электролизе с разной скоростью.
С биологической точки зрения – вопрос достаточно сложный, здесь еще нужно поработать.
fb.ru
Тяжелая вода и ее физические свойства. Оксид дейтерия и его свойства.
Тяжелая вода и ее физические свойства
В давние времена человечество не знало, что такое вода и как она появилась на нашей планете. До середины девятнадцатого века люди думали, что вода просто элемент, хотя теперь стало известно, что это химическое соединение.
В 1932 году на весь мир пролетела новость. На планете помимо простой воды существует и тяжелая вода. В наше время стало известно, что таких химических соединений, как изотопные разновидности воды может быть сто тридцать пять. Состав воды, которая освобождена от различных примесей сложен.
Тяжелая вода, или как ее еще называют оксид дейтерия, имеет такой же химический состав, как и простая обычная вода, но вместо, содержащихся в воде атомов водорода в ней находится два тяжелых изотопа водорода. Формулу тяжелой воды можно записать как: D2O или 2h3O. Визуально тяжелая вода выглядит как простая вода.
Тяжелую воду открыли молодые физики Клейтон и Осборн. В 1933 году ученые смогли выделить ее в чистом виде. По своим свойствам она отличается от простой воды. Реакция с тяжелой водой, протекает слабее, чем с обычной водой. В природных водах соотношение тяжелой воды и обычной воды равно один к пяти тысячам. Дейтерий встречается и в полутяжелой воде.
Тяжелая вода имеет слабую токсичность. Химические реакции протекают медленно. Научные эксперименты над животными показали, что замещение водорода дейтерием (25 процентов) приводит к бесплодию. Если процент содержания дейтерия увеличить животное погибает. Но некоторые организмы могут выжить при семидесяти процентах дейтерия. Например, инфузория туфелька. Человек, способен выпить стакан тяжелой воды без последствий. Дейтерий будет выведен организмом в течение нескольких дней. В этом отношение тяжелая вода не так токсична, как поваренная соль.
Тяжелая вода способна накопиться в остатке электролита при многоразовом электролизе воды. Данный тип воды на открытом воздухе поглощает пары обычной простой воды, а это значит, что она гигроскопична. Стоимость килограмма тяжелой воды равно 250 евро. Такая стоимость установлена из-за энергоемкости.
Самым важным свойством тяжелой воды является то, что она не поглощает нейтроны, поэтому ее можно использовать в ядерных реакторах для такого процесса, как - торможения нейтронов. Также ее можно использовать в химии, в качестве изотопного индикатора.
Российские ученые из ПИЯВ разработали оригинальные современные технологии для того чтобы получать и очищать тяжелую воду. В 1995 года она была введена в эксплуатацию. Установка обладает высокой эффективностью. Установка дает возможность полностью обеспечить потребность предприятий любого объема производства и организаций в тяжелой воде, а также экспортировать часть воды за границу. За время работы установка создала более двадцати тонн тяжелой воды и десятки килограмм дейтерия.
Тяжелая вода играет большую роль в различных химических и биологических процессах. Ученые давно обнаружили, что вода такого вида способна препятствовать развитию бактерий, водорослей, грибов, и ткани животных. А вода с содержание 50 процентов дейтерия имеет анти мутагенное свойство, способствует увеличению биологической массы, ускоряет развитие половых органов у людей.
В европейских странах ученые поили тяжелой водой мышей со злокачественной опухолью. Вода погубила не только опухоль, но и самих носителей. Исследования установили, что такая вода действует плохо на растения и животных. Собак, крыс и мышей для эксперимента поили тяжелой водой. Однако через некоторое время у подопытных началось расстройство обмена веществ, а почки разрушились. Если доля воды повышалась, животные погибали. Если же норма снижалась до 25 процентов, животные становились крупнее и приносили качественные плоды. Яйценоскость кур увеличивалась. Эта вода задерживает возникновение узелков на шейке матки. На появление других типов узелков вода не действует.
Но опухоли, уменьшаются в размерах. К несчастью тяжелая вода способна замедлить рост опухоли, но продлить жизнь она не может. После такого эксперимента, было решено, полностью изъять содержание дейтерия из употребления воды. Это способствовало бы обмену веществ в организме, а значит и увеличило бы его физическую и мыслительную активность. Но со временем возникла проблема. Если полностью изъять дейтерий из воды, человеческая жизнь будет сокращена в несколько раз. Так как организм человека состоит из семидесяти процентов воды. В этой воде находится 0,015 процентов дейтерия. По количественному содержанию он находится на двенадцатом месте элементов, которые находятся в организме человека. В таком соотношении его можно отнести к разряду микроэлементов. Возникает вопрос, что произойдет, если полностью избавиться от дейтерия? На данный вопрос ученым еще предстоит ответить.
www.watermap.ru
Тяжелая вода - это... Что такое Тяжелая вода?
| Другие названия | оксид дейтерия |
| Формула | D2O |
| Молярная масса | 20,04 г/моль |
| В твердом виде | ? |
| Вид | прозрачная жидкость без цвета,вкуса и запаха |
| Номер CAS | [7732-20-0] |
| Плотностьи фазовое состояние | 1104,2 кг/м³, жидкость1017,7 кг/м³, твёрдая (при н. у.) |
| Растворимость | Малорастворима в диэтиловом эфире;Смешивается с этанолом;C обычной водой смешиваетсяв любых пропорциях. |
| удельная теплоёмкость | 5,301(?) кДж/моль |
| Точка плавления | 3,81 °C (276,97 K) |
| Точка кипения | 101,43 °C (374,55 K) |
| Константа диссоциациикислоты (pKa) | ? |
| Вязкость | 0,00125 Па·с (0,0125 пз) при 20 °C |
Тяжёлая вода́ (также оксид дейтерия) — обычно этот термин применяется для обозначения тяжёловодородной воды.
Тяжёловодородная вода имеет ту же химическую формулу, что и обычная вода, но вместо атомов обычного лёгкого изотопа водорода (протия) содержит два атома тяжёлого изотопа водорода — дейтерия. Формула тяжёловодородной воды обычно записывается как D2O или ²h3O. Внешне тяжёлая вода выглядит как обычная — бесцветная жидкость без вкуса и запаха.История открытия
Молекулы тяжёловодородной воды были впервые обнаружены в природной воде Гарольдом Юри в 1932 году, за что был отмечен Нобелевской премией по химии в 1934 году. А уже в 1933 году Гилберт Льюис выделил чистую тяжёловодородную воду.
Свойства
| Молекулярная масса | 20,03 а.е.м. |
| Давление паров | 10 мм. рт. ст. (при 13,1 °C), 100 мм. рт. ст. (при 54 °C) |
| Показатель преломления | 1,32844 (при 20 °C) |
| Энтальпия образования ΔH | −294,6 кДж/моль (ж) (при 298 К) |
| Энергия Гиббса образования G | −243,48 кДж/моль (ж) (при 298 К) |
| Энтропия образования S | 75,9 Дж/моль·K (ж) (при 298 К) |
| Мольная теплоёмкость Cp | 84,3 Дж/моль·K (жг) (при 298 К) |
| Энтальпия плавления ΔHпл | 5,301 кДж/моль |
| Энтальпия кипения ΔHкип | 45,4 кДж/моль |
| Критическое давление | 21,86 МПа |
| Критическая плотность | 0,363 г/см³ |
Нахождение в природе
В природных водах один атом дейтерия приходится на 6400 атомов протия. Почти весь он находится в составе молекул полутяжёлой воды DHO (см. ниже), одна такая молекула приходится на 3200 молекул лёгкой воды. Лишь очень незначительная часть атомов дейтерия формирует молекулы тяжёлой воды D2O, поскольку вероятность двух атомов дейтерия встретиться в составе одной молекулы в природе мала (примерно 0,5·10−7). При искусственном повышении концентрации дейтерия в воде эта вероятность растёт.
Биологическая роль и физиологическое воздействие
Тяжёлая вода токсична лишь в слабой степени, химические реакции в её среде проходят несколько медленнее, по сравнению с обычной водой, водородные связи с участием дейтерия несколько сильнее обычных. Эксперименты над млекопитающими (мыши, крысы, собаки)[1] показали, что замещение 25 % водорода в тканях дейтерием приводит к стерильности, иногда необратимой. Более высокие концентрации приводят к быстрой гибели животного; так, млекопитающие, которые пили тяжёлую воду в течение недели, погибли, когда половина воды в их теле была дейтерирована; рыбы и беспозвоночные погибают лишь при 90% дейтерировании воды в теле. Некоторые микроорганизмы и грибы способны жить в 70 % растворе D2O в h3O и даже в чистой тяжёлой воде[1]. Человек может без всякого вреда для здоровья выпить несколько стаканов тяжёлой воды, весь дейтерий будет выведен из организма через несколько дней.Таким образом, тяжёлая вода гораздо менее токсична, чем, например, поваренная соль. Тяжёлая вода использовалась для лечения артериальной гипертензии у людей в суточных дозах до 1,7 г дейтерия на кг веса пациента; этот метод запатентован (U.S. Patent 5223269 (англ.)).
Некоторые сведения
Тяжёлая вода накапливается в остатке электролита при многократном электролизе воды. На открытом воздухе тяжёлая вода быстро поглощает пары обычной воды, поэтому можно сказать, что она гигроскопична. Производство тяжёлой воды очень энергоёмко, поэтому её стоимость довольно высока (ориентировочно 200—250 долларов за литр).
Среди населения бытует миф о том, что при длительном кипячении природной воды концентрация тяжёлой воды в ней повышается, что якобы может вредно сказаться на здоровье. В действительности же реальное повышение концентрации тяжёлой воды при кипячении ничтожно (менее процента) и к тому же, как сказано выше, тяжёлая вода практически не ядовита. Гораздо сильнее сказывается на вкусе и свойствах воды при кипячении повышение концентрации растворённых солей.
Применение
Важнейшим свойством тяжёловодородной воды является то, что она практически не поглощает нейтроны, поэтому используется в ядерных реакторах для торможения нейтронов и в качестве теплоносителя. Она используется также в качестве изотопного индикатора в химии, биологии и гидрологии. В физике элементарных частиц тяжёлая вода используется для детектирования нейтрино; так, крупнейший детектор солнечных нейтрино SNO (Канада) содержит 1 килотонну тяжёлой воды.
Другие виды тяжёлых вод
Полутяжёлая вода
Выделяют также полутяжёлую воду (известную также под названиями дейтериевая вода, монодейтериевая вода, гидроксид дейтерия), у которой только один атом водорода замещен дейтерием. Формулу такой воды записывают так: DHO или ²HHO. Следует отметить, что вода, имеющая формальный состав DHO, вследствие реакций изотопного обмена реально будет состоять из смеси молекул DHO, D2O и h3O (в пропорции примерно 2:1:1). Это замечание справедливо и для THO и TDO.
Сверхтяжёлая вода
Основная статья: Сверхтяжёлая вода
Сверхтяжёлая вода содержит тритий, период полураспада которого более 12 лет. По своим свойствам сверхтяжёлая вода (T2O) еще заметнее отличается от обычной: кипит при 104 °С, замерзает при +9 °С и имеет плотность 1,33 г/см3. Известны (то есть получены в виде более или менее чистых макроскопических образцов) все девять вариантов сверхтяжёлой воды: THO, TDO и T2O с каждым из трёх стабильных изотопов кислорода. Иногда сверхтяжёлую воду называют просто тяжёлой водой, если это не может вызвать путаницы. Сверхтяжёлая вода имеет высокую радиотоксичность.
Тяжёлокислородные изотопные модификации воды
Термин тяжёлая вода применяют также по отношению к тяжёлокислородной воде, у которой обычный лёгкий кислород 16O заменён одним из тяжёлых стабильных изотопов 17O или 18O. Тяжёлые изотопы кислорода существуют в природной смеси, поэтому в природной воде всегда есть примесь обеих тяжёлокислородных модификаций.
Общее число изотопных модификаций воды
Если подсчитать все возможные нерадиоактивные соединения с общей формулой Н2О, то общее количество возможных изотопных модификаций воды всего девять (так как существует два стабильных изотопа водорода и три — кислорода):
- Н216O − лёгкая вода, или просто вода
- Н217O
- Н218O − тяжёлокислородная вода
- HD16O − полутяжёлая вода
- HD17O
- HD18O
- D216O − тяжёлая вода
- D217O
- D218O
С учётом трития их число возрастает до 18. Таким образом, кроме обычной, наиболее распространённой в природе «лёгкой» воды 1h316O, в общей сложности существует 8 нерадиоактивных (стабильных) и 9 слаборадиоактивных «тяжёлых вод».
Всего же общее число возможных «вод» с учётом всех известных изотопов водорода (7) и кислорода (17) формально равняется 476 (!). Однако распад почти всех радиоактивных изотопов водорода и кислорода происходит за секунды или доли секунды (важным исключением является тритий, период полураспада которого более 12 лет). Например, все более тяжёлые, чем тритий, изотопы водорода живут порядка 10−20 с; за это время никакие химические связи просто не успевают образоваться, и, следовательно, молекул воды с такими изотопами не бывает. Тяжёлые радиоизотопы кислорода имеют периоды полураспада от нескольких десятков секунд до наносекунд. Поэтому макроскопические образцы воды с такими изотопами получить невозможно, хотя молекулы и микрообразцы могут быть получены.
См. также
Ссылки
- ↑ 1 2 D. J. Kushner, Alison Baker, and T. G. Dunstall (1999). "Pharmacological uses and perspectives of heavy water and deuterated compounds". Can. J. Physiol. Pharmacol. 77 (2): 79–88. DOI:10.1139/cjpp-77-2-79. PMID 10535697. “used in boron neutron capture therapy ... D2O is more toxic to malignant than normal animal cells ... Protozoa are able to withstand up to 70% D20. Algae and bacteria can adapt to grow in 100% D2O”
Wikimedia Foundation. 2010.
dic.academic.ru
Тяжёлая вода - это... Что такое Тяжёлая вода?
| Другие названия | оксид дейтерия |
| Формула | D2O |
| Молярная масса | 20,04 г/моль |
| В твёрдом виде | лёд |
| Вид | прозрачная жидкость без цвета,вкуса и запаха |
| Номер CAS | [7732-20-0] |
| Плотностьи фазовое состояние | 1104,2 кг/м³, жидкость1017,7 кг/м³, твёрдая (при н. у.) |
| Растворимость | Малорастворима в диэтиловом эфире;Смешивается с этанолом;C обычной водой смешиваетсяв любых пропорциях. |
| удельная теплоёмкость | 4,105 кДж/К·кг |
| Точка плавления | 3,81 °C (276,97 K) |
| Точка кипения | 101,43 °C (374,55 K) |
| Константа диссоциациикислоты (pKa) | |
| Вязкость | 0,00125 Па·с (0,0125 пз) при 20 °C |
Тяжёлая вода́ (также оксид дейтерия) — обычно этот термин применяется для обозначения тяжёловодородной воды.
Тяжёловодородная вода имеет ту же химическую формулу, что и обычная вода, но вместо атомов обычного лёгкого изотопа водорода (протия) содержит два атома тяжёлого изотопа водорода — дейтерия. Формула тяжёловодородной воды обычно записывается как D2O или 2h3O. Внешне тяжёлая вода выглядит как обычная — бесцветная жидкость без вкуса и запаха.История открытия
Молекулы тяжёловодородной воды были впервые обнаружены в природной воде Гарольдом Юри в 1932 году, за что ученый был удостоен Нобелевской премии по химии в 1934 году. А уже в 1933 году Гилберт Льюис выделил чистую тяжёловодородную воду.
Свойства
| Молекулярная масса | 20,03 а.е.м. |
| Давление паров | 10 мм. рт. ст. (при 13,1 °C), 100 мм. рт. ст. (при 54 °C) |
| Показатель преломления | 1,32844 (при 20 °C) |
| Энтальпия образования ΔH | −294,6 кДж/моль (ж) (при 298 К) |
| Энергия Гиббса образования G | −243,48 кДж/моль (ж) (при 298 К) |
| Энтропия образования S | 75,9 Дж/моль·K (ж) (при 298 К) |
| Мольная теплоёмкость Cp | 84,3 Дж/моль·K (жг) (при 298 К) |
| Энтальпия плавления ΔHпл | 5,301 кДж/моль |
| Энтальпия кипения ΔHкип | 45,4 кДж/моль |
| Критическое давление | 21,86 МПа |
| Критическая плотность | 0,363 г/см³ |
Нахождение в природе
В природных водах один атом дейтерия приходится на 6400 атомов протия. Почти весь он находится в составе молекул полутяжёлой воды DHO, одна такая молекула приходится на 3200 молекул лёгкой воды. Лишь очень незначительная часть атомов дейтерия формирует молекулы тяжёлой воды D2O, поскольку вероятность двух атомов дейтерия встретиться в составе одной молекулы в природе мала (примерно 0,5·10−7). При искусственном повышении концентрации дейтерия в воде эта вероятность растёт.
Биологическая роль и физиологическое воздействие
Тяжёлая вода токсична лишь в слабой степени, химические реакции в её среде проходят несколько медленнее, по сравнению с обычной водой, водородные связи с участием дейтерия несколько сильнее обычных. Эксперименты над млекопитающими (мыши, крысы, собаки)[1] показали, что замещение 25 % водорода в тканях дейтерием приводит к стерильности, иногда необратимой. Более высокие концентрации приводят к быстрой гибели животного; так, млекопитающие, которые пили тяжёлую воду в течение недели, погибли, когда половина воды в их теле была дейтерирована; рыбы и беспозвоночные погибают лишь при 90 % дейтерировании воды в теле. Простейшие способны адаптироваться к 70 % раствору тяжёлой воды, а водоросли и бактерии способны жить даже в чистой тяжёлой воде[1]. Человек может без видимого вреда для здоровья выпить несколько стаканов тяжёлой воды, весь дейтерий будет выведен из организма через несколько дней.Таким образом, тяжёлая вода гораздо менее токсична, чем, например, поваренная соль. Тяжёлая вода использовалась для лечения артериальной гипертензии у людей в суточных дозах до 1,7 г дейтерия на кг веса пациента[2].
Некоторые сведения
Тяжёлая вода накапливается в остатке электролита при многократном электролизе воды. На открытом воздухе тяжёлая вода быстро поглощает пары обычной воды, поэтому можно сказать, что она гигроскопична. Производство тяжёлой воды очень энергоёмко, поэтому её стоимость довольно высока (ориентировочно 19 долларов за грамм в 2012 году[3]).
Среди населения бытует миф о том, что при длительном кипячении природной воды концентрация тяжёлой воды в ней повышается, что якобы может вредно сказаться на здоровье[источник не указан 535 дней]. В действительности же реальное повышение концентрации тяжёлой воды при кипячении ничтожно (менее процента[источник не указан 640 дней]) и к тому же, как сказано выше, тяжёлая вода практически не ядовита[источник не указан 535 дней]. Гораздо сильнее сказывается на вкусе и свойствах воды при кипячении повышение концентрации растворённых солей, переход в раствор веществ из стенок посуды и термическое разложение органических примесей.
Получение
Стоимость производства тяжёлой воды определяется затратами энергии. Поэтому при обогащении тяжёлой воды применяют последовательно разные технологии — вначале пользуются технологиями с бо́льшими потерями тяжёлой воды, но более дешёвыми, а в конце — более энергозатратными, но с меньшими потерями тяжёлой воды.
С 1933 по 1946 годы единственным применявшимся методом обогащения был электролиз. В последующем появились технологии ректификации жидкого водорода и изотопного обмена в системах водород — жидкий аммиак, водород — вода и сероводород — вода. Современное массовое производство во входном потоке использует воду, дистиллированную из электролита цехов получения электролитического водорода, с содержанием 0,1—0,2 % тяжёлой воды.
На первой стадии концентрирования применяется двухтемпературная противоточная сероводородная технология изотопного обмена, выходная концентрация тяжёлой воды 5—10 %. На второй — каскадный электролиз раствора щёлочи при температуре около 0 °C, выходная концентрация тяжёлой воды 99,75—99,995 %.
Применение
Важнейшим свойством тяжёловодородной воды является то, что она практически не поглощает нейтроны, поэтому используется в ядерных реакторах для торможения нейтронов и в качестве теплоносителя. Она используется также в качестве изотопного индикатора в химии, биологии и гидрологии. В физике элементарных частиц тяжёлая вода используется для детектирования нейтрино; так, крупнейший детектор солнечных нейтрино SNO (Канада) содержит 1000 тонн тяжёлой воды.
Другие виды тяжёлых вод
Полутяжёлая вода
Выделяют также полутяжёлую воду (известную также под названиями дейтериевая вода, монодейтериевая вода, гидроксид дейтерия), у которой только один атом водорода замещён дейтерием. Формулу такой воды записывают так: DHO или ²HHO. Следует отметить, что вода, имеющая формальный состав DHO, вследствие реакций изотопного обмена реально будет состоять из смеси молекул DHO, D2O и h3O (в пропорции примерно 2:1:1). Это замечание справедливо и для THO и TDO.
Сверхтяжёлая вода
Основная статья: Сверхтяжёлая вода
Сверхтяжёлая вода содержит тритий, период полураспада которого более 12 лет. По своим свойствам сверхтяжёлая вода (T2O) ещё заметнее отличается от обычной: кипит при 104 °C, замерзает при +9 °C и имеет плотность 1,21 г/см³.[4] Известны (то есть получены в виде более или менее чистых макроскопических образцов) все девять вариантов сверхтяжёлой воды: THO, TDO и T2O с каждым из трёх стабильных изотопов кислорода (16O, 17O и 18O). Иногда сверхтяжёлую воду называют просто тяжёлой водой, если это не может вызвать путаницы. Сверхтяжёлая вода имеет высокую радиотоксичность.
Тяжёлокислородные изотопные модификации воды
Термин тяжёлая вода применяют также по отношению к тяжёлокислородной воде, у которой обычный лёгкий кислород 16O заменён одним из тяжёлых стабильных изотопов 17O или 18O. Тяжёлые изотопы кислорода существуют в природной смеси, поэтому в природной воде всегда есть примесь обеих тяжёлокислородных модификаций. Тяжёлокислородная вода, в частности, 1h318O, используется в ранней диагностике онкологических заболеваний[источник не указан 994 дня].
Общее число изотопных модификаций воды
Если подсчитать все возможные нерадиоактивные соединения с общей формулой Н2О, то общее количество возможных изотопных модификаций воды всего девять (так как существует два стабильных изотопа водорода и три — кислорода):
- Н216O − лёгкая вода, или просто вода
- Н217O
- Н218O − тяжёлокислородная вода
- HD16O − полутяжёлая вода
- HD17O
- HD18O
- D216O − тяжёлая вода
- D217O
- D218O
С учётом трития их число возрастает до 18:
- T216O — сверхтяжелая вода
- T217O
- T218O
- DT16O
- DT17O
- DT18O
- HT16O
- HT17O
- HT18O
Таким образом, кроме обычной, наиболее распространённой в природе «лёгкой» воды 1h316O, в общей сложности существует 8 нерадиоактивных (стабильных) и 9 слаборадиоактивных «тяжёлых вод».
Всего же общее число возможных «вод» с учётом всех известных изотопов водорода (7) и кислорода (17) формально равняется 476. Однако распад почти всех радиоактивных изотопов водорода и кислорода происходит за секунды или доли секунды (важным исключением является тритий, период полураспада которого более 12 лет). Например, все более тяжёлые, чем тритий, изотопы водорода живут порядка 10−20 с; за это время никакие химические связи просто не успевают образоваться, и, следовательно, молекул воды с такими изотопами не бывает. Радиоизотопы кислорода имеют периоды полураспада от нескольких десятков секунд до наносекунд. Поэтому макроскопические образцы воды с такими изотопами получить невозможно, хотя молекулы и микрообразцы могут быть получены. Интересно, что некоторые из этих короткоживущих радиоизотопных модификаций воды легче, чем обычная «лёгкая» вода (например, 1h315O).
См. также
Примечания
dic.academic.ru
Осторожно, тяжелая вода!. Cтатьи. Наука и техника
М. АДЖИЕВ
Тяжелая вода очень дорога и дефицитна. Однако если удастся найти дешевый и практичный способ ее получения, то области применения этого редкого пока ресурса заметно расширятся. Могут открыться новые страницы в химии, биологии, а это новые материалы, неизвестные соединения, может быть, и неожиданные формы жизни.
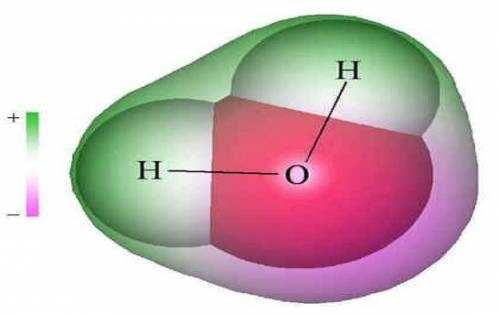
Рис. 1. Молекулы воды прочно связаны друг с другом и образуют устойчивую молекулярную конструкцию, которая сопротивляется любым внешним воздействиям, в частности тепловым. (Именно поэтому, чтобы превратить воду в пар, нужно подвести к ней много тепла). Молекулярная конструкция воды скреплена каркасом из особых квантово-механических связей, названных в 1920 году двумя американскими химиками Латимером и Родебушем водородными. Все аномальные свойства воды, включая необычное поведение при замерзании, объясняются с точки зрения концепции водородных связей.
Вода в природе бывает нескольких «сортов». Обычная, или протиевая (Н2О). Тяжелая, или дейтериевая (D2O). Сверхтяжелая, или тритиевая (Т2О), но ее в природе почти нет. Различается вода и по изотопному составу кислорода. Всего же насчитывается не менее 18 ее изотопных разновидностей.
Если мы откроем водопроводный кран и наберем чайник, то там будет не однородная вода, а ее смесь. При этом дейтериевых «вкраплений» окажется очень немного – примерно 150 граммов на тонну. Получается, что тяжелая вода есть повсюду – в каждой капле! Проблема в том, как ее взять. Ныне во всем мире ее добыча связана с огромными затратами энергии и очень сложным оборудованием.
Однако есть предположение, что на планете Земля возможны такие природные ситуации, когда тяжелая и обычная вода на какое-то время отделяются одна от другой – D2O из рассеянного, «растворенного» состояния переходит в концентрированное. Так, может быть, существуют месторождения тяжелой воды? Пока однозначного ответа нет: никто из исследователей этим вопросом прежде не занимался.
А вместе с тем известно, что физико-химические свойства D2O совсем иные, чем у Н20 – ее постоянного спутника. Так, температура кипения тяжелой воды +101,4°С, а замерзает она при +3,81°С. Ее плотность на 10 процентов больше, чем у обычной.
Надо также заметить, что происхождение тяжелой воды, по-видимому, сугубо земное – в космосе ее следов не обнаружено. Дейтерий образуется из протия вследствие захвата им нейтрона космического излучения. Мировой океан, ледники, атмосферная влага – вот природные «фабрики» тяжелой воды.
Рис. 2. Зависимость плотности обычной и тяжелой воды от температуры. Разница в плотности одной и другой разновидностей воды превышает 10%, и поэтому возможны условия, когда переход в твердое состояние при охлаждении происходит вначале у тяжелой воды, а затем у обычной. Во всяком случае, физика не запрещает появления участков твердой фазы с повышенным содержанием дейтерия. Такому «тяжелому» льду на диаграмме соответствует заштрихованный участок. Если бы вода была «нормальной», а не аномальной жидкостью, то зависимость плотности от температуры имела бы вид, показанный пунктирной линией.
Итак, поскольку есть заметная разница в плотности между D2O и Н2О, то именно плотность, а также агрегатное состояние и могут служить наиболее чувствительными критериями в поисках возможных месторождений тяжелой воды – ведь эти критерии связаны с температурой окружающей среды. А как известно, окружающая среда наиболее «контрастна» в высоких широтах планеты.
Но к настоящему времени сложилось мнение, что воды высоких широт бедны дейтерием. Поводом к этому стали результаты исследований проб воды и льда из Большого Медвежьего озера в Канаде и из других северных водоемов. Обнаружились также колебания в содержании дейтерия по сезонам года – зимой, например, в реке Колумбия его меньше, чем летом. Эти отклонения от нормы связывались с особенностями распределения атмосферных осадков, которые, как принято предполагать, «разносят» дейтерий по планете.
Похоже, что никто из исследователей сразу не заметил скрытого противоречия в этом утверждении. Да, атмосферные осадки влияют на распределение дейтерия по водоемам планеты, однако они никак не влияют на глобальный процесс образования дейтерия!
Когда на Севере наступает осень, в реках начинается быстрое остывание водной массы, которое убыстряется под воздействием вечной мерзлоты, одновременно идет ассоциация молекул h3O. Наконец, наступает критический момент максимальной плотности – температура воды всюду чуть ниже +4°С. И тогда в придонной зоне на некоторых участках интенсивно намораживается рыхлый подводный лед.
В отличие от обычного льда он не имеет правильной кристаллической решетки, у него иная структура. Центры его кристаллизации различны: камни, коряги и разные неровности, причем не обязательно лежащие на дне и связанные с мерзлым грунтом. Появляется рыхлый лед на реках глубоких, со спокойным – ламинарным – течением.
Подводное ледообразование обычно заканчивается тем, что льдины всплывают на поверхность, хотя в это время никакого другого льда нет. Подводный лед иногда появляется и летом. Возникает вопрос: что это за «вода в воде», которая меняет свое агрегатное состояние, когда установившаяся температура в реке слишком высока для того, чтобы в лед превращалась обычная Н2О, чтобы, как говорят физики, произошел фазовый переход?
Можно допустить, что рыхлый лед представляет собой обогащенные концентрации тяжелой воды. Кстати, если это так, то нужно помнить, что тяжелая вода не отличима от обычной, однако потребление ее внутрь организма может вызвать тяжелые отравления. К слову сказать, местные жители высоких широт не употребляют речной лед для приготовления пищи – только озерный лед или снег.
«Механизм» фазового перехода D2O в реке очень напоминает тот, что используется химиками в так называемых кристаллизационных колоннах. Только в северной реке «колонна» растянута на сотни километров и не столь контрастна по температурному режиму.
Если же иметь в виду, что через центры кристаллизации в реке за короткое время проходят сотни и тысячи кубических метров воды, из которых превращается в лед – намораживается – пусть тысячная доля процента, то и этого достаточно, чтобы говорить о способности тяжелой воды концентрироваться, то есть образовывать месторождения.
Только присутствием таких концентраций можно объяснить тот доказанный факт, что зимой в северных водоемах процентное содержание дейтерия заметно уменьшается. Да и полярные воды, как показывают пробы, тоже бедны дейтерием, и в Арктике, вполне вероятно, есть районы, где плавают в основном только льдины, обогащенные дейтерием, – ведь рыхлый донный лед появляется первым и тает последним.
Больше того, как показали исследования, ледники и льды высоких широт в целом богаче тяжелыми изотопами, чем воды, омывающие льды. Например, в Южной Гренландии, в районе станции «Дай-3», выявлены изотопные аномалии на поверхности ледников, и происхождение таких аномалий пока не объяснено. Значит, могут встретиться и льдины, обогащенные дейтерием. Дело, как говорится, за малым – нужно найти эти пока еще гипотетические месторождения тяжелой воды.
Об авторе:
М. АДЖИЕВ, географ.
Источники информации:
- Л. Кульский, В. Даль, Л. Ленчина. Вода знакомая и загадочная. – К.: «Радянська школа», 1982.
- Наука и жизнь №10, 1988.
Дата публикации:
6 сентября 2000 года
n-t.ru
Что такое "тяжелая вода"?
До XIX века люди считали воду обычным химическим элементом. В 1805 году Александр Гумбольдт и Жозеф Луи Гей-Люссак установили, что вода состоит из молекул, каждая из которых содержит два атома водорода и один кислорода и считалось, что вода - индивидуальное соединение, описываемое единственно возможной формулой.
В 1932 году мир облетела сенсация: кроме воды обычной, в природе существует еще и тяжелая вода. В молекулах такой воды место водорода занимает его тяжелый изотоп - дейтерий.
Тяжелую воду открыли американские физики Гаральд Юри и Эльберт Осборн. В 1933 году американец Герберт Льюис совместно с Ричардом Макдональдом впервые выделили ее в чистом виде.
В небольших количествах тяжелая вода постоянно и повсеместно присутствует в природных водах, которую от обычной воды можно различить лишь по физическим характеристикам. В молекулу тяжелой воды входят атомы не легкого водорода - протия (1H), а его тяжёлого изотопа - дейтерия (2D), атом которого на единицу тяжелее протиевого, а молекулярный вес тяжелой воды на 2 единицы больше: 20, а не 18. Тяжёлая на 10% плотнее обычной, вязкость выше на 23%, кипит при 101,42 oС, замерзает при +3,8 oС.
Содержание тяжелой воды в природных водах не равномерно. Например, в замкнутых водоемах ее больше, поскольку по сравнению с обычной водой она испаряется менее интенсивно.
Тяжелой воды больше в местностях с жарким климатом, на поверхности океана на экваторе и в тропиках. Тяжелая вода конденсируется быстрее, чем легкая. Вблизи полюсов в высоких южных широтах (в Антарктике) океанские воды заметно "легче" и отличаются самым низким содержанием дейтерия на планете. Так же невелика доля дейтерия во льдах Гренландии.
Тяжелая вода в природе находится в небольших количествах - в миллионных долях процента. Преобладает ее разновидность, состав которой выражается формулой HDO. В Мировом океане содержится 1015 тонн HDO.
Тяжелая вода - очень важное промышленное сырье для атомной энергетики, эффективный замедлитель быстрых нейтронов. Так, 1 г дейтерия при термоядерном распаде дает в 10 млн. раз больше энергии, чем 1 г угля при сгорании.
Тяжелая вода из за значительного изотопного эффекта, обусловленного двукратным увеличением массы дейтерия относительно протия, действует негативно на жизненные функции организмов; это происходит даже при использовании обычной природной воды с повышенным содержанием тяжелой воды.
Подопытных животных поили водой, 1/3 часть которой была заменена водой состава HDO. Через недолгое время начиналось расстройство обмена веществ животных, разрушались почки. При увеличении доли тяжелой воды животные погибали.
На развитие высших растений тяжелая вода также действует угнетающе; при поливе их водой, на половину состоящей из тяжелой воды, рост прекращается.
Но всё же несмотря на это многие клетки бактерий, растений и водорослей могут быть адаптированы к росту на тяжёлой воде.
Пониженное содержание дейтерия в воде стимулирует жизненные процессы. При потреблении воды с содержанием дейтерия на 25% ниже нормы свиньи, крысы и мыши дали потомство, гораздо многочисленнее и крупнее обычного, яйценоскость кур поднялась вдвое, пшеница созрела раньше и дала более высокий урожай. Это может быть объяснено разницей в плотности и вязкости тяжёлой воды, а также её гидрофобными эффектами.
Термин "тяжелая вода" на практике не имеет эквивалента. Вода, отвечающая формуле D218O, фактически заменяется смесью разновидностей воды с постоянной водородной частью (здесь это дейтерий) и с содержанием изотопов кислорода в соответствии с изотопным составом воздуха.
Существует также и полутяжёлая (или дейтериевая) вода, у которой только один атом водорода замещен дейтерием. Формулу такой воды записывают так: DHO.
Вообще термин тяжёлая вода применяют также по отношению к воде, у которой любой из атомов заменен тяжёлым изотопом:
к тяжёлокислородной воде (в ней лёгкий изотоп кислорода 16O замещен тяжёлыми изотопами 17O или 18O),
к тритиевой и сверхтяжёлой воде (содержащей вместо атомов 1H его радиоактивный изотоп тритий 3H).
Открытие тяжелой воды послужило толчком к выяснению фракционного состава воды. Вскоре была обнаружена сверхтяжелая вода Т20. В ее составе место водорода занимает его природный изотоп, еще более тяжелый, чем дейтерий. Это тритий (Т), он радиоактивен, атомная масса его равна 3. Тритий зарождается в высоких слоях атмосферы, где идут природные ядерные реакции. Он является одним из продуктов бомбардировки атомов азота нейтронами космического излучения. Ежеминутно на каждый квадратный сантиметр земной поверхности падают 8-9 атомов трития.
В небольших количествах сверхтяжелая (тритиевая) вода попадает на Землю в составе осадков. Во всей гидросфере одновременно насчитывается лишь около 20 кг Т20.
Тритиевая вода распределена неравномерно: в материковых водоемах ее больше, чем в океанах; в полярных океанских водах ее больше, чем в экваториальных. По своим свойствам сверхтяжелая вода еще заметнее отличается от обычной: кипит при 104°С, замерзает при 4...9°С, имеет плотность 1,33 г/см3.
Сверхтяжелую воду применяют в термоядерных реакциях. Она удобнее дейтериевой, так как чувствительнее в определении.
Перечень изотопов водорода не кончается тритием. Искусственно получены и более тяжелые изотопы 4H и 5H,тоже радиоактивные. Учёные предсказали существование молекул воды, в которых содержатся любые из пяти водородных изотопов в любом сочетании.
Этим не исчерпывается сложность изотопного состава воды. В природе существуют также изотопы кислорода, которые формируют так называемую тяжёлокислородную воду. В периодической системе химических элементов Д.И. Менделеева значится всем известный кислород 16O.
Существуют еще два природных изотопа кислорода – 17O и 18O. В природных водах в среднем на каждые 10 тысяч атомов изотопа 16O приходится 4 атома изотопа 17O и 20 атомов изотопа 18O.
По физическим свойствам тяжелокислородная вода меньше отличается от обычной, чем тяжеловодородная. Получают ее в основном перегонкой природной воды и используют как источник препаратов с меченым кислородом.
Помимо двух природных 17O и 18O, существуют и шесть искусственно созданных изотопов кислорода. Как и искусственные изотопы водорода, они недолговечны и радиоактивны. Из них: 13O, 14O и 15O – легкие, 19O и 20O – тяжелые, а сверхтяжелый изотоп – 24O получен в 1970 году.
Существование пяти водородных и девяти кислородных изотопов говорит о том, что теоретически изотопных разновидностей воды может быть 135.
Если подсчитать все возможные различные соединения с общей формулой Н2О, то общее количество возможных «тяжёлых вод» достигнет 48. Из них 39 вариантов — радиоактивные, а стабильных вариантов всего девять:
Н21 6O, Н217O, Н218O, HD16O, HD17O, HD18O, D216O, D217O, D218O.
Таким образом, возможно существование молекул воды, в которых содержатся любые из пяти водородных изотопов в любом сочетании.
Основную массу природной воды - свыше 99% - составляет протиевая вода - 1h316O.
Тяжелокислородных вод намного меньше: 1h318O - десятые доли процента. 1h317O - сотые доли от общего количества природных вод.
Только миллионные доли процента составляет тяжелая вода D2O, в форме 1HDO тяжелой воды в природных водах содержится уже заметно больше.
Еще реже, чем D2O, встречаются и девять радиоактивных естественных видов воды, содержащих тритий.
Классической водой следует считать протиевую воду 1h316O в чистом виде, то есть без малейших примесей остальных 134 изотопных разновидностей. И хотя содержание протиевой воды в природе значительно превосходит содержание всех остальных вместе взятых видов, чистой 1h316O в естественных условиях не существует, есть лишь в немногих специальных лабораториях. Ее получают очень сложным путем и хранят с большими предосторожностями. Для получения чистой 1h316O ведут очень тонкую, многостадийную очистку природных вод или синтезируют воду из исходных элементов 1h3 и 16O2, которые предварительно тщательно очищают от изотопных примесей. Такую воду применяют в экспериментах и процессах, требующих исключительной чистоты химических реактивов.
vorum.ru