Водорода оксид: получение и свойства. Кислотно основные свойства воды
13.Ионное произведение воды
Чистая вода очень плохо проводит электрический ток, но все же обладает измеримой электрической проводимостью, которая объясняется небольшой самодиссоциацией воды на катионы водорода и гидроксид-анионы Н2О=Н++ ОН-. Константа ионизации воды. Так как вода – очень слабый электролит, то концентрация недиссоциированных молекул может быть принята равной общему количеству молей в 1л воды [h3O]=1000/18=55,56 моль/л. Тогдаk[h3O]=[Н+] [ОН-] или [Н+] [ОН-]=1,8∙10-16 ∙ 55,56=10-14. Величина [Н+] [ОН-]=10-14 называется ионным произведением воды.
Важность этой величины (ионного произведения воды) состоит в том, что она сохраняет свою величину (является однозначной) для водных растворов любых веществ.
При добавлении кислоты концентрация ионов водорода увеличивается и соответственно уменьшается концентрация гидроксид-ионов, поскольку при данной температуре (22°С) ионное произведение воды – величина постоянная. При добавлении щелочи наблюдается обратная картина. Таким образом, концентрация ионов водорода в растворе может служить мерой кислотности или щелочности среды. В кислых растворах [Н+]>10-7, в щелочных [Н+]<10-7, в нейтральных [Н+]=10-7.
Концентрация водородных ионов и водородный показатель
водородный показатель рН – это отрицательный десятичный логарифм концентрации водородных ионов. . Тогда для нейтральной среды, для кислых растворов рН<7, для щелочных рН>7.
Понятие об индикаторах
Для определения рН используют кислотно-щелочные индикаторы, которые представляют собой слабые органические кислоты и основания, имеющие различную окраску в диссоциированной и молекулярной формах
14.Кислотно-основные свойства веществ.Кислоты, основания и соли с точки зрения теории элд
Со временАррениуса, по определению которогокислотыв водных растворах диссоциирует на ионы водорода и анионы, а основания диссоциируют на гидроксид-ионы и катионы, круг веществ, участвующих в реакциях кислотно-основного равновесия, значительно расширился. Общепринятными считаются протонная теорияБренстеда–Лоурии электронная теорияЛьюиса.
Протонная теория Бренстеда–Лоуриприменима лишь к протонсодержащим или протонприсоединяющим веществам. Согласно этой теории кислотой называется вещество, способное быть донором протонов, а основанием – вещество, которое может присоединить (акцептировать) протон:
По определению, HAn – кислота, An–– основание, сопряженное с этой кислотой. Любой кислоте соответствует сопряженное с ней основание.
Любое кислотно-основное равновесие включает взаимодействие двух пар сопряженных кислот и оснований.
| Рисунок 6.7 |
В определенных условиях многие вещества могут вести себя как кислота или как основание. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества.
В соответствии с законом действующих масс константы равновесия реакций протолиза сопряженных кислот и оснований в воде связаны между собой простым соотношением
Перемножив константы сопряженных кислот и оснований, получим
Заменив активности ина равновесные концентрации, получим
| |
Произведения констант диссоциации сопряженных кислот и оснований в водных растворах равно ионному произведению воды. По известным KK(Kосн) можно легко найти значения сопряженныхKВ.
Электронная теория Льюисадопускает, что участие в кислотно-основном равновесии протона необязательно, поэтому ее называют апротонной. Согласно апротонной (электронной) теории, кислотой называется вещество, способное присоединять электронную пару, а основанием – вещество, способное отдавать электронную пару.
При взаимодействии донора электронной пары: NF3(кислота) и акцептора электронной пары BF3(основание) образуется более устойчивое электронное окружение (октет) за счет донорно-акцепторной (двухэлектронной двухцентровой) связи.
Ни кислота, ни основание протонов не содержат.
Эта концепция расширяет границы веществ, проявляющих кислотно-основные свойства, включая в себя протонотдающие и протонприсоединяющие системы.
В периоде сила кислородсодержащей кислоты растет с увеличением заряда и с уменьшением радиуса иона кислотообразующего элемента:
Для одного и того же элемента константа диссоциации различных кислот возрастает по мере увеличения степени окисления кислотообразующего элемента примерно на пять порядков каждый раз.
В пределах одной группы элементов сила кислоты уменьшается по мере увеличения радиуса кислотообразующего элемента:
Для многоосновных кислот способность к депротонизации уменьшается по мере увеличения отрицательного заряда аниона:
При этом константа диссоциации каждой последующей ступени уменьшается примерно на пять порядков:
| K1:K2:K3= 1 : 10–5: 10–10. |
На состояние динамического равновесия, в котором находится раствор слабого электролита, сильно влияет присутствие одноименного иона. Так, диссоциация уксусной кислоты протекает по схеме
и для этой реакции
Прибавление к раствору уксусной кислоты ее соли (Ch4COONa → Ch4COO–+ Na+) резко увеличивает концентрацию ионов Ch4COO–и смещает равновесие в сторону образования недиссоциированных молекул кислоты. Ее диссоциация теперь пренебрежимо мала, и концентрация недиссоциированных молекул почти равна концентрации кислоты, тогда при [Ch4COOH] = [кислота], и [Ch4COO–] = [соль] концентрация H+равна
или
| |
Следовательно, концентрация ионов H+этого раствора будет определяться соотношением концентраций кислоты и соли, взятых для его приготовления.
Рассуждая аналогичным образом, можно вывести уравнения для раствора слабого основания и его соли (Nh4∙h3O и Nh5Cl):
или
Амфолиты
Амфотерные электролиты (амфолиты) – это вещества, которые одновременно могут проявлять и кислотные, и основные свойства.
К амфотерным относятся две группы веществ:
1. вещества, у которых и кислотные, и основные свойства определяются одной и той же функциональной группой – ОН. К таким веществам можно отнести Zn(OH)2, Al(OH)3:
2. вещества, у которых кислотные и основные свойства определяются наличием разных функциональных групп. К таким вещества относятся аминокислоты типа Nh3RCOOH. В водных растворах жирные аминокислоты полностью или частично переходят в форму: Nh4+RCOO-- это ион, несущий одновременно и положительный и отрицательный заряд.
studfiles.net
13.Ионное произведение воды
Чистая вода очень плохо проводит электрический ток, но все же обладает измеримой электрической проводимостью, которая объясняется небольшой самодиссоциацией воды на катионы водорода и гидроксид-анионы Н2О=Н+ + ОН-. Константа ионизации воды . Так как вода – очень слабый электролит, то концентрация недиссоциированных молекул может быть принята равной общему количеству молей в 1л воды [h3O]=1000/18=55,56 моль/л. Тогда k[h3O]=[Н+] [ОН-] или [Н+] [ОН-]=1,8∙10-16 ∙ 55,56=10-14. Величина [Н+] [ОН-]=10-14 называется ионным произведением воды.
Важность этой величины (ионного произведения воды) состоит в том, что она сохраняет свою величину (является однозначной) для водных растворов любых веществ.
При добавлении кислоты концентрация ионов водорода увеличивается и соответственно уменьшается концентрация гидроксид-ионов, поскольку при данной температуре (22°С) ионное произведение воды – величина постоянная. При добавлении щелочи наблюдается обратная картина. Таким образом, концентрация ионов водорода в растворе может служить мерой кислотности или щелочности среды. В кислых растворах [Н+]>10-7, в щелочных [Н+]<10-7, в нейтральных [Н+]=10-7.
Концентрация водородных ионов и водородный показатель
водородный показатель рН – это отрицательный десятичный логарифм концентрации водородных ионов. . Тогда для нейтральной среды, для кислых растворов рН<7, для щелочных рН>7.
14.Кислотно-основные свойства веществ. Кислоты, основания и соли с точки зрения теории элд
Со времен Аррениуса, по определению которогокислоты в водных растворах диссоциирует на ионы водорода и анионы, а основания диссоциируют на гидроксид-ионы и катионы, круг веществ, участвующих в реакциях кислотно-основного равновесия, значительно расширился. Общепринятными считаются протонная теория Бренстеда–Лоурии электронная теорияЛьюиса.
Протонная теория Бренстеда–Лоури применима лишь к протонсодержащим или протонприсоединяющим веществам. Согласно этой теории кислотой называется вещество, способное быть донором протонов, а основанием – вещество, которое может присоединить (акцептировать) протон.
Любой кислоте соответствует сопряженное с ней основание.
В определенных условиях многие вещества могут вести себя как кислота или как основание. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества.
Произведения констант диссоциации сопряженных кислот и оснований в водных растворах равно ионному произведению воды. По известным KK(Kосн) можно легко найти значения сопряженных KВ.
Произведения констант диссоциации сопряженных кислот и оснований в водных растворах равно ионному произведению воды. По известным KK(Kосн) можно легко найти значения сопряженных KВ.
Электронная теория Льюиса допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому ее называют апротонной. Согласно апротонной (электронной) теории, кислотой называется вещество, способное присоединять электронную пару, а основанием – вещество, способное отдавать электронную пару.
Ни кислота, ни основание протонов не содержат.
Эта концепция расширяет границы веществ, проявляющих кислотно-основные свойства, включая в себя протонотдающие и протонприсоединяющие системы.
концентрация ионов H+ этого раствора будет определяться соотношением концентраций кислоты и соли, взятых для его приготовления.
Амфолиты
Амфотерные электролиты (амфолиты) – это вещества, которые одновременно могут проявлять и кислотные, и основные свойства.
К амфотерным относятся две группы веществ:
1. вещества, у которых и кислотные, и основные свойства определяются одной и той же функциональной группой – ОН. К таким веществам можно отнести Zn(OH)2, Al(OH)3:
2. вещества, у которых кислотные и основные свойства определяются наличием разных функциональных групп. К таким вещества относятся аминокислоты типа Nh3RCOOH. В водных растворах жирные аминокислоты полностью или частично переходят в форму: Nh4+RCOO- - это ион, несущий одновременно и положительный и отрицательный заряд.
studfiles.net
Водорода оксид: получение и свойства
Самое важное и распространенное на нашей планете вещество, безусловно, вода. Что может сравниться с ней по значимости? Известно, что жизнь на Земле стала возможна только с появлением жидкости. Что же собой представляет вода (оксид водорода) с химической точки зрения? Из чего состоит и какими свойствами обладает? Попробуем разобраться в данной статье.

Водород и его соединения
Самый легкий атом во всей периодической системе - водород. Он же занимает двойственное положение, располагаясь как в подгруппе галогенов, так и и первой группе щелочных металлов. Чем объясняются такие особенности? Электронным строением оболочки его атома. У него всего один электрон, который свободно может как уходить, так и присоединять себе еще один, формируя пару и завершая внешний уровень.
Именно поэтому основные и единственные степени окисления данного элемента +1 и -1. Он легко вступает во взаимодействие с металлами, образуя гидриды - твердые нелетучие солеподобные соединения белого цвета.
Однако также легко водород формирует и летучие молекулы веществ, взаимодействуя с неметаллами. Например:
- сероводород h3S;
- метан СН4;
- силан Sih5 и прочие.
В целом соединений водород формирует достаточно много. Однако самым важным веществом, в состав которого он входит, является оксид водорода, формула которого Н2О. Это самое известное соединение, которое узнает по формуле даже ученик начальных классов, еще не знакомый с химией. Ведь вода (а это и есть высший оксид водорода) - не только распространенное вещество, но и источник жизни на нашей планете.
Само название элемента отражает его главную сущность - водород, то есть "рождающий воду". Как и любой другой оксид, данный также является бинарным соединением, обладающим рядом физических, химических свойств. Кроме того, имеются и особые характеристики, отличающие воду от всех других соединений.
Также важным классом соединений, которые образует водород, являются кислоты, как органические, так и минеральные.

Химические свойства водорода
С точки зрения химической активности, водород - достаточно сильный восстановитель. Во многих реакциях он проявляет именно такие свойства. Однако при взаимодействии с еще более сильными металлами, он становится окислителем.
Очень важным в промышленности является взаимодействие водорода с оксидами металлов. Ведь это один из способов получения последних в чистом виде. Водородотермия - это металлургический метод синтеза чистых металлов из их оксидов путем восстановления водородом.
Реакция водорода с оксидом имеет следующий общий вид: MexOy + h3 = h3O + Me.
Конечно, это далеко не единственный способ синтеза чистых металлов. Существуют и другие. Однако восстановление оксидов водородом - энергетически достаточно выгодный и несложный производственный процесс, нашедший себе широкое применение.
Также интересна та особенность, что при смешении с воздухом газ водород способен образовывать сильно взрывчатую смесь. Ее название гремучий газ. Для этого смешивание следует производить из расчета два объема водорода на один кислорода.
Вода - оксид водорода
То, что данный оксид очень важный, мы уже несколько раз упомянули. Теперь давайте охарактеризуем его с точки зрения химии. Действительно ли данное соединение относится именно к этому классу неорганических веществ?
Для этого попробует немного иначе записать формулу: h3O = НОН. Суть та же, количество атомов прежнее, однако, теперь очевидно, что перед нами гидроксид. Какими свойствами должен он обладать? Рассмотрим диссоциацию соединения:
НОН = Н+ + ОН-.
Следовательно, свойства кислотные, так как в растворе присутствуют катионы водорода. К тому же основными они быть не могут, ведь щелочи формируют только металлы.

Поэтому еще одно название, которое имеет водорода оксид - кислородсодержащая кислота самого простого состава. Раз такие сложные переплетения характерны для данной молекулы, следовательно, и свойства ее будут особенными. А свойства отталкиваются от строения молекулы, поэтому его и разберем.
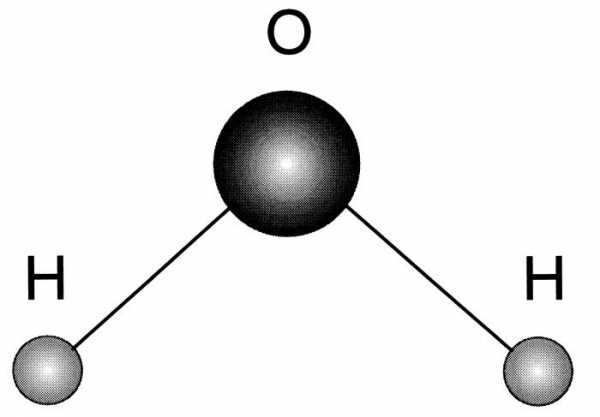
Строение молекулы воды
Впервые о данной модели задумался Нильс Бор, ему и принадлежит первенство и авторство в этом вопросе. Им были установлены следующие особенности.
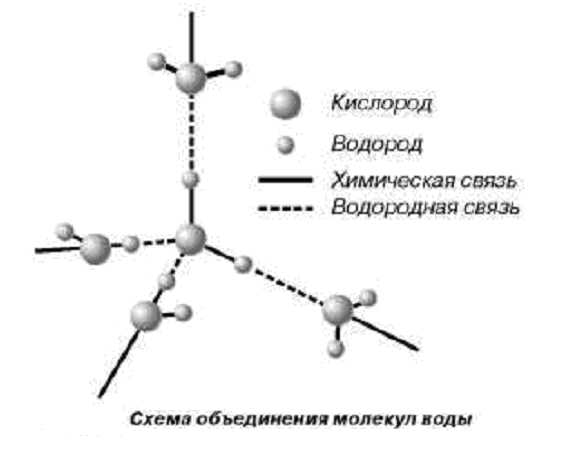
- Молекула воды - диполь, так как элементы, входящие в ее состав сильно отличаются по значению электроотрицательности.
- Форма ее треугольная, в основании - водороды, а в вершине - кислород.
- Благодаря такому строению, данное вещество способно формировать водородные связи, как между одноименными молекулами, так и с другими соединениями, имеющими в составе сильно электроотрицательный элемент.
Посмотреть, как схематически выглядит рассматриваемый водорода оксид, можно на фото ниже.
Физические свойства оксида водорода
Можно обозначить несколько основных характеристических черт.
- Агрегатное состояние: газообразное - пар, жидкое, твердое - снег, лед.
- Температура кипения - 1000С (99,974).
- Температура плавления - 00С.
- Вода способна сжиматься при нагревании в интервале температур от 0-40С. Этим объясняется образование льда на поверхности, который имеет меньшую плотность и сохранение жизни под толщей оксида водорода.
- Высокое значение теплоемкости, однако очень низкая теплопроводность.
- В жидком состоянии водорода оксид проявляет вязкость.
- Особенным свойством можно назвать поверхностное натяжение и формирование отрицательного электропотенциала на поверхности воды.
Как мы отмечали выше, особенности свойств зависят от строения. Так и здесь. Способность формировать водородные связи привела к подобным чертам данного соединения.
Водорода оксид: химические свойства
С точки зрения химии, активность воды достаточно высока. Особенно если речь идет о реакциях, сопровождаемых нагреванием. С чем способен вступать во взаимодействие оксид водорода?
- С металлами, которые в ряду напряжений стоят до водорода. При этом с самыми активными (до алюминия) не нужны особые условия, а обладающие более низкой восстановительной способностью реагируют только с паром. Те же, что стоят после водорода, вообще не способны вступать в подобные взаимодействия.
- С неметаллами. Не со всеми, однако с большинством. Например, в атмосфере фтора вода сгорает фиолетовым пламенем. Также реакция возможна с хлором, углеродом, кремнием и другими атомами.
- С оксидами металлов (основными) и кислотными (неметаллов). Образуются, соответственно, щелочи и кислоты. Среди металлов к таким реакциям способны представители первых двух групп главных подгрупп, кроме магния и бериллия. Неметаллы, образующие кислотные оксиды, взаимодействуют с водой все. Исключением является речной песок - SiO2.
Уравнение реакций оксида водорода в качестве примера можно привести следующее: SO3 + h3O = h3SO4.

Распространение в природе
Мы уже выяснили, что данное вещество - самое распространенное в мире. Обозначим процентное содержание в объектах.
- Около 70% от массы тела человека и млекопитающих животных. Некоторые представители фауны состоят из оксида водорода примерно на 98% (медузы).
- 71% Земли покрыт водой.
- Наибольшая масса составляет воды Мирового океана.
- Около 2% содержится в ледниках.
- 0,63% сосредоточено под землей.
- 0,001% приходится на атмосферу (туман).
- Тело растений состоит на 50% из воды, некоторых видов даже больше.
- Многие соединения встречаются в виде кристаллогидратов, содержащих связанную воду.
Продолжать данный список можно долго, ведь сложно вспомнить хоть что-нибудь, в состав чего не входит вода или когда-то не входила. Либо образовалось без участия этого оксида.

Способы получения
Получение оксида водорода промышленного значения не имеет. Ведь проще использовать готовые источники - реки, озера и прочие водоемы, чем затрачивать огромное количество энергии и реактивов. Поэтому в лаборатории уместно лишь получение дистиллированной, особо чистой воды.
Для этих целей используют определенные аппараты, такие как перегонные кубы. Такая вода необходима для проведения многих химических взаимодействий, так как неочищенная содержит большое количество посторонних примесей, солей, ионов.
Биологическая роль
Сказать, что вода используется везде, не сказать ничего. Немыслимо представить свою жизнь без этого соединения. С самого утра и до самой ночи человек постоянно использует его как в бытовых, так и промышленных целях.
Свойства оксида водорода подразумевают использование его как универсального растворителя. Причем не только в лаборатории. Но и в живых существах, где ежесекундно происходят тысячи биохимических реакций.

Также вода сама является участником многих синтезов, она же служит побочным продуктом, образующимся в результате них. Каждый человек на Земле за 60 лет пропускает через себя около 50 тонн этого удивительного вещества!
Оксид водорода используется:
- во всех отраслях промышленности;
- медицине;
- химических синтезах;
- во всех видах производств;
- бытовых нуждах;
- сельском хозяйстве.
Сложно определить область жизни, в которой можно обойтись без воды. Единственными живыми существами, не имеющими оксид водорода в своем составе и живущими без него, являются вирусы. Именно поэтому человеку сложно бороться с этими организмами.
fb.ru
Химические свойства воды и способы их контроля и изменения
По своей важности вода является вторым аквариумным элементом. Первым является непосредственно сам аквариум, в который эта вода наливается. Увы, начинающие аквариумисты в большинстве своем плохо представляют, что у воды есть очень много жизненно важных для рыб параметров, которые надо поддерживать — кислотность, жесткость воды и пр. И при этом разным рыбам, разным аквариумам нужна вода с разным сочетанием этих параметров.
В это статье мы рассмотрим самые основные и ключевые параметры воды, а также способы их контроля с помощью различных тестов.
Содержание статьи
Кислотность (pH)
Кислотность воды – очень важный показатель для жизнедеятельности рыб. Особенно для экзотических. Но начинающие аквариумисты, как правило, об этом не задумываются и вспоминают о кислотности воды только тогда, когда, к сожалению, рыбы в аквариуме начинают погибать.
Вода состоит из водорода и кислорода. Молекула воды распадается на два иона – это положительный ион водорода H+ и отрицательный ион OH-. Значение рН отображает концентрацию ионов H+. Изменение значения рН на единицу равно увеличению или уменьшению концентрации этих ионов в 10 раз. То есть При рН 7 количество ионов H+ будет в 10 раз меньше, чем при рН 6. Даже небольшие изменения в кислотности (рН) моментально и сильно изменяют химическую структуру воды. В кислотно-нейтральной воде концентрация обоих ионов равномерна и значение рН равняется семи, кислая вода имеет рН меньше семи, а щелочная, соответственно, больше.
Значение рН регулируется добавлением специальных веществ, влияющих на концентрацию иона H+. Так, кислоты растворяются в воде, образовывая этот ион. Соответственно, значение рН уменьшается.
Также многие вещества обладают так называемой буферной способностью – они могут нейтрализовывать колебания рН при добавлении в воду кислоты или щелочи. Наиболее важными из таких веществ – карбонаты, которые определяют карбонатную жесткость воды.
Биологическая активность рыб и других живых существ в аквариуме постепенно приводит к увеличению кислотности воды и понижению значения рН. Поэтому, если вода имеет недостаточную буферную способность, то рН со временем обязательно упадет до недопустимых рыб пределов. Растворенное в воде буферное вещество будет мешать падению рН, но со временем кислоты все равно истощат буфер.
При смене воды происходит тотальное обновление буфера. Если вода в аквариуме мягкая, то увеличить буферную способность можно путем добавления простой пищевой соды.
Большинство рыб может жить в диапазон рН от 6.5 до 8. Нельзя подвергать кислотность воды резким перепадам, это приведет к стрессу и заболеванию и даже гибели рыб. Поэтому даже если вы заметили, что значение кислотности далеко отличается от оптимальных, добавляйте вещества по чуть-чуть, изменяя значение рН одну, максимум две единицы в сутки.
Измерение рН. Самый простейший тест рН – хорошо знакомые всем лакмусовые бумажки с использованием реактивов, меняющих свой цвет в зависимости от кислотности – фенолфталеина и пр. Существует большое разнообразие аквариумных тестов. Такой реактив можно также купить отдельно. Тесты с лакмусовыми бумажками и реактивами просты и достаточно точны. Вам не надо знать значение pH с точностью до 0,1, потому что, как и в природе, суточные колебания кислотности даже на единицу вполне допустимы. Поэтому достаточно иметь тест, измеряющий рН в коридоре 5.5 — 8.0.
Другим способом измерения значения pH являются электронные тестеры. К достоинствам этих приборов относятся скорость получения результата, высокая точность, возможность постоянного контроля и получения сигнала при существенном отступлении от нормы.
Но они имеют и свои недостатки – это высокая их стоимость, необходимость периодической (причем довольно частой) калибровки устройства, требовательность к условиям эксплуатации.
 Жесткость воды
Жесткость воды
Жесткость является вторым по важности параметров воды в аквариуме. Жесткость воды характеризуется наличием растворенных минералов и существенно влияет на многие другие свойства воды. Жесткость воды делится на две части — постоянную GH (от английского general hardness) и переменную KH – carbonate hardness. Сумму этих частей иногда называют общей жесткостью.
Деление жесткости на эти части определяется тем, какие минеральные соли остаются в воде после ее кипячения (постоянная жесткость). А соли, которые определяют карбонатную жесткость, выпадают в осадок.
Значения жесткости воды: 0-4 dGH – очень мягкая вода; 4-8 dGH – мягкая вода; 8-12 dGH – средняя жесткость; 12-18 dGH – умеренная жесткость; 18-30 dGH – жесткая вода.
При необходимости меняйте значение жесткости плавно, так как иначе рыбы подвергнутся стрессу. Увеличивается значение КН бикарбонатом натрия (то есть пищевой содой), GH – карбонатом кальция.
Уменьшение жесткости является более серьезной задачей. Используйте дистиллированную или чистую дождевую воду, если, разумеется, вы уверены в ее чистоте. Также можно применять воду, отфильтрованную через специальные осмотические фильтры или через различные смолы, которые имеются в продаже.
Еще один простой и удобный способ – это фильтрование торфом. Но у торфа есть недостаток – он придает воде желтоватый оттенок.
Кислород и углекислый газ
Основными растворенными в воде газами являются кислород и углекислый газ, а также азот. Азот почти не влияет на жизнь организмов в аквариуме, а кислород и CO2 очень важны для нормального существования жизни в аквариуме.
Основные процессы, в которых участвуют О2 и СО2:
- дыхание рыб;
- дыхание и фотосинтез у растений.
Также бактерии и иные микроорганизмы потребляют кислород.
Надо стараться, чтобы уровень кислорода в воде не падал ниже 7 мг/л. При недостатке кислорода рыбы начинают хватать воздух с поверхности, происходит отравление углекислым газом.
Уровень углекислого газа в воде зависит от многих параметров, а его переизбыток приводит к отравлению и гибели рыб. Самый простой способ поддержать сбалансированное содержание этих газов в воде – аэрация и перемешивание воды помпами. В результате кислород растворяется в воде, а углекислый газ, наоборот, уходит в атмосферу.
Еще один способ – выращивание растений, поглощающих СО2 и выделяющих О2.
 Окислительный потенциал (англ. redox potential, сокр. ORP)
Окислительный потенциал (англ. redox potential, сокр. ORP)
ORP – эта величина, которая характеризует качество и чистоту аквариумной воды. Низкий показатель ORP говорит о том, что в воде много органики.
Существуют два вида реакций: окислительные и восстановительные. Первые – те, в результате которых молекулы теряют электроны (нитратный цикл, в результате чего аммиак превращается в нитраты), ко вторым – обратные процессы (редуцирование нитрата обратно в аммиак). Атомы кислорода и хлора, например, очень «нуждаются» в электронах, поэтому и являются окислителями. А, например, водород имеет «лишние» электроны и является восстановителем. Если окислителей в воде больше, то потенциал будет положителен, и наоборот. Измеряется ORP в милливольтах.
Разложение органики в воде – окислительная реакция. Ее накопление приводит к концентрации восстановителей и уменьшает ORP. Чем выше значение ORP, тем больше окислителей (кислорода) присутствует в воде и тем больше органики сможет разложиться и чище будет вода. С другой стороны, высокий ORP может быть вреден, поскольку способен разрушать живые клетки. Оптимальный коридор значения ORP лежит между 250 и 400 mV.
ORP измеряют специальными измерителями, подобным измерителям pH . Увеличивают ORP регулярной сменой воды и чисткой аквариума, а также продувкой воздуха и использованием озона.
aquante.ru