Аномалии физических и химических свойств воды. Аномалии физических свойств воды
Аномальные физические свойства воды — Мегаобучалка
Аномальные физические свойства воды столь будничны и естественны, что обычно мы и не подозреваем об их существовании, совершенно забыв, что эти свойства - подарок природы всему живому на Земле.
О воде пишут много. Пишут ученые разных специальностей - физики, химики, геологи, биологи, астрономы. Сложилась даже определенная традиция в написании статен о воде начинать рассказ с описания необычных, аномальных свойств этой жидкости.
· Температура плавления и кипения воды
Самое удивительное и благостное для живой природы свойство воды - это ее способность при "нормальных" условиях быть жидкостью. Молекулы очень похожих на воду соединений (например, молекулы h3S или h3Se) намного тяжелее, а образуют при тех же условиях газ. Тем самым вода как будто противоречит закономерностям таблицы Менделеева, которая, как известно, предсказывает, когда, где и какие свойства веществ будут близки.
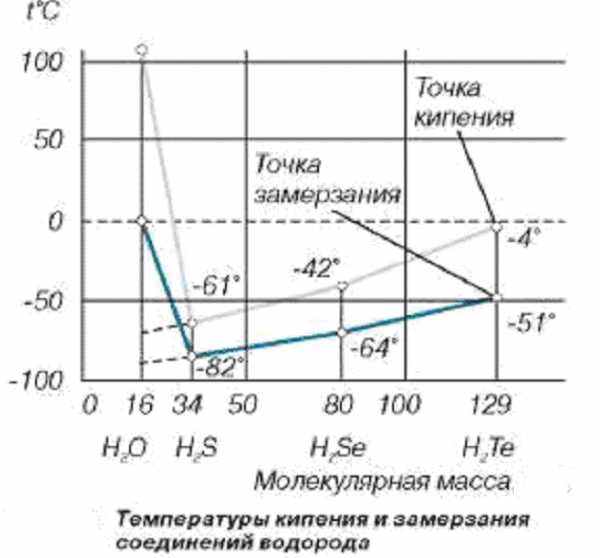
В нашем случае из таблицы следует, что свойства водородных соединений элементов (называемых гидридами), расположенных в одних и тех же вертикальных столбцах, с ростом массы атомов должны изменяться монотонно. Кислород - элемент шестой группы этой таблицы. В этой же группе находятся сера S (с атомным весом 32), селен Se (с атомным весом 79), теллур Te (с атомным весом 128) и поллоний Po (с атомным весом 209). Следовательно, свойства гидридов этих элементов должны меняться монотонно при переходе от тяжелых элементов к более легким, т.е. в последовательности h3Po → h3Te → h3Se → h3S → h3O. Что и происходит, но только с первыми четырьмя гидридами. Например, температуры кипения и плавления растут при увеличении атомного веса элементов. На рисунке крестиками отмечены температуры кипения этих гидридов, а кружочками - температуры плавления.
При уменьшении атомного веса температуры снижаются совершенно линейно. Область существования жидкой фазы гидридов становится все более "холодной", и если бы гидрид кислорода Н2О был нормальным соединением, похожим на своих соседей по шестой группе, то жидкая вода существовала бы в диапазоне от -80° С до -95° С. При более высоких температурах Н2О всегда была бы газом. К счастью для нас и всего живого на Земле, вода аномальна, она не признает периодической закономерности а следует своим законам.
Объясняется это довольно просто - большая часть молекул воды соединена водородными связями. Именно этими связями отличается вода от жидких гидридов h3S, h3Se и h3Te. Если бы их не было, то вода кипела бы уже при минус 95 °C. Энергия водородных связей достаточно велика, и разорвать их можно лишь при значительно более высокой температуре. Даже в газообразном состоянии большое число молекул h3O сохраняет свои водородные связи, объединяясь в димеры (h3O)2. Полностью водородные связи исчезают только при температуре водяного пара 600 °C.
Напомним, что кипение заключается в том, что пузыри пара образуются внутри кипящей жидкости. При нормальном давлении чистая вода кипит при 100 'С. В случае подведения тепла через свободную поверхность будет ускоряться процесс поверхностного испарения, но объёмного парообразования, характерного для кипения, не возникает. Кипение может быть осуществлено и понижением внешнего давления, так как в этом случае давление пара, равное внешнему давлению, достигается при более низкой температуре. На вершине очень высокой горы давление и соответственно точка кипения настолько понижаются, что вода становится непригодной для варки пищи - не достигается требуемая температуры воды. При достаточно высоком давлении воду можно нагреть настолько, что в ней может расплавиться свинец (327 °С), и все же она не будет кипеть.
Помимо сверхбольших температур кипения плавления (причем последний процесс требует слишком большой для такой простой жидкости теплоты плавления), аномален сам диапазон существования воды - сто градусов, на которые разнятся эти температуры, - довольно большой диапазон для такой низкомолекулярной жидкости, как вода. Необычайно велики пределы допустимых значении переохлаждения и перегрева воды - при аккуратном нагревании или охлаждении вода остается жидкой от -40 °C до +200 °C. Тем самым температурный диапазон, в котором вода может оставаться жидкой, расширяется до 240 °C.
При нагревании льда сначала температура его повышается, но с момента образования смеси воды со льдом температура будет оставаться неизменной до того момента, пока не расплавится весь лёд. Это объясняется тем, что тепло, подводимое к тающему льду, прежде всего расходуется только на разрушение кристаллов. Температура тающего льда остаётся неизменной до тех пор, пока не произойдёт разрушение всех кристаллов (см. скрытую теплоту плавления).
· Плотность воды и льда
Жизненно важной для всей биосферы является способность воды при замерзании уменьшать, а не увеличивать свою плотность (как это происходит почти со всеми остальными веществами). Висмут в этом отношении ведет себя, как вода, но он является одним из крайне редких исключений из общего правила. Впервые на это необычное свойство воды обратил внимание еще Г. Галилей. В самом деле, при переходе жидкости в твердое состояние молекулы вещества как будто должны располагаться теснее, а само вещество должно становиться, плотнее. Обычно вещества так и ведут себя. Но вода представляет исключение. Если взять обычную воду и, постепенно охлаждая ее, следить за изменением плотности то можно заметить, что в начале будет происходить совершенно обычный и естественный процесс - вода становится при охлаждении все плотнее и плотнее, и никаких отклонений от нормы мы не увидим до тех пор, пока не охладим воду до 4 °C. Ниже этой температуры вопреки общим представлениям вода вдруг становится легче, а замерзая она делается еще легче и образует лед, который плавает по поверхности воды. Замерзая, вода расширяется на 9% по отношению к прежнему объему. Это расширение может оказаться роковым для водопровода в случае наступления неожиданных морозов. Вода, замерзая в трубах, разорвет их.
Именно эта особенность воды, как известно предохраняет от сплошного промерзания в суровые зимы озера и пруды и тем самым спасает жизнь в этих водоемах. Осенний воздух охлаждает поверхностные слои озера, они становятся тяжелее и опускаются на дно. Озеро охлаждается. Но этот процесс идет лишь до тех пор, пока температура воды не достигнет 4 °C. Если теперь поверхностные слои станут еще холоднее, то они уже не опускаются на дно, так как плотность этих слоев меньше плотности глубинной воды, где сохраняется температура 4 °C. Отличия в плотности не велики - эти отличия проявляются лишь в четвертом знаке после запятой, - но этих отличий вполне достаточно, чтобы вода с температурой, близкой к 0 °C не могла проникнуть в глубину озера. Процесс охлаждения поверхностных слоев пойдет теперь быстрее и вскоре свинцовая гладь озера закроется первым хрупким льдом. Лед - плохой проводник тепла, надежно спрячет от страшных зимних морозов жизнь озера. Такой циркуляцией объясняется, почему на более мелких участках озера лед образуется раньше и в последствии он толще.
Разницей в температурах верхних и нижних слоев воды пользуются при работе земснарядов в зимних условиях. При помощи насосов из более глубоко части водоёма накачивают воду в поверхностные слои, чем предупреждают образование льда у работающего агрегата.
А вот морская вода (представляющая собой, как известно, рассол, в каждом литре которого содержится около 35 граммов солей) при охлаждении ведет себя совсем по-иному: наибольшая плотность у нее отмечается при более низких температурах, чем у пресной, а именно при -3,5 °C. Но замерзает морская вода при -1,9 °C, т.е. она превращается в лед не достигая максимальной плотности.
Если при плавлении льда объём полученной жидкости меньше, чем объём взятого льда, то можно сделать предположение, что переход льда в жидкое состояние будет облегчён, если лёд подвергнуть давлению, т.е. сближению кристаллов между собою. В самом деле, если оказать на лёд высокое давление, то температура плавления его понижается. Так, под давлением в 2045 атм (на 1 см2) лёд будет плавиться при температуре -22 °C. Дальнейшее повышение давления уже не снижает температуры плавления, так как образуются новые формы льда с новыми свойствами. Способностью льда таять при более низкой температуре под большим давлением объясняется и то, что у ледников, толщина которых громадна, таяние у основания начинается раньше чем на поверхности.
· Теплоемкость воды
Количество тепла, необходимого для нагревания 1 г воды на 1°, достаточно, чтобы нагреть на 1° 9,25 г железа, 10,3 г меди. Аномально высокая теплоемкость воды превращает моря и океаны в гигантский термостат, сглаживающий суточные колебания температуры воздуха. Причем не только большие массы воды, как моря, способы сглаживать эти колебания, но и обычный водяной пар атмосферы. Резкие суточные колебания температуры в районах великих пустынь связаны с отсутствием водяного пара в воздухе. Сухой воздух пустыни почти лишен водяного пара, который мог бы сдержать быстрое ночное охлаждение накалившегося за день песка, поэтому температура воздуха может оказаться не больше 5 °C.
Теплоёмкостью воды объясняется явление различного нагревания воды и суши: так как теплоёмкость твёрдых пород, составляющих поверхность суши, и теплоёмкость воды резко отличаются, то для нагревания до одной и той же температуры воды и песка потребуется различное количество тепла, поэтому днём температура песка выше, чем воды. Вода охлаждается медленнее, чем твёрдые породы, поэтому ночью песок холоднее, чем вода. Как известно, нагревание воздуха происходит не непосредственно лучами солнца, а путём отдачи тепла от нагреваемой поверхности суши и воды. В летнее время создаётся значительная разница температур между поверхностью суши и воды, в силу чего происходит перемещение воздуха в направлении, определяемом разницей температур воды морей и океанов и прилегающей к ним суши.
Теплоемкость воды (1 кал), кстати, в 2 раза больше теплоемкости льда (0,5 кал), а для всех других веществ плавление почти не сказывается на этой величине.
Почему в случае воды эта величина демонстрирует столь большое значение? Удельная теплоемкость - это количество тепла, которое надо сообщить одному грамму вещества, чтобы увеличить его температуру на один градус Цельсия. Следовательно, вода требует для своего нагревания аномально большое количество тепла. Так как возрастание температуры означает увеличение средней скорости движения молекул, то на молекулярном языке большая теплоемкость воды означает, что ее молекулы очень инертны. Чтобы увеличить среднюю скорость молекул h3O, им нужно почему-то сообщить довольно много энергии, хотя сами молекулы по молекулярным масштабам сравнительно невелики. Все объясняется существованием водородных связей. Так как большая часть молекул связана в довольно большие комплексы, то отдельная "среднестатистическая" молекула h3O может увеличить свою кинетическую энергию одним из двух способов. Она может, во-первых, освободившись от всех своих водородных связей, начать двигаться самостоятельно. И во-вторых, ускорение всего комплекса молекул приведет, разумеется, к увеличению скорости каждой молекулы h3O, входящей в этот комплекс. Очевидно, что оба эти способа требуют значительных энергетических затрат, что и приводит к большому значению удельной теплоемкости воды.
· Скрытая теплота плавления и испарения воды
Если температура твердого тела повысилась до точки плавления или если жидкость достигла точки кипения, то наступает переходная фаза, как бы пауза, во время которой две фазы (твердая и жидкая или жидкая и газообразная) существуют одновременно. В течение этого промежутка времени, который продолжается до тех пор, пока твердое тело полностью не превратится в жидкость или жидкость в пар, поглощаемое тепло не вызывает никаких изменений в температуре тела. Это тепло называется скрытой теплотой, и его количество у различных веществ неодинаково. Скрытая теплота плавления, а также испарения, у воды необычайно велика; это обстоятельство имеет огромное значение для температуры поверхности земли. Употребляемое нами слово "скрытая" содержит уже некоторый намек на один физический закон, который необходимо подчеркнуть: тепло, поглощаемое водой, никуда не исчезает. Как известно, одним из основных законов природы является закон сохранения и превращения энергии. В самом общем виде этот закон формулируется так: энергия из одной формы переходит в другою (например, тепловая энергия может превращаться в механическую) не уничтожаясь; в замкнутой системе общее количество энергии остается постоянным. Этот закон подтверждается и приведенным нами случаем. Когда мы говорим, что вода обладает исключительной теплоемкостью, мы попросту констатируем, что вода как вещество может накопить больше тепловой энергии при меньшем движении атомов и молекул (а это как раз то, что измеряется температурой), чем любое другое широко распространенное вещество. Энергия остается на месте, в воде; она высвободится в виде тепла, когда температура окружающей среды понизится; в результате понижение температуры не будет таким резким. Вода, замерзая, отдает то же самое количество тепла, которое она поглощает при таянии льда. Мы знаем, что труднее переносить жаркую, но сырую погоду с температурой около 30°, чем сухую и ясную погоду с еще более высокой температурой. Причина этого двоякая: во-первых, наш пот, испаряясь, охлаждает нас, отнимая тепло с поверхности кожи и из окружающего воздуха, но он не может испаряться в насыщенной водяным паром атмосфере сырого дня; во-вторых, при конденсации водяного пара и превращении его в воду выделяется ровно столько тепла, сколько его было затрачено на испарение.
У воды самая высокая в мире минералов скрытая теплота испарения и скрытая теплота плавления. Чтобы выпарить воду из чайника, тепла потребуется в пять с половиной раз больше, чем для того, чтобы вскипятить его. Если бы не это ее свойство - даже в жару медленно испаряться, многие озера и реки летом пересыхали бы до дна. Для плавления льда нужно затратить большое количество теплоты. Скрытая теплота плавления (количество тепла, необходимое для расплавления 1 г льда при температуре 0°) составляет 79,4 кал. Вот почему весеннее таяние льда происходит медленно и спасает нас от больших половодий (хоть и не всегда).
· Диэлектрическая проницаемость воды
Основная электрическая характеристика любой среды - диэлектрическая проницаемость - в случае воды демонстрирует необычные для жидкости особенности. Во-первых, она очень велика, для статических электрических полей она равна 81, в то время как для большинства других веществ она не превышает значения 10. Если на любое вещество воздействовать переменным электрическим полем, то диэлектрическая проницаемость перестанет быть постоянной величиной, а зависит от частоты приложенного поля, сильно уменьшаясь для высокочастотных полей. Но диэлектрическая проницаемость воды уменьшается не только в переменных во времени полях, но также и в пространственно переменных полях, т.е. вода является нелокально поляризующейся средой.
Большое значение диэлектрической проницаемости объясняется особенностями молекулы h3O. Большая величина статической диэлектрической проницаемости воды ε =81 связана с тем, что вода - сильно полярная жидкость и поэтому обладает мягкой ориентационной степенью свободы (т.е. вращения молекулярных диполей). Каждая молекула воды обладает значительным дипольным моментом. В отсутствие электрического поля диполи ориентированы случайным образом, и суммарное электрическое поле, создаваемое ими, равно нулю. Если воду поместить в электрическое поле, то диполи начнут переориентироваться так, чтобы ослабить приложенное поле. Такая картина наблюдается и в любой другой полярной жидкости, но вода благодаря большому значению дипольного момента молекул h3O способна очень сильно (в 80 раз) ослабить внешнее поле. Так реагирует вода на внешнее электрическое поле, если приложенное поле постоянно по времени и слабо меняется (или вообще не меняется) в пространстве, заполняемом водой. В переменных электрических полях диэлектрическая проницаемость воды уменьшается с ростом частоты приложенного поля, достигая значения 4-5 для частот больше 1012 Гц. В 1929 г. П. Дебай предложил описывать реакцию воды на внешнее электрическое поле с помощью комплексной диэлектрической проницаемости:
ε(ω) = ε∞ + (εο - ε∞)/(1 + i ω τ)
где ω - частота внешнего электрического поля, i - мнимая единица, τ - характерное время релаксации, ε∞ ≈ 4÷5 - диэлектрическая проницаемость воды при максимально высокой частоте внешнего поля.
Хотя при выводе своей формулы Дебай использовал довольно искусственную модель структуры воды, это выражение хорошо соответствует экспериментальным данным. Как видим, с ростом частоты внешнего поля диэлектрическая проницаемость резко падает. Молекулярное объяснение этого явления довольно просто. Любые индивидуальные движения молекулы h3O сильно ограничены водородными связями. В переменных электрических полях молекулярные диполи стремятся отследить меняющееся поле. При небольших частотах это им удается. Однако по мере увеличения частоты ориентироваться становится все труднее и труднее. В конце концов диполи вообще перестают реагировать на внешнее поле. Диэлектрическая проницаемость теперь определяется лишь быстрым атомно-молекулярным механизмом перераспределения электрического заряда, который присущ всем веществам. Такие механизмы действуют в воде и в случае постоянных полей, но их вклад в общую величину диэлектрической проницаемости невелик, всего 4-5 единиц.
· Поверхностное натяжение воды
Вы видите его проявление всякий раз, когда наблюдаете, как вода медленно капает из водопроводного крана. Из крана появляется водяная пленка и начинает растягиваться, словно тонкая резиновая оболочка, под тяжестью заключенной в ней жидкости. Эта пленка, прикрепленная к отверстию крана, постепенно удлиняется, пока ее вес не станет вдруг слишком большим. Пленка, однако, не рвется, как порвалась бы резника при перегрузке. Вместо этого она "соскальзывает" с копчика крана и, как бы охватив небольшое количество воды, образует свободно падающую капельку. Несомненно, вы не раз наблюдали, что падающие капельки принимают почти шарообразную форму. Если бы не было внешних сил, они были бы строго шарообразны. То, что вы наблюдаете, является одним из проявлений необычной способности воды "стягиваться", "самоуплотняться", или, другими словами, ее способность к сцеплению (когезии). Капля воды, капающая из крана, стягивается в крошечный шар, а шар из всех возможных геометрических тел обладает наименьшей поверхностью при данном объеме.
Вследствие сцепления на поверхности воды образуется натяжение, и для того, чтобы разорвать поверхность воды, требуется физическая сила, причем, как это ни странно, довольно значительная. Ненарушенная водная поверхность может удерживать на себе предметы, которые значительно "тяжелее" воды, например стальную иголку или лезвие бритвы, или некоторых насекомых, которые скользят по воде, словно это не жидкость, а твердое тело.
Из всех жидкостей, кроме ртути, у воды самое большое поверхностное натяжение.
Внутри жидкости притяжение молекул друг к другу уравновешено. А на поверхности нет. Молекулы воды, которые лежат глубже, тянут вниз самые верхние молекулы. Поэтому капля воды как бы стремится максимально сжаться. Стягивают ее силы поверхностного натяжения.
Физики точно рассчитали, какую гирю надо подвесить к столбику воды толщиной в три сантиметра, чтобы разорвать его. Гиря потребуется огромная - больше ста тонн! Но это когда вода исключительно чистая. В природе такой воды нет. Всегда в ней что-то растворено. Пусть хоть немного, но чужеродные вещества разрывают звенья в прочной цепи молекул воды, и силы сцепления между ними уменьшаются.
Если нанести на стеклянную пластинку капли ртути, а на парафиновую - капли воды, то очень маленькие капельки будут иметь форму шара, а более крупные окажутся слегка сплюснутыми под действием силы тяжести.
Подобное явление объясняется тем, что между ртутью и стеклом, а также между парафином и водой возникают силы притяжения (адгезия) меньшие чем между самими молекулами (когезия). При соприкосновении воды с чистым стеклом, а ртути с металлической пластинкой мы наблюдаем почти равномерное распределение того и другого вещества на пластинках, так как силы притяжения между стеклом и молекулами воды, металлом и молекулами ртути больше, чем притяжение между отдельными молекулами воды и ртути. Такое явление, когда жидкость равномерно располагается на поверхности твёрдого тела, называется смачиванием. Значит, вода смачивает чистое стекле, но не смачивает парафин. Смачиваемость в частном случае может показать степень загрязнённости поверхности. Например, на чисто вымытой тарелке (фарфоровой, фаянсовой) вода растекается ровным слоем, в чисто вымытой колбе стенки равномерно покрываются водой, если же вода на поверхности принимает форму капель, то это указывает, что поверхность посуды покрыта тонким слоем вещества, которое не смачивает вода, чаще всего жиром.
Примеры строение воды:
1. Кристалл дистиллированной воды, не подвергнутый никакому воздействию.
2. Ключевая вода.
3. Антарктический лёд.
4. Так выглядит кристалл воды, прослушавшей «Пастораль» Бетховена.
5. Кристалл, образовавшийся после прослушивания тяжелого металлического рока.
6. Кристалл после воздействия слов «Ты — дурак» очень похож на кристалл после воздействия музыки “тяжелого рока”.
7. Слово «Ангел».
8. Слово «Дьявол».
9. Вода получила просьбу «Сделать это».
10. Вода получила приказ «Сделай это».
11. Слова «Ты надоел мне. Я убью тебя».
12. Вода получала электромагнитные излучения любви и благодарности
17. Слова «Любовь и благодарность», произнесенные на английском языке.
18. Слова «Любовь и благодарность», произнесенные на японском языке.
19. Слова «Любовь и благодарность», произнесенные на немецком языке
Амфифильные вещества:
Всем известно, что рыбы комфортно чувствуют себя только в воде, а большинство кошек относится к водным процедурам с явным недовольством, зато такие животные, как лягушка или тритон, вполне способны как плавать в реке или луже, так и свободно передвигаться по земле! Эти животные получили название земноводных или амфибий. Свои амфибии, способные растворяться как в гидрофильных, так и гидрофобных сами молекулы амфифильных соединений похожи на головастика: они состоят из длинного углеводородного хвоста (построенного обычно более чем из десяти СН2-групп), обеспечивающего растворимость в неполярных средах, и полярной головы, ответственной за гидрофильные свойства. Таким образом, амфифильные соединения одновременно «любят» и воду (то есть являются гидрофильными), и неполярные растворители (проявляют гидрофобные свойства).
В зависимости от типа гидрофильной группы выделяют амфифильные соединения, несущие заряженную катионную или анионную функциональную группу, и амфифильные соединения с незаряженной функциональной группой. Абсолютное большинство известных органических соединений несут более чем одну заряженную функциональную группу. Примером таких веществ являются макромолекулярные соединения — белки, липопротеиды, блок-сополимеры и т.д. Наличие у молекул белка третичной структуры, образующейся в результате внутримолекулярных взаимодействий функциональных групп (полярных или неполярных) между собой, само по себе демонстрирует амфифильную природу этих соединений.
Другим примером амфифильных соединений является большинство лекарственных средств, молекулы которых сочетают в себе набор определенных функциональных групп, необходимых для эффективного связывания с рецептором-мишенью.
Роль амфифильных соединений в получении наноматериалов и нанотехнологических продуктов сложно переоценить. Амфифильные соединения часто являются поверхностно-активными веществами.Их молекулы «самоорганизуются» (самособираются) на различных границах раздела, образуя тонкие пленки самособирающихся монослоев толщиной всего в одну молекулу, формируют «мицеллярные» системы.
Амфифильные соединения играют особую роль в живой природе. Ни одно животное или растение не может существовать без них! Именно из амфифильных молекул состоит мембрана клетки, которая отделяет живой организм от враждебной внешней среды. Именно такие молекулы составляют внутренние органнелы клетки, участвуют в процессе ее деления, задействованы в обмене веществ с окружающей средой. Амфифильные молекулы служат нам пищей и образуются в наших организмах, участвуют во внутренней регуляции и цикле желчных кислот. Наш организм содержит более 10% амфифильных молекул. Именно поэтому синтетические поверхностно-активные вещества могут быть опасны для живых организмов и, например, способны растворить мембрану клетки и привести к ее гибели.
megaobuchalka.ru
Вода Аномалии
АНОМАЛИИ ВОДЫ
Среди необозримого множества веществ вода занимает совершенно особое место. И это надо понимать буквально. Почти все физико-химические свойства воды — исключение в природе: она действительно самое удивительное вещество на свете. Удивительное не только многообразием изотопных форм молекулы и не только надеждами, которые связаны с ней как с источником энергии будущего. Она удивительна своими самыми обычными свойствами.
Не будем ставить под сомнение закон. Вода — редчайшее, и, может быть, уникальное исключение из правил. Пожалуй, нет вещества более удивительного и загадочного, чем обыкновенная вода. Но объяснить до конца причины этого пока не удается, хотя понятно, что загадки воды спрятаны в строении ее молекулы и межмолекулярной структуре.
То, что обычная вода представляет собой еще весьма плохо изученное вещество, объясняется не только сложностью и неопределенностью ее структуры, но и тем, что это жидкое вещество. Значительно легче, нежели жидкое, исследовать твердое вещество или газ, так как в первом молекулы четко упорядочены, а во втором — они слабо взаимодействуют и обладают большой свободой передвижения. Ответа на вопрос: почему существуют две формы конденсированного из газа состояния вещества — жидкое и твердое, — близкие по плотности и энергии межмолекулярного взаимодействия и колоссально отличающиеся по кинетике межмолекулярного взаимодействия, пока еще нет. Не создано теорий, которые адекватно описывали бы жидкое состояние. Не разработана также теория плавления — перехода от порядка к беспорядку в системах с близкими плотностями и энергиями межмолекулярного взаимодействия. Поэтому, например, лед изучен лучше, чем вода. Не получена в лабораториях и абсолютно чистая вода, ее свойства до сих пор остаются загадкой.
| Свойство | Аномалия | Значение |
| Летучесть | Наименьшая среди соединений водорода с элементами подгруппы кислорода | Существенна для физиологии клетки: медленное снижение влажности различных материалов. |
| Скрытая теплота плавления и испарения. | Наиболее высокая из всех твердых и жидких веществ, за исключением аммиака; с повышением температуры несколько снижается (до 40 °С), затем — возрастает | Термостатирующий эффект в технологических процессах, перенос тепла водными течениями в природе, способствует сохранению постоянной температуры тела |
| Температура замерзания | Наиболее высокая, за исключением аммиака | Термостатирующий эффект в точке замерзания. Очень важна для сохранения теплового и водного баланса в атмосфере. |
| Температура кипения | Наиболее высокая из всех жидкостей | Большие затраты тепла на испарение в производственных процессах; экономия возможна при утилизации тепла, выделяющегося при конденсации пара |
| Теплопроводность | Наиболее высокая из всех жидкостей | Играет роль в теплообменной аппаратуре и процессах малого масштаба, например происходящих в живых клетках |
| Поверхностное натяжение | Наиболее высокое из всех жидкостей | Существенно для физиологии клетки, определяет поверхностные явления в технологии |
| Диэлектрическая проницаемость | Наиболее высокая из всех жидкостей | Оказывает существенное влияние на диссоциацию электролитов |
| Растворитель | Растворяет многие вещества в больших количествах, чем другие жидкости | Используется в технике как основной растворитель, связывает между собой явления физические и биологические |
| Плотность | Наибольшая при +4 °С | При замерзании водоемов, нижинй слой воды, как наиболее тяжелый, находится при температуре +4 °С. При этом не замерзает и вода в живых организмах. |
| Вязкость | Уменьшается при увеличении давления | Обеспечивает большую подвижность глубоко в недрах планеты, где давление достигает огромных значений. |
| Удельная теплоемкость | Наиболее высокая, за исключением аммиака и водорода. |
|
studfiles.net
Аномалии физических и химических свойств воды
(характеристика аномально высокой информативности воды)
В периодической системе элементов Д.И. Менделеева кислород образует отдельную подгруппу. Входящие в нее кислород, сера, селен и теллур имеют много общего в физических и химических свойствах. Общность свойств прослеживается, как правило, и для однотипных соединений, образованных членами подгруппы. Однако для воды характерно отклонение от правил.
Из самых легких соединений подгруппы кислорода (а ими являются гидриды) вода – легчайшее. Физические характеристики гидридов, как и других типов химических соединений, определяются положением в таблице элементов соответствующей подгруппы. Так, чем легче элемент подгруппы, тем выше летучесть его гидрида. Поэтому в подгруппе кислорода самой высокой должна быть летучесть воды – гидрида кислорода. Это же свойство очень явственно проявляется и в способности воды «прилипать» ко многим предметам, то есть смачивать их.
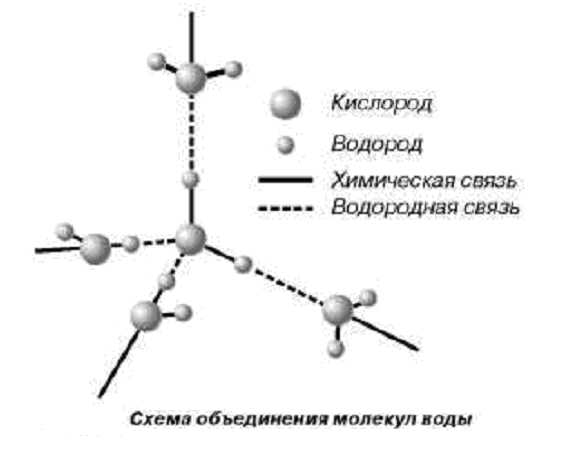
При изучении этого явления установили, что все вещества, которые легко смачиваются водой (глина, песок, стекло, бумага и др.), непременно имеют в своем составе атомы кислорода. Для объяснения природы смачивания этот факт оказался ключевым: энергетически неуравновешенные молекулы поверхностного слоя воды получают возможность образовывать дополнительные водородные связи с «посторонними» атомами кислорода. Благодаря поверхностному натяжению и способности к смачиванию, вода может подниматься в узких вертикальных каналах на высоту большую чем та, которая допускается силой тяжести, то есть вода обладает свойством капиллярности.
Капиллярность играет важную роль во многих природных процессах, происходящих на Земле. Благодаря этому вода смачивает толщу почвы, лежащую значительно выше зеркала грунтовых вод и доставляет корням растений растворы питательных веществ. Капиллярностью обусловлено движение крови и тканевых жидкостей в живых организмах.
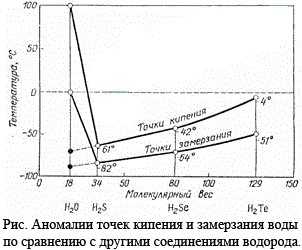
Но для воды характерны некоторые особенности ее свойств. Например, самыми высокими оказываются у воды как раз те характеристики, которые должны были бы быть самыми низкими: температуры кипения и замерзания, теплоты парообразования и плавления.
Температуры кипения и замерзания гидридов элементов кислородной подгруппы графически представлены на рис. 1.7. У самого тяжелого из гидридов 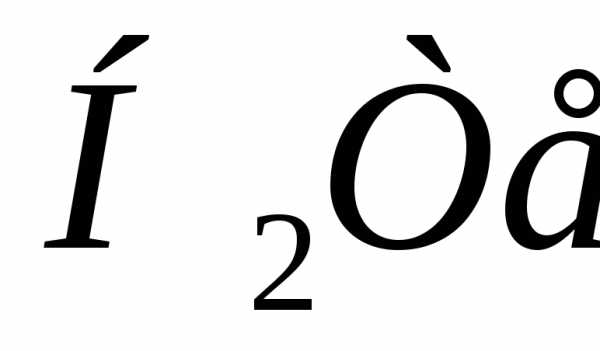 они отрицательны: выше 0°С это соединение газообразно. По мере перехода к гидридам более легким (
они отрицательны: выше 0°С это соединение газообразно. По мере перехода к гидридам более легким (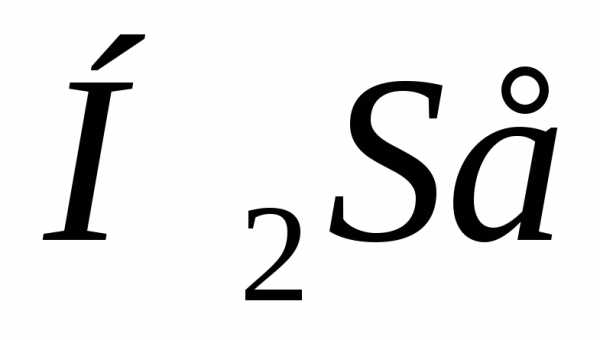 ,
,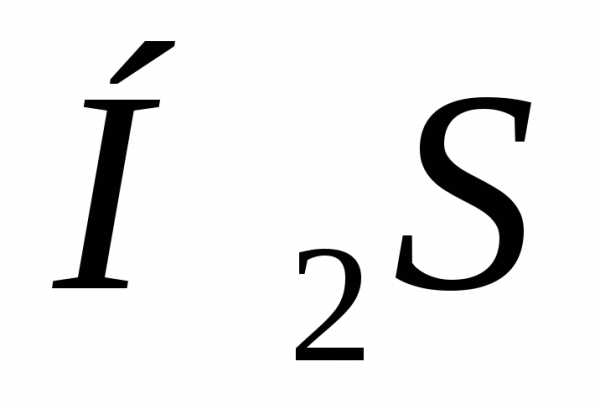 ) температуры кипения и замерзания все более снижаются. Сохранись и далее эта закономерность, можно было бы ожидать, что вода должна кипеть при -70°С и замерзать при -90°C. В таком случае в земных условиях она никогда не могла бы существовать ни в твердом, ни в жидком состояниях. Единственно возможным было бы газообразное (парообразное) состояние. Но на графике зависимости критических температур для гидридов в функции их молекулярной массы существует неожиданно резкий подъем – температура кипения воды +100°С, замерзания – 0°C. Это наглядное преимущество ассоциативности – широкий температурный интервал существования, возможность осуществить все фазовые состояния в условиях нашей планеты.
) температуры кипения и замерзания все более снижаются. Сохранись и далее эта закономерность, можно было бы ожидать, что вода должна кипеть при -70°С и замерзать при -90°C. В таком случае в земных условиях она никогда не могла бы существовать ни в твердом, ни в жидком состояниях. Единственно возможным было бы газообразное (парообразное) состояние. Но на графике зависимости критических температур для гидридов в функции их молекулярной массы существует неожиданно резкий подъем – температура кипения воды +100°С, замерзания – 0°C. Это наглядное преимущество ассоциативности – широкий температурный интервал существования, возможность осуществить все фазовые состояния в условиях нашей планеты.
Ассоциативность воды сказывается и на очень высокой удельной теплоте ее парообразования. Чтобы испарить воду, уже нагретую до 100°С, требуется вшестеро больше количества теплоты, чем для нагрева этой же массы воды на 80°С (от 20 до 100°С).
Каждую минуту миллион тонн воды гидросферы испаряется от солнечного нагрева. В результате в атмосферу постоянно поступает колоссальное количество теплоты, эквивалентное тому, которое бы вырабатывали 40 тысяч электростанций мощностью 1 млрд. киловатт каждая.
При плавлении льда немало энергии уходит на преодоление ассоциативных связей ледяных кристаллов, хотя и вшестеро меньше, чем при испарении воды. Молекулы 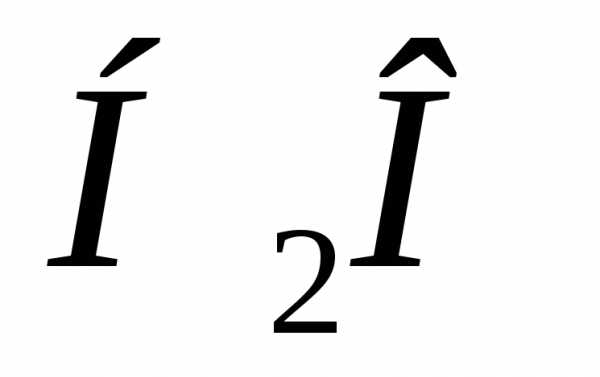 фактически остаются в той же среде, меняется лишь фазовое состояние воды.
фактически остаются в той же среде, меняется лишь фазовое состояние воды.
Удельная теплота плавления льда более высокая, чем у многих веществ, она эквивалентна расходу количества теплоты при нагреве 1 г воды на 80°С (от 20 до 100°С). При замерзании воды соответствующее количество теплоты поступает в окружающую среду, при таянии льда – поглощается. Поэтому ледяные массы, в отличие от масс парообразной воды, являются своего рода поглотителями тепла в среде с плюсовой температурой.
Аномально высокие значения удельной теплоты парообразования воды и удельной теплоты плавления льда используются человеком в производственной деятельности. Знание природных особенностей этих физических характеристик иногда подсказывает смелые и эффективные технические решения. Так, воду широко применяют в производстве как удобный и доступный охладитель в самых разнообразных технологических процессах. После использования воду можно возвратить в природный водоем и заменить свежей порцией, а можно снова направить на производство, предварительно охладив в специальных устройствах – градирнях. На многих металлургических производствах в качестве охладителя используют не холодную воду, а кипяток. Охлаждение идет за счет использования теплоты парообразования – эффективность процесса повышается в несколько раз, к тому же отпадает надобность в сооружении громоздких градирен. Конечно, кипяток-охладитель используют там, где нужно охладить объекты, нагретые выше 100°C.
Широкое применение воды в качестве охладителя объясняется не только и не столько ее доступностью и дешевизной. Настоящую причину нужно тоже искать в ее физических особенностях. Оказывается, вода обладает еще одной замечательной способностью – высокой теплоемкостью. Поглощая огромное количество теплоты, сама вода существенно не нагревается. Удельная теплоемкость воды в пять раз выше, чем у песка, и почти в десять раз выше, чем у железа. Способность воды накапливать большие запасы тепловой энергии позволяет сглаживать резкие температурные колебания на земной поверхности в различные времена года и в разное время суток. Благодаря этому вода является основным регулятором теплового режима нашей планеты.
Интересно, что теплоемкость воды аномальна не только по своему значению. Удельная теплоемкость разная при различных температурах, причем характер температурного изменения удельной теплоемкости своеобразен: она снижается по мере увеличения температуры в интервале от 0 до 37°С, а при дальнейшем увеличении температуры – возрастает. Минимальное значение удельной теплоемкости воды обнаружено при температуре 36,79°С, что соответствует нормальной температура человеческого тела. Нормальная температура почти всех теплокровных живых организмов также находится вблизи этой точки.
Оказалось, что при этой температуре осуществляются и микрофазовые превращения в системе «жидкость – кристалл», то есть «вода – лед». Установлено, что при изменении температуры от 0 до 100°С вода последовательно проходит пять таких превращений. Назвали их микрофазовыми, так как протяженность кристаллов микроскопична, не более 0,2...0,3 нм. Температурные границы переходов – 0, 15, 30, 45, 60 и 100°С.
Температурная область жизни теплокровных животных находится в границах третьей фазы (30...45°С). Другие виды организмов приспособились к иным температурным интервалам. Например, рыбы, насекомые, почвенные бактерии размножаются при температурах, близких к середине второй фазы (23...25°С), эффективная температура весеннего пробуждения семян приходится на середину первой фазы (5...10°С).
Характерно, что явление прохождения удельной теплоемкости воды через минимум при температурном изменении обладает своеобразной симметрией: при отрицательных температурах также обнаружен минимум этой характеристики. Он приходится на – 20°С.
Если вода ниже 0°С сохраняет не замерзшее состояние, например, будучи мелкодисперсной, то около -20°С резко увеличивается ее теплоемкость. Это установили американские ученые, исследуя свойство водных эмульсий, образованных капельками воды диаметром около 5 микрон.
studfiles.net
Аномалии воды — Статьи — Корректор функционального состояния
Развитие молекулярных и структурно-химических представлений позволило дать объясне-ние исключительной способности молекул воды образовывать связи с молекулами почти всех веществ.
Стала проясняться также роль связанной воды в формировании важнейших физических свойств гидратированных органических и неорганических веществ. Большой и все возрастающий научный интерес привлекает проблема биологической роли воды.
 Заселенная живыми организмами наружная оболочка нашей планеты – биосфера является вместилищем жизни на Земле. Её первоосновой, ее незаменимым компонентом является вода. Вода - это и строительный материал, который используется для создания всего живого, и среда, в которой протекают все жизненные процессы, и растворитель, выносящий из организма вредные для него вещества, и уникальный транспорт, снабжающий биологические структуры всем необходимым для нормального протекания в них сложнейших физико-химических процессов. И это всеобъемлющее влияние воды на любую живую структуру может быть не только положительным, но и отрицательным. В зависимости от своего состояния вода может быть как созидателем цветущей жизни, так и ее разрушителем, могильщиком - всё зависит от ее химического и изотопного состава, структурных, биоэнергетических свойств. Не случайно академик И. В. Петрянов сказал: "Вода - это подлинное чудо природы!".
Заселенная живыми организмами наружная оболочка нашей планеты – биосфера является вместилищем жизни на Земле. Её первоосновой, ее незаменимым компонентом является вода. Вода - это и строительный материал, который используется для создания всего живого, и среда, в которой протекают все жизненные процессы, и растворитель, выносящий из организма вредные для него вещества, и уникальный транспорт, снабжающий биологические структуры всем необходимым для нормального протекания в них сложнейших физико-химических процессов. И это всеобъемлющее влияние воды на любую живую структуру может быть не только положительным, но и отрицательным. В зависимости от своего состояния вода может быть как созидателем цветущей жизни, так и ее разрушителем, могильщиком - всё зависит от ее химического и изотопного состава, структурных, биоэнергетических свойств. Не случайно академик И. В. Петрянов сказал: "Вода - это подлинное чудо природы!".
Аномальные свойства воды были открыты учеными в результате длительных и трудоемких исследований. Эти свойства столь привычны и естественны в обыденной нашей жизни, что обычный человек даже не подозревает об их существовании. А вместе с тем вода - вечная спутница жизни на Земле действительно оригинальна и неповторима.
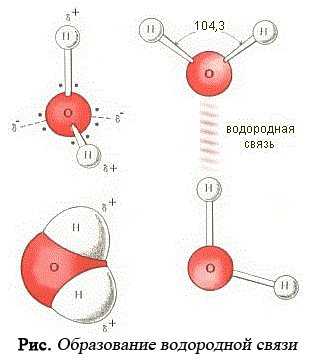
Аномальные свойства воды свидетельствуют о том, что молекулы Н2О в воде довольно прочно связаны между собой и образуют характерную молекулярную конструкцию, которая сопротивляется любым разрушающим воздействиям, например, тепловым, механическим, электрическим. По этой причине, например, необходимо затратить много тепла, чтобы превратить воду в пар. Эта особенность объясняет сравнительно высокую удельную теплоту испарения воды. Становится понятным, что структура воды, характерные связи между молекулами воды, лежат в основе особых свойств воды. Американские ученые У. Латимер и У. Родебуш предложили в 1920 г. эти особые связи называть водородными и с этого времени представление об этом типе связи между молекулами навсегда вошло в теорию химической связи. Не вдаваясь в подробности, отметим только, что происхождение водородной связи обусловлено квантово-механическиими особенностями взаимодействия протона с атомами.
Однако наличие водородной связи у воды - это всего лишь необходимое, но не достаточное условие для объяснения не-обычных свойств воды. Самым важным обстоятельством, объясняющим основные свойства воды, является структура жидкой воды как целостной системы.
 Еще в 1916 г. были разработаны принципиально новые представления о строении жидкости. Впервые с помощью рентгеноструктурного анализа показано, что в жидкостях наблюдается определенная регулярность расположения молекул или иначе - наблюдается ближний порядок расположения молекул. Первые ренгеноструктурные исследования воды провели нидерландские ученые в 1922 году В. Кеез и Дж. де Смедт. Ими было показано, что для жидкой воды характерна упорядоченное размещение молекул воды, т.е. вода имеет определённую регулярную структуру.
Еще в 1916 г. были разработаны принципиально новые представления о строении жидкости. Впервые с помощью рентгеноструктурного анализа показано, что в жидкостях наблюдается определенная регулярность расположения молекул или иначе - наблюдается ближний порядок расположения молекул. Первые ренгеноструктурные исследования воды провели нидерландские ученые в 1922 году В. Кеез и Дж. де Смедт. Ими было показано, что для жидкой воды характерна упорядоченное размещение молекул воды, т.е. вода имеет определённую регулярную структуру.
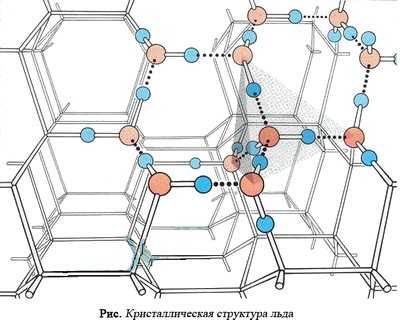
Действительно, структура воды в живом организме во многом напоминает структуру кристаллической решетки льда. И именно этим объясняются сейчас уникальные свойства талой воды, долгое время сохраняющей структуру льда. Талая вода гораздо легче обычной вступает в реакцию с различными веществами, и организму не надо тратить добавочную энергию на перестройку ее структуры.
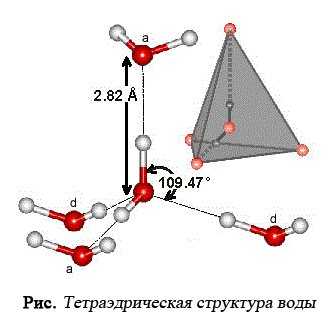
Каждая молекула воды в кристаллической структуре льда участвует в 4 водородных связях, направленных к вершинам тетраэдра. В центре этого тетраэдра находится атом кислорода, в двух вершинах — по атому водорода, электроны которых задействованы в образовании ковалентной связи с кислородом. Две оставшиеся вершины занимают пары валентных электронов кислорода, которые не участвуют в образовании внутримолекулярных связей. При взаимодействии протона одной молекулы с парой неподеленных электронов кислорода другой молекулы возникает водородная связь, менее сильная, чем связь внутримолекулярная, но достаточно могущественная, чтобы удерживать рядом соседние молекулы воды. Каждая молекула может одновременно образовывать четыре водородные связи с другими молекулами под строго определенными углами, равными 109°28', направленных к вершинам тетраэдра, которые не позволяют при замерзании создавать плотную структуру (при этом в структурах льда I, Ic, VII и VIII этот тетраэдр правильный).
Известно, что биологические ткани на 70-90% состоят из воды. Это позволяет предполагать, что многие физиологические явления могут отображать молекулярные особенности не только растворенного вещества, но в равной степени и растворителя - воды. Подобного рода соображения, высказываемые такими крупными современными учеными, как Сент-Дьерди, Поллинг, Клотц и другие, вызвали новую волну повышенного интереса к вопросам структуры и состояния воды в различных системах.
Первую теорию о структуре воды выдвинули английские исследователи Дж. Бернал и Фаулер. Они создали концепцию о тетраэдрической структуре воды.
 В августовском номере 1933 г. только что созданного международного журнала по химической физике "Journal of Chemical Physics” была опубликована их классическая работа о структуре молекулы воды и ее взаимодействии с себе подобными молекулами и ионами разных сортов.
В августовском номере 1933 г. только что созданного международного журнала по химической физике "Journal of Chemical Physics” была опубликована их классическая работа о структуре молекулы воды и ее взаимодействии с себе подобными молекулами и ионами разных сортов.
В своей научной интуиции Дж. Бернал и Р. Фаулер опирались на обширный материал накопленных экспериментальных и теоретических данных в области изучения строения молекулы воды, структуры льда, строения простых жидкостей, на данные ренгеноструктурного анализа воды и водных растворов. Прежде всего, они определили роль водородных связей в воде.
Было известно, что в воде есть ковалентные и водородные связи. Ковалентные связи не рвутся при фазовых переходах воды: вода-пар-лед. Лишь электролиз, нагревание воды на железе и т.п. разрывает ковалентные связи воды. Водородные связи в 24 раза слабее ковалентных. При таянии льда, снега, водородные связи в образующейся воде частично сохраняются, в паре воды они все разорваны.
Попытки представить воду как ассоциированную жидкость с плотной упаковкой молекул воды, подобно шарикам какой-либо емкости, не соответствовали элементарным фактическим данным. В этом случае удельная плотность воды должна была бы быть не 1 г/см3, а более 1,8 г/см3.
Второе важное доказательство в пользу особой структуры молекулы воды состояла в том, что в отличие от других жидкостей вода - это было уже известно - обладает сильным электрическим моментом, составляющим ее дипольную структуру. Поэтому нельзя было представить наличие весьма сильного электрического момента молекулы воды в симметрической конструкции двух атомов водорода относительно атома кислорода, расположив все входящие в нее атомы по прямой линии, т.е. Н-О-Н.
Экспериментальные данные, а также математические расчеты окончательно убедили английских ученых в том, что молекула воды "однобока" и имеет "угловую" конструкцию, а оба атома водорода должны быть смещены в одну сторону относительно атома кислорода на угол 104,50
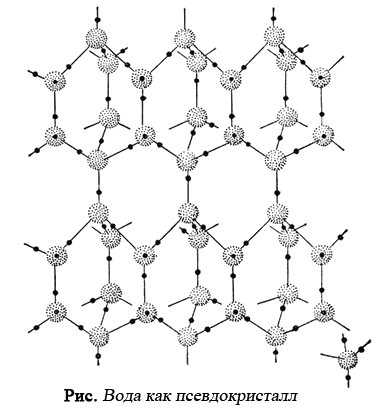
Именно поэтому модель воды Бернала-Фаулера - трехструктурная, с наличием нескольких раздельных типов структур. Согласно этой модели, структура воды определяется структурой ее отдельных молекул.
В дальнейшем была развита идея считать жидкую воду псевдокристаллом, согласно которой вода в жидком состоянии представляет собой как бы смесь трех компонент с различными структурами (структура льда, кристаллического кварца и плотно упакованная структура обычной воды).
Вода - это ажурный псевдокристалл, в котором отдельные тетраэдрические молекулы h3О связаны друг с другом направленными водородными связями, образуя гексагональные структуры как в структуре льда.
В дальнейшем модель воды Бернала-Фаулера была уточнена и пересмотрена. На ее основе возникли более 20 моделей структуры воды, которые можно разделить на 5 групп; 1) непрерывные, 2) смешанные модели структуры воды (двух- и трехструктурные), 3) модели с заполнением пустот, 4) кластерные и 5) модели ассоциатов.
Непрерывные модели структуры воды постулируют, что вода - это единая тетраэдрическая сеть водо-родных связей между отдельными молекулами воды, которые искривляются при плавлении льда.
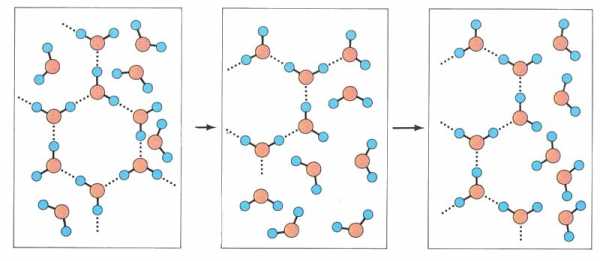
Смешанные модели: вода - это смесь двух или трех структур, например, одиночных молекул, их ассоциатов различной сложности – кластеров.
Дальнейшее усовершенствование этой модели привело к созданию модели с заполнением пустот (включая клатратные модели) и к кластерным моделям. Причём кластеры могут содержать более несколько сот молекул Н2О и подобно мерцающим скоплениям непрерырвно возникают и разрушаются вследствие местных флуктуаций плотности.
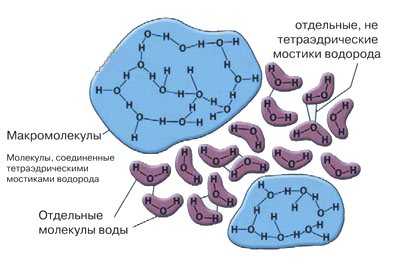
Широко известна кластерная модель структуры воды А.Фрэнка и В.Вена, усовершенствованная Г. Немети-Г. Шерагой (1962). По этой модели, в жидкой воде, наряду с мономерными молекулами имеются кластеры, рои молекул Н2О, объединенных водородными связями со временем жизни 10-10 – 10-11 сек. Они разрушаются и создаются вновь.
Практически все кластерные гипотезы воды осно-вываются на том, что жидкая вода состоит из сети из 4-кратно связанных молекул Н2О и мономеров, которые заполняют пространство между кластерами. На граничных поверхностях кластеров имеются 1, 2- или 3-х кратно связанные молекулы. Еще данную модель называют моделью "мерцающих скоплений". По С. Зенину, кластеры и ассоциаты являются основой структурной памяти воды - долговременной (стабильные) и кратковременной (лабильные, неустойчивые ассоциаты).
В настоящее время известно большое число гипотез и моделей структуры воды. Некоторые исследователи говорят о наличии в воде 10 различных структур воды с неодинаковыми кристаллическими решетками, различной плотностью и температурой плавления.
Профессор И.З. Фишер в 1961 г. ввел понятие о том, что структура воды зависит от времен-ного интервала, в течение которого ее определяют. Он различал три вида структуры воды:
 • Мгновенная структура (время измерения t)
• Мгновенная структура (время измерения t)
• Структура воды средних отрезков времени, когда tд > t > to. 1 и 2 структуры общие со структурой льда. Эта структура существует больше времени осциляции, но меньше времени диффузии tд.
• Структура, характерная для более длительных отрезков времени (>tд), когда молекула h3О передвигается на большие расстояния.
Д. Эзенберг и В. Каутсман связали названия этих трех структур воды с видами движения ее молекул, 1-ю структуру они назвали І-структурой (от английского instantenous – мгновенный), 2-ю - V-структурой (от английского vibrational - вибрационный), 3-ю - D-структурой (от английского diffusion – диффузионный).
Рентгеноструктурное исследование кристаллов воды, проведенное Морганом и Уорреном, показало, что воде свойственна структура, подобная структуре льда. В воде, также как и во льду, каждый атом кислорода окружен как в тетраэдре другими атомами кислорода. Расстояние между соседними молекулами неодинаково. При 25°С каждая молекула воды в каркасе имеет одного соседа на расстоянии 2,77 A и трех - на расстоянии 2,94 A, в среднем - 2,90 A. Среднее между ближайшими соседями молекулы воды примерно на 5,5% больше, чем между молекулами льда. Остальные молекулы находятся на расстояниях, промежуточ-ных между первыми и вторыми соседними дистанциями. Расстояние 4,1 A - это расстояние между атомами О-Н в молекуле Н2О.
По современным представлениям, такая структура в значительной мере определяется водородными связями, которые, объединяя каждую молекулу с ее четырьмя соседями, образуют весьма ажурную "тридимитоподобную" структуру с пустотами, превосходящими по размерам сами молекулы. Основное отличие структуры жидкой воды от льда - это более размытое расположение атомов в решетке, нарушение дальнего порядка. Тепловые колебания приводят к изгибу и разрыву водородных связей. Сошедшие с равновесных положений молекулы воды попадают в соседние пустоты структуры и на некоторое время задерживаются там, так как пустотам соответствуют относительные минимумы потенциальной энергии. Это ведет к увеличению координационного числа и к образованию дефектов решетки, наличие которых обусловливает аномальные свойства воды. Координационное число молекул (число ближайших соседей) меняется от 4,4 при 1,5 °С до 4,9 при 83 °С.
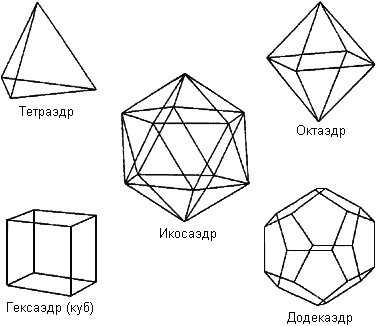
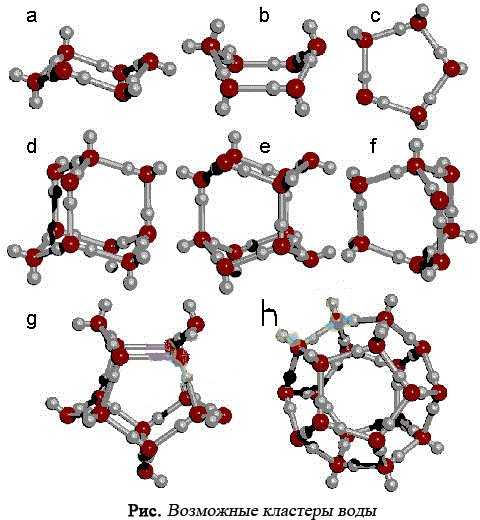 Согласно гипотезе нашего учёного соотечественника С.В. Зенина, вода представляет собой иерархию правильных объемных структур "ассоциатов" (clathrates), в основе которых лежит кристаллоподобный "квант воды", состоящий из 57 ее молекул, которые взаимодействуют друг с другом за счет свободных водородных связей. При этом 57 молекул воды (квантов), образуют структуру, напоминающую тетраэдр. Тетраэдр в свою очередь состоит из 4 додекаэдров (правильных 12-гранников). 16 квантов образуют структурный элемент, состоящий из 912 молекул воды. Вода на 80% состоит из таких элементов, 15% - кванты-тетраэдры и 3% - классические молекулы Н2О. Таким образом, структура воды связана с так называемыми платоновыми телами (тетраэдр, додекаэдр), форма которых связана с золотой пропорцией. Ядро кислорода также имеет форму платонова тела (тетраэдра).
Согласно гипотезе нашего учёного соотечественника С.В. Зенина, вода представляет собой иерархию правильных объемных структур "ассоциатов" (clathrates), в основе которых лежит кристаллоподобный "квант воды", состоящий из 57 ее молекул, которые взаимодействуют друг с другом за счет свободных водородных связей. При этом 57 молекул воды (квантов), образуют структуру, напоминающую тетраэдр. Тетраэдр в свою очередь состоит из 4 додекаэдров (правильных 12-гранников). 16 квантов образуют структурный элемент, состоящий из 912 молекул воды. Вода на 80% состоит из таких элементов, 15% - кванты-тетраэдры и 3% - классические молекулы Н2О. Таким образом, структура воды связана с так называемыми платоновыми телами (тетраэдр, додекаэдр), форма которых связана с золотой пропорцией. Ядро кислорода также имеет форму платонова тела (тетраэдра).
Элементарной ячейкой воды являются тетраэдры, содержащие связанные между собой водородными связями четыре (простой тетраэдр) или пять молекул Н2О (объемно-центрированный тетраэдр).
При этом у каждой из молекул воды в простых тетраэдрах сохраняется способность образовывать водородные связи. За счет их простые тетраэдры могут объединяться между собой вершинами, ребрами или гранями, образуя различные кластеры со сложной структурой, например, в форме додекаэдра.
Объединяясь друг с другом, кластеры могут образовывать более сложные структуры.
Кластеры, содержащие в своём составе 20 молекул, оказались более стабильными.
Профессор Мартин Чаплин рассчитал и предположил иную модель воды, в основе которой лежит икосаэдр.
Согласно этой модели вода состоит из 1820 молекул воды - это в два раза больше, чем в модели Зенина. Гигантский икосаэдр в свою очередь состоит из 13 более мелких структурных элементов. Причем, так же как и у Зенина, структура гигантского ассоциата базируется на более мелких образованиях.
Таким образом, сейчас это является очевидным фактом, что в воде возникают ассоциаты воды, которые несут в себе очень большую энергию и информацию крайне высокой плотности.
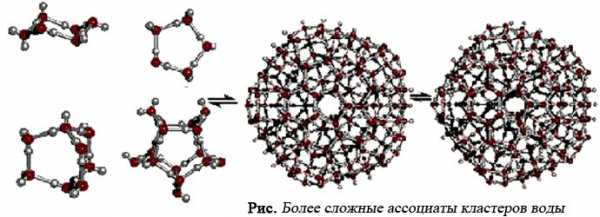
Порядковое число таких структур воды так же высоко, как и порядковое число кристаллов (структура с максимально высоким упорядочением, которую мы только знаем), потому их также называют «жидкими кристаллами» или «кристаллической водой». Такая структура энергетически выгодна и разрушается с освобождением свободных молекул воды лишь при высоких концентрациях спиртов и подобных им растворителей [Зенин, 1994].
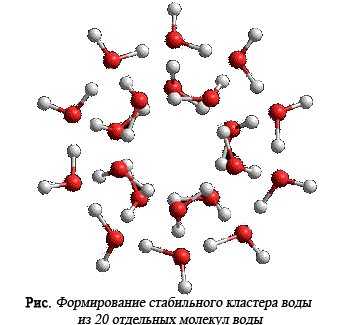

"Кванты воды" могут взаимодействовать друг с другом за счет свободных водородных связей, торчащих наружу из вершин “кванта” своими гранями. При этом возможно образование уже двух типов структур второго порядка. Их взаимодействие друг с другом приводит к появлению структур высшего порядка. Последние состоят из 912 молекул воды, которые по модели Зенина практически не способны к взаимодействию за счет образования водородных связей. Этим и объясняется, например, высокая текучесть жидкости, состоящей из громадных полимеров. Таким образом, водная среда представляет собой как бы иерархически организованный жидкий кристалл.

Изменение положения одного структурного элемента в этом кристалле под действием любого внешнего фактора или изменение ориентации окружающих элементов под влиянием добавляемых веществ обеспечивает, согласно гипотезе Зенина, высокую чувствительность информационной системы воды. Если степень возмущения структурных элементов недостаточна для перестройки всей структуры воды в данном объеме, то после снятия возмущения система через 30-40 мин возвращается в исходное состояние. Если же перекодирование, т. е. переход к другому взаимному расположению структурных элементов воды оказывается энергетически выгодным, то в новом состоянии отражается кодирующее действие вызвавшего эту перестройку вещества [Зенин, 1994]. Такая модель позволяет Зенину объяснить "память воды" и ее информационные свойства [Зенин, 1997].
 Кроме того, структурированное состояние воды оказалось чувствительным датчиком различных полей. С. Зенин считает, что мозг, сам состоящий на 90% из воды, может, тем не менее, изменять её структуру.
Кроме того, структурированное состояние воды оказалось чувствительным датчиком различных полей. С. Зенин считает, что мозг, сам состоящий на 90% из воды, может, тем не менее, изменять её структуру.
Кластерная модель воды объясняет её многие аномальные свойства.
Первое аномальное свойство воды – аномалия точек кипения и замерзания: Если бы вода - гидрид кислорода – Н2О была бы нормальным мономолекулярным соединением, таким, например, как ее аналоги по шестой группе Периодической системы элементов Д.И. Менделеева гидрид серы Н2S, гидрид селена Н2Se, гидрид теллура Н2Те, то в жидком состоянии вода существовала бы в диапазоне от минус 90°C до минус 70°C.
При таких свойствах воды жизни на Земле не существовало бы. Но к счастью для нас, и для всего живого на свете, вода аномальна. Она не признает периодических закономерностей, характерных для бесчисленного множества соединений на Земле и в космосе, а следует своим, еще не вполне понятным для науки законам, подарившим нам удивительный мир жизни.
 "Ненормальные" температуры плавления и кипения воды - далеко не единственная анормальность воды. Для всей биосферы исключительно важной особенностью воды является ее способность при замерзании увеличивать, а не уменьшать свой объем, т.е. уменьшать плотность. Это вторая аномалия воды, которая именуется аномалией плотности. На это особое свойство воды впервые обратил внимание еще Г. Галилей. При переходе любой жидкости (кроме галлия и висмута) в твердое состояние молекулы располагаются теснее, а само вещество, уменьшаясь в объеме, становится плотнее. Любой жидкости, но не воды. Вода и здесь представляет собой исключение. При охлаждении вода сначала ведет себя, как и другие жидкости: постепенно уплотняясь, она уменьшает свой объем. Такое явление можно наблюдать до +4°С (точнее до +3,98°С).
"Ненормальные" температуры плавления и кипения воды - далеко не единственная анормальность воды. Для всей биосферы исключительно важной особенностью воды является ее способность при замерзании увеличивать, а не уменьшать свой объем, т.е. уменьшать плотность. Это вторая аномалия воды, которая именуется аномалией плотности. На это особое свойство воды впервые обратил внимание еще Г. Галилей. При переходе любой жидкости (кроме галлия и висмута) в твердое состояние молекулы располагаются теснее, а само вещество, уменьшаясь в объеме, становится плотнее. Любой жидкости, но не воды. Вода и здесь представляет собой исключение. При охлаждении вода сначала ведет себя, как и другие жидкости: постепенно уплотняясь, она уменьшает свой объем. Такое явление можно наблюдать до +4°С (точнее до +3,98°С).
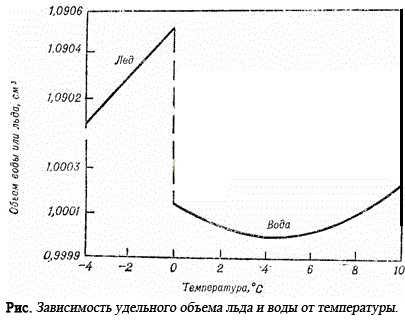 Именно при температуре +3,98°С вода имеет наибольшую плотность и наименьший объем. Дальнейшее охлаждение воды постепенно приводит уже не к уменьшению, а к увеличению объема. Плавность этого процесса вдруг прерывается и при 0°С происходит резкий скачок увеличения объема почти на 10%! В это мгновение вода превращается в лед.
Именно при температуре +3,98°С вода имеет наибольшую плотность и наименьший объем. Дальнейшее охлаждение воды постепенно приводит уже не к уменьшению, а к увеличению объема. Плавность этого процесса вдруг прерывается и при 0°С происходит резкий скачок увеличения объема почти на 10%! В это мгновение вода превращается в лед.
Уникальная особенность поведения воды при охлаждении и образовании льда играет исключительно важную роль в природе и жизни. Именно эта особенность воды предохраняет от сплошного промерзания в зимний период все водоемы земли - реки, озера, моря и тем самым спасает жизнь.
В отличие от пресной воды морская вода при охлаждении ведет себя иначе. Замерзает она не при 0°С, а при минус 1,8-2,1°С - в зависимости от концентрации растворенных в ней солей. Имеет максимальную плотность не при + 4°С, а при -3,5°С. Таким образом она превращается в лед, не достигая наибольшей плотности. Если вертикальное перемешивание в пресных водоемах прекращается при охлаждении всей массы воды до +4°С, то в морской воде вертикальная циркуляция происходит даже при температуре ниже 0°С. Процесс обмена между верхними и нижними слоями идет непрерывно, создавая благоприятные условия для развития животных и растительных организмов.
Особенно благоприятной средой для обитателей морей и океанов являются талые воды, образующиеся при таянии ледников и айсбергов. В безбрежных просторах океанов плавающие горы-айсберги в основном скрыты под водой, однако могут представлять серьезную опасность для судоходства. Трагедией века была названа гибель "Титаника", которая произошла в результате столкновения суперлайнера с огромным айсбергом 14 апреля 1912 года.
Все термодинамические свойства воды заметно или резко отличаются от других веществ.
Наиболее важная из них – аномалия удельной теплоемкости. Аномально высокая теплоемкость воды делает моря и океаны гигантским регулятором температуры нашей планеты, в результате чего не происходит резкого перепада температур зимой и летом, днем и ночью. Континенты, расположенные вблизи морей и океанов, обладают мягким климатом, где перепады температуры в различные времена года бывают незначительными.
Мощные атмосферные потоки, содержащие огромное количество теплоты, поглощенное в процессе парообразования, гигантские океанические течения играют исключительную роль в создании погоды на нашей планете.
Аномалия теплоёмкости заключается в следующем: При нагревании любого вещества теплоемкость неизменно повышается. Да, любого вещества, но не воды. Вода - исключение, она и здесь не упускает возможности быть оригинальной: с повышением температуры изменение теплоемкости воды аномально; от 0 до 37°С она понижается и только от 37 до 100°С теплоемкость все время растет.
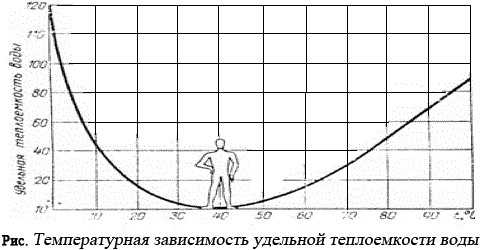
В пределах температур, близких к 37°С, теплоемкость воды минимальна. Именно эти температуры - область температур человеческого тела, область нашей жизни. Физика воды в области температур 35-41°С (пределы возможных, нормально протекающих физиологических процессов в организме человека) констатирует вероятность достиже-ния уникального состояния воды, когда массы квазикристаллической и объемной воды равны друг другу и способность одной структуры переходить в другую - вариабельность - максимальная. Это замечательное свойство воды предопределяет равную вероятность течения обратимых и необратимых биохимических реакций в организме человека и обеспечивает "легкое управление" ими.
Другим общеизвестна исключительная способность воды растворять любые вещества. И здесь вода демонстрирует необычные для жидкости аномалии, и в первую очередь аномалии диэлектрической постоянной воды. Это связано с тем, что ее диэлектрическая постоянная (или диэлектрическая проницаемость) очень велика и составляет 81, в то время как для других жидкостей она не превышает 10. В соответствии с законом Кулона сила взаимодействия двух заряженных частиц в воде будет в 81 раз меньше, чем, например, в воздухе, где эта характеристика равна единице. В этом случае прочность внутримолекуляр-ных связей уменьшается в 81 раз и под действием теплового движения молекулы диссоциируют с образованием ионов. Необходимо отметить, что из-за исключительной способности растворять другие вещества вода никогда не бывает идеально чистой.
Следует упомянуть еще об одном удивительной аномалии воды - исключительно высоком поверхностном натяжении. Из всех известных жидкостей только ртуть имеет более высокое поверхностное натяжение. Это свойство проявляется в том, что вода всегда стремится сократить свою поверхность.
Нескомпенсированные межмолекулярные силы наружного (поверхностного) слоя воды, вызванные квантовомеханическими причинами, создают внешнюю упругую пленку. Благодаря пленке многие предметы, будучи тяжелее воды, не погружаются в воду. Если, например, стальную иголку осторожно положить на поверхность воды, то иголка не тонет. А ведь удельный вес стали почти в восемь раз больше удельного веса воды. Всем известна форма капли воды. Высокое поверхностное натяжение позволяет воде иметь шарообразную форму при свободном падении.
Поверхностное натяжение и смачивание являются основой особого свойств воды и водных растворов, названного капиллярностью. Капиллярность имеет огромное значение для жизни растительного, животного мира, формирования структур природных минералов и плодородия земли. В каналах, которые во много раз уже человеческого волоса, вода приобретает удивительные свойства. Она становится более вязкой, уплотняется в 1,5 раза, а замерзает при минус 80-70°С.
Причиной сверханомальности капиллярной воды являются межмолекулярные взаимодействия, тайны которых еще далеко не раскрыты.
Ученым и специалистам известна так называемая поровая вода. В виде тончайшей пленки она устилает поверхность пор и микрополостей пород и минералов земной коры и других объектов живой и неживой природы.
Связанная межмолекулярными силами с поверхностью других тел, эта вода, как и капиллярная вода, обладает особой структурой.
Таким образом, аномальные и специфические свойства воды играют ключевую роль в ее многообразном взаимодействии с живой и неживой природой. Все эти необычные особенности свойств воды настолько "удачны" для всего живого, что делает воду незаменимой основой существования жизни на Земле.
Автор: О феномене "памяти" воды к.х.н. О.В. Мосин
ЛИТЕРАТУРА
1. Белая М.Л., Левадный В.Г. Молекулярная структура воды. М.: Знание 1987. – 46 с.
2. Бернал Дж. Д. Геометрия построек из молекул воды. Успехи химии, 1956, т. 25, с. 643-660.
3. Бульенков Н.А. О возможной роли гидратации как ведущего интеграционного фактора в организации биосистем на разных уровнях их иерархии. Биофизика, 1991, т.36, в.2, с.181-243.
4. Зацепина Т.Н. Свойства и структура воды. М.: изд-во МГУ, 1974, - 280 с.
5. Наберухин Ю.И. Структурные модели жидкости. М.: Наука. 1981 – 185 с.
kfs-centr.com