Водорода оксид: описание вещества, получение, свойства. Вода оксид
описание вещества, получение, свойства :: SYL.ru
Что собой представляет кислородное соединение водорода? Оксид данного элемента обладает определенными физическими и химическими свойствами. Попробуем понять двойственность признаков данного соединения и выявить его отличительные характеристики.

Определение
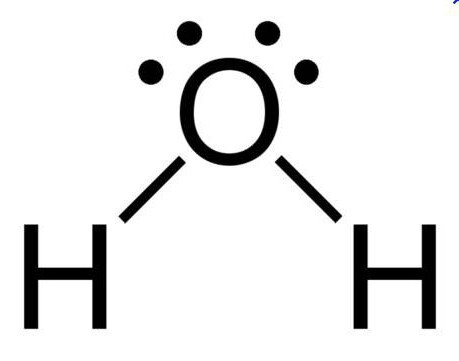
Самым важным и распространенным на нашей планете веществом является именно кислородное соединение водорода. Оксид его знаком нам в качестве обычной воды. Сложно представить себе какое-то иное соединение, которое имеет такое же значение для живых организмов. Оксидами принято называть бинарные соединения, в составе которых есть кислород. Важным условием при этом является расположение кислорода в конце химической формулы.
Классификация
В настоящее время выделяют три группы оксидов. Основными считают кислородные соединения, которые образованы металлами, имеющими низкую валентность (один или два). В качестве исключений из общего правила можно рассмотреть оксиды бериллия и цинка. Несмотря на то что валентность этих металлов равна двум, их кислородные соединения относят к амфотерным оксидам. Особенностью амфотерных соединений считают их взаимодействие с кислотами и щелочами. Двойственные свойства также проявляют оксиды металлов, имеющих валентность три.
Кислотные оксиды образуются неметаллами, а также металлами с валентностью от четырех до семи. К какой группе относится соединение водорода? Оксид данного элемента проявляет двойственные химические свойства, поэтому считается амфотерным соединением.

Получение в лаборатории
Восстановление оксидов водородом является одним из способов получения воды. Данный процесс используется в промышленности для переработки металлолома, выделения из него черных и цветных металлов. Гидрирование относится к термическому и каталитическому процессу, одним из продуктов которого является жидкая вода.
Распространенность в природе
Есть ли в природе данное соединение водорода? Оксид этого неметалла присутствует в газообразном виде в составе воздуха, в твердом состоянии он находится в ледниках. Жидкая форма данного оксида - обычная вода, с которой знаком каждый человек. По праву именно этот оксид считают самым распространенным на Земле веществом, обеспечивающим протекание всех биологических и химических процессов, происходящих в живой природе.

Физические свойства и особенности строения
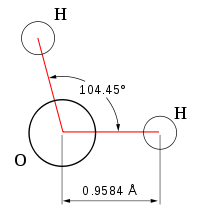
При нормальных условиях вода является бесцветной жидкостью, не имеющей вкуса и запаха. Данное вещество считается отличным полярным растворителем, поэтому многие процессы протекают именно в водной среде. Температура ее кипения составляет 100 градусов. При нулевой же температуре вода превращается в лед. Данное соединение имеет дипольное строение, а объяснить это можно особенностями молекулы. Так как у кислорода остаются незадействованными две электронные пары, в оксиде sp3 гибридное состояние имеет атом кислорода, величина валентного угла составляет 110 градусов.
Химические свойства
С какими веществами вступает в реакцию оксид водорода? Химическое уравнение, отражающее реакцию между водой и кислотными оксидами, предполагает образование кислот. Исключением из общего правила является оксид кремния - с ним не реагирует оксид водорода. Уравнение реакции между кислородным соединением активного металла и водой представлено в виде: СаО+Н2О=Са(ОН)2
Конечным продуктом такого взаимодействия является щелочь.
Помимо реакций с оксидами, вода способна к взаимодействию с металлами. Щелочные металлы (без нагревания) образуют щелочь, при этом образуется и газообразный водород.
Металлы средней активности (при нагревании) образуют в реакции с водой оксид и водород. Малоактивные металлы, которые располагаются в электрохимическом ряду напряжений металлов после водорода, не способны взаимодействовать с водой.
Последовательность лабораторного получения воды может быть представлена в следующем виде: водород-оксид. Реакция, протекающая в этом случае, является экзотермической и сопровождается выделением большого количества тепловой энергии. Конечным продуктом ее является оксид водорода. Уравнение реакции имеет вид: 2Н2+О2=2Н2О
Дипольное строение молекулы воды объясняет возможность образования этим неорганическим соединением водородных связей, имеющих ковалентный характер. У этого соединения самое высокое значение теплопроводности, поэтому именно вода является тем веществом, которое применяют в отопительных системах. 
Биологическое значение
Невозможно представить жизнь человека без воды. Этот универсальный растворитель нужен не только в химической лаборатории. Каждую секунду в живых существах осуществляются сложные биохимические процессы. Вода не только является активным участником многих синтезов, но и выступает в качестве побочного продукта многих из них. За шестьдесят лет своего существования, человек пропускает через свой организм около 50 тонн этого уникального неорганического вещества.
Оксид водорода нашел применение во многих сферах промышленной деятельности человека. Данное соединение незаменимо в медицине, востребовано в сельском хозяйстве.
Например, в теплоэнергетике описываемое химическое соединение является рабочим телом и основным теплоносителем. Электрические станции, базирующиеся на нем, расходуют до 40 кубических метров воды за одну секунду. К примеру, для полного охлаждения конденсатора гидротурбины, необходимо до десяти тысяч кубических метров оксида водорода. В металлургической отрасли вода применяется в качестве охлаждающего вещества для основного оборудования, используются и ее физические характеристики, например высокая теплопроводность.
В химической отрасли она востребована как хороший растворитель, а также отличное «транспортное средство» для перемещения реагентов из одного технологического препарата в другой.
Отметим, что и вывод жидких производственных отходов также осуществляется в виде суспензий и эмульсий. Сложно достоверно оценить те объемы оксида водорода, которые идут на бытовые и промышленные нужды.
В медицине вода - это отличный растворитель, вещество для гигиены и санитарии, лекарственное средство. Она обеспечивает перенос питательных веществ к растениям, является активным участником фотосинтеза, регулятором температуры живых существ. В быту данное химическое соединение необходимо и для приготовления пищи, и для вывода продуктов жизнедеятельности человека. Именно поэтому так важно, чтобы питьевая вода, используемая людьми, отвечала всем требованиям, не содержала вредных для здоровья человека примесей.
Кстати, среди многочисленных существ, которые обитают на нашей планете, не нуждаются в воде только вирусы.
www.syl.ru
Оксиды Классификация, свойства, получение, применение
Оксиды — это неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2. Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
 Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
- Солеобразующие оксиды (CO2, N2O5,Na2O, SO3 и т. д.)
- Несолеобразующие оксиды(CO, N2O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
- Основные оксиды — (Оксиды металлов — Na2O, CaO, CuO и т д)
- Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn2O7,CO2, N2O5, SO2, SO3 и т д)
- Амфотерные оксиды (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты. Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам: Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства:
Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства: Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
CO2 – оксид углерода (IV)
N2O3 – оксид азота (III)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Химические свойства оксидов
-
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований): Основные оксиды реагируют с кислотными оксидами с образованием солей:
Основные оксиды реагируют с кислотными оксидами с образованием солей: Аналогично реагируют и с кислотами, но с выделением воды:
Аналогично реагируют и с кислотами, но с выделением воды: Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
-
Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты: Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли: Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:
Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями: Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:
Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль: Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
-
Амфотерные оксиды
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей:  И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом:  При обжиге или горении различных бинарных соединений:
При обжиге или горении различных бинарных соединений: Термическое разложение солей, кислот и оснований :
Термическое разложение солей, кислот и оснований : Взаимодействие некоторых металлов с водой:
Взаимодействие некоторых металлов с водой:
Применение оксидов
 Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO2 является основным компонентом стекла. Оксид хрома Cr2O3 применяют для производства цветных зелёных стекол и керамики, а за счёт высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO2, который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
in-chemistry.ru
Оксид водорода - это... Что такое Оксид водорода?
| Вода | |
 | |
| Систематическое наименование | Оксид водорода |
| Традиционные названия | вода |
| Химическая формула | Н2O |
| Молярная масса | 18,01528 г/моль |
| Плотность вещества | 0,9982 г/см³ |
| Состояние (ст. усл.) | жидкость |
| Динамическая вязкость (ст. усл.) | 0,00101 Па·с(при 20 °C) |
| Кинематическая вязкость (ст. усл.) | 0,01012 см²/с(при 20 °C) |
| Температура плавления | 0 °C |
| Температура кипения | 99,974 °C |
| Тройная точка | 0,01 °C, 611,73 Па |
| Критическая точка | 374 °C, 22,064 MПа |
| Молярная теплоёмкость (ст. усл.) | 75,37 Дж/(моль·К) |
| Теплопроводность (ст. усл.) | 0,56 Вт/(м·K) |
Вода́ (оксид водорода) — прозрачная жидкость, не имеющая цвета (в малом объёме) и запаха. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. 71 % поверхности Земли покрыто водой (океаны, моря, озера, реки).
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Физические и химические свойства
Физические свойства
Вода обладает рядом необычных особенностей:
- При таянии льда его плотность увеличивается (с 0,9 до 1 г/см³). Почти у всех остальных веществ при плавлении плотность уменьшается.
- При нагревании от 0 °C до 4 °C (3,98 °C — точно) вода сжимается. Благодаря этому могут жить рыбы в замерзающих водоёмах: когда температура падает ниже 4 °C, более холодная вода, как менее плотная, остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура.
- Высокая температура и удельная теплота плавления (0 °C и 333,55 кДж/кг), температура кипения (100 °C) и удельная теплота парообразования (2250 КДж/кг [1]), по сравнению с соединениями водорода с похожим молекулярным весом.
- Высокая теплоёмкость жидкой воды.
- Высокая вязкость.
- Высокое поверхностное натяжение.
- Отрицательный электрический потенциал поверхности воды.
Все эти особенности связаны с наличием водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а так же того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода — каждый в одной, а атом кислорода — в двух. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4 °С этот эффект слабее, чем обычное тепловое расширение; при испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.

Капля, ударяющаяся о поверхность воды
По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. [2] Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Чистая (не содержащая примесей) вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония h4O+) и гидроксильных ионов HO- составляет 0,1 мкмоль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60% парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чем основан принцип действия микроволновой печи.
Агрегатные состояния

По состоянию различают:
При атмосферном давлении вода замерзает (превращается в лёд) при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C. При снижении давления температура плавления воды медленно растёт, а температура кипения — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такое давление и температура называются тройной точкой воды. При более низком давлении вода не может находится в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки льда падает со снижением давления.
При росте давления температура кипения воды растёт, плотность водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
Так же возможны метастабильные состояния — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Изотопные модификации воды
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов, входящих в молекулу, выделяют следующие виды воды: Лёгкая вода (просто вода), Тяжёлая вода (дейтериевая) и Сверхтяжёлая вода(тритиевая).
Химические свойства
Вода является наиболее распространённым растворителем на Земле, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+ анион OH-). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ ок. 16.
Сама по себе вода относительно инертна в обычных условиях, но её сильно полярные молекулы сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Вода в природе
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде. Роль воды в клетке - см. статью
Атмосферные осадки
Осадки согласно направлению
Осадки согласно состоянию
Виды воды
Вода на Земле может существовать в трёх основных состояниях — жидком, газообразном и твёрдом и в свою очередь приобретать самые разные формы, которые зачастую соседствуют друг с другом. Водный пар и облака в небе, морская вода и айсберги, горные ледники и горные же реки, водоносные слои в земле. Вода способна растворять в себе много веществ, приобретая тот или иной вкус. Из-за важности воды, «как источника жизни» её нередко подразделяют на типы.
Характеристики вод
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
Исследования воды
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
Биологическая роль
Вода играет уникальную роль, как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Применение
Земледелие
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90% в некоторых странах.
Питьё и приготовление пищи
Живое человеческое тело содержит от 55% до 78% воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. Для нормального функционирования организма человеку нужно усвоить от 1 до 7 литров воды за день в зависимости от температуры и влажности окружающей среды, физической активности и пр.
Растворитель
Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
Теплоноситель
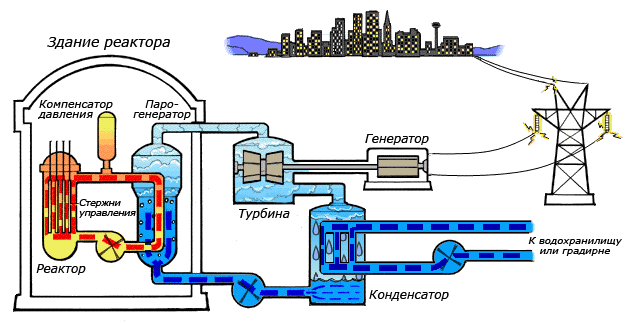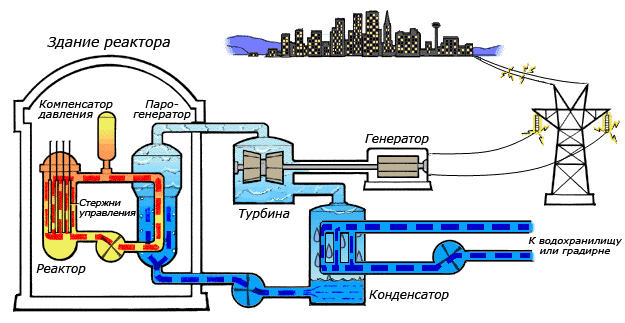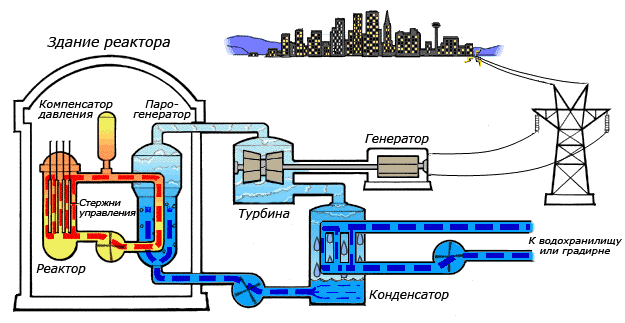 Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР)
Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР) Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Пожаротушение
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции от огня в составе пены.
Спорт
Многие вида спорта проходят на водных поверхностях, на льду, на снегу и даже в воде. Это подводное плавание, хоккей, лодочные виды спорта, биатлон и пр.
Инструмент
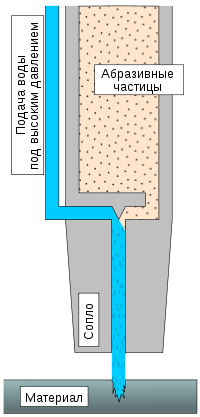
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Интересные факты
- В среднем в организме растений и животных содержится более 50 % воды.[3]
- В составе мантии Земли воды содержится в 10-12 раз больше, чем в Мировом океане.
- При средней глубине в 4 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.
- Если бы на Земле не было впадин и выпуклостей, вода покрыла бы всю Землю, и ее толщина была бы 3 км.
- Если бы все ледники растаяли, то уровень воды на Земле поднялся бы на 64 м и около 1/8 поверхности суши было бы затоплено водой.
- Морская вода при обычной её солёности 35 ‰ замерзает при температуре −1,91 °C[4].
- Иногда вода замерзает при положительной температуре[5].
- При определённых условиях (внутри нанотрубок) молекулы воды образуют новое состояние, при котором они сохраняют способность течь даже при температурах, близких к абсолютному нулю.[6]
- Среди существующих в природе жидкостей поверхностное натяжение воды уступает только ртути.
- Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
- Синий цвет чистой океанской воды объясняется избирательным поглощением и рассеянием света в воде.
- С помощью капель воды из кранов можно накопить заряд 10 киловольт, опыт называется «Капельница Кельвина».
- Существует следующая поговорка с использованием формулы воды - h3O: «Сапоги мои того — пропускают h3O». Вместо сапогов в поговорке может участвовать и другая дырявая обувь.[7][8][9]
См. также

71 % поверхности - Н2O
Дополнительное чтение
Литература
Примечания
Ссылки
Информационные проекты
Справочные материалы
Статьи
Wikimedia Foundation. 2010.
dic.academic.ru
Оксиды: интересные факты
Оксидом является соединение, образованное двумя химическими элементами, один из которых кислород. Практически все элементы Периодической системы Менделеева Д. И. способны образовывать оксиды. Но оксиды Гелия, Неона, Аргона не получены. Наиболее известным и широко распространённым оксидом является вода. Она повсюду. Даже радуга – это результат преломления солнечных лучей в каплях воды.
Формулы оксидов
Элемент с постоянной валентностью образует один оксид. Например, у двухвалентного кальция оксид: CaO. Если у элемента переменная валентность, то он способен образовывать несколько оксидов. Примером являются окиды хрома: СrO, Сr2O3, СrO3.
Формула определяется в зависимости от валентностей составляющих элементов. Приведём пример для оксида серы. 1.Кислород двухвалентен. Сера черырёхвалентна. Пишем валентности над символами IV II химических элементов: SO. 2. Определяем наименьшее число, которое делится на 2 и 4. Таким числом является 4. 3. Определяем индекс возле серы: делим полученное число на значение валентности 4/4=1. Значит, индекс возле серы не пишем. 4. Этим же методом находим индекс возле кислорода: 4/2=2. 5. Получили формулу: SO2.
Интересное об оксидах
Причиной эффекта собачьей пещеры в Италии является оксид углерода СО2. Он тяжелее воздуха, поэтому получается так, что газ в пещере как раз покрывает собачью голову. Невысокие животные гибнут от удушья за несколько минут. А за счёт своего роста человек может легко пройти по ней.
В 1890 году парусное судно «Малборо» направлялось в Англию из Новой Зеландии. На борту было 23 члена экипажа и несколько пассажиров. В Англию судно не прибыло. Лишь через 23 года корабль появился вновь возле Огненной Земли. Шёл на всех парусах и оказался абсолютно не повреждённым. Оказывается, что причиной гибели людей стало извержение вулкана на острове Мартиника. Вулканические газы содержали 1,6% СО.

СО не растворяется в воде, не обладает запахом, определить его сложно. А на людей и животных воздействует, как яд. При этом для некоторых видов рыб он не опасен, хотя китоподобные могут погибнуть и при очень небольшой концентрации газа в воздухе. Холоднокровные, например жабы, могут переносить концентрацию СО в 1000 раз большую, чем теплокровные.
Появление кислот в атмосфере
Кислотные дожди появляются, когда с атмосферным кислородом и водяным паром соединяются оксиды серы и азота. Эти оксиды выбрасываются в окружающую среду металлургическими предприятиями, электростанциями, автомобильным транспортом. Полученные таким образом кислоты имеют вид дождя и разносятся ветром.

Оксид серы выбросов реагирует с водой, в результате образуется сернистая кислота: SO2+h3O=h3SO3. И взаимодействуя с кислородом воздуха, она частично превращается в серную кислоту: 2Н2SO3+О2=2Н2SO4.
Оксиды азота появляются в атмосфере в результате реакций азота и кислорода. Взаимодействие осуществляется при высоких температурах сгорания топлива N2+O2=2NO Но образуемое соединение быстро взаимодействует с кислородом: 2NO+O2=2NO2, А полученный оксид азота реагирует с влагой из окружающей среды 2NO2+Н2О=НNO2+НNO3.
Сфера влияния кислотных дождей
Таким образом в воздухе появляются примеси кислот: серной, сернистой, азотной и азотистой. И эти примеси с осадками попадают на землю. Кислотные дожди негативно сказываются на росте растений, здоровье животных и людей.
В 1952 году непрозрачный туман охватил улицы Лондона, в результате чего погибло 4000 жителей. Частички смога раздражали дыхательные пути, а в лёгких появлялась слизь. Многие люди получили сердечные приступы с предшествующим тяжёлым кашлем. По оценкам учёных тот туман был более кислым, чем лимонный сок. Затем правительством было запрещено сжигать в городе топливо, образующее большое количество дыма. Это было сделано во избежание образования серной и азотной кислот.
Урожайность многих культур уменьшается на 3-8%, потому что листья повреждаются кислотами. Изменяется состав воды в озёрах и ставках. В результате погибает рыба и многие виды насекомых. Исчезают птицы и животные, которые ими питаются. У улиток истончается карбонатная раковина, которая защищает их. В результате они гибнут. Также разрушаются ракушки обитателей водоёмов. Это негативно сказывается на экосистемах.
Кислотные дожди закисляют почвы. Большинству растений это не по нраву. Существует совсем немного растений, способных расти на кислых почвах без ущерба для себя. Такое растение - хвощ полевой. Из-за жёсткости им не питаются травоядные животные.
Кроме того кислотные дожди увеличивают коррозию металлов, разрушают мрамор и известняк.
После того, как был определён вред подобных дождей, в развитых странах стали устанавливать улавливатели, не пропускающие кислотные оксиды в воздух.
Основные, кислотные, амфотерные оксиды и их свойства, получение
Получение оксидов происходит с помощью различных способов. Из наиболее простых 2h3 + O2 = 2h3O

Существуют основные и кислотные оксиды. Они различаются тем, что при взаимодействии оксида с водой образуется либо кислота, либо основание. Эти реакции относят к реакциям соединения:
СаО+Н2О=Са(ОН)2.
1. Основные оксиды и кислотные оксиды способны взаимодействовать между собой: СаО+SO3=CaSO4 2. Основные оксиды взаимодействуют с кислотами. Образуются соответствующая соль и вода: CaO+h3SO4=CaSO4+h3O 3. Образуются соответствующая соль и вода и при взаимодействии кислотных оксидов со щелочами: СО2+2NaOH=Na2CO3+h3O.
В химии существуют вещества, проявляющие двойственность свойств. Это подобные двуликому Янусу амфотерные оксиды. Выступают как в качестве кислотных, так и в качестве основных оксидов. Поэтому со щелочами они проявляют особенности, характерные для кислотных оксидов, а с кислотами – основных.
Применение оксидов
Известно около 300 оксидов. Из железных руд, содержащих оксиды железа, получают железо. Песок, состоящий преимущественно состоит из SiO2, используют при производстве стекла.
Некоторые оксиды являются основой для красок: ZnO – белой, Fe2O3 – коричневой, Cr2O3 – зелёной. А природные и искусственные кристаллы оксидов алюминия, окрашенные примесями, используют для изготовления ювелирных украшений.

Эти соединения могут как дарить жизнь, так и разрушать её. То есть значение оксидов в жизни человека и природе является довольно существенным.
www.himikatus.ru
СЛАВА ВОДЕ - Химические свойства воды
Химические свойства воды
Взаимодействие воды с металлами.Если в цилиндр с водой опустить стружки кальция, то от поверхности кальция начнут отрываться пузырьки газа, как от поверхности цинка, помещенного в раствор серной кислоты. При поднесении зажженной лучинки к отверстию цилиндра мы будем наблюдать вспышки. Это горит водород. Вода в цилиндре мутнеет. Появившиеся в цилиндре белые взвешенные частицы — гидроксид кальция Са(ОН)2. Протекающая реакция выражается уравнением:
Са + 2Н20 = 2Са (ОН)2 + Н2 ↑
 При этой реакции из молекулы воды Н2О, которую можно представить как Н—ОН (группа — ОН — гидроксогруппа), —ОН переходит в состав гидроксида кальция. Так как атом кальция двухвалентен, то он вытесняет из двух молекул воды два атома водорода, а оставшиеся две группы —ОН соединяются с атомом кальция.
При этой реакции из молекулы воды Н2О, которую можно представить как Н—ОН (группа — ОН — гидроксогруппа), —ОН переходит в состав гидроксида кальция. Так как атом кальция двухвалентен, то он вытесняет из двух молекул воды два атома водорода, а оставшиеся две группы —ОН соединяются с атомом кальция.
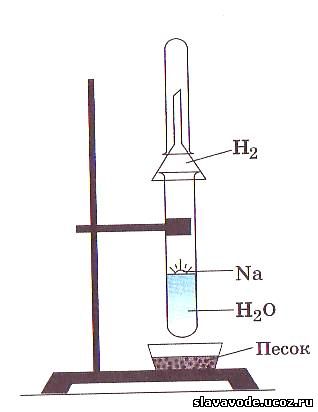
Еще энергичнее протекает реакция натрия с водой. Опустим кусочек натрия в стакан с водой. Натрий всплывает на ее поверхность, плавится, превращаясь в блестящую каплю. Она быстро перемещается по поверхности воды, издавая шипение и уменьшаясь в размерах. Выпарив раствор, мы обнаружим твердое белое вещество — гидроксид натрия NaOH
2Na + 2НОН = 2NaOH + Н2 ↑
Натрий и кальций принадлежат к числу наиболее химически активных.
Взаимодействие воды с оксидами неметаллов.
Сожжем в банке на ложечке красный фосфор. Прильем немного воды и подождем, пока получившийся оксид фосфора (V) Р205 растворится. Добавим к раствору несколько капель фиолетового лакмуса. Лакмус окрасится в красный цвет. Значит, в растворе содержится кислота. Оксид фосфора (V) соединяется с водой, и получается фосфорная кислота Н3Р04:
Р205 + ЗН20 = 2Н3Р04
Сожжем в банке, в которую налито немного воды, серу и получившийся раствор исследуем раствором лакмуса. Он тоже окрасится в красный цвет. Оксид серы (IV) S02, образовавшийся при сгорании серы, соединился с водой, и получилась сернистая кислота:
S02 + h30 = h3S02
Оксид серы (VI), взаимодействуя с водой, образует серную кислоту h3S04:
SO 2 + Н2О = h3S04
Азот может образовать оксид N205, при взаимодействии которого с водой образуется азотная кислота:
N205 + Н20 = 2HN03
Соединения оксидов неметаллов с водой относят к кислотам.
Взаимодействие воды с оксидами металлов.
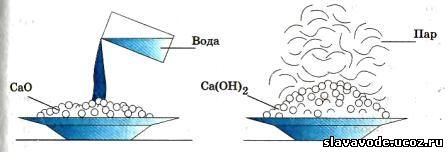 Рассмотрим теперь отношение к воде оксидов металлов. Насыплем в стаканчики оксид меди СиО, оксид железа Fe203, оксид цинка ZnO и оксид кальция СаО и прильем в каждый немного воды. Оксиды меди, железа и цинка в воде не растворяются и не соединяются с ней. Иначе ведет себя оксид кальция, или негашеная известь.
Рассмотрим теперь отношение к воде оксидов металлов. Насыплем в стаканчики оксид меди СиО, оксид железа Fe203, оксид цинка ZnO и оксид кальция СаО и прильем в каждый немного воды. Оксиды меди, железа и цинка в воде не растворяются и не соединяются с ней. Иначе ведет себя оксид кальция, или негашеная известь.
При обливании кусков негашеной извести водой наблюдается такое сильное разогревание, что часть воды превращается в пар, а куски негашеной извести, рассыпаясь, превращаются в сухой рыхлый порошок — гашеную известь, или гидроксид кальция Ca(OH)2 :
СаО + Н20 = Са(ОН)2
Подобно оксиду кальция, соединяются с водой оксиды натрия и калия:
Na20 + h30 = 2NaOH
К20+Н20 = 2КОН
При этих реакциях образуются гидроксид натрия NaOH и гидроксид калия КОН.
Таким образом, одни оксиды металлов не реагируют с водой (их большинство) другие (оксид калия, оксид натрия, оксид кальция, оксид бария и др.) соединяются с ней, образуя гидроксиды, которые относятся к основаниям.
(Неорганическая химия 7-8 класс автор Ю. В. Ходаков и др.)
slavavode.ucoz.ru
| . |
* * * | . |

 Вопрос:Много ли воды на Земле?Однозначно ответить трудно. И много и мало одновременно.Много – это океаны, ледники, реки и т.д.А почему мало?
Вопрос:Много ли воды на Земле?Однозначно ответить трудно. И много и мало одновременно.Много – это океаны, ледники, реки и т.д.А почему мало? 

 Применение углекислого газа: 1. В тушении пожаров.2. При производстве газированных напитков.3. Способность к возгонке: Углекислый газ охлажденный ниже температуры плавления называют «сухой лед» и применяют для хранении продуктов.
Применение углекислого газа: 1. В тушении пожаров.2. При производстве газированных напитков.3. Способность к возгонке: Углекислый газ охлажденный ниже температуры плавления называют «сухой лед» и применяют для хранении продуктов. 




















