Реакция гидролиза: уравнения, продукт гидролиза. Гидролиз воды
Реакция гидролиза: уравнения, продукт гидролиза
Химия, как и большинство точных наук, требующих много внимания и твердых знаний, никогда не была любимой дисциплиной школьников. А зря, ведь с ее помощью можно понять множество процессов, происходящих вокруг и внутри человека. Взять, к примеру, реакцию гидролиза: на первый взгляд кажется, что она имеет значение только для ученых-химиков, но на самом деле без нее ни один организм не мог бы полноценно функционировать. Давайте узнаем об особенностях данного процесса, а также о его практическом значении для человечества.
Реакция гидролиза: что это такое?
Данным словосочетанием называется специфическая реакция обменного разложения между водой и растворяемым в ней веществом с образованием новых соединений. Гидролиз также можно назвать сольволизом в воде. 
Данный химический термин образован от 2 греческих слов: «вода» и «разложение».
Продукты гидролиза
Рассматриваемая реакция может происходить при взаимодействии Н2О как с органическими, так и неорганическими веществами. Ее результат напрямую зависит от того, с чем контактировала вода, а также использовались ли при этом дополнительные вещества-катализаторы, изменялись ли температура и давление.
К примеру, реакция гидролиза соли способствует образованию кислот и щелочей. А если речь идет об органических веществах, получаются другие продукты. Водный сольволиз жиров способствует возникновению глицерина и высших жирных кислот. Если процесс происходит с белками, в результате образовывается различные аминокислоты. Углеводы (полисахариды) разлагаются на моносахариды.
В теле человека, неспособном полноценно усваивать белки и углеводы, реакция гидролиза «упрощает» их до веществ, которые организм в состоянии переварить. Так что сольволиз в воде играет важную роль в нормальном функционировании каждой биологической особи.
Гидролиз солей
Узнав, что такое реакция гидролиза, стоит ознакомиться с ее протеканием в веществах неорганического происхождения, а именно солях.
Особенностями данного процесса является то, что при взаимодействии этих соединений с водой ионы слабого электролита в составе соли отсоединяются от нее и образуют с Н2О новые вещества. Это может быль либо кислота, либо слабое основание, либо и то, и другое. Вследствие всего этого происходит смещение равновесия диссоциации воды.
Обратимый и необратимый гидролиз
В приведенном выше примере в последнем уравнении гидролиза можно заметить вместо одной стрелки две, причем обе направлены в разные стороны. Что это значит? Данный знак сигнализирует о том, что реакция гидролиза имеет обратимый характер. На практике это означает, что, взаимодействуя с водой, взятое вещество одновременно не только разлагается на составляющие (которые позволяют возникать новым соединениям), но и образовывается вновь. 
Однако не всякий гидролиз имеет обратимый характер, иначе бы он не имел смысла, так как новые вещества были бы нестабильны.
Существует ряд факторов, которые могут способствовать тому, чтобы подобная реакция стала необратимой:
- Температура. От того, повышается она или понижается, зависит то, в какую сторону смещается равновесие в происходящей реакции. Если она становится выше, происходит смещение к эндотермической реакции. Если же наоборот, температура понижается, преимущество оказывается на стороне экзотермической реакции.
- Давление. Это еще одна термодинамическая величина, активно влияющая на ионный гидролиз. Если оно повышается, химическое равновесие оказывается смещено в сторону реакции, которую сопровождает уменьшение общего количества газов. Если понижается, наоборот.
- Высокая или низкая концентрация веществ, участвующих в реакции, а также наличие дополнительных катализаторов.
Виды реакций гидролиза в солевых растворах
- По аниону (ион с отрицательным зарядом). Сольволиз в воде солей кислот слабых и сильных оснований. Такая реакция из-за свойств взаимодействующих веществ имеет обратимый характер.
- По катиону (ион с положительным зарядом). Гидролиз соли кислоты сильной и основания слабого. Она также обратима.
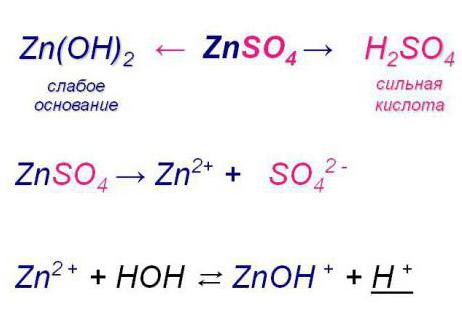
- Реакция соли слабой кислоты и слабого основания. Такой процесс можно считать практически необратимым, поскольку все новообразованные вещества покидают так называемую зону реакции, выпадая в осадок или превращаясь в газ.
- В случае если и основание, и соль кислоты – сильные, в таком растворе не происходит водный сольволиз.
Степень гидролиза
Изучая особенности гидролиза в солях, стоит обратить внимание на такое явление, как его степень. По этим словом подразумевается соотношение солей (которые уже вступили в реакцию разложения с Н2О) к общему количеству содержащегося данного вещества в растворе.
Чем слабее кислоты или основания, участвующее в гидролизе, тем выше его степень. Она измеряется в пределах 0-100 % и определяется по формуле, представленной ниже.
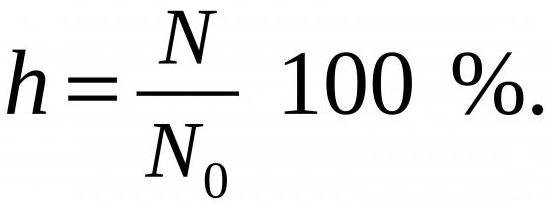
N – число молекул вещества, прошедших гидролиз, а N0 - общее их количество в растворе.
В большинстве случаев степень водного сольволиза в солях невелика. К примеру, в растворе ацетата натрия 1%-м она составляет всего 0,01 % (при температуре в 20 градусов).
Гидролиз в веществах органического происхождения
Изучаемый процесс может происходить и в органических химических соединениях.
Практически во всех живых организмах происходит гидролиз как часть энергетического обмена (катаболизма). С его помощью расщепляются белки, жиры и углеводы на легко усвояемые вещества. При этом часто сама вода редко оказывается в состоянии запустить процесс сольволиза, поэтому организмам приходится использовать различные ферменты в качестве катализаторов.
Если же речь идет о химической реакции с органическими веществами, направленной на получение новых веществ в условиях лаборатории или производства, то для ускорения и улучшения его в раствор добавляют сильные кислоты или щелочи.
Гидролиз в триглицеридах (триацилглицеринах)
Этим сложно произносимым термином именуются жирные кислоты, которые большинству из нас известны как жиры.
Они бывают как животного, так и растительного происхождения. Однако всем известно, что вода не способна растворять подобные вещества, как же происходит гидролиз жиров?
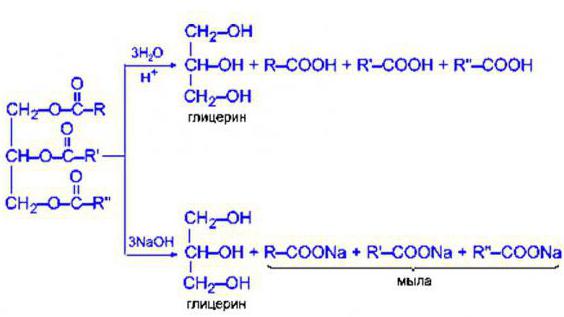 Рассматриваемая реакция именуется омылением жиров. Это водный сольволиз триацилглицеринов под влиянием ферментов в щелочной или кислотной среде. В зависимости от нее, выделяется щелочной гидролиз и кислотный.
Рассматриваемая реакция именуется омылением жиров. Это водный сольволиз триацилглицеринов под влиянием ферментов в щелочной или кислотной среде. В зависимости от нее, выделяется щелочной гидролиз и кислотный.
В первом случае в результате реакции образуются соли высших жирных кислот (более известные всем как мыла). Таким образом, из NaOH получается обычное твердое мыло, а из КОН – жидкое. Так что щелочной гидролиз в триглицеридах – это процесс образования моющих средств. Стоит отметить, что его можно свободно проводить в жирах как растительного, так и животного происхождения.

Рассматриваемая реакция является причиной того, что мыло довольно плохо стирает в жесткой воде и вообще не мылится в соленой. Дело в том, что жесткой называется Н2О, в которой содержится в избытке ионов кальция и магния. А мыло, попав в воду, вновь подвергается гидролизу, распадаясь на ионы натрия и углеводородный остаток. В результате взаимодействия этих веществ в воде образуются нерастворимые соли, которые и выглядят как белые хлопья. Чтобы этого не произошло, в воду добавляется гидрокарбонат натрия NaHCO3, более известный как пищевая сода. Это вещество увеличивает щелочность раствора и тем самым помогает мылу выполнять свои функции. Кстати, чтобы избежать подобных неприятностей, в современной промышленности изготавливают синтетические моющие средства из других веществ, например из солей сложных эфиров высших спиртов и серной кислоты. В их молекулах содержится от двенадцати до четырнадцати углеродных атомов, благодаря чему они не теряют своих свойств в соленой или жесткой воде.
Если среда, в которой происходит реакция, кислая, такой процесс называется кислотным гидролизом триацилглицеринов. В данном случае под действием определенной кислоты вещества эволюционируют до глицерина и карбоновых кислот.
Гидролиз жиров имеет еще один вариант - это гидрогенизация триацилглицеринов. Данный процесс используется в некоторых видах очистки, например при удалении следов ацетилена из этилена или кислородных примесей из различных систем.
Гидролиз углеводов
Рассматриваемые вещества являются одними из наиболее важных составляющих пищи человека и животных. Однако сахароза, лактоза, мальтоза, крахмал и гликоген в чистом виде организм не способен усвоить. Поэтому, так же как и в случае с жирами, эти углеводы расщепляются на усвояемые элементы с помощью реакции гидролиза.
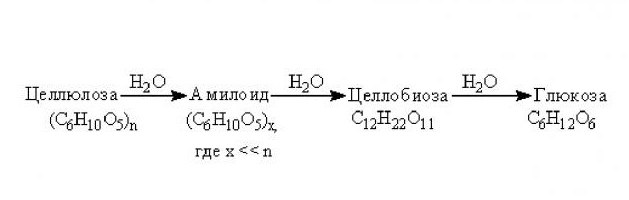
Также водный сольволиз углеродов активно применяется и в промышленности. Из крахмала, вследствие рассматриваемой реакции с Н2О, добывают глюкозу и патоку, которые входят в состав практически всех сладостей.

Еще один полисахарид, который активно используется в промышленности для изготовления многих полезных веществ и продуктов, – это целлюлоза. Из нее добывают технический глицерин, этиленгликоль, дрожжи кормовые, сорбит и хорошо известный всем этиловый спирт.
Гидролиз целлюлозы происходит при длительном воздействии высокой температуры и наличии минеральных кислот. Конечным продуктом этой реакции является, как и в случае с крахмалом, глюкоза. При этом стоит учитывать, что гидролиз целлюлозы проходит более сложно чем, у крахмала, поскольку этот полисахарид устойчивее к воздействию минеральных кислот. Однако поскольку целлюлоза является главной составляющей клеточных оболочек всех высших растений, сырье, ее содержащее, обходится дешевле, чем для крахмала. При этом целлюлозную глюкозу более используют для технических нужд, в то время как продукт гидролиза крахмала считается лучше пригодным для питания.
Гидролиз белков
Белки - это основной строительный материал для клеток всех живых организмов. Они состоят из многочисленных аминокислот и являются весьма важным продуктом для нормального функционирования организма. Однако являясь высокомолекулярными соединения, они могут плохо усваиваться. Чтобы упростить данную задачу, происходит их гидролиз.
Как и в случае с другими органическими веществами, данная реакция разрушает белки до низкомолекулярных продуктов, легко усваиваемых организмом.
fb.ru
15. Гидролиз
Особое место среди обменных реакций занимает гидролиз. В общем случае гидролиз – это разложение веществ водой. Вода – одно из самых активных веществ. Она действует на самые различные классы соединений: соли, углеводы, белки, эфиры, жиры и т. д. При гидролизе соединений неметаллов обычно образуются две кислоты, например:
PCl3 + 3 h3O = h4PO3 + 3 HCl
При этом изменяется кислотность растворов по сравнению с кислотностью растворителя.
В неорганической химии чаще всего приходится иметь дело с гидролизом солей, т.е. с обменным взаимодействием ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды.
Гидролизом соли называется обратимое взаимодействие ионов соли с ионами воды, приводящее к изменению равновесия между ионами водорода и гидроксида в растворе.
Гидролиз является результатом поляризационного взаимодействия ионов соли с их гидратной оболочкой в водном растворе. Чем значительнее это взаимодействие, тем интенсивнее протекает гидролиз. Упрощенно сущность процесса гидролиза можно представить следующим образом.
Катионы Кn+ связываются в растворе с гидратирующими их молекулами воды донорно-акцепторной связью; донором являются атомы кислорода молекулы воды, имеющие две неподеленные электронные пары, акцептором - катионы, имеющие свободные атомные орбитали. Чем больше заряд катиона и чем меньше его размер, тем значительнее поляризующее действие Кn+ на Н2O.
Анионы Аn‾ связываются с молекулами воды водородной связью. Сильное воздействие анионов может привести к полному отрыву протона от молекулы Н2O – водородная связь становится ковалентной. В результате образуется кислота или анион типа HS‾, НСО3‾ и т. п.
Взаимодействие анионов An‾ с протонами тем значительнее, чем больше заряд аниона и меньше его радиус. Таким образом, интенсивность взаимодействия вещества с водой определяется силой поляризующего влияния Кn+ и Аn‾ на молекулы Н2O. Так, катионы элементов побочных подгрупп и непосредственно следующих за ними элементов подвергаются более интенсивному гидролизу, чем другие ионы одинаковых с ними заряда и радиуса, так как ядра первых менее эффективно экранируются d-электронами.
Гидролиз – процесс обратный реакции нейтрализации. Если реакция нейтрализации процесс экзотермический и необратимый, то гидролиз – процесс эндотермический и обратимый.
Реакция нейтрализации:
2 KOH + h3SO3 → K2SO3 + 2 h3O
сильный слабый сильный слабый
2 OH‾ + h3SO3= SO32- + 2 h3O
Реакция гидролиза:
K2SO3+ h3O ↔ KOH + KHSO3
SO32- + HOH ↔ HSO3‾ + OH‾
При гидролизе смещается равновесие диссоциации воды вследствие связывания одного из ее ионов (Н+ или ОН-) в слабый электролит соли. При связывании ионов Н+ в растворе накапливаются ионы ОН−, реакция среды будет щелочная, а при связывании ионов ОН− накапливаются ионы Н+ - среда будет кислая.
Различают четыре варианта действия воды на соли.
1. Если катионы и анионы имеют небольшие заряды и большие размеры, то их поляризующее влияние на молекулы воды невелико, т. е. взаимодействие соли с h3O практически не происходит. Это относится к катионам, гидроксиды которых являются щелочами (например, K+ и Са2+) и к анионам сильных кислот (например, Сl‾ и NО3‾). Следовательно, соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются. В этом случае равновесие диссоциации воды
h3O ↔ H+ + OH‾
в присутствии ионов соли практически не нарушается. Поэтому растворы таких солей нейтральны (pH ≈ 7).
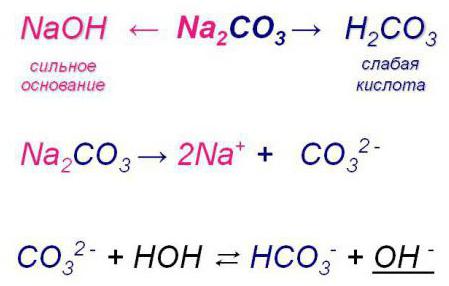
2. Если соль образована катионом сильного основания и анионом слабой кислоты (S2-, CO32-, CN‾ и др.), то происходит гидролиз по аниону. Пример – гидролиз соли СН3СООК. Ионы соли СН3СОО− и К+ взаимодействуют с ионами Н+ и ОН− из воды. При этом ацетат-ионы (СН3СОО−) связываются с ионами водорода (Н+) в молекулы слабого электролита - уксусной кислоты (Ch4COOH), а ионы ОН− накапливаются в растворе, сообщая ему щелочную реакцию, так как ионы К+ не могут связать ионы ОН− (КОН является сильным электролитом), pH > 7.
Молекулярное уравнение гидролиза:
СН3СООК + h3O ↔ КОН + СН3ООН
Полное ионное уравнение гидролиза:
К+ + СН3СОО− + НОН ↔ K+ + ОН− + СН3СООН
сокращенное ионное уравнение гидролиза:
СН3СОО− + НОН ↔ ОН− + СН3СООН
Гидролиз соли Na2S протекает ступенчато. Соль образована сильным основанием (NaOH) и слабой двухосновной кислотой (h3S). В этом случае анион соли S2− связывает ионы Н+ воды, в растворе накапливаются ионы ОН−. Уравнение в сокращенной ионной и молекулярной форме имеет вид:
I. S2− + НОН ↔ HS− + ОН−
Na2S + Н2О ↔ NaHS + NaOH
II. HS−+ НОН ↔ h3S + ОН−
NaHS + Н2О ↔ NaOH + h3S
Вторая ступень гидролиза практически не проходит при обычных условиях, так как, накапливаясь, ионы ОН− сообщают раствору сильнощелочную реакцию, что приводит к реакции нейтрализации, сдвигу равновесия влево в соответствии с принципом Ле Шателье. Поэтому гидролиз солей, образованных сильным основанием и слабой кислотой, подавляется прибавлением щелочи.
Чем больше поляризующее влияние анионов, тем интенсивнее гидролиз. В соответствии с законом действия масс это означает, что гидролиз протекает тем интенсивнее, чем слабее кислота.
3. Если соль образована катионом слабого основания и анионом сильной кислоты, то происходит гидролиз по катиону. Например, это имеет место при гидролизе соли Nh5Cl (Nh5ОH - слабое основание, НСl - сильная кислота). Отбросим ион Сl−, так как он с катионом воды дает сильный электролит, тогда уравнение гидролиза примет следующий вид:
Nh5+ + НОН ↔ Nh5OH + Н+ (сокращенное ионное уравнение)
Nh5Cl + Н2О ↔ Nh5OH + НСl (молекулярное уравнение)
Из сокращенного уравнения видно, что ионы ОН− воды связываются в слабый электролит, ионы Н+ накапливаются в растворе и cреда становится кислой (pH < 7). Добавление кислоты к раствору (введение продукта реакции катионов H+) сдвигает равновесие влево.
Гидролиз соли, образованной многокислотным основанием (например, Zn(NO3)2) протекает ступенчато по катиону слабого основания.
I. Zn2+ + НОН ↔ ZnOH+ + H+ (сокращенное ионное уравнение)
Zn(NO3)2 + Н2О ↔ ZnOHNO3 + HNO3 (молекулярное уравнение)
Ионы ОН− связываются в слабое основание ZnOH+, ионы Н+ накапливаются.
Вторая ступень гидролиза практически не происходит при обычных условиях, так как в результате накопления ионов H+ в растворе создается сильнокислая среда и равновесие реакции гидролиза по 2-ой ступени смещено влево:
II. ZnOH+ + НОН ↔ Zn(OH)2 + H+ (сокращенное ионное уравнение)
ZnOHNO3 + Н2О ↔ Zn(OH)2 + HNO3 (молекулярное уравнение)
Очевидно, чем слабее основание, тем полнее идет гидролиз.
4. Соль, образованная катионом слабого основания и анионом слабой кислоты, подвергается гидролизу по катиону и по аниону. Примером служит процесс гидролиза соли СН3СООNh5. Запишем уравнение в ионной форме:
Nh5+ + Ch4COO− + НОН ↔ Nh5OH + СН3СООН
Гидролиз таких солей протекает очень сильно, поскольку в результате его образуются и слабое основание, и слабая кислота.
Реакция среды в этом случае зависит от сравнительной силы основания и кислоты, т.е. от их констант диссоциации (KД):
В случае гидролиза Ch4COONh5:
KД (Nh5OH) = 1,8·10-5; KД (Ch4COOH)=1,8·10-5,
поэтому реакция водного раствора этой соли будет почти нейтральной (pH ≈ 7).
Если основание и кислота, образующие соль, являются не только слабыми электролитами, но и малорастворимы или неустойчивы и разлагаются с образованием летучих продуктов, то в этом случае гидролиз соли протекает по всем ступеням до конца, т.е. до образования слабого труднорастворимого основания и слабой кислоты. В этом случае речь идет о необратимом или полном гидролизе.
Именно полный гидролиз является причиной того, что водные растворы некоторых солей приготовить нельзя, например Сr2(CO3)3, Al2S3 и др. Например:
Al2S3 + 6h3O → 2Al(OH)3↓ + 3h3S↑
Поэтому сульфид алюминия не может существовать в виде водных растворов, может быть получен только "сухим способом", например, из элементов при высокой температуре:
2Al + 3S –t°→ Al2S3,
и должен храниться в герметических сосудах, исключающих попадание влаги.
Реакцией обмена в водном растворе такие соединения нельзя получить. При взаимодействии солей А13+, Сr3+ и Fe3+ в растворе с сульфидами и карбонатами в осадок выпадают не сульфиды и карбонаты этих катионов, а их гидроксиды:
2AlCl3 +3Na2S +6Н2О → 3Н2S↑ + 2Аl(ОН)3↓ +6NaCl
2CrCl3 + 3Na2CO3 + 3h3O → 2Сr(ОН)3↓ + 3СO2↑ + 6NaCl
В рассмотренных примерах происходит взаимное усиление гидролиза двух солей (АlСl3 и Na2S или СrСl3 и Nа2СО3) и реакция идет до конца, так как продукты реакции выделяются из раствора в виде осадка и газа.
Гидролиз солей в ряде случаев может протекать очень сложно. (Простые уравнения реакции гидролиза в общепринятой записи часто являются условными.) Продукты гидролиза можно установить лишь на основании аналитического исследования. К примеру, продуктами гидролиза солей, содержащих многозарядные катионы, могут быть полиядерные комплексы. Так, если в раствоpax Hg2+ содержатся только одноядерные комплексы, то в растворах Fe3+ помимо комплексов [FeOH]2+ и [Fe(OH)2]+ обнаруживается двухъядерный комплекс [Fe2(OH)2]4+; в растворах Ве2+ в основном образуются многоядерные комплексы состава [Ве3(OH)3]3+; в растворах Sn2+ образуются комплексные ионы [Sn3(OH)4]2+, [Sn2(OH)2]2+, [SnOH]+; в растворах Bi3+ наряду с [ВiOН]2+ находятся комплексные ионы состава [Bi6(OH)12]6+. Реакции гидролиза, приводящие к образованию полиядерных комплексов, можно представить следующим образом:
mMk+ + nh3О ↔ Мm(OН)n(mk - n)+ + nН+,
где m изменяется от 1 до 9, а n может принимать значения от 1 до 15. Такого рода реакции возможны для катионов более чем 30 элементов. Установлено, что каждому заряду иона в большинстве случаев отвечает определенная форма комплекса. Так, для ионов М2+ характерна форма димеров [M2(OH)]3+, для ионов М3+ – [M2(OH)2]4+, а для М4+ – форма [M2(OH)3]5+ и более сложные, например [Zr4(OH)8]8+ .
При высоких температурах и больших значениях рН образуются и оксокомплексы:
2MOH ↔ MOM + h3O или
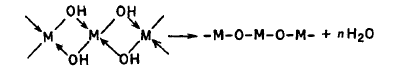
Например,
BiCl3 + h3O « Bi(OH)2Cl + 2HCl
Катион Bi(OH)2+ легко теряет молекулу воды, образуя катион висмутила ВiO+, который с хлорид-ионом дает белый кристаллический осадок:
Bi(OH)2Cl ®BiOCl↓ + h3O.
Структурно полиядерные комплексы можно представить в виде октаэдров, соединенных между собой по вершине, ребру или грани посредством различных мостиков (О, ОН и др.).
Сложный состав имеют продукты гидролиза карбонатов ряда металлов. Так, при взаимодействии растворимых солей Mg2+, Cu2+, Zn2+, Рb2+ с карбонатом натрия образуются не средние карбонаты, а менее растворимые гидроксокарбонаты, например Сu2(ОН)2СО3, Zn5(ОН)6(СО3)2, Рb3(ОН)2(СО3)2. В качестве примера можно привести реакции:
5MgSO4 + 5Na2CO3 + Н2O → Мg5(ОН)2(СО3)4↓ + 5Na2SO4 + СO2↑
2Cu(NO3)2 + 2Na2CO3 + h3O → Cu2(OH)2CO3↓ + 4NaNO3 + CO2↑
Количественно гидролиз характеризуется степенью гидролиза h и константой гидролиза КГ.
Степень гидролиза показывает, какая часть соли, содержащаяся в растворе (СМ), подверглась гидролизу (СМгид) и рассчитывается как отношение:
h = СМгид / СМ (100%).
Очевидно, что для обратимого процесса гидролиза h < 1 (<100%), а для необратимого гидролиза h = 1 (100%). Кроме природы соли, степень гидролиза зависит от концентрации соли и температуры раствора.
В растворах с умеренной концентрацией растворенного вещества степень гидролиза при комнатной температуре обычно невелика. Для солей, образованных сильным основанием и сильной кислотой, она практически равна нулю; для солей, образованных слабым основанием и сильной кислотой или сильным основанием и слабой кислотой, она составляет ≈ 1%. Так, для 0,01 М раствора Nh5Cl h = 0,01%; для 0,1 н. раствора Ch4COONh5h ≈ 0,5%.
Гидролиз – процесс обратимый, поэтому к нему применим закон действующих масс.
Константа гидролиза есть константа равновесия процесса гидролиза, и по своему физическому смыслу определяет степень необратимости гидролиза. Чем больше КГ, тем необратимее гидролиз. КГ имеет свое выражение для каждого случая гидролиза.
Выведем выражение для константы гидролиза соли слабой кислоты и сильного основания на примере NaCN:
NaCN + h3O ↔ NaOH + HCN;
Na+ + CN– +h3O ↔ Na+ + OH– + HCN;
CN– + h3O ↔ HCN + OH–
Кравн = [HCN][OH–] / [CN–][h3O].
[h3O] имеет наибольшую величину, которая в ходе реакции практически не изменяется, поэтому ее можно условно считать постоянной. Тогда помножив числитель и знаменатель на концентрацию протонов и введя постоянную концентрацию воды в константу, получим:
Кравн [h3O] = KW / КД(кисл) = KГ
так как [HCN] / [H+][CN–] = 1/ КД(кисл)
Поскольку KW величина постоянная и равна 10-14 , очевидно, что чем меньше КД слабой кислоты, анион которой входит в состав соли, тем больше KГ.
Аналогично, для соли, гидролизующейся по катиону (например Nh5Cl), получим:
Nh5+ + h3O ↔ Nh5OH + H+ (сокращенное уравнение гидролиза)
Кравн = [Nh5OH][H+] / [Nh5+][h3O]
KГ = Кравн [h3O] = KW / КД(осн)
В этом выражении числитель и знаменатель дроби умножили на [OH–]. Очевидно, что чем меньше КД слабого основания, катион которого входит в состав соли, тем больше KГ.
Если соль образована слабым основанием и слабой кислотой (на примере Nh5CN), то сокращенное уравнение гидролиза имеет вид:
Nh5+ + CN–+ h3O ↔ Nh5OH + HCN
Кравн= [Nh5OH][HCN] / [Nh5+][CN–],
В этом выражении для Кравн числитель и знаменатель дроби умножаем на [H+]·[OH–], поэтому выражение для KГ принимает вид:
KГ = KW / (КД(кислоты) КД(осн)).
Как следует из приведенных выражений, константа гидролиза обратно пропорциональна константе диссоциации слабого электролита, участвующего в образовании соли (если в образовании соли участвуют два слабых электролита, то KГ обратно пропорциональна произведению их констант диссоциации).
Рассмотрим гидролиз многозарядного иона. Возьмем Na2CO3.
I. CO32- + h3O « HCO3– + OH–
KГ(I) = [HCO3–][OH–] / [CO32-][h3O] × ([H+] / [H+]) = KW / КД(II),
то есть в выражение для константы гидролиза по первой ступени в знаменатель входит вторая константа диссоциации, и для второй ступени гидролиза
HCO3– + h3O « h3CO3+ OH–
KГ(II) = [h3CO3][OH–] / [HCO3–][h3O] × ([H+] / [H+]) = KW / КД(I)
KД(I) = 4×10-7 KД(II) = 2.5×10-8
KГ(II) = 5.6×10-11 KГ(I) = 1.8×10-4
Таким образом, KГ(I) >> KГ(II), константа, а следовательно, и степень первой стадии гидролиза много больше последующих.
Степень гидролиза является величиной аналогичной степени диссоциации. Взаимосвязь степени и константы гидролиза аналогична таковой для степени и константы диссоциации.
Если в общем случае исходную концентрацию аниона слабой кислоты обозначить через Со (моль/л), то Соh (моль/л) – концентрация той части аниона A–, которая подверглась гидролизу и образовалось Соh (моль/л) слабой кислоты HA и Соh (моль/л) гидроксидных групп.
A– + h3O ↔ HA + OH–,
Со-Соh Соh Соh
тогда KГ = [HA][OH–] / [A–] = Соh·Соh / (Со-Соh) = Соh3 / (1-h).
П риh << 1 KГ = Соh3h = √КД / Со.
риh << 1 KГ = Соh3h = √КД / Со.
Очень похоже на закон разбавления Оствальда.
Можно рассчитать pH раствора, если известны Со и h. Учитывая, что
[HA] = [OH–] = Соh, получим:
K Г = Соh·Соh / Со = [OH–]2/ Со, откуда
Г = Соh·Соh / Со = [OH–]2/ Со, откуда
[OH–] = √КГ·Со.
Аналогично, можно показать, что при гидролизе по катиону
[ H+] = √КГ·Со.
H+] = √КГ·Со.
Таким образом, способность солей подвергаться гидролизу зависит от двух факторов:
свойств ионов, образующих соль;
внешних факторов.
Как сдвинуть равновесие гидролиза?
1) Добавление одноименных ионов. Поскольку при обратимом гидролизе устанавливается динамическое равновесие, то в соответствии с законом действия масс равновесие можно сместить в ту или иную сторону введением в раствор кислоты или основания. Введение кислоты (катионов Н+) подавляет гидролиз по катиону, добавление щелочи (анионов OH–) подавляет гидролиз по аниону. Этим часто пользуются для усиления или подавления процесса гидролиза.
2) Из формулы для h видно, что разбавление способствует гидролизу. Рост степени гидролиза карбоната натрия
Na2CO3 + НОН ↔ NaHCO3 + NaOH
при разбавлении раствора иллюстрирует рис. 20.
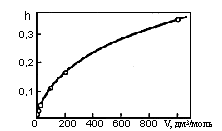
Рис. 20. Зависимость степени гидролиза Na2CO3 от разбавления при 20°С
3) Повышение температуры способствует гидролизу. Константа диссоциации воды увеличивается при повышении температуры в большей степени, чем константы диссоциации продуктов гидролиза - слабых кислот и оснований, поэтому при нагревании степень гидролиза возрастает. К этому выводу легко прийти и иначе: так как реакция нейтрализации экзотермична (DH= –56 кДж/моль), то гидролиз, будучи противоположным ей процессом, эндотермичен, поэтому в соответствии с принципом Ле Шателье нагревание вызывает усиление гидролиза. Рис. 21 иллюстрирует влияние температуры на гидролиз хлорида хрома (III)
СrСl3 + НОН ↔ CrOHCl2 + НСl
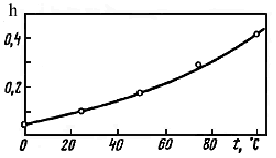
Рис. 21. Зависимость степени гидролиза СrСl3 от температуры
В химической практике весьма распространен гидролиз по катиону солей, образованных многозарядным катионом и однозарядным анионом, например АlС13. В растворах этих солей менее диссоциированное соединение образуется в результате присоединения одного гидроксид-иона к иону металла. Учитывая, что ион Аl3+ в растворе гидратирован, первую стадию гидролиза можно выразить уравнением
[Al(h3O)6]3+ + HOH ↔ [Al(h3O)5OH]2+ + h4O+
При обычной температуре гидролиз солей многозарядных катионов практически ограничивается этой стадией. При нагревании происходит гидролиз по второй ступени:
[Al(h3O)5OH]2+ + HOH ↔ [Al(h3O)4(OH)2]+ + h4O+
Таким образом, кислая реакция водного раствора соли объясняется тем, что гидратированный катион теряет протон и аквагруппа Н2O превращается в гидроксогруппу ОН‾. В рассмотренном процессе могут образоваться и более сложные комплексы, например [Al6(OH)15]3+, а также комплексные ионы вида [AlO(OH)4]3- и [АlO2(ОН)2]3-. Содержание различных продуктов гидролиза зависит от условий проведения реакции (концентрация раствора, температура, присутствие других веществ). Имеет значение также длительность протекания процесса, так как равновесие при гидролизе солей многозарядных катионов обычно достигается медленно.
studfiles.net
Гидролиз солей. Какие соли подвергаются гидролизу :: SYL.ru
Процесс образования слабодиссоциированных соединений с изменением водородного показателя среды при взаимодействии воды и соли называется гидролизом.
Гидролиз солей происходит в случае связывания одного иона воды с образованием труднорастворимых или слабодиссоциированных соединений за счет смещения равновесия диссоциации. По большей части этот процесс является обратимым и при разбавлении или увеличении температуры усиливается.
Чтобы узнать, какие соли подвергаются гидролизу, необходимо знать, какие по силе при ее образовании использовались основания и кислоты. Существует несколько видов их взаимодействий.
Получение соли из основания и кислоты слабой силы
Примерами могут служить сульфид алюминия и хрома, а также аммоний ускуснокислый и карбонат аммония. Данные соли при растворении в воде образуют основания и слабодиссоциирующие кислоты. Чтобы проследить обратимость процесса, необходимо составить уравнение реакции гидролиза солей:
Аммоний уксуснокислый + вода ↔ аммиак + уксусная кислота
В ионном виде процесс выглядит как:
Ch4COO- + Nh5+ + Н2О ↔ Ch4COOH + Nh5OH.
В вышеприведенной реакции гидролизации образуются аммиак и уксусная кислота, то есть слабодиссоциирующие вещества.
Водородный показатель водных растворов (рН) напрямую зависит от относительной силы, то есть констант диссоциации продуктов реакции. Приведенная выше реакция будет слабощелочной, так как постоянная распада уксусной кислоты меньше константы гидроокиси аммония, то есть 1,75 ∙ 10-5 меньше, чем 6,3 ∙ 10-5. Если основания и кислоты удаляются из раствора, тогда процесс происходит до конца.
Рассмотрим пример необратимого гидролиза:
Сульфат алюминия + вода = гидроокись алюминия + сероводород
В этом случае процесс необратим, потому как один из продуктов реакции удаляется, то есть выпадает в осадок.

Гидролиз соединений, полученных взаимодествием слабого основания с сильной кислотой
Этот тип гидролиза описывают реакции разложения сульфата алюминия, хлорида или бромида меди, а также хлорида железа или аммония. Рассмотрим реакцию хлорида железа, которая протекает в две стадии:
Стадия первая:
Хлорид железа + вода ↔ гидроксохлорид железа + соляная кислота
Ионное уравнение гидролиза солей хлорида железа принимает вид:
Fe2+ + Н2О + 2Cl- ↔ Fe(OH)+ + Н+ + 2Cl-
Вторая стадия гидролиза:
Fe(OH)+ + Н2О + Cl- ↔ Fe(OH)2 + Н+ + Cl-
По причине дефицита ионов гидроксогруппы и накапливания ионов водорода гидролиз FeCl2 протекает по первой стадии. Образуется сильная соляная кислота и слабое основание – гидрокись железа. В случае подобных реакций среда получается кислой.
Негидролизующиеся соли, полученные путем взаимодействия сильных оснований и кислот
Примером таких солей могут быть хлориды кальция или натрия, сульфат калия и бромид рубидия. Однако приведенные вещества не гидролизуются, так как при растворении в воде имеют нейтральную среду. Единственным малодиссоциирующим веществом в этом случае является вода. Для подтверждения этого утверждения можно составить уравнение гидролиза солей хлорида натрия с образованием кислоты соляной и гидроокиси натрия:
NaCl + Н2О ↔ NaOH + HCl
Реакция в ионном виде:
Na+ + Cl- + Н2О↔ Na+ + ОН- + Н+ + Cl-
Н2О ↔ Н+ + ОН-
Соли как продукт реакции сильной щелочи и кислоты слабой силы
В данном случае гидролиз солей протекает по аниону, что соответствует щелочной среде водородного показателя. В качестве примеров можно назвать ацетат, сульфат и карбонат натрия, силикат и сульфат калия, а также натриевую соль синильной кислоты. Например, составим ионно-молекулярные уравнения гидролиза солей сульфида и ацетата натрия:
Диссоциация сульфида натрия:
Na2S ↔ 2Na+ + S2-
Первая стадия гидролиза многоосновной соли, происходит по катиону:
Na2S + Н2О ↔ NaHS + NaOH
Запись в ионном виде:
S2- + Н2О ↔ HS- + ОН-
Вторая ступень осуществима в случае повышения температуры реакции:
HS- + Н2О ↔ h3S + ОН-
Рассмотрим еще одну реакцию гидролиза на примере натрия уксуснокислого:
Натрий уксуснокислый + вода ↔ уксусная кислота + едкий натр.
В ионном виде:
Ch4COO- + Н2О ↔ Ch4COOH + ОН-
В результате реакции образуется слабая уксусная кислота. В обоих случаях реакции будут иметь щелочную среду.

Равновесие реакции по принципу Ле-Шателье
Гидролиз, как и остальные химические реакции, бывает обратимым и необратимым. В случае обратимых реакций один из реагентов расходуется не весь, в то время как необратимые процессы протекают с полным расходом вещества. Это связано со смещением равновесия реакций, которое основано на изменении физических характеристик, таких как давление, температура и массовая доля реагентов.
Согласно понятию принципа Ле-Шателье, система будет считаться равновесной до тех пор, пока на нее не будет изменено одно или несколько внешних условий протекания процесса. К примеру, при уменьшении концентрации одного из веществ равновесие системы постепенно начнет смещаться в сторону образования этого же реагента. Гидролиз солей также имеет способность подчиняться принципу Ле-Шателье, с помощью которого можно ослабить или усилить протекание процесса.
Усиление гидролиза
Гидролиз можно усилить до полной необратимости несколькими способами:
- Повысить скорость образования ионов ОН- и Н+. Для этого нагревают раствор, и за счет увеличения поглощения теплоты водой, то есть эндотермической диссоциации, этот показатель повышается.
- Прибавить воды.
- Перевести один из продуктов в газообразное состояние либо связать в тяжело растворимое вещество.
Подавление гидролиза
Подавить процесс гидролизации, так же как и усилить, можно несколькими способами.
Ввести в раствор один из образующихся в процессе веществ. Например, подщелачивать раствор, в случае если рН˃7, или же наоборот подкислять, где реакционная среда меньше 7 по водородному показателю.
Взаимное усиление гидролиза
Взаимное усиление гидролизации применяется в том случае, если система стала равновесной. Разберем конкретный пример, где системы в разных сосудах стали равновесны:
Al3+ + Н2О ↔ AlOh3+ + Н+
СО32- + Н2О ↔ НСО3- + ОН-
Обе системы мало гидролизованы, поэтому, если смешать их друг с другом, произойдет связывание гидроксоинов и ионов водорода. В результате получим молекулярное уравнение гидролиза солей:
Хлорид алюминия + карбонат натрия + вода = хлорид натрия + гидроокись алюминия + диоксид углерода.
По принипу Ле-Шателье равновесие системы перейдет в сторону продуктов реакции, а гидролиз пройдет до конца с образованием гидроксида алюминия, выпавшего в осадок. Такое усиление процесса возможно лишь в том случае, если одна из реакций протекает по аниону, а другая по катиону.
Гидролиз по аниону
Гидролиз водных растворов солей осуществляется за счет соединения их ионов с молекулами воды. Один из способов гидролизации производится по аниону, то есть прибавление водного иона Н+.
В большинстве своем этому способу гидролиза подвержены соли, которые образуются посредством взаимодействия сильного гидроксида и слабой кислоты. Примером солей, разлагающихся по аниону, может выступать сульфат или сульфит натрия, а также карбонат или фосфат калия. Водородный показатель при этом более семи. В качестве примера разберем диссоциацию натрия уксуснокислого:
В растворе это соединение разделяется на катион – Na+, и анион – СН3СОО-.
Катион диссоциированного натрия уксуснокислого, образованный сильным основанием, не может вступить в реакцию с водой.
При этом анионы кислоты с легкостью реагируют с молекулами Н2О:
СН3СОО- + НОН = СН3СООН +ОН-
Следовательно, гидролизация осуществляется по аниону, и уравнение принимает вид:
Ch4COONa + НОН = СН3СООН + NaOH
В случае, если гидролизу подвергаются многоосновные кислоты, процесс происходит в несколько стадий. В нормальных условиях подобные вещества гидролизуются по первой стадии.
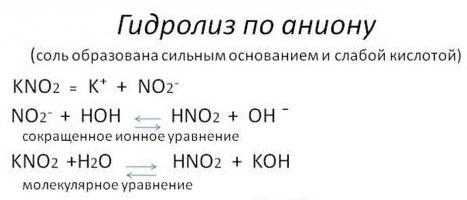
Гидролиз по катиону
Катионному гидролизу в основном подвержены соли, образованные путем взаимодействия сильной кислоты и основания малой силы. Примером служит бромид аммония, нитрат меди, а также хлорид цинка. При этом среда в растворе при гидролизации соответствует менее семи. Рассмотрим процесс гидролиза по катиону на примере хлорида алюминия:
В водном растворе он диссоциирует на анион – 3Cl- и катион – Al3+.
Ионы сильной хлороводородной кислоты не взаимодействуют с водой.
Ионы (катионы) основания, напротив, подвержены гидролизу:
Al3+ + НОН = AlOh3+ + Н+
В молекулярном виде гидролизация хлорида алюминия выглядит следующим образом:
AlCl3 + Н2О = AlOHCl + HCl
При нормальных условиях предпочтительно пренебрегать гидролизацией по второй и третьей ступени.
Степень диссоциации
Любая реакция гидролиза солей характеризуется степенью диссоциации, которая показывает отношение между общим числом молекул и молекулами, способными переходить в ионное состояние. Степень диссоциации характеризуется несколькими показателями:
- Температура, при которой осуществляется гидролиз.
- Концентрация диссоциируемого раствора.
- Происхождение растворяемой соли.
- Природа самого растворителя.
По степени диссоциации все растворы делятся на сильные и слабые электролиты, которые, в свою очередь, при растворении в различных растворителях проявляют разную степень.
- Вещества со степенью диссоциации более 30% являются сильными электролитами. Например, едкий натр, едкий калий, гидроксид бария и кальция, а также серная, соляная и азотная кислоты.
- Электролиты, степень которых менее 2%, называются слабыми. К ним относятся органические кислоты, гидроксид аммония, сероводород и угольная кислота, а также ряд оснований р-, d-, f-элементов периодической системы.

Константа диссоциации
Количественным показателем возможности вещества распадаться на ионы является константа диссоциации, также называемая константой равновесия. Говоря простым языком, постоянная равновесия есть отношение разложившихся на ионы электролитов к непродиссоциированным молекулам.
В отличие от степени диссоциации, этот параметр не зависит от внешних условий и концентрации солевого раствора в процессе гидролизации. При диссоциации многоосновных кислот степень диссоциации на каждой ступени становится на порядок меньше.
Показатель кислотно-основных свойств растворов
Водородный показатель или рН – мера для определения кислотно-основных свойств раствора. Вода в ограниченном количестве диссоциирует на ионы и является слабым электролитом. При расчете водородного показателя используют формулу, которая является отрицательным десятичным логарифмом скопления водородных ионов в растворах:
рН = -lg[Н+]
- Для щелочной среды этот показатель будет равен более семи. Например, [Н+] = 10-8 моль/л, тогда рН = -lg[10-8] = 8, то есть рН ˃ 7.
- Для кислой среды, напротив, водородный показатель должен быть менее семи. Например, [Н+] = 10-4 моль/л, тогда рН = -lg[10-4] = 4, то есть рН ˂ 7.
- Для нейтральной среды, рН = 7.
Очень часто для определения рН-растворов используют экспресс-метод по индикаторам, которые, в зависимости от рН, меняют свой цвет. Для более точного определения пользуются иономерами и рН-метрами.
Количественные характеристики гидролиза
Гидролиз солей, как и любой другой химический процесс, имеет ряд характеристик, в соответствии с которыми протекание процесса становится возможным. К наиболее значимым количественным характеристикам относится константа и степень гидролиза. Остановимся подробнее на каждом из них.

Степень гидролиза
Чтобы узнать, какие соли подвергаются гидролизу и в каком количестве, используют количественный показатель – степень гидролиза, который характеризует полноту протекания гидролизации. Степенью гидролиза называют часть вещества от общего количества молекул, способного к гидролизации, записывается в процентном соотношении:
h = n/N∙ 100%,
где степень гидролиза – h;
количество частиц соли, подвергнутых гидролизации – n;
общая сумма молекул соли, участвующих в реакции – N.
К факторам, влияющим на степень гидролизации, относятся:
- постоянная гидролизации;
- температура, при повышении которой степень возрастает за счет усиления взаимодействия ионов;
- концентрация соли в растворе.
Константа гидролиза
Она является второй по значимости количественной характеристикой. В общем виде уравнения гидролиза солей можно записать как:
МА + НОН ↔ МОН + НА
Отсюда следует, что константа равновесия и концетрация воды в одном и том же растворе есть величины постоянные. Соответственно, произведение этих двух показателей будет также постоянной величиной, что и означает константу гидролиза. В общем виде Кг можно записать, как:
Кг = ([НА]∙[МОН])/[МА],
где НА – кислота,
МОН – основание.
В физическом смысле константа гидролиза описывает способность определенной соли подвергаться процессу гидролизации. Этот параметр зависит от природы вещества и его концентрации.
www.syl.ru
Гидролиз в химии
Гидролиз и его виды
Выделяют два вида гидролиза: гидролиз солей и гидролиз солеобразных бинарных соединений (фосфидов, сульфидов, карбидов, галогенидов некоторых металлов и неметаллов).
Рассмотрим процесс гидролиза на примере: возьмем три пробирки в которых находятся растворы следующих солей – карбоната натрия (Na2CO3 ), хлорида алюминия (AlCl3) и хлорида натрия (NaCl) одинаковой концентрации, бесцветные. Внесем в каждую из пробирок по одной капле универсального индикатора. Цвет раствора в каждой пробирке изменится. Так, в пробирке с Na2CO3 станет голубым, что свидетельствует о наличии щелочной среды (рН>7), в пробирке с AlCl3 появится розовая окраска (кислая среда, рН<7), а в пробирке с NaCl раствор станет желто-зеленого цвета (нейтральная среда, рН=7). Изменение окраски растворов связано с явлением гидролиза – соль прореагировала с водой.
Гидролиз солей
Рассмотрим гидролиз первой из солей – карбоната натрия:
Na2CO3 ↔ 2Na+ + CO32- (подчеркиванием выделяем слабый компонент)
CO32- + HOH ↔ HCO3— + OH— — уравнение гидролиза в ионном виде
Наличие гидроксид иона указывает на щелочной характер среды. Гидролиз – обратимый процесс.
Na2CO3 + HOH ↔ NaHCO3 + NaOH – молекулярное уравнение гидролиза (1-я ступень)
HCO3— + HOH ↔ CO2↑ + h3O + OH—
NaHCO3 + HOH ↔ CO2↑ + h3O + NaOH (2-я ступень гидролиза)
Гидролиз протекает всегда в очень незначительной степени и по первой ступени, вторая и и последующие ступени возможны теоретически.
Рассмотрим гидролиз хлорида алюминия:
AlCl3 ↔ Al3+ +3Cl—
Al3+ + HOH ↔ AlOh3+ + H+ (1-я ступень гидролиза)
Наличие Н+ иона свидетельствует о наличии кислой среды.
AlOh3+ + HOH ↔ Al(OH)2+ + H+ (2-я ступень гидролиза)
Al(OH)2+ + HOH ↔ Al(OH)3 ↓ + H+ (3-я ступень гидролиза)
AlCl3 + HOH ↔ Al(OH)3 ↓ + HCl
Рассмотрим гидролиз хлорида натрия:
NaCl ↔ Na+ + Cl—
Слабого иона нет, следовательно, гидролиз невозможен и среда будет нейтральной.
Гидролизу подвергаются соли образованные сильным основанием и слабой кислотой ( Na2SiO3, K2SO3, K2S), слабым основанием и сильной кислотой ( Zn(NO3)2, CuCl2, CuSO4).
Если соль образована слабым основанием и слабой кислотой, то гидролиз протекает и по катиону и по аниону. В этом случае заранее определить среду весьма сложно. Например:
Ch4COONh5 ↔ Ch4COO— + Nh5+
Ch4COO— + HOH ↔ Ch4COOH + OH—
Nh5+ + HOH ↔ Nh4 × h3O+ H+
Если соль образована сильным основанием и сильной кислотой – гидролиза не происходит.
Гидролиз солеобразных бинарных соединений
Как правило, гидролиз таких соединений протекает необратимо. Карбиды, нидриды, фосфиды, сульфиды при взаимодействии с водой образуют гидроксиды металлов и углеводороды, аммиак, фосфин, сероводород, соответственно.
CaC2 (карбид кальция) + 2h3O → Ca(OH)2 ↓ + C2h3
Mg3N2 (нитрид магния) + 6h3O → 3 Mg(OH)2 ↓ + 2 Nh4 ↑
Константа и степень гидролиза
Ch4COONa ↔ Ch4COO— + Na+
Ch4COO— + HOH ↔ Ch4COOH + OH—
При протекании гидролиза устанавливается химическое равновесие. Согласно закону действующих масс можно записать константу равновесия:
![Rendered by QuickLaTeX.com \[K=\frac{[CH_3COOH][OH]}{[CH_3COO][H_2O]}\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e4da3e67297f8d67cdd584925ccd0d60_l3.png)
[h3O] — фактически постоянная величина, следовательно K[h3O] – также постоянная величина, которую называют константой гидролиза и обозначают [h3O].
![Rendered by QuickLaTeX.com \[K_G=\frac{[CH_3COOH][OH]}{[CH_3COO]} \times \frac{H}{H}\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-659243b816007675a29b86423a3b1e06_l3.png)
[OH][H] = КW (ионное произведение воды)
![Rendered by QuickLaTeX.com \frac{[CH_3COOH]}{[CH_3COO]}](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-8eeb40a015ee4e6418415ca459a1239b_l3.png) = Kдисс (константа диссоциации кислоты), следовательно
= Kдисс (константа диссоциации кислоты), следовательно
КГ =КW (ионное произведение воды) / Kдисс (константа диссоциации слабого компонента).
Чем выше значение константы гидролиза, тем в большей степени он протекает.
h – степень гидролиза – отношение числа молекул, подвергшихся гидролизу к общему числу растворенных молекул.
![Rendered by QuickLaTeX.com \[h=\sqrt{\frac{K_W}{K_{diss} \times c}}\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-6b794e0c2802da113fbb2936077ceec3_l3.png)
Примеры решения задач
ru.solverbook.com
Гидролиз
Гидролиз- обменная реакция соли с водой (сольволиз водой).При этом исходное вещество разрушается водой, с образованием новых веществ.
Так как гидролиз является реакцией ионного обмена, то его движущей силой является образование слабого электролита (выпадение осадка или(и)выделение газа). Важно помнить, что реакция гидролиза является реакцией обратимой(в большинстве случаев), но также существует необратимый гидролиз(протекает до конца, исходного вещества в растворе не будет). Гидролиз- процесс эндотермический (при повышении температуры возрастает и скорость гидролиза, и выход продуктов гидролиза).
Как видно из определения, что гидролиз обменная реакция, то можно предположить, что к металлу идет OH-группа (+ возможный кислотный остаток, если образуется основная соль (при гидролизе соли, образованной сильной кислотой и слабым многокислотным основанием)), а к кислотному остатку идет протон водорода H+ (+ возможный ион металла и ион водорода, с образованием кислой соли, если гидролизуется соль, образованная слабой многоосновной кислотой)).
Существует 4 типа гидролиза:
1. Соль, образованная сильным основанием и сильной кислотой. Так как уже было указанно выше гидролиз- реакция ионного обмена, и она протекает лишь в случае образования слабого электролита. Как описанной выше, к металлу идёт OH- группа, а к кислотному остатку идет протон водорода H+, но ни сильное основание, ни сильная кислота не являются слабыми электролитами, следовательно гидролиз в данном случае не идёт:
NaCl+HOH≠NaOH+HCl
Реакция среды близка к нейтральной: pH≈7
2. Соль образованна слабым основанием и сильной кислотой. Как указанно выше:к металлу идёт OH- группа, а к кислотному остатку идет протон водорода H+. Например:
Nh5Cl+HOH↔Nh5OH+HCl
Nh5++Cl-+HOH↔Nh5OH+H++Cl-
Nh5++HOH↔Nh5OH+H+
Как видно из примера-гидролиз идёт по катиону, реакция среды –кислая pH< 7.При написании уравнений гидролиза для солей, образованных сильной кислотой и слабым многокислотным основанием, то в правой части следует писать основную соль, так как гидролиз идёт только по первой ступени:
FeCl2+HOH↔FeOHCl+HCl
Fe2++2Cl-+HOH↔FeO++H++2Cl-
Fe2++HOH↔FeOH++H+
3. Соль образованна слабой кислотой и сильным основанием.Как указанно выше: к металлу идёт OH- группа, а к кислотному остатку идет протон водорода H+Например:
Ch4COONa+HOH↔NaOH+Ch4COOH
Сh4COO-+Na++HOH↔Na++Ch4COOH+OH-
Сh4COO-+HOH↔+Ch4COOH+OH-
Гидролиз идёт по аниону, реакция среды- щелочная, pH>7.При написании уравнений гидролиза соли, образованной слабой многоосновной кислотой и сильным основанием, в правой части следует писать образование кислой соли, гидролиз идёт по 1 ступени. Например:
Na2CO3+HOH↔NaOH+NaHCO3
2Na++CO32-+HOH↔HCO3-+2Na++OH-
CO32-+HOH↔HCO3-+OH-
4. Соль образованна слабым основанием и слабой кислотой. Это единственный случай, когда гидролиз идёт до конца, является необратимым(до полного расходования исходной соли).Например:
Сh4COONh5+HOH↔Nh5OH+Ch4COOH
Это единственный случай, когда гидролиз идёт до конца. Гидролиз идёт и по аниону, и по катиону, реакцию среды предугадать сложно, но она близка к нейтральной: pH≈7.
Также существует константа гидролиза, рассмотрим ее на примере ацетатного иона, обозначив его Ac-. Как видно из примеров выше уксусная(этановая) кислота является слабой кислотой, а, следовательно, ее соли гидролизуются по схеме:
Ac-+HOH↔HAc+OH-
Найдём константу равновесия для этой системы:

Зная ионное произведение воды , мы можем через него выразить концентрацию [OH]-,

Подставляя это выражение в уравнение для константы гидролиза, мы получаем:


Подставляя константу ионизации воды в уравнение, мы получаем:

Но константа диссоциации кислоты(на примере хлороводородной кислоты) равна:

Где [h4O+] представляет собой гидратированный протон водорода: [H+].Аналогично и для уксусной кислоты, как в примере. Подставляя значение для константы диссоциации кислоты в уравнение константы гидролиза, мы получаем:

Как следует из примера, если соль образованна слабым основанием, то в знаменателе будет стоять константа диссоциации основания, вычисляемая по тому же признаку что и константа диссоциации кислоты. Если соль образованна слабым основанием и слабой кислотой, то в знаменателе будет стоять произведение констант диссоциаций кислоты и основания.
Степень гидролиза.
Так же есть еще одна величина, характеризующая гидролиз- степень гидролиза-α.Которая равна отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли Степень гидролиза зависит от концентрации соли, температуры раствора. Она увеличивается при разбавлении раствора соли и при увеличении температуры раствора. Напомним, что больше разбавлен раствор, тем меньше молярная концентрация исходной соли; а степень гидролиза возрастает при повышении температуры, так как гидролиз- процесс эндотермический, как было указанно выше.

Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие. Как следует из уравнения степени гидролиза и типов гидролиза: при необратимом гидролизе α≈1.
Степень гидролиза и константа гидролиза взаимосвязаны через уравнение Оствальда (Вильгельм Фридрих Оствальд-закон разбавления Оствальда,выведен в 1888 году).Закон разбавления показывает, что степень диссоциации электролита зависит от его концентрации и константы диссоциации. Примем начальную концентрацию вещества за C0, а продиссоциировавшую часть вещества- за γ, напомним, схему диссоциации вещества в растворе:
AB↔A++B-
Тогда закон Оствальда можно выразить следующим образом:

Напомним, что в уравнение стоят концентрации в момент равновесия. Но если вещество малодиссоциировавшее, то (1-γ)→1, что приводит уравнение Оствальда в вид: Kд=γ2C0.
Аналогично связанна степень гидролиза с его константой:

В подавляющем большинстве случаев используется именно эта формула. Но при необходимости, можно выразить степень гидролиза через такую формулу:

Особые случаи гидролиза:
1) Гидролиз гидридов (соединений водорода с элементами (тут мы рассмотрим только металлы 1 и 2 групп и метам), где водород проявляетстепень окисления -1):
NaH+HOH→NaOH+h3↑
Cah3+2HOH→ Ca(OH)2+2h3↑
Ch5+HOH→CO+3h3↑
Реакция с метаном- один из промышленных способов получения водорода.
2) Гидролиз пероксидов. Пероксиды щелочных и щелочноземельных металлов разлагаются водой, с образованием соответствующего гидроксида и пероксида водорода (или кислорода):
Na2O2+2h3O→2NaOH+h3O2
Na2 O2+2h3O→2NaOH+O2↑
3) Гидролиз нитридов.
Ca3N2+6HOH→3Ca(OH)2+2Nh4↑
4) Гидролиз фосфидов.
K3P+3HOH→3KOH+Ph4↑
Выделяющийся газ Ph4-фосфин, очень ядовит, поражает нервную систему. Так же способен к самовозгоранию при контакте с кислородом. Гуляли когда-нибудь ночью по болоту или ходили мимо кладбищ? Видели редкие всплески огней- «блуждающие огни», появляются, так как горит фосфин.
5) Гидролиз карбидов. Здесь будут приведены две реакции имеющие практическое применение, так как с их помощью получаются 1 члены гомологического ряда алканов (реакция 1) и алкинов (реакция 2):
Al4C3+12HOH→4Al(OH)3+3Ch5↑(реакция 1)
СaC2+2HOH→Ca(OH)2+2C2h3↑(реакция 2, продукт – ацителен, по UPAС этин)
6) Гидролиз силицидов. В результате этой реакции образуется 1 представитель гомологического ряда силанов (всего их 8) Sih5 - мономерный ковалентный гидрид.
Mg2 Si+4HOH→2Mg(OH)2+Sih5
7) Гидролиз галогенидов фосфора. Здесь будут рассмотрены хлориды фосфора 3 и 5, являющиеся хлорангидридами фосфористой и фосфорной кислот соответственно:
PCl3+3h3O=h4PO3+3HCl
PCl5+4h3O=h4PO4+5HCl
8) Гидролиз органических веществ.Жиры гидролизуются, с образованием глицерина (C3H5(OH)3) и карбоновой кислоты(пример предельной карбоновой кислоты) (CnH(2n+1)COOH)
Сложные эфиры:
Сh4COOCh4+h3O↔Ch4COOH+Ch4OH
Алкоголята:
C2H5ONa+h3O↔C2H5OH+NaOH
Живые организмы осуществляют гидролиз различных органических веществ в ходе реакций катаболизма при участии ферментов. Например, в ходе гидролиза при участии пищеварительных ферментов белки расщепляются на аминокислоты, жиры — на глицерин и жирные кислоты, полисахариды — на моносахариды (например, на глюкозу).
При гидролизе жиров в присутствии щелочей получают мыло; гидролиз жиров в присутствии катализаторов применяется для получения глицина и жирных кислот.
Задачи
1) Степень диссоциации а уксусной кислоты в 0,1 М растворе при 18 °С равна 1,4·10–2. Рассчитайте константу диссоциации кислоты Кд.(подсказка- используйте уравнение Оствальда.)
2) Какую массу гидрида кальция нужно растворить в воде, чтобы выделившемся газом восстановить до железа 6,96г оксида железа(II,III)?
3) Напишите уравнение реакции Fe2(SO4)3 + Na2CO3 + h3O 
4) Рассчитайте степень, константу гидролиза соли Na2SO3 для концентрации См = 0,03 М, учитывая только 1-ю ступень гидролиза. (Константу диссоциации сернистой кислоты принять равной 6,3∙10-8)
Решения:
a) Подставим данные задачи в закон разбавления Оствальда:
b) Kд = [a2/(1 – a)]·[C] = (1,4·10–2)·0,1/(1 – 0,014) = 1,99·10–5
Ответ. Кд = 1,99·10–5.
c) Fe3O4+4h3→4h3O+3Fe
Cah3+HOH→Ca(OH)2+2h3↑
Находим количество молей оксида железа(II,III), оно равно отношению массы данного вещества к его молярной массе, получаем 0,03(моль).По УХР находим, что моли гидрида кальция равны 0,06(моль).Значит масса гидрида кальция равна 2,52(грамма).
Ответ: 2,52(грамма).
d) Fe2(SO4 )3 +3Na2CO3 +3h3 O→3СO2↑+2Fe(OH)3↓+3Na2 SO4
e) Сульфит натрия подвергается гидролизу по аниону, реакция среды раствора соли щелочная (рН > 7): SO32- + h3O <--> OH- + HSO3- Константа гидролиза (уравнение смотрите выше )равна : 10-14 / 6,3*10-8 = 1,58*10-7 Степень гидролиза рассчитывается по формуле α2/(1 - α) = Кh/С0. Итак, α = (Кh/С0)1/2 = (1,58*10-7 / 0,03)1/2 = 2,3*10-3
Ответ: Kh=1,58*10-7 ;α =2,3*10-3
Автор статьи: Каштанов Артём Денисович
Редактор: Харламова Галина Николаевна
www.teslalab.ru
Гидролиз | CHEMEGE.RU
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н+ и ОН— ионами воды малодиссоциированные электролиты.  Гидролиз солей может протекать:
Гидролиз солей может протекать:
→ обратимо: только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо: практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью оксиления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота h3CO3.
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой, гидролизуются ПО АНИОНУ.
Примеры таких солей — Ch4COONa, Na2CO3, Na2S, KCN.
Реакция гидролиза:
Ch4COONa + HOH ↔ Ch4COOH + NaOH
в ионной форме:
Ch4COO— + Na+ + HOH ↔ Ch4COOH + Na+ + OH—
сокращенное ионное уравнение:
Ch4COO— + HOH ↔ Ch4COOH + OH—
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH—. Водородный показатель такого раствора рН>7.
Гидролиз солей многоосновных кислот (h3CO3, h4PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO32- + HOH ↔ HCO32- +OH—
или в молекулярной форме:
Na2CO3 + HOH ↔ NaHCO3 +NaOH
2 ступень:
HCO3— + HOH ↔ h3CO3 +OH—
или в молекулярной форме:
NaHCO3 + HOH ↔ h3CO3 +NaOH
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой, гидролизуются ПО КАТИОНУ. Пример такой соли: Nh5Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
Nh5+ + HOH ↔ Nh4·h3O + H+
или в молекулярной форме:
Nh5Cl + HOH ↔ Nh4·h3O + HCl
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н+. Водородный показатель такого раствора рН<7.
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей.Например:
I ступень:
Fe3+ + HOH ↔ FeOh3+ + H+
FeCl3 + HOH ↔ FeOHCl2 + HCl
II ступень:
FeOh3+ + HOH ↔ Fe(OH)2+ + H+
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
III ступень:
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой, гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ.
Примеры таких солей: Ch4COONh5, (Nh5)2CO3, HCOONh5,
Уравнение гидролиза:
Ch4COO— + Nh5+ + HOH ↔ Ch4COOH + Nh4·h3O
Ch4COONh5 + HOH ↔ Ch4COOH + Nh4·h3O
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7. Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой, в водных растворах НЕ ИДЕТ.
Сведем вышеописанную информацию в общую таблицу:

Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут провзаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be2+, Co2+, Ni2+, Zn2+, Pb2+, Cu2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl2 + 2Na2CO3 + h3O = Mg2(OH)2CO3 + 4NaCl + CO2
2МеCl2 + 2Na2CO3 + Н2О=(МеОН)2CO3 + 4NaCl + СО2 (МеII, кроме Fe, Ca,Sr,Ba).
! Исключения: (соли Ca, Sr, Ba и Fe2+) – в этом случае получим обычный обменный процесс:
CaCl2 + Na2CO3 = CaCO3 + NaCl,
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз, протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз).Соли металлов со степенью окисления +3 (Al3+, Fe3+, Cr3+) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивани в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (h3S, SO2, CO2):
2AlCl3 + 3K2S +6h3O = 2Al(OH)3 + 3h3S↑ + 6KCl,
2CrCl3 + 3K2CO3 + 3h3O = 2Сr(ОН)3 + 3СO2 + 6KCl,
2Fe(NO3)3 + 3Na2SO3 + 3h3O = 2Fe(ОН)3 + 3SO2 + 6NaNO3,
2МеCl3 + 3Na2CO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3СО2 (МеIII),
2МеCl3 + 3Na2SO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3SО2 (МеIII),
2МеCl3 + 3Na2S + 3Н2О=2Ме(ОН)3 + 6NaCl + 3h3S (МеIII).
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
2FeCl3 + K2S = 2FeCl2 + S↓ + 2KCl (при избытке хлорида железа (III))
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необьратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H+OH—) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO2Cl2 + 2 h3O = h3SO4 + 2 HCl,
SOCl2 + 2 h3O = h3SO3 + 2HCl,
PCl5 + 4 h3O = h4PO4 + 5HCl,
CrO2Cl2 + 2h3O = h3CrO4 + 2HCl,
PCl5 + 8NaOH = Na3PO4 + 5NaCl + 4h3O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl3 + 3h3O = h4PO4 + 3HCl
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| h3SO4 | SO2Cl2 |
| h3SO3 | SOCl2 |
| h3CO3 | COCl2 |
| h4PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
Al2S3 + 6h3O = 2Al(OH)3 + 3h3S
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
Al2S3 + 6HCl = 2AlCl3 + 3h3S
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
Ca+2C-12 + h3O = Ca+2(OH)2 + C-12h3
Al+34C-43 + 12h3O = 4Al+3(OH)3 + 3C-4h5,
Ca3N2 + h3O =
Ca3P2 + h3O =
Mg2Si + h3O =
- Некоторые соли необратимо гидролизуются с образованием оксосолей:
BiCl3 + h3O = BiOCl + 2HCl,
SbCl3 + h3O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
KAl(SO4)2 + K2S + h3O =
MgCl2 + NaНCO3 + h3O =
ZnSO4 + CsНCO3 + h3O =
CdSO4 + RbНCO3 + h3O =
CaSO4 + Rb2CO3 + h3O =
FeCl2 + Rb2CO3 + h3O =
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза.
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень обратимого гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример: изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:

2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример: изменение степени гидролиза Na2CO3 в зависимости от температуры:

По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Пройти тест по теме Гидролиз:
Здесь вы можете потренироваться в решении тестовых заданий в формате ЕГЭ по теме Гидролиз. Среда водных растворов: кислая, нейтральная, щелочная.
Поделиться ссылкой:
chemege.ru
15. Гидролиз
Особое место среди обменных реакций занимает гидролиз. В общем случае гидролиз – это разложение веществ водой. Вода – одно из самых активных веществ. Она действует на самые различные классы соединений: соли, углеводы, белки, эфиры, жиры и т. д. При гидролизе соединений неметаллов обычно образуются две кислоты, например:
PCl3 + 3 h3O = h4PO3 + 3 HCl
При этом изменяется кислотность растворов по сравнению с кислотностью растворителя.
В неорганической химии чаще всего приходится иметь дело с гидролизом солей, т.е. с обменным взаимодействием ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды.
Гидролизом соли называется обратимое взаимодействие ионов соли с ионами воды, приводящее к изменению равновесия между ионами водорода и гидроксида в растворе.
Гидролиз является результатом поляризационного взаимодействия ионов соли с их гидратной оболочкой в водном растворе. Чем значительнее это взаимодействие, тем интенсивнее протекает гидролиз. Упрощенно сущность процесса гидролиза можно представить следующим образом.
Катионы Кn+ связываются в растворе с гидратирующими их молекулами воды донорно-акцепторной связью; донором являются атомы кислорода молекулы воды, имеющие две неподеленные электронные пары, акцептором - катионы, имеющие свободные атомные орбитали. Чем больше заряд катиона и чем меньше его размер, тем значительнее поляризующее действие Кn+ на Н2O.
Анионы Аn‾ связываются с молекулами воды водородной связью. Сильное воздействие анионов может привести к полному отрыву протона от молекулы Н2O – водородная связь становится ковалентной. В результате образуется кислота или анион типа HS‾, НСО3‾ и т. п.
Взаимодействие анионов An‾ с протонами тем значительнее, чем больше заряд аниона и меньше его радиус. Таким образом, интенсивность взаимодействия вещества с водой определяется силой поляризующего влияния Кn+ и Аn‾ на молекулы Н2O. Так, катионы элементов побочных подгрупп и непосредственно следующих за ними элементов подвергаются более интенсивному гидролизу, чем другие ионы одинаковых с ними заряда и радиуса, так как ядра первых менее эффективно экранируются d-электронами.
Гидролиз – процесс обратный реакции нейтрализации. Если реакция нейтрализации процесс экзотермический и необратимый, то гидролиз – процесс эндотермический и обратимый.
Реакция нейтрализации:
2 KOH + h3SO3 → K2SO3 + 2 h3O
сильный слабый сильный слабый
2 OH‾ + h3SO3= SO32- + 2 h3O
Реакция гидролиза:
K2SO3+ h3O ↔ KOH + KHSO3
SO32- + HOH ↔ HSO3‾ + OH‾
При гидролизе смещается равновесие диссоциации воды вследствие связывания одного из ее ионов (Н+ или ОН-) в слабый электролит соли. При связывании ионов Н+ в растворе накапливаются ионы ОН−, реакция среды будет щелочная, а при связывании ионов ОН− накапливаются ионы Н+ - среда будет кислая.
Различают четыре варианта действия воды на соли.
1. Если катионы и анионы имеют небольшие заряды и большие размеры, то их поляризующее влияние на молекулы воды невелико, т. е. взаимодействие соли с h3O практически не происходит. Это относится к катионам, гидроксиды которых являются щелочами (например, K+ и Са2+) и к анионам сильных кислот (например, Сl‾ и NО3‾). Следовательно, соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются. В этом случае равновесие диссоциации воды
h3O ↔ H+ + OH‾
в присутствии ионов соли практически не нарушается. Поэтому растворы таких солей нейтральны (pH ≈ 7).
2. Если соль образована катионом сильного основания и анионом слабой кислоты (S2-, CO32-, CN‾ и др.), то происходит гидролиз по аниону. Пример – гидролиз соли СН3СООК. Ионы соли СН3СОО− и К+ взаимодействуют с ионами Н+ и ОН− из воды. При этом ацетат-ионы (СН3СОО−) связываются с ионами водорода (Н+) в молекулы слабого электролита - уксусной кислоты (Ch4COOH), а ионы ОН− накапливаются в растворе, сообщая ему щелочную реакцию, так как ионы К+ не могут связать ионы ОН− (КОН является сильным электролитом), pH > 7.
Молекулярное уравнение гидролиза:
СН3СООК + h3O ↔ КОН + СН3ООН
Полное ионное уравнение гидролиза:
К+ + СН3СОО− + НОН ↔ K+ + ОН− + СН3СООН
сокращенное ионное уравнение гидролиза:
СН3СОО− + НОН ↔ ОН− + СН3СООН
Гидролиз соли Na2S протекает ступенчато. Соль образована сильным основанием (NaOH) и слабой двухосновной кислотой (h3S). В этом случае анион соли S2− связывает ионы Н+ воды, в растворе накапливаются ионы ОН−. Уравнение в сокращенной ионной и молекулярной форме имеет вид:
I. S2− + НОН ↔ HS− + ОН−
Na2S + Н2О ↔ NaHS + NaOH
II. HS−+ НОН ↔ h3S + ОН−
NaHS + Н2О ↔ NaOH + h3S
Вторая ступень гидролиза практически не проходит при обычных условиях, так как, накапливаясь, ионы ОН− сообщают раствору сильнощелочную реакцию, что приводит к реакции нейтрализации, сдвигу равновесия влево в соответствии с принципом Ле Шателье. Поэтому гидролиз солей, образованных сильным основанием и слабой кислотой, подавляется прибавлением щелочи.
Чем больше поляризующее влияние анионов, тем интенсивнее гидролиз. В соответствии с законом действия масс это означает, что гидролиз протекает тем интенсивнее, чем слабее кислота.
3. Если соль образована катионом слабого основания и анионом сильной кислоты, то происходит гидролиз по катиону. Например, это имеет место при гидролизе соли Nh5Cl (Nh5ОH - слабое основание, НСl - сильная кислота). Отбросим ион Сl−, так как он с катионом воды дает сильный электролит, тогда уравнение гидролиза примет следующий вид:
Nh5+ + НОН ↔ Nh5OH + Н+ (сокращенное ионное уравнение)
Nh5Cl + Н2О ↔ Nh5OH + НСl (молекулярное уравнение)
Из сокращенного уравнения видно, что ионы ОН− воды связываются в слабый электролит, ионы Н+ накапливаются в растворе и cреда становится кислой (pH < 7). Добавление кислоты к раствору (введение продукта реакции катионов H+) сдвигает равновесие влево.
Гидролиз соли, образованной многокислотным основанием (например, Zn(NO3)2) протекает ступенчато по катиону слабого основания.
I. Zn2+ + НОН ↔ ZnOH+ + H+ (сокращенное ионное уравнение)
Zn(NO3)2 + Н2О ↔ ZnOHNO3 + HNO3 (молекулярное уравнение)
Ионы ОН− связываются в слабое основание ZnOH+, ионы Н+ накапливаются.
Вторая ступень гидролиза практически не происходит при обычных условиях, так как в результате накопления ионов H+ в растворе создается сильнокислая среда и равновесие реакции гидролиза по 2-ой ступени смещено влево:
II. ZnOH+ + НОН ↔ Zn(OH)2 + H+ (сокращенное ионное уравнение)
ZnOHNO3 + Н2О ↔ Zn(OH)2 + HNO3 (молекулярное уравнение)
Очевидно, чем слабее основание, тем полнее идет гидролиз.
4. Соль, образованная катионом слабого основания и анионом слабой кислоты, подвергается гидролизу по катиону и по аниону. Примером служит процесс гидролиза соли СН3СООNh5. Запишем уравнение в ионной форме:
Nh5+ + Ch4COO− + НОН ↔ Nh5OH + СН3СООН
Гидролиз таких солей протекает очень сильно, поскольку в результате его образуются и слабое основание, и слабая кислота.
Реакция среды в этом случае зависит от сравнительной силы основания и кислоты, т.е. от их констант диссоциации (KД):
В случае гидролиза Ch4COONh5:
KД (Nh5OH) = 1,8·10-5; KД (Ch4COOH)=1,8·10-5,
поэтому реакция водного раствора этой соли будет почти нейтральной (pH ≈ 7).
Если основание и кислота, образующие соль, являются не только слабыми электролитами, но и малорастворимы или неустойчивы и разлагаются с образованием летучих продуктов, то в этом случае гидролиз соли протекает по всем ступеням до конца, т.е. до образования слабого труднорастворимого основания и слабой кислоты. В этом случае речь идет о необратимом или полном гидролизе.
Именно полный гидролиз является причиной того, что водные растворы некоторых солей приготовить нельзя, например Сr2(CO3)3, Al2S3 и др. Например:
Al2S3 + 6h3O → 2Al(OH)3↓ + 3h3S↑
Поэтому сульфид алюминия не может существовать в виде водных растворов, может быть получен только "сухим способом", например, из элементов при высокой температуре:
2Al + 3S –t°→ Al2S3,
и должен храниться в герметических сосудах, исключающих попадание влаги.
Реакцией обмена в водном растворе такие соединения нельзя получить. При взаимодействии солей А13+, Сr3+ и Fe3+ в растворе с сульфидами и карбонатами в осадок выпадают не сульфиды и карбонаты этих катионов, а их гидроксиды:
2AlCl3 +3Na2S +6Н2О → 3Н2S↑ + 2Аl(ОН)3↓ +6NaCl
2CrCl3 + 3Na2CO3 + 3h3O → 2Сr(ОН)3↓ + 3СO2↑ + 6NaCl
В рассмотренных примерах происходит взаимное усиление гидролиза двух солей (АlСl3 и Na2S или СrСl3 и Nа2СО3) и реакция идет до конца, так как продукты реакции выделяются из раствора в виде осадка и газа.
Гидролиз солей в ряде случаев может протекать очень сложно. (Простые уравнения реакции гидролиза в общепринятой записи часто являются условными.) Продукты гидролиза можно установить лишь на основании аналитического исследования. К примеру, продуктами гидролиза солей, содержащих многозарядные катионы, могут быть полиядерные комплексы. Так, если в раствоpax Hg2+ содержатся только одноядерные комплексы, то в растворах Fe3+ помимо комплексов [FeOH]2+ и [Fe(OH)2]+ обнаруживается двухъядерный комплекс [Fe2(OH)2]4+; в растворах Ве2+ в основном образуются многоядерные комплексы состава [Ве3(OH)3]3+; в растворах Sn2+ образуются комплексные ионы [Sn3(OH)4]2+, [Sn2(OH)2]2+, [SnOH]+; в растворах Bi3+ наряду с [ВiOН]2+ находятся комплексные ионы состава [Bi6(OH)12]6+. Реакции гидролиза, приводящие к образованию полиядерных комплексов, можно представить следующим образом:
mMk+ + nh3О ↔ Мm(OН)n(mk - n)+ + nН+,
где m изменяется от 1 до 9, а n может принимать значения от 1 до 15. Такого рода реакции возможны для катионов более чем 30 элементов. Установлено, что каждому заряду иона в большинстве случаев отвечает определенная форма комплекса. Так, для ионов М2+ характерна форма димеров [M2(OH)]3+, для ионов М3+ – [M2(OH)2]4+, а для М4+ – форма [M2(OH)3]5+ и более сложные, например [Zr4(OH)8]8+ .
При высоких температурах и больших значениях рН образуются и оксокомплексы:
2MOH ↔ MOM + h3O или
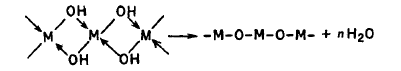
Например,
BiCl3 + h3O « Bi(OH)2Cl + 2HCl
Катион Bi(OH)2+ легко теряет молекулу воды, образуя катион висмутила ВiO+, который с хлорид-ионом дает белый кристаллический осадок:
Bi(OH)2Cl ®BiOCl↓ + h3O.
Структурно полиядерные комплексы можно представить в виде октаэдров, соединенных между собой по вершине, ребру или грани посредством различных мостиков (О, ОН и др.).
Сложный состав имеют продукты гидролиза карбонатов ряда металлов. Так, при взаимодействии растворимых солей Mg2+, Cu2+, Zn2+, Рb2+ с карбонатом натрия образуются не средние карбонаты, а менее растворимые гидроксокарбонаты, например Сu2(ОН)2СО3, Zn5(ОН)6(СО3)2, Рb3(ОН)2(СО3)2. В качестве примера можно привести реакции:
5MgSO4 + 5Na2CO3 + Н2O → Мg5(ОН)2(СО3)4↓ + 5Na2SO4 + СO2↑
2Cu(NO3)2 + 2Na2CO3 + h3O → Cu2(OH)2CO3↓ + 4NaNO3 + CO2↑
Количественно гидролиз характеризуется степенью гидролиза h и константой гидролиза КГ.
Степень гидролиза показывает, какая часть соли, содержащаяся в растворе (СМ), подверглась гидролизу (СМгид) и рассчитывается как отношение:
h = СМгид / СМ (100%).
Очевидно, что для обратимого процесса гидролиза h < 1 (<100%), а для необратимого гидролиза h = 1 (100%). Кроме природы соли, степень гидролиза зависит от концентрации соли и температуры раствора.
В растворах с умеренной концентрацией растворенного вещества степень гидролиза при комнатной температуре обычно невелика. Для солей, образованных сильным основанием и сильной кислотой, она практически равна нулю; для солей, образованных слабым основанием и сильной кислотой или сильным основанием и слабой кислотой, она составляет ≈ 1%. Так, для 0,01 М раствора Nh5Cl h = 0,01%; для 0,1 н. раствора Ch4COONh5h ≈ 0,5%.
Гидролиз – процесс обратимый, поэтому к нему применим закон действующих масс.
Константа гидролиза есть константа равновесия процесса гидролиза, и по своему физическому смыслу определяет степень необратимости гидролиза. Чем больше КГ, тем необратимее гидролиз. КГ имеет свое выражение для каждого случая гидролиза.
Выведем выражение для константы гидролиза соли слабой кислоты и сильного основания на примере NaCN:
NaCN + h3O ↔ NaOH + HCN;
Na+ + CN– +h3O ↔ Na+ + OH– + HCN;
CN– + h3O ↔ HCN + OH–
Кравн = [HCN][OH–] / [CN–][h3O].
[h3O] имеет наибольшую величину, которая в ходе реакции практически не изменяется, поэтому ее можно условно считать постоянной. Тогда помножив числитель и знаменатель на концентрацию протонов и введя постоянную концентрацию воды в константу, получим:
Кравн [h3O] = KW / КД(кисл) = KГ
так как [HCN] / [H+][CN–] = 1/ КД(кисл)
Поскольку KW величина постоянная и равна 10-14 , очевидно, что чем меньше КД слабой кислоты, анион которой входит в состав соли, тем больше KГ.
Аналогично, для соли, гидролизующейся по катиону (например Nh5Cl), получим:
Nh5+ + h3O ↔ Nh5OH + H+ (сокращенное уравнение гидролиза)
Кравн = [Nh5OH][H+] / [Nh5+][h3O]
KГ = Кравн [h3O] = KW / КД(осн)
В этом выражении числитель и знаменатель дроби умножили на [OH–]. Очевидно, что чем меньше КД слабого основания, катион которого входит в состав соли, тем больше KГ.
Если соль образована слабым основанием и слабой кислотой (на примере Nh5CN), то сокращенное уравнение гидролиза имеет вид:
Nh5+ + CN–+ h3O ↔ Nh5OH + HCN
Кравн= [Nh5OH][HCN] / [Nh5+][CN–],
В этом выражении для Кравн числитель и знаменатель дроби умножаем на [H+]·[OH–], поэтому выражение для KГ принимает вид:
KГ = KW / (КД(кислоты) КД(осн)).
Как следует из приведенных выражений, константа гидролиза обратно пропорциональна константе диссоциации слабого электролита, участвующего в образовании соли (если в образовании соли участвуют два слабых электролита, то KГ обратно пропорциональна произведению их констант диссоциации).
Рассмотрим гидролиз многозарядного иона. Возьмем Na2CO3.
I. CO32- + h3O « HCO3– + OH–
KГ(I) = [HCO3–][OH–] / [CO32-][h3O] × ([H+] / [H+]) = KW / КД(II),
то есть в выражение для константы гидролиза по первой ступени в знаменатель входит вторая константа диссоциации, и для второй ступени гидролиза
HCO3– + h3O « h3CO3+ OH–
KГ(II) = [h3CO3][OH–] / [HCO3–][h3O] × ([H+] / [H+]) = KW / КД(I)
KД(I) = 4×10-7 KД(II) = 2.5×10-8
KГ(II) = 5.6×10-11 KГ(I) = 1.8×10-4
Таким образом, KГ(I) >> KГ(II), константа, а следовательно, и степень первой стадии гидролиза много больше последующих.
Степень гидролиза является величиной аналогичной степени диссоциации. Взаимосвязь степени и константы гидролиза аналогична таковой для степени и константы диссоциации.
Если в общем случае исходную концентрацию аниона слабой кислоты обозначить через Со (моль/л), то Соh (моль/л) – концентрация той части аниона A–, которая подверглась гидролизу и образовалось Соh (моль/л) слабой кислоты HA и Соh (моль/л) гидроксидных групп.
A– + h3O ↔ HA + OH–,
Со-Соh Соh Соh
тогда KГ = [HA][OH–] / [A–] = Соh·Соh / (Со-Соh) = Соh3 / (1-h).
П риh << 1 KГ = Соh3h = √КД / Со.
риh << 1 KГ = Соh3h = √КД / Со.
Очень похоже на закон разбавления Оствальда.
Можно рассчитать pH раствора, если известны Со и h. Учитывая, что
[HA] = [OH–] = Соh, получим:
K Г = Соh·Соh / Со = [OH–]2/ Со, откуда
Г = Соh·Соh / Со = [OH–]2/ Со, откуда
[OH–] = √КГ·Со.
Аналогично, можно показать, что при гидролизе по катиону
[ H+] = √КГ·Со.
H+] = √КГ·Со.
Таким образом, способность солей подвергаться гидролизу зависит от двух факторов:
свойств ионов, образующих соль;
внешних факторов.
Как сдвинуть равновесие гидролиза?
1) Добавление одноименных ионов. Поскольку при обратимом гидролизе устанавливается динамическое равновесие, то в соответствии с законом действия масс равновесие можно сместить в ту или иную сторону введением в раствор кислоты или основания. Введение кислоты (катионов Н+) подавляет гидролиз по катиону, добавление щелочи (анионов OH–) подавляет гидролиз по аниону. Этим часто пользуются для усиления или подавления процесса гидролиза.
2) Из формулы для h видно, что разбавление способствует гидролизу. Рост степени гидролиза карбоната натрия
Na2CO3 + НОН ↔ NaHCO3 + NaOH
при разбавлении раствора иллюстрирует рис. 20.
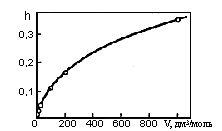
Рис. 20. Зависимость степени гидролиза Na2CO3 от разбавления при 20°С
3) Повышение температуры способствует гидролизу. Константа диссоциации воды увеличивается при повышении температуры в большей степени, чем константы диссоциации продуктов гидролиза - слабых кислот и оснований, поэтому при нагревании степень гидролиза возрастает. К этому выводу легко прийти и иначе: так как реакция нейтрализации экзотермична (DH= –56 кДж/моль), то гидролиз, будучи противоположным ей процессом, эндотермичен, поэтому в соответствии с принципом Ле Шателье нагревание вызывает усиление гидролиза. Рис. 21 иллюстрирует влияние температуры на гидролиз хлорида хрома (III)
СrСl3 + НОН ↔ CrOHCl2 + НСl
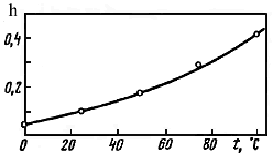
Рис. 21. Зависимость степени гидролиза СrСl3 от температуры
В химической практике весьма распространен гидролиз по катиону солей, образованных многозарядным катионом и однозарядным анионом, например АlС13. В растворах этих солей менее диссоциированное соединение образуется в результате присоединения одного гидроксид-иона к иону металла. Учитывая, что ион Аl3+ в растворе гидратирован, первую стадию гидролиза можно выразить уравнением
[Al(h3O)6]3+ + HOH ↔ [Al(h3O)5OH]2+ + h4O+
При обычной температуре гидролиз солей многозарядных катионов практически ограничивается этой стадией. При нагревании происходит гидролиз по второй ступени:
[Al(h3O)5OH]2+ + HOH ↔ [Al(h3O)4(OH)2]+ + h4O+
Таким образом, кислая реакция водного раствора соли объясняется тем, что гидратированный катион теряет протон и аквагруппа Н2O превращается в гидроксогруппу ОН‾. В рассмотренном процессе могут образоваться и более сложные комплексы, например [Al6(OH)15]3+, а также комплексные ионы вида [AlO(OH)4]3- и [АlO2(ОН)2]3-. Содержание различных продуктов гидролиза зависит от условий проведения реакции (концентрация раствора, температура, присутствие других веществ). Имеет значение также длительность протекания процесса, так как равновесие при гидролизе солей многозарядных катионов обычно достигается медленно.
studfiles.net





















