Карбид кальция и ацетилен - друзья не разлей вода! Вода карбид
Карбид кальция и ацетилен - друзья не разлей вода!
Карбид кальция химическое соединение кальция с углеродом, в чистом виде представляющее собой белое кристаллическое вещество. Химическая формула - СаС2 Технический карбид кальция твердый кускообразный материал, цвет излома которого меняется в зависимости от содержания карбида кальция. При содержании 60-75% СаС2 - имеет излом серого цвета, переходящий в фиолетовый при более высоком содержании CaC2. Высокопроцентный (80% СаС2 и выше) - имеет окраску от светло-коричневого до голубовато-черного.
Технический карбид кальция твердый кускообразный материал, цвет излома которого меняется в зависимости от содержания карбида кальция. При содержании 60-75% СаС2 - имеет излом серого цвета, переходящий в фиолетовый при более высоком содержании CaC2. Высокопроцентный (80% СаС2 и выше) - имеет окраску от светло-коричневого до голубовато-черного. 
Карбид кальция имеет резкий чесночный запах и сильно поглощает воду. Его плотность повышается с увеличением количества примесей и изменяется в пределах 2,22-2,8 г/см3. Молекулярная масса - 64,102. Технический карбид кальция выпускают по ГОСТ 1460.
Карбид кальция является основным сырьем для получения ацетилена - горючего газа применяемого при газовой сварке и газовой резке.
Карбид кальция был получен случайно в 1862 г. Немецкий химик Фридрих Вёлер (Friedrich Wöhler) при попытке выделения металлического кальция из извести (карбоната кальция СаСО3) путем длительного прокаливания смеси, состоящей из извести и угля получил массу сероватого цвета, в которой не обнаружил признаков металла. Как результат неудавшегося эксперимента он выбросил эту массу на свалку во дворе. Во время дождя лаборант заметил выделение какого-то газа из выброшенной массы. Это заинтересовало Фридриха Вёлера, он провел анализ газа и установил, что это ацетилен (С2Н2), ранее открытый Эдмундом Дэви (Edmund Davy), в 1836 г.
Однако имя этому газу присвоил французский химик Пьер Эжен Марселен Бертло (Marcellin Berthelot), после того, как в 1863 году получил ацетилен, пропуская водород над раскалёнными электрической дугой графитовыми электродами.
Томас Уилсон (Thomas Leopold "Carbide" Willson) в 1888 году и Фердинанд Фредерик Анри Муассан (Ferdinand Frederic Henri Moissan) в 1892 независимо друг от друга открыли метод получения карбида кальция в дуговой электропечи, что послужило толчком для дальнейшего развития промышленного получения технического карбида кальция.
В России первые заводы по изготовлению карбида кальция были построены акционерным обществом «Перун» в 1908 г. в Земковицах, а в 1910 г. в Петербурге. В 1914 г. на этом заводе работали две карбидные печи мощностью по 500 кВт и две печи по 900 кВт.
В 1917 г. при Макеевском металлургическом заводе была построена установка с электропечью мощностью 1800 кВт. Почти одновременно на заводе в Баку для нужд нефтепромышленности и на Аллавердском медеплавильном заводе также были пущены карбидные печи.
В 1930 г. был построен и пущен первый большой карбидный завод в Растяпино (ныне г. Дзержинск Нижегородской области). На этом заводе карбид кальция впервые стал выпускаться не только как товарный продукт, но и для получения цианамида кальция.
Получение карбида кальция
Технический карбид кальция получают в результате взаимодействия обожженной извести (СаО) с коксом (3С) или антрацитом в электрических печах при температуре 1900-2300оС. Шихту, состоящую из смеси кокса или антрацита и извести в определенной пропорции, загружают в электропечь, шихта расплавляется, при этом происходит эндотермическая химическая реакция (т. е. с поглощением тепла) по формуле:
СаО+3С = СаС2+СО -108 ккал/моль
Таким образом, для получения 1 т карбида кальция требуется:
- 4000 кг извести
- 600 кг кокса
- 1965 кВт·ч электроэнергии
Однако вследствие значительных потерь энергии в карбидных печах практически для получения 1 т технического карбида кальция расходуется от 2800 до 3700 кВт·ч в зависимости от мощности печи. Если мощность печи меньше 1000 кВт, то расход электроэнергии может достичь 4000 кВт·ч/т и более.
Расплавленный карбид кальция сливают из печи в специальные изложницы, в которых он остывает и затвердевает. После затвердевания его дробят в щековых дробилках и сортируют в решетчатых барабанах на куски различной величины от 2 до 80 мм.
Выход кусков различных размеров при дроблении приведен ниже:
25-80 | 15-25 | 8-15 | 2-8 | до 2 |
66-80 | 8-10 | 6-14 | 4,5-6,5 | 1,5-3,0 |
Товарным карбидом кальция считается грануляцией от 2 до 100 мм. Карбидная пыль, получающаяся при дроблении, непригодна для нормальных ацетиленовых генераторов из-за слишком энергичного разложения водой, перегрева и опасности взрыва.
Зависимость удельного веса технического карбида кальция от содержания в нем СаС2, приведена в таблице ниже:
80 | 75 | 70 | 65 | 60 | 55 |
2,32 | 2,37 | 2,41 | 2.45 | 2,49 | 2,53 |
Технический карбид кальция, получаемый в электропечах, содержит ряд примесей, попадающих в него из исходных материалов, которыми пользуются при его производстве. Средний химический состав технического карбида кальция применяемого для сварки:
Карбид кальция (СаС2) | 72,5 |
Известь (СаО) | 17,3 |
Окись магния (MgO) | 0,4 |
Окись железа (Fe2O3) и окись алюминия (Al2O3) | 2,5 |
Окись кремния (SiO2) | 2,0 |
Сера (S) | 0,3 |
Углерод (С) | 1,0 |
Другие примеси | 4,0 |
Как видно из приведенного состава, основной примесью является известь.
Примеси, содержащиеся в исходных материалах, применяемых для производства, ухудшают его качество. Особенно вредными примесями являются фосфор и сера, которые переходят в карбид кальция в виде фосфористых и сернистых соединений кальция, а при разложении карбида попадают в ацетилен в виде фосфористого водорода и сероводорода.
При температуре 1000°С карбид кальция, взаимодействуя с азотом, образует цианамид кальция:
CaC2+N2=CaCN2+C
Эта реакция используется для промышленного производства цианамида кальция. Цианамид кальция применяется в качестве удобрения и как исходный продукт для получения цианидов.
С водородом карбид кальция вступает в реакцию при температуре выше 2200°С с образованием ацетилена и металлического кальция. При высокой температуре карбид кальция восстанавливает большинство окислов металлов.
Одним из промышленных способом получения ацетилена для газовой сварки и газовой резки является гидролиз карбида кальция т.е. разложение в воде.
При взаимодействии карбида кальция (CaC2) с водой (h3O) образовывается газ - ацетилен (C2h3) и гашеная известь (Ca(OH)2), являющуюся отходом. Химическая активность карбида кальция по отношению к воде столь велика, что он разлагается даже кристаллизационной водой, содержащейся в солях.
Экзотермическая реакция (т.е. с выделением тепла) взаимодействия карбида кальция с водой протекает бурно по уравнению:
CaC2+2h3O=C2h3+Ca(OH)2 +30,4 ккал/моль
Тепловой эффект разложения технического карбида кальция слагается из тепла, выделяемого при взаимодействии с водой карбида кальция и негашеной извести (содержащейся в карбиде кальция). Взаимодействие извести с водой протекает по уравнению:
СаО+h3O = Ca(OH)2 +15,2 ккал/моль
Выход ацетилена объем ацетилена в литрах, выделяемый при разложении 1 кг карбида, приведенный к 20° и 760 мм рт. ст.Для разложения 1 кг химически чистого карбида кальция теоретически необходимо 0,562 кг воды, при этом получается 0,406 кг ацетилена (285 л) и 1,156 кг гашеной извести.
Значительный тепловой эффект реакции разложения карбида кальция и опасность перегрева ацетилена заставляют вести процесс разложения карбида с большим избытком воды для охлаждения. Это делает процесс более безопасным. Температура выходящего из генератора ацетилена при этом превышает температуру окружающей среды всего на 10-15°С.
Минимальное количество воды, необходимое для охлаждения при разложении 1 кг карбида кальция, может быть рассчитано следующим образом.
При разложении 1 кг 70%-го карбида кальция образуется 0,284 кг ацетилена и 1,127 кг гидрата окиси кальци т.е. гашеной извести (принимая содержание окиси кальция в карбиде кальция равным 24%).
Принимаем, что начальная температура воды равна 15° С, а температура в генераторе во время работы равна 60° С. Уравнение теплового баланса для 1 кг карбида кальция выражается следующим образом:
q=q1+q2+q3+q4+q5
где q - количество тепла, выделяющееся при разложении 1 кг 70%-го карбида кальция, равное 397 ккал/кгq1 - количество тепла, затрачиваемое на нагревание получаемой гашеной извести с 15 до 60°С:q1= 1,127×(60-15)-0,23= 11,7 ккал0,23 - средняя теплоемкость гидрата окиси кальция в ккал/кг
q2 - количество тепла, затрачиваемое на нагревание получаемого ацетилена с 15 до 60° С:q2=0,284×(60-15)-0,336 = 4,3 ккал0,336 - средняя теплоемкость 1 кг ацетилена в ккал в указанном интервале температур
q3 - тепло, затрачиваемое на испарение воды в количестве 0,034 кг (при 60° С содержание водяных паров, насыщающих ацетилен, полученный из 1 кг карбида кальция, равно 34 г) скрытая теплота парообразования воды - 539 ккал/кгq3 = 0,034×539+0,034×1×(60-15) -19,9 ккал
q4 - потеря тепла в окружающую среду и на нагревание стенок генератора, она составляет примерно 7% от общего количества выделяющегося тепла:q4=397×7/100=27,8 ккал
q5 - количество тепла, расходуемое на нагревание воды до температуры 60° С:q5=q×(q1+q2+q3+q4)=397×(11,7+4,3+19,9+27,8) = 336,3 ккал
Искомый минимальный безопасный объем воды равен:
V=q5/(60-15)×1=336,3/45≈7,5 л
Так как 1 м3 ацетилена при абсолютном давлении 1 кгс/мм2 и 20°С весит 1,09 кг, следовательно, из 1 кг химически чистого карбида кальция теоретически можно получить 0,406/1,09 = 0,3725 м3, или 372,5 л ацетилена.
Как уже говорилось выше, технический карбид кальция обычно содержит не более 70-80% CaC2. Поэтому из 1 кг технического карбида кальция можно получить от 230 до 280 л ацетилена.
Если учесть потери ацетилена на растворение в воде и продувку ацетиленового генератора, то для получения 1 м3 (1000 дм3) ацетилена практически приходится расходовать 4,3-4,5 кг карбида кальция. Более точные данные о фактическом выходе ацетилена из технического карбида кальция в зависимости от количества примесей (сорта) и размеров "кусков" (грануляции) указаны в ГОСТ 1460.
Для Получение ацетилена из карбида кальция осуществляется в аппаратах, называемых ацетиленовыми генераторами.
Чем меньше размеры кусков карбида кальция, тем быстрее происходит его разложение.
Например: Карбид кальция размером 50×80 мм разлагается полностью в течение 13 мин, а размером 8×15 мм - в течение 6,5 мин.
При величине кусков менее 2 мм карбид кальция считается отходом и называется карбидной пылью. Карбидная пыль разлагается практически мгновенно. При взаимодействии с водой разложение карбидной пыли происходит на поверхности воды и выделяемое тепло не может быть быстро отведено. Это приводит к повышению температуры в зоне реакции и перегреву частиц карбида и выделяющегося ацетилена. При этом особенно опасно присутствие воздуха, так как быстро достигается температура воспламенения ацетилено-воздушной смеси. Поэтому карбидную пыль нельзя применять в обычных ацетиленовых генераторах, рассчитанных для работы на кусковом карбиде кальция, так как это может вызвать взрыв ацетилена в генераторе. Для разложения карбидной пыли применяют генераторы специальной конструкции.
Чем выше температура воды, тем быстрее идет разложение карбида кальция. Если вода сильно загрязнена гашеной известью, образующейся при разложении карбида кальция, то реакция разложения замедляется.
При разложении неподвижного карбида кальция в недостаточном количестве воды куски его могут покрываться коркой гашеной извести и сильно перегреваться, при этом может иметь место реакция:
СаС2+Ca(ОН)2 = C2h3+2СаО
В этом случае разложение карбида кальция происходит за счет отнятия влаги, содержащейся в гашеной извести. В результате повышается плотность корки, что приводит к еще большему перегреву. Поэтому непрерывное удаление извести из зоны реакции имеет большое значение, так как перегрев карбида кальция может привести к взрыву ацетилено-воздушной смеси или вызвать взрывчатый распад ацетилена.
Если производить разложение одинаковых количеств карбида кальция различными постепенно уменьшающимися количествами воды, то температура получаемой смеси ацетилен - водяной пар будет соответственно повышаться. При температуре около 90°С почти все тепло (за исключением тепла, затрачиваемого на нагревание ацетилена и карбидного ила) расходуется на образование водяного пара. Эти условия разложения соответствуют процессу, при котором получается сухой гидрат окиси кальция, поскольку вся вводимая в реакцию вода расходуется на разложение карбида и образование водяного пара.
При погружении карбида кальция в воду процесс разложения протекает также весьма неравномерно: вначале реакция идет очень активно с бурным выделением ацетилена, а затем скорость реакции уменьшается. Это объясняется уменьшением поверхности кусков и тем, что они покрываются коркой извести, препятствующей свободному доступу воды.
При перемешивании воды с находящимся в ней карбидом кальция разложение происходит быстрее и равномернее.
Скорость разложения карбида кальция в воде зависит от чистоты карбида кальция и поверхности соприкосновения кусков карбида кальция с водой.
Скорость разложения карбида кальция в воде является весьма важным элементом, характеризующим качество карбида кальция. Для практических целей пользуются понятием продолжительности разложения.
Продолжительностью разложения карбида кальция считают время, в течение которого выделяется 98% от всего количества ацетилена, который может быть выделенным из карбида кальция, так как остаток разлагается очень медленно и не характеризует процесс разложения применительно к условиям работы ацетиленовых генераторов.
В таблице ниже приведены экспериментальные данные о продолжительности разложения карбида кальция в зависимости от размеров его кусков.
Пыль | 2/4 | 5/8 | 8/15 | 15/25 | 25/50 | 50/80 |
Несколько секунд | 1,17 | 1,65 | 1,82 | 4,23 | 13,5 | 16,6 |
Следует, оговорить, что данные таблицы характеризуют лишь те образцы карбида кальция, с которыми были проведены опыты. Практически могут иметь место значительные отклонения, главным образом в сторону уменьшения скорости разложения.
Скорость разложения карбида кальция в значительной степени зависит от выхода ацетилена из карбида кальция. Чем ниже выход, тем меньше скорость разложения.
На диаграмме ниже показаны изменения в скорости разложения карбида кальция двух сортов с одинаковыми размерами кусков (25/50).

Например: При разложении 1 кг карбида кальция с выходом ацетилена 263 л/кг за первые 3 мин. выделяется 220 л ацетилена, а соответственно при выходе 226 л/кг - только 150 л.
weldering.com
свойства и применение. Получение ацетилена :: SYL.ru
Карбиды – это группа неорганических соединений углерода с металлами, а также с кремнием или бором (поскольку эти элементы проявляют металлические свойства). Карбид кальция – одно из наиболее востребованных веществ этой группы. О свойствах и применении соединения читайте ниже.
История получения
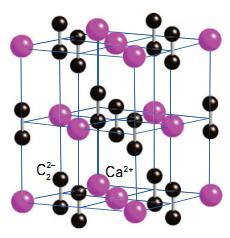
Карбид кальция – соединение, получившее широкое применение в современной промышленности. В 1862 году немецкий химик Фридрих Велер впервые синтезировал молекулу этого вещества. Получение карбида кальция он осуществил следующим образом. Ученый приготовил расплав кальция с цинком, а затем нагрел его с углем. В результате получился карбид. Химическая формула соединения – CaC2.Промышленный способ получения карбида предложил ученый Муассан в 1892 году. Другие названия вещества – ацетиленид кальция, или углеродистый кальций. Кристаллическая решетка соединения выглядит следующим образом:
Физические свойства
По своим физическим свойствам карбид кальция является кристаллическим веществом с температурой плавления 2300 оС. Эта цифра является справедливой лишь для чистого соединения. Карбид, содержащий примеси, может иметь другие показатели температуры плавления. Основное агрегатное состояние вещества – твердое, а цвет варьирует от серого до коричневого.
Химические свойства
Карбид кальция хорошо впитывает воду. Этот процесс сопровождается химической реакцией разложения. Важно, что карбидная пыль обладает раздражающим действием на слизистые оболочки, кожу и органы дыхания. Поэтому во время работы с соединением необходимо использовать противогазы либо противопылевые респираторы. С кислородом карбид кальция взаимодействует при высокой температуре с образованием карбоната кальция. Реакция с азотом приводит к синтезу цианамида кальция. Также при высоких температурах карбид кальция вступает в реакции соединения с хлором, фосфором, мышьяком. Но все-таки одним из важнейших свойств соединения считается разложение водой.

Получение
Производство карбида кальция заключается в следующем. Негашеную известь и предварительно измельченный кокс смешивают. Полученную смесь подвергают расплавлению в электрических печах. Кокс и оксид кальция берутся в равных по массе частях. Процесс происходит при температуре 1900 оС. Расплав выходит из печи и в дальнейшем разливается по специальным формам. Затем уже затвердевший карбид кальция дробят и сортируют по размеру кусков. Гранулы вещества разделяются на четыре фракции в соответствии с их размерами: 25×80, 15×25, 8×15, 2×8, которые определяются ГОСТом 1460-56. По своему составу технический карбид кальция содержит 75-80% основного вещества. На долю примесей, таких, как углерод, известь и других, приходится до 25% от общей массы полученной смеси. Кроме того, содержащийся в техническом карбиде сульфид и фосфид кальция обусловливают довольно неприятный его запах. Представим реакцию получения СаС2: СаО + 3С → СаС2 + СО↑. Образование ацетиленида кальция сопровождается поглощением тепла. Поэтому логично предположить, что реакция его разложения, напротив, идет с выделением энергии.

Транспортировка и хранение
По причине того, что влага моментально разлагает карбид с выделением большого количества тепла и образованием взрывоопасного газа ацетилена, хранить вещество необходимо в герметично закупоренных барабанах или бидонах. Следует помнить, что ацетилен легче воздуха и способен скапливаться в верхних зонах помещения. Этот газ, помимо наркотического действия, обладает способностью к самовоспламенению. Поэтому использовать карбид кальция необходимо с большой осторожностью. Расфасовке на производстве уделяется особое внимание. Готовое вещество помещается в специальные барабаны (тара, напоминающая консервные банки). Такая упаковка требует аккуратного вскрытия. При этом должен использоваться инструмент, не приводящий к образованию искр (молоток или специальный нож). В случае попадания карбида на кожу или слизистые оболочки необходимо немедленно промыть пораженный участок водой и обработать место вазелином или жирным кремом. Транспортировка соединения осуществляется с использованием только крытых видов транспорта. Воздушная доставка карбида запрещена. Помещения, где хранится СаС2, должны быть хорошо проветриваемыми. Также не разрешается хранить карбид совместно с другими химическими веществами. Это может привести к нежелательным, а, возможно, и опасным, реакциям. Срок хранения карбида составляет полгода.

Применение
Область применения карбида кальция чрезвычайно широка. В первую очередь это промышленный синтез. Карбид кальция используется для производства синтетического каучука, уксусной кислоты, ацетона, этилена, винилхлорида, стирола. Также он находит применение в получении цианамида кальция. Это вещество ценно своим использованием в синтезе различных удобрений и цианистых веществ. В сельском хозяйстве любому агроному известно такое название, как карбидно-карбамидный регулятор. Он применяется для регуляции роста растений. А для его получения также используется карбид кальция. Кроме того, это соединение находит применение в процессе производства цианамида кальция. Эта реакция основана на нагревании карбида кальция с азотом. Восстановление щелочных металлов также не обходится без применения описываемого нами вещества. Карбид кальция применяется и в процессе газосварки. Например, широко используются карбидные лампы. Принцип их работы основан на взаимодействии в специальной емкости карбида с водой и сгорании на выходе из аппарата конечного вещества реакции – ацетилена. Посмотрите на фото карбидной лампы.

Производство ацетилена
Одной из важнейших областей применения карбида кальция является его использование в получении ацетилена. Заслуга в открытии этого способа также принадлежит немецкому ученому-химику Фридриху Велеру. В основе этого промышленного процесса лежит реакция разложения карбида под воздействием воды. СаС2 + 2 Н2О → С2Н2 + Са(ОН)2↓.На выходе образуется газ ацетилен и гашеная известь, выпадающая в осадок. Процесс сопровождается выделением большого количества тепла. Объем газа на выходе зависит от того, насколько чистый используется для реакции карбид кальция. Ацетилен, образующийся в результате, может иметь различный объем – 1 кг исходного вещества может дать от 235 до 290 литров газа. Что касается скорости протекания реакции, то она зависит как от малого процента примесей в карбиде кальция, так и от температуры воды, а также ее чистоты. Если рассматривать теоретическую реакцию производства ацетилена из карбида, то в ней на 1 кг карбида достаточно 560 мл воды. Однако на практике объем воды для проведения реакции увеличивается. На 1 кг карбида кальция в условиях промышленного синтеза требуется от 5 до 20 литров воды. Такое количество необходимо для того, чтобы ацетилен лучше охлаждался, а также для обеспечения оптимальной безопасности при работе. Ниже изображен немецкий химик Фридрих Велер.

Лабораторный опыт получения ацетилена
Многим из школьных уроков химии знакома реакция взаимодействия карбида с водой. Обычно этот опыт позволяет продемонстрировать реакцию получения ацетилена, а также физические и химические его свойства. Процесс выделения газа при этом происходит достаточно бурно, поэтому трубка, отводящая ацетилен из колбы с действующими веществами, помещается в чашу с водой. Это обеспечивает менее активное и стремительное движение газа. Кроме того, в лабораторных условиях можно использовать и другой способ, чтобы сделать не слишком бурной реакцию разложения такого соединения, как карбид. Ацетилен при этом идет равномерно и спокойно. Для этого вместо воды необходимо взять насыщенный раствор поваренной соли. Также в лаборатории при проведении этой реакции следует осторожно добавлять воду в карбид, помещенный в объемную колбу, а не наоборот.
www.syl.ru
Карбид кальция
В результате взаимодействия углерода с металлами при высоких температурахполучаются карбиды. Например, карбид кальция: Ca + 2C → CaC2. Из всех карбидов он имеет наибольшее практическое значение. Чистый CaC2 — хорошо кристаллизующееся твердое вещество, бесцветные кристаллы образованы ионами Ca2+ и C2-. Другие его названия — ацетиленид кальция или углеродистый кальций. Молярная масса равняется 64,1 г/моль. Он не летуч и не растворим ни в одном из известных растворителей, а под действием воды разлагается. Плотность его составляет 2,22 г/см³. Температура плавления равняется 2160°С, а кипения — 2300°С. По степени воздействия на организм относится к веществам чрезвычайно опасным (1-й класс опасности).
Впервые ацетиленид кальция был получен в 1862 году немецким химиком Фридрихом Велером при нагревании с углем сплава из цинка и кальция. Им же была описана реакция углеродистого кальция с h3O. Даже с ее следами (например, с атмосферной влагой) карбид кальция реагирует энергично, с выделением большого количества тепла. Но в случае недостатка воды может произойти самовоспламенение образующегося ацетилена. Карбид кальция бурно взаимодействует с разбавленными неорганическими кислотами и водными растворами щелочей. При этом также происходит выделение ацетилена. Являясь сильным восстановителем, CaC2 способен восстанавливать все оксиды металлов до карбидов или чистых металлов.
Получение карбида кальция удобнее не из самого кальция, а его окисла. При высокой температуре (от 2000 до 2300°С) происходит его восстановление. При этом металл и углерод соединяются: CaO + 3C → CO↑ + CaC2. Процесс протекает в электродуговой печи, где накаливают смесь негашеной извести и кокса или антрацита. Технический продукт окрашен, имеет сероватый цвет, так как содержит примеси в виде свободного углерода, окиси, а также сульфида, фосфида кальция и других химических соединений. Массовая доля CaC2 в нем составляет 80—85%.
При взаимодействии карбидов с водой выделяется или металл, или ацетилен. По второму варианту с водой реагирует карбид кальция. Ацетилен, полученный в результате реакции, которая имеет промышленное значение: 2h3O + CaC2 → C2h3 + Ca(OH)2, является техническим и имеет неприятный запах, так как содержит ряд примесей (Nh4, h3S, Ph4 и другие). Хотя в чистом виде он является бесцветным газом с характерным слабоватым запахом, и он довольно хорошо растворяется в воде. Имеет большое значение для получения цианамида кальция (является сырьем в производстве цианистых соединений или применяется в качестве удобрения) из карбида взаимодействием его с азотом по уравнению реакции: N2 + CaC2 → CaCN2 + C.
В прошлом CaC2 широко использовался в карбидных лампах, где служил источником ацетиленового пламени. В настоящее время применение такого источника света ограничивается в основном спелеологией, его используют также в бакенах и маяках. Другие важные направления применения CaC2 — это химические технологии, где он является сырьем. Например, в производстве продуктов органического синтеза, главным из них является каучук синтетический. Также из углеродистого кальция получают ацетиленовую сажу, винилхлорид, уксусную кислоту, акрилонитрил, этилен, ацетон, искусственные смолы, стирол. В металлургии служит для раскисления металлов и десульфурации (снижение содержания кислорода и серы соответственно). Карбид кальция используют для изготовления регулятора роста растений, порошкового карбидного реагента (ацетиленовая сварка).
Получение каждой тонны CaC2 требует примерно 3 тысячи квт/час электроэнергии. Поэтому оно оправдано при наличии низких цен на нее. Однако в целом мировое производство углеродистого кальция растет. Если в 70-х годах предшествующего столетия ежегодно вырабатывалось до 5 миллионов тонн, то в нашем веке это количество выросло примерно вдвое. Так, в Китае производство ацетилена на основе карбида кальция является основным источником сырья для химической промышленности, в частности, для производства поливинилхлорида. Получение ацетилена из своего сырья экономичнее, чем при использовании импортной нефти. Поэтому производство его в Китае растет. В 2005 году оно достигало 8,94 миллионов тонн, и была реальная возможность выпускать 17 миллион тонн.
В отличие от Китая, в США, Европе и Японии потребление углеродистого кальция, как правило, снижается. Уровень его производства в США в 90-х годах составлял всего 236 тысяч тонн в год. В нашей стране карбид кальция выпускают по техническим условиям, изложенным в ГОСТ 1460-81. Основные его потребители — это Украина, Узбекистан, Румыния и Словакия. Из-за высокой энергоемкости продукта и в связи с ростом цен на электроэнергию потребление ацетиленида кальция в России и странах-экспортерах снизилось вдвое.
fb.ru
карбид вода Видео

2 г. назад
Карбид кальция - твердый, кристалический. При взаимодействии с водой карбид кальция разлагается с бурным...

5 г. назад
ВЗРИВ КАРБИТА.

11 мес. назад
В результате реакции карбида кальция и воды выделяется взрывоопасный газ ацетилен, так что нет ничего удив...

1 г. назад
Канал Sumy Racing Team https://www.youtube.com/channel/UCAQ0NDHKIw4nTyFhgQzUr1Q?sub_confirmation=1 Канал Дмитрия ...

9 г. назад
P.S. Видео не моё :)

2 г. назад
Смотри как мы сделали Нафаню - https://www.youtube.com/watch?v=MvhSKzBUSh5 Не пытайся повторить увиденное! Взрыв в момент пуска...

7 мес. назад
Взрывы, опасные моменты ожидают тебя сейчас.

2 г. назад
очень большие шары для экспериментов и взрывов http://ali.pub/1nn0v7 Канал MAD SCIENCE - https://www.youtube.com/user/MegaPeaceDuke Не пытай...

2 г. назад
ONTIME мгновенные займы https://bitly.com/ontimemoneys Ньютон Парк http://vk.com/newtonpark Клуб программистов https://vk.com/pascalclub_khv ...

2 г. назад
Вы же хотите больше взрывов? Пишите комментарий с #ХочуВзрыв □Очень полезные ссылки(можете подписаться...

6 мес. назад
Права у канала kreosan.

2 г. назад
Отличная РАСЧЕСКА-ВЫПРЯМИТЕЛЬ: http://hair1.shops-zone.ru/ Что будет если в кока колу добавить карбид? Эпичный взрыв,...

4 г. назад
мини ядерный взрыв!

2 г. назад
Сотрудничество - [email protected] Автор Вконтакте - https://vk.com/id206285614 Группа - https://vk.com/slivkishow Одноклассники - https://ok.ru/...

2 г. назад
Что такое карбид и с чем его взрывают | Негашеная известь и вода | Где и как найти карбид | Взрыв Карбид кальц...

4 г. назад
Кусок около 150 грамм натрия бросили в реку. Для удобства броска к натрию привязали камень, но в момент броска...

1 г. назад
В БУТИЛКУ КИНУЛ КАРБИТ И ЗАЛИЛ ВОДУ ВОТ ШТО ПОЛУЧИЛОСЬ,МЕГА БОМБА.

5 г. назад
FACEBOOK: https://www.facebook.com/miCCCP MADE IN CCCP Присоединяйся к нам! Все Ссылки на: [email protected] WEB: ...
video-kroft.ru
Карбид: формула, применение и свойства
На свете известно очень много разных химических соединений: порядка сотни миллионов. И все они, как люди, индивидуальны. Нельзя найти два вещества, у которых совпадали бы химические и физические свойства при разном составе.
Одними из интереснейших неорганических веществ, существующих на белом свете, являются карбиды. В данной статье мы обсудим их строение, физические и химические свойства, применение и разберём тонкости их получения. Но для начала немного об истории открытия.

История
Карбиды металлов, формулы которых мы приведём ниже, не являются природными соединениями. Это обусловлено тем, что их молекулы склонны распадаться при взаимодействии с водой. Поэтому здесь стоит говорить о первых попытках синтеза карбидов.
Начиная с 1849 имеются упоминания о синтезе карбида кремния, однако некоторые из этих попыток остаются непризнанными. Крупномасштабное производство начал в 1893 году американский химик Эдвард Ачесон по способу, который был затем назван его именем.
История синтеза карбида кальция также не отличается большим количеством сведений. В 1862 году его получил немецкий химик Фридрих Вёлер, нагревая сплавленный цинк и кальций с углём.
Теперь перейдём к более интересным разделам: химическим и физическим свойствам. Ведь именно в них заключена вся суть применения данного класса веществ.

Физические свойства
Абсолютно все карбиды отличаются своей твёрдостью. Например, одним из самых твёрдых веществ по шкале Мооса является карбид вольфрама (9 из 10 возможных баллов). К тому же эти вещества очень тугоплавкие: температура плавления некоторых из них достигает двух тысяч градусов.
Большинство карбидов химически инертны и взаимодействуют с небольшим количеством веществ. Они не растворимы ни в каких растворителях. Однако растворением можно считать взаимодействие с водой с разрушением связей и образованием гидроксида металла и углеводорода.
О последней реакции и многих других интересных химических превращениях с участием карбидов мы поговорим в следующем разделе.

Химические свойства
Почти все карбиды взаимодействуют с водой. Какие-то - легко и без нагревания (например, карбид кальция), а какие-то (например, карбид кремния) - при нагревании водяного пара до 1800 градусов. Реакционная способность при этом зависит от характера связи в соединении, о котором мы поговорим позже. В реакции с водой образуются разные углеводороды. Происходит это потому, что водород, содержащийся в воде, соединяется с углеродом, находящимся в карбиде. Понять, какой углеводород получится (а может получиться как предельное, так и непредельное соединение), можно, исходя из валентности содержащегося в исходном веществе углерода. Например, если у нас есть карбид кальция, формула которого CaC2, мы видим, что он содержит ион C22-. Значит, к нему можно присоединить два иона водорода с зарядом +. Таким образом, получаем соединение C2h3 - ацетилен. Таким же образом из такого соединения, как карбид алюминия, формула которого Al4C3, получаем Ch5. Почему не C3h22, спросите вы? Ведь ион имеет заряд 12-. Дело в том, что максимальное количество атомов водорода определяется формулой 2n+2, где n - количество атомов углерода. Значит, может существовать только соединение с формулой C3H8 (пропан), а тот ион с зарядом 12- распадается на три иона с зарядом 4-, которые и дают при соединении с протонами молекулы метана.
Интересными представляются реакции окисления карбидов. Они могут происходить как при воздействии сильных смесей окислителей, так и при обыкновенном горении в атмосфере кислорода. Если с кислородом всё понятно: получаются два окисда, то с другими окислителями интереснее. Всё зависит от природы металла, входящего в состав карбида, а также от природы окислителя. Например, карбид кремния, формула которого SiC, при взаимодействии со смесью азотной и плавиковой кислот образует гексафторкремниевую кислоту с выделением углекислого газа. А при проведении той же реакции, но с одной только азотной кислотой, получаем оксид кремния и углекислый газ. К окислителям также можно отнести галогены и халькогены. С ними взаимодействует любой карбид, формула реакции зависит только от его строения.
Карбиды металлов, формулы которых мы рассмотрели - далеко не единственные представители этого класса соединений. Сейчас мы подробнее рассмотрим каждое промышленно важное соединение этого класса и затем поговорим об их применении в нашей жизни.

Какие бывают карбиды?
Оказывается, карбид, формула которого, скажем, CaC2, существенно отличается по строению от SiC. И отличие это прежде всего в характере связи между атомами. В первом случае мы имеем дело с солеобразным карбидом. Назван этот класс соединений так потому, что ведёт себя фактически как соль, то есть способен диссоциировать на ионы. Такая ионная связь очень слабая, что и позволяет легко проводить реакцию гидролиза и многие другие превращения, включающие взаимодействия между ионами.
Другим, наверное, более промышленно важным видом карбидов являются ковалентные карбиды: такие как, например, SiC или WC. Они отличаются высокой плотностью и прочностью. А также тугоплавки и инертны к разбавленным химическим веществам.
Существуют также металлоподобные карбиды. Их скорее можно рассматривать как сплавы металлов с углеродом. Среди таких можно выделить, например, цементит (карбид железа, формула которого бывает разной, но в среднем она примерно такая: Fe3C) или чугун. Они имеют химическую активность, промежуточную по своей степени между ионными и ковалентными карбидами.
Каждый из этих подвидов обсуждаемого нами класса химических соединений имеет своё практическое применение. О том, как и где применяется каждый из них, мы поговорим в следующем разделе.

Практическое применение карбидов
Как мы уже обсудили, ковалентные карбиды имеют самый большой диапазон практических применений. Это и абразивные и режущие материалы, и композиционные материалы, используемые в разных областях (например, в качестве одного из материалов, входящих в состав бронежилета), и автодетали, и электронные приборы, и нагревательные элементы, и ядерная энергетика. И это далеко не полный список применений этих сверхтвёрдых карбидов.
Самое узкое применение имеют солеобразующие карбиды. Их реакцию с водой используют как лабораторный способ получения углеводородов. То, как это происходит, мы уже разобрали выше.
Наравне с ковалентными, металлоподобные карбиды имеют широчайшее применение в промышленности. Как мы уже говорили, таким металлоподобным видом обсуждаемых нами соединений являются стали, чугуны и прочие соединения металлов с вкраплениями углерода. Как правило, металл, находящийся в таких веществах, относится к классу d-металлов. Именно поэтому он склонен образовывать не ковалентные связи, а как бы внедряться в структуру металла.
На наш взгляд, практических применений у вышеперечисленных соединений более чем достаточно. Теперь взглянем на процесс их получения.
Получение карбидов
Первые два вида карбидов, которые мы рассмотрели, а именно ковалентные и солеобразные, получают чаще всего одним простым способом: реакцией оксида элемента и кокса при высокой температуре. При этом часть кокса, состоящего из углерода, соединяется с атомом элемента в составе оксида, и образует карбид. Другая часть "забирает" кислород и образует угарный газ. Такой способ очень энергозатратен, так как требует поддержания высокой температуры (порядка 1600-2500 градусов) в зоне реакции.
Для получения некоторых видов соединений используют альтернативные реакции. Например, разложение соединения, которое в конечном итоге даёт карбид. Формула реакции зависит от конкретного соединения, поэтому обсуждать её мы не будем.
Прежде чем завершить нашу статью, обсудим несколько интересных карбидов и поговорим о них подробнее.
Интересные соединения
Карбид натрия. Формула этого соединения C2Na2. Это можно представить скорее как ацетиленид (то есть продукт замещения атомов водорода в ацетилене на атомы натрия), а не карбид. Химическая формула полностью не отражает этих тонкостей, поэтому их надо искать в строении. Это очень активное вещество и при любом контакте с водой очень активно взаимодействует с ней с образованием ацетилена и щёлочи.
Карбид магния. Формула: MgC2. Интересны способы получения этого достаточно активного соединения. Один из них предполагает спекание фторида магния с карбидом кальция при высокой температуре. В результате этого получаются два продукта: фторид кальция и нужный нам карбид. Формула этой реакции достаточно проста, и вы можете при желании ознакомиться с ней в специализированной литературе.
Если вы не уверены в полезности изложенного в статье материала, тогда следующий раздел для вас.

Как это может быть полезно в жизни?
Ну, во-первых, знание химических соединений никогда не может быть лишним. Всегда лучше быть вооружённым знанием, чем остаться без него. Во-вторых, чем больше вы знаете о существовании определённых соединений, тем лучше понимаете механизм их образования и законы, которые позволяют им существовать.
Перед тем как перейти к окончанию, хотелось бы дать несколько рекомендаций по изучению этого материала.

Как это изучать?
Очень просто. Это ведь всего лишь раздел химии. И изучать его следует по учебникам химии. Начните со школьных сведений и переходите к более углублённым, из университетских учебников и справочников.
Заключение
Эта тема не такая простая и скучная, как кажется на первый взгляд. Химия всегда может стать интересной, если вы найдёте в ней свою цель.
fb.ru
Карбид кальция взаимодействие с водой
Реакция гидратации карбида кальция с образованием ацетилена представляет экзотермическую необратимую гетерогенную реакцию взаимодействия карбида кальция с водой [c.248]При взаимодействии карбида кальция с водой образуется газ ацетилен СоНг [c.435]
Ацетилен получают взаимодействием карбида кальция с водой. Определить объем ацетилена при 24°С и 780 мм рт. ст., полученного из 340 г карбида кальция, содсржащего % примесей. [c.60]
При взаимодействии карбида кальция с водой выделяется горючий газ — ацетилен [c.327]Производство ацетиленовой элементной сажи состоит из трех участков. Первый участок —карбидное отделение, в котором из известняка и угля при высокой температуре в печах получают карбид кальция. Второй — ацетиленовая станция — представляет собой участок, состоящий из ацетиленовых генераторов, в которых при взаимодействии карбида кальция с водой образуется ацетилен. Газообразный ацетилен проходит через компрессоры, которые подают его под давлением на третий участок —в реакторное отделение. Реакторы представляют собой вертикальные герметично закрытые аппараты, выдерживающие высокое давление. Ацетилен поджигается электрической искрой и взрывается внутри реакторов. При взрыве происходит разложение ацетилена на водород и сажу. Готовую сажу упаковывают в мешки из крафтбумаги. [c.60]
Сколько литров ацетилена при 300 К и 202 кПа образуется при взаимодействии 230 г карбида кальция с водой [c.9]
Получение. В лабораторных условиях самым распространенным способом получения ацетилена служит взаимодействие карбида кальция с водой [c.200]
Пока цилиндр наполняется хлором, берут пробирку с водой, опускают в нее кусочек карбида кальция и закрывают быстро пробкой с газоотводной трубкой. В результате взаимодействия карбида кальция с водой выделяется ацетилен [c.257]
Взаимодействие карбида кальция с водой может быть описано двумя уравнениями [c.146]
Метод основан а (взаимодействии карбида кальция с водой. Реакция протекает по уравнению [c.226]
АЦЕТИЛЕН. Ацетилен получают взаимодействием карбида кальция с водой. Исходным веществом служит известняк. [c.359]
Ацетилен, образующийся при взаимодействии карбида кальция с водой, выталкивает воду из внутреннего сосуда 2 с дырчатым дном в пространство / между внутренним [c.625]
Метод основан на измерении объема ацетилена, выделяющегося при взаимодействии карбида кальция с водой,содержащейся в анализируемом продукте [c.96]
Получение ацетилена из карбида кальция. Сущность карбидного метода заключается во взаимодействии карбида кальция с водой (стр. 132). [c.139]
Наиболее часто ацетилен получают по реакции взаимодействия карбида кальция с водой и из природных газов и нефтепродуктов путем термического разложения. [c.205]
Запись данных опыта. Описать проделанную работу. Ответить на вопросы, поставленные в процессе выполнения работы. Написать уравнения реакций получения ацетилена взаимодействием карбида кальция с водой полного и неполного сгорания ацетилена. [c.181]
Из химических методов наиболее известен метод, основанный на взаимодействии карбида кальция с водой по реакции [c.161]
При определении по этому методу возможна ошибка, так как при взаимодействии карбида кальция с водой образуется также оксид кальция, который покрывает карбид и изолирует его поверхность от непосредственного воздействия водяного пара. [c.161]
Имеются вещества, которые могут вызвать воспламенение при соприкосновении с водой, например щелочные металлы (металлические натрий и калий), карбид кальция, алюминийалкилы и др. Металлические натрий и калий при взаимодействии с водой выделяют водород и значительное количество тепла, поэтому водород самовоспламеняется. При взаимодействии карбида кальция с водой выделяется ацетилен, воспламеняющийся от теплоты реакции. Для предохранения от влаги карбид кальция хранят и транспортируют в стальных герметически закупоренных барабанах. Алюминийалкилы хранят под подушкой инертных газов. [c.148]
Тепловой эффект взаимодействия карбида кальция с водой [c.29]
Вес водяного пара. Если принять выход ацетилена равным 250 л/кг, то для образования Т ж ацетилена теоретически потребуется 4,0 кг карбида кальция. При взаимодействии указанного количества карбида кальция с водой выделится 381 -4 = 1524 ккал м . [c.29]
Методика основана на реакции взаимодействия карбида кальция с водой. [c.399]
К этому времени производство карбида кальция было уже достаточно хорошо изучено, так как он имеет большое самостоятельное значение в технике. При взаимодействии карбида кальция с водой выделяется газообраз- [c.76]
Запись данных опыта. Ответить на вопросы. Написать уравнения реакций получения ацетилена взаимодействием карбида кальция с водой и полного и неполного сгорания ацетилена. [c.214]
Карбид кальция взаимодействует с водой по уравнению [c.153]
При взаимодействии карбида кальция с водой при температуре 20° и нормальном давлении из 1 г воды образуется 667,8 мл ацетилена. Так как обычно определение влажности проводят при температурах, близких к 20°, то для приближенного вычисления, обычно удовлетворяющего требованиям технического анализа, эту величину можно ввести в предыдущую формулу (при приближенном вычислении отклонениями атмосферного давления от 760 мм рт. ст. также пренебрегают) тогда формула будет иметь следующий вид [c.25]
Технический карбид кальция — порошок или спек серого цвета, содержащий (примерно) 72,5 — 81% СаСг- Карбид кальция — исходный материал для получения ацетилена, который образуется при взаимодействии карбида кальция с водой [c.226]
Ацетиленовые генераторы служат для производства ацетилена путем взаимодействия карбида кальция н воды. По ГОСТ 5190-57 ацетиленовые генераторы делятся на три группы [c.223]
Сам ацетилен получается в промышленности при взаимодействии карбида кальция с водой СаС2+2Н О — С,Нг+Са(ОН), [c.142]
Карбид кальция обработан водой. Полученное органическое соединение снова обработано водой в присутствии сульфата ртути. Одна часть образовавшегося соединения восстановлена, а другая окислена. Какие вещества получились Какое соединение и в каких условиях можно получить при взаимодействии этих двух веществ Шписать схемы протекающих реакций. [c.427]
Для определения содержания воды в фенольных смолах применяют также карбидный метод, заключаюгцийся в следующем в закрытом сосуде, соединенном с прецизионным манометром, карбид кальция взаимодействует с водой с образованием ацетилена [c.95]
КарбггД кальция, Форберс [76] проводил предварительную химическую реакцию для повышения чувствительности анализа по сравнению с прямыми измерениями для определения воды в углеводородах. Содержание ацетилена, образовавшегося при взаимодействии карбида кальция с водой (см. гл. 2), определялось при 3,05 мкм (валентные колебания групп=С—Н). Коэффициент поглощения составляет 89 л/(моль-см). [c.446]
Шлек и сотр. [15] при определении 1—2% воды в метаноле использовали насыщенный криптоном карбид кальция [15]. Общая активность крипотона-85, освобождающегося при взаимодействии карбида кальция с водой (по счетчику Гейгера) пропорциональна количеству воды в образце. Были построены градуировочные графики, связывающие наблюдаемую радиоактивность с процентным содержанием воды. Радиоактивность, измеряемая в данном методе, различна для разных партий карбида кальция, насыщенного радиоактивным криптоном, поэтому для канедой новой партии необходимо калибровать прибор заново. [c.533]
Производство карбида кальция. В середине 60-х годов производство карбида кальция на основе угля (кокса) и известняка достигало 10 млн. т/год. Это объясняется тем, что ацетилен, получаемый при взаимодействии карбида кальция с водой, широко применялся в сварочной технике и в химической промышленности для производства этанола, уксусной кислоты и уксусного ангидрида, ацетальдегида, ацетона, цианамида кальция, винилхлорида и других продуктов органического синтеза. В 1974 г. производство карбида кальция снизилось до 3 млн. т/год в связи с расширением использования для указанных производств этилена, получаемого из дешевого нефтяного сырья. В настоящее время вновь рассматривается вопрос о производстве ацетилена, который может быть получен путем взаимодействия угля с известняком при 2000—2200 °С [16, с. 76], газификации угля и пиролиза образующегося при этом метана, гидрирования угля с последующей конверсией гидро-генизата в ацетилен в плазменном или дуговом реакторах, а также путем вдувания потоком водорода угольной пыли в электродуговой реактор с быстрой закалкой выделяющихся газов [50], На основании теоретических разработок и усовершенствования аргонового и аргоноводородного плазменных реакторов максимальный выход ацетилена составляет 59 г/(кВт- ч), степень превращения углерода в С2Н2 достигает 14% [51]. [c.22]
Скорость взаимодействия карбида кальция с водой может быть значительно снижена, если поверхность мелких кусков карбида и пыли покрыта слоем нефтепродуктов. Этот способ известен в литературе. Аналогичное предложение было внесено в 1954 г.П.И.Печатным и Г. С. Новицкасом, рекомендовавшими применение для этой цели машинного масла. [c.50]
chem21.info
Карбид кальция разложение водой - Справочник химика 21
Ацетилен получают разложением карбида кальция водой в ацетиленовых генераторах. При методе вода на Карбид разложение проводят в генераторах, в которые воду подают на движущийся по полкам карбид, а из аппарата выводят известь-пушонку. При методе карбид в воду карбид подают в избыток воды, а известь выводят в виде шламовых вод. Ацетилен из карбида кальция получается высокой концентрации с незначительным кО личеством примесей (НгЗ, РНз, ННз), от которых ацетилен очищают раствором щелочи, серной кислотой или гипохлоритом натрия. Влажный или осушенный ацетилен (в зависимости от потребителя) направляют на дальнейшую переработку или в баллоны. [c.25] При погружении карбида кальция в воду процесс разложения протекает неравномерно. Вначале реакция идет очень активно, с бурным выделением ацетилена, а затем скорость ее снижается. Это объясняется уменьшением поверхности кусков карбида кальция и тем, что они покрываются коркой извести, препятствующей свободному доступу воды к частицам карбида. [c.29]Производство ацетиленовой элементной сажи состоит из трех участков. Первый участок —карбидное отделение, в котором из известняка и угля при высокой температуре в печах получают карбид кальция. Второй — ацетиленовая станция — представляет собой участок, состоящий из ацетиленовых генераторов, в которых при взаимодействии карбида кальция с водой образуется ацетилен. Газообразный ацетилен проходит через компрессоры, которые подают его под давлением на третий участок —в реакторное отделение. Реакторы представляют собой вертикальные герметично закрытые аппараты, выдерживающие высокое давление. Ацетилен поджигается электрической искрой и взрывается внутри реакторов. При взрыве происходит разложение ацетилена на водород и сажу. Готовую сажу упаковывают в мешки из крафтбумаги. [c.60]
Скорость разложения карбида кальция в воде зависит от состава карбида кальция, величины поверхности соприкосновения кусков, карбида кальция с водой, температуры воды, содержания в ней ила и других факторов. [c.30]
Время отстаивания карбидного ила зависит от количества воды, затраченной на разложение карбида кальция. В воде, полученной при отстаивании ила, содержится растворенный ацетилен кроме того, часть ацетилена адсорбируется мелкодисперсными частицами ила. При хранении ила количество содержащегося в нем ацетилена постепенно уменьшается. Потери ацетилена с карбидным илом являются основными при эксплуатации генераторов. [c.62]
Определение воды разложением карбида кальция. Метод основан на измерении объема ацетилена, выделяющегося при взаимо-. действии карбида кальция с водой, содержащейся в анализируемом продукте [c.117]
Наиболее часто ацетилен получают по реакции взаимодействия карбида кальция с водой и из природных газов и нефтепродуктов путем термического разложения. [c.205]
При перемешивании воды и находящихся в ней кусков карбида кальция разложение последних происходит несколько быстрее и равномернее. [c.30]
Скорость разложения карбида кальция в воде является весьма важным элементом, характеризующим качество карбида кальция. Однако до сих пор требования в отношении скорости разложения карбида кальция еще не нашли отражения ни в ГОСТе на карбид кальция, ни в заводских технических условиях. [c.30]
При погружении кусков карбида кальция в воду процесс разложения протекает непрерывно. Реакция начинается очень бурно, с большим выделением ацетилена, затем скорость ее постепенно снижается. Это тоже связано с образованием корки извести, препятствующей свободному доступу воды. [c.56]
Время, в течение которого полностью разлагается карбид кальция в воде, называется продолжительностью его разложения. Продолжительность разложения зависит от грануляции, состава карбида кальция, температуры воды и ее чистоты. [c.12]
Повышение температуры воды и увеличение содержания СаСг в техническом карбиде кальция уменьшают время разложения карбида кальция, загрязнение воды гашеной известью увеличивает время разложения. [c.12]
Скорость реакции гидролиза—изменяющаяся величина. Наибольшая скорость реакции наблюдается в момент погружения карбида кальция в воду, затем она непрерывно уменьшается и в конце разложения равна нулю. [c.12]
В генераторах с мокрым процессом вода поступает к не-подвижному карбиду кальция. Тепло, образуемое при разложении карбида кальция, расходуется в основном на нагрев воды. Во время работы в газообразователе всегда находится избыток карбида кальция, а вода поступает в таком количестве, чтобы смоченный ею карбид кальция обеспечил выработку потребного количества газа. [c.33]
Для пуска генератора в работу открывают кран 9, и вода заполняет нижнюю часть реторты 13. Когда вода доходит до карбида кальция, начинается его разложение. Ацетилен, выделяющийся в результате реакции карбида кальция с водой, поступает по трубе 8 под перегородку, в нижнюю часть корпуса генератора. Давлением газа вода из нижней части корпуса генератора вытесняется в верхнюю половину корпуса по трубе / когда уровень воды станет ниже крана 9, вода перестанет поступать в реторту. При отборе газа из генератора по трубе 7 вода в газосборнике находится приблизительно на уровне отверстия трубы 10, поступая по мере расхода ее в реторту. Работа генератора показана на рис. 11, в. [c.59]
При взаимодействии карбида кальция с водой процесс разложения протекает неравномерно. Вначале реакция идет очень активно, с бурным выделением ацетилена, а затем скорость ее снижается. Это объясняется уменьшением поверхности кусков карбида кальция и тем, что они покрываются коркой извести (ила), препятствующей доступу воды к частицам карбида. При перемешивании ила и находящихся в нем кусков карбида кальция разложение последних происходит быстрее и равномернее. С уменьшением грануляции возрастает количество кусков и суммарная поверхность, приходящаяся на единицу массы карбида кальция (см. табл. 1.3). Поэтому с уменьшением размеров кусков скорость гидролиза карбида кальция возрастает. [c.11]
Чтобы избежать нарушения режима генерации и повышенного содержания карбида в извести-пушонке, размер гранул карбида кальция, подаваемого в сухие генераторы, не должен превышать 4 мм. Для предупреждения чрезмерно быстрого разложения карбида и внезапного повышения давления газа до опасных пределов ограничивают содержание пыли и мелочи в карбиде, поступающем на разложение в генераторы методом карбид в воду . Чрезмерное повышение давления в генераторах предупреждается аварийной системой сбора газа через гидрозатвор в газгольдер с относительно более низким давлением. Для поступления избыточного ацетилена из генератора максимальное заполнение газгольдера при нормальном режиме ограничивается. При гипохлоритной очистке ацетилена не допускается снижение щелочности очистительного раствора гипохлорита во избежание его разложения и выделения хлора. Шламовые воды из генераторов, работающих по методу карбид в воду , перед подачей их в шламоотстойники или на переработку должны подвергаться дегазации от растворенного ацетилена. [c.28]
Результаты расчетов, выполненных на аналоговой вычислительной машине Аналог-1, и сравнение расчетных кривых с экспериментальными показывает, что допущение о равнодоступности поверхности при изучении динамики процесса не имеет достаточных оснований. При разложении карбида кальция наблюдается зависимость между изменением скорости реакции и величиной поверхности материала. Так, для карбида кальция, разложение которого осуществлялось при постоянном объеме воды, эта зависимость имеет вид [c.43]
Карбид кальция разлагается водой в аппаратах, называемых ацетиленовыми генераторами. Само разложение карбида кальция водой в этих генераторах может проводиться двумя методами [c.107]
Для производства карбида кальция применяют наиболее чистый известняк. Поэтому при взаимодействии карбида кальция с водой образуется чистая гашеная известь в виде суспензии или пушонки. При разложении 1 кг карбида получается до 2 л тестообразного карбидного ила. Установлено, что в свежем карбидном иле содержится 91,2—97,7% гидроокиси кальция в пересчете на сухое вещество. При длительном соприкосновении с воздухом часть гидроокиси кальция взаимодействует с двуокисью углерода, содержащейся в воздухе, и превращается в углекислый кальций. [c.53]
Разложение карбида кальция водою в ацетилен [c.350]
Система автоматической блокировки подачи карбида кальция и воды в генераторы низкого давления исключает возможность превышения установленных режимов работы генератора. Подача карбида кальция автоматически отключается при достижении колокола газгольдера наивысшего положения (прекращается вращение шнека, подающего партию кальция на разложение). Рабочая и аварийная вода в газообразователь подается с помощью специального клапана, который включает подачу воды при достижении температуры в газообразователе выше 80° С. [c.84]
Полученные блоки цианамида кальция 14 охлаждают в специальном охладительном стакане 13, разбивают на копре и направляют на измельчение в дробилку 15. Измельченный цианамид кальция элеватором 16 и шнеком 18 подают в бункер 19, откуда питателем 20 направляют на измельчение в трубную мельницу 21. В шнеке 22 измельченный цианамид кальция обрабатывают водой для разложения оставшегося карбида кальция, а затем элеватором 23 поднимают в расходный бункер 24. Часть цианамида кальция после дробилки 15 шнеком 17 возвращают в мельницу 6 для приготовления шихты. [c.13]
Температура в зоне реакции карбида кальция с водой может повыситься до Гсв ацетилена в случае отсутствия избыточного количества воды (реакция сопровождается выделением 1880 кДж/кг теплоты). Температура до 1000 °С и более может повыситься также в загрузочной камере при разложении карбидной пыли водяными парами (если имеются отложения пыли на стенках камеры). [c.287]
Процесс производства ацетилена карбидным методом складывается из двух последовательных стадий получение карбида кальция и его разложение водой (гидратация). [c.247]
В современной технике ацетилен получают из карбида кальция разложением его водой или из газообразных углеводородов путем термического или электрического крекинга. [c.105]
В качестве углеродистых материалов для синтеза используются кокс или антрацит. Для снижения содержания в ацетилене вредных примесей к сырью предъявляются жесткие требования по чистоте. Так, известняк должен содержать не менее 97% карбоната кальция, а углеродистые материалы — не более 6—8% летучих веществ и минимальные количества серы и фосфора. Соотношение оксида кальция и углеродистого материала зависит от заданного литража . Литражом карбида кальция называется объем ацетилена в литрах, приведенный к 20°С и 0,1 МПа, полученный при полном разложении 1 кг карбида кальция водой. Теоретический литраж 100%-го СаСг равен 377,73 л. С увеличением количества углерода в шихте литраж карбида кальция повышается, но выход его падает. Обычно применяется шихта с содержанием углерода 40—50%. При этом литраж колеблется в пределах 230—300 л. При образова- [c.247]
В современной промышленной практике производства ацетилена из карбида кальция все большее применение находят генераторы сухого типа. В этих генераторах для разложения карбида кальция подается вода из расчета минимально необходимого количества для полного разложения карбида кальция при этом за [c.111]
Ацетилен получают из карбида кальция разложением его водой. Около 40 г измельченного карбида кальция помещают в сухую колбу 1 (лучше—кругло-донную) с отводной трубкой. Колбу закрывают пробкой с капельной воронкой 2, [c.8]
Соединение кальция, образующееся при разложении карбида кальция водой, вновь используется для производства карбида. Какие последовательные превращения необходимо для этого осуществить [c.119]
Реакция сильно эндотермична и требует больших затрат электроэнергии, что составляет существенный элемент в себестоимости производимого ацетилена. При разложении образовавшегося карбида кальция водой по экзотермической реакции получается ацетилен [c.77]
Практическое получение этого углеводорода в настоящее время осуществляется почти исключительно путем разложения карбида кальция водой. [c.78]
Из карбида кальция при разложении водой [c.85]
Aцeтилeн-d2 получен при разложении карбида кальция тяжелой водой [80, 120]. [c.16]
Во избежание разложения карбида кальция парами воды, находящимися в воздухе, или случайно попавшей на него водой и последующего образования взрывоопасной ацетилено-воздушной смеси карбид кальция упаковывают герметически. [c.13]
Ацетиленовые генераторы предназначены для производства ацетилена из карбида кальция и воды. Процесс газообразования регулируется автоматически, в зависимости от количества газа в газосборнике или от давления газа. Все ацетиленовые генераторы состоят из следующих основных частей газообразователя (одного или нескольких), в котором происходит разложение карбида кальция водой газосборника (газгольдера) для хранения газа и компенсации неравномерности образования и потребления газа предохранительного устройства для удаления избытка газа при повышении давления ацетилена сверх предела, допустимого для данного генератора устройств для автоматического регулирования выработки ацетилена в зависимости от его расхода предохранительного затвора для защиты аппаратов от проникновения в них воздуха, кислорода или пламени из. тинии потребления. [c.27]
При временном прекращении отбора газа (фиг. 7, г) давление в генераторе повышается настолько, что вода полностью оттесняется от карбида кальция. В дальнейшем газообразование происходит лишь за счет воды, оставшейся на поверхности кусков карбида кальция, I извести, находящейся между кусками, а также вслед ствие разложения карбида кальция парами воды, на ходящимися в ацетилене, и доразложения мелких ку сочков карбида кальция, выпавших между пруткамр корзины на поддон 18. [c.42]
Для ацетилено-кислородной сварки наиболее безопасно и удобно использовать ацетилен из баллонов, получаемых на наполнительных станциях, однако ацетилен часто получают разложением карбида кальция водой в передвижных генераторах. Эксплуатация генераторов может оказаться опасной по ряду причин, главными из которых являются повышение температуры или давления ацетилена в генераторе, загрузка генератора карбидом несоответствующей грануляции, образование взрывчатых смесей ацетилена с воздухом или кислородом или образование врывчатых соединений ацетилена, отсутствие или ненормальная работа водяного предохранительного затвора. Проникновение воздуха в аппарат в случае неисправности водяного затвора может привести к взрыву генератора вследствие обратного удара пламени горелки. [c.75]
Ацетиленовые генераторы. Аппараты, в которых проводится разложение карбида кальция водой, иазывают ацетиленовыми генераторами. По принципу отвода тепла они бывают двух типов. [c.78]
При разложении карбида водой получаются раствор-суспензия гидроксида кальция в воде (известковое молоко) и шлам, состоящий из твердых инертных примесей к исходному карбиду (кокс, ферросилиций). Шлам оседает иа дне генератора и собирается в шлюзовом затворе 11, из которого его периодически выгружают. Известковое молоко непрерывно выходит с низа генератора на стстаивапие. Осветленный растпор с добавленной к нему свеже годой возвращают в генератор для разложения карбида, чем гредотвращаются слишком значительные потери ацетилена за [c.78]
Ацетилен был открыт Э. Дэви в 1836 г., синтезирован из угля и водорода М. Бертло в 1862 г. и впервые получен разложением карбида кальция водой Ф. Вёлером в том же 1862 г. После открытия А. Муассаном метода синтеза карбида кальция из угля и извести, карбидный метод производства ацетилена стал одним из основных промышленных методов, сохранившим свое значение до настоящего времени [c.246]
Получение ацетилена и хлористого водорода. Современное промышленное производство ацетилена основано на переработке углеводородного сырья — природного газа, этана, газового бензина и других нефтяных про- дуктов — электрокрекингом, термоокнслнтельным пиролизом и др. Находит применение и старый метод получения ацетилена разложением карбида кальция водой. Ацетилен, используемый для синтеза хлоропрена,"должен отвечать следующим требованиям [65, с. 78] [c.226]
chem21.info



















