Вода. Википедия свойства воды
Свойства воды Википедия
| Вода | |
| Оксид водорода Вода[1] | |
| вода | |
| h3O | |
| жидкость | |
| 18,01528 г/моль | |
| 0,9982 г/см³ | |
| 1,5[3] | |
| 0,00101 Па·с | |
| 0,01012 см²/с (при 20 °C) | |
| (дистиллированная вода) 1348 м/с | |
| 273,1 K (0 ° C) | |
| 373,1 K (99,974 ° C) °C | |
| 273,2 K (0,01 ° C), 611,72 Па | |
| 647,1 K (374 ° C), 22,064 МПа | |
| 75,37 Дж/(моль·К) | |
| 0,56 Вт/(м·K) | |
| 2256,2 кДж/кг[2] | |
| 332,4 кДж/кг[2] | |
| 7732-18-5 | |
| 962 | |
| 231-791-2 | |
| ZC0110000 | |
| 15377 | |
| 937 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
 71 % поверхности Земли покрывает вода
71 % поверхности Земли покрывает вода Вода́ (оксид водорода) — бинарное неорганическое соединение с химической формулой Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях)[4][5]. Составляет приблизительно около 0,05 % массы Земли[6].
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 361,13 млн км2[7][8]. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % — ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды)[9][10]. Бо́льшая часть земной воды — солёная, непригодная для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах[9].
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии[11], возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле[12].
Химические названия
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2, встречается также устаревшее название окись водорода.
- Гидроксид водорода: соединение гидроксильной группы OH- и катиона (H+)
- Гидроксильная кислота: воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «кислотного остатка» OH-
- Монооксид дигидрогена
- Дигидромонооксид
Образование воды
Известно, что 2 объема водорода взаимодействуют с 1 объемом кислорода с образованием воды. При реакции выделяется большое количество тепла, как и при горении свечи. Продукт реакции — вода не похожа на исходные вещества — водород и кислород. Следовательно, превращение, происходящее при взаимодействии водорода и кислорода, должно быть отнесено к химическим реакциям.
В соответствии с атомно-молекулярной теорией мы начинаем рассуждение, предполагая, что в реакции участвуют молекулы Н2 и О2. В результате реакции образуются молекулы воды. Связи между атомами в реагирующих веществах разрываются и атомы перегруппировываются. При этом возникают новые связи в молекулах продукта реакции. Эти превращения легко представить с помощью молекулярных моделей. Молекулярную модель можно представить как две молекулы Н2 (четыре атома) и одна молекула О2 (два атома). Если эти молекулы будут реагировать с образованием воды, то связи между атомами в молекулах водорода и кислорода должны разорваться. Затем «завязываются» новые связи и образуются две молекулы воды. Отметим, что в результате реакции происходит перегруппировка атомов, но общее число атомов при этом не изменяется.
Пример образования молекул воды. Один миллион молекул кислорода реагирует с достаточно большим количеством молекул водорода с образованием воды. Сколько молекул воды образуется? Сколько молекул водорода требуется для этой реакции?
Для получения 100 молекул воды расходуется 100 молекул водорода и 50 молекул кислорода. Таким образом, для получения 1 моля воды (6,02 · 1023 молекул) нам потребуется 1 моль водорода (6,02 · 1023 молекул) и 0,5 моля кислорода (3,01 · 1023 молекул). Результаты приведены в таблице:
| Водород | Кислород | Вода | |
| Число молекул | 2 | 1 | 2 |
| 4 | 2 | 4 | |
| 100 | 50 | 100 | |
| 6,02 · 1023 | 3,01 · 1023 | 6,02 · 1023 | |
| Число молей | 1 | 0,5 | 1 |
| 2 | 1 | 2 | |
| 10 | 5 | 10 |
Реакция между водородом и кислородом протекает намного быстрее, если эти газы смешать и затем поджечь смесь искрой. Происходит сильный взрыв. Тем не менее, на 1 моль реагирующего водорода образуется такое же количество продукта реакции — воды — и выделяется столько же тепла, как и при обычном горении.
Если реагируют 1 моль чистого водорода и 0,5 моля чистого кислорода, образуется 1 моль воды. Количество тепла, выделяющееся при образовании 1 моля воды, равно 68000 кал. Если же мы возьмем только 0,025 моля чистого водорода, то потребуется 0,5 · 0,025 моля кислорода. При этом образуется 0,025 моля воды. Если получено только 0,025 моля воды, то выделяется лишь 0,025 · 68 000 = 1700 кал тепла.
Источником этой тепловой энергии должны быть сами реагирующие вещества (водород и кислород), так как к системе извне подводится только тепло, необходимое для поджигания смеси. Отсюда можно сделать вывод, что вода содержит меньше энергии, чем реагирующие вещества, используемые для ее получения. Реакция, при которой выделяется тепло, называется экзотермической. Количество тепла, выделяющееся при сгорании 1 моля водорода (68 000 кал, или 68 ккал), называется молярной теплотой сгорания водорода.
Свойства
Физические свойства
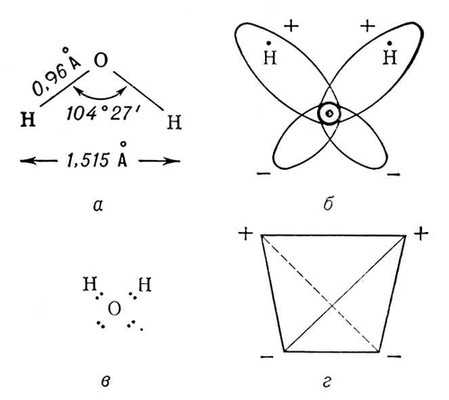
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (h3S, Ch5, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода[13]. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования[13]. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °С, а замерзала при −100 °С[14].
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Физические свойства разных изотопных модификаций воды при различных температурах[15]:
| Н2O | 3,9834 | 0,01 |
| D2O | 11,2 | 3,82 |
| T2O | 13,4 | 4,49 |
| Н218O | 4,3 | 0,31 |
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути[16][17][18][19]. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде[20]. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
Капля, ударяющаяся о поверхность водыЧистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония h4O+) и гидроксильных ионов OH− составляет 10-7 моль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть присутствуют другие положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния
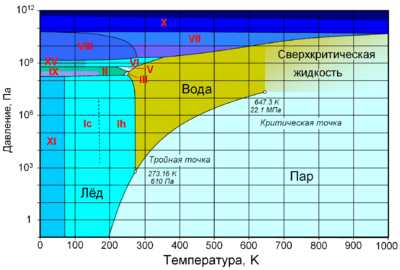
По состоянию различают:
При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт[21]:
| 0,987 (105 Па — нормальные условия) | 99.63 |
| 1 | 100 |
| 2 | 120 |
| 6 | 158 |
| 218,5 | 374,1 |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Оптические свойства
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Изотопные модификации
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды (h3O17 и h3O18) содержится больше, чем воды D2O16: их содержание, соответственно, 1,8 кг и 0,15 кг на тонну[14].
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней[14].
По стабильным изотопам кислорода 16O, 17O и 18O существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.
Химические свойства
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.Воду можно получать:
- в ходе реакций —
- Восстановлением водородом оксидов металлов —
Под воздействием очень высоких температур или электрического тока (при электролизе)[22], а также под воздействием ионизирующего излучения, как установил в 1902 году[23]Фридрих Гизель[en] при исследовании водного раствора бромида радия[24], вода разлагается на молекулярный кислород и молекулярный водород:
2h3O→2h3↑+O2↑{\displaystyle {\mathsf {2H_{2}O\rightarrow 2H_{2}\uparrow +O_{2}\uparrow }}}Вода реагирует при комнатной температуре:
2h3O+2Na→2NaOH+h3↑{\displaystyle {\mathsf {2H_{2}O+2Na\rightarrow 2NaOH+H_{2}\uparrow }}}- со фтором и межгалоидными соединениями
- с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
4h3O+3Fe→Fe3O4+4h3{\displaystyle {\mathsf {4H_{2}O+3Fe\rightarrow Fe_{3}O_{4}+4H_{2}}}} h3O+C⇄ CO+h3{\displaystyle {\mathsf {H_{2}O+C\rightleftarrows \ CO+H_{2}}}}- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот;
- с ацетиленом и другими алкинами;
- с алкенами;
- с нитрилами.
Волновая функция основного состояния воды
В валентном приближении электронная конфигурация молекулы h3O{\displaystyle {\ce {h3O}}} в основном состоянии: (1a1)1(1b2)2(1b1)2(2b2)0(3a1)0.{\displaystyle (1a_{1})^{1}(1b_{2})^{2}(1b_{1})^{2}(2b_{2})^{0}(3a_{1})^{0}.} Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО) — по два электрона на каждой МО ϕi{\displaystyle \phi _{i}}, один со спином α{\displaystyle \alpha }, другой со спином β{\displaystyle \beta }, или 8 спин-орбиталей ψ{\displaystyle \psi }. Волновая функция молекулы, Ψ{\displaystyle \Psi }, представленная единственным детерминантом Слэтера Ф, имеет вид
|ϕ1a1(1)α(1)ϕ1a1(1)β(1)ϕ1b2(1)α(1)...ϕ1b1(1)β(1)ϕ1a1(2)α(2)ϕ1a1(2)β(2)ϕ1b2(2)α(2)...ϕ1b1(2)β(2)ϕ1a1(3)α(3)ϕ1a1(3)β(3)ϕ1b2(3)α(3)...ϕ1b1(3)β(3)...............ϕ1a1(8)α(8)ϕ1a1(8)β(8)ϕb2(8)α(8)...ϕ1b1(8)β(8)|{\displaystyle {\begin{vmatrix}\phi _{1a_{1}}(1)\alpha (1)&\phi _{1a_{1}}(1)\beta (1)&\phi _{1b_{2}}(1)\alpha (1)&...&\phi _{1b_{1}}(1)\beta (1)\\\phi _{1a_{1}}(2)\alpha (2)&\phi _{1a_{1}}(2)\beta (2)&\phi _{1b_{2}}(2)\alpha (2)&...&\phi _{1b_{1}}(2)\beta (2)\\\phi _{1a_{1}}(3)\alpha (3)&\phi _{1a_{1}}(3)\beta (3)&\phi _{1b_{2}}(3)\alpha (3)&...&\phi _{1b_{1}}(3)\beta (3)\\...&...&...&...&...\\\phi _{1a_{1}}(8)\alpha (8)&\phi _{1a_{1}}(8)\beta (8)&\phi _{b_{2}}(8)\alpha (8)&...&\phi _{1b_{1}}(8)\beta (8)\end{vmatrix}}}
Симметрия этой волновой функции определяется прямым произведением НП, по которым преобразуются все занятые спин-орбитали
(a1)⊗(a1)⊗(b2)⊗(b2)⊗(a1)⊗(a1)⊗(b1)⊗(b1).{\displaystyle (a_{1})\otimes (a_{1})\otimes (b_{2})\otimes (b_{2})\otimes (a_{1})\otimes (a_{1})\otimes (b_{1})\otimes (b_{1}).}
Принимая во внимание, что:
- прямое произведение невырожденного НП самого на себя является полносимметричным НП.
- прямое произведение любого невырожденного представления Г на полносимметричное есть Г, получаем:
a1⊗a1⊗⏟A1b2⊗b2⏟A1⊗a1⊗a1⏟A1⊗b1⊗b1⏟A1⏟A1{\displaystyle \underbrace {\underbrace {a_{1}\otimes a_{1}\otimes } _{A_{1}}\underbrace {b_{2}\otimes b_{2}} _{A_{1}}\otimes \underbrace {a_{1}\otimes a_{1}} _{A_{1}}\otimes \underbrace {b_{1}\otimes b_{1}} _{A_{1}}} _{A_{1}}}
Виды
Вода на Земле может существовать в трёх основных состояниях:
- жидком,
- газообразном
- твёрдом.
Вода может приобретать различные формы, которые могут одновременно соседствовать и взаимодействовать друг с другом:
Вода способна растворять в себе множество органических и неорганических веществ. Из-за важности воды, «как источника жизни», её нередко подразделяют на типы по различным принципам.
Виды воды по особенностям происхождения, состава или применения:
по содержанию катионов кальция и магнияпо изотопам водорода в молекуледругие виды- Пресная вода,
- Дождевая вода,
- Морская вода,
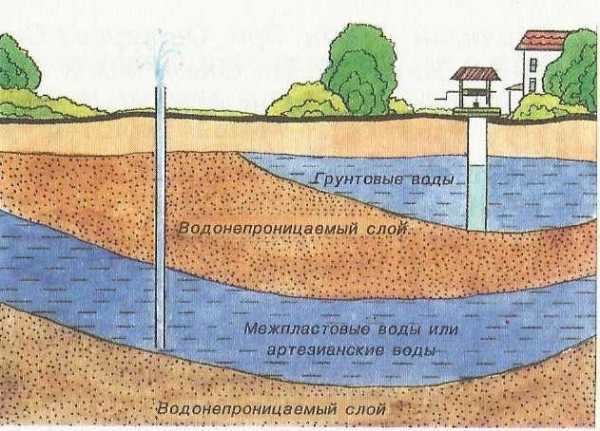
- Подземные воды,
- Минеральная вода,
- Солоноватая вода (en:Brackish water),
- Питьевая вода и Водопроводная вода,
- Дистиллированная вода и деионизированная вода,
- Сточные воды,
- Ливневая вода или поверхностные воды,
- Апирогенная вода,
- Поливода,
- Структурированная вода — термин, применяемый в различных неакадемических теориях,
- Талая вода,
- Мёртвая вода и Живая вода — виды воды со сказочными свойствами,
- Святая вода — особый вид воды с мистическими свойствами (согласно религиозным учениям). По христианским представлениям святая вода — это вода, посвященная Богу. Никакие свойства воды как таковой при этом не меняются.
В природе
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая — криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Мировой океан содержит более 97,54 % земной воды, подземные воды — около 0,63 %, ледники — 1,81 %, реки и озера — 0,009 %, материковые солёные воды — 0,007 %, атмосфера — 0,001 %[8].
Атмосферные осадки
Вода за пределами Земли
Вода — чрезвычайно распространённое вещество в космосе, однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях вакуума космоса, отчего она представлена только в виде пара или льда.
Одним из наиболее важных вопросов, связанных с освоением космоса человеком и возможности возникновения жизни на других планетах, является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда. Не стоит, впрочем, забывать, что не любая водная среда пригодна для жизни.
В результате бомбардировки лунного кратера, проведённой 9 октября 2009 года НАСА с использованием космического аппарата LCROSS, впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объёмах[25].
Вода широко распространена в Солнечной системе. Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: Энцеладе[26][27], Тефии, Европе, Ганимеде и др. Вода присутствует в составе всех комет и многих астероидов. Учёными предполагается, что многие транснептуновые объекты имеют в своём составе воду.
Вода в виде паров содержится в атмосфере Солнца (следы)[28], атмосферах Меркурия (3,4 %, также большие количества воды обнаружены в экзосфере Меркурия)[29], Венеры (0,002 %)[30], Луны[31], Марса (0,03 %)[32], Юпитера (0,0004 %)[33], Европы[34], Сатурна, Урана (следы)[35] и Нептуна[36] (найден в нижних слоях атмосферы).
Содержание водяного пара в атмосфере Земли у поверхности колеблется от 3—4 % в тропиках до 2·10−5% в Антарктиде[37].
Кроме того, вода обнаружена на экзопланетах, например HD 189733 A b[38], HD 209458 b[39] и GJ 1214 b[40].
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет — наиболее вероятно, на Европе — спутнике Юпитера.
Биологическая роль
 Полный стакан с водой
Полный стакан с водойВода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений.
Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить. Существует и другая точка зрения: если бы вода не расширялась при замерзании, то не разрушались бы клеточные структуры, соответственно замораживание не наносило бы ущерба живым организмам. Некоторые существа (тритоны) переносят замораживание/оттаивание — считается что этому способствует особый состав клеточной плазмы, не расширяющейся при замораживании.
Применение
В земледелииВыращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90 % в некоторых странах.
Для питья и приготовления пищиЖивое человеческое тело содержит от 50 % до 75 % воды[41], в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья[42][43].
Как растворительВода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
В качестве теплоносителя Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР)Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в виде льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Как замедлительВо многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции. Также существуют тяжеловодные реакторы, в которых в качестве замедлителя используется тяжёлая вода.
Для ПожаротушенияВ пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены, так как горение поддерживается только при достаточном поступлении кислорода.
В спортеМногими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это подводное плавание, хоккей, лодочные виды спорта, биатлон, шорт-трек и др.
В качестве ИнструментаВода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Для смазкиВода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках[44].
Исследования
Происхождение воды на планете
Происхождение воды на Земле является предметом научных споров. Некоторые учёные считают, что вода была занесена астероидами или кометами на ранней стадии образования Земли, около четырёх миллиардов лет назад, когда планета уже сформировалась в виде шара. В настоящее время установлено, что вода появилась в мантии Земли не позже 2,7 миллиардов лет назад[45].
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
Гидрогеология
Гидрогеоло́гия (от др.-греч. ὕδωρ «водность» + геология) — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой. В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Гидрогеология тесно связана с гидрологией и геологией, в том числе и с инженерной геологией, метеорологией, геохимией, геофизикой и другими науками о Земле. Она опирается на данные математики, физики, химии и широко использует их методы исследования. Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений.
Факты
Данный раздел имеет чрезмерный объём или содержит маловажные подробности. Если вы не согласны с этим, пожалуйста, покажите в тексте существенность излагаемого материала. В противном случае раздел может быть удалён. Подробности могут быть на странице обсуждения. |
- В среднем в организме растений и животных содержится более 50 % воды[46].
- В составе мантии Земли воды содержится в 10-12 раз больше, чем в Мировом океане[47].
- При средней глубине в 3,6 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.[источник не указан 63 дня]
- Если бы на Земле не было впадин и выпуклостей, вода покрыла бы всю Землю слоем толщиной 3 км[48].
- При определённых условиях (внутри нанотрубок) молекулы воды образуют новое состояние, при котором они сохраняют способность течь даже при температурах, близких к абсолютному нулю[49].
- Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.[источник не указан 63 дня]
- Синий цвет чистой океанской воды в толстом слое объясняется избирательным поглощением и рассеянием света в воде.[источник не указан 63 дня]
- С помощью капель воды из кранов можно создать напряжение до 10 киловольт, опыт называется «Капельница Кельвина».[источник не указан 63 дня]
- Вода — это одно из немногих веществ в природе, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают сурьма[50], висмут, галлий, германий и некоторые соединения и смеси).
- Вода и водяной пар горят в атмосфере фтора фиолетовым пламенем. Смеси водяного пара со фтором в пределах взрывчатых концентраций взрывоопасны. В результате этой реакции образуются фтороводород и элементарный кислород.[источник не указан 63 дня]
См. также
Примечания
- ↑ англ. International Union of Pure and Applied Chemistry. Nomenclature of Inorganic Chemistry. IUPAC RECOMMENDATIONS 2005. RSC Publishing, 2005. — p. 306.
- ↑ 1 2 Маленков Г. Г. Вода // Физическая энциклопедия. — М.: Советская энциклопедия, 1988. — Т. I. Ааронова — Бома эффект — Длинные линии. — С. 294—297.
- ↑ Петрушевский Ф. Ф., Гершун А. Л. Лед, в физике // Энциклопедический словарь — СПб.: Брокгауз—Ефрон, 1896. — Т. XVII. — С. 471–473.
- ↑ Henniker, J. C. (1949). «The Depth of the Surface Zone of a Liquid». Reviews of Modern Physics (Reviews of Modern Physics) 21 (2): 322–341. DOI:10.1103/RevModPhys.21.322.
- ↑ Pollack, Gerald. Water Science. University of Washington, Pollack Laboratory. — «Water has three phases – gas, liquid, and solid; but recent findings from our laboratory imply the presence of a surprisingly extensive fourth phase that occurs at interfaces.». Проверено 5 февраля 2011. Архивировано 15 февраля 2013 года.
- ↑ Моря принесены на Землю из космоса?
- ↑ CIA- The world fact book. Central Intelligence Agency. Проверено 20 декабря 2008.
- ↑ 1 2 Marine Science: An Illustrated Guide to Science
- ↑ 1 2 Gleick, P.H. Water in Crisis: A Guide to the World's Freshwater Resources. — Oxford University Press, 1993.
- ↑ Water Vapor in the Climate System (англ.). American Geophysical Union. Проверено 13 февраля 2013. Архивировано 15 февраля 2013 года.
- ↑ Криволуцкий А. Е. Голубая планета. Земля среди планет. Географический аспект. — М.: Мысль, 1985. — С. 212.
- ↑ United Nations. Un.org (22 марта 2005). Проверено 25 июля 2010. Архивировано 15 февраля 2013 года.
- ↑ 1 2 Ларионов А. К. Занимательная гидрогеология. — Москва: Недра, 1979. — С. 5—12. — 157 с.
- ↑ 1 2 3 Петрянов И.В. Самое необыкновенное вещество // Химия и жизнь. — 1965. — № 3. — С. 2—14.
- ↑ Physics of Ice (15 страница)
- ↑ Свойства воды. Физические свойства воды
- ↑ Основные физические свойства воды, водяного пара, льда, снега
- ↑ Коэффициенты поверхностного натяжения жидкостей
- ↑ Surface tension (англ.)
- ↑ Молекулярные преобразователи энергии в живой клетке (Тихонов А. Н., 1997)
- ↑ П. И. Воскресенский Техника лабораторных работ. 9-е изд. Л.: «Химия», 1970. С. 696—697
- ↑ Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 7. Атомы // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 15—18. — 240 с. — 1 630 000 экз.
- ↑ Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 200. — ISBN 5-7155-0292-6.
- ↑ Le Caër S. (2011). «Water Radiolysis: Influence of Oxide Surfaces on h3 Production under Ionizing Radiation». Water 3: 236.
- ↑ Вода на Луне: но откуда?
- ↑ NASA Space Assets Detect Ocean inside Saturn Moon. NASA (3 April 2014). Проверено 3 апреля 2014.
- ↑ (4 April 2014) «The Gravity Field and Interior Structure of Enceladus». Science (journal) 344: 78—80. DOI:10.1126/science.1250551. Проверено 3 April 2014.
- ↑ Solanki, S. K. (1994). «New Light on the Heart of Darkness of the Solar Chromosphere». Science 263 (5143): 64–66. DOI:10.1126/science.263.5143.64. PMID 17748350. Bibcode: 1994Sci...263...64S.
- ↑ MESSENGER Scientists 'Astonished' to Find Water in Mercury's Thin Atmosphere. Planetary Society (3 июля 2008). Проверено 5 июля 2008. Архивировано 17 января 2010 года.
- ↑ Bertaux, Jean-Loup (2007). «A warm layer in Venus' cryosphere and high-altitude measurements of HF, HCl, h3O and HDO». Nature 450 (7170): 646–649. DOI:10.1038/nature05974. PMID 18046397. Bibcode: 2007Natur.450..646B.
- ↑ Sridharan, R.; S.M. Ahmed, Tirtha Pratim Dasa, P. Sreelathaa, P. Pradeepkumara, Neha Naika, and Gogulapati Supriya (2010). «'Direct' evidence for water in the sunlit lunar ambience from CHACE on MIP of Chandrayaan I». Planetary and Space Science 58 (6). DOI:10.1016/j.pss.2010.02.013. Bibcode: 2010P&SS...58..947S.
- ↑ Donald Rapp. Use of Extraterrestrial Resources for Human Space Missions to Moon or Mars. — Springer, 28 November 2012. — P. 78–. — ISBN 978-3-642-32762-9.
- ↑ (2005) «Coupled Clouds and Chemistry of the Giant Planets — A Case for Multiprobes» (PDF). Space Science Reviews 116: 121–136. DOI:10.1007/s11214-005-1951-5. ISSN 0032-0633. Bibcode: 2005SSRv..116..121A.
- ↑ Hubble Sees Evidence of Water Vapor at Jupiter Moon. NASA (December 12, 2013). Проверено 12 декабря 2013.
- ↑ Encrenaz, 2003, p. 92.
- ↑ Hubbard, W. B. (1997). «Neptune's Deep Chemistry». Science 275 (5304): 1279–1280. DOI:10.1126/science.275.5304.1279. PMID 9064785.
- ↑ Земля (планета) — статья из Большой советской энциклопедии.
- ↑ Water Found on Distant Planet 12 July 2007 By Laura Blue, Time
- ↑ Water Found in Extrasolar Planet’s Atmosphere
- ↑ Атмосфера экзопланеты GJ 1214b переполнена водой. Компьюлента (24 февраля 2012). — «Новые наблюдения транзитов GJ 1214 b, удалённой от Земли на 40 световых лет, показали, что вода должна составлять не менее половины от всей массы атмосферы этой «суперземли»». Проверено 21 июля 2013. Архивировано 29 августа 2013 года.
- ↑ Watson, P. E. et al. (1980) Total body water volumes for adult males and females estimated from simple anthropometric measurements, The American Journal for Clinical Nutrition, Vol. 33, No 1, pp.27-39.
- ↑ Моргунова Г.С. Вода, которую мы пьём // Химия и жизнь. — 1965. — № 3. — С. 15—17.
- ↑ Sharma B.K. Water Pollution. — 1994. — P. 408—409.
- ↑ Воскресенский В. А., Дьяков В. И. Глава 2. Смазочные вещества и их физико-химические свойства // Расчет и проектирование опор скольжения (жидкостная смазка): Справочник. — М.: Машиностроение, 1980. — С. 15. — (Библиотека конструктора). — ISBN ББК 34.42, УДК 621.81.001.2 (031).
- ↑ Ученые: вода появилась в мантии Земли 2,7 млрд лет назад. ТАСС. Проверено 26 апреля 2016.
- ↑ Наука и техника. Книги. Загадки простой воды.
- ↑ Состав и природа мантии Земли
- ↑ Биосфера Земли
- ↑ Science Daily (англ.)
- ↑ Сурьма // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 235. — ISBN 5-7155-0292-6.
Литература
Ссылки
Справочные материалыwikiredia.ru
Вода — Википедия
Материал из Википедии — свободной энциклопедии
| Вода | |
| Систематическое наименование | Оксид водорода |
| Традиционные названия | вода |
| Химическая формула | Н2O |
| Молярная масса | 18,01528 г/моль |
| Состояние (ст. усл.) | жидкость |
| Плотность | 0,9982 г/см³ |
| Динамическая вязкость (ст. усл.) | 0,00101 Па·с(при 20 °C) |
| Кинематическая вязкость (ст. усл.) | 0,01012 см²/с(при 20 °C) |
| Температура плавления | 0 °C |
| Температура кипения | 99,974 °C |
| Тройная точка | 0,01 °C, 611,73 Па |
| Критическая точка | 374 °C, 22,064 MПа |
| Молярная теплоёмкость (ст. усл.) | 75,37 Дж/(моль·К) |
| Теплопроводность (ст. усл.) | 0,56 Вт/(м·K) |
Вода́ (оксид водорода) — прозрачная жидкость, не имеющая цвета (в малом объёме) и запаха. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. Около 71 % поверхности Земли покрыто водой (океаны, моря, озера, реки, лёд на полюсах).
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Физические и химические свойства
Физические свойства
Вода обладает рядом необычных особенностей:
- При таянии льда его плотность увеличивается (с 0,9 до 1 г/см³). Почти у всех остальных веществ при плавлении плотность уменьшается.
- При нагревании от 0 °C до 4 °C (точнее, 3,98 °C) вода сжимается. Благодаря этому могут жить рыбы в замерзающих водоёмах: когда температура падает ниже 4 °C, более холодная вода как менее плотная остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура.
- Высокая температура и удельная теплота плавления (0 °C и 333,55 кДж/кг), температура кипения (100 °C) и удельная теплота парообразования (2250 КДж/кг [1]), по сравнению с соединениями водорода с похожим молекулярным весом.
- Высокая теплоёмкость жидкой воды.
- Высокая вязкость.
- Высокое поверхностное натяжение.
- Отрицательный электрический потенциал поверхности воды.
Все эти особенности связаны с наличием водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а так же того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода — каждый в одной, а атом кислорода — в двух; в таком состоянии молекулы находятся в кристалле льда. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4 °С этот эффект становится слабее, чем тепловое расширение. При испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Капля, ударяющаяся о поверхность водыПо сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. [2] Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Чистая (не содержащая примесей) вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония h4O+) и гидроксильных ионов HO- составляет 0,1 мкмоль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чем основан принцип действия микроволновой печи.
Агрегатные состояния
По состоянию различают:
При атмосферном давлении вода замерзает (превращается в лёд) при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C. При снижении давления температура плавления воды медленно растёт, а температура кипения — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такое давление и температура называются тройной точкой воды. При более низком давлении вода не может находится в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки льда падает со снижением давления.
При росте давления температура кипения воды растёт, плотность водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
Так же возможны метастабильные состояния — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Изотопные модификации воды
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов, входящих в молекулу, выделяют следующие виды воды: Лёгкая вода (просто вода), Тяжёлая вода (дейтериевая) и Сверхтяжёлая вода(тритиевая).
Химические свойства
Вода является наиболее распространённым растворителем на Земле, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+ анион OH-). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ ок. 16.
Сама по себе вода относительно инертна в обычных условиях, но её сильно полярные молекулы сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Вода в природе
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде. Роль воды в клетке — см. статью
Атмосферные осадки
Осадки согласно направлению
Осадки согласно состоянию
Виды воды
Вода на Земле может существовать в трёх основных состояниях — жидком, газообразном и твёрдом и в свою очередь приобретать самые разные формы, которые зачастую соседствуют друг с другом. Водный пар и облака в небе, морская вода и айсберги, горные ледники и горные же реки, водоносные слои в земле. Вода способна растворять в себе много веществ, приобретая тот или иной вкус. Из-за важности воды, «как источника жизни» её нередко подразделяют на типы.
Характеристики вод
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
Вода за пределами Земли
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет, наиболее вероятно, на Европе, спутнике Юпитера.
Исследования воды
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
Биологическая роль
Вода играет уникальную роль, как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Применение
Земледелие
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90 % в некоторых странах.
Питьё и приготовление пищи
Живое человеческое тело содержит от 55 % до 78 % воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. Для нормального функционирования организма человеку нужно усвоить от 1 до 7 литров воды за день в зависимости от температуры и влажности окружающей среды, физической активности и пр.
Растворитель
Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
Теплоноситель
Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР)Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Пожаротушение
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции от огня в составе пены.
Спорт
Многие вида спорта проходят на водных поверхностях, на льду, на снегу и даже в воде. Это подводное плавание, хоккей, лодочные виды спорта, биатлон и пр.
Инструмент
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Интересные факты
- В среднем в организме растений и животных содержится более 50 % воды.[3]
- В составе мантии Земли воды содержится в 10-12 раз больше, чем в Мировом океане.
- При средней глубине в 4 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.
- Если бы на Земле не было впадин и выпуклостей, вода покрыла бы всю Землю, и ее толщина была бы 3 км.
- Если бы все ледники растаяли, то уровень воды на Земле поднялся бы на 64 м и около 1/8 поверхности суши было бы затоплено водой.
- Морская вода при обычной её солёности 35 ‰ замерзает при температуре −1,91 °C[4].
- Иногда вода замерзает при положительной температуре[5].
- При определённых условиях (внутри нанотрубок) молекулы воды образуют новое состояние, при котором они сохраняют способность течь даже при температурах, близких к абсолютному нулю.[6]
- Среди существующих в природе жидкостей поверхностное натяжение воды уступает только ртути.
- Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
- Синий цвет чистой океанской воды объясняется избирательным поглощением и рассеянием света в воде.
- С помощью капель воды из кранов можно накопить заряд 10 киловольт, опыт называется «Капельница Кельвина».
- Существует следующая поговорка с использованием формулы воды — h3O: «Сапоги мои того — пропускают h3O». Вместо сапог в поговорке может участвовать и другая дырявая обувь.[7][8][9]
- Вода — это одно из немногих веществ на Земле, которые расширяются при переходе из жидкой фазы в твердую (кроме воды, таким свойством обладают висмут, галлий и некоторые соединения и смеси).
См. также
Дополнительное чтение
Литература
Примечания
Ссылки
Справочные материалы
Статьи
arquivo.pt
Вода Википедия
| Вода | |
| Оксид водорода Вода[1] | |
| вода | |
| h3O | |
| жидкость | |
| 18,01528 г/моль | |
| 0,9982 г/см³ | |
| 1,5[3] | |
| 0,00101 Па·с | |
| 0,01012 см²/с (при 20 °C) | |
| (дистиллированная вода) 1348 м/с | |
| 273,1 K (0 ° C) | |
| 373,1 K (99,974 ° C) °C | |
| 273,2 K (0,01 ° C), 611,72 Па | |
| 647,1 K (374 ° C), 22,064 МПа | |
| 75,37 Дж/(моль·К) | |
| 0,56 Вт/(м·K) | |
| 2256,2 кДж/кг[2] | |
| 332,4 кДж/кг[2] | |
| 7732-18-5 | |
| 962 | |
| 231-791-2 | |
| ZC0110000 | |
| 15377 | |
| 937 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
 71 % поверхности Земли покрывает вода
71 % поверхности Земли покрывает вода Вода́ (оксид водорода) — бинарное неорганическое соединение с химической формулой Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях)[4][5]. Составляет приблизительно около 0,05 % массы Земли[6].
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 361,13 млн км2[7][8]. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % — ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды)[9][10]. Бо́льшая часть земной воды — солёная, непригодная для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах[9].
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии[11], возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле[12].
Химические названия
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2, встречается также устаревшее название окись водорода.
- Гидроксид водорода: соединение гидроксильной группы OH- и катиона (H+)
- Гидроксильная кислота: воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «кислотного остатка» OH-
- Монооксид дигидрогена
- Дигидромонооксид
Образование воды
Известно, что 2 объема водорода взаимодействуют с 1 объемом кислорода с образованием воды. При реакции выделяется большое количество тепла, как и при горении свечи. Продукт реакции — вода не похожа на исходные вещества — водород и кислород. Следовательно, превращение, происходящее при взаимодействии водорода и кислорода, должно быть отнесено к химическим реакциям.
В соответствии с атомно-молекулярной теорией мы начинаем рассуждение, предполагая, что в реакции участвуют молекулы Н2 и О2. В результате реакции образуются молекулы воды. Связи между атомами в реагирующих веществах разрываются и атомы перегруппировываются. При этом возникают новые связи в молекулах продукта реакции. Эти превращения легко представить с помощью молекулярных моделей. Молекулярную модель можно представить как две молекулы Н2 (четыре атома) и одна молекула О2 (два атома). Если эти молекулы будут реагировать с образованием воды, то связи между атомами в молекулах водорода и кислорода должны разорваться. Затем «завязываются» новые связи и образуются две молекулы воды. Отметим, что в результате реакции происходит перегруппировка атомов, но общее число атомов при этом не изменяется.
Пример образования молекул воды. Один миллион молекул кислорода реагирует с достаточно большим количеством молекул водорода с образованием воды. Сколько молекул воды образуется? Сколько молекул водорода требуется для этой реакции?
Для получения 100 молекул воды расходуется 100 молекул водорода и 50 молекул кислорода. Таким образом, для получения 1 моля воды (6,02 · 1023 молекул) нам потребуется 1 моль водорода (6,02 · 1023 молекул) и 0,5 моля кислорода (3,01 · 1023 молекул). Результаты приведены в таблице:
| Водород | Кислород | Вода | |
| Число молекул | 2 | 1 | 2 |
| 4 | 2 | 4 | |
| 100 | 50 | 100 | |
| 6,02 · 1023 | 3,01 · 1023 | 6,02 · 1023 | |
| Число молей | 1 | 0,5 | 1 |
| 2 | 1 | 2 | |
| 10 | 5 | 10 |
Реакция между водородом и кислородом протекает намного быстрее, если эти газы смешать и затем поджечь смесь искрой. Происходит сильный взрыв. Тем не менее, на 1 моль реагирующего водорода образуется такое же количество продукта реакции — воды — и выделяется столько же тепла, как и при обычном горении.
Если реагируют 1 моль чистого водорода и 0,5 моля чистого кислорода, образуется 1 моль воды. Количество тепла, выделяющееся при образовании 1 моля воды, равно 68000 кал. Если же мы возьмем только 0,025 моля чистого водорода, то потребуется 0,5 · 0,025 моля кислорода. При этом образуется 0,025 моля воды. Если получено только 0,025 моля воды, то выделяется лишь 0,025 · 68 000 = 1700 кал тепла.
Источником этой тепловой энергии должны быть сами реагирующие вещества (водород и кислород), так как к системе извне подводится только тепло, необходимое для поджигания смеси. Отсюда можно сделать вывод, что вода содержит меньше энергии, чем реагирующие вещества, используемые для ее получения. Реакция, при которой выделяется тепло, называется экзотермической. Количество тепла, выделяющееся при сгорании 1 моля водорода (68 000 кал, или 68 ккал), называется молярной теплотой сгорания водорода.
Свойства
Физические свойства
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (h3S, Ch5, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода[13]. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования[13]. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °С, а замерзала при −100 °С[14].
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Физические свойства разных изотопных модификаций воды при различных температурах[15]:
| Н2O | 3,9834 | 0,01 |
| D2O | 11,2 | 3,82 |
| T2O | 13,4 | 4,49 |
| Н218O | 4,3 | 0,31 |
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути[16][17][18][19]. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде[20]. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
Капля, ударяющаяся о поверхность водыЧистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония h4O+) и гидроксильных ионов OH− составляет 10-7 моль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть присутствуют другие положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния

По состоянию различают:
При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт[21]:
| 0,987 (105 Па — нормальные условия) | 99.63 |
| 1 | 100 |
| 2 | 120 |
| 6 | 158 |
| 218,5 | 374,1 |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Оптические свойства
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Изотопные модификации
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды (h3O17 и h3O18) содержится больше, чем воды D2O16: их содержание, соответственно, 1,8 кг и 0,15 кг на тонну[14].
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней[14].
По стабильным изотопам кислорода 16O, 17O и 18O существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.
Химические свойства
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.Воду можно получать:
- в ходе реакций —
- Восстановлением водородом оксидов металлов —
Под воздействием очень высоких температур или электрического тока (при электролизе)[22], а также под воздействием ионизирующего излучения, как установил в 1902 году[23]Фридрих Гизель[en] при исследовании водного раствора бромида радия[24], вода разлагается на молекулярный кислород и молекулярный водород:
2h3O→2h3↑+O2↑{\displaystyle {\mathsf {2H_{2}O\rightarrow 2H_{2}\uparrow +O_{2}\uparrow }}}Вода реагирует при комнатной температуре:
2h3O+2Na→2NaOH+h3↑{\displaystyle {\mathsf {2H_{2}O+2Na\rightarrow 2NaOH+H_{2}\uparrow }}}- со фтором и межгалоидными соединениями
- с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
4h3O+3Fe→Fe3O4+4h3{\displaystyle {\mathsf {4H_{2}O+3Fe\rightarrow Fe_{3}O_{4}+4H_{2}}}} h3O+C⇄ CO+h3{\displaystyle {\mathsf {H_{2}O+C\rightleftarrows \ CO+H_{2}}}}- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот;
- с ацетиленом и другими алкинами;
- с алкенами;
- с нитрилами.
Волновая функция основного состояния воды
В валентном приближении электронная конфигурация молекулы h3O{\displaystyle {\ce {h3O}}} в основном состоянии: (1a1)1(1b2)2(1b1)2(2b2)0(3a1)0.{\displaystyle (1a_{1})^{1}(1b_{2})^{2}(1b_{1})^{2}(2b_{2})^{0}(3a_{1})^{0}.} Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО) — по два электрона на каждой МО ϕi{\displaystyle \phi _{i}}, один со спином α{\displaystyle \alpha }, другой со спином β{\displaystyle \beta }, или 8 спин-орбиталей ψ{\displaystyle \psi }. Волновая функция молекулы, Ψ{\displaystyle \Psi }, представленная единственным детерминантом Слэтера Ф, имеет вид
|ϕ1a1(1)α(1)ϕ1a1(1)β(1)ϕ1b2(1)α(1)...ϕ1b1(1)β(1)ϕ1a1(2)α(2)ϕ1a1(2)β(2)ϕ1b2(2)α(2)...ϕ1b1(2)β(2)ϕ1a1(3)α(3)ϕ1a1(3)β(3)ϕ1b2(3)α(3)...ϕ1b1(3)β(3)...............ϕ1a1(8)α(8)ϕ1a1(8)β(8)ϕb2(8)α(8)...ϕ1b1(8)β(8)|{\displaystyle {\begin{vmatrix}\phi _{1a_{1}}(1)\alpha (1)&\phi _{1a_{1}}(1)\beta (1)&\phi _{1b_{2}}(1)\alpha (1)&...&\phi _{1b_{1}}(1)\beta (1)\\\phi _{1a_{1}}(2)\alpha (2)&\phi _{1a_{1}}(2)\beta (2)&\phi _{1b_{2}}(2)\alpha (2)&...&\phi _{1b_{1}}(2)\beta (2)\\\phi _{1a_{1}}(3)\alpha (3)&\phi _{1a_{1}}(3)\beta (3)&\phi _{1b_{2}}(3)\alpha (3)&...&\phi _{1b_{1}}(3)\beta (3)\\...&...&...&...&...\\\phi _{1a_{1}}(8)\alpha (8)&\phi _{1a_{1}}(8)\beta (8)&\phi _{b_{2}}(8)\alpha (8)&...&\phi _{1b_{1}}(8)\beta (8)\end{vmatrix}}}
Симметрия этой волновой функции определяется прямым произведением НП, по которым преобразуются все занятые спин-орбитали
(a1)⊗(a1)⊗(b2)⊗(b2)⊗(a1)⊗(a1)⊗(b1)⊗(b1).{\displaystyle (a_{1})\otimes (a_{1})\otimes (b_{2})\otimes (b_{2})\otimes (a_{1})\otimes (a_{1})\otimes (b_{1})\otimes (b_{1}).}
Принимая во внимание, что:
- прямое произведение невырожденного НП самого на себя является полносимметричным НП.
- прямое произведение любого невырожденного представления Г на полносимметричное есть Г, получаем:
a1⊗a1⊗⏟A1b2⊗b2⏟A1⊗a1⊗a1⏟A1⊗b1⊗b1⏟A1⏟A1{\displaystyle \underbrace {\underbrace {a_{1}\otimes a_{1}\otimes } _{A_{1}}\underbrace {b_{2}\otimes b_{2}} _{A_{1}}\otimes \underbrace {a_{1}\otimes a_{1}} _{A_{1}}\otimes \underbrace {b_{1}\otimes b_{1}} _{A_{1}}} _{A_{1}}}
Виды
Вода на Земле может существовать в трёх основных состояниях:
- жидком,
- газообразном
- твёрдом.
Вода может приобретать различные формы, которые могут одновременно соседствовать и взаимодействовать друг с другом:
Вода способна растворять в себе множество органических и неорганических веществ. Из-за важности воды, «как источника жизни», её нередко подразделяют на типы по различным принципам.
Виды воды по особенностям происхождения, состава или применения:
по содержанию катионов кальция и магнияпо изотопам водорода в молекуледругие виды- Пресная вода,
- Дождевая вода,
- Морская вода,
- Подземные воды,
- Минеральная вода,
- Солоноватая вода (en:Brackish water),
- Питьевая вода и Водопроводная вода,
- Дистиллированная вода и деионизированная вода,
- Сточные воды,
- Ливневая вода или поверхностные воды,
- Апирогенная вода,
- Поливода,
- Структурированная вода — термин, применяемый в различных неакадемических теориях,
- Талая вода,
- Мёртвая вода и Живая вода — виды воды со сказочными свойствами,
- Святая вода — особый вид воды с мистическими свойствами (согласно религиозным учениям). По христианским представлениям святая вода — это вода, посвященная Богу. Никакие свойства воды как таковой при этом не меняются.
В природе
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая — криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Мировой океан содержит более 97,54 % земной воды, подземные воды — около 0,63 %, ледники — 1,81 %, реки и озера — 0,009 %, материковые солёные воды — 0,007 %, атмосфера — 0,001 %[8].
Атмосферные осадки
Вода за пределами Земли
Вода — чрезвычайно распространённое вещество в космосе, однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях вакуума космоса, отчего она представлена только в виде пара или льда.
Одним из наиболее важных вопросов, связанных с освоением космоса человеком и возможности возникновения жизни на других планетах, является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда. Не стоит, впрочем, забывать, что не любая водная среда пригодна для жизни.
В результате бомбардировки лунного кратера, проведённой 9 октября 2009 года НАСА с использованием космического аппарата LCROSS, впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объёмах[25].
Вода широко распространена в Солнечной системе. Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: Энцеладе[26][27], Тефии, Европе, Ганимеде и др. Вода присутствует в составе всех комет и многих астероидов. Учёными предполагается, что многие транснептуновые объекты имеют в своём составе воду.
Вода в виде паров содержится в атмосфере Солнца (следы)[28], атмосферах Меркурия (3,4 %, также большие количества воды обнаружены в экзосфере Меркурия)[29], Венеры (0,002 %)[30], Луны[31], Марса (0,03 %)[32], Юпитера (0,0004 %)[33], Европы[34], Сатурна, Урана (следы)[35] и Нептуна[36] (найден в нижних слоях атмосферы).
Содержание водяного пара в атмосфере Земли у поверхности колеблется от 3—4 % в тропиках до 2·10−5% в Антарктиде[37].
Кроме того, вода обнаружена на экзопланетах, например HD 189733 A b[38], HD 209458 b[39] и GJ 1214 b[40].
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет — наиболее вероятно, на Европе — спутнике Юпитера.
Биологическая роль
 Полный стакан с водой
Полный стакан с водойВода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений.
Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить. Существует и другая точка зрения: если бы вода не расширялась при замерзании, то не разрушались бы клеточные структуры, соответственно замораживание не наносило бы ущерба живым организмам. Некоторые существа (тритоны) переносят замораживание/оттаивание — считается что этому способствует особый состав клеточной плазмы, не расширяющейся при замораживании.
Применение
В земледелииВыращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90 % в некоторых странах.
Для питья и приготовления пищиЖивое человеческое тело содержит от 50 % до 75 % воды[41], в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья[42][43].
Как растворительВода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
В качестве теплоносителя Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР)Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в виде льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Как замедлительВо многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции. Также существуют тяжеловодные реакторы, в которых в качестве замедлителя используется тяжёлая вода.
Для ПожаротушенияВ пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены, так как горение поддерживается только при достаточном поступлении кислорода.
В спортеМногими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это подводное плавание, хоккей, лодочные виды спорта, биатлон, шорт-трек и др.
В качестве ИнструментаВода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Для смазкиВода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках[44].
Исследования
Происхождение воды на планете
Происхождение воды на Земле является предметом научных споров. Некоторые учёные считают, что вода была занесена астероидами или кометами на ранней стадии образования Земли, около четырёх миллиардов лет назад, когда планета уже сформировалась в виде шара. В настоящее время установлено, что вода появилась в мантии Земли не позже 2,7 миллиардов лет назад[45].
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
Гидрогеология
Гидрогеоло́гия (от др.-греч. ὕδωρ «водность» + геология) — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой. В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Гидрогеология тесно связана с гидрологией и геологией, в том числе и с инженерной геологией, метеорологией, геохимией, геофизикой и другими науками о Земле. Она опирается на данные математики, физики, химии и широко использует их методы исследования. Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений.
Факты
Данный раздел имеет чрезмерный объём или содержит маловажные подробности. Если вы не согласны с этим, пожалуйста, покажите в тексте существенность излагаемого материала. В противном случае раздел может быть удалён. Подробности могут быть на странице обсуждения. |
- В среднем в организме растений и животных содержится более 50 % воды[46].
- В составе мантии Земли воды содержится в 10-12 раз больше, чем в Мировом океане[47].
- При средней глубине в 3,6 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.[источник не указан 63 дня]
- Если бы на Земле не было впадин и выпуклостей, вода покрыла бы всю Землю слоем толщиной 3 км[48].
- При определённых условиях (внутри нанотрубок) молекулы воды образуют новое состояние, при котором они сохраняют способность течь даже при температурах, близких к абсолютному нулю[49].
- Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.[источник не указан 63 дня]
- Синий цвет чистой океанской воды в толстом слое объясняется избирательным поглощением и рассеянием света в воде.[источник не указан 63 дня]
- С помощью капель воды из кранов можно создать напряжение до 10 киловольт, опыт называется «Капельница Кельвина».[источник не указан 63 дня]
- Вода — это одно из немногих веществ в природе, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают сурьма[50], висмут, галлий, германий и некоторые соединения и смеси).
- Вода и водяной пар горят в атмосфере фтора фиолетовым пламенем. Смеси водяного пара со фтором в пределах взрывчатых концентраций взрывоопасны. В результате этой реакции образуются фтороводород и элементарный кислород.[источник не указан 63 дня]
См. также
Примечания
- ↑ англ. International Union of Pure and Applied Chemistry. Nomenclature of Inorganic Chemistry. IUPAC RECOMMENDATIONS 2005. RSC Publishing, 2005. — p. 306.
- ↑ 1 2 Маленков Г. Г. Вода // Физическая энциклопедия. — М.: Советская энциклопедия, 1988. — Т. I. Ааронова — Бома эффект — Длинные линии. — С. 294—297.
- ↑ Петрушевский Ф. Ф., Гершун А. Л. Лед, в физике // Энциклопедический словарь — СПб.: Брокгауз—Ефрон, 1896. — Т. XVII. — С. 471–473.
- ↑ Henniker, J. C. (1949). «The Depth of the Surface Zone of a Liquid». Reviews of Modern Physics (Reviews of Modern Physics) 21 (2): 322–341. DOI:10.1103/RevModPhys.21.322.
- ↑ Pollack, Gerald. Water Science. University of Washington, Pollack Laboratory. — «Water has three phases – gas, liquid, and solid; but recent findings from our laboratory imply the presence of a surprisingly extensive fourth phase that occurs at interfaces.». Проверено 5 февраля 2011. Архивировано 15 февраля 2013 года.
- ↑ Моря принесены на Землю из космоса?
- ↑ CIA- The world fact book. Central Intelligence Agency. Проверено 20 декабря 2008.
- ↑ 1 2 Marine Science: An Illustrated Guide to Science
- ↑ 1 2 Gleick, P.H. Water in Crisis: A Guide to the World's Freshwater Resources. — Oxford University Press, 1993.
- ↑ Water Vapor in the Climate System (англ.). American Geophysical Union. Проверено 13 февраля 2013. Архивировано 15 февраля 2013 года.
- ↑ Криволуцкий А. Е. Голубая планета. Земля среди планет. Географический аспект. — М.: Мысль, 1985. — С. 212.
- ↑ United Nations. Un.org (22 марта 2005). Проверено 25 июля 2010. Архивировано 15 февраля 2013 года.
- ↑ 1 2 Ларионов А. К. Занимательная гидрогеология. — Москва: Недра, 1979. — С. 5—12. — 157 с.
- ↑ 1 2 3 Петрянов И.В. Самое необыкновенное вещество // Химия и жизнь. — 1965. — № 3. — С. 2—14.
- ↑ Physics of Ice (15 страница)
- ↑ Свойства воды. Физические свойства воды
- ↑ Основные физические свойства воды, водяного пара, льда, снега
- ↑ Коэффициенты поверхностного натяжения жидкостей
- ↑ Surface tension (англ.)
- ↑ Молекулярные преобразователи энергии в живой клетке (Тихонов А. Н., 1997)
- ↑ П. И. Воскресенский Техника лабораторных работ. 9-е изд. Л.: «Химия», 1970. С. 696—697
- ↑ Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 7. Атомы // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 15—18. — 240 с. — 1 630 000 экз.
- ↑ Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 200. — ISBN 5-7155-0292-6.
- ↑ Le Caër S. (2011). «Water Radiolysis: Influence of Oxide Surfaces on h3 Production under Ionizing Radiation». Water 3: 236.
- ↑ Вода на Луне: но откуда?
- ↑ NASA Space Assets Detect Ocean inside Saturn Moon. NASA (3 April 2014). Проверено 3 апреля 2014.
- ↑ (4 April 2014) «The Gravity Field and Interior Structure of Enceladus». Science (journal) 344: 78—80. DOI:10.1126/science.1250551. Проверено 3 April 2014.
- ↑ Solanki, S. K. (1994). «New Light on the Heart of Darkness of the Solar Chromosphere». Science 263 (5143): 64–66. DOI:10.1126/science.263.5143.64. PMID 17748350. Bibcode: 1994Sci...263...64S.
- ↑ MESSENGER Scientists 'Astonished' to Find Water in Mercury's Thin Atmosphere. Planetary Society (3 июля 2008). Проверено 5 июля 2008. Архивировано 17 января 2010 года.
- ↑ Bertaux, Jean-Loup (2007). «A warm layer in Venus' cryosphere and high-altitude measurements of HF, HCl, h3O and HDO». Nature 450 (7170): 646–649. DOI:10.1038/nature05974. PMID 18046397. Bibcode: 2007Natur.450..646B.
- ↑ Sridharan, R.; S.M. Ahmed, Tirtha Pratim Dasa, P. Sreelathaa, P. Pradeepkumara, Neha Naika, and Gogulapati Supriya (2010). «'Direct' evidence for water in the sunlit lunar ambience from CHACE on MIP of Chandrayaan I». Planetary and Space Science 58 (6). DOI:10.1016/j.pss.2010.02.013. Bibcode: 2010P&SS...58..947S.
- ↑ Donald Rapp. Use of Extraterrestrial Resources for Human Space Missions to Moon or Mars. — Springer, 28 November 2012. — P. 78–. — ISBN 978-3-642-32762-9.
- ↑ (2005) «Coupled Clouds and Chemistry of the Giant Planets — A Case for Multiprobes» (PDF). Space Science Reviews 116: 121–136. DOI:10.1007/s11214-005-1951-5. ISSN 0032-0633. Bibcode: 2005SSRv..116..121A.
- ↑ Hubble Sees Evidence of Water Vapor at Jupiter Moon. NASA (December 12, 2013). Проверено 12 декабря 2013.
- ↑ Encrenaz, 2003, p. 92.
- ↑ Hubbard, W. B. (1997). «Neptune's Deep Chemistry». Science 275 (5304): 1279–1280. DOI:10.1126/science.275.5304.1279. PMID 9064785.
- ↑ Земля (планета) — статья из Большой советской энциклопедии.
- ↑ Water Found on Distant Planet 12 July 2007 By Laura Blue, Time
- ↑ Water Found in Extrasolar Planet’s Atmosphere
- ↑ Атмосфера экзопланеты GJ 1214b переполнена водой. Компьюлента (24 февраля 2012). — «Новые наблюдения транзитов GJ 1214 b, удалённой от Земли на 40 световых лет, показали, что вода должна составлять не менее половины от всей массы атмосферы этой «суперземли»». Проверено 21 июля 2013. Архивировано 29 августа 2013 года.
- ↑ Watson, P. E. et al. (1980) Total body water volumes for adult males and females estimated from simple anthropometric measurements, The American Journal for Clinical Nutrition, Vol. 33, No 1, pp.27-39.
- ↑ Моргунова Г.С. Вода, которую мы пьём // Химия и жизнь. — 1965. — № 3. — С. 15—17.
- ↑ Sharma B.K. Water Pollution. — 1994. — P. 408—409.
- ↑ Воскресенский В. А., Дьяков В. И. Глава 2. Смазочные вещества и их физико-химические свойства // Расчет и проектирование опор скольжения (жидкостная смазка): Справочник. — М.: Машиностроение, 1980. — С. 15. — (Библиотека конструктора). — ISBN ББК 34.42, УДК 621.81.001.2 (031).
- ↑ Ученые: вода появилась в мантии Земли 2,7 млрд лет назад. ТАСС. Проверено 26 апреля 2016.
- ↑ Наука и техника. Книги. Загадки простой воды.
- ↑ Состав и природа мантии Земли
- ↑ Биосфера Земли
- ↑ Science Daily (англ.)
- ↑ Сурьма // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 235. — ISBN 5-7155-0292-6.
Литература
Ссылки
Справочные материалыwikiredia.ru
Вода — Википедия
Эта статья — о веществе. О классическом элементе см. Вода (стихия).| Вода | |
 | |
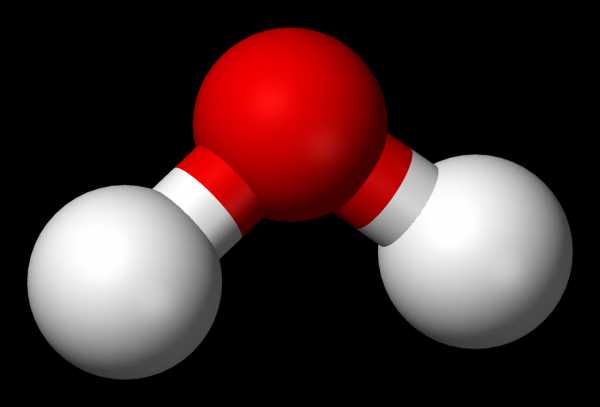 | |
| Систематическоенаименование | Оксид водорода Вода[1] |
| Традиционные названия | вода |
| Хим. формула | h3O |
| Состояние | жидкость |
| Молярная масса | 18,01528 г/моль |
| Плотность | 0,9982 г/см³ |
| Динамическая вязкость | 0,00101 Па·с |
| Кинематическая вязкость | 0,01012 см²/с(при 20 °C) |
| Скорость звука в веществе | (дистиллированная вода) 1348 м/с |
| Т. плав. | 273,1 K (0 ° C) |
| Т. кип. | 373,1 K (99,974 ° C) °C |
| Тройная точка | 273,2 K (0,01 ° C), 611,72 Па |
| Кр. точка | 647,1 K (374 ° C), 22,064 МПа |
| Мол. теплоёмк. | 75,37 Дж/(моль·К) |
| Теплопроводность | 0,56 Вт/(м·K) |
| Удельная теплота испарения | 2256,2 кДж/кг[2] |
| Удельная теплота плавления | 332,4 кДж/кг[2] |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
 71 % поверхности Земли покрывает вода
71 % поверхности Земли покрывает вода Вода́ (оксид водорода) — бинарное неорганическое соединение с химической формулой Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеет цвета (в малом объёме), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях)[3][4]. Составляет приблизительно около 0,05 массы Земли[5].
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 361,13 млн км2[6][7]. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % — ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды)[8][9]. Бо́льшая часть земной воды — солёная, непригодная для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах[8].
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на планете Земля[10].
Химические названия воды[править]
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2
- Гидроксид водорода: соединение гидроксильной группы OH- и катиона (H+)
- Гидроксильная кислота: воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «кислотного остатка» OH-
- Монооксид дигидрогена
- Оксидан
- Дигидромонооксид
Физические свойства[править]
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (h3S, Ch5, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода[11]. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования[11]. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °С, а замерзала при −100 °С[12].
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути[13][14][15][16]. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде[17]. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
 Капля, ударяющаяся о поверхность воды
Капля, ударяющаяся о поверхность воды Чистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония h4O+) и гидроксильных ионов OH− составляет 10-7 моль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть присутствуют другие положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния[править]
По состоянию различают:

При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (температура 0 °C и 100 °C были специально выбраны как температура таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт[18]:
| 0,987 (105 Па — нормальные условия) | +99.63° |
| 1 | +100° |
| 2 | +120° |
| 6 | +158° |
| 218,5 | +374,1° |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Советский учёный Б. В. Дерягин заявлял, что существует тип воды, которая имеет плотность на 40 % выше нормальной и закипает при температуре +300°С. Эта разновидность воды была якобы открыта им на поверхности кристаллов кварца[11]. Позднее Дерягин опроверг собственные утверждения, объяснив свою ошибку неряшливо поставленным экспериментом.
Оптические свойства
Оптические свойства воды оцениваются по её прозрачности, которая в свою очередь зависит от длины волны луча, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов видимого света вода приобретает голубоватую окраску. Вода прозрачна только для видимых лучей и сильно поглощает инфракрасную радиацию, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85%. Под лед океана проникает только 2% солнечного света.
Изотопные модификации воды[править]
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды (h3O17 и h3O18) содержится больше, чем воды D2O16: их содержание, соответственно, 1,8 кг и 0,15 кг на тонну[12].
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней[12].
По стабильным изотопам кислорода 16O, 17O и 18O существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.
Химические свойства[править]
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
- Воду можно получить в ходе реакций:
- Восстановлением оксидов металлов водородом:
Под воздействием очень высоких температур или электрического тока (при электролизе)[19], а также под воздействием ионизирующего излучения, как установил в 1902 году[20]Фридрих Гизель[en] при исследовании водного раствора бромида радия[21], вода разлагается на молекулярный кислород и молекулярный водород:
- со фтором и межгалоидными соединениями
- с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз:
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот;
- с ацетиленом и другими алкинами;
- с алкенами;
- с нитрилами.
Вода на Земле может существовать в трёх основных состояниях — жидком, газообразном и твёрдом и приобретать различные формы, которые могут одновременно соседствовать друг с другом: водяной пар и облака в небе, морская вода и айсберги, ледники и реки на поверхности земли, водоносные слои в земле. Вода способна растворять в себе множество органических и неорганических веществ. Из-за важности воды, «как источника жизни», её нередко подразделяют на типы по различным принципам.
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Мировой океан содержит более 97,54 % земной воды, подземные воды — около 0,63 %, ледники — 1,81 %, реки и озера — 0,009 %, материковые солёные воды — 0,007 %, атмосфера — 0,001 %[7].
Атмосферные осадки[править]
Вода за пределами Земли[править]
Вода — чрезвычайно распространённое вещество в космосе, однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях вакуума космоса, отчего она представлена только в виде пара или льда.
Одним из наиболее важных вопросов, связанных с освоением космоса человеком и возможности возникновения жизни на других планетах, является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда. Не стоит, впрочем, забывать, что не любая водная среда пригодна для жизни.
В результате бомбардировки лунного кратера, проведённой 9 октября 2009 года НАСА с использованием космического аппарата LCROSS, впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объёмах[22].
Вода широко распространена в Солнечной системе. Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: Энцеладе[23][24], Тефии, Европе, Ганимеде и др. Вода присутствует в составе всех комет и многих астероидов. Учёными предполагается, что многие транснептуновые объекты имеют в своём составе воду.
Вода в виде паров содержится в атмосфере Солнца (следы)[25], атмосферах Меркурия (3,4 %, также большие количества воды обнаружены в экзосфере Меркурия)[26], Венеры (0,002 %)[27], Луны[28], Марса (0,03 %)[29], Юпитера (0,0004 %)[30], Европы[31], Сатурна, Урана (следы)[32] и Нептуна[33] (найден в нижних слоях атмосферы).
Содержание водяного пара в атмосфере Земли у поверхности колеблется от 3—4 % в тропиках до 2·10−5% в Антарктиде[34].
Кроме того, вода обнаружена на экзопланетах, например HD 189733 b[35], HD 209458 b[36] и GJ 1214 b[37].
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет, наиболее вероятно, на Европе — спутнике Юпитера.
Биологическая роль воды[править]
 Полный стакан с водойВода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений.
Полный стакан с водойВода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить. Существует и другая точка зрения: если бы вода не расширялась при замерзании, то не разрушались бы клеточные структуры, соответственно замораживание не наносило бы ущерба живым организмам. Некоторые существа (тритоны) переносят замораживание/оттаивание — считается что этому способствует особый состав клеточной плазмы, не расширяющейся при замораживании.
Земледелие[править]
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90 % в некоторых странах.
Питьё и приготовление пищи[править]

Живое человеческое тело содержит от 50 % до 75 % воды[38], в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья[39][40].
Растворитель[править]
Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
Теплоноситель[править]
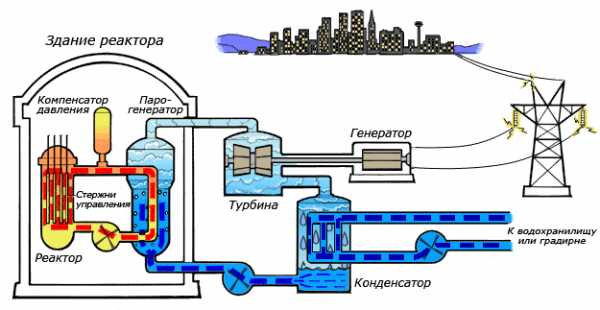 Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР)
Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР) Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Замедлитель[править]
Во многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции. Также существуют тяжеловодные реакторы, в которых в качестве замедлителя используется тяжёлая вода.
Пожаротушение[править]
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены.
Спорт[править]
Многими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это подводное плавание, хоккей, лодочные виды спорта, биатлон и др.
Инструмент[править]
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Смазка[править]
Вода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках[41].
Исследования воды[править]
Гидрология[править]
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
Гидрогеология[править]
Гидрогеоло́гия (от др.-греч. ὕδωρ «водность» + геология) — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой. В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Гидрогеология тесно связана с гидрологией и геологией, в том числе и с инженерной геологией, метеорологией, геохимией, геофизикой и другими науками о Земле. Она опирается на данные математики, физики, химии и широко использует их методы исследования. Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений.
- В среднем в организме растений и животных содержится более 50 % воды[42].
- В составе мантии Земли воды содержится в 10-12 раз больше, чем в Мировом океане[43].
- При средней глубине в 3,6 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.
- Если бы на Земле не было впадин и выпуклостей, вода покрыла бы всю Землю слоем толщиной 3 км[44].
- Если бы все ледники растаяли, то уровень воды в земных океанах поднялся бы на 64 м и около 1/8 поверхности суши было бы затоплено водой[45].
- Морская вода при обычной её солёности 35 ‰ замерзает при температуре −1,91 °C[46].
- Иногда вода замерзает при положительной температуре[47].
- При определённых условиях (внутри нанотрубок) молекулы воды образуют новое состояние, при котором они сохраняют способность течь даже при температурах, близких к абсолютному нулю[48].
- Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
- Синий цвет чистой океанской воды в толстом слое объясняется избирательным поглощением и рассеянием света в воде.
- С помощью капель воды из кранов можно создать напряжение до 10 киловольт, опыт называется «Капельница Кельвина».
- Вода — это одно из немногих веществ в природе, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают сурьма[49], висмут, галлий, германий и некоторые соединения и смеси).
- Вода и водяной пар горят в атмосфере фтора фиолетовым пламенем. Смеси водяного пара со фтором в пределах взрывчатых концентраций взрывоопасны. В результате этой реакции образуются фтороводород и элементарный кислород.
- ↑ англ. International Union of Pure and Applied Chemistry. Nomenclature of Inorganic Chemistry. IUPAC RECOMMENDATIONS 2005. RSC Publishing, 2005. — p. 306.
- ↑ 2,02,1 Маленков Г. Г. Вода // Физическая энциклопедия. — М.: Советская энциклопедия, 1988. —. —.
- ↑ Henniker, J. C. (1949). «The Depth of the Surface Zone of a Liquid». Reviews of Modern Physics (Reviews of Modern Physics) 21 (2): 322–341. DOI:10.1103/RevModPhys.21.322.
- ↑ Pollack, Gerald. Water Science. University of Washington, Pollack Laboratory. — «Water has three phases – gas, liquid, and solid; but recent findings from our laboratory imply the presence of a surprisingly extensive fourth phase that occurs at interfaces.» Проверено 5 февраля 2011. Архивировано из первоисточника 15 февраля 2013.
- ↑ Моря принесены на Землю из космоса?
- ↑ CIA- The world fact book. Central Intelligence Agency. Проверено 20 декабря 2008.
- ↑ 7,07,1 Marine Science: An Illustrated Guide to Science
- ↑ 8,08,1 Gleick, P.H. Water in Crisis: A Guide to the World's Freshwater Resources. — Oxford University Press, 1993.
- ↑ Water Vapor in the Climate System (англ.). American Geophysical Union. Проверено 13 февраля 2013. Архивировано из первоисточника 15 февраля 2013.
- ↑ United Nations. Un.org (22 марта 2005). Проверено 25 июля 2010. Архивировано из первоисточника 15 февраля 2013.
- ↑ 11,011,111,2 Ларионов А. К. Занимательная гидрогеология. — Москва: Недра, 1979. — С. 5-12. — 157 с.
- ↑ 12,012,112,2 Петрянов И.В. Самое необыкновенное вещество // Химия и жизнь. — 1965. —. —.
- ↑ Свойства воды. Физические свойства воды
- ↑ Основные физические свойства воды, водяного пара, льда, снега
- ↑ Коэффициенты поверхностного натяжения жидкостей
- ↑ Surface tension (англ.)
- ↑ Молекулярные преобразователи энергии в живой клетке (Тихонов А. Н., 1997)
- ↑ П. И. Воскресенский Техника лабораторных работ. 9-е изд. Л.: «Химия», 1970. С. 696—697
- ↑ Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 7. Атомы // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 15—18. — 240 с. — 1 630 000 экз.
- ↑ Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. —. — ISBN 5-7155-0292-6.
- ↑ Le Caër S. (2011). «Water Radiolysis: Influence of Oxide Surfaces on h3 Production under Ionizing Radiation». Water 3: 236.
- ↑ Вода на Луне: но откуда?
- ↑ NASA Space Assets Detect Ocean inside Saturn Moon. NASA (3 April 2014). Проверено 3 апреля 2014.
- ↑ (4 April 2014) «The Gravity Field and Interior Structure of Enceladus». Science (journal) 344: 78-80. DOI:10.1126/science.1250551. Проверено 3 April 2014.
- ↑ Solanki, S. K. (1994). «New Light on the Heart of Darkness of the Solar Chromosphere». Science 263 (5143): 64–66. DOI:10.1126/science.263.5143.64. PMID 17748350. Bibcode: 1994Sci...263...64S.
- ↑ MESSENGER Scientists 'Astonished' to Find Water in Mercury's Thin Atmosphere. Planetary Society (3 июля 2008). Проверено 5 июля 2008. Архивировано из первоисточника 16 октября 2010.
- ↑ Bertaux, Jean-Loup (2007). «A warm layer in Venus' cryosphere and high-altitude measurements of HF, HCl, h3O and HDO». Nature 450 (7170): 646–649. DOI:10.1038/nature05974. PMID 18046397. Bibcode: 2007Natur.450..646B.
- ↑ Sridharan, R.; S.M. Ahmed, Tirtha Pratim Dasa, P. Sreelathaa, P. Pradeepkumara, Neha Naika, and Gogulapati Supriya (2010). «'Direct' evidence for water in the sunlit lunar ambience from CHACE on MIP of Chandrayaan I». Planetary and Space Science 58 (6). DOI:10.1016/j.pss.2010.02.013. Bibcode: 2010P&SS...58..947S.
- ↑ Donald Rapp. Use of Extraterrestrial Resources for Human Space Missions to Moon or Mars. — Springer, 28 November 2012. — P. 78–. — ISBN 978-3-642-32762-9.
- ↑ (2005) «Coupled Clouds and Chemistry of the Giant Planets — A Case for Multiprobes» (PDF). Space Science Reviews 116: 121–136. DOI:10.1007/s11214-005-1951-5. ISSN 0032-0633. Bibcode: 2005SSRv..116..121A.
- ↑ Hubble Sees Evidence of Water Vapor at Jupiter Moon. NASA (December 12, 2013). Проверено 12 декабря 2013.
- ↑ Encrenaz, 2003, p. 92
- ↑ Hubbard, W. B. (1997). «Neptune's Deep Chemistry». Science 275 (5304): 1279–1280. DOI:10.1126/science.275.5304.1279. PMID 9064785.
- ↑ БСЭ
- ↑ Water Found on Distant Planet 12 July 2007 By Laura Blue, Time
- ↑ Water Found in Extrasolar Planet’s Atmosphere
- ↑ Атмосфера экзопланеты GJ 1214b переполнена водой. Компьюлента (24 февраля 2012). — «Новые наблюдения транзитов GJ 1214 b, удалённой от Земли на 40 световых лет, показали, что вода должна составлять не менее половины от всей массы атмосферы этой «суперземли»» Проверено 21 июля 2013. Архивировано из первоисточника 29 августа 2013.
- ↑ Watson, P. E. et al. (1980) Total body water volumes for adult males and females estimated from simple anthropometric measurements, The American Journal for Clinical Nutrition, Vol. 33, No 1, pp.27-39.
- ↑ Моргунова Г.С. Вода, которую мы пьём // Химия и жизнь. — 1965. —. —.
- ↑ Sharma B.K. Water Pollution. — 1994. — P. 408-409.
- ↑ Воскресенский В. А., Дьяков В. И. Глава 2. Смазочные вещества и их физико-химические свойства // Расчет и проектирование опор скольжения (жидкостная смазка): Справочник. — М.: Машиностроение, 1980. — С. 15. — (Библиотека конструктора). — ISBN ББК 34.42, УДК 621.81.001.2 (031).
- ↑ Наука и техника. Книги. Загадки простой воды.
- ↑ Состав и природа минтии Земли
- ↑ Биосфера Земли
- ↑ Загадки простой воды
- ↑ Дайвинг: статьи, каталог снаряжения, обучение, магазины, клубы и центры
- ↑ Всеволод Арабаджи. Загадки простой воды. 2001
- ↑ Science Daily (англ.)
- ↑ Сурьма // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. —. — ISBN 5-7155-0292-6.
wp.wiki-wiki.ru
Вода — Википедия
Материал из Википедии — свободной энциклопедии
Эта статья — о веществе. О классическом элементе см. Вода (стихия).| Вода | |
| Систематическоенаименование | Оксид водорода Вода[1] |
| Традиционные названия | вода |
| Хим. формула | h3O |
| Состояние | жидкость |
| Молярная масса | 18,01528 г/моль |
| Плотность | 0,9982 г/см³ |
| Динамическая вязкость | 0,00101 Па·с |
| Кинематическая вязкость | 0,01012 см²/с(при 20 °C) |
| Скорость звука в веществе | (дистиллированная вода) 1348 м/с |
| Т. плав. | 273,1 K (0 ° C) |
| Т. кип. | 373,1 K (99,974 ° C) °C |
| Тройная точка | 273,2 K (0,01 ° C), 611,72 Па |
| Кр. точка | 647,1 K (374 ° C), 22,064 МПа |
| Мол. теплоёмк. | 75,37 Дж/(моль·К) |
| Теплопроводность | 0,56 Вт/(м·K) |
| Удельная теплота испарения | 2256,2 кДж/кг[2] |
| Удельная теплота плавления | 332,4 кДж/кг[2] |
| Рег. номер CAS | 7732-18-5 |
| PubChem | 962 |
| Рег. номер EINECS | 231-791-2 |
| SMILES | |
| InChI | |
| RTECS | ZC0110000 |
| ChemSpider | 937 |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
 71 % поверхности Земли покрывает вода
71 % поверхности Земли покрывает вода Вода́ (оксид водорода) — бинарное неорганическое соединение с химической формулой Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеет цвета (в малом объёме), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях)[3][4]. Составляет приблизительно около 0,05 массы Земли[5].
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 361,13 млн км2[6][7]. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % — ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды)[8][9]. Бо́льшая часть земной воды — солёная, непригодная для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах[8].
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на планете Земля[10].
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2
- Гидроксид водорода: соединение гидроксильной группы OH- и катиона (H+)
- Гидроксильная кислота: воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «кислотного остатка» OH-
- Монооксид дигидрогена
- Оксидан
- Дигидромонооксид
Физические свойства[править | править вики-текст]
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (h3S, Ch5, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода[11]. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования[11]. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °С, а замерзала при −100 °С[12].
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути[13][14][15][16]. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде[17]. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
Капля, ударяющаяся о поверхность водыЧистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония h4O+) и гидроксильных ионов OH− составляет 10-7 моль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть присутствуют другие положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния[править | править вики-текст]
По состоянию различают:
При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (температура 0 °C и 100 °C были специально выбраны как температура таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт[18]:
| 0,987 (105 Па — нормальные условия) | +99.63° |
| 1 | +100° |
| 2 | +120° |
| 6 | +158° |
| 218,5 | +374,1° |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Советский учёный Б. В. Дерягин заявлял, что существует тип воды, которая имеет плотность на 40 % выше нормальной и закипает при температуре +300°С. Эта разновидность воды была якобы открыта им на поверхности кристаллов кварца[11]. Позднее Дерягин опроверг собственные утверждения, объяснив свою ошибку неряшливо поставленным экспериментом.
Оптические свойства
Оптические свойства воды оцениваются по её прозрачности, которая в свою очередь зависит от длины волны луча, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов видимого света вода приобретает голубоватую окраску. Вода прозрачна только для видимых лучей и сильно поглощает инфракрасную радиацию, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лед океана проникает только 2 % солнечного света.
Изотопные модификации воды[править | править вики-текст]
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды (h3O17 и h3O18) содержится больше, чем воды D2O16: их содержание, соответственно, 1,8 кг и 0,15 кг на тонну[12].
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней[12].
По стабильным изотопам кислорода 16O, 17O и 18O существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.
Химические свойства[править | править вики-текст]
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
- Воду можно получить в ходе реакций:
- Восстановлением оксидов металлов водородом:
Под воздействием очень высоких температур или электрического тока (при электролизе)[19], а также под воздействием ионизирующего излучения, как установил в 1902 году[20]Фридрих Гизель[en] при исследовании водного раствора бромида радия[21], вода разлагается на молекулярный кислород и молекулярный водород:
- со фтором и межгалоидными соединениями
- с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз:
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот;
- с ацетиленом и другими алкинами;
- с алкенами;
- с нитрилами.
Вода на Земле может существовать в трёх основных состояниях — жидком, газообразном и твёрдом и приобретать различные формы, которые могут одновременно соседствовать друг с другом: водяной пар и облака в небе, морская вода и айсберги, ледники и реки на поверхности земли, водоносные слои в земле. Вода способна растворять в себе множество органических и неорганических веществ. Из-за важности воды, «как источника жизни», её нередко подразделяют на типы по различным принципам.
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Мировой океан содержит более 97,54 % земной воды, подземные воды — около 0,63 %, ледники — 1,81 %, реки и озера — 0,009 %, материковые солёные воды — 0,007 %, атмосфера — 0,001 %[7].
Атмосферные осадки[править | править вики-текст]
Вода за пределами Земли[править | править вики-текст]
Вода — чрезвычайно распространённое вещество в космосе, однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях вакуума космоса, отчего она представлена только в виде пара или льда.
Одним из наиболее важных вопросов, связанных с освоением космоса человеком и возможности возникновения жизни на других планетах, является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда. Не стоит, впрочем, забывать, что не любая водная среда пригодна для жизни.
В результате бомбардировки лунного кратера, проведённой 9 октября 2009 года НАСА с использованием космического аппарата LCROSS, впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объёмах[22].
Вода широко распространена в Солнечной системе. Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: Энцеладе[23][24], Тефии, Европе, Ганимеде и др. Вода присутствует в составе всех комет и многих астероидов. Учёными предполагается, что многие транснептуновые объекты имеют в своём составе воду.
Вода в виде паров содержится в атмосфере Солнца (следы)[25], атмосферах Меркурия (3,4 %, также большие количества воды обнаружены в экзосфере Меркурия)[26], Венеры (0,002 %)[27], Луны[28], Марса (0,03 %)[29], Юпитера (0,0004 %)[30], Европы[31], Сатурна, Урана (следы)[32] и Нептуна[33] (найден в нижних слоях атмосферы).
Содержание водяного пара в атмосфере Земли у поверхности колеблется от 3—4 % в тропиках до 2·10−5% в Антарктиде[34].
Кроме того, вода обнаружена на экзопланетах, например HD 189733 A b[35], HD 209458 b[36] и GJ 1214 b[37].
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет, наиболее вероятно, на Европе — спутнике Юпитера.
 Полный стакан с водой
Полный стакан с водой Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений.
Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить. Существует и другая точка зрения: если бы вода не расширялась при замерзании, то не разрушались бы клеточные структуры, соответственно замораживание не наносило бы ущерба живым организмам. Некоторые существа (тритоны) переносят замораживание/оттаивание — считается что этому способствует особый состав клеточной плазмы, не расширяющейся при замораживании.
Земледелие[править | править вики-текст]
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90 % в некоторых странах.
Питьё и приготовление пищи[править | править вики-текст]
Живое человеческое тело содержит от 50 % до 75 % воды[38], в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья[39][40].
Растворитель[править | править вики-текст]
Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
Теплоноситель[править | править вики-текст]
Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР)Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Замедлитель[править | править вики-текст]
Во многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции. Также существуют тяжеловодные реакторы, в которых в качестве замедлителя используется тяжёлая вода.
Пожаротушение[править | править вики-текст]
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены.
Спорт[править | править вики-текст]
Многими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это подводное плавание, хоккей, лодочные виды спорта, биатлон, шорт-трек и др.
Инструмент[править | править вики-текст]
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Смазка[править | править вики-текст]
Вода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках[41].
Происхождение воды на планете[править | править вики-текст]
Происхождение воды на Земле является предметом научных споров. Некоторые учёные считают, что вода была занесена астероидами или кометами на ранней стадии образования Земли, около четырех миллиардов лет назад, когда планета уже сформировалась в виде шара. В настоящее время установлено, что вода появилась в мантии Земли не позже 2,7 миллиарда лет назад[42].
Гидрология[править | править вики-текст]
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
Гидрогеология[править | править вики-текст]
Гидрогеоло́гия (от др.-греч. ὕδωρ «водность» + геология) — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой. В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Гидрогеология тесно связана с гидрологией и геологией, в том числе и с инженерной геологией, метеорологией, геохимией, геофизикой и другими науками о Земле. Она опирается на данные математики, физики, химии и широко использует их методы исследования. Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений.
- В среднем в организме растений и животных содержится более 50 % воды[43].
- В составе мантии Земли воды содержится в 10-12 раз больше, чем в Мировом океане[44].
- При средней глубине в 3,6 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.
- Если бы на Земле не было впадин и выпуклостей, вода покрыла бы всю Землю слоем толщиной 3 км[45].
- Если бы все ледники растаяли, то уровень воды в земных океанах поднялся бы на 64 м и около 1/8 поверхности суши было бы затоплено водой[46].
- Морская вода при обычной её солёности 35 ‰ замерзает при температуре −1,91 °C[47].
- Иногда вода замерзает при положительной температуре[48].
- При определённых условиях (внутри нанотрубок) молекулы воды образуют новое состояние, при котором они сохраняют способность течь даже при температурах, близких к абсолютному нулю[49].
- Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
- Синий цвет чистой океанской воды в толстом слое объясняется избирательным поглощением и рассеянием света в воде.
- С помощью капель воды из кранов можно создать напряжение до 10 киловольт, опыт называется «Капельница Кельвина».
- Вода — это одно из немногих веществ в природе, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают сурьма[50], висмут, галлий, германий и некоторые соединения и смеси).
- Вода и водяной пар горят в атмосфере фтора фиолетовым пламенем. Смеси водяного пара со фтором в пределах взрывчатых концентраций взрывоопасны. В результате этой реакции образуются фтороводород и элементарный кислород.
- ↑ англ. International Union of Pure and Applied Chemistry. Nomenclature of Inorganic Chemistry. IUPAC RECOMMENDATIONS 2005. RSC Publishing, 2005. — p. 306.
- ↑ 1 2 Маленков Г. Г. Вода // Физическая энциклопедия. — М.: Советская энциклопедия, 1988. — Т. I. Ааронова — Бома эффект — Длинные линии. — С. 294—297.
- ↑ Henniker, J. C. (1949). «The Depth of the Surface Zone of a Liquid». Reviews of Modern Physics (Reviews of Modern Physics) 21 (2): 322–341. DOI:10.1103/RevModPhys.21.322.
- ↑ Pollack, Gerald. Water Science. University of Washington, Pollack Laboratory. — «Water has three phases – gas, liquid, and solid; but recent findings from our laboratory imply the presence of a surprisingly extensive fourth phase that occurs at interfaces.» Проверено 5 февраля 2011. Архивировано из первоисточника 15 февраля 2013.
- ↑ Моря принесены на Землю из космоса?
- ↑ CIA- The world fact book. Central Intelligence Agency. Проверено 20 декабря 2008.
- ↑ 1 2 Marine Science: An Illustrated Guide to Science
- ↑ 1 2 Gleick, P.H. Water in Crisis: A Guide to the World's Freshwater Resources. — Oxford University Press, 1993.
- ↑ Water Vapor in the Climate System (англ.). American Geophysical Union. Проверено 13 февраля 2013. Архивировано из первоисточника 15 февраля 2013.
- ↑ United Nations. Un.org (22 марта 2005). Проверено 25 июля 2010. Архивировано из первоисточника 15 февраля 2013.
- ↑ 1 2 3 Ларионов А. К. Занимательная гидрогеология. — Москва: Недра, 1979. — С. 5-12. — 157 с.
- ↑ 1 2 3 Петрянов И.В. Самое необыкновенное вещество // Химия и жизнь. — 1965. — № 3. — С. 2—14.
- ↑ Свойства воды. Физические свойства воды
- ↑ Основные физические свойства воды, водяного пара, льда, снега
- ↑ Коэффициенты поверхностного натяжения жидкостей
- ↑ Surface tension (англ.)
- ↑ Молекулярные преобразователи энергии в живой клетке (Тихонов А. Н., 1997)
- ↑ П. И. Воскресенский Техника лабораторных работ. 9-е изд. Л.: «Химия», 1970. С. 696—697
- ↑ Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 7. Атомы // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 15—18. — 240 с. — 1 630 000 экз.
- ↑ Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 200. — ISBN 5-7155-0292-6.
- ↑ Le Caër S. (2011). «Water Radiolysis: Influence of Oxide Surfaces on h3 Production under Ionizing Radiation». Water 3: 236.
- ↑ Вода на Луне: но откуда?
- ↑ NASA Space Assets Detect Ocean inside Saturn Moon. NASA (3 April 2014). Проверено 3 апреля 2014.
- ↑ (4 April 2014) «The Gravity Field and Interior Structure of Enceladus». Science (journal) 344: 78-80. DOI:10.1126/science.1250551. Проверено 3 April 2014.
- ↑ Solanki, S. K. (1994). «New Light on the Heart of Darkness of the Solar Chromosphere». Science 263 (5143): 64–66. DOI:10.1126/science.263.5143.64. PMID 17748350. Bibcode: 1994Sci...263...64S.
- ↑ MESSENGER Scientists 'Astonished' to Find Water in Mercury's Thin Atmosphere. Planetary Society (3 июля 2008). Проверено 5 июля 2008. Архивировано из первоисточника 16 октября 2010.
- ↑ Bertaux, Jean-Loup (2007). «A warm layer in Venus' cryosphere and high-altitude measurements of HF, HCl, h3O and HDO». Nature 450 (7170): 646–649. DOI:10.1038/nature05974. PMID 18046397. Bibcode: 2007Natur.450..646B.
- ↑ Sridharan, R.; S.M. Ahmed, Tirtha Pratim Dasa, P. Sreelathaa, P. Pradeepkumara, Neha Naika, and Gogulapati Supriya (2010). «'Direct' evidence for water in the sunlit lunar ambience from CHACE on MIP of Chandrayaan I». Planetary and Space Science 58 (6). DOI:10.1016/j.pss.2010.02.013. Bibcode: 2010P&SS...58..947S.
- ↑ Donald Rapp. Use of Extraterrestrial Resources for Human Space Missions to Moon or Mars. — Springer, 28 November 2012. — P. 78–. — ISBN 978-3-642-32762-9.
- ↑ (2005) «Coupled Clouds and Chemistry of the Giant Planets — A Case for Multiprobes» (PDF). Space Science Reviews 116: 121–136. DOI:10.1007/s11214-005-1951-5. ISSN 0032-0633. Bibcode: 2005SSRv..116..121A.
- ↑ Hubble Sees Evidence of Water Vapor at Jupiter Moon. NASA (December 12, 2013). Проверено 12 декабря 2013.
- ↑ Encrenaz, 2003, p. 92.
- ↑ Hubbard, W. B. (1997). «Neptune's Deep Chemistry». Science 275 (5304): 1279–1280. DOI:10.1126/science.275.5304.1279. PMID 9064785.
- ↑ Земля (планета) — статья из Большой советской энциклопедии.
- ↑ Water Found on Distant Planet 12 July 2007 By Laura Blue, Time
- ↑ Water Found in Extrasolar Planet’s Atmosphere
- ↑ Атмосфера экзопланеты GJ 1214b переполнена водой. Компьюлента (24 февраля 2012). — «Новые наблюдения транзитов GJ 1214 b, удалённой от Земли на 40 световых лет, показали, что вода должна составлять не менее половины от всей массы атмосферы этой «суперземли»» Проверено 21 июля 2013. Архивировано из первоисточника 29 августа 2013.
- ↑ Watson, P. E. et al. (1980) Total body water volumes for adult males and females estimated from simple anthropometric measurements, The American Journal for Clinical Nutrition, Vol. 33, No 1, pp.27-39.
- ↑ Моргунова Г.С. Вода, которую мы пьём // Химия и жизнь. — 1965. — № 3. — С. 15—17.
- ↑ Sharma B.K. Water Pollution. — 1994. — P. 408-409.
- ↑ Воскресенский В. А., Дьяков В. И. Глава 2. Смазочные вещества и их физико-химические свойства // Расчет и проектирование опор скольжения (жидкостная смазка): Справочник. — М.: Машиностроение, 1980. — С. 15. — (Библиотека конструктора). — ISBN ББК 34.42, УДК 621.81.001.2 (031).
- ↑ Ученые: вода появилась в мантии Земли 2,7 млрд лет назад. ТАСС. Проверено 26 апреля 2016.
- ↑ Наука и техника. Книги. Загадки простой воды.
- ↑ Состав и природа минтии Земли
- ↑ Биосфера Земли
- ↑ Загадки простой воды
- ↑ Дайвинг: статьи, каталог снаряжения, обучение, магазины, клубы и центры
- ↑ Всеволод Арабаджи. Загадки простой воды. 2001
- ↑ Science Daily (англ.)
- ↑ Сурьма // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 235. — ISBN 5-7155-0292-6.
arquivo.pt