1. Физико-химические свойства воды. Органические свойства воды
Органолептические свойства и показатели воды
Похожие материалыОрганолептические свойства воды — это именно те ее признаки, которые воспринимают органы чувств человека. Данные свойства оцениваются по интенсивности восприятия. У определении таких свойств участвуют обонятельные, вкусовые и зрительные, органы чувств. Получаемые ими ощущения обусловлены как физическими характеристиками воды, так и наличием в ней каких-либо посторонних химических веществ.
К ним относятся запах, вкус, цвет и прозрачность, т. е. те свойства, которые могут быть определены органами чувств человека. Мутная, окрашенная в какой-либо цвет или имеющая неприятный запах и вкус вода неполноценна в санитарно-гигиеническом отношении даже в том случае, если она безвредна для организма человека. Это обусловлено тем, что к мутной, окрашенной и неприятно пахнущей воде человек испытывает неприятное чувство, достигающее иногда отвращения. Ухудшение свойств воды отрицательно сказывается на водно-питьевом режиме, рефлекторно влияет на многие физиологические функции, в частности на секреторную деятельность желудка.
Наличие хороших органолептических свойств воды делает такую воду пригодной для употребления человеком. Так, хорошие органолептические свойства воды очень сильно влияют на функциональность всех систем организма человека. Так, чистая приятная на вкус вода серьезно повышает остроту зрения и увеличивает частоту сердечных сокращений, а неприятная – снижает данные показатели.
Органолептические показатели воды
Прозрачность. Это важный показатель чистоты воды. Под прозрачностью воды понимается ее способность пропускать свет и делать видимыми предметы, находящиеся на определенной глубине. Прозрачность воды определяется количеством содержащихся в ней механических и химических примесей.
Мутная вода всегда подозрительна в эпидемиологическом отношении, так как в ней создается питательная среда для различных микроорганизмов, а значительная мутность препятствует свободному проникновению в глубь водоема солнечных ультрафиолетовых лучей и их бактерицидному действию на микроорганизмы.
Прозрачность питьевой воды должна быть не менее 30 см, а воды плавательных бассейнов — 20 см.
Цвет. Питьевая вода должна быть бесцветной. Окраска воды, как и ее мутность, делает воду неприятной для питья. Совершенно бесцветная вода встречается редко, например в подземных водоносных слоях. В открытых водоемах вода обычно имеет тот или иной оттенок. Желтоватый оттенок чаще всего свидетельствует о наличии в воде солей железа или гуминовых веществ, образующихся в процессе гниения или разложения растительных остатков. Он характерен для воды болот. Зеленоватый цвет воде придают микроводоросли.
Запах. Чистая питьевая вода не должна иметь никакого запаха. Любой запах указывает на присутствие в воде либо продуктов биологического распада растительных или животных организмов, либо каких-либо химических соединений, посторонних для питьевой воды. Например, запах сероводорода указывает на возможное наличие в воде патогенных микроорганизмов. Хотя иногда это лишь следствие избыточного количества в воде солей серной кислоты, например сернистого железа. Это чаще всего характерно для определенных минеральных вод. Фенольный, смоляной и другие запахи свидетельствуют о возможном загрязнении воды промышленными сточными водами, запах хлора — об избыточных концентрациях остаточного хлора, используемого для обеззараживания питьевой воды и воды в плавательных бассейнах (выше 0,5—0,6 мг в 1 л воды).
Вкус. Питьевая вода не должна иметь посторонних привкусов. Вкус воды зависит от ее минерального состава, температуры, концентрации растворенных в ней газов (кислорода и углекислого газа). Кипяченая вода менее вкусна вследствие потери газов и двууглекислых солей кальция и магния. Изменения вкуса воды или появление неприятного вкуса свидетельствуют о возможном наличии в ней органических веществ, продуктов распада различных органических веществ животного или растительного происхождения.
Температура. Наиболее благоприятной для питьевой воды считается температура +7...+12°С. Такая вода эффективнее утоляет жажду, способствует охлаждению слизистой оболочки полости рта и пищевода и вызывает усиление деятельности слюнных желез.
Все органолептические показатели воды характеризуются показателями из двух основных подгрупп. Первые из них, физико-органолептическими, представляют собой совокупность органолептических признаков, которые воспринимаются органами чувств. Вторые, химико-органолептические показатели свидетельствуют о содержании в воде определенных химических веществ, которые способны раздражать соответствующие анализаторы.
Прием воды, имеющей температуру 5° С и ниже, приводит к подавлению желудочной секреции, нарушению пищеварения. Очень холодная вода может привести к местному переохлаждению носоглотки и простудным заболеваниям, особенно если употреблять такую воду в разгоряченном состоянии, например сразу же после тренировочных занятий.
Температура воды имеет большое гигиеническое значение и при купании и плавании. В соответствии с гигиеническими нормативами вода в закрытых плавательных бассейнах (для взрослых) должна иметь температуру +25...+26°С, а для детей - не менее +26 °С. Температура воды в естественных водоемах не нормируется.
Температура воды служит одним из гигиенических показателей ее качества. Чем глубже от поверхности почвы залегает водоносный слой, тем меньше вероятность проникновения в нее различных загрязнителей. Это объясняется как фильтрацией возможных загрязнителей при их прохождении с поверхностными водами через толстые слои почвы, так и за счет наличия в почве водонепроницаемых слоев. Одновременно это сопровождается и снижением температуры воды по мере удаления водоносного пласта от поверхности почвы и определяется как постоянство температуры воды на большой глубине. Вода из глубоких подземных водоносных слоев всегда имеет более низкую и постоянную температуры, она чище, чем вода из водоносных слоев высокого залегания (расположенных близко к поверхности почвы).
Химический состав воды. В природе вода практически всегда содержит большее или меньшее количество растворенных в ней минеральных солей. Степень и минеральный состав воды определяются характером почвы или грунтов, прилегающих к водоносным слоям или поверхностным водоисточникам.
Количество минеральных солей, содержащихся в воде, выражается в мг/л.
Характеристика питьевой воды
Питьевая вода является очень важным продуктом питания. Точно также как и кислород, обычную воду можно рассматривать как настоящий эликсир жизни, поскольку организм сможет выжить без поступления в него воды извне не более нескольких дней. В употребляемой нами питьевой воде всегда должно быть мало минералов, или мало солей. Такая малосольность и есть самая главная характеристика питьевой воды.
Органические вещества. Из них самые важные — вещества животного происхождения, поскольку именно они могут содержать различные патогенные микробы. Косвенным гигиеническим показателем наличия или отсутствия этих веществ в воде служит окисляемость воды.
Окисляемость воды. Это количество кислорода (мг), расходуемого на полное окисление органических веществ, содержащихся в 1 л воды (обозначается — мг/л). Чем меньше в воде органических веществ, тем меньше величина расхода кислорода на полное окисление содержащихся в 1 л воды органических веществ. Например, окисляемость чистых подземных вод, как правило, не бывает более 2—4 мг/л, речных — в пределах 7 мг/л.
Одним из показателей возможного присутствия в воде органических веществ служит количество растворенного в ней кислорода (мг). В чистых водоемах растворено 3—6 мг/л кислорода, а в загрязненных — намного меньше, вплоть до полного отсутствия.
О возможном загрязнении воды органическими веществами животного происхождения свидетельствует наличие аммиака, солей азотистой и азотной кислот. Аммиак — это продукт начальных стадий гниения органических веществ животного происхождения, а соли азотной и азотистой кислот - конечные продукты минерализации органических веществ. Их наличие указывает на давнее загрязнение воды.
Присутствие в воде солей соляной и серной кислот — показатель возможного загрязнения воды экскрементами животных и человека (фекального загрязнения). Обычно в 1 л чистой природной воды содержится не более 20—30 мг хлоридов.
Жесткость воды. Она определяется содержанием в ней солей кальция и магния. Различают воду мягкую, умеренно жесткую и жесткую. Выделяют общую жесткость воды — жесткость сырой воды, устранимую жесткость, уменьшающуюся при кипячении или отстаивании, и неустранимую, не снижающуюся даже после кипячения воды.
В жесткой воде плохо развариваются овощи и мясо, потому что находящиеся в них белки образуют с кальцием и магнием нерастворимые соединения, не усваивающиеся в кишечнике человека.
Такая вода не подходит и для гигиенических процедур: наличие в ней избыточного количества солей препятствует пенообразованию, нерастворимые соединения оседают на волосах и затрудняют процесс мытья.
Жесткость питьевой воды не должна превышать 7 мг/л. Эту характеристику можно измерять и в градусах (1 мг/экв жесткости воды равен 2,8°). Жесткой считается вода, имеющая больше 20°, мягкой — менее 10°.
Соли железа. Вода, содержащая железо, безвредна, но в избыточных количествах оно придает ей горьковатый металлический вкус и желтую или желто-бурую окраску, снижая прозрачность. В питьевой воде допускается до 0,5 мг/л железа (в открытых водоемах) и 1,0 мг/л (в подземных источниках).
Фтор. Содержащийся в питьевой воде, он оказывает значительное влияние на состояние зубов. При его повышенной концентрации возникает флюороз (появление темных пятен на эмали зубов), ведущий к полному их разрушению, а при недостаточном содержании учащается заболеваемость кариесом. В воде должно находиться не более 1,5 мг/л фтора, оптимальное количество — 0,7—1,0 мг/л. Если фтора не хватает, воду искусственно фторируют, т. е. добавляют фтористый натрий.
Действия воды на человеческий организм достаточно трудно переоценить, ведь вода входит в состав практически тканей, и без нее просто невозможно нормальное функционирование нашего организма. Вода отвечает за осуществление процесса обмена, за поддержание теплового баланса, за удаление продуктов метаболизма и многое другое. Обезвоживание организма всего лишь на несколько процентов приводит к нарушению его жизнедеятельности
all-gigiena.ru
Лекция_2_свойства_воды
Лекция № 2. Основные особенности воды как среды обитания
Вода́ (оксид водорода) — химическое вещество в виде прозрачной жидкости, не имеющей цвета (в малом объёме), запаха и вкуса (при нормальных условиях). Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, лёд).
Вода как физико-химическое тело оказывает непрерывное влияние на жизнь гидробионтов. Вода предоставляет организмам опору, приносит им пищу, кислород, уносит продукты метаболизма, переносит половые продукты. Благодаря подвижности воды в гидросфере возможно существование прикрепленных форм животных, которых нет на суше, и осуществляет пассивное расселение гидробионтов. Поэтому физико-химические свойства воды представляют собой один из важнейших факторов абиотической среды для обитателей пелагиали и бентали.
Химические свойства и строение воды: Молекула простой или легкой воды состоит из двух атомов водорода (протия) и одного атома кислорода.
Среди населения бытует миф о том, что при длительном кипячении природной воды концентрация тяжёлой воды в ней повышается, что якобы может вредно сказаться на здоровье. В действительности же реальное повышение концентрации тяжёлой воды при кипячении ничтожно (менее процента) и к тому же, как сказано выше, тяжёлая вода практически не ядовита. Гораздо сильнее сказывается на вкусе и свойствах воды при кипячении повышение концентрации растворённых солей.
Термические свойства воды
В результате действия сил электростатического притяжения молекулы воды образуют между собой комплексы или агрегаты молекул определенной структуры. Которая зависит от температуры и постоянно меняется. Вода много структурное вещество. Перестройка структуры воды при изменении температуры делает многие физико-химические свойства воды аномальными.
Одной из таких аномалий является способность воды расширятся при замерзании и и иметь большую плотность при температуре 4°С
В воде в жидком состоянии одновременно можно встретить одиночные молекулы (гидроли), и ассоциации из двух дигидроли , тригидроли и до восьми форм. При явном преобладании дигидролей. При замерзании температуры количество дигидролей уменьшается а начинают преобладать пяти-восьмичленные ассоциации воды тетроидраедной формы при которой молекулы группируются в виде призм с полым пространством внутри. Поэтому плотность льда уменьшается и лед всплывает к поверхности. При этом увеличивается удельный объем воды увеличивается. Плотность чистого льда меньше чем плотность чистой воды поэтому лед держится на поверхности предохраняя водоемы от промерзания. Самая плотная вода в пресноводных водоемах находится в интервале от +4° С до 0 . Поэтому относительно теплая и самая плотная вода опускается на дно, что также препятствует перемерзанию водоемов, а подледные холодные воды не погружаются в глубину, плавая на более теплых. При нагревании свыше 4°С плотность воды опять уменьшается поэтому более теплые и менее плотные воды поднимаются вверх. Образующая слоистость, или температурная стратификации
Теплоемкость
Вода обладает высокой теплоемкость. Удельной теплоемкостью воды называется количество тепла необходимое для нагревания 1 кг воды на 1 градус. Она равна 4,19*103 Дж/(кгК) .Большая теплоемкость воды играет значительную роль в процессе охлаждения и нагревания водоемов, а также в формировании климатических условий прилагающих районов). Вода медленно охлаждается и нагревается как во время суток так и при смене сезонов. Максимальное колебание температуры в Мировом океане не превышает 40°С, в то время как в воздухе эти колебания могут достигать 100-120°С.
Теплопроводность (или перенос тепловой энергии) воды незначителен. Поэтому вода снег и лед плохо проводят тепло. В водоемах передача тепла на глубины происходит очень медленно.
Эти свойства обуславливают образование слоистости воды на разных горизонтах или температурную стратификацию., потому что низкая теплопроводность существенно тормозит выравниванию температурных градиентов в пелагиали водоемов.
Термостабильности воды способствует высокая теплота парообразования (539 кал/г) и плавления льда (80 кал/г).
Плотность воды и давление
Плотность воды при 4°С равна 1 г/см2 Плотность может повышается за счет растворенных в ней солей и при изменении температуры, последнее изменяется не так существенно но все равно оказывает большое значение на гидробионтов обитающих в толще воды изменяя условия их плавания.
Другое значение плотности как экологического фактора связано с давление на организм которое с глубиной повышается. С углублением на 10 м давление воды повышается на 1 атм.
Вязкость воды
Вода обладает сравнительно небольшой вязкостью. Малая вязкость облегчает организмам плавание. Вязкость может изменятся при изменении солености и температуры воды. Существенно влияя на скорость передвижения особенно мелких организмов. Огромное влияния вязкость оказывает на скорость погружения. Вязкость воды облегчает организмам парение в толщи. У многих гидробионтов выработались адаптации направленные на на увеличение сил трения с водой особенно летом когда вязкость ее снижается.
Поверхностное натяжение воды.
Внутримолекулярные силы проявляются внутри воды в виде сил сцепления, а на свободной поверхности в виде вил прилипания (адгезии). Силы сцепления обуславливают вязкость а силы адгезии поверхностное натяжение. На свободной поверхности межмолекулярные силы стремятся втянуть все молекулы во внутрь жидкости и уменьшить свободную поверхность. В результате возникает сила поверхностного натяжения. С эти м явлением и смачиванием связана способность воды подниматься по капиллярам.
Химический состав природной воды.
В следствии полярности молекулы вода обладает высокой силой растворимости веществ. Вода в природе сложный раствор солей, газов, биогенных веществ, микроэлементов и органики.
Химический состав природной воды можно разделить на 5 групп
Главные ионы: хлоридные -Cl , сульфатные SO2-4, гидрокарбонатные – HCO-3, карбонатные – CO2-3, ионы натрия – Na+, Калия K+, магния – Mg+и кальция Ca+.
Растворенные газы: кислород – O2 азот – N2, двуокись углерода CO2, водород – H, сероводород- h3S и др.
Биогенные вещества: соединения азота, фосфора, кремния.
Микроэлементы
Органическое вещество.
Газы присутствуют в воде в виде молекул, соли в виде ионов и комплексов, а минеральные и органические вещества в виде коллоидов.
Оптические свойства воды.
Определяются общими законами – отражения, преломления, и рассеивания света. Попав в воду часть суммарной световой энергии поглощается или рассеивается. Вода – полупрозрачная среда, оптически более плотная чем воздух. Поэтому поток световой энергии попадая в воду быстро слабеет. В наиболее прозрачной воде на глубину 10 м проникает 85% солнечной энергии. На 5 м – 30%, на 100 м 3.5%. На глубине 150 м сумеречная освещенность, а на глубине 200 м практически полная темнота.
На практике надежным показателем оптических свойств воды является ее прозрачность и свет. Которая зависит от наличия взвесей и планктонных организмов. В прибрежных районах прозрачность ниже. В океане возрастает из-за отсутствия планктона
Цвет воды- . Цвет зависит от оптических свой ст воды и толщины просматриваемого слоя. Различают синий, зеленый, и бурый.
Акустические свойства- воды. В воде звук распространяется на очень большие расстояния и с большей скоростью чем в воздухе. Но звуковые лучи плохо преодолевают границу вода-воздух. Скорость звука в воде равна 1400-1550 м/с. Высокочастотные колебания затухают быстрее но могут быть узконаправленные, низкочастотные распространяются на далекие расстояния но более широкие. Собственные шумы водоема создаются движением масс, а биологические шумы жизнедеятельностью животных и их скоплений.
Контрольные вопросы.
Химическое строение воды
Термические свойства воды, теплоемкость и теплопроводность
Давление и плотность
Поверхностное натяжение
Химический состав природных вод
Оптические свойства воды
Акустические свойства воды.
studfiles.net
13.2. Физико-химические свойства воды и их значение для природных процессов
Вода – простейшее химическое соединение водорода с кислородом. Химически чистая вода состоит из 11,19 % водорода и 88,81 % кислорода (по весу). Вода – самое распространенное и самое необыкновенное вещество на Земле благодаря своим аномальным свойствам. В земных условиях только вода находится в трех физических агрегатных состояниях: твердом (лед, снег), жидком (вода) и газообразном (пар). В парообразном состоянии (при температуре 100 °С) вода состоит главным образом из простых молекул, называемых гидролями (Н2О). В жидкой фазе вода представляет собой смесь гидролей (Н2О) двойных молекул – дигидролей (Н2О)2 и тройных молекул – тригидролей (Н2О)3. В твердой фазе (лед) в воде преобладают тригидроли (Н2О)3. Переход воды из одного состояния в другое происходит быстро и сопровождается или поглощением тепла (при испарении, таянии льда и снега) или выделением тепла (при конденсации и сублимации водяного пара, при замерзании воды), но на температуру самой воды (льда) это не влияет. При этом скачкообразно изменяются физические и химические свойства воды. Химически чистая вода при нормальном атмосферном давлении 760 мм (1013 гПа) кипит при 100 °С, замерзает при О°С (это и температура плавления льда), имеет наибольшую плотность при температуре +4 °С.
Теплоемкость. Вода – одно из самых теплоемких в природе тел. Удельной теплоемкостью вещества называется количество теплоты, необходимое для нагревания 1 кг вещества на 1 °С. Вследствие высокой теплоемкости воды океанов, морей и озер поглощают огромное количество тепла летом, являясь его мощными аккумуляторами. Зимой воды, охлаждаясь, отдают тепло в атмосферу. Этим объясняется большое умеряющее (летом охлаждающее, зимой отепляющее) влияние океанов и морей на климат прилегающих материков в умеренных и высоких широтах. В экваториально-тропических теплоэнергетических зонах вода нагревается весь год и тепло морскими течениями и воздушными потоками передается в умеренные и полярные широты. Это перераспределение тепла имеет огромное климатическое значение.
Для воды характерны высокие значения теплоты испарения (597 кал/г) и теплоты плавления (79,4 кал/г). Эти свойства очень важны для живых организмов. Высокая теплота испарения обеспечивает защиту их от перегрева, а большая теплота плавления – от переохлаждения.
Теплопроводность воды весьма незначительна. Поэтому нагревание воды в естественных водоемах происходит не столько путем молекулярной теплопроводности, сколько путем плотностной конвекции, перемешивания воды
вследствие течений и волнения. При отсутствии перемешивания воды в озерах наблюдается вертикальная термическая слоистость (стратификация).'Лед и особенно снег обладают еще меньшей теплопроводностью, чем вода. Поэтому лед, возникнув на поверхности водоема, предохраняет воду от дальнейшего охлаждения, а снег – почву от промерзания, бесснежие же губит озимые культуры.
Плотность воды зависит от температуры и солености. Наибольшая плотность химически чистой воды достигается при температуре +4°С, а выше и ниже +4°С плотность воды уменьшается – вода становится легче. Это удивительное аномальное свойство воды по сравнению с другими жидкостями, плотность которых при понижении температуры и затвердевании увеличивается, объясняется тем, что одиночные молекулы воды Н2О (моногид-роли) могут объединяться и образовывать сложные молекулы: дигидроли и тригидроли. Они более крупные по объему, но относительно рыхлые, ажурные по структуре и поэтому более легкие. При понижении температуры воды происходит, с одной стороны, нормальное уменьшение объема и уплотнение воды, вызванное охлаждением, как у всех жидкостей, а с другой – увеличение объема и соответственно уменьшение плотности воды из-за объединения молекул воды в более сложные, но более легкие. При охлаждении воды до +4°С преобладает первый процесс, при температуре +4°С оба процесса уравновешиваются, поэтому плотность наибольшая, при дальнейшем охлаждении воды ниже +4°С преобладает второй процесс. Плотностная аномалия воды имеет громадное значение для природных вод. Во-первых, при осеннем охлаждении пресных водоемов до +4°С более холодная и плотная вода с поверхности опускается и обогащает глубинные слои кислородом, как бы подготавливая водоем к зиме. Во-вторых, вследствие этой аномалии водоемы даже в условиях сурового климата не промерзают до дна, за исключением совсем мелких, поскольку при охлаждении воды ниже +4°С вплоть до О °С верхние слои воды становятся менее плотными, более легкими и удерживаются на поверхности. Так как молекулярная теплопроводность воды и льда невелика, верхние слои предохраняют от охлаждения ниже расположенные толщи воды; живые организмы тем самым уберегаются от гибели. Весной после таяния льда и нагревания воды в верхнем ее слое до +4°С она становится тяжелее, плотнее и опускается вниз, обогащая глубинные слои кислородом, что очень важно для жизни, так как после зимы запасы кислорода в водоемах истощаются. Но это опускание прекращается после достижения температуры +4°С, ибо при
последующем прогревании поверхностная вода становится легче. Таким образом, благодаря плотностной аномалии воды сохраняется жизнь в водоемах в условиях холодных и умеренных климатических поясов.
Своеобразным свойством воды является резкое увеличение ее объема при замерзании. Объем льда примерно на 10% больше по сравнению с первоначальным объемом воды. И наоборот, плавление льда сопровождается не расширением, а сжатием и уменьшением объема воды. Это аномальное свойство воды объясняется тем, что при понижении температуры воды и переходе ее через 0°С происходит быстрое превращение почти всех ее молекул в тригидроли, что сопровождается скачкообразным увеличением объема льда. Увеличиваясь в объеме, лед становится менее плотным (плотность льда при замерзании воды составляет 0,91 г/см3), а значит, более легким, чем вода, и всплывает. Будучи плохим проводником тепла, лед предохраняет глубокие слои воды от замерзания. Свойство воды увеличиваться в объеме при замерзании играет огромную роль при разрушении горных пород путем физического («морозного») выветривания, поскольку, замерзая в трещинах пород, лед давит на их стенки и разрывает породу на мелкие части. Изменение объема воды при замерзании и таянии льда создает в области многолетней мерзлоты особый рельеф: бугры пучения при замерзании воды и впадины при таянии льдистых грунтов и линз льда.
Подвижность – характерное свойство жидкой воды. Движение воды происходит под действием силы тяжести, различия плотностей, под влиянием ветра, вследствие притяжения Луной и Солнцем и др. Перемешивание воды способствует выравниванию ее температуры, солености, химического состава и т. д. Велика роль движущейся воды в перераспределении тепла в океанах путем морских течений. Благодаря поверхностным текучим водам размываются, перемещаются и отлагаются огромные массы горных пород.
Термическая устойчивость воды весьма высока. Водяной пар разлагается на водород и кислород только при температуре выше 1000°С в высоких слоях атмосферы.
Поверхностное натяжение. Вода среди жидкостей, кроме ртути, обладает самым большим поверхностным натяжением. Благодаря этому свойству вода поднимается по капиллярам в грунтах, движется вверх в растениях, обеспечивая соответственно почвообразование и питание растений. Без воды земледелие было бы невозможно.
Вода – прекрасный растворитель, поэтому все воды представляют собой газосолевые растворы различного химического состава и различной концентрации. Концентрация растворенных в воде веществ характеризуется соленостью, обозначается символом S и выражается в промилле (%о), т. е. в тысячных долях (граммах вещества на килограмм воды). Соленость пресной воды менее 1%о, остальные воды в той или иной степени соленые. Большая часть химических элементов находится в воде в виде гидратированных ионов, газы – в виде растворенных молекул. Растворимость газов в воде больше при низких температурах и повышенном давлении. Обнаружилось, что вода изменяет свою растворяющую способность под воздействием искусственно создаваемого магнитного поля. Растворяющая способность воды обусловливает химическое выщелачивание (выветривание) горных пород, обмен веществами между компонентами природы внутри географической оболочки, между сушей и океаном, между организмами и средой. Вообще минерализация воды до определенного предела – основа жизни. Химически чистая вода для жизни непригодна.
Многообразен не только химический и молекулярный, но и изотопный состав природных вод, так как кислород и водород имеют несколько изотопов. В природных условиях известны атомы водорода с атомным весом 1 (Н1 – протий), 2 (Н2=Д – дейтерий) и 3 (Н3=Т – тритий) и атомы кислорода с атомным весом 16(О16), 17(О17) и 18(О18). Из сочетания изотопов водорода Н, Д и Т и кислорода О16, О17 и О18 образуется девять видов воды. Природная вода – смесь всех этих
видов. Причем на долю обыкновенной воды Н2'О16 приходится 99.7% на Земле. Все остальные виды воды, кроме обыкновенной, называются тяжелой водой. Наиболее существенно отличается от обыкновенной тяжелая вода Н22О16 (Д9О). Она имеет молекулярный вес 20, кипит при температуре 101,42°С, замерзает при температуре 0,8 °С, имеет максимальную плотность при 11,6 °С. Тяжелая вода нашла применение в атомной энергетике.
Способность к самоочищению – важное свойство воды. Оно осуществляется в процессе течения в реках, волнения в озерах и морях, фильтрации воды через грунт, в процессе испарения. Но при загрязнении выше определенных пределов эта способность нарушается.
Цвет воды. Вода имеет голубоватый оттенок, но в тонких слоях бесцветна. Оттенки цвета зависят от угла падения солнечных лучей, глубины проникновения света и от примесей.
Прозрачность воды определяется глубиной погружения белого диска диаметром 30 см. Прозрачность зависит от примесей. При большой прозрачности свет проникает на большую глубину, поддерживая необходимые условия для существования организмов.
Физические и химические свойства воды тесно взаимосвязаны. Особенно сильно изменяются свойства воды под влиянием температуры и давления. Удивительные свойства воды способствовали появлению и развитию жизни на Земле. Благодаря воде совершаются все процессы в географической оболочке.
studfiles.net
1. Физико-химические свойства воды
В ХIХ веке была открыта химическая формула этого соединения Н2О, которая, как тогда казалось, дает полную информацию о воде, но в 1932 году открылся новый сенсационный факт – помимо обыкновенной воды, существует еще и понятие «тяжелая» вода, а на сегодняшний день уже известно до 135 изотопных разновидностей воды. Состав отдельно взятой капли воды, при условии полного ее очищения от примесей минеральных и органических веществ, всегда уникален, а ее свойства меняются в зависимости от физической природы составляющих ее атомов, способа формирования молекулы, и от объединения этих молекул в химическое соединение [4-11].
Одним из самых замечательных и в то же время затрудняющим изучение воды свойством, является способность воды выступать в качестве универсального растворителя. Любое вещество, будь оно в твердом, жидком или газообразном состоянии, обязательно в какой-то степени растворяется в воде, поэтому вода всегда является раствором, имеющим очень сложный химический состав. И даже когда химический состав воды, взятой в различных местах, полностью идентичен, оказывается, что вода оказывает совершенно различное влияние на организм, так как условия формирования воды также определяют ее свойства.
Следует отметить, что в природе не существует абсолютно чистой воды, а наиболее близкой к этому понятию является дождевая вода, хотя даже она в своем составе имеет некоторое количество примесей, которые попадают в нее из воздуха. А наиболее характерным растворителем является морская вода, так как она может растворить практически любое вещество, а ее состав может включать до 70 элементов периодической системы Менделеева, начиная с хлора, магния, натрия, серы, кальция и калия, брома, углерода, стронция и бора, которые содержатся в морской воде в больших количествах, и заканчивая редчайшими радиоактивными элементами в очень небольших долях.
В зависимости от содержания в воде различных примесей ее можно разделить на несколько классов: пресную воду, соленую и рассолы. От этого зависит и цвет воды. На первый взгляд, любая вода – прозрачная бесцветная жидкость, не имеющая ни вкуса, ни запаха, однако глубокие воды моря или океана выглядят голубыми, а вода горных рек кажется зеленой, именно присутствие различных примесей в воде придает ей различный цвет. Казалось бы, при современном оборудовании и технологиях на сегодняшний день мы знаем о воде все, но открываются новые и новые факты, которые показывают, что вода обладает нераскрытым потенциалом, который еще только предстоит узнать человечеству.
Оказывается, что вода не только с древнейших времен служит для удовлетворения бытовых и промышленных нужд человека, но и защищает Землю летом от перегревания, а зимой, отдавая ей свое тепло, от перемерзания. Избыток углекислого газа, вырабатываемый в процессе жизнедеятельности человека, мог бы привести к катастрофическим последствиям, если бы не был поглощен водами мирового океана.
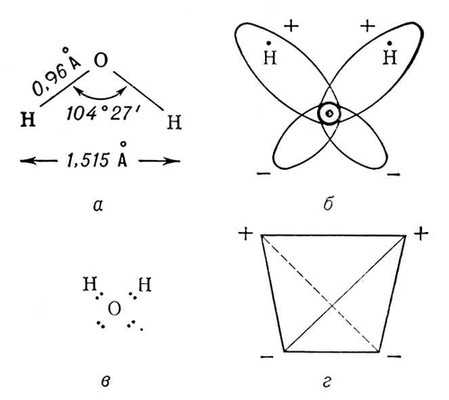
Вода обладает специфическими свойствами, которые не присущи не одному химическому соединению, так, к примеру, при переходе воды из жидкого состояния в твердое, она не увеличивает свою плотность, а увеличивает объем. Это связано с молекулярным строением льда: при замерзании молекулы располагаются на значительном расстоянии друг от друга, образуя рыхлую структуру льда, тем самым, увеличивая объем, но сохраняя массу, таким образом, вода в твердом состоянии (лед), легче, чем в жидком. Не обладай вода этим свойством, возникновение жизни на Земле не было бы возможно, так как возникший на поверхности водоема лед сразу же тонул и реки, моря и даже океаны промерзли бы до самого дна. Итак, одним из факторов, определяющих свойства воды, является ее молекулярный состав [10,11]. Молекула воды представляет собой равнобедренный треугольник в основании которого лежат атомы водорода, а вершиной является атом кислорода, валентный угол этого треугольника НОН составляет 104,31°, при этом атомы водорода настолько тесно прилегают к атому кислорода, что на первый взгляд, молекула имеет сферическую форму. Молекула воды имеет слабые водородные связи, что позволяет воде испаряться, то есть если поместить воду в открытый сосуд, то постепенно все молекулы воды переместятся в воздух. Если же сосуд закрыть, то вода будет испаряться до тех пор, пока не будет достигнуто некое равновесие, которое объясняется давлением, оказываемым молекулами водяного пара, скопившегося между крышкой сосуда и оставшейся водой. Испарение происходит даже в твердом состоянии воды, то есть с поверхности льда или снега. При этом вязкость воды напрямую зависит от ее температуры, чем выше температура, тем меньше вязкость, при достижении точки кипения воды вязкость уменьшается в 8 раз, нежели при ее точке замерзания. Воду практически невозможно сжать, а ее плотность максимальна при 4°С.
Физические характеристики воды таковы, что она переходит из твердого в жидкое состояние и наоборот (тает и замерзает) при одной и той же температуре 0°С. Температура кипения воды - 100°С, хотя и тут вода проявляет интереснейшие свойства: это правило соблюдается только при нормальном давлении, которое составляет 760 мм рт. ст., при понижении давления уменьшается и температура кипения воды, так на высоте 2900 м над уровнем моря, где атмосферное давление составляет 525 мм рт. ст., точка кипения воды составляет 90°С.
Земля на 75% покрыта водой, и природой постоянно поддерживается естественный круговорот воды: она испаряется с поверхности водоемов, а затем выпадает в виде осадков: дождя или снега, но даже при таком разумном решении, некоторые районы земного шара постоянно страдают от недостатка пресной воды. Именно поэтому стоит помнить, что вода – величайшее богатство, дарованное нам природой, и каждая ее капля – драгоценна, ведь жизнь человека невозможна без воды.
studfiles.net