Конспект урока по Химии "Состав , физические и химические свойства воды" 8 класс. 8 свойств воды
Еда. Часть 3. 8 свойств воды
В этой статье мы поговорим про воду. Какую воду можно пить, какую нельзя? Как изменить ее свойства? Что такое живая вода и что такое мертвая?
Вода имеет множество свойств, мы разберем ряд свойств воды и узнаем, как приготовить идеальную воду для питья.
1. Поверхностное натяжение воды.
Что такое поверхностное натяжение воды можно понять, если налить воду в стакан до краев, а потом по каплям добавлять в него воду. Вы увидите, что вода не начала сразу выливаться, а держится своеобразной «шапочкой».
На поверхность воды можно даже что-то положить. А такие насекомые, как водомерки, используют это свойство воды для передвижения.

Каким поверхностным натяжением должна обладать вода для питья?
Водопроводная вода имеет 70-75 дин/см2, а внутриклеточная 43 дин/см2. Поэтому водопроводная вода плохо проходит в клетки и плохо вымывает шлаки и токсины. Организму нужна текучая вода.
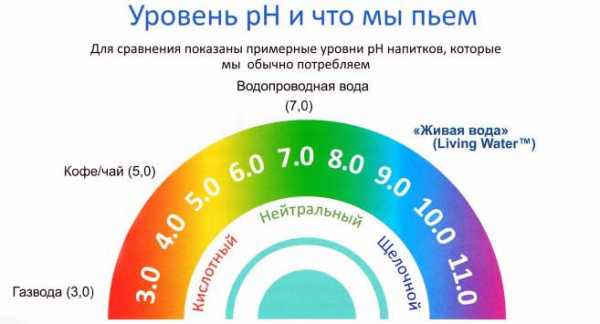
2. Ph – кислотность.
Ph – это сокращенное pondus hydrogenii — «вес водорода», т.е. мера активности ионов водорода. Как известно, ионы Н+ – это ионы кислоты, ионы OH- ионы щелочи. Т.е. если ионов Н больше, то значит вода кислотная, если ионов OH, то щелочная.
Измеряется Ph от 0 до 14. 0 – кислота, 14 – щелочь. 7 – нейтральный показатель. Щелочная вода считается живой, кислотная мертвой.
Пить нужно слабощелочную воду примерно 7,5 Ph. Т.к. клетки нашего организма имеют примерно такой же показатель. Если пить воду с Ph = 6, или 5, то организм будет закисляться.
PH кока-колы – примерно 3. Т.е. это сильнейшая кислота, с помощью нее можно даже накипь из чайника удалять.
3. Жесткость.
Жесткость – это содержание в воде солей щелочноземельных металлов (магния, кальция и других).
Слишком жесткая вода – вызывает образование камней в почках, другие болезни. Слишком мягкая вода не несет в себе нужных организму минералов.
Поэтому в рецепте по приготовлению полезной воды ниже мы сначала удалим все соли из воды, а потом искусственно насытим ее именно теми минералами, какие нам нужны.
Организм усваивает только органические минералы, поэтому этот процесс имеет очень большую важность. Мы удалим из воды неорганические минералы, и наполним органическими.
Чем отличаются неорганические минералы от органических?
Все очень просто: органические не имеют кристаллической формы.
Переход минералов из неорганической формы в органическую осуществляют растения, именно они извлекают минералы из земли и предоставляют их нам в удобном виде, в виде плодов.
Опять же вернемся к природе, во время эволюции люди не жевали песок и не лизали соляные камни, а ели то, что было вокруг. Природа предусмотрела именно этот путь минералов в наш организм. В органическом виде минералы легко усваиваются организмом.
4. ОВП – окислительно-восстановительный потенциал.
Все мы слышали про какие-то загадочные антиоксиданты и свободные радикалы. И все мы знаем, что антиоксиданты полезные, а свободные радикалы вредны.
Что это такое?
Свободные радикалы – частицы, у которых не хватает электронов на внешней оболочке. При попадении в организм свободные радикалы, как бы нуждаются в этих электронах, которых у них не хватает.
Процесс, когда какое-то вещество отнимает у другого электроны называется окисление. Окислитель отнимает электроны у других веществ. В предыдущих статьях, я писал, что сейчас в мире ужасающее количество еды, которая закисляет организм. Это очень сильно вредит здоровью.
Антиоксиданты – вещества, которые противостоят окислению в организме. Т.е. они нейтрализуют свободные радикалы.
ОВП – это способность жидкости принимать или отдавать свободные электроны.
Внутриклеточный ОВП нашего организма – минус 100. Минус, потому что электрон чисто условно считается отрицательно заряженной частицей. Поэтому заряд «минус» показывает наличие свободных электронов.
Т.е. минус – наличие электронов, это хорошо. Плюс – отсутствие электронов – это плохо (наличие в жидкости свободных радикалов).
ОВП водопроводной воды равна примерно плюс 200-300 мВ. Это вредная вода, полная свободных радикалов. Чтобы нейтрализовать негативное влияние свободных радикалов организму придется затратить энергию.
ОВП выпитой воды должна быть от минус 100. В идеале минус 200 и более. Тогда, организму не нужно будет тратить ресурс на то, чтобы все время бороться за правильный ОВП.
5. Температура.
Нельзя пить очень холодную или очень горячую воду.
Температура воды должна быть примерно 25-35 градусов. Вода холоднее 20 градусов считается холодной и организму потребуется энергия для того, чтобы ее нагреть. Пить воду больше 42 градусов тоже вредно, т.к. при контакте с тканями тела она уничтожает верхний слой клеток (все мы знаем, что ткани человека при такой температуре не живут).
На сколько важно пить воду правильной температуры. На самом деле очень важно, думаю у каждого были случаи в жизни, когда он выпивал 1-2 стакана холодной воды и после этого у него начинало болеть горло. Т.е. даже 1 стакана очень холодной воды достаточно, чтобы нанести вред здоровью.
Теперь о нагреве воды. Водопроводную воду лучше не кипятить до очистки.
При нагреве воды выше 65 градусов, в большом количестве образуются неорганические минералы и диоксины. Неорганические минералы мы можем наблюдать в виде накипи внутри чайника. Часть этой накипи естественно попадет в организм, а поскольку это водонерасворимая субстанция, эти минералы или выведутся из организма или отложатся на стенках сосудов, в разных органах и т.д.

Поэтому, если вы хотите вскипятить воду для чая, или сварить что-то, то лучше всего пропустите эту воду через фильтр обратного осмоса. Этот фильтр почти полностью очистит воду от солей и неорганические минералы не появятся в воде.
6. Химическая или биологическая чистота воды (химия, микроорганизмы).
Тут думаю все понятно. В воде не должно быть различных вредных веществ, микробов и бактерий. Что делать с водой, чтобы этого там не было, мы поговорим ниже.
7. Структура воды.
Структура воды – это способность воды создавать так называемые кластеры, т.е. это цепочки из молекул воды.
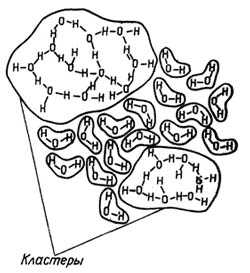
Неверная структура воды может нанести вред. Поэтому наша задача сбросить структуру воды.
Для этого воду нужно заморозить и разморозить. Замораживание изменяет структуру, именно поэтому вода из горных рек считается полезной, это талая вода.
8. Информационная память воды.
Массару Емото – японский исследователь, который проводил опыты с водой. Он разливал одну и ту же воду в разные емкости и произносил над ней различные слова. Потом он замораживал эту воду и фотографировал кристаллы.

Негативное влияние на воду оказывают отрицательные эмоции, электро-магнитное излучение (в том числе бытовая электроника), микроволновые волны. Поэтому не ругайтесь, внутри нас тоже есть вода и она тоже имеет память.
Наши мысли способны заложить в воду программу, наделить ее особыми свойствами.
Как сделать хорошую воду в домашних условиях?
Я постараюсь дать рецепт для приготовления воды, который каждый человек сможет легко и просто повторить.
Этап 1. Очистка. Обратный осмос или дистиллятор.
На этом этапе мы получаем практически чистую воду без примесей, дальше мы будем придавать ей полезные свойства.
Купите фильтр обратного осмоса или бытовой дистиллятор. Эти приборы практически полностью очищают воду от всех примесей.

Этап 2. Заморозить и разморозить.
Таким образом мы изменяем структуру воды. Для этой цели купите пищевые контейнеры известного производителя из качественного пластика.
Этап 3. Минерализовать самому.
Для этого можно применять уже готовые пакетики с органическими минералами.
Я использую вот такие пакетики с минералами органического происхождения.

С помощью поиска в интернете вы можете найти минералы различных производителей.
Как рассчитать сколько сыпать?
Пакетики рассчитаны для того, чтобы пить их просто растворяя в стакане воды.
Но наша задача не принимать ударные дозы минералов раз в несколько дней, что конечно тоже хорошо, но мы пойдем немного другим путем. Т.к. можно отдельно принимать минералы, но что за воду мы будем пить в остальное время?
Мы растворим минеральный комплекс в идеально очищенной воде так, чтобы получилась именно идеальная вода для питья.
В одном пакетике 240 мг кальция, 20 мг магния и 1740 мг других микроэлементов (если вы купите пакетики другого производителя, то цифры могут отличаться, в этом случае произведите рассчет сами).
В местах где проживали долгожители проводили анализ вод (исследования Друзьяка Н.Г.). И эти исследования показали, что содержание кальция в воде было от 8 до 20 мг/л. Т.е. это достаточно мягкая вода т.к. в водопроводной воде кальция от 30-140 мг/л.
Возьмем максимальное значение 20 мг/л, т.к. мы знаем, что кальций нам нужен и скорее всего он у нас уже в недостатке.
Считаем: 240/20 = 12 литров. Т.е. один пакетик нам нужно растворить в 12 литрах воды.
В итоге у нас получается слабощелочная вода очищенная от вредных примесей, неорганических минералов, бактерий, металлов и т.д., вода с природной структурой и насыщенная органическими минералами в нужном количестве.
Мы как бы повторили в домашних условиях природный процесс: очищение, таяние ледника, насыщение минералами. Возможно получилось даже лучше, т.к. минералы мы растворяем сами и знаем сколько там чего.
Этап 4. Заложить в воду намерение.
Осталось только заложить в воду намерение, зарядить воду информацией.
Как это сделать?
Все очень просто, вы можете поставить руки с двух сторон от сосуда и сказать (вслух или про себя) слова которыми вы хотите наделить воду.
Это могут быть слова благодарности, любви, пожелание здоровья своей семье и т.д. Также можно проговорить свои цели или цели своей семьи (свои цели произносите над отдельным стаканом).
Постарайтесь не просто произносить слова, а именно мысленно наделять воду нужной вам программой.
Внимание: если у вас плохое настроение в этот день, то пропустите этот пункт.
Как хранить воду?
Воду лучше всего хранить в стекле, глине или других природных материалах. Плохо хранить воду в пластике (есть безопасные виды пластика, но откуда же нам знать, честен ли производитель этих бутылок или нет). Еще плохо хранить воду металле.
Как пить воду?
Вода – это отдельный продукт. Ее нужно потреблять в чистой отдельно от приемов пищи.
Воду нужно пить за 30 минут до еды или через 1 час после.
Почему нельзя запивать пищу. Дело в том, что наш желудочный сок подготавливает еду к дальнейшему пищеварению, он разлагает кусочки еды на мельчайшие частицы и затем все это проходит дальше в двенатцатиперстную кишку.
Желудочный сок кислотный и имеет сильную концентрацию, если мы разбавим его водой, то он не сможет качественно растворить пищу, она пойдет в кишечник не подготовленной и плохо усвоится.
То же самое можно сказать и о непережеванной пище, желудок не сможет растворить большие куски.
Запить можно только какие-то сублимированные сухие или обезвоженные продукты (печенье например). В этом случае допускается выпить немного воды, чтобы это компенсировать.
Еще желудок осуществляет обеззараживание пищи, соответственно, если разбавить желудочный сок, то он не сможет этого сделать. И еще нельзя переедать, в этом случае желудок опять не справится с количеством пиши.
Итого: пить воду за 30 минут до еды или через 1 час после. Нельзя запивать еду, нельзя переедать, нужно хорошо пережевывать пищу.
Сколько пить воды?
30-35г на килограмм веса. Т.е. если вы весите 65 килограмм, то вам нужно пить примерно 2 литра чистой качественной воды в день. В общем, это примерно 10 стаканов, не так уж и сложно.
Сок, компот, чай и т.д. водой не считается. Это по сути жидкое питание.
Тут можно привести пример с мытьем окна, если мыть окно компотом, то оно вряд ли станет чистым. То же самое с нашим организмом, ему требуется чистая вода, чтобы поддерживать жизнь и выводить вредные вещества изнутри.
С уважением, Игорь Сафронов.
p.s. Получите пошаговую инструкцию трансформации своего подсознания. Подробнее >>
p.p.s. Если вы занимаетесь бизнесом, то прочитайте информацию о том, как развить у себя мышление предпринимателя. Подробнее >>
Интересные публикации:
blog.prosperitylab.ru
Конспект урока по Химии "Состав , физические и химические свойства воды" 8 класс
Открытый урок по химии в 8 классе по теме: «Состав , физические и химические свойства воды ».
Учитель МКОУ СОШ с.п. Кара-Суу Жабоева Раиса Муратовна
Задачи:
Образовательная: создать условия для углубления знаний учащихся о составе, физических свойствах воды, воде как универсальном растворителе;
Развивающая: создать условия для развития теоретического мышления, грамотного химического языка, установление причинно-следственных связей; прививать навыки самостоятельной работы, адекватной самооценки;
Воспитательная: создать условия для формирования эстетического восприятия окружающего мира, сочетания химических явлений с изучаемыми объектами.
Тип урока: изучение нового материала.
Оборудование: Два химических стакана с водой, стеклянная палочка для перемешивания, сухое горючее, спички, предметное стекло; пробиркодержатель, пипетка; соли – медный купорос и поваренная соль.
Формы организации работы детей: фронтальная (беседа), групповая (практическая работа), индивидуальная (работа с книгой и рабочей тетрадью).
ХОД УРОКА
Физические свойства
ВОДА, ЛЁД И ПАР, соответственно жидкое, твердое и газообразное состояния химического соединения молекулярной формулы Н2О.
Благодаря сильному притяжению между молекулами у воды высокие температуры плавления (0С) и кипения (100С). Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей. Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Чистая вода – плохой проводник электричества. Плотность воды максимальна при 4С она равна 1 г/см3. Лёд имеет меньшую плотность, чем жидкая вода и всплывает на её поверхность, что очень важно для обитателей водоёмов зимой.
Воду можно получить в ходе реакций:
В ходе реакций нейтрализации:
Химические свойства воды
Давайте вспомним все уже известные нам реакции, в которых участвует вода. Для этого вновь напишем уравнения встречавшихся ранее реакций и систематизируем их. Оказывается, вода – весьма активное в химическом отношении вещество.
1) Вода реагирует со многими металлами с выделением водорода:
2Na + 2h3O = h3 + 2NaOH (бурно)
2K + 2h3O = h3 + 2KOH (бурно)
3Fe + 4h3O = 4h3 + Fe3O4 (только при нагревании)
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + h3O = h3 + CO (при сильном нагревании)
Ch5 + 2h3O = 4h3 + CO2 (при сильном нагревании)
2) Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем:
3) Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
| + | h3O | = | h3SO3 | |
|
|
|
|
| сернистая кислота |
| + | h3O | = | h3SO4 | |
|
|
|
|
| серная кислота |
| + | h3O | = | h3CO3 | |
|
|
|
|
| угольная кислота |
4) Некоторые оксиды металлов также могут вступать в реакции соединения с водой. Примеры таких реакций мы уже встречали:
| + | h3O | = | Ca(OH)2 | |
|
|
|
|
| гидроксид кальция (гашеная известь) |
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует. Мы уже встречались с такими оксидами. Это ZnO, TiO2, Cr2O3, из которых приготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней.
5) Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называетсякристаллогидратом. Например:
| + | 5 h3O | = | CuSO4.5h3O | |
| вещество белого цвета (безводный сульфат меди) |
|
|
| кристаллогидрат (медный купорос), синие кристаллы |
Приведем другие примеры образования гидратов:
h3SO4 + h3O = h3SO4.h3O (гидрат серной кислоты)
NaOH + h3O = NaOH.h3O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью, например, удаляют водяные пары из влажного атмосферного воздуха.
6) Особая реакция воды – синтез растениями крахмала (C6h20O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
6n CO2 + 5n h3O = (C6h20O5)n + 6n O2 (при действии света)
Таким образом, почти все важнейшие химические реакции воды уже встречались нам в предыдущих параграфах.
Применение воды
ЗемледелиеВыращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды , доходящих до 90 % в некоторых странах.
Питьё и приготовление пищиЖивое человеческое тело содержит от 50 % до 75 % воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья.
Растворитель Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
Теплоноситель Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Замедлитель Во многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции. Также существуют тяжеловодные реакторы, в которых в качестве замедлителя используется тяжёлая вода.
Пожаротушение В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены.
Спорт Многими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это подводное плавание, хоккей, лодочные виды спорта, биатлон и др.
Гидроабразивная резка Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Смазка Вода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках.
4.Закрепление нового материала:
Задачи
1.Сколько граммов воды потребуется для превращения всего оксида серы (VI), полученного из 64 г серы, в серную кислоту? Сколько при этом получится серной кислоты?
2.Напишите уравнения реакций следующих превращений:
Ca ---Cah3 --- Ca(OH)2 .
На этом уроке мы постарались раскрыть все возможности о воде –как уникальном веществе: ее распространенности в природе, значении и использовании. Очистке питьевой воды и ее круговороте в природе , физических свойствах и проблеме экономии чистой воде.
Рефлексия
Давайте вернемся к нашей теме урока
Что узнали на уроке?
С какими веществами реагирует вода?
В какие типы химических реакций она вступает?
А пригодятся ли вам полученные знания на уроке в жизни?
Как вы думаете, достигли мы цели? Что мы делали для этого?
Домашнее задание
А домашнее задание будет не простое. Вам необходимо подумать и ответить на вопросы
1.Как вы объясните высказывание Леонардо да Винчи: «Воде дана была волшебная власть стать соком жизни на Земле»
2.Часто говорят: «Вода - уникальное природное соединение» В чем вы видите уникальность этого соединения?
3. Составьте загадки о воде, четверостишия о воде .
globuss24.ru
Краткосрочный план урока по теме "Физические свойства воды. Три состояния воды. Изучение физических свойств воды" 8 класс
| ФИО учителя: Махмуда Баян Рапихкызы | |||||
| Тема урока | Физические свойства воды. Три состояния воды. Изучение физических свойств воды | ||||
| Цели обучения | 8.4.2.10 объяснять уникальные свойства воды 8.4.2.11 понимать точку кипения как критерий чистоты вещества и определять экспериментальным путем точку кипения воды | ||||
| Цели урока |
| ||||
| Критерии успеха Навыки Знание и понимание | Учащийся достиг цели обучения, если | ||||
| - объясняют уникальные свойства воды -понимает и определяет, что точка кипения чистой воды это 100o C, и что примеси изменяют точку кипения вещества - предлагают идеи по проектированию безопасного и эффективного эксперимента - выявляют потенциальные риски, чтобы безопасно работать с необходимыми химическими оборудованиями и веществами; - принимают решения об оборудовании, которое должно быть использовано в исследовании; - проводят наблюдения, используя все органы чувств и соответствующее оборудование; -пишут отчет об эксперименте, включая метод, аппарат, результаты и заключения; | |||||
| Языковые цели | Учащиеся могут: устно описать, как определили экспериментальным путем точку кипения воды, правильно используя лексику данной темы, при проведении процедуры установки точки кипения воды (собирать, выполнять и т.д.) последовательность терминов во-первых, затем, когда, и т.д. Предметная лексика и терминология: точка кипения, безводный, чистый, получить, собирать, проверять, выполнять, конденсировать Серия полезных фраз для диалога/письма: Для того, чтобы (провести) тест (для) определения чистоты во-первых мы... Показывает ли этот опыт ...? Как мы можем узнать / проверить | ||||
| Привитие ценностей |
| ||||
| Межпредметные связи | Межпредметная интеграция на уроке с предметами: - физика осуществляется через проведения лабораторного опыта «Изучение уникальных свойств воды» - молекулярная биология, знает биологические функции воды ( движение, испарение, контроль температуры, как среда для жизни, какую роль они занимают в таких реакциях, как например, фотосинтез) | ||||
| Предварительные знания | 7.1В. Изменения состояния веществ 7.2В. Простые химические реакции 7.3C. Растворы и растворимость 7.3А. Химические элементы, соединения и организм человека | ||||
| Ход урока | |||||
| Запланированные этапы урока | Запланированная деятельность на уроке | Ресурсы | |||
| Начало урока | Приветствие. Учитель: Послушайте загадку: "А ну, скорей снимите шляпу! Я дочь космического папы! Я вездесуща и легка, - Я лёд, я пот, я - облака, Я иней, чай, бульон, туман, Река, ручей и океан. Когда я злюсь - я закипаю, Когда мороз - я застываю". Вопросы учащимся: Да, ребята сегодня на уроке мы будем говорить о воде. Класс разделить на три группы : «Лед», «Туман», «Океан». Учитель: Вода - самая популярная и самая загадочная из всех жидкостей, существующих на земле. Поэты посвящают ей удивительные строки, прозаики готовы писать о воде целые тома. "Вода! У тебя нет ни вкуса, ни запаха, тебя невозможно описать, тобой наслаждаться, не ведая, что ты такое. Нельзя сказать, что ты необходима для жизни: ты - сама жизнь. Ты наполняешь нас радостью, которую не объяснить нашими чувствами... Ты самое большое богатство на свете..." Антуан де Сент Экзюпери. Обсудите в парах следующий вопрос: Попробуем представить себе, что вода внезапно исчезла с поверхности Земли. Как бы выглядела наша планета? Ответы запишите на стикерах. Каждая пара выходит к доске со своим стикером и закрепляет его. Обсуждение вышеуказанного вопроса с классом. Предполагаемы ответы учащихся:
| ||||
| Использует научный стиль изложения (природная вода- примесь, значение воды для растений и животных, растворимость веществ в воде, агрегатные состояния воды) | |||||
| Соблюдает время для говорения (не менее 1 минуты) | |||||
| Речь при выступлении четкая, понятная, последовательная | |||||
Учитель: Тысячи лет человек восхищается, любуется, наслаждается водой. И всё это время ищет ответа на вопрос: Что такое вода? Почему вода обладает столь удивительными свойствами? Сколько воды на Земле?
Сегодня на уроке мы попытаемся ответить на эти вопросы.
Запись на доске ключевых слов и понятий. Обсуждение и дополнение ответов.
Обсуждение темы урока. Обсуждая направить учащихся на выведение цели обучения и критерии успеха. Учащиеся формулируют цели обучения, которую достигнут в течении урока и составляют словесный план достижения ЦО.
ЛЕД
ТУМАН
ОКЕАН
Стикеры
Слайд презента-ции
Середина урока
Просмотр видеоматериала: «Вода» (4 минут)
Цель: знать показатели чистой воды
Учащимся раздать рабочие листы с вопросами, на которые ответят во время просмотра видеоматериала
Вопросы:
1)Какими органолептическими свойствами обладает чистая вода?
2)Каковы показатели качественной воды?
3) Укажите основные причины загрязнения воды?
4) Обсуждение видеоматериала
Учащимся раздаются рабочие листы с инструкциями для выполнения лабораторных опытов.
Парная работа: «Изучение уникальных свойств воды»
Рабочий лист
Цель: Изучить уникальные свойства воды, на основании которых сформулировать вывод о свойствах воды
Оборудование: Химические стаканы, вода, лед, чайный пакет, шерстяной платок, монеты.
Опыт №1
Ход работы:
1.Наполовину наполните химический стакан водой
2.Опустите в него лед.
3.Что вы наблюдаете?
4.Что является необычным в этом?
Вывод:
Опыт №2
Ход работы:
1.Наполовину наполните химический стакан водой
2.Опустите в него чайный пакет.
3.Что вы наблюдаете?
4.Что является необычным в этом?
Вывод:
Опыт №3
Ход работы:
1.Наполните химический стакан водой
2.Тонкой струей перелейте его в другой стакан
3.Возьмите шерстяной платок, потрите им пластмассовую ручку и поднесите к струе воды.
4.Что вы наблюдаете?
5.Что является необычным в этом?
Вывод:
Опыт №4
Ход работы:
1.Наполните химический стакан водой
2.Опускайте в него монеты ребром вниз один за другим.
3.Что вы наблюдаете?
4.Что является необычным в этом?
Вывод:
Просмотр видеоматериала: «Опыты с водой»
Учащиеся обсуждают увиденный видеоматериал и дополняют выводы в рабочих листах.
Предполагаемые выводы учащихся:
У большинства веществ в твердом состоянии плотность выше, чем в жидком. В отличие от них вода в твердом агрегатном состоянии (лед) имеет более низкую плотность, чем в жидком
Такая особенность воды объясняет, почему водоемы начинают замерзать не со дна, а с поверхности и очень редко промерзают до самого дна. Это защищает живые организмы, обитающие в реках и морях, от гибели.
Вода обладает большой теплоемкостью - 42 Дж/г град - поэтому она медленно нагревается и медленно остывает, являясь хорошим теплоносителем. А водные бассейны регулируют температуру на нашей планете: летом не дают ей перегреваться, а зимой снабжают материки теплом. А от космического холода предохраняют те капли воды, которые рассеяны в атмосфере.
Струя воды отклоняются под воздействием электрических и / или магнитных полей.
Поверхностного натяжения воды и изменение ее вязкости в зависимости от температуры.
Групповая игра:
Метод «Пантомима»
Цель: встряхнуться, весело расслабиться.
Проведение: один из учащегося выбирает одного ученика, говорит ему на ухо какое-нибудь предложение или словосочетание, например: «идет дождь». С помощью жестов и мимики последний должен объяснить коллегам задание. Кто первый угадает, тому и следующему показывать.
Лабораторная работа «Определение точки кипения воды»
Цель: понимать точку кипения как критерий чистоты вещества и определять экспериментальным путем точку кипения воды
Учащимся раздаются рабочие листы с инструкциями по выполнению работы.
Рабочий лист
Оборудование и реактивы: Колбы с двумя горловинами, лабораторный штатив, термометр, дистиллированная вода, этиловый спирт, хлорид натрия
Ход работы:
1.Нагревая чистую воду в круглодонной колбе с двумя горловинами, с помощью термометра найти точку кипения воды
2. Растворить в воде небольшое количество этилового спирта. Найти точку кипения.
3. В другой колбе смешать небольшое количество соли, хлорида натрия и воду. Найти точку кипения.
4. Сделать сравнительный анализ.
5.Вывод.
Обсуждение итогов лабораторной работы.
Задание для закрепления: работа с текстом (учащиеся делятся на 2 группы с помощью цветных палочек) и составляют ментальную карту: Вода и человек
Взаимооценивание групп:
Оцените ментальную карту по теме: «Вода и человек» с помощью критериев
Баллы (7)
1
В карте использована верная научная терминология
1
2
Правильно выстроена структура карты: в логике –от целого к частному
3
3
Каждый элемент карты сопровождает изображение
3
Видео: http://www.youtube.com/watch?v=VF6exZYWu9k
(Просмотр 4 минут)
Рабочий лист Приложение № 1
Видео: http://www.fixiki.ru/watch/11/56819/
Приложе-ние № 2
Рабочий лист
http://www1.lsbu.ac.uk/water/water_anomalies.html
Конец урока
В конце урока учащиеся проводят рефлексию:
Метод «ХИМС» 
Цель: Выяснить впечатления учащихся от прошедшего урока.
Проведение: Этот метод позволяет учителю быстро выяснить впечатления от урока учащихся по следующим вопросам, начальные буквы которых составляют это не очень понятное название метода:
– Хорошо…
– Интересно…
– Мешало…
– Возьму с Собой
Каждый ученик должен ответить на эти вопросы, включая и свое личное самочувствие, которое тоже влияет на продуктивность работы на уроке.
Приложение № 3
Ответы учащиеся пишут на стикерах и приклеивают на ватмане:
Домашнее задание.
Какие методы разделения смесей вы бы использовали для очистки воды от примесей?
Рабочая тетрадь
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися?
Оценивание – как Вы планируете проверить уровень усвоения материала учащимися?
Здоровье и соблюдение техники безопасности
Все учащиеся будут: знают и понимают физические свойства воды: три агрегатного состояния, цвет, прозрачность, температуру кипения, температуру плавления, объяснить термины: точка кипения, безводный, чистый,
получить, собирать, проверять, выполнять, конденсировать Большинство учащихся будут: объяснять уникальные свойства воды и понимать точку кипения как критерий чистоты вещества и определять экспериментальным путем точку кипения воды
Некоторые учащиеся смогут: в полной мере оценить уникальность воды и объяснять ее значение в живой природе.
На протяжении всех этапов урока, оценивание проводится через устную и письменную рефлексию, самооценивание и взаимооценивание, постановку и решение проблемного вопроса, проведение лабораторной работы.
Правила техники безопасности на данном уроке.
Учащиеся соблюдали правила техники безопасности при работе с химическими реактивами и нагревательными приборами.
Рефлексия по уроку
Были ли цели урока/цели обучения реалистичными?
Все ли учащиеся достигли ЦО?
Если нет, то почему?
Правильно ли проведена дифференциация на уроке?
Выдержаны ли были временные этапы урока?
Какие отступления были от плана урока и почему?
Используйте данный раздел для размышлений об уроке. Ответьте на самые важные вопросы о Вашем уроке из левой колонки.
В ходе урока была организована деятельность, направленная на формирование знаний и развитие навыков, относящихся к целям урока. Цели обучения соответствуют учебной программе.
В ходе деятельности у учащихся формируются и развиваются знания и навыки через анализ и обработку информации, исследование, практическую работу, решение проблемных ситуаций. Учащиеся 8 классов имеют представление о физических свойствах воды из курса физики, поэтому понимание рассматриваемых вопросов у учащихся не вызвало затруднения, все учащиеся достигли цели обучения.
Учащиеся проговаривают цели обучения и составляют словесный план изучаемого материала. Проверка рабочих листов по результатам лабораторных опытов учащихся показала, что ответы были полной и правильной, соответствовали критериям оценивания.
Общая оценка
Какие два аспекта урока прошли хорошо (подумайте как о преподавании, так и об обучении)?
1:Проведение лабораторных работ
2: Весело, активно прошла игра «Пантомима» , проведенная с целью встряхнуться и весело расслабиться
Что могло бы способствовать улучшению урока (подумайте как о преподавании, так и об обучении)?
1: Проведение интегрированного урока с физикой.
2:
Что я выявил(а) за время урока о классе или достижениях/трудностях отдельных учеников, на что необходимо обратить внимание на последующих уроках?
- аспекты, вызвавшие затруднения: публичное выступление и использование академического языка;
- при планировании следующего урока учитывать предложения учащихся по рефлексии;
- использовать элементы технологии дифференцированного и проблемного обучения, чтобы учащиеся смогли самореализоваться в очень короткий отрезок времени.
Рабочий лист
ФИО учащегося _______________________________ Класс______________
Лабораторная работа №11 Определение точки кипения воды
Цель исследования
Гипотеза
Введение
Оборудование: Колбы с двумя горловинами , лабораторный штатив , термометр , дистиллированная вода, этиловый спирт , хлорид натрия
Ход работы:
1.Нагревая чистую воду в круглодонной колбе с двумя горловинами, найти ее точку кипения, с помощью термометра.
2. Растворить в воде небольшое количество этилового спирта. Найти точку кипения.
3. В другой колбе смешать небольшое количество соли, хлорида натрия и воду. Найти точку кипения.
4. Сделать сравнительный анализ.
Результаты исследования
Обсуждение результатов исследования
Оценка результатов.
Вывод
Рефлексия
- выявлять потенциальные риски, чтобы безопасно работать с необходимыми химическими оборудованиями и веществами;
- принимать решения об оборудовании, которое должно быть использовано в исследовании;
- проводить наблюдения, используя все органы чувств и соответствующее оборудование;
- написать простой отчет об эксперименте, включая метод, аппарат, результаты и заключения;
infourok.ru
Урок 'Физические свойства воды' (8 класс)
Конспект урока
«Физические свойства воды»
Романцева Т.В.
учитель химии
Цель урока: сформировать у учащихся представление о физических свойствах воды.
Задачи:
-
Образовательные:
- научить учащихся анализировать физические свойства воды.
- сформировать представление о роли воды в природе и жизни человека.
-
Воспитательные:
- воспитать бережное отношение к окружающей природе, в частности к воде и её охране.
-
Развивающие:
- развить потребность в системном подходе к изучению воды.
- развить познавательный интерес и творческую активность.
4. Коррекционные:
- развивать устную и письменную речь учащихся через обогащение
словарного запаса.
Планируемые результаты:
предметные: ученик научится описывать физические свойства воды, находить зависимость свойств от строения молекул вещества.
метапредметные:
познавательные: искать и выделять необходимую информацию; контролировать и оценивать процесс и результат обучения; устанавливать причинно-следственные связи;
регулятивные: ученик научится самостоятельно формулировать познавательные цели; прогнозировать результат деятельности; владеть самооценкой и самоконтролем; принимать решения в проблемной ситуации.
коммуникативные: ученик научится находить способы взаимодействия и инициативное сотрудничество, как с учителем, так и со сверстниками; оказывать в сотрудничестве необходимую взаимопомощь; точно и с достаточной полнотой выражать свои мысли.
личностные: ученик научится устанавливать связи между целью деятельности на уроке и её мотивом; получит возможность для формирования нравственно-этического оценивания событий.
Тип урока: урок изучения нового материала.
Формы организации деятельности учащихся:
- фронтальная
- работа в парах при выполнении практического задания
- индивидуальная
Методы обучения: иллюстративный, проблемный.
Оборудование и реактивы: на столах учащихся химический стакан с водой, пробирка с поваренной солью, сульфатом меди, сульфатом никеля; пипетка, чашка Петри.
Учебник - Химия: 8 класс / Н.Е. Кузнецова, И.М. Титова, Н.Н. Гара и др. ; под редакцией Н.Е. Кузнецовой. - М.: Вентана-Граф, 2011.
Предварительная работа: подготовка учащимися сообщений под руководством учителя.
Ход урока.
1.Организационный момент.
Приветствие.
Проверка готовности учащихся к уроку.
Организация внимания.
2.Мотивация и актуализация знаний.
Начинается наш урок химии.
- Вспомним, что изучает наука химия?
(Химия - это наука о веществах и их свойствах, о превращениях веществ и способах управления этими превращениями).
Сегодня мы поговорим о самом распространённом веществе на Земле, о веществе, которое играет колоссальную роль в жизни нашей планеты, в жизни всех живых организмов. Антуан де Сент-Экзюпери сказал об этом веществе: «…у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое. Ты не просто необходима для жизни, ты и есть жизнь».
- Как называется это вещество?
(Вода).
- Какая химическая формула воды?
(h3O)
Как вы думаете, что будет целью нашего урока? (дети формулируют цель).
Сегодня мы будем много говорить об этом удивительном веществе - воде, о строении молекулы воды и свойствах этого вещества. Можете ли вы ответить на вопросы: почему рыба не замерзает зимой в водоёме, хотя поверхность водоёма замёрзла или почему плавают айсберги?
Мы сможем ответить на любые вопросы, связанные с таким веществом, как вода, подробно изучив физические свойства воды.
Тема урока: «Физические свойства воды».
3.Изучение нового материала.
- Вспомним по какому плану описываются физические свойства любого вещества?
(Агрегатное состояние, цвет, вкус, запах, плотность, температуры плавления, кипения, теплопроводность, электропроводность, растворимость).
Уникальные свойства воды мы начнём описывать с агрегатного состояния. Чтобы вам легче было вспомнить виды агрегатного состояния воды, я зачитаю вам загадки-подсказки:
Без досок, без топоров
Через реку мост готов.
Мост - как синее стекло:
Скользко, весело, светло.
(Лёд. Твёрдое агрегатное состояние).
Он длиннющий,
Он большущий,
Он от тучи, до земли…
Пусть идёт он пуще, пуще.
Чтоб грибы скорей росли.
(Дождь. Жидкое агрегатное состояние).
В морях и реках обитает,
И часто в облаках летает,
А как наскучит ей летать,
На землю падает опять.
(Вода. Круговорот воды в природе. Газообразное агрегатное состояние).
Капните каплю воды в чашку Петри. Какой формы капля? Мы видим округлую ровную каплю на тарелке. Почему?
- Какой тип связи в молекуле воды?
(Ковалентная полярная связь).
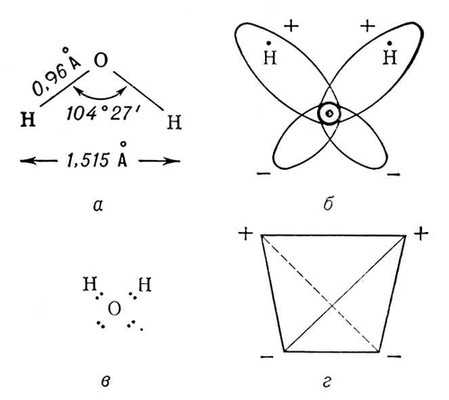
Кислород электроотрицательнее водорода и общие электронные пары смещены в сторону атома кислорода. Общие связи в пространстве находятся под углом 104,5 градусов. Молекула воды в пространстве имеет плоскую угловую форму. В ней возникает два полюса. Часто молекулу воды называют - диполь воды.
Вследствие полярности молекул воды между ними образуются водородные связи. Молекулы воды оказываются объединенными посредством этих связей. В единый комплекс объединяются до семи молекул. Водородные связи придают капле воды её сферическую форму.
- Какая температура замерзания воды?
(Температура замерзания воды 0 градусов по Цельсию).
При замерзании воды между молекулами возникает химическая связь - водородная, при этом выделяется энергия. При образовании льда каждый атом кислорода окружён четырьмя атомами водорода. Во льду все молекулы связаны между собой водородными связями. Молекулы воды могут двигаться в жидком состоянии, а при замерзании образуется жёсткая шестиугольная решётка с пустотами.
Постановка проблемного вопроса.
В 1913 году печальное известие облетело весь мир. Погиб, столкнувшись с айсбергом, гигантский океанический лайнер «Титаник». По-разному объясняли эксперты причины катастрофы. Сошлись на том, что в тумане капитан не разглядел огромную плавающую ледяную гору и, налетев на нее корабль, окончил свое земное существование. Как бы вы могли объяснить это прискорбное событие глазами химика?
Плотность льда меньше плотности воды (жидкости).
Плотность льда - 0, 9168 г/см кубический, плотность воды - 0,999 г/см кубический (при 0 градусов).
Глубокие моря, озера, реки не промерзают до дна, а лед находится на поверхности воды. Это явление можно объяснить тем, что при замерзании вода расширяется, лед имеет меньшую плотность и массу, чем жидкая вода, поэтому он плавает на поверхности. Айсберги плавают, подобно пробке, на поверхности воды.
- Как вы думаете, какое это имеет значение для водоёмов и жизни их обитателей?
(Водоёмы не промерзают до дна, лёд остаётся на поверхности, не опускается на дно. В водоёмах сохраняется жизнь).
Наибольшая плотность воды при +4 градусов по Цельсию - 1 г/см кубический, выше и ниже этой температуры плотность меньше. Температура подо льдом всегда постоянная +4 градуса. В нижней части водоёма тепло почвы не позволяет охладиться воде слишком сильно. Это оптимальные условия выживания растения и животных в зимнее время.
- Какая температура кипения воды?
(Температура кипения воды 100 градусов по Цельсию).
При нагревании воды идёт разрушение водородных связей между её молекулами. Для превращения воды в пар требуется много энергии, происходит поглощение тепла из окружающей среды.
Сообщение учащегося.
(Солнце нагревает воду на всей планете. Вода поглощает почти всю энергию попадающих на неё солнечных лучей и испаряется. Солнце испаряет на Земле за одну минуту миллиард тонн воды. Водяной пар поднимается в верхний слой атмосферы и является основным утеплителем планеты, изолируя её от космического пространства и перехватывая тепловое излучение Земли. Уменьшение в атмосфере водяного пара наполовину понизило бы температуру у поверхности Земли до 5 градусов.
На большой высоте, где низкая температура, водяной пар конденсируется, и мельчайшие капельки образуют облака. Когда пар превращается в облака, выделяется огромное количество энергии. Это та энергия, которая, которая заставляет дуть ветры, рождает бури, орошает поверхность Земли дождями. Таким образом, в природе происходит постоянный круговорот воды. Вода - планетарный переносчик тепла.
Вода обладает большой теплоёмкостью. Воду можно назвать планетарным аккумулятором тепла. Весной и летом она медленно нагревается (охлаждает готовый накалиться воздух) а осенью медленно остывает (согревая воздух). Без данных процессов климат Земли был бы значительно суровее).
- Перед вами на столах стакан. Что в нём находится?
(Вода).
То что налито в стакане мы по привычке называет попросту водой, на самом деле если быть более точными, то в стакане раствор, не абсолютно чистая вода.
- Вспомним, что такое раствор?
(Раствор - это физико-химическая система, состоящая из двух или более компонентов, относительные количества которых могут изменяться в широких пределах)
Вода - уникальный растворитель. Проверим это вместе.
Практическая часть: растворение разных солей в воде.
Вернёмся к строению молекулы воды - она полярна. Именно полярностью объясняется её способность к растворению всех веществ имеющих полярное строение (соли, оксиды, кислоты, щёлочи).
Как вы уже заметили, соли могут быть разного цвета. А всегда ли соль придет воде солёный вкус? Вкус у солей тоже бывает разный.
Сообщение учащегося.
(Вкус воды зависит от растворённых в ней веществ. Подземные воды, содержащие только растворенные неорганические вещества, имеют специфический вкус, вызванный наличием железа, марганца, магния, натрия, калия, хлоридов и карбонатов.
Далеко не все соли солоны.
Солёные соли: хлорид натрия, хлорид калия, сульфат натрия.
Горькая соль - сульфат магния.
Сладкая соль - хлорид бериллия.
Вода, содержащая в своем составе растворённые соли, микроэлементы, а также некоторые биологически активные компоненты - минеральная вода. Это вода, добытая или вынесенная на поверхность из земных недр. Среди минеральных вод выделяют минеральные природные питьевые воды, воды для наружного применения и другие.
В воде растворяются и газы: азот, кислород, углекислый газ. Кислород, растворённый в воде, обеспечивает жизнедеятельность водных живых организмов).
Следует отметить, что солёность является важной характеристикой воды. В частности, от степени солёности зависит температура замерзания воды: морская вода замерзает при температуре минус 2 градуса по Цельсию, а вода некоторых солёных озёр минус 20 градусов.
Снижение содержания солей в морской воде до уровня, при котором вода становится пригодной к использованию, называют опреснением.
Сообщение учащегося.
(Самое большое количество пресной воды ледяным щитом покрывает Антарктиду. Средняя толщина этого щита достигает 3 тысяч метров. Человек в настоящее время практически не использует для своих нужд это полярное сокровище. Он удовлетворяется более доступными запасами пресной воды в озёрах и реках. Но всё чаще рассматривают океан как источник пресной воды, путём опреснения. Пресная вода, поступающая для домашних нужд. Проходит очистку. Подготовка водопроводной воды обычно включает несколько стадий. На последней стадии воду обрабатывают химическим веществом: озоном или хлором, для уничтожения бактерий).
- А знаете ли вы, что представляет собой дистиллированная вода?
(Это очищенная вода, практически не содержащая примесей и посторонних включений).
Дистиллированную воду используют для безопасной эксплуатации аккумуляторов, для добавления в паровые утюги (полностью исключают появление накипи), при цветной фотопечати. В медицине используется как растворитель для приготовления лекарственных форм для инъекций (чаще называется "вода для инъекций").
Дистиллированная вода изолятор.
Но поскольку природная вода - хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Когда говорят о воде, то часто упоминают тяжёлую воду.
- Что такое тяжёлая вода?
Работа с учебником. (Кузнецова Н.Е. Химия: 8 класс. Параграф 54, с.204)
Прочитайте выделенный фрагмент в учебнике, выпишите состав, отличительные свойства и применения тяжёлой воды.
Проверка конспекта.
4.Закрепление (работа по карточкам).
Охарактеризуйте физические свойства воды по плану (на карточках):
Агрегатное состояние.
Цвет.
Вкус.
Запах.
Плотность.
Температура замерзания и кипения.
Теплопроводность.
Электрическая проводимость.
(Учитель оглашает правильные ответы. Самопроверка).
Вопросы:
- Почему пред заморозками рассаду поливают? (При замерзании воды выделяется тепло).
- Почему в лиственных лесах прохладно даже в жару? (При испарении воды поглощается тепло, воздух охлаждается).
- Почему для предохранения овощей от замерзания в погреб помещают большой сосуд с водой? (При замерзании воды выделяется тепло).
- В зимний морозный день поставьте бутылку с водой на улицу и оставьте там на ночь. Утром увидите, что вода замёрзла, а бутылка раскололась. Почему? (Вода при охлаждении расширяется).
5. Подведение итогов. Рефлексия.
Изучение нового материала подходит к концу. Что вы узнали для себя нового?
Где пригодятся вам полученные знания?
«Самое трудное в работе»;
«Самое интересное»;
«Что понравилось»;
«Пожелание себе»;
Выставление оценок за урок.
6. Домашнее задание.
Параграф 54, с. 204-206. Работа с дополнительной литературой, составление конспекта на тему «Основные мероприятия по охране водных ресурсов».
Используемая литература:
Аликберова Л.Ю. Занимательная химия. - М.: АСТ-ПРЕСС, 2002.
Анита ван Саан 101 эксперимент с водой. - Х.: Ранок, 2012.
Боровский Е.Э. Вода в природе. Дефицит чистой пресной воды. - М.: Чистык пруды, 2009.
Троегубова Н.П. Поурочные разработки по химии: 8 класс. - М.: ВАКО, 2012.
Химия. 8 класс: Поурочные планы / С.Ю. Дибленко - Волгоград: Учитель, 2004.
http://mokroe-school.pruzhany.by/?p=974
botana.cc
Урок "Физические свойства воды" (8 класс)
Конспект урока
«Физические свойства воды»
Романцева Т.В.
учитель химии
Цель урока: сформировать у учащихся представление о физических свойствах воды.
Задачи:
Образовательные:
- научить учащихся анализировать физические свойства воды.
- сформировать представление о роли воды в природе и жизни человека.
Воспитательные:
- воспитать бережное отношение к окружающей природе, в частности к воде и её охране.
Развивающие:
- развить потребность в системном подходе к изучению воды.
- развить познавательный интерес и творческую активность.
4. Коррекционные:
- развивать устную и письменную речь учащихся через обогащение
словарного запаса.
Планируемые результаты:
предметные: ученик научится описывать физические свойства воды, находить зависимость свойств от строения молекул вещества.
метапредметные:
познавательные: искать и выделять необходимую информацию; контролировать и оценивать процесс и результат обучения; устанавливать причинно-следственные связи;
регулятивные: ученик научится самостоятельно формулировать познавательные цели; прогнозировать результат деятельности; владеть самооценкой и самоконтролем; принимать решения в проблемной ситуации.
коммуникативные: ученик научится находить способы взаимодействия и инициативное сотрудничество, как с учителем, так и со сверстниками; оказывать в сотрудничестве необходимую взаимопомощь; точно и с достаточной полнотой выражать свои мысли.
личностные: ученик научится устанавливать связи между целью деятельности на уроке и её мотивом; получит возможность для формирования нравственно-этического оценивания событий.
Тип урока: урок изучения нового материала.
Формы организации деятельности учащихся:
- фронтальная
- работа в парах при выполнении практического задания
- индивидуальная
Методы обучения: иллюстративный, проблемный.
Оборудование и реактивы: на столах учащихся химический стакан с водой, пробирка с поваренной солью, сульфатом меди, сульфатом никеля; пипетка, чашка Петри.
Учебник - Химия: 8 класс / Н.Е. Кузнецова, И.М. Титова, Н.Н. Гара и др. ; под редакцией Н.Е. Кузнецовой. – М.: Вентана-Граф, 2011.
Предварительная работа: подготовка учащимися сообщений под руководством учителя.
Ход урока.
1.Организационный момент.
Приветствие.
Проверка готовности учащихся к уроку.
Организация внимания.
2.Мотивация и актуализация знаний.
Начинается наш урок химии.
- Вспомним, что изучает наука химия?
(Химия – это наука о веществах и их свойствах, о превращениях веществ и способах управления этими превращениями).
Сегодня мы поговорим о самом распространённом веществе на Земле, о веществе, которое играет колоссальную роль в жизни нашей планеты, в жизни всех живых организмов. Антуан де Сент-Экзюпери сказал об этом веществе: «…у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое. Ты не просто необходима для жизни, ты и есть жизнь».
- Как называется это вещество?
(Вода).
- Какая химическая формула воды?
(h3O)
Как вы думаете, что будет целью нашего урока? (дети формулируют цель).
Сегодня мы будем много говорить об этом удивительном веществе – воде, о строении молекулы воды и свойствах этого вещества. Можете ли вы ответить на вопросы: почему рыба не замерзает зимой в водоёме, хотя поверхность водоёма замёрзла или почему плавают айсберги?
Мы сможем ответить на любые вопросы, связанные с таким веществом, как вода, подробно изучив физические свойства воды.
Тема урока: «Физические свойства воды».
3.Изучение нового материала.
- Вспомним по какому плану описываются физические свойства любого вещества?
(Агрегатное состояние, цвет, вкус, запах, плотность, температуры плавления, кипения, теплопроводность, электропроводность, растворимость).
Уникальные свойства воды мы начнём описывать с агрегатного состояния. Чтобы вам легче было вспомнить виды агрегатного состояния воды, я зачитаю вам загадки-подсказки:
Без досок, без топоров
Через реку мост готов.
Мост – как синее стекло:
Скользко, весело, светло.
(Лёд. Твёрдое агрегатное состояние).
Он длиннющий,
Он большущий,
Он от тучи, до земли…
Пусть идёт он пуще, пуще.
Чтоб грибы скорей росли.
(Дождь. Жидкое агрегатное состояние).
В морях и реках обитает,
И часто в облаках летает,
А как наскучит ей летать,
На землю падает опять.
(Вода. Круговорот воды в природе. Газообразное агрегатное состояние).
Капните каплю воды в чашку Петри. Какой формы капля? Мы видим округлую ровную каплю на тарелке. Почему?
- Какой тип связи в молекуле воды?
(Ковалентная полярная связь).
Кислород электроотрицательнее водорода и общие электронные пары смещены в сторону атома кислорода. Общие связи в пространстве находятся под углом 104,5 градусов. Молекула воды в пространстве имеет плоскую угловую форму. В ней возникает два полюса. Часто молекулу воды называют - диполь воды.
Вследствие полярности молекул воды между ними образуются водородные связи. Молекулы воды оказываются объединенными посредством этих связей. В единый комплекс объединяются до семи молекул. Водородные связи придают капле воды её сферическую форму.
- Какая температура замерзания воды?
(Температура замерзания воды 0 градусов по Цельсию).
При замерзании воды между молекулами возникает химическая связь – водородная, при этом выделяется энергия. При образовании льда каждый атом кислорода окружён четырьмя атомами водорода. Во льду все молекулы связаны между собой водородными связями. Молекулы воды могут двигаться в жидком состоянии, а при замерзании образуется жёсткая шестиугольная решётка с пустотами.
Постановка проблемного вопроса.
В 1913 году печальное известие облетело весь мир. Погиб, столкнувшись с айсбергом, гигантский океанический лайнер «Титаник». По-разному объясняли эксперты причины катастрофы. Сошлись на том, что в тумане капитан не разглядел огромную плавающую ледяную гору и, налетев на нее корабль, окончил свое земное существование. Как бы вы могли объяснить это прискорбное событие глазами химика?
Плотность льда меньше плотности воды (жидкости).
Плотность льда - 0, 9168 г/см кубический, плотность воды – 0,999 г/см кубический (при 0 градусов).
Глубокие моря, озера, реки не промерзают до дна, а лед находится на поверхности воды. Это явление можно объяснить тем, что при замерзании вода расширяется, лед имеет меньшую плотность и массу, чем жидкая вода, поэтому он плавает на поверхности. Айсберги плавают, подобно пробке, на поверхности воды.
- Как вы думаете, какое это имеет значение для водоёмов и жизни их обитателей?
(Водоёмы не промерзают до дна, лёд остаётся на поверхности, не опускается на дно. В водоёмах сохраняется жизнь).
Наибольшая плотность воды при +4 градусов по Цельсию – 1 г/см кубический, выше и ниже этой температуры плотность меньше. Температура подо льдом всегда постоянная +4 градуса. В нижней части водоёма тепло почвы не позволяет охладиться воде слишком сильно. Это оптимальные условия выживания растения и животных в зимнее время.
- Какая температура кипения воды?
(Температура кипения воды 100 градусов по Цельсию).
При нагревании воды идёт разрушение водородных связей между её молекулами. Для превращения воды в пар требуется много энергии, происходит поглощение тепла из окружающей среды.
Сообщение учащегося.
(Солнце нагревает воду на всей планете. Вода поглощает почти всю энергию попадающих на неё солнечных лучей и испаряется. Солнце испаряет на Земле за одну минуту миллиард тонн воды. Водяной пар поднимается в верхний слой атмосферы и является основным утеплителем планеты, изолируя её от космического пространства и перехватывая тепловое излучение Земли. Уменьшение в атмосфере водяного пара наполовину понизило бы температуру у поверхности Земли до 5 градусов.
На большой высоте, где низкая температура, водяной пар конденсируется, и мельчайшие капельки образуют облака. Когда пар превращается в облака, выделяется огромное количество энергии. Это та энергия, которая, которая заставляет дуть ветры, рождает бури, орошает поверхность Земли дождями. Таким образом, в природе происходит постоянный круговорот воды. Вода – планетарный переносчик тепла.
Вода обладает большой теплоёмкостью. Воду можно назвать планетарным аккумулятором тепла. Весной и летом она медленно нагревается (охлаждает готовый накалиться воздух) а осенью медленно остывает (согревая воздух). Без данных процессов климат Земли был бы значительно суровее).
- Перед вами на столах стакан. Что в нём находится?
(Вода).
То что налито в стакане мы по привычке называет попросту водой, на самом деле если быть более точными, то в стакане раствор, не абсолютно чистая вода.
- Вспомним, что такое раствор?
(Раствор – это физико-химическая система, состоящая из двух или более компонентов, относительные количества которых могут изменяться в широких пределах)
Вода – уникальный растворитель. Проверим это вместе.
Практическая часть: растворение разных солей в воде.
Вернёмся к строению молекулы воды – она полярна. Именно полярностью объясняется её способность к растворению всех веществ имеющих полярное строение (соли, оксиды, кислоты, щёлочи).
Как вы уже заметили, соли могут быть разного цвета. А всегда ли соль придет воде солёный вкус? Вкус у солей тоже бывает разный.
Сообщение учащегося.
(Вкус воды зависит от растворённых в ней веществ. Подземные воды, содержащие только растворенные неорганические вещества, имеют специфический вкус, вызванный наличием железа, марганца, магния, натрия, калия, хлоридов и карбонатов.
Далеко не все соли солоны.
Солёные соли: хлорид натрия, хлорид калия, сульфат натрия.
Горькая соль – сульфат магния.
Сладкая соль – хлорид бериллия.
Вода, содержащая в своем составе растворённые соли, микроэлементы, а также некоторые биологически активные компоненты – минеральная вода. Это вода, добытая или вынесенная на поверхность из земных недр. Среди минеральных вод выделяют минеральные природные питьевые воды, воды для наружного применения и другие.
В воде растворяются и газы: азот, кислород, углекислый газ. Кислород, растворённый в воде, обеспечивает жизнедеятельность водных живых организмов).
Следует отметить, что солёность является важной характеристикой воды. В частности, от степени солёности зависит температура замерзания воды: морская вода замерзает при температуре минус 2 градуса по Цельсию, а вода некоторых солёных озёр минус 20 градусов.
Снижение содержания солей в морской воде до уровня, при котором вода становится пригодной к использованию, называют опреснением.
Сообщение учащегося.
(Самое большое количество пресной воды ледяным щитом покрывает Антарктиду. Средняя толщина этого щита достигает 3 тысяч метров. Человек в настоящее время практически не использует для своих нужд это полярное сокровище. Он удовлетворяется более доступными запасами пресной воды в озёрах и реках. Но всё чаще рассматривают океан как источник пресной воды, путём опреснения. Пресная вода, поступающая для домашних нужд. Проходит очистку. Подготовка водопроводной воды обычно включает несколько стадий. На последней стадии воду обрабатывают химическим веществом: озоном или хлором, для уничтожения бактерий).
- А знаете ли вы, что представляет собой дистиллированная вода?
(Это очищенная вода, практически не содержащая примесей и посторонних включений).
Дистиллированную воду используют для безопасной эксплуатации аккумуляторов, для добавления в паровые утюги (полностью исключают появление накипи), при цветной фотопечати. В медицине используется как растворитель для приготовления лекарственных форм для инъекций (чаще называется "вода для инъекций").
Дистиллированная вода изолятор.
Но поскольку природная вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Когда говорят о воде, то часто упоминают тяжёлую воду.
- Что такое тяжёлая вода?
Работа с учебником. (Кузнецова Н.Е. Химия: 8 класс. Параграф 54, с.204)
Прочитайте выделенный фрагмент в учебнике, выпишите состав, отличительные свойства и применения тяжёлой воды.
Проверка конспекта.
4.Закрепление (работа по карточкам).
Охарактеризуйте физические свойства воды по плану (на карточках):
Агрегатное состояние.
Цвет.
Вкус.
Запах.
Плотность.
Температура замерзания и кипения.
Теплопроводность.
Электрическая проводимость.
(Учитель оглашает правильные ответы. Самопроверка).
Вопросы:
- Почему пред заморозками рассаду поливают? (При замерзании воды выделяется тепло).
- Почему в лиственных лесах прохладно даже в жару? (При испарении воды поглощается тепло, воздух охлаждается).
- Почему для предохранения овощей от замерзания в погреб помещают большой сосуд с водой? (При замерзании воды выделяется тепло).
- В зимний морозный день поставьте бутылку с водой на улицу и оставьте там на ночь. Утром увидите, что вода замёрзла, а бутылка раскололась. Почему? (Вода при охлаждении расширяется).
5. Подведение итогов. Рефлексия.
Изучение нового материала подходит к концу. Что вы узнали для себя нового?
Где пригодятся вам полученные знания?
«Самое трудное в работе»;
«Самое интересное»;
«Что понравилось»;
«Пожелание себе»;
Выставление оценок за урок.
6. Домашнее задание.
Параграф 54, с. 204-206. Работа с дополнительной литературой, составление конспекта на тему «Основные мероприятия по охране водных ресурсов».
Используемая литература:
Аликберова Л.Ю. Занимательная химия. – М.: АСТ-ПРЕСС, 2002.
Анита ван Саан 101 эксперимент с водой. – Х.: Ранок, 2012.
Боровский Е.Э. Вода в природе. Дефицит чистой пресной воды. – М.: Чистык пруды, 2009.
Троегубова Н.П. Поурочные разработки по химии: 8 класс. – М.: ВАКО, 2012.
Химия. 8 класс: Поурочные планы / С.Ю. Дибленко – Волгоград: Учитель, 2004.
http://mokroe-school.pruzhany.by/?p=974
infourok.ru