Функции воды и других неорганических веществ в клетке. Вода функции свойства
Структура, свойства и функции воды
Воде обладает уникальными химические и физические свойства. Взгляните на рисунок 6.1: молекула воды (Н2О) состоит из двух атомов водорода, соединенных с атомом кислорода ковалентными связями. На полюсах молекулы воды находятся
положительные и отрицательный заряды, то есть она полярная. Благодаря этому две соседние молекулы обычно взаимно притягиваются за счет сил электростатического взаимодействия между отрицательным зарядом атома кислорода одной молекулы и положительным зарядом атома водорода другой. При этом возникает водородная связь (рис. 6.2), в 15-20 раз слабее ковалентная. Когда вода находится в жидком состоянии, ее молекулы непрерывно движутся и водородные связи постоянно то разрываются, то возникают вновь.
Часть молекул воды формирует водную оболочку вокруг некоторых соединений (например, белков). Такую воду называют связанной, или структурированной (4-5% общего количества воды в организмах). Структурированная вода формирует водную оболочку вокруг определенных молекул, предотвращает их взаимодействия. Кроме того, вода участвует в поддержании структуры определенных молекул, например белков. Остальные 95-96% воды называется свободной: она не связана с другими соединениями.
Зависимости от температуры среды вода способна изменять агрегатное состояние. Снижения температуры вода из жидкого состояния может переходить в твердое, а за повышение - в газовать.
Образование кристаллов льда в клетках организмов разрушает клеточные структуры. Это приводит к гибели клеток и всего организма. Именно поэтому млекопитающих и человека невозможно заморозить, а затем - разморозить без потери способности восстанавливать процессы жизнедеятельности.
Под влиянием растворенных в ней веществ вода может менять свои свойства, в частности точки температур замерзания (плавления) и кипения, что имеет важное биологическое значение. Например, в клетках растений с наступлением зимы повышается концентрация растворов углеводов, членистоногих - глицерина, рыб - белков и т.д.. Это снижает температуру, при которой вода переходит в твердое состояние, что предотвращает промерзание. Представьте себе: среди насекомых известны льодовичникы (рис. 6.3), способны сохранять активность на снежном покрове (они живут и в Украине). Молекулам воды присуща способность к ионизации, когда они расщепляются на ионы водорода и гидроксила. Хотя ионизация химически чистой воды очень слабая (при температуре +25 ° С из 107 молекул только одна находится в ионизированном состоянии), она играет важную биологическую роль. От концентрации ионов водорода, которую оценивают по водородным показателем (рН - значение отрицательного десятичного логарифма концентрации ионов Н +), зависят структурные особенности и активность макромолекул и т.д.. Нейтральной реакции раствора соответствует рН 7,0. Если его значение ниже-реакция раствора кислая, выше - щелочная. В разных частях организма и даже одной клетки можно наблюдать разные значения водородного показателя. Это важно для осуществления процессов обмена веществ, поскольку одни ферменты активны в щелочной среде, другие - в кислой. Например, у инфузории-туфельки пищеварительные вакуоли периодически «путешествуют» по клетке, оказываясь то в кислой, то в щелочной среде. При этом последовательно активные то одни пищеварительные ферменты, то другие, способствует лучшему перевариванию питательных веществ. Вспомните: у человека и млекопитающих ферменты желудочного сока активны в кислой среде, а поджелудочного - в щелочной.
Водные растворы, способные противостоять изменению их показателя рН при добавлении определенного количества кислоты или щелочи, называют буферными системами. Они состоят из слабой кислоты (донора Н +) и основы (акцептора Н +), способных соответствии связывать ионы гидроксила (ОН-) и водорода (Н +), благодаря чему рН внутри клетки почти не изменяется.
Вода определяет физические свойства клеток - объем и внутриклеточное давление (тургор). По сравнению с другими жидкостями в нее относительно высокие температуры кипения и плавления, что обусловлено водородными связями между молекулами воды.
Вода - значительно лучше растворитель, чем большинство других известных жидкостей. Поэтому все вещества подразделяют на хорошо растворимые в воде (гидрофильные) и нерастворимые (гидрофобные).
К гидрофильных соединений предстоит много кристаллических солей, например поваренная соль (NaCl), глюкоза, фруктоза, тростниковый сахар и т.д.. Гидрофильные соединения содержат полярные (частично заряженные) группы, способные взаимодействовать с молекулами воды или ионизуватися (образовывать заряженные ионы из нейтральных частей своей молекулы). Это, например, аминокислоты, содержащие карбоксильные (-СООН) и аминные (-Nh3) группы.
Гидрофобные вещества (почти все липиды, некоторые белки) содержат неполярные группы, которые не взаимодействуют с молекулами воды. Они растворяются преимущественно в неполярных органических растворителях (хлороформ, бензол).
Существуют и амфифильных вещества, например фосфолипиды (соединения липидов с остатками ортофосфатнои кислоты), липопротеиды (соединения липидов с белками), много белков. Одна часть молекулы этих соединений проявляет гидрофильные свойства, другая - гидрофобные.
Когда определенная соединение переходит в раствор, ее молекулы приобретают способность к движению и их реакционная способность возрастает. Именно поэтому большая часть биохимических реакций происходит в водных растворах.
Вода как универсальный растворитель играет важную роль в обмене веществ. Проникновение веществ в клетку и выведение из нее продуктов жизнедеятельности возможно в основном лишь в растворенном состоянии.
Вода как универсальный растворитель играет чрезвычайно важную роль в транспорте различных соединений в живых организмах. Растворы органических и неорганических веществ растения транспортируют по ведущим тканях или межклетниках. У животных такую функцию выполняют кровь, лимфа, тканевая жидкость и т.д..
Вода участвует в сложных биохимических превращениях. Например, при участии воды происходят реакции гидролиза - расщепления органических соединений с присоединением к местам разрывов ионов Н + и ОН-.
С водой связана способность организмов регулировать свой тепловой режим. Ей свойственна высокая теплоемкость, которая предопределяет способность поглощать тепло при незначительных изменений собственной температуры. Теплоемкость - количество тепла, необходимого для нагревания тела или среды на 1 ° С. Благодаря этому вода предотвращает резким изменениям температуры в клетках и организме в целом при резких ее колебаний в окружающей среде. Поскольку на испарение воды расходуется много теплоты, организмы таким образом защищают себя от перегрева (например, транспирация у растений, потоотделение у млекопитающих, испарения влаги со слизистых оболочек животных).
Благодаря высокой теплопроводности вода обеспечивает равномерное распределение тепла между тканями и органами организма. Например, благодаря циркуляции жидкостей внутренней среды у животных или движения растворов по телу растения.
Водные растворы определенных соединений служат маслом, защищает поверхности постоянно подвергаются трению. Например, жидкость, которая заполняет полость суставов, облегчает скольжение суставных поверхностей, уменьшая трение между ними. Она также питает хрящ, покрывающий суставные поверхности костей.
Каждому виду организмов присущ водный баланс - определенное соотношение между поступлением воды и ее расходованием. Если расходы воды превышают ее поступления в организм, наблюдают водный дефицит отрицательно влияет на различные процессы жизнедеятельности (у растений - фотосинтеза, транспирации, у растений и животных - терморегуляции, протекания биохимических процессов и т.п.). Поэтому поддержание водного баланса - одно из условий нормального функционирования любого организма.
worldofscience.ru
9. Функции воды в клетке
| Функции | Пояснение | |
| 1. | Транспортная | перенос веществ из клетки в клетку, по организму (кровообращение) |
| 2. | Среда для протекания биохимических реакций | взаимодействие веществ в реакциях метаболизма происходит в водной среде |
| 3. | Растворитель веществ | в растворенном состоянии реакционная способность веществ возрастает |
| 4. | Теплорегуляторная | сглаживает колебания температуры тканей при резких колебаниях температуры окружающей среды (транспирация у растений, потоотделение у млекопитающих) |
| 5. | Придает форму и упругость клетке | поддерживает в клетках тургорное давление, придавая им нужную форму, и отвечает за их растяжение при росте у растений; |
| 6. | Химический реагент | донор электронов в ходе световой фазы фотосинтеза, источник водорода в темновой фазе фотосинтеза, участвует в гидролизе полимеров |
| 7. | Хороший амортизатор при механических воздействиях | смягчает механические воздействия |
| 8. | Участие в формировании структуры биополимеров | образует гидратные оболочки биополимеров и участвует в формировании конформации белков, нуклеиновых кислот и др. |
| 9. | Участие в процессах осмоса | поступление воды из почвы; плазмолиз, поддержание осмотического давления в клетке |
| 10. | Среда для оплодотворения | вода является обязательным условием оплодотворения у низших и высших споровых растений, а также многих животных (кишечнополостные, рыбы, земноводные и др) |
10. Осмотические явления в клетке (Осмос – проникновение воды через полупроницаемую мембрану, вызванное разностью концентраций)
| Растворы | Изменения | |
| В растительной клетке | В животной клетке | |
| Гипертонический | Плазмолиз – отставание цитоплазмы от клеточной стенки вследствие осмотической отдачи клеткой воды. Обратный процесс - деплазмолиз | Выход воды из клетки, вследствие чего происходит сморщивание клетки и ее гибель |
| Изотонический | Изменений нет | |
| Гипотонический | Поступление воды в клетку, вследствие чего возникает напряженное состояние - тургор | Поступление воды в клетку, вследствие чего происходит разрыв клетки и ее гибель |
Движение воды происходит всегда из раствора с меньшей концентрацией растворенных веществ в раствор с их большей концентрацией. Диффузия воды происходит с силой, равной осмотическому давлению. Чем больше концентрация раствора, тем больше его осмотическое давление.
11. Формы и роль минеральных веществ в клетке
| Минеральные вещества | Значение | |
| В виде нерастворимых соединений | CaCO3 | Входит в состав раковин моллюсков, панцирей раков, клеточных оболочек некоторых морских водорослей и др |
| Ca3(PO4)2 (меньше Mg3(PO4)2 | Входят в состав костей | |
| CaF2 | Входит в состав зубной эмали | |
| SrSO4 | Входит в состав внутриклеточного скелета радиолярий | |
| SiO2 | Входит в состав клеточных оболочек многих растений (хвощи, злаки и др) | |
| В виде ионов (растворенном виде) | Катионы К+, Na+, Ca2+, Mg2+, Nh5+ |
|
| Анионы Cl- , HPO42- , h3PO4- , HCO3- , NO3- | ||
| Неорганические кислоты и их соли | HCl h3SO4 HNO3 | Входит в состав желудочного сока Остатки SO42-, присоединяясь к чужеродным веществам, способствуют их выведению из организма Натриевые и калиевые соли являются важными компонентами минерального питания растений |
studfiles.net
Вода. Строение, свойства. Роль воды в клетке и организме — МегаЛекции
Вода - самое распространенное соединение в живых системах. Но содержание воды колеблется в широких пределах: от 10% (эмаль зубов), 20% (костная ткань), до 85% (головной мозг человека), в сухих семенах 10-12%, у медузы 95-98%, т.е. весь организм по существу состоит из воды. Потеря 20% воды приводит к гибели клетки или анабиозу.
Свойства воды уникальны, т.е. ни одно другое соединение не обладает ими. Это обусловлено строением ее молекул: один атом кислорода связан прочной ковалентной связью с двумя атомами водорода, т.е. Н2О – очень простое соединение. Атомы водорода присоединены к кислороду под углом 104,50.
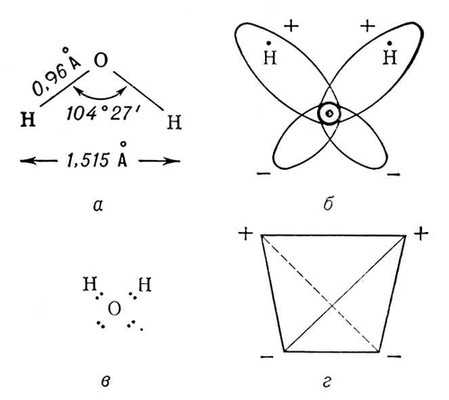
Рис.1. Строение молекулы воды.
Особенности физических свойств воды связаны со структурой её молекулы и особенностями межмолекулярных взаимодействий. Распределение электронной плотности в молекуле воды таково (рис.1, б, в), что создаются 4 полюса зарядов: 2 положительных, связанных с атомами водорода, и 2 отрицательных, связанных с электронными облаками электронов атома кислорода. Указанные 4 полюса зарядов располагаются в вершинах тетраэдра (рис. 1, г). Благодаря этому молекула воды дипольна, а четыре полюса зарядов позволяют каждой молекуле образовать четыре водородные связи с соседними (такими же) молекулами. В результате образуются кластеры (при мгновенном замораживании они похожи на красивые снежинки, рис.2.).
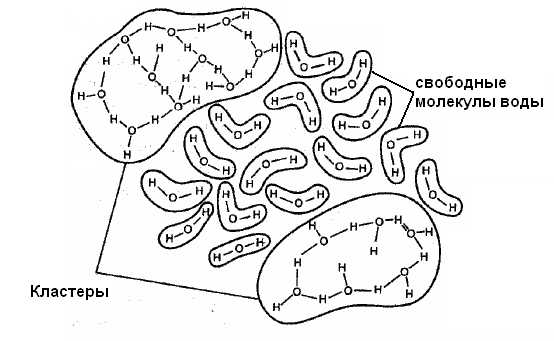
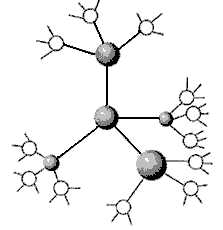
Рис.2. Образование кластера воды.
Кластеры образуют рабочую «структуру воды». Водородные связи слабые, в 15-20 раз слабее ковалентных. Поэтому одни связи легко рвутся, другие возникают. Вследствие этого молекулы очень подвижны. Любые внешние изменения (температуры, давления и т.д.) меняют эту рабочую структуру. Таким образом, вода обладает высокой чувствительностью и памятью.
Молекулы воды могут присоединяться к молекулам, несущим электронный заряд, в результате образуются гидраты. Если сила притяжения между молекулами воды меньше, чем притяжение воды к молекулам вещества – вещество растворяется.
Свойства и функции воды.
1. Связывает в единую систему всю живую и неживую природу на планете. Вода подвижна, изменчива, но меняется не химический состав молекул, а структура кластера.
2. Вода - универсальный растворитель. Из-за полярности она не имеет в этом себе равных: в воде растворяется больше веществ, чем в каких-либо других жидкостях. Вещества в клетку поступают и выводятся только в растворенном виде.
3. По отношению к воде вещества в клетке делятся на 2 группы:
а) гидрофобные (fobos – страх, ужас): нерастворимы в воде (жиры, полисахариды и др.)
б) гидрофильные (fileon – люблю): растворимы в воде (минеральные соли, кислоты, моносахариды и др.)
Благодаря этому свойству воды (за счет гидрофобных взаимодействий) в клетке собираются:
1) биологические мембраны,
2) белки и ДНК принимают форму спирали.
4. Для воды характерна высокая теплоемкость (т.е. чтобы поднять температуру воды и разорвать водородные связи требуется много энергии). Так температура кипения воды 1000С, а у спирта 700С.
5. Высокая теплопроводность. Благодаря этому свойству в клетке и организме поддерживается тепловое равновесие.
6. Вода сама как химическое соединение участвует во многих химических реакциях. Например, реакции гидролиза идут за счет присоединения воды.
7. Является источником О2 и Н+ при фотосинтезе (фотолиз воды).
8. Вода – основная среда для транспорта веществ в клетке (диффузия) и организме (токи крови и лимфы, межтканевой жидкости, содержащими питательные вещества, О2 и СО2, гормоны, вещества, включающие и выключающие работу генов). Это транспортная функция.
9. Обеспечивает объем и упругость клетки: тургорное и осмотическое давление, сохраняет форму клеток и организмов (гидроскелет у круглых и кольчатых червей).
10. Среда для оплодотворения.
11. Среда для жизни водных организмов.
12. Среда для развития зародышей животных (в амнионе).
13. Участвует в образовании смазочных жидкостей в суставах, плевральной полости, околосердечной сумке.
14. Образует слизи, обеспечивающие передвижение веществ по кишечнику, влажную среду на слизистых оболочках (чихание, кашель).
15. Участвует в образовании секретов (слюна, слезы, желчь, сперма и соли в организме).
16. Вода - лимитирующий фактор жизни на нашей планете. Всюду, где есть вода, есть жизнь, где нет воды – там нет жизни.
megalektsii.ru
Функции воды и других неорганических веществ в клетке
Вода играет важнейшую роль в жизни клеток и живых организмов в целом. Помимо того, что она входит в их состав, для многих организмов это еще и среда обитания. Роль воды в клетке определяется ее свойствами. Свойства эти довольно уникальны и связаны главным образом с малыми размерами молекул воды, с полярностью ее молекул и с их способностью, соединяться друг с другом водородными связями.
Молекулы воды имеют нелинейную пространственную структуру. Атомы в молекуле воды удерживаются посредством полярных ковалентных связей, которые связывают один атом кислорода с двумя атомами водорода. Полярность ковалентных связей (т.е. неравномерное распределение зарядов) объясняется в данном случае сильной электроотрицательностью атомов кислорода по отношению к атому водорода; атом кислорода оттягивает на себя электроны из общих электронных пар.
Вследствие этого на атоме кислорода возникает частично Отрицательный заряд, а на атомах водорода — частично положительный. Между атомами кислорода и водорода соседних молекул возникают водородные связи.
Благодаря образованию водородных связей молекулы воды им одна с другой, что и обусловливает ее исходное состояние при нормальных условиях.
Вода является превосходным растворителем для полярных веществ, например солей, сахаров, спиртов, кислот и др. Вещества хорошо растворимые в воде, называются гидрофильными.
Абсолютно неполярные вещества типа жиров или масел вода не растворяет и не смешивается с ними, поскольку она не может образовывать с ними водородные связи. Нерастворимые в воде вещества называютсягидрофобными.
Вода обладает высокой удельной теплоемкостью. Для разрыва водородных связей, удерживающих молекулы воды, требуется поглотить большое количество энергии. Это свойство обеспечивает поддержание теплового баланса организма при значительных перепадах температуры в окружающей среде. Кроме того, вода обладает высокой теплопроводностью, что позволяет организму поддерживать одинаковую температуру во всем его объеме.
Вода обладает также высокой теплотой парообразования, т.е. способностью молекул уносить с собой значительное количество тепла, охлаждая организм. Это свойство воды используется при потоотделении у млекопитающих, тепловой одышке у крокодилов и транспирации у растений, предотвращая их перегрев.
Для воды характерно исключительно высокое поверхностное натяжение. Это свойство имеет очень важное значение для адсорбционных процессов, для передвижения растворов по тканям (кровообращение, восходящий и нисходящий токи в теле растений). Многие мелкие организмы извлекают для себя пользу из поверхностного натяжения: оно позволяет им удерживаться на воде или скользить по ее поверхности.
Биологические функции воды
Транспортная. Вода обеспечивает передвижение веществ в клетке и организме, поглощение веществ и выведение продуктов метаболизма.
Метаболическая. Вода является средой для всех биохимических реакций в клетке. Ее молекулы участвуют во многих химических реакциях, например при образовании или гидролизе полимеров. В процессе фотосинтеза вода является донором электронов и источником атомов водорода. Она же является источником свободного кислорода.
Структурная. Цитоплазма клеток содержит от 60 до 95 % воды. У растений вода определяет тургор клеток, а у некоторых животных выполняет опорные функции, являясь гидростатическим скелетом (круглые и кольчатые черви, иглокожие).
Вода участвует в образовании смазывающих жидкостей (синовиальная в суставах позвоночных; плевральная в плевральной полости, перикардиальная в околосердечной сумке) и слизей (которые облегчают передвижение веществ по кишечнику, создают влажную среду на слизистых оболочках дыхательных путей). Она входит в состав слюны, желчи, слез, спермы и др.
Минеральные соли. Молекулы солей в водном растворе диссоциируют на катионы и анионы. Наибольшее значение имеют катионы: К+, Na+, Са2+, Mg2+ и анионы: Cl—, h3PO4—, HPO42-, HCO3—, NO3—, SO42-. Существенным является не только содержание, но и соотношение ионов в клетке.
Разность между количеством катионов и анионов на поверхности и внутри клетки обеспечивает возникновение потенциала действия, что лежит в основе нервного и мышечного возбуждения. С разностью концентрации ионов по разные стороны мембраны связывают активный перенос веществ через мембрану, а также преобразование энергии.
Анионы фосфорной кислоты создают фосфатную буферную систему, поддерживающую pH внутриклеточной среды организма на уровне 6,9.
Угольная кислота и ее анионы создают бикарбонатную буферную систему, которая поддерживает рН внеклеточной среды (плазма крови) на уровне 7,4.
Некоторые ионы участвуют в активации ферментов, создании осмотического давления в клетке, в процессах мышечного сокращения, свертывании крови и др.
Некоторые катионы и анионы могут включаться в комплексы с различными веществами (например, анионы фосфорной кислоты входят в состав фосфолипидов, АТФ, нуклеотидов и др.; ион Fe2+ входит в состав гемоглобина и т.д.).
jbio.ru





















