План: Введение Основные понятия о воде. Физические свойства воды. Свойство воды реферат
Реферат на тему: "Свойства воды"
Российский Государственный Гидрометеорологический университет
Кафедра Океанологии
Дисциплина "Химия"
Выполнил ст. гр. О-136
Гусев М.В.
Санкт-Петербург
2011
I. Введение..............................................................................................................3
II. Основная часть...................................................................................................3
Физические свойства. ...................................................................................4
Тяжелая(дейтериевая) вода..........................................................................5
Омагниченная вода. ......................................................................................7
Химические свойства воды..........................................................................7
........................................................................................................9
Список литературы: .............................................................................................10
I. Введение
Почти ¾ поверхности нашей планеты занято океанами и морями, а снегом и льдом – покрыто около 20% суши. Из общего количества воды на Земле, равного 1 млрд. 386 млн. кубических километров, 1 млрд. 338 млн. кубических километров приходится на долю солёных вод Мирового океана, и только 35 млн. кубических километров приходится на долю пресных вод. Почти 70% пресных вод заключено в ледниковых покровах полярных стран и в горных ледниках, 30% - в водоносных слоях под землёй, а в руслах всех рек содержатся одновременно всего лишь 0,006% пресных вод.
Вода – единственное вещество на Земле, которое существует в природе во всех трёх агрегатных состояниях – жидком, твёрдом и газообразном.
Молекулы воды были обнаружены в межзвёздном пространстве. Вода входит в состав комет, большинства планет солнечной системы и их спутников.
Существуют девять устойчивых изотопных разновидностей воды. Содержание их в пресной воде в среднем следующее:
1Н216О – 99,73%, 1Н218О – 0,2%, 1Н217О – 0,04%, 1h3Н16О – 0,03%.
Остальные пять изотопных разновидностей присутствуют в воде в ничтожно малых количествах.
II. Основная часть
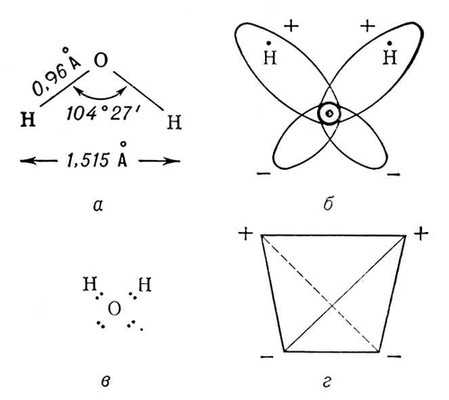
Строение молекулы. 
Как известно, свойства химических соединений зависят от того, из каких элементов состоят их молекулы, и изменяются закономерно. Воду можно рассматривать как оксид водорода или как гидрид кислорода. Атомы водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи О – Н 0,958 нм; валентный угол Н – О – Н 104o 27’(104,45о).
Но поскольку оба водородных атома расположены по одну сторону от кислородного, электрические заряды в ней рассредоточиваются. Молекула воды полярна, что является причиной особого взаимодействия между разными её молекулами. Атомы водорода в молекуле воды, имея частичный положительный заряд, взаимодействуют с электронами атомов кислорода соседних молекул (водородная связь). Она объединяет молекулы воды в своеобразные полимеры пространственного строения. В жидкой и твёрдой фазах каждая молекула воды образует четыре водородные связи: две – как донор протонов и две – как акцептор протонов. Средняя длина этих связей – 0, 28 нм, угол Н – О – Н стремится к 180о .Четыре водородные связи молекулы воды направлены приблизительно к вершинам правильного тетраэдра.
studfiles.net
Реферат о свойствах воды, в том числе, что она воспринимает информацию
li{counter-increment:lst-ctn-kix_list_1-7}#doc7218396 ol.lst-kix_list_2-8.start{counter-reset:lst-ctn-kix_list_2-8 0}#doc7218396 .lst-kix_list_2-6>li{counter-increment:lst-ctn-kix_list_2-6}#doc7218396 .lst-kix_list_2-8>li:before{content:"" counter(lst-ctn-kix_list_2-8,lower-roman) ". "}#doc7218396 .lst-kix_list_1-1>li:before{content:"" counter(lst-ctn-kix_list_1-1,lower-latin) ". "}#doc7218396 ol.lst-kix_list_2-0{list-style-type:none}#doc7218396 .lst-kix_list_1-1>li{counter-increment:lst-ctn-kix_list_1-1}#doc7218396 ol.lst-kix_list_2-0.start{counter-reset:lst-ctn-kix_list_2-0 0}#doc7218396 ol.lst-kix_list_2-1{list-style-type:none}#doc7218396 ol.lst-kix_list_2-2{list-style-type:none}#doc7218396 ol.lst-kix_list_2-3{list-style-type:none}#doc7218396 ol.lst-kix_list_2-4{list-style-type:none}#doc7218396 ol.lst-kix_list_2-5{list-style-type:none}#doc7218396 .lst-kix_list_2-0>li:before{content:"" counter(lst-ctn-kix_list_2-0,decimal) ". "}#doc7218396 ol.lst-kix_list_1-2.start{counter-reset:lst-ctn-kix_list_1-2 0}#doc7218396 .lst-kix_list_1-2>li:before{content:"" counter(lst-ctn-kix_list_1-2,lower-roman) ". "}#doc7218396 .lst-kix_list_2-8>li{counter-increment:lst-ctn-kix_list_2-8}#doc7218396 .lst-kix_list_1-5>li:before{content:"" counter(lst-ctn-kix_list_1-5,lower-roman) ". "}#doc7218396 .lst-kix_list_2-3>li{counter-increment:lst-ctn-kix_list_2-3}#doc7218396 .lst-kix_list_1-8>li{counter-increment:lst-ctn-kix_list_1-8}#doc7218396 ol.lst-kix_list_1-7.start{counter-reset:lst-ctn-kix_list_1-7 0}#doc7218396 ol.lst-kix_list_2-7{list-style-type:none}#doc7218396 ol.lst-kix_list_2-6{list-style-type:none}#doc7218396 .lst-kix_list_2-3>li:before{content:"" counter(lst-ctn-kix_list_2-3,decimal) ". "}#doc7218396 .lst-kix_list_2-4>li:before{content:"" counter(lst-ctn-kix_list_2-4,lower-latin) ". "}#doc7218396 ol.lst-kix_list_2-8{list-style-type:none}#doc7218396 ol.lst-kix_list_1-5.start{counter-reset:lst-ctn-kix_list_1-5 0}#doc7218396 .lst-kix_list_1-4>li:before{content:"" counter(lst-ctn-kix_list_1-4,lower-latin) ". "}#doc7218396 ol.lst-kix_list_2-4.start{counter-reset:lst-ctn-kix_list_2-4 0}#doc7218396 ol.lst-kix_list_1-1.start{counter-reset:lst-ctn-kix_list_1-1 0}#doc7218396 .lst-kix_list_2-1>li{counter-increment:lst-ctn-kix_list_2-1}#doc7218396 .lst-kix_list_2-0>li{counter-increment:lst-ctn-kix_list_2-0}#doc7218396 ol.lst-kix_list_1-0.start{counter-reset:lst-ctn-kix_list_1-0 0}#doc7218396 ol.lst-kix_list_2-3.start{counter-reset:lst-ctn-kix_list_2-3 0}#doc7218396 .lst-kix_list_1-5>li{counter-increment:lst-ctn-kix_list_1-5}#doc7218396 .lst-kix_list_2-5>li:before{content:"" counter(lst-ctn-kix_list_2-5,lower-roman) ". "}#doc7218396 .lst-kix_list_1-0>li:before{content:"" counter(lst-ctn-kix_list_1-0,decimal) ". "}#doc7218396 .lst-kix_list_2-4>li{counter-increment:lst-ctn-kix_list_2-4}#doc7218396 .lst-kix_list_2-7>li:before{content:"" counter(lst-ctn-kix_list_2-7,lower-latin) ". "}#doc7218396 .lst-kix_list_1-8>li:before{content:"" counter(lst-ctn-kix_list_1-8,lower-roman) ". "}#doc7218396 .lst-kix_list_1-6>li{counter-increment:lst-ctn-kix_list_1-6}#doc7218396 .lst-kix_list_2-5>li{counter-increment:lst-ctn-kix_list_2-5}#doc7218396 ol.lst-kix_list_1-6.start{counter-reset:lst-ctn-kix_list_1-6 0}#doc7218396 ol.lst-kix_list_2-2.start{counter-reset:lst-ctn-kix_list_2-2 0}#doc7218396 .lst-kix_list_1-3>li:before{content:"" counter(lst-ctn-kix_list_1-3,decimal) ". "}#doc7218396 .lst-kix_list_1-0>li{counter-increment:lst-ctn-kix_list_1-0}#doc7218396 ol.lst-kix_list_2-7.start{counter-reset:lst-ctn-kix_list_2-7 0}#doc7218396 ol.lst-kix_list_2-1.start{counter-reset:lst-ctn-kix_list_2-1 0}#doc7218396 ol.lst-kix_list_1-3.start{counter-reset:lst-ctn-kix_list_1-3 0}#doc7218396 .lst-kix_list_1-3>li{counter-increment:lst-ctn-kix_list_1-3}#doc7218396 .lst-kix_list_2-7>li{counter-increment:lst-ctn-kix_list_2-7}#doc7218396 ol.lst-kix_list_2-6.start{counter-reset:lst-ctn-kix_list_2-6 0}#doc7218396 .lst-kix_list_1-2>li{counter-increment:lst-ctn-kix_list_1-2}#doc7218396 ol.lst-kix_list_2-5.start{counter-reset:lst-ctn-kix_list_2-5 0}#doc7218396 ol.lst-kix_list_1-7{list-style-type:none}#doc7218396 ol.lst-kix_list_1-8{list-style-type:none}#doc7218396 .lst-kix_list_1-6>li:before{content:"" counter(lst-ctn-kix_list_1-6,decimal) ". "}#doc7218396 .lst-kix_list_2-6>li:before{content:"" counter(lst-ctn-kix_list_2-6,decimal) ". "}#doc7218396 .lst-kix_list_1-4>li{counter-increment:lst-ctn-kix_list_1-4}#doc7218396 .lst-kix_list_2-2>li:before{content:"" counter(lst-ctn-kix_list_2-2,lower-roman) ". "}#doc7218396 .lst-kix_list_1-7>li:before{content:"" counter(lst-ctn-kix_list_1-7,lower-latin) ". "}#doc7218396 ol.lst-kix_list_1-8.start{counter-reset:lst-ctn-kix_list_1-8 0}#doc7218396 ol.lst-kix_list_1-4.start{counter-reset:lst-ctn-kix_list_1-4 0}#doc7218396 ol.lst-kix_list_1-2{list-style-type:none}#doc7218396 ol.lst-kix_list_1-1{list-style-type:none}#doc7218396 .lst-kix_list_2-1>li:before{content:"" counter(lst-ctn-kix_list_2-1,lower-latin) ". "}#doc7218396 ol.lst-kix_list_1-0{list-style-type:none}#doc7218396 .lst-kix_list_2-2>li{counter-increment:lst-ctn-kix_list_2-2}#doc7218396 ol.lst-kix_list_1-6{list-style-type:none}#doc7218396 ol.lst-kix_list_1-5{list-style-type:none}#doc7218396 ol.lst-kix_list_1-4{list-style-type:none}#doc7218396 ol.lst-kix_list_1-3{list-style-type:none}#doc7218396 ol{margin:0;padding:0}#doc7218396 .c14{line-height:1.5;padding-top:19.6pt;widows:2;orphans:2;text-indent:36.8pt;direction:ltr;margin-left:0.6pt;padding-bottom:0pt}#doc7218396 .c4{line-height:1.5;padding-top:0pt;widows:2;orphans:2;text-indent:35.4pt;text-align:justify;direction:ltr;padding-bottom:0pt}#doc7218396 .c7{line-height:1.5;padding-top:0pt;widows:2;orphans:2;height:11pt;direction:ltr;padding-bottom:0pt}#doc7218396 .c1{line-height:1.0;padding-top:0pt;widows:2;orphans:2;height:11pt;direction:ltr;padding-bottom:0pt}#doc7218396 .c27{line-height:1.5;padding-top:0.1pt;widows:2;orphans:2;text-indent:16pt;direction:ltr;padding-bottom:0pt}#doc7218396 .c8{line-height:1.0;padding-top:0pt;widows:2;orphans:2;direction:ltr;padding-bottom:0pt}#doc7218396 .c28{line-height:1.5;padding-top:17.9pt;widows:2;orphans:2;direction:ltr;padding-bottom:0pt}#doc7218396 .c9{line-height:1.5;padding-top:0pt;widows:2;orphans:2;direction:ltr;padding-bottom:0pt}#doc7218396 .c0{vertical-align:baseline;font-size:14pt;font-family:"Times New Roman";text-decoration:underline;font-weight:normal}#doc7218396 .c26{vertical-align:baseline;font-size:24pt;font-family:"Times New Roman";font-weight:bold}#doc7218396 .c10{vertical-align:baseline;font-size:14pt;font-family:"Times New Roman";font-weight:bold}#doc7218396 .c3{vertical-align:baseline;font-size:14pt;font-family:"Times New Roman";font-weight:normal}#doc7218396 .c15{vertical-align:baseline;font-size:16pt;font-family:"Times New Roman";font-weight:normal}#doc7218396 .c2{vertical-align:baseline;font-size:12pt;font-family:"Times New Roman";font-weight:normal}#doc7218396 .c23{vertical-align:baseline;font-size:24pt;font-family:"Times New Roman";font-weight:normal}#doc7218396 .c29{max-width:467.7pt;background-color:#ffffff;padding:56.7pt 42.5pt 56.7pt 85pt}#doc7218396 .c17{padding-left:0.5pt;margin-left:53.4pt}#doc7218396 .c11{margin:0;padding:0}#doc7218396 .c21{text-indent:41.8pt;margin-left:0.7pt}#doc7218396 .c22{text-indent:19.2pt;margin-left:0.8pt}#doc7218396 .c25{padding-left:0pt;margin-left:54pt}#doc7218396 .c5{color:#000000}#doc7218396 .c24{margin-right:18pt}#doc7218396 .c18{margin-left:35.4pt}#doc7218396 .c12{height:11pt}#doc7218396 .c13{text-align:justify}#doc7218396 .c20{font-style:italic}#doc7218396 .c6{text-align:center}#doc7218396 .c19{text-align:right}#doc7218396 .c16{text-indent:35.4pt}#doc7218396 .title{widows:2;padding-top:24pt;line-height:1.15;orphans:2;text-align:left;color:#000000;font-size:36pt;font-family:"Arial";font-weight:bold;padding-bottom:6pt;page-break-after:avoid}#doc7218396 .subtitle{widows:2;padding-top:18pt;line-height:1.15;orphans:2;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:"Georgia";padding-bottom:4pt;page-break-after:avoid}#doc7218396 li{color:#000000;font-size:11pt;font-family:"Arial"}#doc7218396 p{color:#000000;font-size:11pt;margin:0;font-family:"Arial"}#doc7218396 h2{widows:2;padding-top:24pt;line-height:1.15;orphans:2;text-align:left;color:#000000;font-size:24pt;font-family:"Arial";font-weight:bold;padding-bottom:6pt;page-break-after:avoid}#doc7218396 h3{widows:2;padding-top:18pt;line-height:1.15;orphans:2;text-align:left;color:#000000;font-size:18pt;font-family:"Arial";font-weight:bold;padding-bottom:4pt;page-break-after:avoid}#doc7218396 h4{widows:2;padding-top:14pt;line-height:1.15;orphans:2;text-align:left;color:#000000;font-size:14pt;font-family:"Arial";font-weight:bold;padding-bottom:4pt;page-break-after:avoid}#doc7218396 h5{widows:2;padding-top:12pt;line-height:1.15;orphans:2;text-align:left;color:#000000;font-size:12pt;font-family:"Arial";font-weight:bold;padding-bottom:2pt;page-break-after:avoid}#doc7218396 h5{widows:2;padding-top:11pt;line-height:1.15;orphans:2;text-align:left;color:#000000;font-size:11pt;font-family:"Arial";font-weight:bold;padding-bottom:2pt;page-break-after:avoid}#doc7218396 h6{widows:2;padding-top:10pt;line-height:1.15;orphans:2;text-align:left;color:#000000;font-size:10pt;font-family:"Arial";font-weight:bold;padding-bottom:2pt;page-break-after:avoid}#doc7218396 ]]>Муниципальное общеобразовательное учреждение
Катановская средняя общеобразовательная школа
Секция «Гидробиология»
Вода - самое удивительное создание природы
Выполнила: Габова Екатерина
ученица 8 кл
Руководитель: Капсаргина Д.С.
учитель географии
аал Катанов 2014г
Содержание
1.Введение _______________________________________3 стр.
2.Основная часть
2.1 Теоретическая часть: Вода – чудо природы ________2 стр.
2.2 Экспериментальная часть: Опыт с водой ___________2 – 4 стр.
3. Заключительная часть
3.1 Выводы _________________________________ 9 стр.
3.2 Рекомендации __________________________________10 – 11 стр.
4. Литература ___________________________________12 стр.
1. Введение. Значение воды.
Никого из нас не удивляет дождь или падающий снег, гладь плавно текущей реки или озера. Другое дело - огромные просторы морей и океанов, гигантские ледники. От этих красот у любого захватит дух. Но редко кто задумается над тем, откуда взялись моря и реки, дождь или снег, каковы свойства воды, предстающей в таком разнообразном виде. Вода - самая загадочная жидкость на Земле. Певцы издавна воспевали ее, поэты посвящали ей удивительные строки, художники изображали ее на своих полотнах. Даже капелькой воды восхищаются до сих пор. А ученые по сей день, как и сотни лет назад, не могут дать точного ответа на, казалось бы, несложный вопрос: что такое вода? Однажды я посмотрела документальный фильм о воде, где ученые выдвигают гипотезу, что вода обладает памятью. Я решила это проверить.
Цель: изучить свойства воды воспринимать информацию через слово.
Задачи: 1. Изучить теоретический материал о воде и ее свойствах.
2. Провести исследовательский эксперимент.
3. Формировать экологическую культуру по отношению к воде.
Актуальность темы: Вода ничем не заменима. На Земле нет ни одного, даже самого примитивного, существа и ни одного растения, которое не имело бы в своем составе воды и могло бы без него обходиться. Благодаря своим свойствам вода универсальна.
Методы исследования: Изучение литературы, просмотр фильмов и телепередач, работа с Интернетом, проведение эксперимента, анализ изученного.
2. Основная часть.
2.1. Вода – чудо природы.
Еще древнегреческий философ Фалес Милетский, живший две с половиной тысячи лет назад, обратил внимание на то, что вода - единственное вещество, которое в природе встречается в трех состояниях: твердом, жидком и газообразном. Поэтому, сделал вывод, все в мире состоит из воды и в неё, в конечном счете, превращается. «Вода - первооснова всего», - утверждал он. Вода – это основа жизни на Земле. Вода – колыбель жизни. Всем известно, что любая жизнь, в том числе и эмбрион человека, зарождается и развивается в воде. Чистая, дистиллированная вода - продукт рук человека, обнаружить её можно только в лаборатории. Но такая вода не пригодна для жизни. Почти вся вода на Земле солёная. В океанах и морях, в озёрах и реках, в подземных водах присутствует разное количество минеральных соединений. Так, в морской воде обнаружено около 50 химических элементов. Кроме солей есть в ней даже золото и серебро.
Вода на Земле может существовать одновременно в твёрдом, жидком и газообразном состоянии. Это - пар, изморось, туман, снег, дождь, ливень, град, роса, лёд и т.д. Оказывается, всё это по тому, что Земля обращается вокруг Солнца на расстоянии примерно 150 миллионов км. Если это расстояние было бы меньше, то вся вода на Земле испарилась бы, а больше - превратилась бы в лёд.
Все свойства воды уникальны и исключительны. Поэтому из-за своих качеств это соединение - вода - наиболее благоприятно для жизни. И чем дольше учёные изучают состав воды, тем больше убеждаются, что эта жидкость волшебная.
1. Почему лёд не тонет?
Все вещества в природе при нагревании расширяются, а при охлаждении сжимаются. Вода следует этому правилу, но до известного придела. Она сжимается, охлаждаясь до +4°С. При такой температуре, вода обладает наибольшей плотностью и весом. Охлаждаясь дальше и превращаясь в лёд при 0°С, она вдруг снова расширяется. При этом вода и лёд увеличиваются в объёме, а их плотность и вес уменьшаются. Лёд становится легче воды, из которой образовался. Вот почему лёд не тает в воде, а плавает на её поверхности. Зимой, когда поверхность скована льдом, на дне температура +4°С. Не будь этого, водоёмы полностью промерзали бы, Земля вся оледенела бы и жизнь на ней прекратилась бы.
2.Почему во время дождя всё вокруг становится мокрым? Почему, если ходить по лужам, промокают ботинки? Потому что вода способна прилипать к другим веществам, смачивать их. Это свойство воды сыграло огромную роль в развитии жизни на Земле. Благодаря этому движется кровь в организмах животных и человека, растение добывает воду и минеральные соли из почвы.
3. Может ли вода «делать погоду»?
Вода обладает очень большой теплоёмкостью, то есть способностью отдавать и накапливать тепло. Вода медленнее нагревается, но зато долго сохраняет тепло. Поэтому летним вечером на море вода теплее, чем песок на берегу.
4. Почему дождь падает каплями?
Молекулы воды связывает сила поверхностного натяжения, и они как бы примагничиваются друг к другу. Молекулы воды стремятся втянуться внутрь с поверхностного слоя. Поэтому вода в свободном состоянии принимает форму шариков. Сколь велика эта сила, все мы не раз убеждались, когда дождевые капли очень чувствительно секли нам лицо. А как они стучат по крышам домов!
Значение воды для человека.
Мы с вами знаем, как велико значение воды на нашей планете. Академик Карпинский писал: «Вода - это живая кровь, которая создаёт жизнь». Без воды нет жизни. Человек не может прожить без воды более 8 дней. Вода - это чудесный дар природы для всего живого, в том числе человека, т. е. нас вами.
Существование человечества, расселение людей по планете непосредственно связанно с водой. Во все времена человек стремился к рекам, озерам, селился по их берегам. Вода для человека не только кормилица, но и предмет восхищения. Не случайно из глубины веков до нас дошли слова народной мудрости: «Три вещи, человек может созерцать бесконечно: текущую воду, горящий огонь и плывущие облака»
2.2. Опыт с водой
Я решила провести опыт, используя рис, чтобы лучше увидеть реакцию воды на воспринимаемую информацию. Эксперимент разделила на две части.
Описание эксперимента: В три банки с чистой водой засыпали рис. Одной банке с водой каждый день говорила хорошие слова, другой говорила плохие слова, третьей ничего не говорила. Эксперимент продолжался 5 дней.
Результат эксперимента: В банке, которой говорили плохие слова, на второй день вода помутнела, в других вода стояла прозрачной. Через несколько дней, в банке с рисом, которой ничего не говорили, стала появляться желтая пленка. В конце опыта в банке с рисом, которой говорили плохие слова, тоже появилась пленка, но намного меньше, чем в банке, на которую не обращали внимания.
Следующий этап эксперимента заключался в том, что я решила проверить энергетическое поле воды в этих банках. Сделав рамки для измерения энергетического поля, я подводила их к каждой по очереди. Над банкой с рисом, которой говорили хорошие слова, рамки разошлись. Над банкой с рисом, которой говорили плохие слова, рамки сомкнулись. Над третьей банкой, рамки остались неподвижными.
Вывод по эксперименту: Из эксперимента следует, что вода воспринимает информацию и начинает менять свой состав, а также способна ее сохранять и реагировать на энергетическом уровне.
3. ЗАКЛЮЧЕНИЕ
Некоторые ученые считают, что вода – хранительница информации, накапливающаяся в процессе жизнедеятельности человечества. Считают, что наводнения, циклоны – это расплата за то, что люди воюют, загрязняют окружающую среду, а фабрики и заводы сбрасывают в воду свои отходы, допускают вредные выбросы в атмосферу. В водоёмах погибают растения и животные, чахнут растения на берегах.
3.1.Выводы
Выполняя эту исследовательскую работу и получив результаты эксперимента можно сделать следующие выводы:
- Вода является уникальным веществом на планете по физическим свойствам.
- Вода способна воспринимать и сохранять информацию.
- Продолжить данную работу, т.к. свойства воды до сих пор изучаются.
3.2.Рекомендации
Если вспомнить традиции разных народов, то почти везде перед употреблением пищи люди читали молитву, которая обладает мощной очищающей энергетикой. И еще всегда запрещали за столом говорить о плохом, наверное, потому что еда состоит из воды, а она запоминает эту информацию.
Исходя, из выше сказанного можно дать следующие рекомендации:
- Благодарить за угощение перед едой, а не после.
- Не говорить при воде о плохом.
- Провести беседы о воде с учащимися школы.
- Представить результат работы в виде презентации.
Вода является величайшей драгоценностью. Каждый человек должен беречь воду. Работая над темой, я очень много узнала о воде и поняла: почему ее называют самым удивительным созданием природы. В компьютере я нашла много красивых пейзажей с изображением воды в различных состояниях. Дух захватывает от этой красоты и великолепия! Как же я раньше не замечала всего этого! Люди, посмотрите вокруг! Сколько чудес вокруг нас! И одно из великих чудес – это вода. Сейчас она находится в опасности. Люди, приложим все усилия, чтобы спасти ее, сохраним ее чистоту для будущих поколений!
nsportal.ru
Реферат Свойства воды
скачатьРеферат на тему:

План:
- Введение
- 1 Виды воды
- 1.1 Химические названия воды
- 2 Свойства
- 2.1 Физические свойства
- 2.1.1 Агрегатные состояния
- 2.1.2 Изотопные модификации воды
- 2.1 Физические свойства
- 3 Химические свойства
- 4 Вода в природе
- 4.1 Атмосферные осадки
- 4.2 Вода за пределами Земли
- 5 Исследования воды
- 6 Биологическая роль
- 7 Применение
- 7.1 Земледелие
- 7.2 Питьё и приготовление пищи
- 7.3 Растворитель
- 7.4 Теплоноситель
- 7.5 Замедлитель
- 7.6 Пожаротушение
- 7.7 Спорт
- 7.8 Инструмент
- 7.9 Смазка
- 8 Интересные факты
- 9 Дополнительное чтение ЛитератураПримечания
Введение

71 % поверхности — вода
Вода́ (оксид водорода) — химическое вещество в виде прозрачной жидкости, не имеющей цвета (в малом объёме), запаха и вкуса (при нормальных условиях). Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, лёд на полюсах).
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
1. Виды воды
Вода на Земле может существовать в трёх основных состояниях — жидком, газообразном и твёрдом и приобретать различные формы, которые могут одновременно соседствовать друг с другом. Водяной пар и облака в небе, морская вода и айсберги, горные ледники и горные реки, водоносные слои в земле. Вода способна растворять в себе много веществ, приобретая тот или иной вкус. Из-за важности воды, «как источника жизни», её нередко подразделяют на типы по различным принципам.
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
- Мягкая вода и жёсткая вода — по содержанию катионов кальция и магния
- По изотопам молекулы:
- Лёгкая вода (по составу почти соответствует обычной)
- Тяжёлая вода (дейтериевая)
- Сверхтяжёлая вода (тритиевая)
- Талая вода
- Пресная вода
- Дождевая вода
- Морская вода
- Подземные воды
- Минеральная вода
- Солоноватая вода (en:Brackish water)
- Питьевая вода, Водопроводная вода
- Дистиллированная вода и деионизированная вода
- Сточные воды
- Ливневая вода или поверхностные воды
- Мёртвая вода и Живая вода — виды воды из сказок (со сказочными свойствами)
- Святая вода — особый вид воды согласно религиозным учениям
- Поливода
- Структурированная вода — термин, применяемый в различных неакадемических теориях.
1.1. Химические названия воды
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода
- Гидроксид водорода
- Монооксид дигидрогена
- Гидроксильная кислота
- англ. hydroxic acid
- Оксидан (англ. oxidane)
- Дигидромонооксид
2. Свойства
2.1. Физические свойства
Вода обладает рядом необычных особенностей:
- При таянии льда его плотность увеличивается (с 0,9 до 1 г/см³). Почти у всех остальных веществ при плавлении плотность уменьшается.
- При нагревании от 0 °C до 4 °C (точнее, 3,98 °C) вода сжимается. Соответственно, при остывании — плотность падает. Благодаря этому могут жить рыбы в замерзающих водоёмах: когда температура падает ниже 4 °C, более холодная вода как менее плотная остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура.
- Высокая температура и удельная теплота плавления (0 °C и 333,55 кДж/кг), температура кипения (100 °C) и удельная теплота парообразования (2250 КДж/кг [2]), по сравнению с соединениями водорода с похожим молекулярным весом.
- Высокая теплоёмкость жидкой воды.
- Низкая вязкость.
- Высокое поверхностное натяжение.
- Отрицательный электрический потенциал поверхности воды.
Все эти особенности связаны с наличием водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а также того, что ион водорода (протон) не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Определенную роль играет протонное обменное взаимодействие между молекулами и внутри молекул воды. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода — каждый в одной, а атом кислорода — в двух; в таком состоянии молекулы находятся в кристалле льда. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4 °C этот эффект становится слабее, чем тепловое расширение. При испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.

Капля, ударяющаяся о поверхность воды
По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде.[3] Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Чистая (не содержащая примесей) вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония h4O+) и гидроксильных ионов HO− составляет 0,1 мкмоль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
2.1.1. Агрегатные состояния
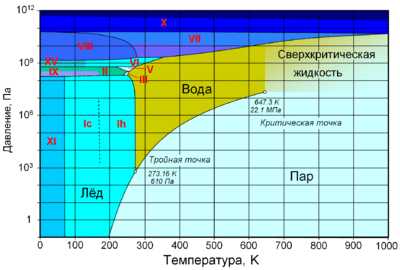
Фазовая диаграмма воды: по вертикальной оси — давление в Па, по горизонтальной — температура в Кельвинах. Отмечены критическая (647,3 K; 22,1 МПа) и тройная (273,16 K; 610 Па) точки. Римскими цифрами отмечены различные структурные модификации льда
По состоянию различают:
- Твёрдое — лёд
- Жидкое — вода
- Газообразное — водяной пар
Типы снежинок.
При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода тает (плавится) при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (температура 0 °C и 100 °C были специально выбраны как температура таяния и кипения воды при создании температурной шкалы «по Цельсию» в системе СИ). При снижении давления температура таяния (плавления) воды медленно растёт, а температура кипения — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такое давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
При росте давления температура кипения воды растёт, плотность водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
Так же возможны метастабильные состояния — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
2.1.2. Изотопные модификации воды
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
- Лёгкая вода (это по составу практически то же, что просто вода).
- Тяжёлая вода (дейтериевая).
- Сверхтяжёлая вода (тритиевая).
Известно, что тяжёлая вода не поддерживает жизни, то есть большинство живых организмов (за исключением некоторых микроорганизмов и грибов) в такой воде умирает[4].
Существуют тяжелокислородные модификации воды, но их свойства не так сильно отличаются от обычной воды, как при замене изотопов водорода.
3. Химические свойства
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+ анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ ок. 16.
Вода химически довольно активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Вода реагирует при комнатной температуре:
- с активными металлами (натрий, калий, кальций, барий и др.)
- с галогенами (фтором, хлором) и межгалоидными соединениями
- с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т.д.)
- с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
- с железом, магнием
- с углем, метаном
- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот
- с ацетиленом и другими алкинами
- с алкенами
- с нитрилами
4. Вода в природе
.
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
4.1. Атмосферные осадки
Осадки согласно направлению[источник не указан 550 дней]
| Дождь | Роса | Облака |
| Дождь со снегом | Иней | Туман |
| Изморось | Атмосферное оледенение | Морская пена |
| Переохлаждённая морось | Гололёд | |
| Снег | ||
| Снежная крупа | ||
| Снежные зерна | ||
| Ледяная крупа | ||
| Ледяной дождь | ||
| Град | ||
| Ледяные кристаллы |
Осадки согласно состоянию[источник не указан 550 дней]
| Дождь | Снег |
| Дождь со снегом | Снежная крупа |
| Изморось | Снежные зерна |
| Переохлаждённая морось | Ледяная крупа |
| Роса | Ледяной дождь |
| Град | |
| Ледяные кристаллы | |
| Иней | |
| Атмосферное оледенение | |
| Гололёд | |
| Позёмка |
4.2. Вода за пределами Земли
Одним из наиболее важных вопросов, связанных с освоением космоса человеком и возможности возникновения жизни на других планетах, является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда. Не стоит, впрочем, забывать, что не любая водная среда пригодна для жизни — в частности, аккумуляторная батарея содержит 25 % раствор серной кислоты в воде (но жизнь в нем, очевидно, маловероятна, тем более, её возникновение).
В результате бомбардировки лунного кратера, проведённого 9 октября 2009 года НАСА с использованием космического аппарата LCROSS, впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объемах.[5]
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет, наиболее вероятно, на Европе, спутнике Юпитера.
5. Исследования воды
5.1. Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
6. Биологическая роль
Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
7. Применение
7.1. Земледелие
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90 % в некоторых странах.
7.2. Питьё и приготовление пищи
Живое человеческое тело содержит от 55 % до 78 % воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. Для нормального функционирования организма человеку нужно усвоить от 1 до 7 литров воды за день в зависимости от температуры и влажности окружающей среды, физической активности и т. д.
7.3. Растворитель
Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
7.4. Теплоноситель
Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР)
Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
7.5. Замедлитель
Во многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции. Также существуют тяжёловодные реакторы, в которых в качестве замедлителя используется тяжёлая вода.
7.6. Пожаротушение
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены.
7.7. Спорт
Многие виды спорта проходят на водных поверхностях, на льду, на снегу и даже в воде. Это подводное плавание, хоккей, лодочные виды спорта, биатлон и пр.
7.8. Инструмент
Гидроабразивная резка
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
7.9. Смазка
Вода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках.[6]
8. Интересные факты
- В среднем в организме растений и животных содержится более 50 % воды.[7]
- В составе мантии Земли воды содержится в 10-12 раз больше, чем количество воды в Мировом океане [8].
- При средней глубине в 4 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.
- Если бы на Земле не было впадин и выпуклостей, вода покрыла бы всю Землю, и её толщина была бы 3 км [9].
- Если бы все ледники растаяли, то уровень воды на Земле поднялся бы на 64 м и около 1/8 поверхности суши было бы затоплено водой [10].
- Морская вода при обычной её солёности 35 ‰ замерзает при температуре −1,91 °C[11].
- Иногда вода замерзает при положительной температуре[12].
- При определённых условиях (внутри нанотрубок) молекулы воды образуют новое состояние, при котором они сохраняют способность течь даже при температурах, близких к абсолютному нулю.[13]
- Среди существующих в природе жидкостей поверхностное натяжение воды уступает только ртути.[14][15]
- Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
- Синий цвет чистой океанской воды объясняется избирательным поглощением и рассеянием света в воде.
- С помощью капель воды из кранов можно создать напряжение до 10 киловольт, опыт называется «Капельница Кельвина».
- Существует следующая поговорка с использованием формулы воды — h3O: «Сапоги мои того — пропускают h3O». Вместо сапог в поговорке может участвовать и другая дырявая обувь.[16][17][18]
- Вода — это одно из немногих веществ на Земле, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают висмут, галлий, свинец и некоторые соединения и смеси).
- Вода может гореть, если ее поместить в атмосферу с фтором, иногда даже со взрывом. При этом выделяется кислород.
- Распространено мнение, что нежелательно смешивать кипячёную воду с некипячёной, якобы употребление такой воды может вызвать диарею [1].
9. Дополнительное чтение
- Всеволод Арабаджи Загадки простой воды.
- Л.Кульский, В.Даль, Л.Ленчина. Вода: знакомая и загадочная
- Мембрана: Впервые созданы пятиугольные кристаллы льда
Литература
- Лосев К.С. Вода. — Л.: Гидрометеоиздат, 1989. — 272 с.
- Жорес Медведев. Какая вода лучше
- Гидробионты в самоочищении вод и биогенной миграции элементов. М.: МАКС-Пресс. 2008. 200 с. Предисловие члена-корр. РАН В. В. Малахова. (Серия: Наука. Образование. Инновации. Выпуск 9). ISBN 978-5-317-02625-7.
- О некоторых вопросах поддержания качества воды и ее самоочищения // Водные ресурсы. 2005. т. 32. № 3. С. 337—347.
- Андреев В. Г. Влияние протонного обменнного взаимодействия на строение молекулы воды и прочность водородной связи. Материалы V Международной конференции «Актуальные проблемы науки в России», Кузнецк 2008, т.3 с.58-62.
Примечания
- англ. International Union of Pure and Applied Chemistry. Nomenclature of Inorganic Chemistry. IUPAC RECOMMENDATIONS 2005. RSC Publishing, 2005. — p. 306.
- Элементарный учебник физики. - www.physel.ru/content/view/299/24/
- pereplet.ru - www.pereplet.ru/obrazovanie/stsoros/355.html
- англ. D. J. Kushner, Alison Baker, and T. G. Dunstall (1999). «Pharmacological uses and perspectives of heavy water and deuterated compounds». Can. J. Physiol. Pharmacol. 77 (2): 79–88. DOI:10.1139/cjpp-77-2-79 - dx.doi.org/10.1139/cjpp-77-2-79. PMID 10535697 - www.ncbi.nlm.nih.gov/pubmed/10535697?dopt=Abstract. “used in boron neutron capture therapy ... D2O is more toxic to malignant than normal animal cells ... Protozoa are able to withstand up to 70% D2O. Algae and bacteria can adapt to grow in 100% D2O”
- Вода на луне: но откуда? - www.infuture.ru/article/2535
- Воскресенский В. А., Дьяков В. И. Глава 2. Смазочные вещества и их физико-химические свойства // Расчет и проектирование опор скольжения (жидкостная смазка): Справочник. — М.: Машиностроение, 1980. — С. 15. — (Библиотека конструктора). — ISBN ББК 34.42, УДК 621.81.001.2 (031)
- Наука и техника. Книги. Загадки простой воды. - n-t.ru/ri/ar/zv01.htm
- Состав и природа минтии Земли - www.priroda.ru/lib/detail.php?ID=5546
- Биосфера Земли - znaniya-sila.narod.ru/solarsis/zemlya/earth_04.htm
- Загадки простой воды - n-t.ru/ri/ar/zv01.htm
- Дайвинг: статьи, каталог снаряжения, обучение, магазины, клубы и центры - www.tetis.ru/?p=uwabout&id=95
- Всеволод Арабаджи. Загадки простой воды. - n-t.ru/ri/ar/zv01.htm 2001
- Science Daily (англ.) - www.sciencedaily.com/releases/2005/06/050605183843.htm
- Коэффициенты поверхностного натяжения жидкостей - www.habit.ru/35/188.html
- Surface tension (англ.)
- Глава 3. Химическая связь и строение молекул. - www.alhimik.ru/teleclass/glava3/gl-3-4.shtml — учебник с сайта alhimik.ru
- Доспехи водника - sport.potrebitel.ru/data/2/64/060.shtml — описание снаряжения с сайта sport.potrebitel.ru
- Бизнес на босу ногу - www.megapolis.kz/show_article.php?art_id=4406 — казахстанская общенациональная газета «Мегаполис»
wreferat.baza-referat.ru
План: Введение Основные понятия о воде. Физические свойства воды
Реферат
«Загадки воды»
Ученицы 9 «А» класса
средней общеобразовательной школы №7
Ждановой Ксении Александровны
Учитель: Стёпочкина Наталия Васильевна
2008 год
Актуальность:
Вода остается одной из самых загадочных жидких субстанций, однако в курсе физики и химии общеобразовательной школы свойствам воды уделяется не много внимания, именно поэтому был создан данный проект.
Цели и задачи:
Расширить свои знания об основных понятиях и свойствах воды.
Познакомиться с аномалиями воды.
Выяснить роль воды в нашей жизни.
Обобщить все знания о воде.
План:
Введение
Основные понятия о воде.
Физические свойства воды
Аномалии воды.
аномалия плотности
аномалия сжимаемости
аномалия теплоёмкости
переохлажденная вода
водородные связи
память воды
Вода в нашей жизни.
Заключение.
Список литературы.
Введение
Вода – вещество привычное и необычное. Известный советский ученый академик И.В.Петрянов свою научно – популярную книгу о воде назвал “Самое необыкновенное вещество в мире”. А доктор биологических наук Б.Ф.Сергеев начал свою книгу “Занимательная физиология” с главы о воде – “Вещество, которое создало нашу планету”.
Вода. Мы никогда не задумываемся над смыслом и сутью этого слова. Но вода - это сама жизнь, без неё всё погибает. Наша голубая планета Земля на 70 % состоит из воды: океаны и моря, реки и озера, родники и ручьи, болота, ледники, айсберги,вечные снега на горных вершинах и вечная мерзлота. Воды много, но для питья пригоден лишь 1% из всего этого многообразия ( имеется в виду вода в своем естественном, природном состоянии). Человеческий организм на 70-80% состоит из воды, благодаря которой происходят все жизненно важные процессы в организме: она питает, обогащает кислородом, охлаждает тело, помогает освобождаться от токсинов, восстанавливает клетки. Человек очень остро ощущает нарушение водного баланса. Потеря влаги на 6-7% от веса тела вызывает обмороки. При потере 10-12% влаги сердце перестает биться. Механизм старения организма связан напрямую с потерей воды. К 50 годам человек «усыхает» и воды остаётся менее 60% от массы тела. Вода выполняет в живой клетке множество функций, главная — структурно -энергетическая! Вода способна сохранять «память» о структуре растворенных веществ. Можно сказать, перенимает её свойства. От воды зависят многочисленные химические реакции, и она служит определяющим компонентом во многих биохимических реакциях.Будучи главной жидкостью, в организме вода служит растворителем для минеральных веществ, витаминов, аминокислот, глюкозы и многих других питательных веществ. Вода играет ключевую роль в пищеварении, всасывании, переносе и утилизации питательных веществ. Вода является средой для безопасного выведения токсинов и продуктов жизнедеятельности, она решающим образом влияет на процесс терморегуляции в организме, от процесса образования энергии до смазки суставов и процесса репродукции. Нет ни одной системы в организме, которая не зависела бы от воды. Вода необходима для мышечных сокращений.
Вода, несмотря на все её аномальные свойства, является эталоном для измерения температуры, массы ( веса), количества тепла, высоты местности.
Шведский физик Андерс Цельсий, член Стокгольмской академии наук, создал в 1742 году стоградусную шкалу термометра, которой в настоящее время пользуются почти повсеместно. Точка кипения воды обозначена 100 , а точка таяния льда 0 .
При разработке метрической системы, установленной по декрету французского революционного правительства в 1793 году взамен различных старинных мер, вода была использована для создания основной меры массы (веса) – килограмма и грамма: 1 грамм, как известно, это вес 1 кубического сантиметра (милилитра) чистой воды при температуре её наибольшей плотности – 40 С. Следовательно, 1 килограмм – это вес 1 литра (1000 кубических сантиметров) или 1 кубического дециметра воды: а 1 тонна (1000 килограммов) – это вес 1 кубического метра воды.
Вода используется и для измерения количества тепла. Одна калория – это количество тепла, нужное для нагревания 1 грамма воды с 14, 5 до 15,50 С.
Все высоты и глубины на земном шаре отсчитываются от уровня моря.
Ученые правы: нет на Земле вещества более важного для нас, чем обыкновенная вода, и в то же время не существует другого такого же вещества, в свойствах которого было бы столько противоречий и аномалий, сколько в её свойствах.
Основные понятия о воде.
Вода (h30) - окись водорода, простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом (11,19% водорода и 88,81% кислорода по массе). Вода – бесцветная жидкость, не имеющая ни вкуса, ни запаха, молекулярная масса 18,0160. Воде принадлежит важнейшая роль в геологической истории Земли и возникновении жизни, в формировании физической и химической среды, климата и погоды на нашей планете. 71 % поверхности Земли покрыто водой (это океаны, моря, озера, реки и т. п.). Также вода в газообразном состоянии находится в атмосфере планеты в виде облаков, туманов и т. п. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса и т. д.). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая криосферой.
Без воды невозможно существование живых организмов. Вода — обязательный компонент практически всех технологических процессов — как сельскохозяйственного, так и промышленного производства.
Благодаря широкой распространённости воды и её роли в жизни людей, она издавна считалась первоисточником жизни. Представление философов античности о воде как о начале всех вещей нашло отражение в учении Аристотеля (4 в. до н. э.) о четырёх стихиях (огне, воздухе, земле и воде), причём вода считалась носителем холода и влажности. Вплоть до конца 18 в. в науке существовало представление о воде как об индивидуальном химическом элементе. В 1781—1782 английский учёный Г. Кавендиш впервые синтезировал воду, взрывая электрической искрой смесь водорода и кислорода, а в 1783 французский учёный А. Лавуазье, повторив эти опыты, впервые сделал правильный вывод, что вода есть соединение водорода и кислорода. В 1785 Лавуазье совместно с французским учёным Ж. Менье определил количественный состав воды. В 1800 английские учёные У. Николсон и А. Карлейль разложили воду на элементы электрическим током. Таким образом, анализ и синтез воды показали сложность её состава и позволили установить для неё формулу h3O. Изучение физических свойств воды началось ещё до установления её состава в тесной связи с другими научно-техническими проблемами. В 1612 итальянский учёный Г. Галилей обратил внимание на меньшую плотность льда сравнительно с жидкой водой как на причину плавучести льда. В 1665 голландский учёный Х. Гюйгенс предложил принять температуру кипения и температуру плавления воды за опорные точки шкалы термометра. В 1772 французский физик Делюк нашёл, что максимум плотности воды лежит при 4°С; при установлении в конце 18 в. метрической системы мер и весов это наблюдение было использовано для определения единицы массы — килограмма. В связи с изобретением паровой машины французские учёные Д. Араго и П. Дюлонг (1830) изучили зависимость давления насыщенного пара воды от температуры. В 1891—1897 Д. И. Менделеев дал формулы зависимости плотности воды от температуры. В 1910 американский учёный П. Бриджмен и немецкий учёный Г. Тамман обнаружили у льда при высоком давлении несколько полиморфных модификаций. В 1932 американские учёные Э. Уошберн и Г. Юри открыли тяжёлую воду. Развитие физических методов исследования позволило существенно продвинуться в изучении структуры молекул воды, а также строения кристаллов льда. В последние десятилетия особое внимание учёных привлекает структура жидкой воды и водных растворов.
Каждый знает, что человек на 80% состоит из воды, а вот где именно в нас хранится вода – не знаем. Поэтому на таблице снизу указано содержание воды в органах и тканях млекопитающих.
| Органы и ткани | Содержание воды, % |
| скелет | 20 - 40 |
| мышцы | 75 |
| печень | 75 |
| Мозг человека | |
| серое вещество | 84 |
| белое вещество | 72 |
Физические свойства воды
Чистая вода представляет собой бесцветную прозрачную жидкость. Плотность воды при переходе ее из твердого состояния в жидкое не уменьшается, как почти всех других веществ, а возрастает. При нагревании воды от 0 до 40 ?С плотность ее также увеличивается. Вода обладает аномально высокой теплоемкостью [4200/(кг * град)]. Температура кипения 100 градусов. Замерзает пр 0 градусов.
Молекула воды имеет угловое строение; входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине - ядро атома кислорода. Длина каждой связи. О - Н близка к 1 А, расстояние между ядрами атомов водорода равно около 1,5 А. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды две электронные пары образуют ковалентные связи О - Н, а остальные четыре электрона представляют собой две неподеленных электронных пары.
| Свойство | Значение |
| Плотность, г/см3 |
|
| лёд . . . . . . . . . . . . . . . . . . | 0,9168 (0°С) |
| жидкость . . . . . . . . . . . . | 0,99987 (0°С) 1,0000 (3,98°С) 0,99823 (20°С) |
| пар насыщенный . . . . . . | 0,5977 кг/м3 (100°С) |
| Темп-ра плавления . . . . . | 0°С |
| Темп-ра кипения . . . . . . . | 100°С |
| Критич. темп-ра . . . . . . . . | 374,15°С |
| Критич. давление . . . . . . . | 218,53 кгс/см2 |
| Критич. плотность . . . . . . | 0,325 г/см3 |
| Теплота плавления . . . . . . | 79,7 кал/г |
| Теплота испарения . . . . . . | 539 кал/г (100°С) |
| Уд. теплопровод-ность, кал/(смЇсекЇград) |
|
| лёд . . . . . . . . . . . . . . . . . . | 5,6Ї10-3 (0°С) |
| жидкость . . . . . . . . . . . . | 1,43Ї10-3 (0°С) 1,54Ї10-3 (45°С) |
| пар насыщенный . . . . . . | 5,51Ї10-5 (100°С) |
| Уд. электропровод-ность, ом–1Їсм-1 |
|
| лёд . . . . . . . . . . . . . . . . . . | 0,4Ї10-8 (0°С) |
| жидкость . . . . . . . . . . . . | 1,47Ї10-8 (0°С) 4,41Ї10-8 (18°С) 18,9Ї10-8 (50°С) |
| Уд. теплоёмкость кал/(гЇград) |
|
| жидкость . . . . . . . . . . . . | 1,00 (15°С) |
| пар насыщенный . . . . . . | 0,487 (100°С) |
| Диэлектрическая про-ницаемость |
|
| лёд . . . . . . . . . . . . . . . . . . | 74,6 (°С) |
| жидкость . . . . . . . . . . . . | 81,0 (20°С) |
| пар насыщенный | 1,007 (145°С) |
| Вязкость, спз |
|
| жидкость . . . . . . . . . . . . | 1,7921 (0°С) 0,284 (100°С)
|
| Поверхностное натя-жение жидкой во- ды на границе своздухом, дин/см | 74,64 (0°С) 62,61 (80°С) |
| Показатель прелом- ления (D - линиянатрия) . . . . . . . . . . . . . . | 1,33299 (20°С) |
| Скорость звука в во-де . . . . . . . . . . . . . . . . . . . | 1,496 м/сек (25°С) |
Аномалии воды.
Ученые насчитали 40 аномалий, характерных для воды. Они пытаются дать этому объяснение: какие-то кажутся исчерпывающими, некоторые спорными, другие совершенно неудовлетворительными. Вот примеры наиболее известных аномалий воды:
Первая и, наверное, самая популярная аномалия – аномалия плотности. Во-первых плотность воды наибольшая при +3,98°С, дальнейшее охлаждение, приводящее к переходу ее в лед, сопровождается уменьшением плотности (однако, в обычных жидкостях плотность всегда уменьшается с температурой, так как чем больше температура, тем больше тепловая скорость молекул, тем сильнее они расталкивают друг друга, приводя к большей рыхлости вещества). Конечно и в воде повышение температуры увеличивает тепловую скорость молекул, но это приводит к понижению плотности только при высоких температурах. После того как плотность льда уменьшилась, можно наблюдать, что лед плавает на поверхности воды (хотя плотности других жидких веществ меньше, чем плотность кристалла). Это объясняется тем, что в кристаллах молекулы расположены регулярно, обладают пространственной периодичностью - это свойство кристаллов всех веществ. Но у обычных веществ молекулы в кристаллах, кроме того, плотно упакованы. После плавления кристалла регулярность в расположении молекул исчезает, и это возможно только при более рыхлой упаковке молекул, то есть плавление обычно сопровождается уменьшением плотности вещества. Такого рода уменьшение плотности очень мало: например, при плавлении металлов она уменьшается на 2 - 4%. А плотность воды превышает плотность льда сразу на 10%. То есть скачок плотности при плавлении льда аномален не только по знаку, но и по величине.
Вот еще пример аномалии воды: необычное температурное поведение ее сжимаемости, то есть степени уменьшения объема при увеличении давления (обычно сжимаемость жидкости растет с температурой: при очень высоких температурах жидкости более рыхлы (имеют меньшую плотность) и их легче сжать). Вода принимает такое нормальное поведение только при высоких температурах. Минимальная сжимаемость воды - при t = 45°.
Наверное, самая сильная аномалия воды - температурное поведение ее теплоемкости. Величина теплоемкости показывает, сколько нужно затратить тепла, чтобы поднять температуру вещества на один градус. Для подавляющего числа веществ теплоемкость жидкости после плавления кристалла увеличивается незначительно - никак не более 10%. Другое дело - вода. При плавлении льда теплоемкость скачет в два раза! Такого огромного скачка теплоемкости при плавлении не наблюдается ни у одного другого вещества: здесь вода абсолютный рекордсмен. Во льду энергия, подводимая для нагревания, тратится в основном на увеличение тепловой скорости молекул. Скачок теплоемкости после плавления означает, что в воде открываются какие-то новые процессы (и очень энергоемкие), на которые тратится подводимое тепло и которые обусловливают появление избыточной теплоемкости. Такая избыточная теплоемкость и, следовательно, упомянутые энергоемкие процессы существуют во всем диапазоне температур, при которых вода находится в жидком состоянии. Она исчезает только в паре, то есть эта аномалия является свойством именно жидкого состояния воды.
В последнее время много внимания уделяется изучению свойств переохлажденной воды, то есть остающейся в жидком состоянии ниже точки замерзания 0°С. (Переохладить воду можно либо в тонких капиллярах, либо - еще лучше - в виде эмульсии: маленьких капелек в неполярной среде - "масле"). Появляется вопрос - что же происходит с аномалией плотности при переохлаждении воды? С одной стороны, плотность воды сильно уменьшается по мере переохлаждения (то есть первая аномалия усиливается), но, с другой стороны, она приближается к плотности льда при понижении температуры (то есть вторая аномалия ослабевает).
Все аномалии воды непосредственно связаны с перестройкой ее структуры. Структура любого вещества, то есть закономерности взаимного расположения составляющих его частиц, определяется характером взаимодействий между молекулами. И специфика структуры воды обусловлена особыми свойствами взаимодействий между молекулами воды. При сравнении с родственными с жидкостью веществами видно, что вода резко выпадает из плавной зависимости температур плавления и кипения этих жидкостей: если бы общие закономерности выполнялись и для воды, то она замерзала бы при -100°С и кипела бы при -76°С. Здесь наглядно показано, что между молекулами воды действуют какие-то особые силы, которые отсутствуют в родственных ей гидридах. Эти силы принято называть водородными связями.
Водородные связи между молекулами воды возникают в результате специфического распределения в них электронной плотности. На атомах водорода имеется некоторый положительный заряд, а на атоме кислорода - отрицательный (в целом же молекула воды электрически нейтральна). Хорошей моделью воды в этом отношении является правильный тетраэдр, в центре которого находится атом кислорода, в двух вершинах (соответствующих атомам водорода) расположены положительные точечные заряды (равные примерно 20% от заряда электрона), а в двух других - отрицательные заряды, изображающие распределение электронной плотности на атоме кислорода. В такой модели углы между каждой парой линий, соединяющих центр с вершинами, равны 109,5°. Наиболее выгодным расположением других молекул воды вокруг данной является такое, что против положительного заряда одной расположен отрицательный заряд другой и центры атомов О и Н одной и О другой находятся на одной линии О-Н …О (здесь сплошной линией показана химическая связь внутри одной молекулы, а точками - водородная связь между двумя молекулами). Мы видим, что водородная связь имеет электростатическую природу. У родственных воде гидридов атомы практически нейтральны - таково их химическое свойство, и поэтому водородные связи между их молекулами не образуются. Таким образом, особые свойства воды являются следствием специфического электронного устройства ее молекул.
Существует такое мнение, что у воды есть память, и она способна переносить целительные энергии питать тело виртуальной информацией. Долгое время изучением памяти воды занимался японский исследователь – Масару Эмото - выпускник университета в Иокогаме и доктор наук по проблемам альтернативной медицины в двух томах своей книги «Послания воды». Доктор Эмото провел исследования, в ходе которых он замораживал капельку воды, а потом — при температуре -5 градусов — рассматривал образовавшиеся кристаллы под микроскопом и фотографировал их встроенной в микроскоп фотокамерой. Подвергая воду различным воздействиям, он снова ее замораживал, фотографировал и сравнивал изменения.
Наиболее рельефно эти изменения видны после того, как вода «прослушивает» музыку. Самые красивые кристаллы образуются под воздействием классики. Менее эффектные, но тоже гармоничные дает народная музыка. И уж совсем безобразная «грязь» остается от музыки в стиле «тяжелого металла».
Оказалось, что молекулярную структуру воды меняют вибрации человеческой энергии, мыслей слов, идей и звуков.
Необходимо принять во внимание то, что вода после воздействия замораживается в кристаллы льда, но как меняется физическая структура льда! Это заставляет нас подумать и представить, что то же самое происходит и с водой внутри нашего организма!
Приведу пример поведения снежинки при прослушивании «тяжелого металла» и музыки Бетховена:
 Тяжелый металл Музыка Бетховена
Тяжелый металл Музыка Бетховена
Вода в нашей жизни.
Трудно представить нашу жизнь без воды, ведь человек на 80% состоит из воды, а медуза на 90%.Без воды человек может прожить всего несколько дней, поскольку тело не имеет средств для хранения воды, ему требуется постоянное снабжение, чтобы восполнять запасы жидкости, которая теряется в процессе обычной физиологической деятельности, такой как дыхание, выделение пота и мочеиспускание. Без воды так же не сможет прожить ни одно растение, даже кактус, который растёт в пустыне, не может выжить без воды.
Для того чтобы хорошо себя чувствовать, человек должен употреблять только качественную питьевую воду. Учеными давно установлена прямая связь между качеством питьевой воды и продолжительностью жизни. По данным Всемирной организации здравоохранения около 90% болезней человека вызывается употреблением для питьевых нужд некачественной воды. Во-первых, питьевая вода не должна иметь вредных для человека веществ, а во-вторых, должна содержать полезные минералы (селен, цинк, фтор для здоровья зубов), так необходимые для нормальной жизнедеятельности нашего организма.
Но иногда вода может стать источником массовых заболеваний неинфекционной природы. Содержание в воде хлоридов, сульфатов и продуктов разложения органических веществ (аммиак, нитриты и нитраты) рассматривалось лишь как косвенный показатель опасного для здоровья населения загрязнения воды бытовыми стоками. Благодаря применению новых методов исследования были обнаружены районы с недостатком или избытком в воде тех или иных микроэлементов. В этих районах наблюдаются своеобразные изменения флоры и фауны. В связи с недостаточным или избыточным поступлением в организм микроэлементов с водой и с пищей, среди населения отмечаются характерные заболевания. Так, развитие эндемического флюороза вызывается недостаточным содержанием фтора в питьевой воде, причём выявлена прямая связь между концентрацией фтора в воде и частотой и тяжестью поражения зубов. Фтор питьевой воды оказывает также влияние на фосфорно-кальциевый обмен и на процесс кальцификации костей. Для фтора питьевой воды характерен малый диапазон концентраций от токсических до физиологически полезных. В связи с этим установлено, что содержание фтора в питьевой воде не должно превышать 0,7—1,0 мг/л в зависимости от климатических условий. Долгое время существовало представление о содержащихся в воде нитратах как о косвенных показателях бытового загрязнения воды Однако наличие повышенных концентраций нитратов обнаруживается и в природных подземных водах и даже в воде артезианских водоносных.
Помимо обычной питьевой воды в жизни мы можем употреблять и минеральную воду. Целебное действие свежей природной минеральной воды заключается в замене клеточной воды с частично разрушенной структурой на индивидуально структурированную воду, что позволяет увеличить время жизни и эффективность работы абсолютно всех клеток человека, а также в благотворном комплексном воздействии на весь организм в целом, что позволяет организму самостоятельно гасить внутренние очаги патологий. Вода так же активно применяется в промышленности. Невозможно указать другое вещество, которое бы находило столь разнообразное и широкое применение в промышленности, как вода. Вода — химический реагент, участвующий в производстве кислорода, водорода, щелочей, азотной кислоты, спиртов, альдегидов, гашёной извести и многих других важнейших химических продуктов. Вода — необходимый компонент при схватывании и твердении вяжущих материалов — цемента, гипса, извести и т.п. Как технологический компонент для варки, растворения, разбавления, выщелачивания, кристаллизации Вода применяется в многочисленных производственных процессах. В технике она служит энергоносителем, теплоносителем (паровое отопление, водяное охлаждение), рабочим телом в паровых машинах, используется для передачи давления (в частности, в гидравлических передачах и прессах, а также при нефтедобыче) или для передачи мощности. Вода, подаваемая под значительным давлением через сопло, размывает грунт или породу.
Вода — на первый взгляд простейшее химическое соединение двух атомов водорода и одного атома кислорода — является, без всякого преувеличения, основой жизни на Земле. Не случайно ученые в поисках форм жизни на других планетах солнечной системы столько усилий направляют на обнаружение следов воды.Сама по себе вода не имеет питательной ценности, но она является непременной составной частью всего живого. В растениях содержится до 90% воды, в теле же взрослого человека ее 60-65%, но это “усредненно” от общей массы тела. Если же говорить более детально, то кости — это всего 22% воды, однако мозг — это уже 75%, мускулы — тоже 75% воды (в них находится около половины всей воды тела), кровь состоит из воды аж на 92%. Первостепенная роль воды в жизни всех живых существ, и человека в том числе, связана с тем, что она является универсальным растворителем огромного количества химических веществ. Т.е. фактически является той средой, в которой и протекают все процессы жизнедеятельности.Вот лишь небольшой и далеко не полный перечень “обязанностей” воды в нашем организме.Вода:— Регулирует температуру тела.— Увлажняет воздух при дыхании.— Обеспечивает доставку питательных веществ и кислорода ко всем клеткам тела.— Защищает и буферизирует жизненно важные органы.— Помогает преобразовывать пищу в энергию.— Помогает питательным веществам усваиваться органами.— Выводит шлаки и отходы процессов жизнедеятельности.Определенное и постоянное содержание воды — вот необходимое условие существования живого организма. При изменении количества потребляемой воды и ее солевого состава нарушаются процессы пищеварения и усвоения пищи, кроветворения и пр. Без воды невозможна регуляция теплообмена организма с окружающей средой и поддержание температуры тела.Человек чрезвычайно остро ощущает изменение содержания воды в своем организме и может прожить без нее всего несколько суток. При потере воды в количестве менее 2% веса тела (1-1.5л) появляется чувство жажды, при утрате 6-8% наступает полуобмо-рочное состояние, при 10% — галлюцинации, нарушение глотания. Потеря 10-20% воды опасна для жизни. Животные погибают при потере 20-25% воды.В зависимости от интенсивности работы, внешних условий (в т.ч. климата), культурных традиций человек суммарно (вместе с пищей) употребляет от 2 до 4 л воды в сутки. Среднесуточное же потребление составляет около 2 -2.5 л. Именно из этих цифр исходит Всемирная Организация Здравоохранения (ВОЗ) при разработке рекомендаций по качеству воды.
Заключение.
Мы никогда не задумываемся над смыслом и сутью этого слова. Но вода - это сама жизнь, без неё всё погибает. Наша голубая планета Земля на 70 % состоит из воды: океаны и моря, реки и озера, родники и ручьи, болота, ледники, айсберги,вечные снега на горных вершинах и вечная мерзлота. Воды много, но для питья пригоден лишь 1% из всего этого многообразия ( имеется в виду вода в своем естественном, природном состоянии). Человеческий организм на 70-80% состоит из воды, благодаря которой происходят все жизненно важные процессы в организме: она питает, обогащает кислородом, охлаждает тело, помогает освобождаться от токсинов, восстанавливает клетки. Человек очень остро ощущает нарушение водного баланса. Вода способна сохранять «память» о структуре растворенных веществ. Можно сказать, перенимает её свойства. От воды зависят многочисленные химические реакции, и она служит определяющим компонентом во многих биохимических реакциях.Будучи главной жидкостью, в организме вода служит растворителем для минеральных веществ, витаминов, аминокислот, глюкозы и многих других питательных веществ. Вода играет ключевую роль в пищеварении, всасывании, переносе и утилизации питательных веществ. Вода является средой для безопасного выведения токсинов и продуктов жизнедеятельности, она решающим образом влияет на процесс терморегуляции в организме, от процесса образования энергии до смазки суставов и процесса репродукции. Нет ни одной системы в организме, которая не зависела бы от воды. Вода необходима для мышечных сокращений.
Вода – самая важная жидкость в нашей жизни, без неё не было бы ничего живого на нашей Земле. Но несмотря на её распространенность, она также самое загадочное и необычное вещество, все аномалии которой до сих пор не может объяснить не один ученый.
Список литературы
Виктор Шаубергер //Энергия воды – М. 2007г.
Асламазов Л. Г.; Варламов А. А. // Удивительная физика – М. 2005г.
Большая энциклопедия Кирилла и Мифодия.
Журнал GEO за январь 2008г.
refdb.ru