Справочник химика 21. Вода белок
Релаксация взаимодействий вода белок - Справочник химика 21
Желание понять структурные, функциональные и динамические факторы, характеризующие поведение воды на поверхности белка и других поверхностях, а также их взаимосвязи стимулирует интерес исследователей к этой проблеме. Спектроскопия ядерного магнитного резонанса позволяет получить информацию как о структуре, так и о динамике процессов взаимодействия. В настоящей работе внимание сосредоточено на динамических аспектах взаимодействия воды с белком. Особенно подробно обсуждено явление перекрестной релаксации между протонами воды и белка и приведены новые доказательства существования этого процесса. Непонимание значения перекрестной релаксации приводит к неправильным заключениям относительно динамики воды на белковых поверхностях. [c.149] Временная зависимость намагничиваемости для системы протонов в гидратированном белке может быть эвристически описана двумя сопряженными уравнениями, содержащими три скорости релаксации —скорость спин-решеточной релаксации для воды в отсутствие взаимодействия протонов белка Я р — скорость спин-решеточной релаксации протонов белка в отсутствие релаксации, обусловленной присутствием протонов воды, и — скорость переноса намагничиваемости между двумя спиновыми системами. Тогда уравнения приобретают следующий вид [c.153]По нашему мнению, продолжительность жизни молекулы воды в гидратационном слое по порядку величины составляет 10 с, т. е. примерно в 100 раз больше, чем время, требуемое для молекулы воды, чтобы разорвать и снова образовать несколько водородных связей, которые ограничивают ее движение в чистом растворителе. Тем не менее это время достаточно мало, чтобы его можно было рассматривать как характеристическое время для движения молекул жидкости. Разъяснение данной точки зрения и другие аспекты динамики взаимодействий вода — белок и белок — вода — белок в растворах белков и являются предметом настоящей статьи. Ниже представлены данные и выводы, следующие из результатов использования очень эффективного экспериментального метода, который, не будучи уже новым, применяется только в нашей и еще очень немногих лабораториях. Авторы измерили зависимость скорости магнитной спин-решеточной релаксации ядер растворителя (воды) в растворах белка от величины магнитного поля. Этому методу дали сокращенное название ЯМР-д (дисперсия ядерной магнитной релаксации). Опыты по ЯМР-д показали, что на быстрое вращательное броуновское движение молекул растворителя (воды) накладывается в результате функционирования механизма взаимодействия (еще не вполне понятого) очень небольшая по величине компонента, которая имитирует намного более медленное вращательное движение молекул белка [6, 7]. Кроме того, в экспериментах по ЯМР-д измеряются усредненные свойства всех молекул растворителя, так что время жизни молекул воды в гидратационном слое выступает в качестве естественного параметра во многих моделях, которые объясняют эти данные. Можно добавить, что данные по ЯМР-д прямо указывают на довольно быстрое ориентационное броуновское движение. Поэтому появляется возможность изучения микроскопической вязкости растворителя вблизи белковой молекулы в широком диапазоне значений pH, в присутствии различных буферов и т. д., что не всегда удается сделать с помощью других методов. [c.162]
Присутствие в воде растворенного белка накладывает на быстрое броуновское движение растворителя-воды небольшую по величине, но измеримую компоненту, которая характеризует более медленное броуновское движение молекул белка. Это явление известно около 10 лет, и сначала его наблюдали как увеличение скорости магнитной релаксации протонов растворителя. С тех пор оно было изучено более глубоко путем исследования зависимости релаксации протонов и дейтронов растворителя от величины магнитного поля. Полученные данные несут необычайно богатую информацию о взаимодействиях вода— белок и белок—белок как в растворах, так и в суспензиях клеток. Однако природа лежащих в их основе взаимодействий растворитель—растворенное вещество остается весьма неясной. Для проверки концепции связанной воды, по которой ведется дискуссия, были проведены измерения на растворах белков в смешанном растворителе h3O/D2O. Данные этих измерений неожиданно указывают на взаимодействия между протонами белка и растворителя по механизму перекрестной релаксации. Эти последние результаты дают основание предположить, что интерпретация увеличивающейся информации о релаксационных измерениях образцов тканей нуждается в перепроверке, а возможно, и в новой интерпретации. [c.182]
Д. Конденсация воды над наиболее слабо взаимодействующими участками поверхности (неполярными областями) приводит к образованию многослойного покрытия при степени гидратации 0,4 г воды/г белка. На поверхности белка вода должна располагаться особым локальным образом для достижения высокого значения степени покрытия в расчете на одну молекулу адсорбированной воды. Конденсация является главным этапом процесса гидратации. Это видно из результатов измерения теплоемкости, т. е. статических измерений, и является тем пунктом, с которого начинается изменение динамических свойств (диэлектрической релаксации, времени корреляции для спиновой метки, ферментативной активности). Подвижность системы белок — вода резко увеличивается после завершения формирования монослоя. [c.134]
В настоящем исследовании предложен критический тест для оценки относительной важности перекрестной релаксации, в которую вовлечены протоны как воды, так и белка в системах гидратированных белков. Кроме того, с успехом продемонстрировано, что температурная зависимость релаксации как в воде, так и в белке определяется в основном движениями в водной фазе, а не движениями в твердой фазе типа вращений метильных групп. Хотя авторы не пытались дать детального ана- лиза, очевидно, что картина поведения воды на границе раздела с белком, согласующаяся с данными по ЯМР-релаксации, характеризуется быстрым и в некоторой степени анизотропным движением. Структурные модели взаимодействия белков с водой должны находиться в согласии с предположением, что вода сохраняет свойства жидкости на границе раздела фаз. Однако не менее важно отметить, что временная шкала, соответствующая описанным выше экспериментам, все же достаточно длинна по сравнению с временами корреляции вращения или временами диффузии, которые обычно характерны для воды в истинно жидком состоянии. [c.158]
ЯМР-д на ядрах и 0. Исходя из самого общего рассмотрения механизмов магнитной релаксации [14], можно сделать вывод, что наблюдаемая релаксация протонов растворителя должна возникать в основном в результате магнитных биполярных взаимодействий данного протона либо с соседним протоном той же молекулы воды, либо с протонами гидратированного растворенного белка, либо вследствие проявления обоих эффектов. В первом случае каждая молекула воды (в среднем) ощущает вращательное движение белковых молекул в результате дальнодействующего процесса гидродинамического характера или в результате того, что часть времени она находится в состоянии какого-то связывания с растворенным белком и подвергается реориентации вместе с ним. Если имеет место только внутримолекулярное взаимодействие и результаты исследования ЯМР-д целиком обусловлены влиянием усредненной по времени кинетической предыстории молекул растворителя, то должны быть справедливы два следующих утверждения а) спектры Н-ЯМР-д в дейтерированном растворителе (которые легко получить) и спектры Ю (которые снять очень трудно) имитируют, если их нормализовать по отношению к скорости релаксации чистого растворителя, данные по ЯМР-д протонов б) величина вкладов Ли/) для протонов [уравнение [c.167]
Выше представлено описание группы явлений, наблюдаемых при проведении экспериментов по ЯМР-д с растворами диамагнитных белков. Следует подчеркнуть, что полученные результаты отражают влияние растворенного белка и суспендированных клеток на усредненную динамическую предысторию молекул растворителя. Авторы формулируют на основании этих данных точку зрения на гидратацию и взаимодействия растворитель— белок и белок — белок, которые имеют гидродинамическую природу в масштабах, сравнимых с размером белковой молекулы, и кинетическую природу на уровне атомных размеров. Гидратация, в той степени, в которой она отождествляется с особым слоем воды на поверхности белка, относится к молекулам воды с определенной геометрией. Предполагается, что эта геометрия согласована с возможностями образования водородных связей с аминокислотными остатками, выходящими на поверхность макромолекулы, но эти молекулы воды могут быстро обмениваться с объемной водой. Любое замедление движения молекул растворителя обусловлено пространственными затруднениями, возникающими при их диффузии вблизи поверхности молекулы белка, особенно вблизи полярных групп. Шкала времени имеет порядок 10 с. Хотя это время соответствует в 100 раз более медленному движению, чем движение молекул растворителя, оно все же достаточно мало по сравнению с соответствующими временами релаксации во много раз больших по своим размерам молекул белка. Авторы не обнаружили никаких признаков существования особых связывающих центров со значениями времен обмена больше 10 9 с. [c.181]
Как и при интерпретации влияния солей на водные растворы, основное внимание следует обращать на изменение свободной энергии системы при добавлении неполярных веществ к водным растворам интерпретация этого явления непосредственно с точки зрения структурной модели может оказаться ошибочной. Так, структурная модель дает приемлемое объяснение солюбилизации гидрофобных соединений под действием спиртов алкилзамещенных аминов и мочевин. Если одно растворенное вещество увеличивает структурированность раствора, можно было бы ожидать, что оно должно облегчать введение молекул другого подобного вещества. С другой стороны, структурирующая способность вещества совершенно необязательна для того, чтобы оно было в состоянии солюбилизировать гидрофобные соединения в воде. Уже отмечалось, что один из возможных механизмов денатурации белков и нуклеиновых кислот под действием мочевины заключается в стабилизации гидрофобных боковых цепей аминокислот и оснований нуклеиновых кислот при увеличении их контакта с растворителем, что проявляется в увеличении растворимости и уменьшении коэффициента активности этих групп в присутствии мочевины [31, 32, 35]. Спирты, ацетон и подобные им вещества разрушают гидрофобные связи и способствуют денатурации аналогичным образом. Однако мочевина, вероятно, не обладает структурирующим действием, по крайней мере в том смысле, как это понимается для неполярных молекул мочевина очень слабо влияет на большинство свойств воды и либо практически не изменяет структуру воды, либо, из данных по поглощению ультразвука, несколько ее разрушает [85]. Данные по энтальпии и теплоемкости растворов веществ с гидрофобными группами, а также исследования спектра ультразвуковой релаксации полиэтиленгликоля в воде и растворах мочевины указывают на то, что энергетически более благоприятное взаимодействие гидрофобных групп с мочевиной, чем с водой, связано с уменьшением структурированности воды вокруг гидрофобных групп [85, 86]. Таким образом, разрушение гидрофобных связей под действием мочевины или спирта нельзя объяснить одним и тем же механизмом с точки зрения структуры растворителя, хотя по свободной энергии эффекты соединений этих двух типов одинаковы. Возможно, что мочевина создает более благоприятное окружение для гидрофобных групп, находящихся в пустотах струк- [c.328]
Метод спиновых меток оказался весьма эффективным для изучения структуры биологических мембран и конформационных явлений в мембранах [263, 264]. Весьма перспективно изучение ядерной релаксации в биополимерах, содержащих парамагнитную метку. Время релаксации зависит от взаимодействия спинов ядра и электрона и, следовательно, от расстояния между ними (Т пропорционально г ). Тем самым, можно получить информацию о геометрии молекулы и о ее движениях [265]. В работах [266] изучались спектры ЭПР и ЯМР алкогольдегидроге-назы, меченной аналогом никотинамидадениндинуклеотида. Оказалось, что метка конкурирует с НАД-Н в месте связывания ферментом, сильно иммобилизуется белком, резко изменяет время релаксации протонов воды, причем величина Т сильно зависит от концентрации спирта. Установлено место связывания спирта этим ферментом и оценены кинетические и геометрические характеристики системы. [c.346]
Представления о механизме возникновения гидрофобных взаимодействий, развиваемые Шерагой, подтверждаются при наблюдении ряда свойств водных растворов глобулярных белков и ПАВ. Исследование указанных систем представляется чрезвычайно плодотворным для получения экспериментальных доказательств основных предпосылок теории гидрофобного взаимодействия. Безусловно, необходимы и прямые исследования структурирования воды вблизи углеводородных молекул. Некоторые попытки таких исследований были выполнены Песиком и Клиффордом [71] цтГ с помощью ЯМР-спектроскопии, однако пока не получено ясных результатов. Тем не менее Герцем и Цайдлером [72] показано, что время релаксации молекул воды вблизи углеводородных лю-лекул в 2 раза больше, чем у чистой воды. Создание количественной теории жид] ой воды и, следовательно, детального механизма гидрофобных взаимодействий возможно только при комплексном рассйтотренин данных, получаемых при исследованиях водных растворов как методом ЯМР, так и в результате разнообразных физико-химических исследований систем, свойства которых он-реде.ляются гидрофобными взаимодействиями. [c.17]
В некоторых случаях ионы металла можно ввести в систему, которая первоначально не содержит таких катионов. Таким примером может служить гликогенфосфорилаза Ь, катализирующая превращение полисахарида гликогена в фосфорилированные моно-сахаридные единицы глюкозо-1-фосфата (Г-1-Ф). Путем измерения скорости протонной релаксации в присутствии Мп + и фермента было показано [П], что этот катион специфически связывается по определенным центрам фермента. Важная особенность этого фермента состоит в том, что он неактивен в отсутствие другого лиганда — аденозинмоно( сфата (АМФ), который усиливает связывание субстратов и повышает максимальную скорость действия фермента. Инозинмонофосфат (ИМФ) активирует фермент только путем повышения максимальной скорости, но не сродства к субстратам, и это различие в механизмах активации отражается на результатах измерения ускорения протонной релаксации в присутствии парамагнитных ионов. Введение АМФ в систему, содержащую Мп + и фосфорилазу, изменяет скорость релаксации протонов воды, тогда как добавление ИМФ не дает заметного эффекта. Отсюда делают вывод о конформационном переходе в белке, индуцированном связыванием АМФ, который сопровождается изменением т,-для взаимодействия Мп +—НгО. Аналогичные измерения в присутствии Г-1-Ф позволили предположить наличие ряда конформационных состояний фермента, исходя из данных по скорости релаксации протонов воды [И]. [c.387]
В настоящее время опыт опережает теорию. Предложенные модельные механизмы авторы смогли изложить на количественном уровне лишь в одном случае, а именно для зависимости реориентационного времени релаксации белка от концентрации последнего. Тем не менее в этой работе удалось прояснить различие между макроскопической и микроскопической вязкостью, измерить взаимодействия белок — белок внутри клеток и продемонстрировать перенос намагничиваемости от протонов белка к протонам растворителя. Все это согласуется с динамикой взаимодействий вода — белок, которая и явилась предметом обсуждения. [c.181]
Шульман н сотр. [ИЗ—115] исследовали активный центр карбоксипептидазы А путем измерения релаксации малых молекул, связанных с этим ферментом. Карбоксипептидаза является протео-литическим металлсодержащим ферментом, который катализирует расщепление С-концевой пептидной связи в пептидах и белках. Она имеет молекулярную массу 34600 и содержит 1 атом цинка на молекулу, который обусловливает каталитическую активность, но фермент остается активным при замене 20 + на ионы Мп + или Со2+ [116]. Кристаллическая структура фермента известна [117, 118]. С атомом металла координированы три белковых лиганда, и имеются свободные положения по меньшей мере еще для двух лигандов. Связывание растворителя (НгО) [ИЗ], ингибиторов [114] или фторид-иона [115] на активном центре Мп2+-фермента влияет на релаксацию связанных ядер не только потому, что белок имеет длинное время корреляции, но также вследствие наличия парамагнитного иона металла. Уширение резонансных сигналов растворителя было объяснено тем, что одна молекула воды связывается с ионом Мп2+. Как следует из измерения уширения пиков метильных или метиленовых протонов конкурирующих ингибиторов — индо-лилуксусной, г/7ег-бутилуксусной, бромуксусной и метоюсиуксус-ной кислот — и одновременного определения времен корреляции взаимодействия протонов ингибитора с металлом, релаксация определяется главным образом временем обмена комплекса белок — ингибитор. Используя известные константы Михаэлиса — Ментен и эти данные, можно определить константы скорости всех отдельных стадий реакции фермента с субстратом. [c.393]
Вода играет важную роль в живых системах и в значительной степени определяет структуру и функции биологических полимеров, таких, как белки. Однако в этом сообщении мы сконцентрируем внимание в первую очередь не на том, как влияет вода на биополимеры, а на влиянии биополимеров на воду, которая с ними взаимодействует. Представляют интерес изменения структурных, энергетических и динамических свойств молекул воды. В результате изучения вращательной подвижности молекул воды на поверхности белков молекулы растворителя были поделены на три группы [1]. Первая группа включает быстро реориентируемые молекулы с временем вращательной релаксации (тг) не более 10 " с. В следующую группу входят частицы, имеющие время вращательной релаксации пример,но 10 с они предположительно идентифицируются как молекулы воды, связанные сильной связью с ионными остатками. Третья группа имеет Тг порядка 10- с эти молекулы растворителя считаются связанными с макромолекулами связями, запрещающими вращение примером могут служить четыре молекулы воды, распо- [c.31]
Температурная зависимость спин-решеточной релаксации протонов белка в образце, содержащем 0,07 г ОгО/г лизоцима, приведена на рис. 8.3. Возможно, здесь имеет место небольшое диполь-дипольное взаимодействие, обусловленное наличием дейтерия, и некоторое изменение структуры белка, вызванное заменой воды на дейтерий. Однако эти данные, по-видимому, надо рассматривать как удовлетворительную оценку величины Ню для гидратированного лизоцима. В ранее опубликованной работе [23], посвященной исследованию сухого лизоцима, получены сходные кривые, имеющие мцнимум вблизи 180 К. На рис. 8.3 показана также зависимость величины Тх для протонов белка в гидратированном лизоциме (0,17 г НгО/г лизоцима). Как видно из этих данных, присутствие воды на белке приводит к существенному увеличению скорости релаксации. Следовательно, в гидратированном белке релаксация в основной массе протекает через водную фазу, а не через быстро вращающиеся метильные группы, по которым проходит в основном релаксация в системе сухого белка [23]. Не было сделано никакой попытки обнаружить релаксацию, описываемую с помощью двух экспонент измерялась только медленная компонента релаксационной кривой. [c.156]
chem21.info
Значение белков для организма

Белки играют в питании человека чрезвычайно важную роль, так как они являются главной составной частью клеток всех органов и тканей организма. С белками тесно связаны все жизненные процессы: обмен веществ, сократимость, раздражимость, способность к росту, размножению и даже к высшей форме движения материи — мышлению. Связывая значительные количества воды, белки образуют плотные коллоидные структуры, характерные для нашего тела. По определению Ф. Энгельса, «жизнь — это способ существования белковых тел, существенным моментом которого является постоянный обмен с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка».
Назначение белков
Основное назначение белков пищи — это построение новых клеток и тканей, обеспечивающих развитие молодых растущих организмов. В зрелом возрасте, когда процессы роста уже полностью завершены, остается потребность в регенерации изношенных, отживших клеток. Для этой цели требуется белок, причем пропорционально изнашиваемости тканей. Установлено, что чем выше мышечная нагрузка, тем больше потребности в регенерации и соответственно в белке.
Поступление белка необходимо и для поддержания постоянства специфических белков организма, представляющих собой особую ценность. Эти белки выполняют в организме тонкие и сложные функции, входят в состав гормонов, ферментов, антител и других образований, участвующих в важнейших биохимических процессах жизнедеятельности. Количество и состав специфических белков в организме поддерживаются на постоянном уровне за счет использования пищи.
Белки — сложные азотсодержащие биополимеры, мономерами которых служат α-аминокислоты. Молекулярная масса белков варьирует от 6000 до 1 000 000 и более.
Аминокислотный состав разных белков различен.
Он является критерием биологической ценности белка. По своей структуре аминокислоты представляют собой органические соединения, содержащие две функциональные группы: карбоксильную (—СООН—), определяющую кислотные свойства молекул, и аминогруппу (—NH²—), придающую им основные свойства.
Среди огромного количества природных аминокислот в составе белков пищевых продуктов их содержится 20: лизин, треонин, глицин (гликокол), аланин, серин, метионин, цистин, валин, лейцин, изолейцин, глутаминовая кислота, глутамин, аспарагиновая кислота, аспарагин, аргинин, фенилаланин, тирозин, гистидин, триптофан, пролин.
Белки пищевых продуктов делятся на простые (протеины) и сложные (протеиды).
Простые белки состоят только из полипептидных цепей, сложные содержат, помимо белковой молекулы, небелковую часть (простетическую группу). В зависимости от пространственной структуры белки делятся на глобулярные (молекулы которых имеют сферическую, эллипсоидную или близкую к ним форму) и фибриллярные (состоящие из вытянутых нитевидных молекул).
К числу простых глобулярных белков относятся альбумины, глобулины, проламины и глютелины. Альбумины и глобулины составляют основную часть белков молока, яичного белка, белков сыворотки крови. Проламины и глютелины относятся к растительным белкам семян злаков, образуя основную массу клейковины.
Растительные белки характеризуются низким содержанием лизина, лейцина, треонина, метионина и триптофана и высоким содержанием глутаминовой кислоты. Структурные белки (протеноиды) относятся к фибриллярным белкам животного происхождения, которые выполняют в организме опорную функцию. Они не растворимы в воде и устойчивы к перевариванию пищеварительными ферментами. К ним относятся кератины, эластин, коллаген.
При длительном кипячении в воде коллаген превращается в водорастворимый желатин (глютин), используемый в технологии приготовления ряда мясных, рыбных и других блюд. Коллаген и эластин содержат мало серосодержащих аминокислот, кератин богат цистином.
В отличие от других белков пищевых продуктов коллаген содержит значительное количество оксипролина и оксилизина. Вместе с тем в коллагене отсутствует триптофан. Среди сложных белков различают нуклеопротеиды, липопротеиды, гликопротеиды, хромопротеиды, металлопротеиды, фосфо- протеиды.
Белки в организме человека выполняют несколько важных функций — пластическую, каталитическую, гормональную, функцию специфичности и транспортную.
Важнейшей функцией пищевых белков является обеспечение организма пластическим материалом. Белки являются основным строительным материалом клетки, ее органоидов и межклеточного вещества, образуют наряду с фосфолипидами остов всех биологических мембран клеток, являются основным компонентом всех, без исключения, ферментов и значительной части гормонов.
Белки участвуют в транспорте кровью кислорода липидов, углеводов, некоторых витаминов, гормонов и других веществ.
Специфические белки-переносчики осуществляют транспорт различных минеральных солей и витаминов через мембраны клеток и субклеточных структур. Белки обеспечивают индивидуальную и видовую специфичность, лежащую в основе проявлений иммунитета и аллергии. Организм человека практически лишен резервов белка. Единственным источником их являются белки пищи, вследствие чего они относятся к незаменимым компонентам рациона.
Количества азота, поступающего в организм с пищей, обычно равно количеству, выводимому из организма (с мочой, калом, потом, слущивающимся эпидермисом, волосами, ногтями), т. е. поддерживается состояние азотного равновесия.
Позитивный азотный баланс имеет место у детей в связи с процессом роста, а также у выздоравливающих после тяжелых заболеваний. Негативным азотный баланс возникает при преобладании процессов катаболизма белка над процессами синтеза (полное или частичное голодание, потребление низкобелковых рационов, анорексия, рвота), а также при нарушении абсорбции белков в пищеварительной системе или их усиленном распаде вследствие заболеваний (туберкулез, опухоли, ожоговая болезнь и др.).
Белки, окисляясь, вносят определенный вклад в снабжение организма энергией. При сгорании 1 г белка в организме выделяется 16,7 кДж (4 ккал) энергии. При голодании использование белков организма в качестве источника энергии значительно усиливается.
Белки, поступившие с пищевыми продуктами в желудочно-кишечный тракт, перед тем как усвоиться организмом, должны предварительно расщепиться до аминокислот в пищеварительном канале. Аминокислоты затем всасываются слизистой оболочкой кишечника и через систему воротной вены поступают вначале в печень, а затем во все другие органы т ткани и используются для синтеза белков организма человека.
Из 20 аминокислот пищи 8 (треонин, лизин, лейцин, изолейцин, валин, фенилаланин, триптофан, метионин) не синтезируются в организме и поэтому относятся к числу незаменимых. Для детей в возрасте до года незаменимой аминокислотой является также гистидин.
Дефицит любой из незаменимых аминокислот в пищевом рационе, а также нарушение сбалансированности аминокислотного состава приводят к нарушению синтеза белка и тем самым способствуют возникновению ряда патологических состояний. Дефицит белков в пище приводит к развитию белковой недостаточности.
Легкие формы белковой недостаточности могут возникать вследствие нарушений принципов сбалансированного питания, а также при заболеваниях, сопровождающихся нарушением переваривания и всасывания белков и аминокислот в пищеварительном канале, усилением процессов катаболизма собственных белков организма и другими нарушениями метаболизма белков и аминокислот (хронические колиты и энтероколиты, ожоговая болезнь, обширные хирургические вмешательства и травмы, злокачественные новообразования и др.).
Избыточное потребление белков вызывает усиление работы пищеварительной системы, активацию процессов обмена аминокислот и синтеза мочевины, увеличивает нагрузку и на выделительную систему, может приводить к образованию в пищеварительном канале продуктов их гниения и неполного расщепления, способных вызывать интоксикацию.
По материалам: belkablog.com
Опрос:
 Загрузка ...
Загрузка ... Поделиться "Значение белков для организма"
Значение белков для организма
4.7 (66.67%) проголосовало 3belkablog.com
Белка определение в воде - Справочник химика 21
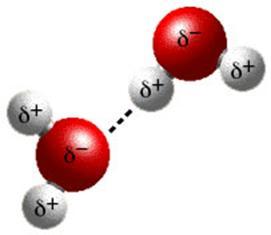
Растворение белков в воде связано с гидратацией каждой молекулы, что приводит к образованию вокруг белковой глобулы водных (гидратных) оболочек, состоящих из ориентированных в определенной форме в пространстве молекул воды. По химическим и физическим свойствам вода, входящая в состав гидратной оболочки, отличается от чистого растворителя. В частности, температура замерзания ее составляет —40°С. В этой воде хуже растворяются сахара, соли и другие вещества. Растворы белков отличаются крайней неустойчивостью, и под действием разнообразных факторов, нарушающих гидратацию, белки легко выпадают в осадок. Поэтому при добавлении к раствору белка любых водоотнимающих средств (спирт, ацетон, концентрированные растворы нейтральных солей щелочных металлов), а также под влиянием физических факторов (нагревание, облучение и др.) наблюдаются дегидратация молекул белка и их выпадение в осадок. [c.26] Так, если взять раствор белка в воде и коагулировать его определенным образам, получается начальная степень мутности прибавив затем в другую порцию раствора протеина фермент (например пепсин) и произведя по истечении некоторого времени и в атом растворе коагуляцию, сравнивают его при помощи особого прибора — нефелометра с первой коагулированной пробой. Ведя аналогично наблюдения над последующими пробами, подвергшимися различному по времени воздействию фермента, можно по изменении мутности проследить ход гидролитического расщепления протеина. [c.19]В работе Эллиса и Бата [67 ] обсуждаются различные аспекты влияния содержания воды на спектры поглощения желатины а) интенсивность полосы поглощения, соответствующей первому обертону валентного колебания группы N—Н при 1,50 мкм, при добавлении воды существенно снижается, так же как и для составных полос поглощения, соответствующих деформационно-валентным колебаниям групп N—Н при 2,05 и 2,18 мкм б) положение и форма полосы поглощения воды при 1,96 мкм практически не изменяются в) полоса поглощения при 1,79 мкм становится более интенсивной и резкой, чем для чистой воды, что указывает на наличие препятствий свободному вращению молекул воды в окружении, более гомогенном, чем в жидкой воде г) максимум полосы поглощения воды при 1,44 мкм сдвигается в сторону более длинных волн, что указывает на наличие связанных молекул воды д) появляется новая полоса поглощения при 1,35 мкм, поглощение в области 2,4 мкм становится более интенсивным, чем в жидкой воде. Эти наблюдения могут оказаться полезными при разработке новых методов с применением измерений поглощения в ближней ИК-области для определения воды в желатине и других материалах, содержащих белки. [c.443]
Растворение белка в воде связано с гидратацией каждой его молекулы, т. е. с образованием вокруг частиц белка особого рода водных оболочек, состоящих из молекул воды, которые определенным образом ориентированы. Молекулы воды, входящие в состав слоя, прилегающего к полярным группам белковых молекул, обладают иными свойствами, чем вся остальная масса воды. [c.275]
Пояснения. Динамические свойства обнаруживают изменения при уровнях гидратации выше 0,4 г воды/г белка, что соответствует моменту завершения изменений статических свойств. Вследствие того что последние отражают формирование монослоя воды вокруг молекулы белка, дополнительная вода, обнаруживаемая при измерении динамических свойств, представляет собой воду многослойного покрытия. Кроме того, гидратация в значительной степени влияет на некоторые кинетические свойства. Следует ожидать более сложной зависимости от степени гидратации для динамических свойств, чем для статических. Все статические свойства (по крайней мере термодинамические) имеют простую молекулярную основу. Разнообразные переходные состояния, управляющие кинетикой, напротив, должны непременно отличаться друг от друга. В самом деле, замечательно, что согласие между данными динамических и статических измерений оказывается таким хорошим при определении последовательности стадий во время протекания процесса гидратации. Как отмечено выше, каждый из методов— ЯМР-спектроскопия, измерения диэлектрической релаксации, ЭПР-спектроскония и измерения ферментативной активности — определяет одну или более стадий процесса гидратации, что проявляется при измерении статических свойств. [c.130]
Если результаты гидродинамических измерений интерпретировать упрощенно, то можно прийти к выводу, что гидратационные слои дают вклад в инерционность молекулы белка (в растворе), а время жизни молекулы воды в этих слоях должно быть велико ло сравнению с характеристическим временем движения белковых молекул. Например, если ориентационные времена релаксации больших белковых молекул, согласно, скажем, измерениям частотной зависимости диэлектрической проницаемости или вычислениям из закона Стокса, составляют Ю" с, то можно ожидать, что продолжительность их жизни будет значительно больше. Однако такая точка зрения неправильна. Чтобы объяснить данные гидродинамических измерений, достаточно предположить, что при гидратации белка молекула воды находится в определенном положении. Если это условие удовлетворяется (а для этого молекула воды должна резко изменить свой угловой момент инерции, как если бы она внедрялась в массу растворителя или же покидала его), то продолжительность жизни молекулы воды может быть меньше, чем время, которое характеризует движение белка и еще дает вклад в инерционность белковых молекул. На то, что это требование удовлетворяется, указывают рентгенографические данные, согласно которым многие молекулы воды в гидратационном слое находятся в определенных положениях. [c.161]
Белковые вещества обладают способностью связывать значительные количества воды — гидратироваться. Важность гидратации белков видна из того, что вода представляет собой универсальную среду биологических реакций. Гидратация состоит в связывании дипольных молекул воды с ионами или ионными группами, а также с диполями или полярными группами она происходит и в растворах, и в твердых веществах. Значительную гидратацию белков обусловливает наличие на поверхности их молекул большого количества разнообразных полярных, в том числе ионогенных, групп. Количество гидратационной воды, связанной с альбуминами и глобулинами, составляет 0,2—0,6 г на 1 г сухого веса белка. Объем гидратированных молекул всегда меньше суммы объемов ее компонентов. Это значит, что гидратация всегда сопровождается уплотнением, уменьшением общего объема. Интересно, что растворимость белков в воде далеко не всегда параллельна их способности гидратироваться. Некоторая взаимосвязь здесь имеется, однако наличие большого количества положительно и отрицательно заряженных радикалов может приводить и к противоположному эффекту группы с разными зарядами могут образовывать солеобразные связи внутри молекулы белка и с соседними белковыми молекулами. В определенных условиях белки могут образовывать студни (гели), в которых иммобилизированы значительные количества воды. [c.30]
Расчеты сольватации полимеров по числу полярных групп в молекуле, с учетом данных табл. 15, хорошо сходятся с прямыми весовыми определениями сольватации (в граммах растворителя на 1 а полимера), которые для ряда белков в воде составляют 0,25—0,35 г г, для нитроцеллюлозы в ацетоне 0,47 г/з, для крахмала— 0,35 г а и др. [c.156]
Поскольку при определении парциального удельного объема допускается, что объем смеси белка с водой равен сумме объемов каждого компонента, то гидратация белка в расчет здесь не принимается. Поэтому оценить степень гидратации по величине V2 не представляется возможным. Тем не менее эта вели- [c.177]
Белка определение в воде. Содержание белка в растворах является важной их характеристикой при различных биологических исследованиях. В анализируемые растворы вводят избыток ионов серебра и затем при помощи сульфидсеребряного электрода 94-16 и электрода сравнения 90-02 определяют концентрацию не прореагировавшего с белком серебра. [c.25]
В литературе описаны отдельные детали анализа различных материалов для определения аммиака, например сталей [30], белков [38], вод [39—43], порошка металлического вольфрама [44], титановой губки [45], металлического бериллия [46], атмосферных осадков [47], воздуха [43], бензгидроксамовой кислоты и ее производных [48], а также для определения гидроксиламина реактивом Несслера [49]. [c.21]
Хотя оборудование, требующееся для осмометрии, весьма несложно (фиг. 4), точные определения очень затруднительны. Чтобы избежать бактериального разложения белка, определения следует проводить при низких температурах и в течение коротких промежутков времени. Для ускорения достижения равновесия часто применяют в качестве манометра капиллярную трубку. При этом капиллярных явлений [11] можно избежать, заменяя воду в капилляре толуолом. С целью уменьшить эффект Доннана и исключить ошибки, вызванные следами солей, присутствующих в белковых растворах, в качестве растворителя используют концентрированный солевой раствор в него же погружают и мембрану осмометра. Измерение мембранных потенциалов позволяет рассчитать ту часть давления р, которая обусловлена различиями в активности ионов. [c.51]
При локализации метки в наружном водном слое значение Тс составляет 10 -е- 10 ° с (рис. Х.12). Поверхностные слои, в которые входят боковые группы белков и вода в щелях , характеризуются Тс 10 ° -е- 10 с. В более глубоком слое глобулы, где включены внешние полипептидные цепи, стиснутые боковые группы и прочносвязанная вода, Тс повышается до 10 -10 с. Это ясно свидетельствует о замедлении скорости вращения метки по мере ее погружения, что соответствует существованию более плотного ядра глобулы по сравнению с рыхлой опушкой (см. 2 гл. УП). В целом времена корреляции, поддающиеся определению методом спиновых меток, находятся в диапазоне 0,1-300 не, хотя в последние годы интенсивно развиваются методы, позволяющие определять Тс спиновых меток до 10 -10 " с. [c.278]
В пробирки помещают по 0,2 мл исследуемого раствора, содержащего белок, доводят бидистиллированной водой до 1 мл, добавляют 4 мл биуретового реактива и перемешивают. В контрольную пробирку вместо белка наливают воду. Через 30 мин измеряют оптическую плотность проб (развивается сине-фиолетовое окрашивание за счет пептидных связей) при длинах волн 540—650 нм против контроля (для более точного определения зарегистрировать спектр поглощения проб и выявить против контрольного раствора). [c.235]
Растворимость белков в воде варьирует в широких пределах. Определенной зависимости между гидратацией и растворимостью белков не наблюдается. Например, сухой коллаген способен связать гораздо больше воды, чем сухой сывороточный альбумин. Однако коллаген нерастворим в воде, а альбумин растворяется в ней легко. На возможность гидратации белков за счет пептидных связей указывает тот факт, что искусственный полипептид нейлон, не содержащий боковых ионогенных цепей и гидрофильных групп, способен связывать воду. [c.186]
Часть 3. Определение полочного белка, углеводов и содержания воды [c.265]
Учащиеся, работающие за одним лабораторным столом, разделяются на две группы. Первая группа займется определением процента белка в молоке, вторая изучит (одержание углеводов и воды. [c.265]
Успехи в изучении етруктуры белков, н в частности лизоцима, в кристаллическом состоянии методами рентгеноструктурного анализа неизбежно повлекли за собой вопрос о том, насколько третичная структура фермента, и в особенности его активно1 о це1гтра, в кристалле близка к таковой в растворе. С одной стороны, можно было бы ожидать близкое сходство, если не идентичность, между структурами фермента в данных двух физических состояниях, поскольку по меньшей мере одна треть объема для большинства кристаллических белков занята водой [35], причем по данным ЯМР эта вода имеет жидкую структуру [36]. С другой стороны, определенные ограничения в подвижности фермента в кристалле, а также взаимные стерические влияния молекулы в кристаллической решетке (возможно, различные для разных полиморфных модификаций кристаллического фермента) могут, вообще говоря, сказываться на топографии активного центра, доступности его по отношению к молекулам субстрата и эффекторов и в целом на механизме ферментативного катализа. [c.155]
ОН и др.) связывают такое же количество воды, как и в молекулах жирной кислоты или спирта. Расчеты сольватации полимеров по числу полярных групп в 1 юлекуле, с учетом данных табл. 15, хорошо сходятся с прямыми весовыми определениями сольватации (в граммах растворителя на 1 г полимера), которые для ряда белков в воде составляют 0,25—0,35 г/г, для нитроцеллюлозы в ацетоне 0,47 г/г, для крахмала—0,35 г/г, и др. Этот результат показывает, что при сольватации молекулы растворителя располагаются в виде одного слоя лишь вокруг полярных групп полимера, приблизительно пропорционально их содержанию в цепи. Неполярные участки, лежащие между полярны1 ш группами в полимерах, и составляющие, например, в белках или нитроцеллюлозе около половины веса полимера, остаются свободными от растворителя, т. е. топография гидратного слоя выражается рядом островков на молекуле полимера. На каждом из этих центров сольватации связанные 1 юлекулы растворителя обладают определенной продолжительностью жизни и статистическое равновесие связывания и освобождения молекул растворителя на сотнях центров, существующих в 1 юлекуле полимера, аналогично электрохимическому равновесию при ионизации поливалентных электролитов (стр. 105) или динамическому равновесию адсорбции-десорбции, выражаемому изотермой Лангмюра (стр. 93), хотя лишь в последнем случае процесс происходит на физической поверхности раздела. Этим объясняется, почему сольватационное равновесие или взаимодействие полимерных 1 юлекул в растворе иногда выражают уравнением адсорбционной изотермы или говорят об адсорбции молекул растворителя молекулами полимера. В наличии внутренней связи этих различных процессов заключается одна нз характерных особенностей коллоидных систем, которая отсутствует в растворах низко молекулярных веществ (см. главу первую). [c.175]
Определение изоэлектрической точки белка. Белки являются а фотерными электролитами, т. е. они могут диссоциировать как кислот и как основания. Часть молекул белка в воде находится в ионизироваь ной форме, в виде биполярных ионов (амфионов). Ионы Н+ (протоны освобождающиеся в результате диссоциации кислотной группы, npi соединяются к NHa-rpynne, и таким образом молекула белка перехс дит в ионизированную форму [c.36]
Если частицы распределенного вещества имеют размеры порядка 1 — 100 нм, такие дисперсные системы называются коллоидными растворами, или золями. Частицы, образующие коллоидный раствор, нельзя увидеть в обычный микроскоп, но их можно различить в ультрамикроскопе, где свет падает сбоку или сзади, в результате чего в поле зрения вндны светлые точки, соответствующие рассеянию света диспергнрованныхми частицами. В определенных условиях коллоидные растворы могут распадаться с образованием взвесей и затем расслаиваться. К коллоидным растворам относятся некоторые системы, играющие большую роль в живой природе и в технике, например растворы белков в воде, некоторые клеи и т. д. [c.77]
Высушивание в сушильном шкафу при атмосферном давлении непригодно для определения воды в крови и других белоксодержащих материалах. Бенедикт и Маннинг [63 ] высушивали белки при 100—105 °С и обнаружили среди летучих компонентов жиры и азотсодержащие вещества, хотя несколько процентов воды удерживалось белками даже после достижения образцом постоянной массы [298]. Высушивание белков в глубоком вакууме в течение нескольких недель дает те же результаты, что и высушивание при 110°С в нормальных условиях, и только повторное высушивание в глубоком вакууме приводит к дополнительному уменьшению массы [63]. При высушивании в термостате (105 °С) цельной крови, клеток и плазмы Миллер [250 ] получил соответственно более низкие результаты, чем при отгонке с толуолом (см. гл. 5). [c.144]
Для определения воды в белках Свенпоэл и ван-Ренсбург [176] применили метод, основанный на измерении удельной теплопроводности. Этот метод представляет собой модификацию автоматической методики Симона и сотр. [165], разработанной для определения углерода и водорода. При температуре печи 180 °С вода удаляется из многих материалов без разрушения образца. При выполнении типичных анализов пробу шерсти массой 5—10 мг помещали в трубку для сожжения при температуре 180 10 °С. В качестве газа-носителя использовали гелий, и количество паров воды определяли с помощью детектора по удельной теплопроводности. В табл. 11-11 приведены данные определения воды в некоторых белках описанным методом в сопоставлении с обычным высушиванием в сушильном шкафу. Авторы подчеркивают, что для выполнения анализа достаточно 1 мкг образца. Существует серийный прибор для таких определений. [c.590]
Ход определения. 2 мл сыворотки крови переносят пинеткой в сосуд для центрифугирования, прибавляют 2 мл насыщенного раствора оксалата натрия и 6—8 мл дважды дистиллированной воды. После основательного перемешивания стеклянной палочкой оставляют на 6—12 час. Затем вынимают палочку, ополаскивают ее дважды дистиллированной водой и центрифугируют в течение 10 мин. при 3000 об/мин. Сливают жидкость с осадка и внутренние стенки сосуда высушиваю г фильтровальной бумагой. Осадок оксалата кальция растворяют прибавлением 1 мл 1 н. раствора соляной кислоты, тщательно перемешивают стеклянной палочкой и ополаскивают стенки сосуда. Выделившиеся хлопья белка определению не мешают. Затем прибавляют 2—3 мг комплексоната магния, 2 мл Ъ -а. раствора аммиака, эриохром черный Т и титруют 0,001 М раствором комплексона Ш до перехода виннокрасной окраски в чисто-синюю. [c.461]
Необходимо заметить, что, выделяясь из водного раствора, многие тела, не имея кристаллической формы, удерживают воду в таком же состоянии непрочном, как и в кристаллогидратах только эту воду нельзя назвать кристаллизационною, если выделяющееся тело не имеет кристаллического вида. Примером подобных непрочных гидратов могут служить соединения глинозема и кремнезема с водою. Если из водного раствора эти вещества выделяются чрез химический процесс, то они всегда выделяются (сперва) с содержанием воды. Здесь особенно очевидно образование нового химического соединения с содержанием воды, потому что глинозем и кремнезем 8 безводном состоянии представляют иные химические свойства, чем в соединении с водою, и притом они с водою прямо вовсе не соединяются. Целый ряд коллоидальных тел, выделяясь иэ воды, образует такие соединения, имеющие вид студенистых твердых тел, лишенных кристаллического вида. В застывшем клее, в сваренном белке удерживается вода в значительном количестве. Прожиманием ее нельзя оттуда выделить значит, здесь произошло какое-то соединение тела с водою. Эта вода, однако, легко выделяется при высушивании, но только не вся — часть удерживается, и эта удерживаемая часть воды принадлежит, как говорят, гидрату, хотя определенные соединения с водою здесь получить весьма трудно, если только возможно. В таких примерах ясно видно вышеупомянутое отсутствие резких границ между растворами, кристаллогидратами и обычными гидратами, т.-е. между определенными и неопределенными химическими соединениями. [c.410]
Согласно Розенбоуму [14], экспериментально определенное значение плотности сухой шерсти действительно представляет собой плотность полимерного материала, содержащего малые статические пустоты , которые в нативном состоянии гидратированного белка заняты водой. При таком подходе экспериментальное значение удельного объема для шерсти оказывается на 7% больше, чем удельный объем без пустот . [c.238]
Вода в животных и растительных тканях не представляет собой хаотизированной среды молекулы ее расположены относительно упорядоченно, и можно сказать, что вода в нашем организме имеет определенное сходство со льдом. Этот удивительный вывод был использован Л. Полингом в его теории наркоза. Л. Полинг предположил, что функции некоторых наркотизирующих веществ заключаются в том, что они облегчают образование вокруг молекул белков структурированной воды, повышая ее [c.38]
В качестве критерия чистоты соединения пользуются также растворимостью. Известно, что растворимость гомогенного вещества постоянна и не изменяется в присутствии избытка твердого вещества. Этот метод вряд ли пригоден для определения растворимости белков в чистой воде, так как растворимость белков в воде сильно зависит от следов электролитов и от концентрации водородных или гидроксильных ионов. Влияние этих веществ можно исключить, если в качестве растворителя использовать концентрированный раствор соли. При проверке растворимости кристаллического яичного альбумина или карбокси-гемоглобина в растворе сернокислого ам1мония было найдено, что растворимость до некоторой степени зависит от количества твердой фазы [22]. На этом основании было сделано заключение, что молекулы этих белков можно рассматривать как системы обратимо диссоциирующих компонентов. Очень тщательные определения растворимости кристаллического химотрипсиногена [23] и рибонуклеазы [24] показали, что эти белки ведут себя как гомогенные соединения. В высшей степени важно, что эти гомогенные белки являются ферментами (см. гл. ХП). [c.15]
Поскольку белки легче растворяются в концентрированных растворах мочевины, чем в воде, 6,66 М раствор мочевины часто используется как растворитель при определении молекулярного веса белков [5]. Оказалось, однако, что молекулярные веса амандина и эксцельсина в растворе мочевины равны 30 300 и 35 700, тогда как в нативных водных растворах они составляют соответственно 206 000 и 214 000 [18]. Правда, молекулярные веса яичного альбумина, сывороточного альбумина, глиадина и некоторых других белков в воде и в растворе мочевины одинаковы [19]. Многие другие белки после денатурации мочевиной и подобными агентами подвергаются агрегации [19]. [c.51]
Другой метод, применяемый для той же цели, основан на определении растворимости мочевины, глюкозы и других неэлектролитов в растворах белков. Было высказано предположение, что гидратная вода, связанная с белками, неспособна функционировать как растворитель для других веществ. Растворимость добавленных неэлектролитов можно определить путем химического анализа при помощи криоскопии или измерением упругости пара. Однако этот метод нерастворяющего объема имеет ряд серьезных недостатков. Один из них обусловлен тем, что в систему вводится постороннее вещество, которое может конкурировать с белком за воду и поэтому может уменьшать начальную степень гидратации. Другой зависит от нашего неуменья отличать адсорбцию ионов Н+ и 0Н от действительной гидратации, т. е. от присоединения молекул воды к белку [23]. Однако самый серьезный недостаток указанного метода связан с тем, что добавленные к раствору белка вещества сами иногда присоединяются к белку, в связи с чем вместо ожидаемого уменьшения растворимости имеет место увеличение последней [24]. Несмотря на эти недочеты, описанный метод позволил все же получить ряд ценных результатов. В сравнительных опытах, проведенных при различных значениях pH и при различных температурах, было найдено, что нерастворяющий объем почти не зависит от pH [25]. Из этих данных следует, что высокая вязкость ще.лочных растворов белков не может быть приписана увеличению гидратации, как это делали раньше. Другим важным результатом этих исследований было установление того факта, что нерастворяющий объем лишь незначительно уменьшается при денатурации и тепловой коагуляции белка [26]. Оказалось, что коагулированные белки обладают способностью связывать воду почти в той же мере, как и нативные растворенные белки. [c.109]
Растворимость белков в воде варьирует в широких пределах. Одни белки легко растворяются в воде, не содержащей солей, другие, наоборот, растворяются только в воде, содержащей определенное количество солей белки третьей группы нерастворимы в воде, но растворяются в смеси воды и спирта белки четвертой группы — склеропротеины — не растворяются ни в каких растворителях. Эти особенности белков послужили основой для разделения их на альбумины, глобулиноподобные белки, проламины и склеропротеины. Такая классификация является более или менее искусственной, и значение ее ограниченно. Так, например, одни гемоглобины легко растворимы в воде, не содержащей солей, другие же почти нерастворимы в отсутствие солей, но легко растворяются при их добавлении. [c.111]
При всех седиментационных измерениях наиболее целесообразно работать с растворителями, имеющими возможно большую разность плотностей относительно растворенного вещества. Для многих цепных молекул в opгaничe киx растворителях это значительно легче осуществить, чем для белков в воде. Коэффициент (1 — Vp) при седиментации полистирола в дибромэтане в 5 раз больше, чем для белков в воде, что обеспечивает более быстрое проведение седиментации и значительно уменьшает влияние диффузии, мешающей определению молекулярновесового распределения. Кроме того, для повышения скорости седиментации вязкость растворителя должна быть низкой. В растворителях умеренной растворяющей способности концентрационная зависимость константы седиментации меньше, чем в хороших растворителях, что облегчает экстраполяцию к нулевой концентрации. Более поздний обзор опытов с высокомолекулярными органическими веществами дается в статье Никольса и Бэйлея [88]. [c.374]
Помимо ИЭТ кислотно-основные свойства белков характеризует также изоионная точка. Согласно определению, изоион-ная точка соответствует pH раствора изоионного белка в воде или в растворе какого-либо другого вещества, которое само по себе при растворении в воде не дает водородных или гидроксильных ионов [767]. [c.213]
Проведены сравнительные исследования общего содержания бел ка (среднее значение четырех отдельных определений) сыворотки животных с предопухолевыми изменениями и раком молочной железы. Не были обнаружены такие различия, которые могли бы объяснить повышение Фактически, по данным Hollis и сотрудников (1974), незначительное увеличение концентрации белка приводит к удлинению Данные о том, что почти одни и те же значения концентрации белка в сыворотке крови обнаружены у мышей с двумя типами предопухолевых узлов и у животных с двумя типами злокачественных опухолей, ставят вообще под вопрос роль этого фактора в повышении значений Для того чтобы снизить концентрацию белка в сыворотке крови, животные были посажены на безбелковую диету. Сыворотка этих мышей, получавших в течение 5 дней глюкозу, имела низкую концентрацию белка (3,8 мг %), тогда как у контрольных животных содержание белка было 4,95 мг%. Однако значения сыворотки этих животных не отличались от контрольных. Следовательно, полученные результаты не подтверждают идею о том, что значения сыворотки являются только функцией концентрации белка и воды. [c.284]
Физиологическая засухоустойчивость складывается из способностей растений переносить обезвоживание и действие высоких температур. Поэтому при изучении засухоустойчивости необходимо исследовать как способность выносить обезвоживание, так и перегрев. Для диагностики засухоустойчивости пр дпочтительиее использовать прямые методы, непосредственно связанные с засухоустойчивостью. К ним относят определение засухоустойчивости в засушниках эксикаторный метод определения способности растений выносить обезвоживание определение водоудерживающей способности метод коагуляции белков определение гидрофильности коллоидов цитоплазмы, содержания свободной и связанной воды, эластичности и вязкости протоплазмы метод крахмальной пробы и др. [c.214]
Механическая прочность мясных изделий обусловлена определенной жесткостью третичной структуры белков. Наибольшей жесткостью обладают белки соеди 1ительных тканей (коллаген и эластин). Одним из основных, но не единственным фактором, обусловливающим жесткость третичной структуры большинства белков животного происхождения, за исключением яиц и икры, является присутствие в них воды (в форме прочносвязанной, гидратной и др., которые здесь не рассматриваются). В мясных продуктах вода в третичной структуре связана главным образом с мышечными белками, а не с соединительнотканными. Содержание соединительнотканных белков зависит от характера сырья, возраста животного и ряда других условий. В среднем меньше всего их в рыбе (2—4%), затем в молодых птицах и свинине (до 8%), больше всего (8—12%) в убойном мясе говядины и баранины. Тепловая обработка животных продуктов и заключается в частичном разрушении соединительнотканных, а также мышечных белков. Разрушение происходит за счет воды, участвующей в образовании третичной структуры мышечных белков (практически вода в мясе связана главным образом с этими белками) и освобождающейся при их температурной коагуляции. При тепловой обработке высвобожденная вода внедряется непосредственно во вторичную структуру белков (главным образом коллагена), разрушая их и приводя соединительнотканные белки в желатинообразное состояние. Эту фазу часто рассматривают как образование из коллагена глютина. Механическая прочность мясных продуктов при этом заметно уменьшается. Температурная коагуляция белков в зависимости от их природы начинается с 60, но в большинстве случаев с 70°С. При варке и жарке мяса температура внутри изделия в зависимости от вида мяса и величины куска обычно достигает 75— 95°С [4]. [c.158]
chem21.info