5.4. Ионное произведение воды. Водородный показатель. Ион воды
Ионное произведение воды и показатель водородных ионов (рН)
Электропроводность чистой воды свидетельствует о том, что она, хотя и незначительно, диссоциирует на ион гидроксония Н30+ и ион гидроксила ОН-.
Диссоциация протекает по схеме
Н2О + Н - О - Н ↔ Н3О+ + ОН-.
Таким образом, ион водорода Н+ (протон) в водных растворах существует в виде иона гидроксония Н3О+. Однако при расчетах не имеет значения какой ион, Н+ или Н3О+ , выбран; на результаты вычислений это не влияет. Обычно в расчетах принимают ион Н+, а не Н3О+.
Известно, что ионы, различные по знаку и растворенные в воде, например Na+ и Сl-, Fe3+ и SO42-, взаимно притягиваются. В результате каждый ион образует вокруг себя как бы «атмосферу» из ионов другого знака. Эта ионная атмосфера препятствует передвижению ионов в растворе, понижая его электропроводность.
Следовательно, снижение подвижности ионов приводит к снижению электропроводности растворов и создает эффект неполной диссоциации электролита. С повышением концентрации раствора взаимное притяжение различных по знаку и отталкивание одинаковых по знаку ионов из-за сокращения расстояния между ними усиливается; поэтому их скорость передвижения в электрическом поле уменьшается, что приводит к дальнейшему уменьшению электропроводности раствора.
Таким образом, усиление электростатического взаимодействия между ионами влияет на свойство раствора, так же как влияло бы частичное соединение ионов в молекулы.
Если ионы связаны силами притяжения, то они не могут вести себя свободно и в химических реакциях активность их действия понижается, а это сказывается на физико-химических свойствах растворов. Поэтому концентрация вещества без учета сил взаимодействия между ионами и молекулами в водном растворе не может характеризовать свойство раствора.
Для оценки ослабленной способности ионов к химическим реакциям, вызываемой их электростатическим взаимодействием, в настоящее время пользуются термином активная концентрация иона, под которой подразумевают ту концентрацию его, которая соответствует определенным свойствам раствора: электропроводности, понижению температуры замерзания, повышению температуры кипения и т. д.
Таким образом, активная концентрация иона аион - действующая (эффективная), но условная концентрация иона.
Естественно было принять, что активная концентрация - активность иона - пропорциональна концентрации иона сион
аион = ƒ/сион,
где ƒ - коэффициент активности, учитывающий взаимодействие данного иона с окружающей средой.
Активность ионов выражается в грамм-ионах на литр (г X ион/л) и является эффективной концентрацией, проявляющей себя при химических реакциях. Обычная же концентрация - это количество вещества, находящегося в растворе.
Коэффициент активности, как правило, меньше единицы, и лишь при очень больших разбавлениях раствора, когда силы взаимодействия между ионами приближаются к нулю, коэффициент активности / равен единице. В этом случае а ≈ с, т. е. движение ионов в растворе не стеснено.
По величине электропроводности можно вычислить активность ионов ан+ и аон- в чистой воде:
Диссоциация воды - обратимый процесс:
Н2О ↔ Н+ + ОН-,
поэтому при наступлении равновесия согласно закону действия масс
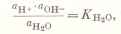
где Кн2о - константа диссоциации воды, равная 1,8∙10-16 (при 22°С).
В 1 л воды находится 1000:18,016=55,56 моля Н2О, из которых всего только 10-7 молей диссоциированы на ионы; концентрация же оставшихся недиссоциированными молекул воды равна 55,56-10-7 моля. Поэтому концентрацию (активность) недиссоциированных молекул воды можно приравнять к общему количеству воды, находящемуся в 1 л, и считать ее постоянной величиной. Тогда можно записать
ан+ ∙ аон- = Кн2о ∙ ан2о = Кв = const.
Только произведение активности ионов, а не произведение концентраций [Н+]. [ОН-] есть постоянная величина. Однако в химически чистой воде концентрация ионов ничтожно мала, и поэтому активность ионов практически равна их концентрации.
Таким образом, для чистой воды
ан+ ∙ аон- = [Н+] ∙ [ОН-] = 10-14 (при 22°С).
Для растворов электролитов обычных концентраций
ан+ ∙ аон- = ƒ [Н+] ∙ ƒ [ОН-] = ƒ2 [Н+] ∙ [ОН-] = Кв.
Постоянная для данной температуры величина Кв называется ионным произведением воды. Во всяком водном растворе при постоянной температуре произведение активностей ионов водорода и гидроксила равно ионному произведению воды.
Произведение ан+ ∙ аон- никогда не может быть равным нулю, так как любая величина, умноженная на нуль, дает нуль.
Если активность одного из ионов стремится к нулю (т. е. становится бесконечно малой величиной), то активность другого иона должна быть бесконечно величиной. При увеличении температуры воды Кв также увеличивается.
При диссоциации молекул воды образуется один ион водорода и один ион гидроксила. Следовательно, для чистой воды можно написать
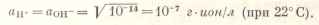
Величина активности ионов Н+ и ОН- в нейтральном растворе равна 10-7 г∙ион/л только при 22°С. При других температурах в нейтральной среде она будет другой.
Все свойства, характерные для кислот, зависят от присутствия в растворе ионов водорода Н+ (точнее, ионов гидроксония Н3О+), а свойства, характерные для щелочей,- от ионов гидроксила ОН-. Поэтому растворы, в которых активность водородных и гидроксильных ионов одинакова, называются нейтральными растворами (ан+ = аон-). Кислыми растворами называются такие, в которых активность ионов водорода больше активности ионов гидроксила (ан+>аон-), а щелочными - растворы, в которых активность ионов водорода меньше активности ионов гидроксила (аон- > ан+).
Выражать кислотность или щелочность раствора числами с отрицательными показателями степени очень неудобно. Поэтому этот способ заменен более простым: вместо активности (концентрации) ионов водорода или гидроксила указывают значения их отрицательных логарифмов, называемые соответственно водородным и гидроксильным показателями, и обозначают соответственно рН и рОН. Таким образом,
рН = -lg ан+ и рОН = - lg аон-.
Для очень разбавленных растворов электролитов ан+≈[H+] и ан- ≈[ОН-], поэтому можно считать
рН ≈ -lg [Н+] и рОН ≈ -lg [ОН-].
Следовательно, в нейтральной среде рН = 7 (22°С), в кислой рН < 7 и в щелочной рН > 7.
www.comodity.ru
5.4. Ионное произведение воды. Водородный показатель
Вода – очень слабый амфотерный электролит: Н20  Н+ + ОН‾ при 24°С=1,6∙10‾9
Н+ + ОН‾ при 24°С=1,6∙10‾9

Подставляя в уравнение Кдисс [Н2O]=[Н+]∙[0Н-] концентрацию воды, которая вычисляется из соотношения [Н2O] =1000/18 = 55,5 моль/л, получаем выражение для константы воды: 1,8∙10-16∙55,5=[Н+]∙[0Н-]=1∙10-14=КН2О,
где КН2О=1∙10-14 - ионное произведение воды; КН2О зависит от температуры, с повышением температуры КН2О увеличивается, т.е. диссоциация Н20 происходит с поглощением тепла.
КН2О – постоянна не только для Н2О, но и для разбавленных водных растворов любых веществ [Н+]=[0Н-]=√КН2О=10-7моль/л.
Пользуясь КН2О, можно выразить любую реакцию среды через концентрацию ионов водорода. Нейтральный раствор [Н+]=[0Н-]=10-7моль/л. Кислый раствор [Н+]>10-7моль/л. Щелочной раствор [Н+]<10-7моль/л.
Количественное обозначение реакции среды можно упростить, если ввести водородный показатель pH и гидроксильный показатель pОH, тогда
pH= -lg[Н+]; pОH= -lg[0Н-]. Нейтральная среда pH=7; pОH=7. Кислая средаpH<7; pОH>7. Щелочная среда pH> 7; pОH<7.
5.5 Равновесие в гетерогенных системах, произведение растворимости
Примером гетерогенной системы может служить насыщенный раствор труднорастворимого соединения, находящегося в равновесии с твердой фазой. К труднорастворимым веществам относятся многие электролиты - соли, основания (чаще всего амфотерные), некоторые кислоты (h3SiO3; β-h3SnO3 и др.). Так, труднорастворимы галогениды серебра, сульфаты бария и стронция, карбонаты бария и кальция. Сульфиды металлов, за исключением сульфидов натрия и аммония, характеризуются очень малой растворимостью. Вследствие малой растворимости раствор труднорастворимого электролита становится насыщенным при очень малых концентрациях растворенного вещества. Между твердой фазой и раствором электролита устанавливается равновесие, например, AgCl Ag++CI-
Ag++CI-
твердая насыщенный
фаза раствор
В единицу времени в насыщенный раствор переходит столько ионов, сколько их вновь переходит в осадок. Это состояние равновесия характеризуется величиной константы равновесия

Концентрация твердой фазы – величина постоянная, т.е. [AgCl]тв= const, следовательно, [Ag+][Cl-] также величина постоянная, называемая произведением растворимости (ПР): ПРAgCI=[Ag+]∙[CI-].
Таким образом, в насыщенном растворе труднорастворимого соединения произведение концентраций его ионов при данной температуре есть величина постоянная. При написании ПР необходимо учитывать стехиометрические коэффициенты в уравнении диссоциации соединения, например: ПРAg2CrO4=[Ag+]2[CrO42-]; ПРAg3PO4=[Ag+]3[PO43-];: ПРAg2S3=[Ag+]2[S2-]3.
В общем виде для системы КmAn↔mkn+ nAn, ПР выразится следующим образом: ПРKmAn=[Kn+]m[Am-]n.
Из понятия ПР вытекает условие образования и растворения осадков. Если [Kn+]m[Am-]n= ПРKmAn , система находится в равновесии.
Если [Kn+]m [Am-]n>ПРKmAnили [Kn+]m [Am-]n<ПРKmAn, система стремится к новому состоянии равновесия, приводящему в первом случав к выпадению осадка, во втором - к его растворению. Эти процессы будут происходить до тех пор, пока не будут достигнуты ионные концентрации, соответствующие величине произведения растворимости. В таблице 4 приведены примеры некоторых труднорастворимых веществ.
Таблица 4
Произведение растворимости некоторых труднорастворимых веществ
| Вещество | ПР | Вещество | ПР |
| CuS | 6,3∙10-36 | α- ZnS | 1,6∙10-24 |
| Cu2S | 25∙10-48 | β - ZnS | 2,5∙10-22 |
| HgS | 3∙10-52 | ZnSe | 1∙10-21 |
Физико-химические свойства растворов электролитов.
Примеры решения задач.
Пример 1. Вычисление кажущейся степени диссоциации сильного электролита.
Вычислить степень диссоциации 0,2 М раствора муравьиной кислоты HCOOH, если Кд=2,1∙10-4.
Решение: По закону разбавления α=√(Кд/См)= √(2,1∙10-4/0,2)=3,24∙10-2 или 3,24%.
Пример 2. Вычисление степени диссоциации электролита по осмотическому давлению его раствора.
Рассчитайте кажущуюся степень электролитической диссоциации ZiCI в 0,1М раствора соли, если раствор изотоничен с 0,19 М раствором сахара С12Н22О11 при 0ºС.
Решение: Моль сахара равен 342 г.
Росм=(mRT)/(M∙V)= (342∙0,19∙8,3144∙273)/ (342∙10-3) = 4,31∙105 Па.
М(ZiCI)=42 г∙моль-1. По осмотическому давлению определяем изотонический коэффициент раствора ZiCI
i=(Pосм∙V)/(nRT)=(4,31∙103∙10-3∙42,39)/(4,239∙8,3144∙273)= 1,19.
Кажущаяся степень диссоциации в 0,1 М ZiCI равна
α=(i-1)/(n-1)=(1,9-1)/(2-1)=0,9 или 90 %.
Пример 3. Вычисление степени диссоциации электролита по понижению давления пара растворителя над раствором.
Давление пара водного раствора NaNO3(ω=0 ,08) равно 2268,8 Па при 20 °С. Давление паров воды при этой температуре равно 2337,8 Па. Найдите кажущуюся степень диссоциации нитрата натрия в этом растворе.
Решение. С помощью первого закона Рауля для электролитов вычисляем значение изотонического коэффициента для NaNO3:
i = (P0-P)∙(N+n)/P0∙n; M(NaNO3) = 85,00 г∙моль-1; n=8:85=0,094 моль; М(Н2О)=18,02 г∙моль-1;
i = (2337,8-2268,9) ∙ (0,094+5,911)/(2337,8∙0,094)=(0,69∙5,199)/219,75 = 1,63.
Кажущаяся степень диссоциации NaNO3 в этом растворе равна
α=(1,63-1)/(2-1) = 0,63 (или 63 %).
Пример 4. Вычисление изотонического коэффициента по повышению температуры кипения раствора.
Раствор, содержащий 8 г NaOH в 1000 г Н2О, кипит при 100,184°С. Определите изотонический коэффициент (для воды Е =-0,516°С).
Решение. Второй закон Рауля для растворов электролитов выражается уравнением ∆t0кип=ι∙ (Кэ∙100∙m)/(mр-ля∙М(р.в)). Тогда
ι = (∆t0кип∙mр-ля*М(р.в))/(Кэ∙m∙1000)= (0,184∙1000∙40)/(0,516∙1000∙8)=1,78.
Ионное произведение воды. Водородный показатель
Электростатическое взаимодействие полярных молекул воды приводит к их самоионизации: 2Н2О↔Н3О++ОН- или в упрощенной форме Н2О↔Н++ОН-;
Константа диссоциации воды весьма мала при 25°С

Принимая поэтому концентрацию воды [Н2О] величиной практически постоянной, можно записать К∙ [Н2О]=[Н+] ∙ [ОН-] = 1,8∙10-16[Н2О]. Но концентрация воды равна 1000/18=55,56 моль∙л-1, отсюда получаем
[Н+]∙[ОН-] = =1,8∙10-16∙55,56=1∙10-14=Кв.
Произведение концентраций ионов водорода и ионов гидроксида называется ионным произведением воды Кв. Ионное произведение воды есть величина постоянная при постоянной температуре. В чистой воде и нейтральных растворах[Н+]=[ОН-]=√10-14=10-7 моль∙л-1.
Математически более удобной характеристикой среды является водородный показатель рН, равный десятичному логарифму концентрации водородных ионов, взятому с обратным знаком: рН = -lg[Н+].
Тогда рН различных растворов будут иметь следующие значения:
кислый рН <7;
нейтральный рН = 7;
щелочной рН >7.
Аналогично, отрицательный десятичный логарифм концентрации гидроксо-ионов называется гидроксильным показателем и обозначается рОН. Следовательно,

рН + рОН = 14.
Пример 1. Вычисление водородного показателя раствора.
Вычислите водородный показатель рН раствора гидроксида натрия, содержащегося в растворе в концентрации 4,2∙10-3 моль∙л-1 .
Решение. Концентрация ОН- ионов в растворе NaOH равна
[0Н-]=4,2∙10-3моль∙л -1. Исходя из ионного произведения воды Кв, находим концентрацию ионов водорода: [Н+]=КВ/[ОН-]=10-14/4,2∙10-3=0,24∙10-11. Водородный показатель раствора NaOH равен: рН= -lg([Н+])=-lg(0,24∙10-11)=11,62.
Пример 2. Определение концентрации ионов Н+ и ОН- в растворах сильных кислот и оснований.
Определите концентрацию ионов водорода и рН в 0,01 М раствора соляной кислоты.
Решение. Соляная кислота – сильный электролит, в растворе полностью диссоциирует на ионы: НС1 Н+ + С1-. Концентрация ионов [Н+] численно равна концентрации НС1. Из 0,01 моль НС1 образуется 0,01 моль иона Н+. Отсюда [Н+] =0,01∙10-2; рН=-lg(1∙10-2)=2.
Н+ + С1-. Концентрация ионов [Н+] численно равна концентрации НС1. Из 0,01 моль НС1 образуется 0,01 моль иона Н+. Отсюда [Н+] =0,01∙10-2; рН=-lg(1∙10-2)=2.
Пример 3. Вычисление рН сильного электролита с учетом его коэффициента активности.
Найдите водородный показатель раствора НNO3, если его молярная концентрация равна 0,178 моль∙л-1.
Решение. При значительной концентрации сильного электролита его активная концентрация существенно отличается от истинной. Поэтому в таких случаях нужно вводить поправку на активность электролита. Определяем ионную силу раствора НNO3: J= 1/2∙ (0,176∙I2 + 0,178∙I2) = 0,356/2 = 0,178.
Далее по вычисленной ионной силе находим коэффициент активности иона [Н+]= f(Н+)=0.838. Тогда активность ионов [Н+], а (Н+) =0,83∙0,178=0,148. Водородный показатель раствора НNO3 равен: рН = -lg а(Н+) = -lg 0,148=0,83.
Пример 4. Определение концентрации ионов Н+ и ОН- в растворах слабых кислот и оснований.
Концентрации [Н+] и [ОН-] ионов в растворах слабой кислоты и слабого основания могут быть вычислены, если известны их константы диссоциации. В общем виде формула для вычисления концентрации [Н+] в растворе слабой кислоты:
Концентрация ионов [Н+]и [ОН-] в растворе слабого основания может быть вычислена по формуле:  ; [Н+]= Кв/[ОН-];
; [Н+]= Кв/[ОН-];
 .
.
Определите концентрацию[Н+], [ОН-], рН, рОН, в 0,0М раствора муравьиной кислоты, если Кд(HCOOH)=2,1∙10-4
Решение:
[Н+]=√2,1∙10-4∙3∙10-2 = √6,3∙10-6= 2,5∙10-3 моль∙л-1;
рН= -lg 2,5∙10-3=3-lg 2,5 = 3-0,4= 2,6;
[ОН-]= Кв/[Н+]= 10-14/(2,5∙10-3)=4∙10-12 моль∙л-1;
рОН= 14-рН=14-2,6 = 11,4.
studfiles.net
Ионное произведение воды | Chemistry-gid.ru
Ионизация воды (также автоионизация воды и автодиссоциация воды ) представляет собой реакцию ионизации в чистой воде или в водном растворе.
В котором молекула воды, h3O, депротонирует (теряет ядро одного из своих атомов водорода Атомов), чтобы стать гидроксидным ионом, OH—. Ядро водорода, H+, немедленно протонирует другую молекулу воды с образованием гидрония, h4O+ . Это пример автопротолиза, и он иллюстрирует амфотерную природу воды.

Константы равновесия
Химически чистая вода имеет электрическую проводимость 0,055 мкм/см. Согласно теориям Сванте Аррениуса , это должно быть связано с наличием ионов . Ионы образуются в результате реакции самоионизации.
h3O + h3O3h4O+ + OH—
Это равновесие применимо к чистой воде и любому водному раствору.
Выраженный с химической активностью а, вместо концентраций константа термодинамического равновесия для реакции ионизации воды составляет:

Которая численно равна более традиционной константе термодинамического равновесия, записанной как:

В предположении, что сумма химических потенциалов H+ и h4O+ формально равна удвоенному химическому потенциалу h3O при одинаковых температуре и давлении.
Поскольку большинство растворов на основе кислот обычно являются очень разбавленными, активность воды обычно аппроксимируется равной единице, что позволяет получить ионный продукт воды в виде:

В разбавленных водных растворах активность растворенных частиц примерно равна их концентрации. Таким образом, константа ионизации , константа диссоциации , константа самоионизации или ионный продукт воды, обозначаемая Kw , может быть выражена как:

де [h4O+] — молярность (≈ молярная концентрация ) водорода или иона гидрония , а [OH—] — концентрация гидроксид- иона. Когда константа равновесия записывается как произведение концентраций (в отличие от видов деятельности), необходимо внести поправки в значение 
При 25 °C и нулевой ионной силе равен 1,0 × 10-14 . Обратите внимание, что, как и все константы равновесия, результат безразмерный, потому что концентрация на самом деле представляет собой концентрацию относительно стандартного состояния, которое для Н+ и ОН— оба определены как 1 молярное (или молярное). Для большинства практических целей мольные и молярные концентрации равны вблизи температуры и давления окружающей среды. Молекулярная шкала концентрации приводит к значениям концентрации, которые учитывают изменение плотности при изменении температуры или давления; Поэтому она представляет собой шкалу, используемую в точном или нестандартном применении, например, для морской воды или при повышенных температурах, например, на тепловых электростанциях.
Мы также можем определить pKw = -log10Kw = 14 при 25°C. Это аналогично обозначениям pH и pKa для константы диссоциации кислоты , где символ p обозначает кологарифм . Логарифмическая форма уравнения равновесной константы имеет вид pKw = pH + pOH.
Зависимость от температуры, давления и ионной силы
chemistry-gid.ru
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ СРЕДЫ — Мегаобучалка
Тщательно очищенная от посторонних примесей вода обладает незначительной электрической проводимостью. Это может быть объяснено тем, что молекулы воды частично распадаются на ионы, т.е. Н2О является слабым электролитом. Процесс диссоциации воды протекает согласно следующей схемы
2Н2О ↔ Н3О+ + ОН-
или упрощенно
Н2О ↔ Н+ + ОН-
Применяя закон действия масс к процессу диссоциации воды, имеем:
КД = [H+][OH-] / [h3O] или KД∙[h3O] = [H+][OH-],
где КД – константа диссоциации (величина табличная).
Поскольку на ионы диссоциирует небольшая часть молекул воды (распадается лишь одна из примерно 108 молекул), то ее концентрацию можно считать неизменной и постоянной. Обозначая KД∙[h3O] через КВ, получаем:
КВ = [H+][OH-], (6)
где КВ – ионное произведение воды.
Ионное произведение воды показывает, чему равно произведение концентраций ионов водорода и гидроксид-ионов в воде.
Значение КВ зависит только от температуры. Установлено, что при 220С ионное произведение воды КВ=10-14.
Так как в соответствии с уравнением диссоциации концентрации ионов Н+ и ОН- в воде одинаковы, то их можно определить
[H+] = [OH-] =  = 10-7 моль/л. (7)
= 10-7 моль/л. (7)
В соответствии с теорией электролитической диссоциации ионы Н+ являются носителями кислотных свойств, а ионы ОН- - носителями основных свойств. Поэтому, раствор будет нейтральным, когда СН+ = СОН- = 10-7 моль/л; кислотным, когда СН+ > СОН- > 10-7 моль/л, и основным, когда СН+ < СОН- < 10-7 моль/л.
При изменении кислотности раствора ионное произведение воды остается постоянным: при подкислении раствора повышается концентрация ионов водорода, но во столько же раз уменьшается концентрация гидроксил-ионов; при подщелачивании раствора возрастает концентрация гидроксильных ионов, но соответственно уменьшается концентрация ионов водорода.
Зная концентрацию ионов водорода, легко найти концентрацию гидроксид-ионов, и наоборот.
ПРИМЕР 5. Определить концентрацию ионов водорода, если концентрация гидроксид-ионов равна 10-9 моль/л.
РЕШЕНИЕ. Используя формулу (6), имеем [H+] = KB / [OH-].
[H+] = 10-14 / 10-9 = 10-5 моль/л.
ОТВЕТ: [H+] = 10-5 моль/л.
Оперировать числами с отрицательным показателем степени неудобно, поэтому введена особая единица измерения концентрации ионов водорода, называемая водородным показателем и обозначаемая рН.
Водородным показателем рН называется отрицательный десятичный логарифм концентрации ионов водорода в растворе.
рН = - lg [H+] (8)
Водородный показатель определяет характер реакции раствора. При 220С в нейтральной среде рН = 7, в кислой среде рН < 7 и в щелочной среде рН > 7.
Аналогично отрицательный десятичный логарифм концентрации гидроксид-ионов называется гидроксильным показателем и обозначается рОН.
рОН = - lg [OH-] (9)
При 220С в нейтральной среде рОН = 7, в кислой среде рОН > 7 и в щелочной среде рОН < 7.
Из выше сказанного следует, что с увеличением кислотности раствора значение рН уменьшается, значение рОН возрастает, а их сумма всегда равна 14.
рН + рОН = 14 (10)
Зная рН среды, можно легко рассчитать рОН среды, и наоборот.
ПРИМЕР 6.Рассчитать рН раствора и определить характер среды, если рОН = 8.
РЕШЕНИЕ. Используя формулу (10), получаем рН = 14 – рОН = 14 – 8 = 6.
Так как рН < 7, следовательно, раствор имеет кислую среду.
ОТВЕТ: рН = 6, среда кислая.
ПРИМЕР 7. Рассчитайте рН 0,01 М раствора Nh5OH при 250С.
РЕШЕНИЕ. Гидроксид аммония – слабый электролит и диссоциирует обратимо: Nh5OH ↔ Nh5+ + ОН-.
Значение КД находим в приложении; КД (Nh5OH) = 1,8∙10-5.
Равновесную концентрацию ионов ОН- находим из формулы (4)
[ОH-] =  =
=  = 4,24∙10-4 моль/л.
= 4,24∙10-4 моль/л.
По формуле (9) определяем гидроксильный показатель
рОН = - lg [OH-] = - lg [4,24∙10-2] = 3,37.
Используя формулу (10) определим рН раствора
рН = 14 – рОН = 14 – 3,37 = 10,63.
ОТВЕТ: рН = 10,63.
Водородный показатель имеет важное значение для понимания большинства процессов, протекающих в жидкой фазе, так как ионы Н+ и ОН- непосредственно участвуют во многих из этих процессов. Кроме того, эти ионы являются гомогенными катализаторами многих реакций. Величина рН может служить критерием силы кислоты и основания. В ряду кислот более сильной будет та, у которой при одинаковой молярной концентрации концентрация ионов водорода выше (рН ниже). Для оснований подобная зависимость имеет обратный характер.
С определением кислотности среды приходится иметь дело на химических предприятиях и в химических лабораториях; в кондитерском и хлебопекарном производстве. Существенно влияние на урожайность оказывает рН почвы, на экологию водоема – рН воды.
megaobuchalka.ru