2.1.3. Водородная связь. Связь воды
Что такое водородная связь? Типы, влияние
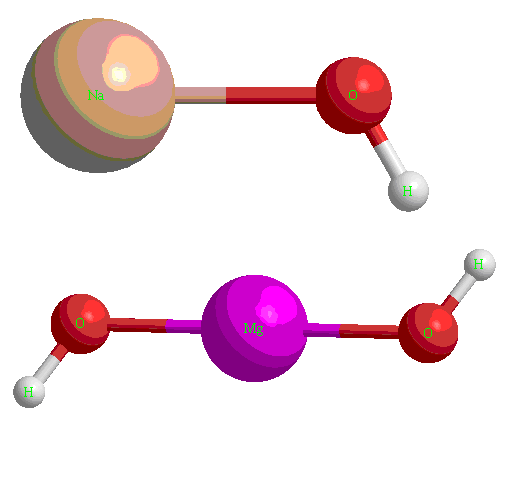
Что такое водородная связь? Известный всем пример этой связи представляет обычная вода (h3O). Из-за того, что атом кислорода (О) более электроотрицателен, чем два атома водорода (Н), он как бы оттягивает от атомов водорода связывающие электроны. В результате создания такой ковалентной полярной связи образуется диполь. Кислородный атом приобретает не очень большой заряд отрицательный, а водородные атомы – небольшой положительный заряд, который притягивается к электронам (их неподеленной паре) на кислородном атоме соседней молекулы Н2О (то есть воды). Таким образом, можно сказать, что водородная связь – это образующаяся сила притяжения между водородным атомом и электроотрицательным атомом. Важной особенностью водородного атома является то, что при притяжении его связующих электронов оголяется его ядро (то есть протон, другими электронами не экранированный). И хотя водородная связь более слабее, чем ковалентная, именно она обуславливает целых ряд аномальный свойств Н2О (воды).
Чаще всего эта связь образуется с участием атомов следующих элементов: кислород (О), азот (N) и фтор (F). Это происходит по той причине, что атомы данных элементов имеют малые размеры и характеризуются высокой электроотрицательностью. С атомами размера большего (сера S или хлор Cl) образующаяся водородная связь слабее, несмотря на то, что по своей электроотрицательности эти элементы сравнимы с N (то есть с азотом).
Существует два типа водородной связи:
1. Водородная межмолекулярная связь – появляется между двумя молекулами, например: метанол, аммиак, фтороводород.2. Водородная связь внутримолекулярная – появляется внутри одной молекулы, например: 2-нитрофенол.
Также в настоящее время есть мнение, что водородная химическая связь бывает слабой и сильной. Они отличаются друг от друга по энергии и длине связи (расстояние между атомами):
1. Водородные связи слабые. Энергия – 10-30 кДж/моль, длина связи – 30. Все вещества, перечисленные выше, являются примерами нормальной или слабой водородной связи.2. Водородные связи сильные. Энергия – 400 кДж/моль, длина – 23-24. Данные, полученные экспериментальным путем, свидетельствуют о том, что сильные связи образуются в следующих ионах: ион-водороддифторид [F-H-F]-, ион-гидратированный гидроксид [HO-H-OH]-, ион оксония гидратированный [h3O-H-Oh3]+, а также в различных других органических и неорганических соединениях.
Влияние водородных межмолекулярных связей
Аномальные значения температур кипения и плавления, энтальпии испарения и поверхностного натяжения некоторых соединений можно объяснить наличием связей водородных. Вода имеет аномальные значения всех перечисленных свойств, а фтороводород и аммиак – температуры кипения и плавления. Вода и фтороводород в твердом и жидком состояниях из-за наличия в них водородных межмолекулярных связей считаются полимеризованными. Данная связь объясняет не только слишком высокую температуру плавления данных веществ, но также и их малую плотность. Причем при плавлении водородная связь частично разрушается, из-за чего молекулы воды (Н2О) упаковываются более плотно.
Димеризацию некоторых веществ (карбоновые кислоты, например, бензойная и уксусная) можно также объяснить наличием в них связи водородной. Димер – это две молекулы, которые связаны между собой. По этой причине температура кипения карбоновых кислот выше, чем у соединений, имеющих приблизительно такую же молекулярную массу. Например, у кислоты уксусной (СН3СООН) температура кипения равна 391 К, в то время как у ацетона (СН3СОСН3) она равна 329 К.
Влияние водородных внутримолекулярных связей
Эта связь тоже влияет на структуру и свойства различных соединений, таких как: 2- и 4-нитрофенол. Но наиболее известный и важный пример водородной связи – это дезоксирибонуклеиновая кислота (сокр.: ДНК). Молекулы этой кислоты свернуты в виде двойной спирали, две нити которой соединены между собой водородной связью.
fb.ru
Водородная связь
Промежуточный характер межу межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Если водород соединен с сильно электроотрицательным элементом (F, O, N) он может образовывать еще одну дополнительную связь – водородную. Хотя энергия водородной связи мала (8-40 кДж/моль), эту связь следует считать разновидностью ковалентной связи, т.к. она обладает свойствами направленности и насыщаемости. Механизм образования водородной связи сводится в электростатическому и донорно-акцепторным взаимодействиям (донор электронной пары – атом электроотрицательного элемента; акцептор – протон (Н+).
Рассмотрим возникновение водородной связи в молекуле фтороводорода. В ней электронная пара смещена к атому фтора, т.е. атом водорода поляризован положительно, а фтор – отрицательно. Благодаря тому, что фтор сильно электроотрицателен, электронная пара практически полностью смещена к нему и ион водорода приобретает пустую, вакантную орбиталь, которая с неподеленной парой фтора образует донорно-акцепторную связь. Водородную связь принято обозначать точками. Обращаю внимание, что водородная связь это связь между молекулами, а не атомами в молекуле.
Благодаря водородным связям фтороводородная кислота, в отличие от соляной, является слабой кислотой и образует соли типа KHF2. Водородная связь играет большую роль в процессах растворения, т.к. растворимость зависит и от способности вещества образовывать водородные связи с растворителем (водой).
Водородная связь в молекуле воды
Пример. Серная кислота и фтороводород растворяется в воде неограниченно, а хлороводород обладает ограниченной растворимостью, что не позволяет получать соляную кислоту с концентрацией выше 37%. Объяснить это различие.
Решение. Серная кислота содержит связь О–Н, фтороводород Н–F , которые способны образовывать водородные связи с водой, которая тоже имеет связь О–Н, и растворение происходит практически неограниченно.
Виды химической связи
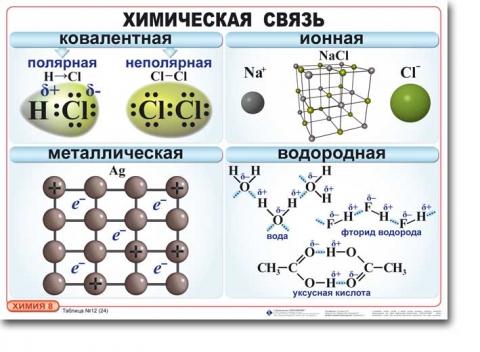
К основным характеристикам химической связи, дающим информацию о структуре молекулы и ее прочности, относятся валентный угол, длина, полярность и энергия связи.
Длиной связи называют расстояние между центрами атомов, образующих данную связь (межъядерное расстояние). Ее определяют экспериментально при помощи различных физико-химических методов. Длина связи обусловлена размером реагирующих атомов и степенью перекрывания их электронных облаков, которая зависит от типа химической связи. Надо обратить внимание, что длина связи всегда меньше суммы радиусов элементов, т.к. происходит перекрывание атомных орбиталей, а не их касание.
Длина связи от этана к ацетилену уменьшается, т.к. увеличивается кратность (порядок) связи от одинарной к тройной. Чем больше кратность связи, тем меньше длина связи.
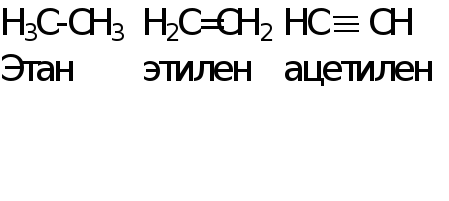
В ряду галогеноводородов длина связи Н‑Г имеет следующие значения (в пм, 1 пм = 10-12 м):
| Соединение | H-F | H-Cl | H-Br | H-I |
| Длина связи | 100 | 127 | 141 | 162 |

Другой характеристикой химической связи, отражающей геометрическое строение, является валентный угол.
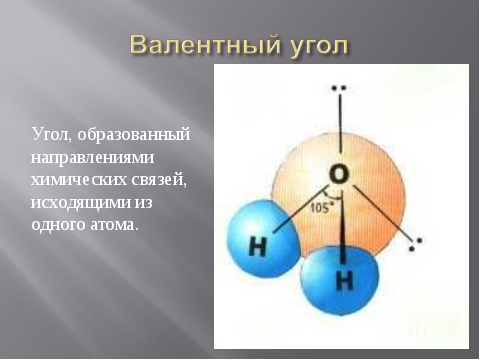
Он зависит от природы атомов и характера химической связи.
Количество энергии, выделяющейся при образовании химической связи, называется энергией связи. Эта величина является характеристикой прочности связи. Ее выражают в кДж/моль образующегося вещества.
Полярные молекулы являются диполями, т.е. системами, состоящими из двух равных по величине, но противоположных по знаку зарядов (q+ и q‑), находящихся на расстоянии l (длина диполя) друг от друга. Полярность молекулы оценивается значением электрического момента диполя =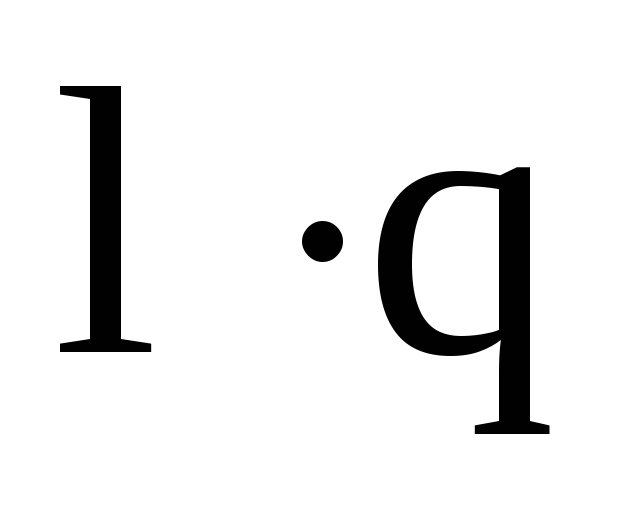 . Электрический момент диполя представляет собой векторную сумму моментов всех связей и несвязывающих электронных пар в молекуле. Результат сложения зависит от структуры молекулы. Молекула СО2 имеет линейное строение и, несмотря на полярность связи С=О, вследствие взаимной компенсации электрических моментов диполя, молекула СО2 неполярна (=0). В угловой молекуле воды полярные связи О-Н располагаются под углом 104,5, взаимной компенсации не происходит и молекула воды полярна (=0,6110-29 Клм).
. Электрический момент диполя представляет собой векторную сумму моментов всех связей и несвязывающих электронных пар в молекуле. Результат сложения зависит от структуры молекулы. Молекула СО2 имеет линейное строение и, несмотря на полярность связи С=О, вследствие взаимной компенсации электрических моментов диполя, молекула СО2 неполярна (=0). В угловой молекуле воды полярные связи О-Н располагаются под углом 104,5, взаимной компенсации не происходит и молекула воды полярна (=0,6110-29 Клм).
studfiles.net
2.1.3. Водородная связь.
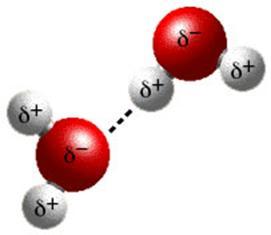
Структуру водородной связи мы с вами разберём на примере взаимодействия молекул воды между собой.
Молекула воды является диполем. Это объясняется тем, что атом водорода, связанный с более электроотрицательным элементом кислородом, имеющим неподелённую электронную пару, испытывает недостаток электронов и поэтому способен взаимодействовать с атомом кислорода другой молекулы воды.
В результате этого взаимодействия возникает водородная связь (Рис. 2.1):
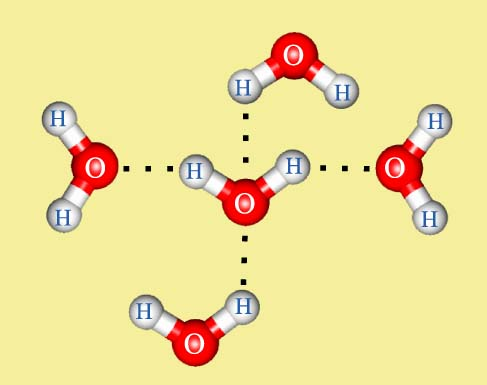
2.1. Механизм образования водородной связи между молекулами воды
Это объясняется тем, что атом водорода, связанный с более электроотрицательным элементом, имеющим неподелённую электронную пару (азотом, кислородом, фтором и др.), испытывает недостаток электронов и поэтому способен взаимодействовать с неподелённой парой электронов другого электроотрицательного атома этой же или другой молекулы.
В результате также возникает водородная связь, которая графически обозначается тремя точками (Рис. ):

Рис. 2.2. Механизм образования водородной связи между протоном (Н.δ+) и более электроотрицательными атомами серы(:Sδ-), кислорода (:Oδ-) и азота (:Nδ-)
Эта связь значительно слабее других химических связей (энергия ее образования 10-40 кДж/моль), и, в основном, определяется электростатическим и донорно-акцепторным взаимодействиями.
Водородная связь может быть как внутримолекулярной, так и межмолекулярной.
2.1.4. Гидрофобные взаимодействия
Прежде, чем рассматривать природу гидрофобного взаимодействия, необходимо ввести понятие «гидрофильных» и «гидрофобных» функциональных групп.
Группы, которые могут образовывать водородные связи с молекулами воды, называются гидрофильными.
К этим группам относятся полярные группы: аминогруппа (-Nh3), карбоксильная (-COOH), карбонильная группы (-CHO) и сульфгидрильная группа (-SH).
Как правило, гидрофильные соединения хорошо растворимы в воде. !!! Это обусловлено тем, что полярные группы способны образовывать водородные связи с молекулами воды.
Появление таких связей сопровождается выделением энергии, поэтому и возникает тенденция к максимальному увеличению поверхности контакта заряженных групп и воды (Рис. 2.3):

Рис. 2.3. Механизм образования гидрофобных и гидрофильных взаимодействий
Молекулы или части молекул, неспособные образовывать водородные связи с водой называются гидрофобными группами.
К этим группам относятся алкильные и ароматические радикалы, которые неполярны и не несут электрического заряда.
Гидрофобные группы – плохо или вовсе не растворимы в воде.
Это объясняется тем, что атомы и группы атомов, входящие в состав гидрофобных групп, являются электронейтральными и (поэтому) не могут образовывать водородных связей с водой.
!!! Гидрофобные взаимодействия возникают в результате контакта между неполярными радикалами, неспособными разорвать водородные связи между молекулами воды.
В результате этого молекулы воды вытесняются на поверхность гидрофильных молекул (Рис. 2.3).
2.1.5. Ван-дер-ваальсовы взаимодействия.
В молекулах существуют также весьма слабые и короткодействующие силы притяжения между электрически нейтральными атомами и функциональными группами.
Это так называемые ван-дер-ваальсовые взаимодействия.
Они обусловлены электростатическим взаимодействием между отрицательно заряженными электронами одного атома и положительно заряженным ядром другого атома.
Так как ядра атомов экранированы окружающими их собственными электронами от ядер соседних атомов, то возникающие между различными атомами ван-дер-ваальсовы взаимодействия весьма невелики.
Все эти типы взаимодействий принимают участие в формировании, поддержании и стабилизации пространственной структуры (конформации) белковых молекул (Рис. 2.4):
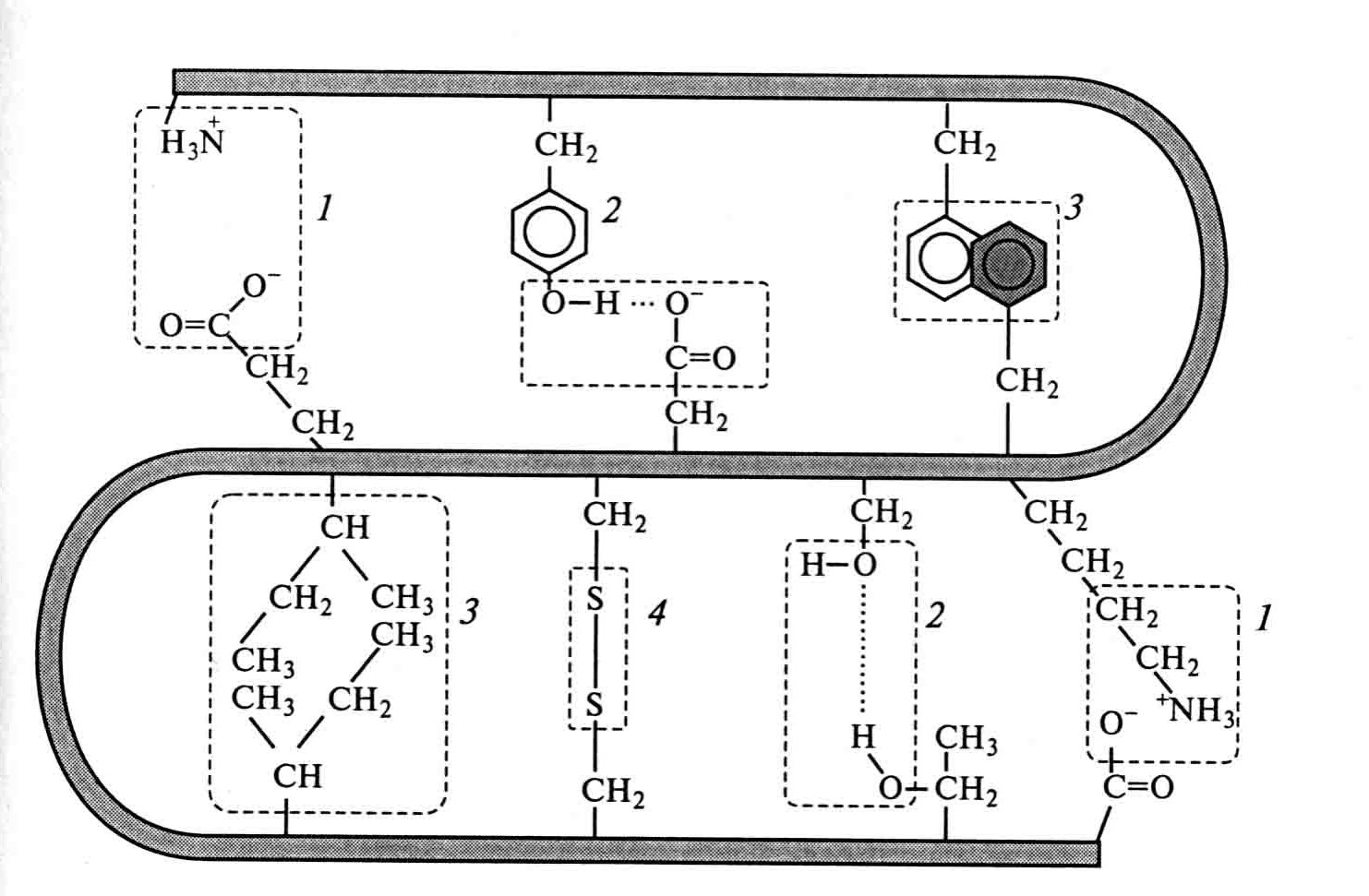
Рис. 2.4. Механизм образования ковалентных связей и слабых нековалентных взаимодействий: 1 - электро-статические взаимодействия; 2 – водородные связи; 3 – гидрофобные взаимодействия, 4 – дисульфидные связи
Силы, которые способствуют формированию пространственной структуры белков и удерживающие её в стабильном состоянии, являются очень слабыми силами. Энергия этих сил на 2-3 порядка меньше энергии ковалентных связей. Они действуют между отдельными атомами и группами атомов.
Однако, огромное число атомов в молекулах биополимеров (белков), приводит к тому, что суммарная энергия этих слабых взаимодействий становится сравнима с энергией ковалентных связей.
studfiles.net