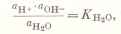Урок "Белки, свойства и значения". Белок вода
Функциональные свойства мышечных белков
В продуктах из мяса птицы белки выполняют множество различных функций. Свойства, характерные для определенных изделий, в частности выход, качество и органолептические показатели, зависят от успешного использования функциональных свойств белков в процессе переработки.
Под функциональными свойствами понимают физические и химические свойства белков, которые определяют их поведение в пищевых продуктах в процессе переработки, хранения и потребления. Они зависят от молекулярного строения и биохимических особенностей белка. Функциональные свойства белков оказывают влияние на многие показатели качества и органолептические характеристики продукта, ощущаемые и воспринимаемые потребителем. Понимание особенностей белков птицы, их свойств и функций необходимо для эффективного использования ингредиентов, разработки новых и модификации существующих продуктов, снижения количества отходов и контроля потребления энергии в ходе технологического процесса. Наиболее важные для конечного продукта функциональные свойства можно классифицировать на три общие категории:
- взаимодействия белок-вода;
- взаимодействия белок-жир;
- взаимодействия белок-белок.
Важность какого-либо функционального свойства может меняться в зависимости от вида продукта, мясного сырья, вида и концентрации немясных добавок, используемого технологического оборудования, условий и степени переработки. Функциональные свойства мышечных белков зависят от содержания в рецептуре других ингредиентов и от условий переработки. Любые их изменения в рецептуре продукта или технологическом процессе требуют оценки возможного влияния этих изменений на структуру мышечных белков. Например, изменения в рецептуре могут повлиять на pH, концентрацию соли и белка в продукте, что наряду с другими факторами вызывает изменение биохимических, а следовательно и функциональных свойств мышечных белков. Изменения условий переработки, особенно температуры продукта или степени измельчения, также могут повлиять на биохимические свойства белков. Все это отражается на их структуре и, следовательно, оказывает непосредственное влияние на качество конечного продукта. Зачастую потребность в определенном функциональном свойстве изменяется в процессе переработки. Так, растворимость, способность к связыванию воды и жира являются наиболее важными функциональными свойствами сырых продуктов из мяса птицы. Способность к удержанию воды и жира и к гелеобразованию крайне важны для мясных продуктов в процессе термообработки. Чаще всего необходима многофункциональность белков, то есть предполагается, что любой белок проявляет не одно, а несколько функциональных свойств либо одновременно, либо последовательно в процессе переработки.
Мышечные белки
Мясо птицы содержит примерно 20-23% белков. Мышечные белки по их растворимости можно разделить на три группы: миофибриллярные, саркоплазматические и белки стромы.
Таблица 1. Белки скелетных мышц птицы
|
I |
Миофибриллярные белки (55% от общего количества белков) |
|
|
Сократительные белки |
|
|
Пример: миозин, актин |
|
|
Регуляторные белки |
|
|
Пример: тропомиозин, тропонин |
|
|
Цитоскелетные белки |
|
|
Пример: тайтин, небулин |
|
II |
Саркоплазматические белки (35% от общего количества белков) |
|
|
Гликолитические ферменты |
|
|
Митохондриальные и окислительные ферменты |
|
|
Лизосомальные ферменты |
|
|
Миоглобин и другие гемовые ферменты |
|
III |
Белки стромы (3-5% от общего количества белков) |
|
|
Коллаген |
|
|
Эластин |
|
|
Ретикулин |
Миофибриллярные, или солерастворимые белки нерастворимы в воде, но большинство растворяется в растворах поваренной соли концентрацией более 1%. Эта группа состоит примерно из 20 отдельных белков, входящих в состав миофибрилл сократительной мышцы. Миофибриллярные белки могут быть разделены на три группы в зависимости от выполняемой функции: сократительные, которые ответственны за мышечные сокращения, регуляторные, участвующие в управлении процессом сокращения, и цитоскелетные, скрепляющие миофибриллы и способствующие сохранению их структурной целостности.
Сократительные белки миозин и актин оказывают большое влияние на функциональность мышечного белка. Поскольку в окоченевшей мышце актин и миозин находятся в виде актомиозинового комплекса, изменяется функциональность миозина как в эмульгированных, так и в формованных продуктах из мяса птицы. Свойства продуктов зависят также от общего соотношения актина и миозина и соотношения миозина и актина в свободном состоянии. Саркоплазматические белки и белки стромы, в свою очередь, влияют на функциональные свойства миофибриллярных белков.
Саркоплазматические белки растворимы в воде или в растворах с малой ионной силой (< 0,6 ммоль/куб. дм). В данную группу входят окислительные ферменты, миоглобин и другие гемовые пигменты, гликолитические ферменты, ответственные за гликолиз, и липосомальные ферменты. Миоглобин определяет цвет мяса, однако в целом белки этой группы вносят небольшой вклад в функциональные свойства белков мяса.
Белки стромы, часто называемые белками соединительной ткани, служат каркасом, поддерживающим структуру мышцы. Основным белком стромы является коллаген. Эластин и ретикулин составляют небольшую часть стромы. Все эти белки нерастворимы в воде и солевых растворах. Нежность мяса, как правило, уменьшается с увеличением возраста животных благодаря образованию поперечных связей и другим изменениям коллагена.
Кожа птицы является основным источником коллагена в рецептурах продуктов из мяса птицы. Хотя этот вид сырья обычно используют в качестве источника жира, его добавление приводит к увеличению содержания коллагена. При высоких концентрациях в рецептурах коллаген может оказывать влияние на функциональные свойства миофибриллярных белков. Он способен вызвать уменьшение размеров (усадку) продуктов из измельченного мяса, особенно при высокотемпературной обработке, а также влиять на связывание кусков мяса в формованных продуктах.
Роль белков в эмульгированных и формованных продуктах
При изготовлении эмульгированных продуктов из мяса птицы мясо, вода, соль, фосфаты и другие ингредиенты измельчают или перемалывают до образования пастообразной массы – мясной эмульсии. Эмульсией заполняют оболочку желаемой формы и подвергают термообработке.
Мясная эмульсия представляет собой сложную систему, состоящую из гидратированных мышечных белков, мышечных волокон, фрагментов миофибрилл, жировых клеток, капель жира, воды, соли, фосфатов и других компонентов. Эмульгированные продукты, такие как сосиски, копченые и вареные колбасы, содержат примерно 17-20% белка, 0-20% жира и 60-80% воды. Таким образом, относительно небольшое количество белка должно связать достаточно большое количество воды и жира. В рецептурах мясных продуктов для экстракции и гидратации миофибриллярных белков используется обычно 1,5-2,0% соли.
В процессе эмульгирования происходит измельчение мышечной ткани, то есть ее физическое разрушение путем повреждения сарколеммы (оболочки мышечной клетки) и внутренней сети из соединительной ткани. В присутствии соли мышечные волокна набухают, миофибриллы разделяются на более короткие части, миофибриллярные белки экстрагируются и гидратируются. Эти явления приводят к образованию вязкой пастообразной массы, которая удерживает воду и стабилизирует жир. Под воздействием тепловой обработки экстрагированные и гидратированные мышечные белки эмульсии образуют поперечно-связанную матрицу геля, которая удерживает внутри себя воду и жир, а также формирует текстуру, характерную для готовых эмульгированных продуктов.
Формованные продукты из птицы изготавливают из ломтиков или кусков мяса, связанных или склеенных друг с другом. Рулеты из мяса грудок индейки и куриное мясо ломтями (chickencoldcuts) являются типичными примерами таких продуктов. При производстве эмульгированных и формованных продуктов происходят одни и те же явления. Главное различие заключается в том, что при производстве формованных продуктов большинство изменений происходит на поверхности кусков мяса. Для разрушения мышечных клеток, расщепления мышечных волокон и извлечения миофибриллярных белков с поверхности кусков мяса применяют тумблирование, массирование или перемешивание в присутствии соли. На поверхности кусков мяса при этом образуется склеивающий слой из выделившихся миофибриллярных белков. При тепловой обработке этот белковый раствор превращается в гель, который действует подобно клею и удерживает куски мяса вместе. Считается, что наибольший вклад в скрепляющую способность белкового раствора вносит миофибриллярный белок миозин. Было установлено, что в присутствие коллагена на поверхности снижает сцепление между кусками мяса.
Взаимодействие белок-вода
В целом все функциональные свойства белков зависят от их взаимодействия с водой. Однако три свойства, зависящие от взаимодействия белок-вода, особенно важны для сырых продуктов из мяса птицы: извлечение (экстракция) и гидратация белков, влагоудерживающая способность, вязкость.
Термин «экстрагируемость» используется для описания того количества белка, которое освобождается или извлекается из миофибриллярной структуры в процессе обработки. При определенных внешних условиях экстрагированный мышечный белок растворим в водной фазе. Растворимость непосредственно зависит от распределения гидрофильных и гидрофобных аминокислот на поверхности молекул белка и термодинамики взаимодействий белок-вода. Экстрагируемость и растворимость мышечных белков зависят от рН, концентрации соли, вида солей и температуры.
Влагоудерживающая способность, как следует из названия, характеризует способность белкового матрикса удерживать влагу или абсорбировать добавленную воду при внешних воздействиях, таких как варка, центрифугирование и прессование. Вода может быть химически связана с белком, удерживаться за счет капиллярных сил или быть физически заключенной внутри белковой структуры. В высокоорганизованной миофибриллярной структуре белки химически связывают воду. Кроме того, вода удерживается физически в пространстве между волокнами. Влагоудерживающая способность также зависит от рН, от концентрации и вида присутствующей соли и температуры.
Вязкость, которая определяется в реологии как сопротивление течению, оказывает сильное влияние на стабильность сырого продукта перед тепловой обработкой. Вязкость мясного фарша увеличивается в процессе измельчения (куттерования), которое сопровождается набуханием мышечных волокон и абсорбцией ими воды. Экстрагированные белки, особенно крупные фибриллярные и хорошо растворимые, например миозин, могут увеличить вязкость растворов даже при очень малой концентрации. Вязкость фарша, с одной стороны, должна быть достаточно большой для обеспечения устойчивости сырого продукта, с другой стороны, не должна затруднять процессы перекачки и промежуточного накопления продукта на предприятии.
Добавление соли уменьшает электростатические взаимодействия между молекулами белка, что способствует увеличению экстрагируемости, растворимости и влагосвязывающей способности. Измельчение, или тумблирование мяса в присутствии соли приводит к разрушению мышечной ткани, способствует поглощению воды и набуханию мышечных волокон и в результате к увеличению вязкости мясного фарша. Вследствие солюбилизации и экстракции миофибриллярных белков происходит также разрушение структуры тонких и толстых нитей саркомера. Отдельные миофибриллы высвобождаются из мышечных волокон и дробятся на более короткие части. Экстрагированные белки, особенно миозин, также связывают воду и увеличивают вязкость фарша из мяса птицы, что способствует повышению устойчивости диспергированного жира. По этой причине в большинстве рецептур продуктов из мяса птицы дозировка соли составляет примерно 1,5-2,0%. Более высокая концентрация соли может увеличить влагоудерживающую способность фарша, однако это приводит к излишне соленому вкусу продукта.
На экстрагируемость, растворимость и влагоудерживающую способность мышечных белков влияет также рН фарша. В производстве продуктов из мяса птицы широко используются щелочные фосфаты, позволяющие повышать рН мясного фарша на 0,1-0,4 единиц рН, что приводит к увеличению влагосвязывающей способности мышечных белков.
В процессе переработки необходимо тщательно контролировать продолжительность и температуру измельчения для эмульсионных продуктов и тумблирования – для формованных продуктов. Избыточное измельчение или тумблирование могут привести к денатурации белка, а также к избыточному разрушению мышечных волокон и уменьшению вязкости фарша, что сопровождается снижением качества пространственной структуры белкового геля после тепловой обработки. Параметры измельчения и тумблирования должны быть подобраны таким образом, чтобы максимально увеличить степень экстракции белка, избегая при этом его денатурации.
Взаимодействие белок-жир
В грубо измельченных продуктах, таких как формованные продукты и многие колбасы, жир в основном сохраняется внутри неповрежденных жировых клеток. При их изготовлении обычно не возникает проблем, связанных с отделением жира в процессе переработки и тепловой обработки, так как он заключен внутри клеточных оболочек. Вязкость фарша и неповрежденные оболочки жировых клеток препятствуют появлению проблем, связанных с недостаточной связанностью жира.
В тонкоизмельченных эмульгированных продуктах, таких как колбасы и сосиски, жировые клетки разрушены, и жир находится в виде капель, образуя одну из фаз в эмульсиях. В эмульгированных продуктах капли жира образуют дисперсионную фазу, а непрерывная фаза состоит из воды, белков и солей. Для образования эмульсии необходима энергия, которая передается фаршу в процессе измельчения. Как правило, чем больше подводится энергии, тем меньше по размеру и многочисленнее образующиеся капли жира дисперсионной фазы фарша.
При высоких температурах и при достаточно большом поступлении энергии мембраны жировых клеток разрушаются, твердый жир плавится и эмульгируется, образуя жидкие капли. Основная часть жира птицы начинает плавиться при 13 °C, однако вследствие сложного липидного состава он плавится полностью лишь около 33 °С.
Капли жидкого жира нестабильны и со временем легко коалесцируют – маленькие жировые капли объединяются в крупные. Процесс этот крайне нежелателен, поскольку приводит к ряду дефектов качества эмульгированных продуктов. При достаточно низкой температуре жировые частицы могут находиться в частично кристаллизованном состоянии, и вероятность коалесценции в этом случае уменьшается.
Капли жидкого жира в тонкоизмельченных эмульгированных продуктах необходимо стабилизировать, чтобы избежать нежелательных изменений при переработке, перекачке и тепловой обработке. Этого можно достичь двумя способами. Во-первых, коалесценции препятствует высокая вязкость фарша. Во-вторых, наличие вокруг жировых капель белковой оболочки уменьшает межфазовое поверхностное натяжение между жиром и водой (то есть между диспергированной и непрерывной фазами) и стабилизирует капли.
Концентрация белка должна быть достаточно высокой, чтобы его молекулы могли взаимодействовать друг с другом и образовывать устойчивую непрерывную пленку на поверхности жировой капли. Общее количество растворимого белка также должно быть большим, чтобы образовать оболочки вокруг всех жировых капель. Существует еще одна причина возможной нестабильности тонкоизмельченных эмульгированных продуктов – мелкие жировые капли имеют большую площадь поверхности и для образования вокруг них стабильной белковой оболочки необходимо большее количество гидратированного белка. Миозин является главным компонентом оболочки, окружающей жировые капли, и считается, что он играет ключевую роль для обеспечения устойчивости жировых капель в процессе хранения и на ранних стадиях тепловой обработки.
Взаимодействие белок-белок
В процессе тепловой обработки взаимодействие молекул белка друг с другом приводит к формированию матрикса из белкового геля. Белковый гель образуется при нагревании в результате разворачивания и агрегирования мышечных белков, образующих прочную непрерывную поперечно связанную пространственную сеть, или матрикс. Образование непрерывной структуры белкового геля существенно влияет на текстурные и органолептические свойства, а также на выход продуктов из мяса птицы при тепловой обработке. Миофибриллярные белки образуют гель при термообработке как эмульгированных, так и формованных продуктов, и, по-видимому, гелеобразование является наиболее важным для готовых мясных продуктов, подвергаемых тепловой обработке, функциональным свойством белков. Однако на способность миофибриллярных белков образовывать прочный гель могут влиять саркоплазматические белки и соединительная ткань.
Миофибриллярные белки образуют термически необратимые гели. Это означает, что поперечная сшивка за счет химических связей, образующихся между белками в процессе нагрева, практически не изменяется при охлаждении или повторном нагреве.
Белковые гели удерживают в сетчатой структуре большое количество воды, связанной как в результате химических реакций, так и механически захваченной в ячейки. Матрикс белкового геля физически предотвращает коалесценцию жира в термообработанном мясном фарше. Под воздействием нагревания образуются также поперечные связи между белковой пленкой, окружающей жировую каплю, и непрерывным матриксом белкового геля.
В зависимости от рН и концентрации соли могут образовываться гели со структурой разного типа, что обуславливает получение продуктов с разными текстурными и влагоудерживающими свойствами. Как правило, при рН от 6 до 6,5 получаются эмульгированные продукты с максимально прочной текстурой и приемлемой упругостью. При более низких значениях рН, близких к pIмышечных белков, получаются гели с мягкой текстурой и слабой влагоудерживающей способностью, так как белки переходят в нерастворимое состояние и сильно агрегируются.
В общем случае миофибриллярные белки птицы начинают денатурировать при температуре примерно 40 °С, точка их гелеобразования достигается при температуре около 55 °С. Прочность геля и влагоудерживающая способность в процессе тепловой обработки повышаются до температуры 65-70 °С. Нагревание свыше 70 °С зачастую плохо влияет на качество гомогенизированных продуктов вследствие избыточной агрегации белка внутри сетки геля, что приводит к синерезису – отделению воды из продукта. Причиной синерезиса и выделения влаги при температурах свыше 70 °С может также быть желатинизация белка стромы – коллагена. На структуру образующегося геля и соответственно на качество готовых продуктов из мяса птицы может также влиять скорость нагрева. Считается, что при низкой скорости формируются гели с более упорядоченной структурой и соответственно с большей влагоудерживающей способностью. Например, для образования структуры белкового геля с высокой влагоудерживающей способностью сосиски с низким содержанием жира следует прогревать с меньшей скоростью, чем такой же продукт, содержащий больше жира.
Модельные системы в исследовании функциональных свойств белка
С увеличением ассортимента продуктов из мяса птицы все большую важность приобретает необходимость изменения и контроля функциональных свойств белка. Изучение этих свойств может привести к более глубокому пониманию изменений, происходящих в процессе изготовления и термообработки эмульгированных и формованных продуктов из мяса птицы. Целенаправленная модификация функциональных свойств белков может применяться в целях использования более дешевых или нетрадиционных источников мясного сырья, улучшения качества существующих продуктов и более эффективного использования немясных компонентов. Кроме того, изменение функциональных свойств белков мяса птицы позволяет снизить энергетические и технологические затраты, а также количество отходов производства.
Для исследования функциональных свойств белков мяса птицы было разработано множество различных модельных систем. Наиболее простым решением является использование определенной мышцы в тонкоизмельченном виде. Однако в такой системе зачастую бывает очень сложно выявить действительные причины и следствия из-за огромного количества составных частей и возможных взаимодействий. Поэтому в целях ограничения числа ингредиентов и снижения уровня сложности применяются более простые. Так, для установления функций белков в продуктах из мяса птицы использовались модельные системы на основе фракционированных белков, включающих в себя миофибриллы, миофибриллярные белки, солерастворимые белки, актомиозин и даже миозин.
Так как состав белков в конкретной фракции зависит от способа подготовки, то зачастую сложно сравнивать результаты, полученные в разных исследованиях модельных систем. Например, фракция солерастворимых белков состоит из смеси 15 и более белков, взаимодействующих при нагревании. Известно, что состав солерастворимой фракции может меняться в зависимости от условий экстракции и исходного материала. Таким образом, разные количества общего миозина или различное соотношение актина и миозина в солерастворимой фракции могут влиять на получаемые результаты исследований. С учетом этих факторов выбор испытательной системы следует осуществлять с особой тщательностью. При проведении исследований по разработке продукта наилучшее решение – работать с реальным продуктом или выбрать систему, как можно более близкую к нему. При проведении более фундаментальных исследований лучше начинать с упрощенной системы, например с чистого миозина, а затем переходить к более сложным, что позволит проверить, сохраняются ли закономерности, установленные для простой системы, при добавлении других компонентов.
Источник: книга «Переработка мяса птицы» (под ред. Алана Р.Сэмса, пер. с англ. под ред. В.В.Гущина)СПб, «Профессия», 2007г.
sfera.fm
Белки с водой - Справочник химика 21
Водоудерживающая способность, как и растворимость, одновременно зависит от степени воздействий как белков с водой, так и белка с белком, и поэтому от конформации и степени денатурации данного белка. Ввиду этого тепловая обработка оказывает сильное воздействие на это функциональное свойство. Влияние температуры на удерживание воды особенно тщательно исследовано применительно к мясу. В данном случае, начиная с 40 °С и выше, происходит денатурация белков, которая выражается в уменьшении количества групп кислого характера и снижения гидратации продукта [16]. [c.516] В настоящем исследовании предложен критический тест для оценки относительной важности перекрестной релаксации, в которую вовлечены протоны как воды, так и белка в системах гидратированных белков. Кроме того, с успехом продемонстрировано, что температурная зависимость релаксации как в воде, так и в белке определяется в основном движениями в водной фазе, а не движениями в твердой фазе типа вращений метильных групп. Хотя авторы не пытались дать детального ана- лиза, очевидно, что картина поведения воды на границе раздела с белком, согласующаяся с данными по ЯМР-релаксации, характеризуется быстрым и в некоторой степени анизотропным движением. Структурные модели взаимодействия белков с водой должны находиться в согласии с предположением, что вода сохраняет свойства жидкости на границе раздела фаз. Однако не менее важно отметить, что временная шкала, соответствующая описанным выше экспериментам, все же достаточно длинна по сравнению с временами корреляции вращения или временами диффузии, которые обычно характерны для воды в истинно жидком состоянии. [c.158]Поскольку при определении парциального удельного объема допускается, что объем смеси белка с водой равен сумме объемов каждого компонента, то гидратация белка в расчет здесь не принимается. Поэтому оценить степень гидратации по величине V2 не представляется возможным. Тем не менее эта вели- [c.177]
В желудке имеется фермент пепсин, обладающий способностью очень эффективно катализировать реакцию гидролиза белков на аминокислоты (т. е. расщеплять пептидную связь при взаимодействии белков с водой). Наиболее эффективно пепсин действует в кислых растворах. Желудочный сок обладает сильной кислотностью — его pH 0,8, а следовательно, он обладает большей кислотностью, чем 0,1 М раствор соляной кислоты. [c.491]
Количественным методом измерения числа пептидных групп, связанных друг с другом водородными связями, служит изучение кинетики изотопного обмена полипептида, или белка с водой. Этот метод был развит с помощью техники дейтериевой метки Лиидерштрём-Лангом и с помощью тритиевой метки в нашей лаборатории. Речь идет о скорости обмена имидного водорода пептидной группы с растворителем. Известно, что в низкомолекулярных полипептидах этот атом водорода обменивается с водой неизмеримо быстро. Здесь он подобен подвижному водороду [c.47]
Частичный, очень небольшой гидролиз может быть вызван одним нагреванием белка с водой, но глубокого гидролиза можно достигнуть, только катализируя этот процесс нагреванием е кислотами или щелочами или действием ферментов. [c.34]
Сравнительная характеристика методов, применяемых для оценки величины и формы белковых молекул Глава VII. Электрохимия белков. Взаимодействие белков с водой. [c.4]
Глава VI ВЗАИМОДЕЙСТВИЕ БЕЛКОВ С ВОДОЙ [c.100]
ВЗАИМОДЕЙСТВИЕ БЕЛКОВ С ВОДОЙ [c.101]
При умеренной засухе (первая фаза) увеличивается содержание воды, оставшейся в клетках после взаимодействия их с гипертоническим раствором. Это может означать увеличение содержания связанной воды в результате усиления взаимодействия белков с водой. При сильной засухе (вторая фаза), когда [c.42]
Вода тканей является не просто растворителем или инертным компонентом она выполняет существенную структурную и функциональную роль. Например, взаимодействие белков с водой обеспечивает их конформацию с преимущественным расположением гидрофильных групп на поверхности белковой глобулы, а гидрофобных — внутри. Еще большее значение имеет вода для структурной организации биологических мембран и их основы —двойного липидного слоя, в котором гидрофильные поверхности каждого монослоя взаимодействуют с водой, отграничивая от нее гидрофобное пространство внутри мембраны, между монослоями. [c.387]
Компенсационный эффект свойствен ферментативным процессам. Так, при гидролитическом расщеплении эт-илового эфира Ы-ацетил-Е-триптофана химотрипсином АР очень мало, а ДЯ и Д5 велики. В сущности, почти все данные, пр 1веденные в последних трех столбцах табл. 6.2, свидетельствуют о компенсации. Связывание ряда ингибиторов ацетилхолинэстеразой также сопровождается компенсацией — ДЯ варьирует в этих процессах от —7 до +2 ккал/моль, а Д5 от —10 до - -20 кал/моль-град [26. Если здесь справедливо предположение об определяющей роли воды, то нужно установить, как влияет на поведение белковых молекул окружающая водная структура. Ламри и Ражендер считают, что связь белка с водой проявляется в изменении объема белковой молекулы в ходе реакции. Как будет показано в 6.5 и 6.7, ферментативная активность зависит от конформационных превращений белка и, тем самым, глобулы могут изменять свой объем. Изменение энергии водно-белковой системы можно представить в виде [c.372]
При попытках выяснить, предсуществуют ли (или, как часто говорили, преформированы ли) выделенные дикетопиперазины в молекуле белка, необходимо было исключать все случаи, когда применение метода гидролиза вело к образованию дикетопиперазинов из дипептидов или аминокислот, т. е. все случаи, когда гидролиз проводили нагреванием белков с водой или слабой кислотой под давлением, а также при гидролизе и экстракции, когда имеется опасность образования тех эфиров пептидов или аминокислот, которые, как известно, легко образуют дикетопиперазины. [c.98]
chem21.info
БЕЛКИ И ВОДА - Справочник химика 21
Биофизика мембран. Биологические мембраны — это тонкие (- 80 А) листки из липидов и белков. Они играют ключевую роль во многих жизненных процессах, но об их структуре известно мало. Большая часть физических экспериментов (например, ЯМР) не может быть осуществлена на отдельной мембране, поскольку она содержит слишком мало вещества. Однако можно создать модельную систему из липидов и воды или даже из липида, белка и воды [58], имеющую ламеллярную (слоистую) структуру. Предполагается, что каждый отдельный слой будет в некотором смысле аналогом мембраны. Можно использовать достаточно большие образцы объемной фазы этого типа, чтобы проводить точные физические исследования ). [c.34] Прочность адсорбционных межфазных слоев водных растворов белков на границе с различными углеводородами неодинакова. Нами была предпринята попытка объяснить это явление с учетом результатов исследования взаимодействия этих же углеводородов с белками в водном растворе (солюбилизации углеводородов) [159, 160]. Было установлено, что взаимодействие белков с углеводородами в водных растворах является самопроизвольным обратимым процессом, механизм которого заключается в распределении углеводородов между неполярными областями макромолекул белка и водой. [c.215]Протоплазма состоит преимущественно из белков и воды, но содержит также жиры, сахара, соли и другие соединения. Белки — гидрофильные коллоиды их сильное химическое сродство к воде обусловлено в значительной степени гидрофильными группами аминокислотных боковых цепей, расположенных вдоль полипептидного состава белковой молекулы. Некоторые из этих боковых цепей содержат неполярные углеводородные участки, не имеющие сродства к воде однако атомы кислорода и азота гидрофильны, и молекулы воды вокруг них оказываются строго ориентированными, главным образом вследствие образования водородных связей. [c.146]
Первому набору контуров приписывается нулевая энергия (пунктирный контур на рис. 11.1). Если для этого контура выбрать более низкое значение энергии, то любая часть объема, которая не находится на расстоянии 6 А по прямой по крайней мере от одного из атомов белка, будет ошибочно рассматриваться как недоступная для растворителя. Однако не весь объем в пределах контура с нулевой энергией доступен для растворителя. Взаимодействия валентно несвязанных атомов каждой молекулы воды в кристалле должны быть вполне энергетически выгодны, если для молекулы воды предпочтительно кристаллическое окружение по сравнению с водным раствором, находящимся в равновесии с кристаллом. Поэтому положение, для которого энергия взаимодействия между белком и водой равна нулю, может быть занято молекулой воды лишь в том случае, если для молекулы воды в этом положении возможно несколько энергетически выгодных взаимодействий. [c.204]
Устойчивость раствора высокополимеров в полярных растворителях в значительной степени связана с сольватацией полярных групп. Раствор полимера образуется в том случае, если притяжение белка и воды значительно больше взаимного притяжения молекул полимера. Добавление органического растворителя к раствору белка вызывает уменьшение притяжения полярных групп фермента к молекулам воды, так как уменьшается количество молекул воды, присоединяющихся к полярным группам белка. Уменьшение притяжения активных групп фермента к молекулам воды обусловлено главным образом снижением диэлектрической постоянной среды. [c.143]
Для выяснения причин различной прочности межфазных адсорбционных слоев белков на разных углеводородных границах исследовалось взаимодействие этих же углеводородов с белками в водном растворе (солюбилизация углеводородов) [24]. Было установлено, что взаимодействие белков с углеводородами в водных растворах является самопроизвольным обратимым процессом, механизм которого заключается в распределении углеводорода между неполярными областями макромолекулы белка и водой. Вычислено изменение свободной энергии при связывании углеводородов, которое составляло 2— [c.48]
ГЕНЫ, БЕЛКИ И ВОДА [c.252]
Стокер [734] предположил, что реакция протоплазмы на недостаток воды проходит две стадии первая из них связана с уменьшением вязкости и увеличением проницаемости, а вторая, наоборот, — с увеличением вязкости и уменьшением проницаемости. Во время первой стадии, как полагает Стокер, связи между белком и водой ослабевают, а во время второй они восстанавливаются вновь, но уже в иной конфигурации. Возможно, что две противоречащие друг другу группы данных, о которых мы только что говорили, можно согласовать на этой основе. [c.200]
При локализации метки в наружном водном слое значение Тс составляет 10 -е- 10 ° с (рис. Х.12). Поверхностные слои, в которые входят боковые группы белков и вода в щелях , характеризуются Тс 10 ° -е- 10 с. В более глубоком слое глобулы, где включены внешние полипептидные цепи, стиснутые боковые группы и прочносвязанная вода, Тс повышается до 10 -10 с. Это ясно свидетельствует о замедлении скорости вращения метки по мере ее погружения, что соответствует существованию более плотного ядра глобулы по сравнению с рыхлой опушкой (см. 2 гл. УП). В целом времена корреляции, поддающиеся определению методом спиновых меток, находятся в диапазоне 0,1-300 не, хотя в последние годы интенсивно развиваются методы, позволяющие определять Тс спиновых меток до 10 -10 " с. [c.278]
Таким образом, в первой (приспособительной) фазе ответной реакции растения на действие засухи происходит усиление взаимодействия основных структурных ингредиентов цитоплазмы— белков и воды. Результатом является повышение стабильности цитоплазмы и увеличение водоудерживающей способности клеток листа, подтвержденное специальными экспериментами [104]. Эти изменения позволяют растению с меньшими потерями перенести умеренную засуху. Во время второй фазы ответной реакции начинается разупорядочение цитоплазмы, способное привести к гибели растения. [c.44]
Известно, что объемистая гуанидиновая группа занимает гидрофобные области белка с меньшей вероятностью, чем аминогруппа. Поэтому замена последней группы на первую должна стабилизировать структуру белка. Данные о скорости обмена тритием между белком и водой действительно согласуются с предположением о менее гибкой структуре модифицированного белка. [c.108]
В. Применение метода к кристаллу ИТПЖБ. Система, подлежащая моделированию, состоит из атомов белка одной молекулы ИТПЖБ [5] и 140 молекул воды. Требуемое число молекул воды можно рассчитать и из объема кристалла, для которого энергия взаимодействия белок — вода равна нулю или отрицательна (пространство растворителя) [9], и из объема элементарной ячейки и плотности белка и воды. Взаимодействия вода — белок рассчитывались, как описано выше, а взаимодействия белок — белок — по методу, изложенному в работе [23]. Расчет взаимодействий между молекулами воды вели, используя модель 5Т2, введенную Раманом и Стиллинджером [11] при моделировании жидкой воды методом молекулярной динамики. [c.211]
Проведены сравнительные исследования общего содержания бел ка (среднее значение четырех отдельных определений) сыворотки животных с предопухолевыми изменениями и раком молочной железы. Не были обнаружены такие различия, которые могли бы объяснить повышение Фактически, по данным Hollis и сотрудников (1974), незначительное увеличение концентрации белка приводит к удлинению Данные о том, что почти одни и те же значения концентрации белка в сыворотке крови обнаружены у мышей с двумя типами предопухолевых узлов и у животных с двумя типами злокачественных опухолей, ставят вообще под вопрос роль этого фактора в повышении значений Для того чтобы снизить концентрацию белка в сыворотке крови, животные были посажены на безбелковую диету. Сыворотка этих мышей, получавших в течение 5 дней глюкозу, имела низкую концентрацию белка (3,8 мг %), тогда как у контрольных животных содержание белка было 4,95 мг%. Однако значения сыворотки этих животных не отличались от контрольных. Следовательно, полученные результаты не подтверждают идею о том, что значения сыворотки являются только функцией концентрации белка и воды. [c.284]
Миелиновые оболочки являются доминирующим элементом белого вещества, составляя 50% его сухого веса, и имеют самое высокое содержание липидов, низкое содержание белка и воды. Миелин довольно дегидратированная структура, в нем около 40% воды (немиелиновая часть белого вещества содержит 80% воды). Твердый остаток миелина в среднем содержит 70—80% липидов и 20—30% белка. Липиды миелина ЦНС содержат 25—28% холестерина, 27—30% галактосфинголипидов, 40—45% фосфолипидов. В табл. 27 представлены данные по химическому составу миелина. [c.111]
chem21.info
Взаимодействия вода белок - Справочник химика 21
Теплоемкость. Измерения удельной теплоемкости систем, содержащих белки, представляют особый интерес по нескольким причинам 1. Они отражают влияние сольватации неполярных участков в дополнение к гидратации других частей поверхности белка и поэтому могут рассматриваться как наиболее совершенная термодинамическая характеристика взаимодействий вода — белок. 2. Теплоемкость удобно измерять как в растворе, так и в твердых образцах, поэтому можно сопоставить результаты исследования теплоемкости этих двух групп образцов. [c.117] По нашему мнению, продолжительность жизни молекулы воды в гидратационном слое по порядку величины составляет 10 с, т. е. примерно в 100 раз больше, чем время, требуемое для молекулы воды, чтобы разорвать и снова образовать несколько водородных связей, которые ограничивают ее движение в чистом растворителе. Тем не менее это время достаточно мало, чтобы его можно было рассматривать как характеристическое время для движения молекул жидкости. Разъяснение данной точки зрения и другие аспекты динамики взаимодействий вода — белок и белок — вода — белок в растворах белков и являются предметом настоящей статьи. Ниже представлены данные и выводы, следующие из результатов использования очень эффективного экспериментального метода, который, не будучи уже новым, применяется только в нашей и еще очень немногих лабораториях. Авторы измерили зависимость скорости магнитной спин-решеточной релаксации ядер растворителя (воды) в растворах белка от величины магнитного поля. Этому методу дали сокращенное название ЯМР-д (дисперсия ядерной магнитной релаксации). Опыты по ЯМР-д показали, что на быстрое вращательное броуновское движение молекул растворителя (воды) накладывается в результате функционирования механизма взаимодействия (еще не вполне понятого) очень небольшая по величине компонента, которая имитирует намного более медленное вращательное движение молекул белка [6, 7]. Кроме того, в экспериментах по ЯМР-д измеряются усредненные свойства всех молекул растворителя, так что время жизни молекул воды в гидратационном слое выступает в качестве естественного параметра во многих моделях, которые объясняют эти данные. Можно добавить, что данные по ЯМР-д прямо указывают на довольно быстрое ориентационное броуновское движение. Поэтому появляется возможность изучения микроскопической вязкости растворителя вблизи белковой молекулы в широком диапазоне значений pH, в присутствии различных буферов и т. д., что не всегда удается сделать с помощью других методов. [c.162]Надо подчеркнуть, что, хотя нам предположительно известно происхождение члена А, причинный механизм однозначно не установлен. Безусловно, на этот счет не существует никакой теории [7]. Поэтому вопрос остается открытым. Тем не менее экспериментальные подходы и получаемые при этом данные сами по себе крайне полезны при исследовании взаимодействий вода — белок и белок — белок. [c.176]
Присутствие в воде растворенного белка накладывает на быстрое броуновское движение растворителя-воды небольшую по величине, но измеримую компоненту, которая характеризует более медленное броуновское движение молекул белка. Это явление известно около 10 лет, и сначала его наблюдали как увеличение скорости магнитной релаксации протонов растворителя. С тех пор оно было изучено более глубоко путем исследования зависимости релаксации протонов и дейтронов растворителя от величины магнитного поля. Полученные данные несут необычайно богатую информацию о взаимодействиях вода— белок и белок—белок как в растворах, так и в суспензиях клеток. Однако природа лежащих в их основе взаимодействий растворитель—растворенное вещество остается весьма неясной. Для проверки концепции связанной воды, по которой ведется дискуссия, были проведены измерения на растворах белков в смешанном растворителе h3O/D2O. Данные этих измерений неожиданно указывают на взаимодействия между протонами белка и растворителя по механизму перекрестной релаксации. Эти последние результаты дают основание предположить, что интерпретация увеличивающейся информации о релаксационных измерениях образцов тканей нуждается в перепроверке, а возможно, и в новой интерпретации. [c.182]
Моделирование взаимодействий вода — белок в кристалле белка [c.202]
МОДЕЛИРОВАНИЕ ВЗАИМОДЕЙСТВИИ ВОДА - БЕЛОК 211 [c.211]
Г. Результаты. На рис. 11.2 показаны изменения средней энергии в расчете на одну молекулу и средние энергии взаимодействий вода — белок и вода — вода во время моделирования. Энергия уменьшалась в течение первых 30 000 шагов, поэтому первые 30 000 конфигураций были отброшены. Следующий набор из 50 000 конфигураций использовали в качестве статистической модели. Процент удачных перескоков молекул воды на первом этапе моделирования уменьшился и достиг при равновесии примерно 27о- Увеличение числа шагов до 80 000 потребовало 10 ч машинного времени на ЭВМ 370/165. [c.212]
I — общая энергия 2 — энергия взаимодействия вода — вода 3 — энергия взаимодействия вода — белок. [c.213]
Теоретический подход, реализованный в работах Стиллинджера (1), Карпласа (2) и Германса (11), становится все более и более продуктивным. Если говорить кратко, то энергии взаимодействия вода — вода относительно велики в случае несвязывающих взаимодействий, а взаимодействия вода — белок в грубом приближении сравнимы по величине, что делает поверх- [c.11]
Измерение релаксационных свойств. Для изучения взаимодействий вода — белок в растворе и в гидратированных порошках был использован метод ЯМР [2]. Хилтон и др. [24] показали, что вода в частично гидратированных порошках лизоцима по своей подвижности лучше всего может быть охарактеризована как вязкая жидкость. С помощью спектров диэлектрической релаксации удается различить два типа воды один с временем релаксации около 0 с и другой, обнаруживаемый при степенях гидратации выше 0,3, с временем релаксации около 2-10-1 с, что близко к значению времени релаксации для объемной воды. Разрыв в плавном ходе изменения диэлектриче- [c.125]
В настоящее время опыт опережает теорию. Предложенные модельные механизмы авторы смогли изложить на количественном уровне лишь в одном случае, а именно для зависимости реориентационного времени релаксации белка от концентрации последнего. Тем не менее в этой работе удалось прояснить различие между макроскопической и микроскопической вязкостью, измерить взаимодействия белок — белок внутри клеток и продемонстрировать перенос намагничиваемости от протонов белка к протонам растворителя. Все это согласуется с динамикой взаимодействий вода — белок, которая и явилась предметом обсуждения. [c.181]
В. Применение метода к кристаллу ИТПЖБ. Система, подлежащая моделированию, состоит из атомов белка одной молекулы ИТПЖБ [5] и 140 молекул воды. Требуемое число молекул воды можно рассчитать и из объема кристалла, для которого энергия взаимодействия белок — вода равна нулю или отрицательна (пространство растворителя) [9], и из объема элементарной ячейки и плотности белка и воды. Взаимодействия вода — белок рассчитывались, как описано выше, а взаимодействия белок — белок — по методу, изложенному в работе [23]. Расчет взаимодействий между молекулами воды вели, используя модель 5Т2, введенную Раманом и Стиллинджером [11] при моделировании жидкой воды методом молекулярной динамики. [c.211]
chem21.info
Питательные вещества - белки, жиры, углеводы, минералы, витамины, вода

Это основные полезные вещества, получаемые из пищи. Они используются для поддержания жизнеспособности тканей, их обновления, выработки энергии для физиологической активности и регуляции метаболизма (обмена веществ). Потребность в них испытывается в течение всей жизни, причем каждое вещество выполняет определенные функции.
Усвоение полезных веществ происходит после их расщепления. В чистом виде они не усваиваются. Расщепленные ферменты просачиваются сквозь стенки пищеварительного тракта, попадая в кровь. Получаемые из питания белки, жиры и углеводы обеспечивают организм топливом в виде калорий. Вода, минералы, витамины выполняют функции строительного и расходного материала, что не менее важно.
Белки
Необходимы для роста и восстановления тканей, а также для нормального осуществления химических реакций в организме. Также белки содержат в себе аминокислоты, обеспечивают пластические процессы в тканях и восстанавливают затраченную энергию (читайте подробнее про белки). Большое количество белков содержится в мясе, птице, рыбе, молочных продуктах, яйцах, бобовых, орехах.

Жиры
Необходимы для обеспечения пластичности тканей, здоровья кожи, волос, ногтей, участвуют в обновлении клеток организма, помогают усваиваться витаминам, участвуют в выработке энергии (читайте подробнее про жиры). Жиры содержатся в растительных продуктах (орехах, растительных маслах, авокадо, оливках, сое) и продуктах животного происхождения (молочных продуктах, мясе, птице, рыбе).
Углеводы
В первую очередь нужны для выработки жизненно необходимой энергии для организма. Углеводы участвуют в образовании клеток, химических реакциях. Без углеводов невозможна нормальная работа организма, мозга, мышц и клеток. Углеводы делятся на простые (моносахариды - глюкоза, фруктоза, сахароза) и сложные (полисахариды - крахмал, клетчатка, гликоген, пектины). Большое количество простых углеводов содержится в мучных изделиях, сладостях, фруктах, меде, вареньях, сладких и газированных напитках, мороженом. Избыточное количество простых углеводов вредно для здоровья и фигуры (читайте подробнее про простые и сложные углеводы и их влияние на организм). Сложные углеводы содержатся в злаковых, бобовых, картофеле, макаронных изделиях. В отличие от простых углеводов, которые быстро попадают в кровь, сложные углеводы расщепляются и усваиваются гораздо медленнее, попадают в кровь постепенно, поэтому надолго дают чувство сытости.

Клетчатка (пищевые волокна)
Вид сложных углеводов, которые представляют собой грубые растительные волокна. Они очень полезны для микрофлоры кишечника, так как не перевариваются и выходят из пищеварительного тракта, очищая организм от шлаков и токсинов. Клетчатка улучшает работу желудочно-кишечного тракта, повышает сопротивляемость различным заболеваниям (подробнее про клетчатку читайте здесь).
Минералы
(Макро- и микроэлементы) отвечают за прочность опорно-двигательного аппарата, водный и кислотно-щелочной баланс, способствуют соединению белков с жирами, укрепляют нервную систему и участвуют в большинстве химических реакций. Недостаток какого-либо минерала в организме тормозит активность остальных минеральных веществ.
Витамины
Витамины играют важнейшую роль для здоровья человека и, в частности, для регуляции обменных процессов и формирования иммунитета. Недостаток витаминов в организме выражается в нарушениях обмена веществ или неполноценной работе отдельных органов. Витамины мы получаем главным образом с растительной пищей. У каждого из витаминов есть своя особая функция, свои процессы, в которых он является необходимым участником (подробнее здесь).

Вода
Недаром воду называют эликсиром жизни. Вода участвует во всех жизненно важных химических процессах организма. Она осуществляет транспортировку веществ и гормонов ко всем органам, питает клетки, активизирует работу почек. Только насыщенные водой клетки способны эффективно растворять жиры.
fit-cook.ru
Урок "Белки, свойства и значения"
Разделы: Химия
Тип урока: комбинированный.
Задачи:
- образовательные:– знать свойства белков и их значение; – знать цветные реакции на белки, на обнаружение каких видов связи; – уметь доказывать амфотерные свойства белков; – уметь устанавливать причинно– следственные связи при изучении свойств и строения;
- воспитательные– формирование научного мировоззрения; – воспитание трудолюбия, настойчивости, сознательной дисциплины;
- развивающие– способствовать развитию логического мышления (умению сравнивать, выделять главное)
Оборудование и реактивы: таблицы, раствор белка, раствор спирта, HNO3. CuSO4. NaOH. (Ch4 COO)2 Pb, HCl , спиртовка, держатель, пробирки, спички.
“Единственный путь, ведущий к знанию – это деятельность” (Б.Шоу.)
Ход урока
I. Актуализация знаний о строении, структуре белков.
Вопросы для актуализация знаний:
- Какие элементы входят в состав белка?
- В каких пределах изменяется молекулярная масса белков? (От нескольких тысяч до нескольких миллионов Mr белка яйца = 36.000, Mr белка мышц = 1.500.000.)
- Кто из ученых предложил пептидную теорию, которая стала ключом к тайне строения белка? (Русский ученый А.Я. Данилевский, немецкий ученый Э.Г.Фишер.)
- В чем суть этой теории? (Белки – это полимеры, состоящие из остатков аминокислот, соединенных пептидной связью HN–CO.)
- Какое еще название белков из этого следует? (Пептиды.)
- На какие группы делят белки по степени сложности? (Простые – протеины – состоящие только из остатков аминокислот, сложные – протеиды – имеющие еще и небелковый компонент: липопротеиды– кроме белкового компонента содержат липиды, фосфопротеины – содержат фосфорную кислоту.)
- Какова структурная организация белков? (Различают первичную, вторичную, третичную, четвертичную, структуру белков.)
- Что представляет первичная структура белка? (Строго определенная последовательность аминокислотных остатков полипептидной цепи, все связи ковалентные.)
- 9) Что представляет вторичная структура белка? (Белковая макромолекула, свернутая в спираль, между витками которой водородные связи.)
- 10) Что такое третичная структура белка? (Спиралевидная пептидная цепь, уложенная в клубок-глобулу, за счет водородных, гидрофобных, дисульфидных связей.)
- 11) Какова четвертичная структура белка? (Сложный агрегатный комплекс из полипептидных цепей, в котором присутствуют все перечисленные типы связей.)
II. Изучение нового материала.
А. Определение темы урока.
Мне хотелось бы продемонстрировать небольшой эксперимент. В 3 пробирках находятся: белок куриного яйца, кожа, волосы. Наливаем воду и пытаемся растворить вещества в воде. Какие вещества? (Белки.) А отношение веществ к воде называется……свойством, причем…..физическим. Сформулируем тему урока“ Свойства белков”. Вернемся к нашему опыту. Белок куриного яйца растворился в воде, образовав коллоидный раствор, а белки кожи и волос в воде не растворились. Поэтому по отношения к воде белки делятся на растворимые и нерастворимые. Продолжим знакомство со свойствами белков в процессе исследования.
Б. Поисковый этап.
Ученики разбиты на творческие группы, каждая из которых получает задание и необходимые реактивы для проведения эксперимента. В процессе работы заполняют протокол исследования.
| Взаимодействующие вещества | Условия | Наблюдения | Вывод |
1-я группа. Тема “Гидролиз белка под действием ферментов”.
Цель исследования: изучение гидролиза белков под действием желудочного сока.
Реактивы: белок куриного яйца, натуральный желудочный сок, 0,5% раствор гидроксида натрия
Ход эксперимента:
Опыт 1. К раствору белка куриного яйца добавить 1 мл. желудочного сока и поместить пробирку на водяную баню при t +37 0C
Белок + вода ------------------ аминокислоты
Что наблюдаете?
Опыт 2. К раствору белка куриного яйца добавить 1 мл. желудочного сока и поместить пробирку в стакан со льдом. Белок + вода ------------
Что наблюдаете?
Опыт 3. К раствору белка куриного яйца добавить 1 мл. желудочного сока и 3 капли 0,5% раствора гидроксида натрия. Поместить пробирку на водяную баню при t +37 0C
Белок + вода + NaOH -----------
Что наблюдаете?
Объясните результат эксперимента и сделайте вывод о процессе гидролиза и условиях его протекания.
(Гидролиз белка – важнейшее свойство белков. В результате гидролиза происходит разрушение первичной структуры белка и образование аминокислот, из которых в клетках организма образуются белки, характерные для данного организма. При выполнении опытов, изменение наблюдались только в 1 случае, где белок и желудочный сок находились при t +370C. Из этого следует, что ферменты действуют на белки только в кислой среде и при t тела. Опыты необходимо заложить заранее, т. к для их протекания необходимо 20–30 минут.)
2-я группа. Тема “Денатурация белков”.
Цель исследования: изучение денатурации белка под действием различных факторов.
Реактивы: раствор белка куриного яйца, раствор этанола, раствор уксусной кислоты.
Ход эксперимента:
Опыт 1. К раствору белка куриного яйца прилейте раствор этанола.
Белок + этанол -------- денатурация
Что наблюдаете? Добавьте воды. Что наблюдаете?
Опыт 2. К раствору белка куриного яйца прилейте раствор уксусной кислоты.
Белок + Ch4COOH --------- денатурация
Что наблюдаете? Добавьте воды. Что наблюдаете?
Опыт 3. Пробирку с раствором белка куриного яйца нагрейте на пламени спиртовки.
Белок + нагревание --------- денатурация
Что наблюдаете? Охладите и добавьте воды. Что наблюдаете?
Объясните результаты эксперимента и сделайте вывод о денатурации и ее причинах.
(Во все 3 опытах наблюдали выпадение осадка, что свидетельствует о процессе денатурации белка. Денатурация – это изменение вторичной, третичной и четвертичной структуры белка. Денатурацию вызывают различные факторы: в 1 и 2 опытах – химические вещества (этанол и Ch4COOH), в 3 опыте – изменение температуры. После добавления воды, осадок не растворился. Значит, данный процесс является необратимым.)
3-я группа. Тема “Качественные реакции на белки”.
Цель исследования: изучение качественных реакций на белки.
Реактивы: раствор белка куриного яйца, HNO3(конц.), NaOH, раствор медного купороса.
Ход эксперимента:
Опыт 1. Биуретовая реакция.
К раствору белка куриного яйца прилить 2 мл. раствора гидроксида натрия, затем – 2мл. раствора медного купороса
Белок + NaOH + CuSO4 ---------- фиолетовое окрашивание
Что наблюдаете? Наличие каких связей подтверждает данная реакция? (Пептидных.)
Опыт 2. Ксантопротеиновая реакция.
К раствору белка куриного яйца добавить несколько капель концентрированной азотной кислоты.
Осторожно нагрейте. Белок + HNO3(конц.) ------------ желтое окрашивание
Что наблюдаете? Наличие каких групп подтверждает данная реакция? (Ароматических ядер.)
Объясните результаты эксперимента и сделайте вывод о качественных реакциях на белки.
(Качественные реакции – это реакции, позволяющие определить наличие каких-либо ионов или веществ, в данном случае белков. В обоих опытах происходило изменение окраски, поэтому качественные реакции на белки называют еще цветными реакциями белков. При взаимодействии белка с раствором NaOH и медного купороса, появившееся фиолетовое окрашивание свидетельствовало о наличии белка и пептидных связей в нем.)
4-я группа. Тема “ Химические свойства белков. Горение белков”.
Цель исследования: изучение горения белков растительного и животного происхождения.
Оборудование: шерстяная и хлопчатобумажная нити, спички.
Ход эксперимента:
Опыт 1. Возьмите одну из имеющихся нитей и подожгите ее. Что наблюдаете?
Опыт 2. Возьмите вторую нить и подожгите ее. Что наблюдаете?
Объясните результаты эксперимента и сделайте вывод о процессе горения белков растительного и животного происхождения.
(Белки горят. При этом образуется азот, углекислый газ, вода и некоторые другие вещества. Процесс горения белков сопровождается характерным запахом: растительных белков – запахом жженной бумаги, животных белков – запахом жженных перьев.)
В. Этап рефлексии (презентация полученных результатов).
Констатация достижения учащимися поставленных целей, они развивают умения публичного выступления и обмениваются с другими учащимися результатами выполненного исследования. Отчет групп учащихся сопровождается составлением кластера на доске. Результатом данного урока является наличие положительного мотива к исследовательской деятельности, учащиеся осуществляли эксперимент, наблюдали и делали выводы.
Функции белков: (сообщение учащегося).
- Строительная. Белки входят в состав клеточных стенок грибов, бактерий, участвуют в построении мембран. Из белка кератина состоят волосы, ногти, когти, а белок коллаген является основой сухожилия и связок.
- Ферментативная, каталитическая. Белки – ферменты ускоряют протекание реакций. Они высокоспецифичны и катализируют только одну определенную реакцию.
- Двигательная осуществляется специальными сократительными белками, к которым относятся актин, миозин, входящие в состав мышечных волокон.
- Транспортная. Белки, например, переносят через клеточную мембрану в клетку ионы калия, аминокислоты, сахара и другие соединения. Белки также являются межтканевыми переносчиками.
- Регулируя обмен веществ внутри клеток и между клетками, тканями организма, белки выполняют гормональную или регуляторную функцию. Например, гормон инсулин участвует в регуляции белкового и жирового обменов.
- Защитная. Антитела– это белки, которые вырабатываются иммунной системой организма при вторжении в него чужеродного белка, бактерии, вируса. Они опознают чужака и участвуют в его уничтожении.
- Энергетическая. При разложении 1 г. Белка выделяется 17,6 кДж. Энергии.
Значение белков.
- Отдельные белки находят применение в народном хозяйстве, например белки шерсти, шелка, кожи и рогов животных.
- Выяснение структуры белков, их многообразных функций в организме позволяет понять механизм наследственности, что в свою очередь, имеет большое значение для выведения высокопродуктивных пород животных и сортов растений.
- Изучение белков важно и для выяснения природы заболеваний, наблюдаемых у человека и животных.
Ответьте на следующие вопросы.
1. Почему врачи рекомендуют “сбивать” температуру у больного, если она превышает 38 °С? (Из-за возможной тепловой денатурации белков).
2. С чем связано отторжение пересаженных (трансплантированных) органов и тканей у пациентов? (Антитела, выполняя защитную функцию, опознают чужеродный белок пересаженных органов и вызывают реакции его отторжения.)
3. Почему из сваренных яиц никогда не появится цыпленок? (Белки яйца необратимо потеряли свою нативную структуру из-за тепловой денатурации.)
4. Почему происходит уменьшение веса мяса и рыбы после их тепловой обработки? (Во время тепловой обработки происходит денатурация белков мяса или рыбы. Белки становятся практически нерастворимыми в воде и отдают значительную часть содержащейся в них воды, при этом масса мяса уменьшается на 20–40%.)
5. О чем свидетельствует образование “хлопьев” или помутнение бульона во время варки мяса? (Если мясо погрузить в холодную воду и нагревать, то растворимые белки из наружных слоев мяса переходят в воду. Во время варки происходит их денатурация, при этом образуются хлопья, пена, всплывающая на поверхность воды, или мелкая суспензия, делающая раствор мутным.)
Домашнее задание:
Выполнить на выбор творческую работу:
- составить кроссворд,
- составить рекламу на белки,
- написать исследовательскую работу по белкам,
- сочинить стихи о белках,
- составить опорную схему.
Приложение. Составление кластера.
xn--i1abbnckbmcl9fb.xn--p1ai
§ 9. Физико-химические свойства белков
§ 9. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Белки – это очень крупные молекулы, по своим размерам они могут уступать только отдельным представителям нуклеиновых кислот и полисахаридам. В таблице 4 представлены молекулярные характеристики некоторые белков.
Таблица 4
Молекулярные характеристики некоторых белков
|
Белок |
Относитель-ная молекулярная масса |
Число цепей |
Число аминокислотных остатков |
|
Инсулин |
5733 |
2 |
51 |
|
Рибонуклеаза |
13683 |
1 |
124 |
|
Миоглобин |
16890 |
1 |
153 |
|
Химотрипсин |
22600 |
3 |
241 |
|
Гемоглобин |
64500 |
4 |
574 |
|
Глутамат-дегидрогеназа |
~1000000 |
~40 |
~8300 |
В молекулах белков может содержаться самое разное количество аминокислотных остатков - от 50 и до нескольких тысяч; относительные молекулярные массы белков также сильно колеблются - от нескольких тысяч (инсулин, рибонуклеаза) до миллиона (глутаматдегидрогеназа) и более. Число полипептидных цепей в составе белков может составлять от единицы до нескольких десятков и даже тысяч. Так, в состав белка вируса табачной мозаики входит 2120 протомеров.
Зная относительную молекулярную массу белка, можно приблизительно оценить, какое число аминокислотных остатков входит в его состав. Средняя относительная молекулярная масса аминокислот, образующих полипептидную цепь, равна 128. При образовании пептидной связи происходит отщепление молекулы воды, следовательно, средняя относительная масса аминокислотного остатка составит 128 – 18 = 110. Используя эти данные, можно подсчитать, что белок с относительной молекулярной массой 100000 будет состоять приблизительно из 909 аминокислотных остатков.
Электрические свойства белковых молекул
Электрические свойства белков определяются присутствием на их поверхности положительно и отрицательно заряженных аминокислотных остатков. Наличие заряженных группировок белка определяет суммарный заряд белковой молекулы. Если в белках преобладают отрицательно заряженные аминокислоты, то его молекула в нейтральном растворе будет иметь отрицательный заряд, если преобладают положительно заряженные – молекула будет иметь положительный заряд. Суммарный заряд белковой молекулы зависит и от кислотности (рН) среды. При увеличении концентрации ионов водорода (увеличении кислотности) происходит подавление диссоциации карбоксильных групп:
и в то же время увеличивается число протонированных амино-групп;
.
Таким образом, при увеличении кислотности среды происходит уменьшение на поверхности молекулы белка числа отрицательно заряженных и увеличение числа положительно заряженных групп. Совсем другая картина наблюдается при снижении концентрации ионов водорода и увеличении концентрации гидроксид-ионов. Число диссоциированных карбоксильных групп возрастает
и снижается число протонированных аминогрупп
.
Итак, изменяя кислотность среды, можно изменить и заряд молекулы белка. При увеличении кислотности среды в молекуле белка снижается число отрицательно заряженных группировок и увеличивается число положительно заряженных, молекула постепенно теряет отрицательный и приобретает положительный заряд. При снижении кислотности раствора наблюдается противоположная картина. Очевидно, что при определенных значениях рН молекула будет электронейтральной, т.е. число положительно заряженных групп будет равно числу отрицательно заряженных групп, и суммарный заряд молекулы будет равен нулю (рис. 14).
Значение рН, при котором суммарный заряд белка равен нулю, называется изоэлектрической точкой и обозначается pI.
Рис. 14. В состоянии изоэлектрической точки суммарный заряд молекулы белка равен нулю
Изоэлектрическая точка для большинства белков находится в области рН от 4,5 до 6,5. Однако есть и исключения. Ниже приведены изоэлектрические точки некоторых белков:
|
Белок |
pI |
|
Пепсин |
1,0 |
|
Каталаза |
5,1 |
|
Рибонуклеаза |
7,8 |
|
Лизоцим |
11,0 |
При значениях рН ниже изоэлектрической точки белок несет суммарный положительный заряд, выше – суммарный отрицательный.
В изоэлектрической точке растворимость белка минимальна, так как его молекулы в таком состоянии электронейтральны и между ними нет сил взаимного отталкивания, поэтому они могут «слипаться» за счет водородных и ионных связей, гидрофобных взаимодействий, ван-дер-ваальсовых сил. При значениях рН, отличающихся от рI, молекулы белка будут нести одинаковый заряд - либо положительный, либо отрицательный. В результате этого между молекулами будут существовать силы электростатического отталкивания, препятствующие их «слипанию», растворимость будет выше.
Растворимость белков
Белки бывают растворимые и нерастворимые в воде. Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и других факторов и определяется природой тех групп, которые находятся на поверхности белковой молекулы. К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (щелк, паутина). Многие другие белки растворимы в воде. Растворимость определяется наличием на их поверхности заряженных и полярных группировок (-СОО-, -Nh4+, -OH и др.). Заряженные и полярные группировки белков притягивают к себе молекулы воды, и вокруг них формируется гидратная оболочка (рис. 15), существование которой обусловливает их растворимость в воде.
Рис. 15. Образование гидратной оболочки вокруг молекулы белка.
На растворимость белка влияет наличие нейтральных солей (Na2SO4, (Nh5)2SO4 и др.) в растворе. При малых концентрациях солей растворимость белка увеличивается (рис. 16), так как в таких условиях увеличивается степень диссоциации полярных групп и экранируются заряженные группы белковых молекул, тем самым снижается белок-белковое взаимодействие, способствующее образованию агрегатов и выпадению белка в осадок. При высоких концентрациях солей растворимость белка снижается (рис. 16) вследствие разрушения гидратной оболочки, приводящего к агрегации молекул белка.
Рис. 16. Зависимость растворимости белка от концентрации соли
Существуют белки, которые растворяются только в растворах солей и не растворяются в чистой воде, такие белки называют глобулины. Существуют и другие белки – альбумины, они в отличие от глобулинов хорошо растворимы в чистой воде. Растворимость белков зависит и от рН растворов. Как мы уже отмечали, минимальной растворимостью обладают белки в изоэлектрической точке, что объясняется отсутствием электростатического отталкивания между молекулами белка. При определенных условиях белки могут образовывать гели. При образовании геля молекулы белка формируют густую сеть, внутреннее пространство которой заполнено растворителем. Гели образуют, например, желатина (этот белок используют для приготовления желе) и белки молока при приготовлении простокваши. На растворимость белка оказывает влияние и температура. При действии высокой температуры многие белки выпадают в осадок вследствие нарушения их структуры, но об этом более подробно поговорим в следующем разделе.
Денатурация белка
Рассмотрим хорошо нам знакомое явление. При нагревании яичного белка происходит постепенное его помутнение, и затем образуется твердый сгусток. Свернувшийся яичный белок – яичный альбумин – после охлаждения оказывается нерастворимым, в то время как до нагревания яичный белок хорошо растворялся в воде. Такие же явления происходят и при нагревании практически всех глобулярных белков. Те изменения, которые произошли при нагревании, называются денатурацией. Белки в естественном состоянии носят название нативных белков, а после денатурации - денатурированных. При денатурации происходит нарушение нативной кон-формации белков в результате разрыва слабых связей (ион-ных, водородных, гидрофобных взаимодействий). В результате этого процесса могут разрушаться четвертичная, третичная и вторичные структуры белка. Первичная структура при этом сохраняется (рис. 17).
Рис. 17. Денатурация белка
При денатурации гидрофобные радикалы аминокислот, находящиеся в нативных белках в глубине молекулы, оказываются на поверхности, в результате создаются условия для агрегации. Агрегаты белковых молекул выпадают в осадок. Денатурация сопровождается потерей биологической функции белка.
Денатурация белка может быть вызвана не только повышенной температурой, но и другими факторами. Кислоты и щелочи способны вызвать денатурацию белка: в результате их действия происходит перезарядка ионогенных групп, что приводит к разрыву ионных и водородных связей. Мочевина разрушает водородные связи, следствием этого является потеря белками своей нативной структуры. Денатурирующими агентами являются органические растворители и ионы тяжелых металлов: органические растворители разрушают гидрофобные связи, а ионы тяжелых металлов образуют нерастворимые комплексы с белками.
Наряду с денатурацией существует и обратный процесс – ренатурация. При снятии денатурирующего фактора возможно восстановление исходной нативной структуры. Например, при медленном охлаждении до комнатной температуры раствора восстанавливается нативная структура и биологическая функция трипсина.
Белки могут денатурировать и в клетке при протекании нормальных процессов жизнедеятельности. Совершенно очевидно, что утрата нативной структуры и функции белков – крайне нежелательное событие. В связи с этим следует упомянуть об особых белках – шаперонах. Эти белки способны узнавать частично денатурированные белки и, связываясь с ними, восстанавливать их нативную конформацию. Шапероны также узнают белки, процесс денатурации которых зашел далеко, и транспортируют их в лизосомы, где происходит их расщепление (деградация). Шапероны играют важную роль и в процессе формирования третичной и четвертичной структур во время синтеза белка.
Интересно знать! В настоящее время часто упоминается такое заболевание, как коровье бешенство. Эту болезнь вызывают прионы. Они могут вызывать у животных и человека и другие заболевания, носящие нейродегенеративный характер. Прионы – это инфекционные агенты белковой природы. Прион, попадая в клетку, вызывает изменение конформации своего клеточного аналога, который сам становится прионом. Так возникает заболевание. Прионный белок отличается от клеточного по вторичной структуре. Прионная форма белка имеет в основном b-складчатую структуру, а клеточная – a-спиральную.
ebooks.grsu.by