Бензол: формула. Бензол: электронное строение, свойства. Бензол вода
Химические свойства бензола | Дистанционные уроки
06-Дек-2012 | комментариев 5 | Лолита Окольнова
В лекции о бензоле мы рассмотрели строение молекулы и определили, что бензольное кольцо — уникальная система. И у этой системы свои характеристики, отличающиеся от свойств других углеводородов.
 Первая такая характеристика — прочность бензольного кольца. Прочность не просто геометрической фигуры шестиугольника, а именно системы связей и делокализованного электронного облака.
Первая такая характеристика — прочность бензольного кольца. Прочность не просто геометрической фигуры шестиугольника, а именно системы связей и делокализованного электронного облака.
Что это означает? Это означает, что разрушить эту систему (раскрыть кольцо) возможно при специальных условиях — давление, температура, катализатор…
Для бензола и его гомологов характерны реакции замещения.
Остальные реакции идут с трудом.
Лучше, конечно, разделить химические свойства бензола и химические свойства алкилбензолов. По сути, алкилбензолы — вещества с двумя функциональными группами — бензольным кольцом и насыщенным алкильным радикалом, для которого более характерны свойства алканов.
Химические свойства бензола
Реакции замещения в бензольном кольце проходят в присутствии катализаторов: солей Al(3+) или Fe(3+):
Реакция галогенирования бензола (взаимодействие с бромом — качественная реакция на бензол):
C6H6 + Br2 = C6H5Br + HBr

Нитрование бензола (обратите внимание, в органической химии неорганические кислоты реагируют немного по-другому — с отщеплением группы -OH):
C6H6 + HO-NO2 → C6H5NO2 + h3O

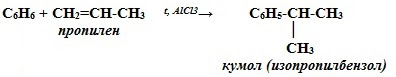
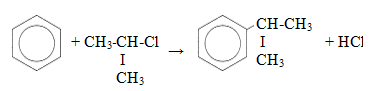
Химические свойства бензола — Алкилирование— получение гомологов бензола, алкилбензолов (катализаторы реакции — галогениды алюминия: AlCl3, AlBr3 и т.д.):
С6H6 + С2H5Cl → C6H5C2H5 + HCl

Химические свойства гомологов бензола — алкилбензолов
Реакции замещения алкилбензолов:
во-первых, гомологи бензола более ракционноспособны — легче вступают в реакции,
во-вторых, эти реакции идут немного по-другому:
Галогенирование алкилбензолов:
С6H5-Ch4 + Br2 (на свету) = С6H5-Ch3Br + HBr

Т.е. бром идет в боковую цепь, а не в кольцо.
Чтобы бром пошел в кольцо, надо использовать катализатор — соли Al(3+)
Нитрование алкилбензолов:
С6H5-Ch4 + 3HNO3 → C6h3Ch4(NO2)3

тринитротолуол, он же тротил
Окисление: реакция, характерная для алкилбензолов и не характерная для самого бензола
С6H5Ch4 + [O] → C6H5COOH — бензойная кислота

Гидрирование бензола и алкилбензолов:
Тут уже различий нет. при гидрировании всех аренов (температура, давление, катализатор — бензольное кольцо разорвать не так уж и просто) получаются циклоалканы, а точнее, циклогексан и циклогексан с радикалами:
С6H6 + 3 h3 → C6h22 циклогексан
С6H5Ch4 + 3 h3 → C6h21-Ch4 — метилциклогексан

Реакция горения: все органические вещества горят с образованием углекислого газа CO2 и воды h3O:
Cnh3n-6 + (3n-3)\2 O2 → nCO2 + (n-3)h3O
Категории: |
Обсуждение: "Химические свойства бензола"
(Правила комментирования)distant-lessons.ru
Урок №21. Физические и химические свойства аренов. Получение. Применение
Физические свойства
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Физические свойства некоторых аренов представлены в таблице.
Таблица. Физические свойства некоторых аренов
| Название | Формула | t°.пл.,°C | t°.кип.,°C |
| Бензол | C6H6 | +5,5 | 80,1 |
| Толуол (метилбензол) | С6Н5Сh4 | -95,0 | 110,6 |
| Этилбензол | С6Н5С2H5 | -95,0 | 136,2 |
| Ксилол (диметилбензол) | С6Н4(Сh4)2 |
|
|
| орто- |
| -25,18 | 144,41 |
| мета- |
| -47,87 | 139,10 |
| пара- |
| 13,26 | 138,35 |
| Пропилбензол | С6Н5(Ch3)2Ch4 | -99,0 | 159,20 |
| Кумол (изопропилбензол) | C6H5CH(Ch4)2 | -96,0 | 152,39 |
| Стирол (винилбензол) | С6Н5CH=СН2 | -30,6 | 145,2 |
Бензол – легкокипящая (tкип = 80,1°С), бесцветная жидкость, не растворяется в воде
Внимание! Бензол – яд, действует на почки, изменяет формулу крови (при длительном воздействии), может нарушать структуру хромосом.
Большинство ароматических углеводородов опасны для жизни, токсичны.
Получение аренов (бензола и его гомологов)
В лаборатории
1. Сплавление солей бензойной кислоты с твёрдыми щелочами
C6H5-COONa + NaOH t → C6H6 + Na2CO3
бензоат натрия
2. Реакция Вюрца-Фиттинга: (здесь Г – галоген)
С6H5-Г + 2Na + R-Г → C6H5-R + 2NaГ
С6H5-Cl + 2Na + Ch4-Cl → C6H5-Ch4 + 2NaCl
В промышленности
- выделяют из нефти и угля методом фракционной перегонки, риформингом;
- из каменноугольной смолы и коксового газа
1. Дегидроциклизацией алканов с числом атомов углерода больше 6:
C6h24 t, kat→ C6H6 + 4h3

2. Тримеризация ацетилена (только для бензола) – р. Зелинского:
3С2h3 600°C, акт. уголь → C6H6

3. Дегидрированием циклогексана и его гомологов:
Советский академик Николай Дмитриевич Зелинский установил, что бензол образуется из циклогексана (дегидрирование циклоалканов
C6h22 t, kat→ C6H6 + 3h3

C6h21-Ch4 t, kat→ C6H5-Ch4 + 3h3
метилциклогексан толуол
4. Алкилирование бензола (получение гомологов бензола) – р Фриделя-Крафтса.
C6H6 + C2H5-Cl t, AlCl3→ C6H5-C2H5 + HCl
хлорэтан этилбензол
Химические свойства аренов
I. РЕАКЦИИ ОКИСЛЕНИЯ
1. Горение (коптящее пламя):
2C6H6 + 15O2t → 12CO2 + 6h3O + Q
2. Бензол при обычных условиях не обесцвечивает бромную воду и водный раствор марганцовки
3. Гомологи бензола окисляются перманганатом калия (обесцвечивают марганцовку):
А) в кислой среде до бензойной кислоты
При действии на гомологи бензола перманганата калия и других сильных окислителей боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением a -атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную кислоту:

Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:

5C6H5-C2H5 + 12KMnO4 + 18h3SO4 → 5C6H5COOH + 5CO2 + 6K2SO4 + 12MnSO4+28h3O
5C6H5-Ch4 + 6KMnO4 + 9h3SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 +14h3O
Упрощённо:
C6H5-Ch4 + 3O KMnO4 → C6H5COOH + h3O
Б) в нейтральной и слабощелочной до солей бензойной кислоты
C6H5-Ch4 + 2KMnO4 → C6H5COOК + KОН + 2MnO2 + h3O
II. РЕАКЦИИ ПРИСОЕДИНЕНИЯ (труднее, чем у алкенов)
1. Галогенирование
C6H6 +3Cl2hν → C6H6Cl6(гексахлорциклогексан - гексахлоран)

2. Гидрирование
C6H6 + 3h3 t,Pt или Ni → C6h22 (циклогексан)

3. Полимеризация
III. РЕАКЦИИ ЗАМЕЩЕНИЯ – ионный механизм (легче, чем у алканов)
1. Галогенирование -
a) бензола
C6H6 + Cl2 AlCl3→ C6H5-Cl + HCl (хлорбензол)

C6H6 + 6Cl2 t ,AlCl3→ C6Cl6 + 6HCl (гексахлорбензол)
C6H6 + Br2 t,FeCl3→ C6H5-Br + HBr (бромбензол)

б) гомологов бензола при облучении или нагревании
По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген по свободно-радикальному механизму. Поэтому в отсутствие катализатора при нагревании или УФ-облучении идет радикальная реакция замещения в боковой цепи. Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно связанного с бензольным кольцом (a -атома углерода).
1) C6H5-Ch4 + Cl2hν→ C6H5-Ch3-Cl + HCl
2)

в) гомологов бензола в присутствии катализатора
C6H5-Ch4 + Cl2 AlCl3→ (смесь орта, пара производных) + HCl
2. Нитрование (с азотной кислотой)
C6H6 + HO-NO2 t, h3SO4→ C6H5-NO2 + h3O
нитробензол - запах миндаля!
 C6H5-Ch4 + 3HO-NO2 t, h3SO4→ Сh4-C6h3(NO2)3 + 3h3O
C6H5-Ch4 + 3HO-NO2 t, h3SO4→ Сh4-C6h3(NO2)3 + 3h3O 2,4,6-тринитротолуол (тол, тротил)
Применение бензола и его гомологов
Бензол C6H6 – хороший растворитель. Бензол в качестве добавки улучшает качество моторного топлива. Служит сырьем для получения многих ароматических органических соединений – нитробензола C6H5NO2 (растворитель, из него получают анилин), хлорбензола C6H5Cl, фенола C6H5OH, стирола и т.д.
Толуол C6H5–Ch4 – растворитель, используется при производстве красителей, лекарственных и взрывчатых веществ (тротил (тол), или 2,4,6-тринитротолуол ТНТ).
Ксилолы C6h5(Ch4)2. Технический ксилол – смесь трех изомеров (орто-, мета- и пара-ксилолов) – применяется в качестве растворителя и исходного продукта для синтеза многих органических соединений.
Изопропилбензол C6H5–CH(Ch4)2 служит для получения фенола и ацетона.
Хлорпроизводные бензола используют для защиты растений. Так, продукт замещения в бензоле атомов Н атомами хлора – гексахлорбензол С6Сl6 – фунгицид; его применяют для сухого протравливания семян пшеницы и ржи против твердой головни. Продукт присоединения хлора к бензолу – гексахлорциклогексан (гексахлоран) С6Н6Сl6 – инсектицид; его используют для борьбы с вредными насекомыми. Упомянутые вещества относятся к пестицидам – химическим средствам борьбы с микроорганизмами, растениями и животными.
Стирол C6H5 – CH = Ch3 очень легко полимеризуется, образуя полистирол, а сополимеризуясь с бутадиеном – бутадиенстирольные каучуки.
ВИДЕО-ОПЫТЫ
Изучение физических свойств бензола
Горениебензола
Изучениеотношения бензола к бромной воде и раствору перманганата калия
Бромирование бензола
Нитрование бензола
Хлорированиебензола (получение гексахлорана)
sites.google.com
Физические и химические свойства бензола
Формула – С6Н6 (структурная формула – рис. 1). Молекулярная масса – 78, 11.
Рис. 1. Структурные и пространственная формулы бензола.
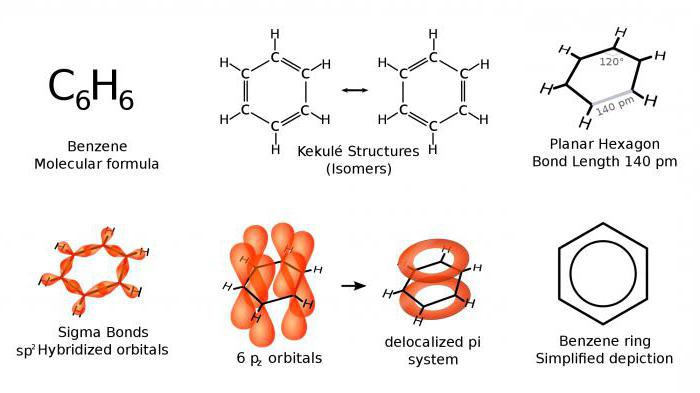
Все шесть атомов углерода в молекуле бензола находятся в sp2 гибридном состоянии. Каждый атом углерода образует 3σ-связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Шесть атомов углерода образуют правильный шестиугольник (σ-скелет молекулы бензола). Каждый атом углерода имеет одну негибридизованную р-орбиталь, на которой находится один электрон. Шесть р-электронов образуют единое π-электронное облако (ароматическую систему), которое изображают кружочком внутри шестичленного цикла. Углеводородный радикал, полученный от бензола носит название C6H5 – — фенил (Ph-).
Химические свойства бензола
Для бензола характерны реакции замещения, протекающие по электрофильному механизму:
— галогенирование (бензол взаимодействует с хлором и бромом в присутствии катализаторов – безводных AlCl3, FeCl3, AlBr3)
C6H6 + Cl2 = C6H5-Cl + HCl;
— нитрование (бензол легко реагирует с нитрующей смесью – смесь концентрированных азотной и серной кислот)
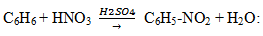
— алкилирование по Фридею-Крафтсу
— алкилирование алкенами
C6H6+ Ch3 = CH-Ch4 → C6H5-CH(Ch4)2;
Реакции присоединения к бензолу приводят к разрушению ароматической системы и протекают только в жестких условиях:
— гидрирование (реакция протекает при нагревании, катализатор – Pt)
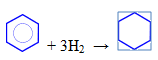
— присоединение хлора (протекает под действием УФ-излучения с образованием твердого продукта – гексахлорциклогексана (гексахлорана) – C6H6Cl6)
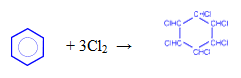
Как и любое органическое соединение бензол вступает в реакцию горения с образованием в качестве продуктов реакции углекислого газа и воды (горит коптящим пламенем):
2C6H6 +15O2 → 12CO2 + 6h3O.
Физические свойства бензола
Бензол – жидкость без цвета, но обладающая специфическим резким запахом. Образует с водой азеотропную смесь, хорошо смешивается с эфирами, бензином и различными органическими растворителями. Температура кипения – 80,1 С, плавления – 5,5
С, плавления – 5,5 С. Токсичен, канцероген (т.е. способствует развитию онкологических заболеваний).
С. Токсичен, канцероген (т.е. способствует развитию онкологических заболеваний).
Получение и применение бензола
Основные способы получения бензола:
— дегидроциклизация гексана (катализаторы – Pt, Cr3O2)
Ch4 –(Ch3)4-Ch4 → С6Н6 + 4h3↑;
— дегидрирование циклогексана (реакция протекает при нагревании, катализатор – Pt)
С6Н12 → С6Н6 + 4h3↑;
— тримеризация ацетилена (реакция протекает при нагревании до 600 С, катализатор – активированный уголь)
С, катализатор – активированный уголь)
3HC≡CH → C6H6.
Бензол служит сырьем для производства гомологов (этилбензола, кумола), циклогексана, нитробензола, хлорбензола и др. веществ. Ранее бензол использовали в качестве присадки к бензину для повышения его октанового числа, однако, сейчас, в связи с его высокой токсичностью содержание бензола в топливе строго нормируется. Иногда бензол используют в качестве растворителя.
Примеры решения задач
ru.solverbook.com
формула. Бензол: электронное строение, свойства :: SYL.ru
Ароматические углеводороды составляют важную часть циклического ряда органических соединений. Простейшим представителем таких углеводородов является бензол. Формула этого вещества не только выделила его из ряда остальных углеводородов, но и дала толчок в развитии нового направления органической химии.
Открытие ароматических углеводородов
Ароматические углеводороды были открыты в начале 19 века. В те времена наиболее распространенным топливом для уличного освещения являлся светильный газ. Из его конденсата великий английский физик Майкл Фарадей выделил в 1825 году три грамма маслянистого вещества, подробно описал его свойства и назвал так: карбюрированный водород. В 1834 году немецкий ученый, химик Митчерлих, нагревая бензойную кислоту с известью, получил бензол. Формула, по которой протекала данная реакция, представлена ниже:
C6 H5 COOH + CaO сплавление C6 H6 + CaCO3.
В то время редкую бензойную кислоту получали из смолы бензое, которую могут выделять некоторые тропические растения. В 1845 году новое соединение было обнаружено в каменноугольной смоле, которая являлась вполне доступным сырьем для получения нового вещества в промышленных масштабах. Другим источником бензола является нефть, полученная в некоторых месторождениях. Чтобы обеспечить потребность промышленных предприятий в бензоле, его получают также путем ароматизации некоторых групп ациклических углеводородов нефти.
Современный вариант названия предложил немецких ученый Либих. Корень слова «бензол» следует искать в арабских языках - там оно переводится как «ладан».
Физические свойства бензола
Бензол является бесцветной жидкостью со специфическим запахом. Это вещество кипит при температуре 80,1 оС, отвердевает при 5,5 оС и превращается при этом в белый кристаллический порошок. Бензол практически не проводит тепло и электричество, плохо растворяется в воде и хорошо – в различных маслах. Ароматические свойства бензола отражают суть структуры его внутреннего строения: относительно устойчивое бензольное ядро и неопределенный состав.
Химическая классификация бензола

Бензол и его гомологи - толуол и этилбензол - представляют собой ароматический ряд циклических углеводородов. Строение каждого из этих веществ содержит распространенную структуру, названную бензоловым кольцом. Структура каждого из вышеперечисленных веществ содержит особую циклическую группировку, созданную шестью атомами углерода. Она получила название бензольного ароматического ядра.
История открытия
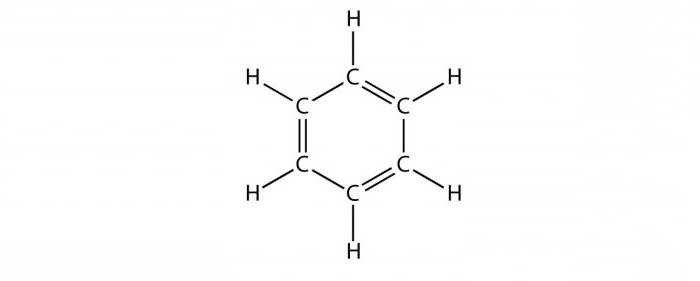
Установление внутреннего строения бензола растянулось на несколько десятилетий. Основные принципы строения (кольцевая модель) были предложены в 1865 году химиком А. Кекуле. Как рассказывает легенда, немецкий ученый увидел формулу этого элемента во сне. Позднее было предложено упрощенное написание структуры вещества, называемого так: бензол. Формула этого вещества представляет собой шестиугольник. Символы углерода и водорода, которые должны быть расположены в углах шестиугольника, опускаются. Таким образом, получается простой правильный шестиугольник с чередующимися одинарными и двойными линиями на сторонах. Общая формула бензола представлена на рисунке ниже.
Ароматические углеводороды и бензол
Химическая формула этого элемента позволяет утверждать, что для бензола реакции присоединения нехарактерны. Для него, как и для других элементов ароматического ряда, типичны реакции замещения атомов водорода в бензольном кольце.
Реакция сульфирования
При обеспечения взаимодействия концентрированной серной кислоты и бензола, повышая температуру реакции, можно получить бензосульфокислоту и воду. Структурная формула бензола в этой реакции выглядит следующим образом: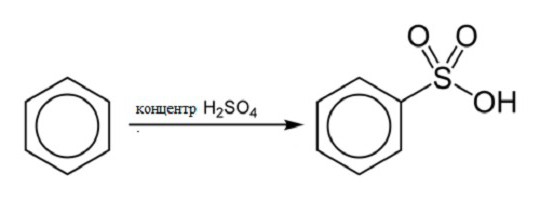
Реакция галогенирования
Бром или хром в присутствии катализатора взаимодействует с бензолом. При этом получаются галогенопроизводные. А вот реакция нитрирования проходит с использованием концентрированной азотной кислоты. Конечным итогом реакции является азотистое соединение:
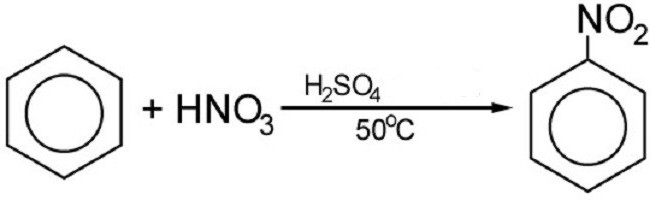
С помощью нитрирования получают известное всем взрывчатое вещество – тротил, или тринитотолуол. Мало кто знает, что в основе тола лежит бензол. Многие другие нитросоединения на основе бензольного кольца также могут быть использованы как взрывчатые вещества
Электронная формула бензола
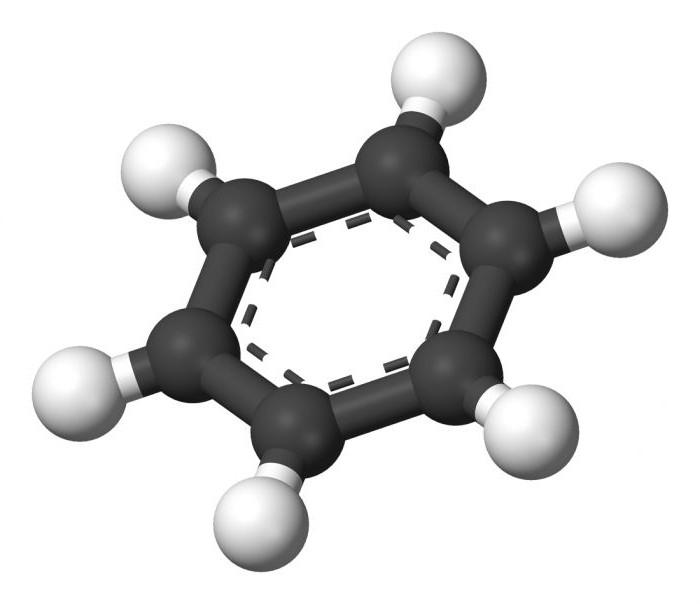
Стандартная формула бензольного кольца не совсем точно отражает внутренне строение бензола. Согласно ей, бензол должен обладать тремя локализованными п-связями, каждая из которых должна взаимодействовать с двумя атомами углерода. Но, как показывает опыт, бензол не обладает обычными двойными связями. Молекулярная формула бензола позволяет увидеть, что все связи в бензольном кольце равноценны. Каждая из них имеет длину около 0,140 нм, что является промежуточным значением между длиной стандартной простой связи (0,154 нм) и двойной этиленовой связи (0,134 нм). Структурная формула бензола, изображенная с чередованием связей, несовершенна. Более правдоподобна трехмерная модель бензола, которая выглядит так, как показано на картинке ниже.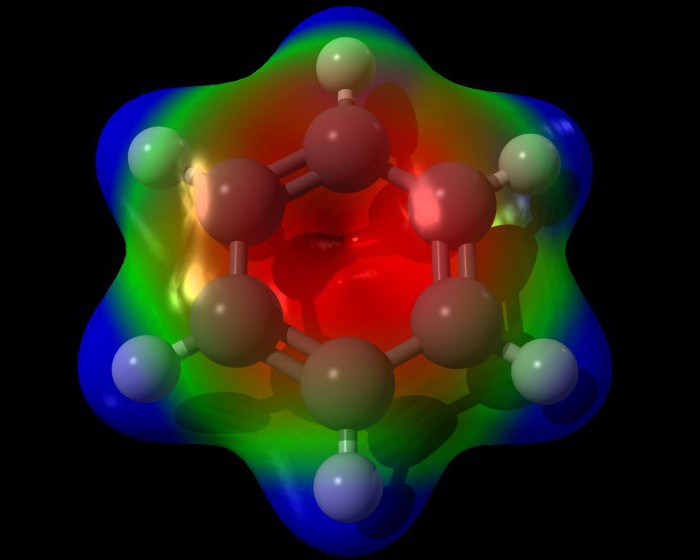 Каждый из атомов бензольного кольца находится в состоянии sp2-гибридизации. Он затрачивает на образование сигма-связей по три валентных электрона. Эти электроны охватывают два соседних атома углевода и один атом водорода. При этом и электроны, и связи С-С, Н-Н находятся в одной плоскости.
Каждый из атомов бензольного кольца находится в состоянии sp2-гибридизации. Он затрачивает на образование сигма-связей по три валентных электрона. Эти электроны охватывают два соседних атома углевода и один атом водорода. При этом и электроны, и связи С-С, Н-Н находятся в одной плоскости.
Четвертый валентный электрон образует облако в форме объемной восьмерки, расположенное перпендикулярно плоскости бензольного кольца. Каждое такое электронное облако перекрывается над плоскостью бензольного кольца и непосредственно под ней с облаками двух соседних атомов углерода.
Плотность облаков п-электронов этого вещества равномерно распределена между всеми углеродными связями. Таким путем образуется единое кольцевое электронное облако. В общей химии такая структура получила название ароматического электронного секстета.
Равноценность внутренних связей бензола
Именно равноценностью всех граней шестиугольника объясняется выравненность ароматических связей, обуславливающих характерные химические и физические свойства, которыми обладает бензол. Формула равномерного распределения п-электронного облака и равноценность всех его внутренних связей показана ниже.
Как видно, вместо чередующихся одинарных и двойных черт внутреннюю структуру изображают в виде окружности.
Сущность внутренней структуры бензола дает ключ к пониманию внутреннего строения циклических углеводородов и расширяет возможности практического применения этих веществ.
www.syl.ru
Бензол - это... Что такое Бензол?
 | |
| Другие названия | фен (Лоран, 1837),фениловый водород, бензен |
| Молекулярная формула | C6H6 |
| SMILES | c1ccccc1C1=CC=CC=C1 |
| Молярная масса | 78,11 г/моль |
| Вид | Синяя жидкость |
| Регистрационный номер CAS | 71-43-2 |
| ГОСТ | 8448-78 |
| Плотность и фазовое состояние | 0,8786 г/см³=878,6 кг/м³, жидкость |
| Растворимость в воде | 1,79 г/л при 25 °C |
| Температура плавления | 5,5 °C |
| Температура кипения | 80,1 °C |
| Вязкость | 0,652 П при 20 °C |
| Описание | Токсичен,опасен для окружающей среды,огнеопасен |
| Температура воспламенения паров | −11 °C |
| Температура самовозгорания | 562 °C |
| Близкие углеводороды | нафталинциклогексан |
| Производные | толуол |
| Если не указано другое, параметры даны для 25 °C, 100 кПа | |
Бензо́л (C6H6, PhH) — органическое химическое соединение, бесцветная жидкость с приятным сладковатым запахом.
Простейший ароматический углеводород. Бензол входит в состав бензина, широко применяется в промышленности, является исходным сырьём для производства лекарств, различных пластмасс, синтетической резины, красителей. Хотя бензол входит в состав сырой нефти, в промышленных масштабах он синтезируется из других её компонентов. Токсичен, канцерогенен.История
Впервые бензолсодержащие смеси, образующиеся в результате перегонки каменноугольной смолы, описал немецкий химик Иоганн Глаубер в книге Furni novi philosophici, опубликованной 1651 году[1]. Бензол как индивидуальное вещество был описан Майклом Фарадеем, выделившим это вещество в 1825 году из конденсата светильного газа, получаемого коксованием угля. Вскоре, в 1833 году, получил бензол — при сухой перегонке кальциевой соли бензойной кислоты — и немецкий физик-химик Эйльгард Мичерлих. Именно после этого получения вещество стали называть бензолом.
К шестидесятым годам XIX-го века было известно, что соотношение количества атомов углерода и атомов водорода в молекуле бензола аналогично таковому у ацетилена, и эмпирическая формула их — CnHn. Изучением бензола серьёзно занялся немецкий химик Фридрих Август Кекуле, которому в 1865 году и удалось предложить правильную — циклическую формулу этого соединения. Известна история о том, что Ф. Кекуле представлял в своём воображении бензол в виде змеи из шести атомов углерода[2]. Идея же о цикличности соединения пришла ему во сне, когда воображаемая змея укусила себя за хвост. Фридриху Кекуле удалось на тот момент наиболее полно описать свойства бензола. [3]
Физические свойства

 Бензол (жидкий)
Бензол (жидкий) Бесцветная жидкость со своеобразным резким запахом. Температура плавления = 5,5 °C, температура кипения = 80,1 °C, плотность = 0,879 г/см³, молярная масса = 78,11 г/моль. Подобно ненасыщенным углеводородам бензол горит сильно коптящим пламенем. С воздухом образует взрывоопасные смеси, хорошо смешивается с эфирами, бензином и другими органическими растворителями, с водой образует азеотропную смесь с температурой кипения 69,25 °C (91 % бензола). Растворимость в воде 1,79 г/л (при 25 °C).
Химические свойства
Для бензола характерны реакции замещения — бензол реагирует с алкенами, хлоралканами, галогенами, азотной и серной кислотами. Реакции разрыва бензольного кольца проходят в жёстких условиях (температура, давление).
- Взаимодействие с хлором в присутствии катализатора:
С6H6 + Cl2 -(FeCl3)→ С6H5Cl + HCl образуется хлорбензол
Катализаторы содействуют созданию активной электрофильной частицы путём поляризации между атомами галогена.
Cl-Cl + FeCl3 → Clઠ-[FeCl4]ઠ+
С6H6 + Clઠ--Clઠ+ + FeCl3 → [С6H5Cl + FeCl4] → С6H5Cl + FeCl3 + HCl
В отсутствие катализатора при нагревании или освещении идёт радикальная реакция замещения.
С6H6 + 3Cl2 -(освещение)→ C6H6Cl6 образуется смесь изомеров гексахлорциклогексанавидео
- Взаимодействие с бромом (чистый):
С6H6 + Br2 -(FeBr3 или AlCl3)→ С6H5Br + HBr образуется бромбензолвидео
С6H6 + С2H5Cl -(AlCl3)→ С6H5С2H5 + HCl образуется этилбензол
С6H6 + HNO3 -(h3SO4)→ С6H5NO2 + h3O
Структура

Бензол по составу относится к ненасыщенным углеводородам (гомологический ряд Cnh3n-6), но в отличие от углеводородов ряда этилена C2h5 проявляет свойства, присущие ненасыщенным углеводородам (для них характерны реакции присоединения) только при жёстких условиях, а вот к реакциям замещения бензол более склонен. Такое «поведение» бензола объясняется его особым строением: нахождением всех связей и молекул на одной плоскости и наличием в структуре сопряжённого 6π-электронного облака. Современное представление об электронной природе связей в бензоле основывается на гипотезе Лайнуса Полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
Производство
На сегодняшний день существует три принципиально различных способа производства бензола.
- Коксование каменного угля. Этот процесс исторически был первым и служил основным источником бензола до Второй мировой войны. В настоящее время доля бензола, получаемого этим способом, составляет менее 1 %. Следует добавить, что бензол, получаемый из каменноугольной смолы, содержит значительное количество тиофена, что делает такой бензол сырьем, непригодным для ряда технологичных процессов.
- Каталитический риформинг (аромаизинг) бензиновых фракций нефти. Этот процесс является основным источником бензола в США. В Западной Европе, России и Японии этим способом получают 40—60 % от общего количества вещества. В данном процессе кроме бензола образуются толуол и ксилолы. Ввиду того, что толуол образуется в количествах, превышающих спрос на него, его также частично перерабатывают в:
- бензол — методом гидродеалкилирования;
- смесь бензола и ксилолов — методом диспропорционирования;
- Пиролиз бензиновых и более тяжелых нефтяных фракций. До 50 % бензола производится этим методом. Наряду с бензолом образуются толуол и ксилолы. В некоторых случаях всю эту фракцию направляют на стадию деалкилирования, где и толуол, и ксилолы превращаются в бензол.
Тримеризация ацетилена
При пропускании ацетилена при 400°C над активированным углем с хорошим выходом образуется бензол и другие ароматические углеводороды:
3С2Н2 → С6H6
Применение
Значительная часть получаемого бензола используется для синтеза других продуктов:
В существенно меньших количествах бензол используется для синтеза некоторых других соединений. Изредка и в крайних случаях, ввиду высокой токсичности, бензол используется в качестве растворителя. Кроме того, бензол входит в состав бензина. Ввиду высокой токсичности его содержание новыми стандартами ограничено введением до 1 %.
Биологическое действие
При непродолжительном вдыхании паров бензола не возникает немедленного отравления, поэтому до недавнего времени порядок работ с бензолом особо не регламентировался.
В больших дозах бензол вызывает тошноту и головокружение, а в некоторых тяжёлых случаях отравление может повлечь смертельный исход. Первым признаком отравления бензолом нередко бывает эйфория. Пары бензола могут проникать через неповрежденную кожу. Если организм человека подвергается длительному воздействию бензола в малых количествах, последствия также могут быть очень серьёзными. В этом случае хроническое отравление бензолом может стать причиной лейкемии и анемии. Сильный канцероген.
Бензол и токсикомания
Бензол оказывает на человека одурманивающее воздействие и может приводить к наркотической зависимости.
Ссылки
Примечания
dic.academic.ru
Что такое бензол? Строение бензола, формула, свойства, применение
Среди огромного арсенала органических веществ можно выделить несколько соединений, открытие и изучение которых сопровождалось многолетними научными спорами. К ним по праву относится бензол. Строение бензола в химии было окончательно принято лишь к началу 20 столетия, тогда как элементный состав вещества определили еще в 1825 году, выделив его из каменноугольной смолы, которую получали как побочный продукт коксования угля.
Бензол вместе с толуолом, антраценом, фенолом, нафталином в настоящее время относят к ароматическим углеводородам. В нашей статье мы рассмотрим, каковы же особенности молекулы этого углеводорода, выясним физические свойства, например, такие как растворимость, температуру кипения и плотность бензола, а также обозначим области применения соединения в промышленности и сельском хозяйстве.
Что такое арены?
Химия органических соединений классифицирует все известные вещества на несколько групп, например, такие как алканы, алкины, спирты, альдегиды и т.д. Главной отличительной чертой каждого класса веществ является наличие определенных типов связей. Молекулы предельных углеводородов содержат только сигма-связь, вещества ряда этилена – двойную, у алкинов связь тройная. К какому же классу относится бензол?
Строение бензола указывает на присутствие в его молекуле ароматического кольца, названного бензольным ядром. Все соединения органической природы, содержащие одно или несколько таких колец в составе своих молекул, относят к классу аренов (ароматических углеводородов). Кроме бензола, который мы сейчас рассматриваем, в эту группу входит большое количество очень важных веществ, каких как толуол, анилин, фенол и другие.
Как решили проблему строения молекулы ароматического углеводорода
Вначале ученые установили качественный и количественный состав соединения, выразив его формулой С6Н6, согласно которой относительная молекулярная масса бензола равна 78. Затем было предложено несколько вариантов структурных формул, но ни одна из них не соответствовала реальным физическим и химическим свойствам бензола, наблюдаемым химиками в лабораторных опытах.
Прошло около сорока лет, прежде чем немецкий исследователь А. Кекуле представил свою версию структурной формулы, которую имеет молекула бензола. В ней присутствовали три двойных связи, указывающие на возможный непредельный характер химических свойств углеводорода. Это вступало в противоречие с действительно существующим характером взаимодействий соединения формулы С6Н6 с другими веществами, например, с бромом, нитратной кислотой, хлором.

Только после выяснения электронной конфигурации молекулы бензола в его структурной формуле появилось обозначение бензольного ядра (кольца), а сама она до сих пор используется в курсе органической химии.
Электронная конфигурация молекулы С6Н6
Какую же пространственную структуру имеет бензол? Строение бензола окончательно было подтверждено благодаря двум реакциям: тримеризации ацетилена с образованием бензола и его восстановления водородом до циклогексана. Оказалось, что атомы углерода, соединяясь между собой, образуют плоский шестиугольник и находятся в состоянии sp2-гибридизации, используя на связи с другими атомами три из четырех своих валентных электронов.
Оставшиеся шесть свободных p-электронов располагаются перпендикулярно плоскости молекулы. Перекрываясь между собой, они формируют общее электронное облако, названное бензольным ядром.
Природа полуторной химической связи
Хорошо известно, что физические и химические свойства соединений зависят, прежде всего, от их внутреннего строения и типов химических связей, возникающих между атомами. Рассмотрев электронную структуру бензола, можно прийти к выводу, что его молекула не имеет ни простых, ни двойных связей, которые можно увидеть в формуле Кекуле. Наоборот, между атомами углерода все химические связи равноценны. Более того, общее π-электронное облако (всех шести атомов С) образует химический тип связи, названный полуторной, или ароматической. Именно этот факт обуславливает специфические свойства бензольного кольца и, как следствие, характер химического взаимодействия ароматических углеводородов с другими веществами.
Физические свойства
Арены, содержащие в составе молекулы небольшое количество атомов углерода, представлены в основном жидкостями. Не является исключением и бензол. Строение бензола, как мы помним, указывает на его молекулярную природу. Как же этот факт отразился на его свойствах?
При понижении температуры жидкость переходит в твердую фазу, и бензол превращается в белую кристаллическую массу. Она легко плавится при температуре 5,5 °С. В обычных условиях вещество представляет собой бесцветную жидкость со своеобразным запахом. Его температура кипения составляет 80,1 °С.
Плотность бензола меняется в зависимости от изменения температуры. Чем температура выше, тем плотность меньше. Приведем несколько примеров. При температуре 10° плотность составляет 0,8884 г/мл, а при 20° - 0,8786 г/мл. Молекулы бензола неполярные, поэтому вещество нерастворимо в воде. Зато само соединение является хорошим органическим растворителем, например, для жиров.
Особенности химических свойств бензола
Экспериментально установлено, что ароматическое бензольное ядро устойчиво, т.е. характеризуется высокой стойкостью к разрыву. Этот факт служит объяснением склонности вещества к протеканию реакций по типу замещения, например, с хлором при обычных условиях, с бромом, с нитратной кислотой в присутствии катализатора. Нужно отметить высокую устойчивость бензола к действию окислителей, таких как перманганат калия и бромная вода. Это еще раз подтверждает факт отсутствия в молекуле арена двойных связей. Жесткое окисление, иначе называемое горением, характерно для всех ароматических углеводородов. Так как процентное содержание углерода в молекуле С6Н6 велико, горение бензола сопровождается коптящим пламенем с образованием частиц сажи. В результате реакции образуется углекислый газ и вода. Интересным представляется вопрос: может ли ароматический углеводород вступать в реакции присоединения? Рассмотрим его далее более подробно.
К чему приводит разрыв бензольного ядра?
Напомним, что в молекулах аренов присутствует полуторная связь, возникшая в результате перекрывания шести р-электронов атомов карбона. Она и лежит в основе бензольного ядра. Чтобы его разрушить и провести реакцию присоединения, необходим ряд специальных условий, например, таких как световое облучение, высокие температура и давление, катализаторы. Смесь бензола и хлора вступает в реакцию присоединения под действием ультрафиолетового излучения. Продуктом такого взаимодействия будет гексахлорциклогексан – токсическое кристаллическое вещество, применяемое в сельском хозяйстве в качестве инсектицида. В молекуле гексахлорана уже нет бензольного ядра, по месту его разрыва произошло присоединение шести атомов хлора.

Области практического применения бензола
В различных отраслях промышленности вещество широко используется как растворитель, а также как сырье для дальнейшего получения лаков, пластических масс, красителей, в качестве добавки к моторному топливу. Еще больший диапазон применения имеют производные бензола и его гомологи. Например, нитробензол С6Н5NO2 является основным реагентом для получения анилина. В результате реакции замещения с хлором в присутствии хлорида алюминия в качестве катализатора получают гексахлорбензол. Его применяют для предпосевной обработки семян, а также используют в деревообрабатывающей промышленности для защиты древесины от вредителей. Нитрованием гомолога бензола (толуола) получают взрывчатое вещество, известное как тротил или тол.
В данной статье мы рассмотрели такие свойства ароматического соединения, как реакции присоединения и замещения, горение бензола, а также определили области его применения в промышленности и сельском хозяйстве.
fb.ru
Химические свойства бензола
1. Реакции замещения в бензольном кольце
Первая группа реакций реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах, но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
Первое химическое свойство галогенирование. Замещение атома водорода на атом галогена хлора или брома.
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.
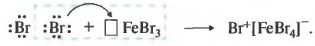
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.

Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.
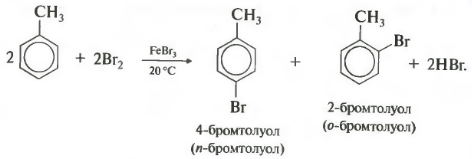
Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
Второе свойство нитрование бензола, введение нитрогруппы в бензольное кольцо.
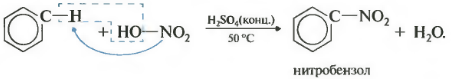
Образуется тяжелая желтоватая жидкость с запахом горького миндаля нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.
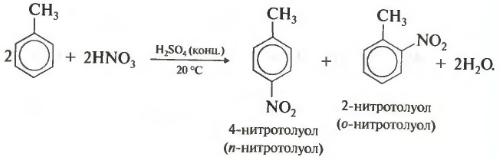
Третье свойство алкилирование бензола галогеналканами.
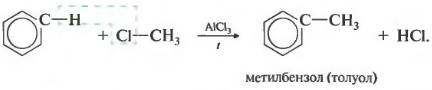
Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство алкилирование бензола алкенами.
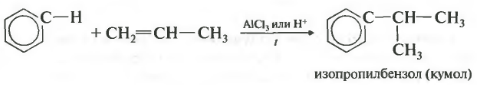
Таким способом можно получить, например, кумол или же этилбензол. Катализатор хлорид алюминия.
2. Реакции присоединения к бензолу
Вторая группа реакций реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
Пятое свойство в общем списке гидрирование, присоединение водорода.
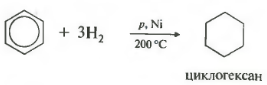
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.
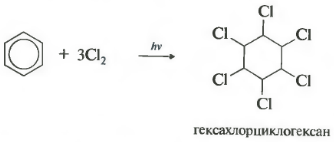
Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
3. Замещение в боковой цепи гомологов бензола
Третья группа реакций касается только гомологов бензола это замещение в боковой цепи.
Седьмое свойство в общем списке галогенирование по альфа-атому углерода в боковой цепи.
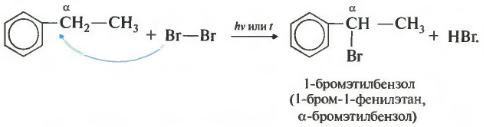
Реакция происходит при нагревании или облучении и всегда только по альфа-углероду. При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
4. Окисление гомологов бензола
Четвертая группа реакций окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.
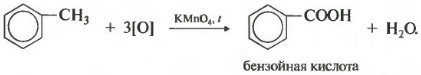
Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
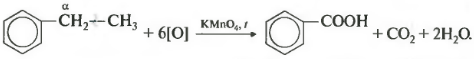
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам окисляется углерод, находящийся в альфа-положении.
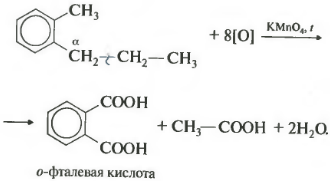
В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.
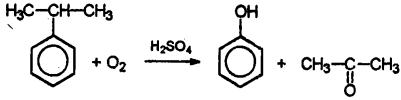
Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.

По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO2. Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.
stepenin.ru



















