Удивительная и странная физика воды. Физика воды
Удивительная и странная физика воды
Создано 01.12.2011 17:34 Автор: Евгений
«Нет ничего мягче и слабее воды, но все же нет ничего лучше для обработки твердых и крепких вещей».
Этот парадокс был сформулирован китайским мудрецом Лао-цзы в древнем тексте «Тао-Те-Кинг, или писание о нравственности». Действительно, способность воды омывать, успокаивать и питать контрастирует с неудержимой силой, примером этому является Ниагарский водопад, Большой каньон (он был высечен с течением веков рекой Колорадо) и цунами.
Точно так же парадоксально, что вода и крайне знакома – она составляет около двух третей нашего тела и покрывает три четверти планеты – и крайне загадочна. Хотя вам кажется, что вы ее отлично знаете, многие свойства воды вас очень удивят. А некоторые из них настолько странные, что до сих пор до конца не поняты наукой.
Гонка по нисходящей
Логично мыслящий человек предположит, что горячей воде понадобится больше времени, чтобы остудиться до температуры 0 градусов Цельсия и замерзнуть, чем холодной. Но странно то, что это не всегда правда. В 1963 году танзанийский учащийся по имени Эрасто Мпемба заметил, что в действительности горячая вода замерзает быстрее, чем холодная, когда две массы воды подвергаются воздействию одинаковых условий с температурой ниже нуля.
И никто не знает, почему.
Единственное допущение – это что эффект Мпембы появляется в результате процесса циркуляции тепла под названием конвекция. В контейнере теплая вода поднимается вверх, вытесняя холодную и создавая «утепленный верх». Ученые предполагают, что конвекция может каким-то образом ускорить процесс охлаждения, позволяя более теплой воде замерзать быстрее, чем холодной, несмотря на то, сколько ртутного столбика ей нужно преодолеть до точки замерзания.
Скользкая субстанция

Полтора века научных исследований так и не дали ответ, почему на льду можно упасть. Ученые единогласны в том, что тонкий слой жидкой воды на верху твердого льда становится причиной скользкости, а подвижность жидкости затрудняет движение, даже если лет тонкий. Но нет консенсуса относительного того, почему лед в отличие от большинства твердых веществ имеет такой слой.
Теоретики предполагают, что именно процесс скольжения, то есть контакт со льдом, заставляет таять его поверхность. Другие считают, что жидкий слой существует еще до того, как появляется скользящий предмет, и что он образуется благодаря внутреннему движению молекул поверхности.
Несомненно, вы ищете виновного, лежа на спине и кипя от злости, но, к сожалению, его еще предстоит найти.
Акванавт
На Земле кипящая вода создает тысячи крошечных пузырьков пара. В космосе же создается один гигантский колеблющийся пузырь.
Динамика жидкости столь сложна, что физики не могли предположить, что случится с кипящей водой при нулевой гравитации, пока в 1992 году не был проведен эксперимент на борту космического корабля. После этого физики решили, что упрощенный вид кипения в космосе, очевидно, связан с отсутствием конвекции и подъемной силы – оба этих явления образуются гравитацией. На Земле эти эффекты вызывают бурление, которое мы видим в чайнике.
Парящая жидкость
Когда капля воды падает на поверхность гораздо горячее ее точки кипения, она может гораздо дольше носиться по поверхности, чем вы ожидаете. Это эффект Лейденфроста, и он появляется из-за того, что когда нижний слой капли испаряется, газообразным молекулам воды в этом слое некуда деться, и их присутствие изолирует остаток капли и препятствует ее касанию горячей поверхности. Таким образом, капля существует несколько секунд до того, как полностью испариться.
Необыкновенная оболочка

Порой кажется, что вода отрицает законы физики, удерживаясь от распада, даже несмотря на попытки гравитации или даже давление тяжелых объектов разорвать ее.
Это сила поверхностного натяжения, свойство, которое делает внешний слой массы воды (и некоторых других жидкостей) вести себя, как гибкая оболочка. Поверхностное натяжение возникает из-за того, что молекулы воды слабо связаны друг с другом. Благодаря этому молекулы поверхности испытывают внутреннее усилие от молекул под ними. Вода останется целостной, пока разрывающая ее сила не превзойдет силу этих слабых связей и не прорвет поверхность.
Например, на фото выше скрепка для бумаги лежит на поверхности воды. Хотя металл плотнее воды и потому должен утонуть, поверхностное натяжение не позволяет скрепке прорвать поверхность воды.
Кипящий снег
Когда есть огромная разница температур между водой и внешним воздухом, происходит удивительный эффект – скажем, если вылить кастрюлю кипящей воды (100 градусов Цельсия) в воздух температурой минус 34 градуса Цельсия, то кипящая вода мгновенно превратиться в снег и разлетится.
Объяснение: крайне холодный воздух очень плотный, расстояние между его молекулами такое маленькое, что не остается достаточно места для переноса водяного пара. Кипящая вода, с одной стороны, очень активно испускает пар. Когда ее кидают в воздух, она распадается на капельки, из-за чего появляется еще больше пространства для распространения пара. Это представляет собой проблему. Испускается больше пара, чем может удержать воздух, и потому он распределяется, закрепляясь на микроскопических частицах в воздухе, как сода или кальций, и формирует кристаллы. Именно так и образуются снежинки.
Пустое пространство

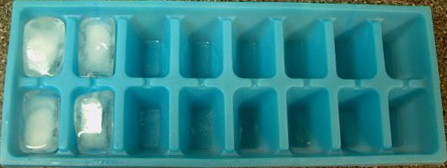
Хотя твердое состояние почти любой субстанции плотнее, чем жидкое, так как атомы в твердых телах обычно плотно прилегают друг к другу, это не действует для Н2О. Когда вода замерзает, ее объем увеличивается на почти 8 процентов. Это странное свойство, позволяющее кубам льда и даже громадным айсбергам плавать.
Когда вода охлаждается до точки замерзания, существует меньше энергии, заставляющей молекулы скрепляться, и потому они могут формировать более прочные водородные связи со своими соседями и постепенно закрепляться. Этот же процесс заставляет все жидкости отвердевать. И, как и в других твердых телах, связи между молекулами льда действительно короче и прочнее, чем в жидкой воде; разница в том, что гексагональная структура кристаллов льда оставляет много пустого места, что делает лед в целом менее плотным, чем вода.
Избыток объема можно иногда увидеть в форме выступов на верху кубиков льда в вашей морозильной камере. Эти выступы состоят из избытка воды, выдавленной из кубика замораживающимся (и расширяющимся) льдом. В контейнере вода замерзает от боков и низа к центру и верху, и лед расширяется по направлению к центру.
Единственные в своем роде

Как говорится, нет двух одинаковых снежинок. В самом деле, за всю историю исследования снега каждая прекрасная структура была абсолютно уникальной. И вот почему: снежинка зарождается в форме простой гексагональной призмы. Во время падения она сталкивается с неповторяющимися условиями, меняющими их форму, включая разные температуры, уровни влажности и атмосферное давление. Этих переменных факторов достаточно для того, чтобы формирование кристаллов никогда не проходило дважды по одной схеме.
И что самое интересное относительно снежинок – это что все их шесть ответвлений вырастают абсолютно синхронно, создавая гексагональную симметрию, потому как каждое ответвление испытывает те же условия, что и все другие.
Откуда она?

Точное происхождение воды на нашей планете, покрывающей около 70 процентов поверхности, все еще остается загадкой для ученых. Они подозревают, что любая вода, накапливавшаяся на поверхности планеты во время ее формирования в течение 4,5 миллиардов лет, испарилась бы из-за интенсивного жара молодого Солнца. Это означает, что вода, которую мы сейчас имеем, должна была появиться позже.
Как? В течение периода под названием поздняя тяжелая бомбардировка, проходившего около 4 миллиардов лет назад, массивные объекты, возможно, из других систем падали на Землю и планеты Солнечной системы. Возможно, что такие объекты были наполнены водой, и эти столкновения могли доставить на нашу планету громадные объемы этого вещества.
Кометы – глыбы изо льда и камня с хвостами из испаряющегося льда, вращающиеся по длинным орбитам вокруг Солнца – вполне могут быть остатками того, что упало на планету. Однако есть проблема: удаленные исследования воды, испаряющейся с нескольких крупных комет, выявили, что они состоят из воды другого типа Н2О (содержат более тяжелый изотоп водорода), чем земная, потому такие кометы не могут быть источником всей нашей чудесной воды.
Источник: Lifeslittlemysteries
www.facepla.net
#физика | Почему вода легче… воды?

Одно из самых распространенных веществ на Земле: вода. Она, как и воздух, необходима нам, но мы ее порой совсем не замечаем. Она просто есть. Но, оказывается, обыкновенная вода может менять свой объем и весить то больше, то меньше. При испарении воды, ее нагревании и охлаждении происходят поистине удивительные вещи, о которых мы и узнаем сегодня.

Мюриэль Мэнделл в своей занимательной книге «Phycisc Experiments for Children» излагает интереснейшие мысли о свойствах воды, на основе которых не только юные физики могут узнать немало нового, но и взрослые освежат свои знания, которые давненько не приходилось применять, поэтому они оказались слегка забытыми.
Сегодня речь пойдет об объеме и весе воды. Оказывается, один и тот же объем воды не всегда весит одинаково. И если налить воду в стакан и она не прольется через край — это еще не значит, что она поместится в нем при любых обстоятельствах.
1. При нагревании вода увеличивается в объеме
Поставьте наполненную водой банку в кастрюлю, наполненную сантиметров на пять кипящей водой, и на слабом огне поддерживайте кипение. Вода из банки начнет переливаться через край. Это происходит потому, что при нагревании вода, подобно другим жидкостям, начинает занимать больше пространства. Молекулы отталкиваются друг от друга с большей интенсивностью и это ведет к увеличению объема воды.
2. При охлаждении вода сжимается
Дайте воде в банке остыть при комнатной температуре, или налейте новую воду, и поставьте ее в холодильник. Через некоторое время вы обнаружите, что полная прежде банка уже не полна. При охлаждении до температуры 3,89 градусов по Цельсию вода уменьшает свой объем по мере снижения температуры. Причиной тому стало снижение скорости движения молекул и их сближение друг с другом под воздействием охлаждения.
Казалось бы, все очень просто: чем холоднее вода, тем меньший объем она занимает, но…
3. …объем воды вновь возрастает при замерзании
Наполните банку водой до краев и накройте куском картона. Поставьте ее в морозилку и дождитесь замерзания. Вы обнаружите, что картонную «крышку» вытолкнуло. На температурном интервале между 3,89 и 0 градусов по Цельсию, то есть на подходе к точке своего замерзания, вода вновь начинает расширяться. Она является одним из немногих известных веществ, обладающих подобным свойством.
Если использовать плотную крышку, то лед просто разнесет банку. Приходилось ли вам слышать о том, что даже водопроводные трубы может разорвать льдом?
4. Лед легче воды
Поместите пару кубиков льда в стакан с водой. Лед будет плавать на поверхности. Вода при замерзании увеличивается в объеме. И, вследствие этого, лед легче воды: его объем составляет около 91% соответствующего объема воды.
Это свойство воды существует в природе не зря. У него есть вполне определенное предназначение. Говорят, что зимой реки замерзают. Но на самом деле это не совсем верно. Обычно замерзает лишь небольшой верхний слой. Это ледяной покров не тонет, поскольку он легче жидкой воды. Он замедляет замерзание воды на глубине реки и служит своеобразным одеялом, оберегая рыб и другую речную да озерную живность от лютых зимних морозов. Изучая физику, начинаешь понимать, что очень многое в природе устроено целесообразно.
5. Водопроводная вода содержит минералы
Влейте в небольшую стеклянную миску 5 столовых ложек обычной водопроводной воды. Когда вода испарится, на миске останется белая кайма. Эта кайма сформирована минералами, которые были растворены в воде, когда она проходила слои грунта.
Посмотрите внутрь своего чайника и вы увидите там минеральный налет. Такой же налет образуется и на отверстии для стока воды в ванне.
Попробуйте испарить дождевую воду, чтобы самостоятельно проверить, содержит ли она минералы.
Если совместить воду с другими жидкостями, то можно обнаружить, что с некоторыми вода не смешивается. Благодаря таким свойствам веществ можно сделать красивейшую сахарную радугу.
hi-news.ru
Удивительная и странная физика воды
Создано 01.12.2011 17:34 Автор: Евгений
«Нет ничего мягче и слабее воды, но все же нет ничего лучше для обработки твердых и крепких вещей».
Этот парадокс был сформулирован китайским мудрецом Лао-цзы в древнем тексте «Тао-Те-Кинг, или писание о нравственности». Действительно, способность воды омывать, успокаивать и питать контрастирует с неудержимой силой, примером этому является Ниагарский водопад, Большой каньон (он был высечен с течением веков рекой Колорадо) и цунами.
Точно так же парадоксально, что вода и крайне знакома – она составляет около двух третей нашего тела и покрывает три четверти планеты – и крайне загадочна. Хотя вам кажется, что вы ее отлично знаете, многие свойства воды вас очень удивят. А некоторые из них настолько странные, что до сих пор до конца не поняты наукой.
Гонка по нисходящей

Логично мыслящий человек предположит, что горячей воде понадобится больше времени, чтобы остудиться до температуры 0 градусов Цельсия и замерзнуть, чем холодной. Но странно то, что это не всегда правда. В 1963 году танзанийский учащийся по имени Эрасто Мпемба заметил, что в действительности горячая вода замерзает быстрее, чем холодная, когда две массы воды подвергаются воздействию одинаковых условий с температурой ниже нуля.
И никто не знает, почему.
Единственное допущение – это что эффект Мпембы появляется в результате процесса циркуляции тепла под названием конвекция. В контейнере теплая вода поднимается вверх, вытесняя холодную и создавая «утепленный верх». Ученые предполагают, что конвекция может каким-то образом ускорить процесс охлаждения, позволяя более теплой воде замерзать быстрее, чем холодной, несмотря на то, сколько ртутного столбика ей нужно преодолеть до точки замерзания.
Скользкая субстанция

Полтора века научных исследований так и не дали ответ, почему на льду можно упасть. Ученые единогласны в том, что тонкий слой жидкой воды на верху твердого льда становится причиной скользкости, а подвижность жидкости затрудняет движение, даже если лет тонкий. Но нет консенсуса относительного того, почему лед в отличие от большинства твердых веществ имеет такой слой.
Теоретики предполагают, что именно процесс скольжения, то есть контакт со льдом, заставляет таять его поверхность. Другие считают, что жидкий слой существует еще до того, как появляется скользящий предмет, и что он образуется благодаря внутреннему движению молекул поверхности.
Несомненно, вы ищете виновного, лежа на спине и кипя от злости, но, к сожалению, его еще предстоит найти.
Акванавт
На Земле кипящая вода создает тысячи крошечных пузырьков пара. В космосе же создается один гигантский колеблющийся пузырь.
Динамика жидкости столь сложна, что физики не могли предположить, что случится с кипящей водой при нулевой гравитации, пока в 1992 году не был проведен эксперимент на борту космического корабля. После этого физики решили, что упрощенный вид кипения в космосе, очевидно, связан с отсутствием конвекции и подъемной силы – оба этих явления образуются гравитацией. На Земле эти эффекты вызывают бурление, которое мы видим в чайнике.
Парящая жидкость
Когда капля воды падает на поверхность гораздо горячее ее точки кипения, она может гораздо дольше носиться по поверхности, чем вы ожидаете. Это эффект Лейденфроста, и он появляется из-за того, что когда нижний слой капли испаряется, газообразным молекулам воды в этом слое некуда деться, и их присутствие изолирует остаток капли и препятствует ее касанию горячей поверхности. Таким образом, капля существует несколько секунд до того, как полностью испариться.
Необыкновенная оболочка

Порой кажется, что вода отрицает законы физики, удерживаясь от распада, даже несмотря на попытки гравитации или даже давление тяжелых объектов разорвать ее.
Это сила поверхностного натяжения, свойство, которое делает внешний слой массы воды (и некоторых других жидкостей) вести себя, как гибкая оболочка. Поверхностное натяжение возникает из-за того, что молекулы воды слабо связаны друг с другом. Благодаря этому молекулы поверхности испытывают внутреннее усилие от молекул под ними. Вода останется целостной, пока разрывающая ее сила не превзойдет силу этих слабых связей и не прорвет поверхность.
Например, на фото выше скрепка для бумаги лежит на поверхности воды. Хотя металл плотнее воды и потому должен утонуть, поверхностное натяжение не позволяет скрепке прорвать поверхность воды.
Кипящий снег
Когда есть огромная разница температур между водой и внешним воздухом, происходит удивительный эффект – скажем, если вылить кастрюлю кипящей воды (100 градусов Цельсия) в воздух температурой минус 34 градуса Цельсия, то кипящая вода мгновенно превратиться в снег и разлетится.
Объяснение: крайне холодный воздух очень плотный, расстояние между его молекулами такое маленькое, что не остается достаточно места для переноса водяного пара. Кипящая вода, с одной стороны, очень активно испускает пар. Когда ее кидают в воздух, она распадается на капельки, из-за чего появляется еще больше пространства для распространения пара. Это представляет собой проблему. Испускается больше пара, чем может удержать воздух, и потому он распределяется, закрепляясь на микроскопических частицах в воздухе, как сода или кальций, и формирует кристаллы. Именно так и образуются снежинки.
Пустое пространство

Хотя твердое состояние почти любой субстанции плотнее, чем жидкое, так как атомы в твердых телах обычно плотно прилегают друг к другу, это не действует для Н2О. Когда вода замерзает, ее объем увеличивается на почти 8 процентов. Это странное свойство, позволяющее кубам льда и даже громадным айсбергам плавать.
Когда вода охлаждается до точки замерзания, существует меньше энергии, заставляющей молекулы скрепляться, и потому они могут формировать более прочные водородные связи со своими соседями и постепенно закрепляться. Этот же процесс заставляет все жидкости отвердевать. И, как и в других твердых телах, связи между молекулами льда действительно короче и прочнее, чем в жидкой воде; разница в том, что гексагональная структура кристаллов льда оставляет много пустого места, что делает лед в целом менее плотным, чем вода.
Избыток объема можно иногда увидеть в форме выступов на верху кубиков льда в вашей морозильной камере. Эти выступы состоят из избытка воды, выдавленной из кубика замораживающимся (и расширяющимся) льдом. В контейнере вода замерзает от боков и низа к центру и верху, и лед расширяется по направлению к центру.
Единственные в своем роде

Как говорится, нет двух одинаковых снежинок. В самом деле, за всю историю исследования снега каждая прекрасная структура была абсолютно уникальной. И вот почему: снежинка зарождается в форме простой гексагональной призмы. Во время падения она сталкивается с неповторяющимися условиями, меняющими их форму, включая разные температуры, уровни влажности и атмосферное давление. Этих переменных факторов достаточно для того, чтобы формирование кристаллов никогда не проходило дважды по одной схеме.
И что самое интересное относительно снежинок – это что все их шесть ответвлений вырастают абсолютно синхронно, создавая гексагональную симметрию, потому как каждое ответвление испытывает те же условия, что и все другие.
Откуда она?

Точное происхождение воды на нашей планете, покрывающей около 70 процентов поверхности, все еще остается загадкой для ученых. Они подозревают, что любая вода, накапливавшаяся на поверхности планеты во время ее формирования в течение 4,5 миллиардов лет, испарилась бы из-за интенсивного жара молодого Солнца. Это означает, что вода, которую мы сейчас имеем, должна была появиться позже.
Как? В течение периода под названием поздняя тяжелая бомбардировка, проходившего около 4 миллиардов лет назад, массивные объекты, возможно, из других систем падали на Землю и планеты Солнечной системы. Возможно, что такие объекты были наполнены водой, и эти столкновения могли доставить на нашу планету громадные объемы этого вещества.
Кометы – глыбы изо льда и камня с хвостами из испаряющегося льда, вращающиеся по длинным орбитам вокруг Солнца – вполне могут быть остатками того, что упало на планету. Однако есть проблема: удаленные исследования воды, испаряющейся с нескольких крупных комет, выявили, что они состоят из воды другого типа Н2О (содержат более тяжелый изотоп водорода), чем земная, потому такие кометы не могут быть источником всей нашей чудесной воды.
Источник: Lifeslittlemysteries
www.facepla.net
| Физика и химия воды. Вода состоит из двух атомов водорода и одного — кислорода. Все, казалось бы, просто. Но на самом деле есть 42 сочетания этих атомов в молекуле воды, и 9 из них — Устойчивы. Значит, наша обычная Н20 состоит из смеси Девяти видов воды, имеющих весьма различные химические свойства. Эта бесцветная и безвкусная жидкость обладает совершенно уццкальной способностью образовывать необыкно- лвенно прочную поверхностную пленку. На ней может лежать стальная игла, если, конечно, ее осторожно опустить. Более того, установлено, что чем чище вода, тем сильнее растет ее поверхностное натяжение, и если бы удалось получить когда-нибудь абсолютно чистую, без всяких примесей воду, то, как полагают ученые, по озеру такой воды можно было бы не только ходить, но и кататься на коньках. Давно известна людям сила воды. Когда мифический Геракл приступал к свершению своего седьмого по счету подвига, он призвал на помощь силы природы. Чтобы расчистить конюшню царя Авгия, он запрудил реку, и взволновавшийся поток сделал то, что было не по плечу ни одному из эллинов. Вода заставляет жернова мельниц молоть зерно, крутит колеса пароходов, вращает роторы гидротурбин, побуждая бежать по проводам электричество. Казалось бы, исчерпаны разнообразные возможности этого «исторического» вида энергии, узнаны все его способности. И в то же время нет, не все! Водная струя диаметром 3—4 мм, подаваемая под давлением от 300 до 500 атм, режет «черный камень» — уголье При давлении, в 5 раз большем,— мрамор, гранит, песчаник. Срезы аккуратные, гладкие — как ножом (цифра для сравнения: в водопроводном кране вода течет под давлением в 0,5 атм). В нашей стране созданы основы гидроэкструзии — перспективного метода обработки материалов жидкостью высокого давления. Метод гидропрессования, у истоков которого стоял выдающийся советский физик академик JI. Верещагин, обеспечивает ювелирную точность изделий при больших скоростях технологического процесса. Гидромеханический способ добычи угля — один из прогрессивных. В Кузбассе и Донбассе, например, действуют целые шахты гидродобычи, где операции по выемке и погрузке угля выполняет вода. Производительность таких шахт очень высока. К обычным угольным комбайнам рэгработаны гидронасадки — дополнение для более эффективной и облегченной добычи угля. Работают они в комплексе с основными узлами машины — резцом, выгребающим устройством, конвейером. Но главное преимущество, которое дает приспособление,—это снижение запыленности воздуха в забое. . Образование воды из соединений водорода и кислорода при возникновении электрической искры впервые было отмечено в 1783 г. английским физиком Г. Кавендишом. В последующем известны много исследований по уточнению химического состава и физических свойств воды. То, что вода состоит из водорода и кислорода, показали в 1785 г. французский физик А. Лавуазье, а в 1805 г.— немецкий естествоиспытатель А. Гумбольдт и французский исследователь Гей-Люссак. Они определили состав воды: два объема водорода и один — кислорода молекулярный вес 18. К настоящему времени установлено существование веды с молекулярным весом 19, 20, 21, 22. Такие молекулы воды состоят из более тяжелых атомов водорода и кислорода, т. е. водорода, имеющего атомный вес более 1, и кислорода — более 16. Оказалось, что в природе встречается тяжелый изотоп водорода с массой 2, который назван дейтерием (D) и еще более тяжелый изотоп, с массой 3, получивший название тритий ,(Т). У кислорода выявлены три изотопа с атомным весом 16, 17 и 18. Соединение из двух атомов дейтерия и одного кислорода назвали тяжелой водой (В20), а соединение двух атомов трития с одним атомом кислорода — сверхтяжелой водой (Т20). В природных условиях 99,73% составляет обычная вода с молекулярным составом Н2Ю16, 0,04% — тяжелокислородная вода с составом Н2Ю17 и 0,02% — НзЮ18. Доля тяжелой воды (D20) и сверхтяжелой воды |(Т20) в природных водах чрезвычайно мала. Тяжелая вода отличается от обычной как по физическим свойствам, так и по физиологическим воздействиям на организм.Испаряется она медленнее, чем обычная вода. Возможно, это является причиной большего содержания тяжелой воды во внутренних замкнутых водоемах южных Широт. Атмосферная вода в процессе круговорота обогащается Дейтерием благодаря диссипации протонов в космическом пространстве. Именно благодаря этому дождевая вода более богата тяжелым водородом. Тритий может поступать в атмосферу в результате космических процессов, а также обогащать земную воду, правда, в очень небольших Количествах, сверхтяжелой водой. Любопытна структура внутреннего строения молекулы воды. В центре молекулы обычной воды располагается кислорода, а на некотором расстоянии — два атома водорода. Атомы водорода по отношению к атому кислорода находятся не по прямой линии, проведенной через центр атома кислорода, а под углом, равным 105°. Связь между атомами водорода и кислорода в молекуле воды осуществляется электронами. Поскольку ядра атомов водорода и кислорода расположены несимметрично, молекулы воды имеют форму тетраэдра, в вершинах которого имеются четыре полюса зарядов. Каждая молекула воды способна соединиться с четырьмя ближайшими к ней молекулами. При этом положительно заряженный полюс одной молекулы притягивает отрицательно заряженный полюс другой. Таким образом могут образоваться группировки молекул, состоящих из двух, трех и более молекул. В зависимости от температуры и давления среды, в которой находится вода, расстояния между молекулами могут увеличиваться или сокращаться. Это делает структуру воды исключительно изменчивой. Повышение температуры вызывает увеличение скорости молекул и расстояния между ними. Максимальная плотность воды достигается при температуре плюс 4°С. Вода, как все вещества в природе, при охлаждении от плюс 100° до плюс 4° уменьшается в объеме. При дальнейшем охлаждении воды до 0° ее объем увеличивается. Такое свойство типично только для воды. Ученые объясняют это тем, что при понижении температуры от 4° до 0° происходит перестройка ее внутренней структуры, жидкость превращается в лед, т. е. в кристалл, где молекулы образуют своеобразную решетку. При замерзании объем воды возрастает примерно на 11%. В связи с этим замерзание ее в замкнутом пространстве приводит к возникновению избыточного давления, достигающего, как показывают наблюдения, 2,5 тыс. кгс/см2. Этим объясняют разрушительную силу замерзающей воды в замкнутых пустотах, трещинах горных пород, откалывающую подчас многотонные глыбы и дробящую их в дальнейшем на мелкие осколки. С увеличением давления термпература замерзания воды уменьшается. Эта зависимость для воды аномальна: у других веществ, наоборот, с ростом давления температура замерзания повышается. Подобная аномалия воды очень важная [ Даже без учета растворенных в ней солей вода на больший | глубинах в океаце не замерзает, причем при температуре минус З'С этого не случается даже на глубине около 4 тыс. м. Так как максимальная плотность воды наблюдается при 4°С, то лед оказывается легче жидкой воды и поэтому плавает на ее поверхности.Если бы этого не происходило, то водоемы и водотоки промерзали бы зимой до самого дна, что было бы настоящей катастрофой для всего живого в них. Впрочем, эта особенность воды при некоторых условиях имеет исключения. Речь идет о возможности образования донного или внутриводного льда. Теплоемкость воды в 3,3 тыс. раз выше теплоемкости воздуха. Иными словами, нагревая 1 л воды и 1 л воздуха на 1°С, мы в первом случае затратим в 3,3 тыс. раз больше энергии, чем во втором. Климатическое значение этой аномалии трудно переоценить. Высокая теплоемкость делает воду главным аккумулятором солнечной энергии и распределителем ее на планете. Морские течения переносят тепло, накопленное летом в морях и океанах, из южных в северные районы земного шара, прогревая на пути воздух и воду, смягчая и выравнивая климат в этих шпротах. О существовании течений в океанах знали давно: древние греки называли океан рекой и считали, что он течет подобно реке: они могли наблюдать сильные приливы и отливы лишь за пределами своих внутренних морей. Течения переносят громадные массы воды, перераспределяя накопленное Мировым океаном солнечное тепло. Один лишь Гольфстрим по своей мощности превосходит все реки планеты, вместе взятые. Благодаря этому течению каждый квадратный сантиметр европейского побережья получает в год 4 млрд. ккал — столько тепла выделяется при сжигании 0,5 млн. т угля. В различных районах земного шара известны и другие поверхностные течения — теплые или холодные. Их издавна хорошо изучили мореходы и рыбаки; ученые основы- Бали на данных об их мощности и направлениях свои заключения о циркуляции воды в верхних слоях океана. Например, Гольфстрим уже многие столетия является для Мореходов своеобразной рекой в океане. Хорошо зная его Режим и направление, опытный кормчий ведет корабль в стРуе Гольфстрима, сокращая время пути к берегам Евро- 1Гк гаоборот, двигаясь в обратном направлении, предпо- v-x держаться в стороне. Из физических свойств воды можно обратить внимание на следующее. Толочь воду — не такое уж бесперспективное занятие, как выяснили эстонские ученые. Правда, вместо допотопной ступы они использовали дезинтегратор — своеобразную мельницу со стремительно вращающимися роторами. Оказалось, что в активированной таким образом воде форель, например, растет в 1,5 раза быстрее. Из 100 икринок форели обычно появляются лишь 50 мальков, а в активированной воде — 90. Повышает она и урожаи различных культур. Однако пока нет научного объяснения этого явления. Предполагают, что молекулы воды объединяются в некие цепочки, которые с течением тысячелетий удлиняются. Вода, как бы стареет, медленнее проникает в ткани растений и животных. А вот сотни миллионов лет назад, когда на Земле бушевали смерчи и ураганы, вода была богаче энергией, моложе. Рыбы в ней лучше развивались, потому и достигали огромных размеров. Дезинтегратор, по-видимому, проделывает ту же работу — разрушает цепочки молекул. Являясь хорошим растворителем, вода сохраняет свою инертность. Благодаря этому свойству, живые организмы получают важнейшие питательные вещества в растворах, в малоизмененном виде. В воде могут растворяться твердые, жидкие и газообразные вещества. Абсолютно нерастворимых в воде веществ в природе нет: в ничтожных количествах этому процессу подвержены даже такие элементы, как серебро, золото, гранит, базальт и др. В естественных условиях практически невозможно представить чистую воду. Она всюду обогащена примесями различных веществ. Дождевая вода имеет примеси веществ, находящихся в атмосфере. 6 воздухе над морями и океанами содержатся соли, характерные для морской и океанической воды. Вода рек и озер ббогащена частицами поверхностной почвы и горных пород. По содержанию ионов природные воды делятся на пресные, минерализация которых не превышает 1 г/л минерализованные, содержащие от 1 до 50 г/л минерал ных веществ, и рассолы, в которых содержится свыше 50 г/л минералов. Наиболее распространенные группы минерализаци образуются при растворении хлорйдов, сульфатов и гидрокарбонатов, находящихся в недрах Земли. По этим причалам проводится классификация вод. Наиболее чаще встречаются воды: гидрокарбонатные, сульфатные и хлорид ные. В природных водах практически всегда присутствуют микроэлементы. К ним относятся бор, бром, фтор, йод, медь, мышьяк, никель, кобальт, цинк и др. Вместе с водой микроэлементы поступают в организм человека, животных и растений. Хотя концентрации этих веществ находятся в сравнительно малых количествах, но они совершенно незаменимы. Они оказывают влияние па ход и направленность обменных процессов организма. В частности, они способны стимулировать или угнетать ферментные процессы, принимают непосредственное участие в процессах эритропоэза и гемоглобинообразования. Отмечено положительное влияние микроэлементов на рост, размножение и продолжительность жизни животных и растений. Похожие статьи: Добавить статью в закладки
|
Физика и химия воды. Вода и жизнь на Земле
Физика и химия воды
Вода состоит из двух атомов водорода и одного — кислорода. Все, казалось бы, просто. Но на самом деле есть 42 сочетания этих атомов в молекуле воды, и 9 из них — устойчивы. Значит, наша обычная Н2O состоит из смеси девяти видов воды, имеющих весьма различные химические свойства.
Эта бесцветная и безвкусная жидкость обладает совершенно уникальной способностью образовывать необыкновенно прочную поверхностную пленку. На ней может лежать стальная игла, если, конечно, ее осторожно опустить. Более того, установлено, что чем чище вода, тем сильнее растет ее поверхностное натяжение, и если бы удалось получить когда-нибудь абсолютно чистую, без всяких примесей воду, то, как полагают ученые, по озеру такой воды можно было бы не только ходить, но и кататься на коньках.
Давно известна людям сила воды. Когда мифический Геракл приступал к свершению своего седьмого по счету подвига, он призвал на помощь силы природы. Чтобы расчистить конюшню царя Авгия, он запрудил реку, и взволновавшийся поток сделал то, что было не по плечу ни одному из эллинов.
Вода заставляет жернова мельниц молоть зерно, крутит колеса пароходов, вращает роторы гидротурбин, побуждая бежать по проводам электричество. Казалось бы, исчерпаны разнообразные возможности этого «исторического» вида энергии, узнаны все его способности. И в то же время нет, не все!
Водная струя диаметром 3–4 мм, подаваемая под давлением от 300 до 500 атм, режет «черный камень» — уголь. При давлении, в 5 раз большем, — мрамор, гранит, песчаник. Срезы аккуратные, гладкие — как ножом (цифра для сравнения: в водопроводном кране вода течет под давлением в 0,5 атм).
В нашей стране созданы основы гидроэкструзии — перспективного метода обработки материалов жидкостью высокого давления.
Метод гидропрессования, у истоков которого стоял выдающийся советский физик академик Л. Верещагин, обеспечивает ювелирную точность изделий при больших скоростях технологического процесса.
Гидромеханический способ добычи угля — один из прогрессивных. В Кузбассе и Донбассе, например, действуют целые шахты гидродобычи, где операции по выемке и погрузке угля выполняет вода. Производительность таких шахт очень высока. К обычным угольным комбайнам разработаны гидронасадки — дополнение для более эффективной и облегченной добычи угля. Работают они в комплексе с основными узлами машины — резцом, выгребающим устройством, конвейером. Но главное преимущество, которое дает приспособление, — это снижение запыленности воздуха в забое.
Образование воды из соединений водорода и кислорода при возникновении электрической искры впервые было отмечено в 1783 г. английским физиком Г. Кавендишом. В последующем известны много исследований по уточнению химического состава и физических свойств воды. То, что вода состоит из водорода и кислорода, показали в 1785 г. французский физик А. Лавуазье, а в 1805 г. — немецкий естествоиспытатель А. Гумбольдт и французский исследователь Гей-Люссак. Они определили состав воды: два объема водорода и один — кислорода молекулярный вес 18.
К настоящему времени установлено существование воды с молекулярным весом 19, 20, 21, 22. Такие молекулы воды состоят из более тяжелых атомов водорода и кислорода, т. е. водорода, имеющего атомный вес более 1, и кислорода — более 16. Оказалось, что в природе встречается тяжелый изотоп водорода с массой 2, который назван дейтерием (D) и еще более тяжелый изотоп, с массой 3, получивший название тритий (Т). У кислорода выявлены три изотопа с атомным весом 16, 17 и 18.
Соединение из двух атомов дейтерия и одного кислорода назвали тяжелой водой (D2O), а соединение двух атомов трития с одним атомом кислорода — сверхтяжелой водой (Т2O). В природных условиях 99,73 % составляет обычная вода с молекулярным составом Н21O16, 0,04 % — тяжелокислородная вода с составом Н21O17 и 0,02 % — h31O18. Доля тяжелой воды (D2O) и сверхтяжелой воды (Т2O) в природных водах чрезвычайно мала.
Тяжелая вода отличается от обычной как по физическим свойствам, так и по физиологическим воздействиям на организм. Испаряется она медленнее, чем обычная вода. Возможно, это является причиной большего содержания тяжелой воды во внутренних замкнутых водоемах южных широт.
Атмосферная вода в процессе круговорота обогащается дейтерием благодаря диссипации протонов в космическом пространстве. Именно благодаря этому дождевая вода более богата тяжелым водородом. Тритий может поступать в атмосферу в результате космических процессов, а также обогащать земную воду, правда, в очень небольших количествах, сверхтяжелой водой.
Любопытна структура внутреннего строения молекулы воды. В центре молекулы обычной воды располагается атом кислорода, а на некотором расстоянии — два атома водорода. Атомы водорода по отношению к атому кислорода находятся не по прямой линии, проведенной через центр атома кислорода, а под углом, равным 105°. Связь между атомами водорода и кислорода в молекуле воды осуществляется электронами.
Поскольку ядра атомов водорода и кислорода расположены несимметрично, молекулы воды имеют форму тетраэдра, в вершинах которого имеются четыре полюса зарядов.
Каждая молекула воды способна соединиться с четырьмя ближайшими к ней молекулами. При этом положительно заряженный полюс одной молекулы притягивает отрицательно заряженный полюс другой. Таким образом могут образоваться группировки молекул, состоящих из двух, трех и более молекул. В зависимости от температуры и давления среды, в которой находится вода, расстояния между молекулами могут увеличиваться или сокращаться. Это делает структуру воды исключительно изменчивой. Повышение температуры вызывает увеличение скорости молекул и расстояния между ними. Максимальная плотность воды достигается при температуре плюс 4 °C.
Вода, как все вещества в природе, при охлаждении от плюс 100° до плюс 4° уменьшается в объеме. При дальнейшем охлаждении воды до 0° ее объем увеличивается. Такое свойство типично только для воды. Ученые объясняют это тем, что при понижении температуры от 4° до 0° происходит перестройка ее внутренней структуры, жидкость превращается в лед, т. е. в кристалл, где молекулы образуют своеобразную решетку.
При замерзании объем воды возрастает примерно на 11 %. В связи с этим замерзание ее в замкнутом пространстве приводит к возникновению избыточного давления, достигающего, как показывают наблюдения, 2,5 тыс. кгс/см2. Этим объясняют разрушительную силу замерзающей воды в замкнутых пустотах, трещинах горных пород, откалывающую подчас многотонные глыбы и дробящую их в дальнейшем на мелкие осколки. С увеличением давления температура замерзания воды уменьшается. Эта зависимость для воды аномальна: у других веществ, наоборот, с ростом давления температура замерзания повышается. Подобная аномалия воды очень важна. Даже без учета растворенных в ней солей вода на больших глубинах в океане не замерзает, причем при температуре минус 3 °C этого не случается даже на глубине около 4 тыс. м.
Так как максимальная плотность воды наблюдается при 4 °C, то лед оказывается легче жидкой воды и поэтому плавает на ее поверхности. Если бы этого не происходило, то водоемы и водотоки промерзали бы зимой до самого дна, что было бы настоящей катастрофой для всего живого в них. Впрочем, эта особенность воды при некоторых условиях имеет исключения. Речь идет о возможности образования донного или внутриводного льда.
Теплоемкость воды в 3,3 тыс. раз выше теплоемкости воздуха. Иными словами, нагревая 1 л воды и 1 л воздуха на 1 °C, мы в первом случае затратим в 3,3 тыс. раз больше энергии, чем во втором. Климатическое значение этой аномалии трудно переоценить. Высокая теплоемкость делает воду главным аккумулятором солнечной энергии и распределителем ее на планете. Морские течения переносят тепло, накопленное летом в морях и океанах, из южных в северные районы земного шара, прогревая на пути воздух и воду, смягчая и выравнивая климат в этих шпротах.
О существовании течений в океанах знали давно: древние греки называли океан рекой и считали, что он течет подобно реке: они могли наблюдать сильные приливы и отливы лишь за пределами своих внутренних морей. Течения переносят громадные массы воды, перераспределяя накопленное Мировым океаном солнечное тепло. Один лишь Гольфстрим по своей мощности превосходит все реки планеты, вместе взятые. Благодаря этому течению каждый квадратный сантиметр европейского побережья получает в год 4 млрд. ккал — столько тепла выделяется при сжигании 0,5 млн. т угля.
В различных районах земного шара известны и другие поверхностные течения — теплые или холодные. Их издавна хорошо изучили мореходы и рыбаки; ученые основывали на данных об их мощности и направлениях свои заключения о циркуляции воды в верхних слоях океана. Например, Гольфстрим уже многие столетия является для мореходов своеобразной рекой в океане. Хорошо зная его режим и направление, опытный кормчий ведет корабль в струе Гольфстрима, сокращая время пути к берегам Европы, и, наоборот, двигаясь в обратном направлении, предпочитает держаться в стороне.
Из физических свойств воды можно обратить внимание на следующее. Толочь воду — не такое уж бесперспективное занятие, как выяснили эстонские ученые. Правда, вместо допотопной ступы они использовали дезинтегратор — своеобразную мельницу со стремительно вращающимися роторами.
Оказалось, что в активированной таким образом воде форель, например, растет в 1,5 раза быстрее. Из 100 икринок форели обычно появляются лишь 50 мальков, а в активированной воде — 90. Повышает она и урожаи различных культур.
Однако пока нет научного объяснения этого явления. Предполагают, что молекулы воды объединяются в некие цепочки, которые с течением тысячелетий удлиняются. Вода, как бы стареет, медленнее проникает в ткани растений и животных. А вот сотни миллионов лет назад, когда на Земле бушевали смерчи и ураганы, вода была богаче энергией, моложе. Рыбы в ней лучше развивались, потому и достигали огромных размеров. Дезинтегратор, по-видимому, проделывает ту же работу — разрушает цепочки молекул.
Являясь хорошим растворителем, вода сохраняет свою инертность. Благодаря этому свойству, живые организмы получают важнейшие питательные вещества в растворах, в малоизмененном виде.
В воде могут растворяться твердые, жидкие и газообразные вещества. Абсолютно нерастворимых в воде веществ в природе нет: в ничтожных количествах этому процессу подвержены даже такие элементы, как серебро, золото, гранит, базальт и др. В естественных условиях практически невозможно представить чистую воду. Она всюду обогащена примесями различных веществ. Дождевая вода имеет примеси веществ, находящихся в атмосфере. В воздухе над морями и океанами содержатся соли, характерные для морской и океанической воды. Вода рек и озер обогащена частицами поверхностной почвы и горных пород.
По содержанию ионов природные воды делятся на пресные, минерализация которых не превышает 1 г/л; минерализованные, содержащие от 1 до 50 г/л минеральных веществ, и рассолы, в которых содержится свыше 50 г/л минералов.
Наиболее распространенные группы минерализации образуются при растворении хлоридов, сульфатов и гид рокарбонатов, находящихся в недрах Земли. По этим признакам проводится классификация вод. Наиболее чаще встречаются воды: гидрокарбонатные, сульфатные и хлоридные.
В природных водах практически всегда присутствуют и микроэлементы. К ним относятся бор, бром, фтор, йод, медь, мышьяк, никель, кобальт, цинк и др. Вместе с водой микроэлементы поступают в организм человека, животных и растений. Хотя концентрации этих веществ находятся в сравнительно малых количествах, но они совершенно незаменимы. Они оказывают влияние на ход и направленность обменных процессов организма. В частности, они способны стимулировать или угнетать ферментные процессы, принимают непосредственное участие в процессах эритропоэза и гемоглобинообразования. Отмечено положительное влияние микроэлементов на рост, размножение и продолжительность жизни животных и растений.
Поделитесь на страничкеСледующая глава >
bio.wikireading.ru
Вода. Тяжелая вода Содержание 1. Вода в природе 2. Физические свойства воды 3. Диаграмма состояния воды 4. Химические свойства воды 5. Тяжелая вода 6. Библиография 1. Вода в природе. Вода — весьма распространенное на Земле вещество. Почти 3/4 поверхности земного шара покрыты водой, образующей океаны, моря, реки и озера. Много воды находится в газообразном состоянии в виде паров в атмосфере; в виде огромных масс снега и льда лежит она круглый год на вершинах высоких гор и в полярных странах. В недрах земли также находится вода, пропитывающая почву и горные породы. Природная вода не бывает совершенно чистой. Наиболее чистой является дождевая вода, но и она содержит незначительные количества различных примесей, которые захватывает из воздуха. Количество примесей в пресных водах обычно лежит в пределах от 0,01 до 0,1% (масс.) . Морская вода содержит 3,5% (масс.) растворенных веществ, главную массу которых составляет хлорид натрия (поваренная соль) . Вода, содержащая значительное количество солей кальция и магния, называется жесткой в отличие от мягкой воды, например дождевой. Жесткая вода дает мало пены с мылом, а на стенках котлов образует накипь. Чтобы освободить природную воду от взвешенных в ней частиц, ее фильтруют сквозь слой пористого вещества, например, угля, обожженной глины и т.п. При фильтровании больших количеств воды пользуются фильтрами из песка и гравия. Фильтры задерживают также большую часть бактерий. Кроме того, для обеззараживания питьевой воды ее хлорируют; для полной стерилизации воды требуется не более 0,7 г хлора на 1 т воды. Фильтрованием можно удалить из воды только нерастворимые примеси. Растворенные вещества удаляют из нее путем перегонки (дистилляции) или ионного обмена. Вода имеет очень большое значение в жизни растений, животных и человека. Согласно современным представлениям, само происхождение жизни связывается с морем. Во всяком организме вода представляет собой среду, в которой протекают химические процессы, обеспечивающие жизнедеятельность организма; кроме того, она сама принимает участие в целом ряде биохимических реакций. 2. Физические свойства воды. Чистая вода представляет собой бесцветную прозрачную жидкость. Плотность воды при переходе ее из твердого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает. При нагревании воды от 0 до 4°С плотность ее также увеличивается. При 4°С вода имеет максимальную плотность, и лишь при дальнейшем нагревании ее плотность уменьшается. Если бы при понижении температуры и при переходе из жидкого состояния в твердое плотность воды изменялась так же, как это происходит у подавляющего большинства веществ, то при приближении зимы поверхностные слои природных вод охлаждались. бы до 0°С и опускались на дно, освобождая место более теплым слоям, и так продолжалось бы до тех пор, пока вся масса водоема не приобрела бы температуру 0°С. Далее вода начинала бы замерзать, образующиеся льдины погружались бы на дно и водоем промерзал бы на всю его глубину. При этом многие формы жизни в воде были бы невозможны. Но так как наибольшей плотность вода достигает при 4 °С, то перемещение ее слоев, вызываемое охлаждением, заканчивается при достижении этой температуры. При дальнейшем понижении температуры охлажденный слой, обладающий меньшей плотностью, остается на поверхности, замерзает и тем самым защищает лежащие ниже слои от дальнейшего охлаждения и замерзания. Большое значение в жизни природы имеет и тот факт, что вода. обладает аномально высокой теплоемкостью [4,18 Дж/(г К) ], Поэтому. в ночное время, а также при переходе от лета к зиме вода остывает медленно, а днем или при переходе от зимы к лету так же медленно нагревается, являясь, таким образом, регулятором температуры на земном шаре. В связи с тем, что при плавлении льда объем, занимаемый водой, уменьшается, давление понижает температуру плавления льда. Эта вытекает из принципа Ле Шателье. Действительно, пусть. лед и жидкая вода находятся в равновесии при О°С . При увеличении давления равновесие, согласно принципу Ле Шателье, сместится в сторону образования той фазы, которая при той же температуре занимает меньший объем. Этой фазой является в данном случае жидкость. Таким образом, возрастание давления при О°С вызывает превращение льда в жидкость, а это и означает, что температура плавления льда снижается. Молекула воды имеет угловое строение; входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине — ядро атома кислорода, Межъядерные расстояния О—Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно примерно 0,15 нм. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды К) ], Поэтому. в ночное время, а также при переходе от лета к зиме вода остывает медленно, а днем или при переходе от зимы к лету так же медленно нагревается, являясь, таким образом, регулятором температуры на земном шаре. В связи с тем, что при плавлении льда объем, занимаемый водой, уменьшается, давление понижает температуру плавления льда. Эта вытекает из принципа Ле Шателье. Действительно, пусть. лед и жидкая вода находятся в равновесии при О°С . При увеличении давления равновесие, согласно принципу Ле Шателье, сместится в сторону образования той фазы, которая при той же температуре занимает меньший объем. Этой фазой является в данном случае жидкость. Таким образом, возрастание давления при О°С вызывает превращение льда в жидкость, а это и означает, что температура плавления льда снижается. Молекула воды имеет угловое строение; входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине — ядро атома кислорода, Межъядерные расстояния О—Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно примерно 0,15 нм. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды  две электронные пары образуют ковалентные связи О—Н, а остальные четыре электрона представляют собой две неподеленных электронных пары. Атом кислорода в молекуле воды находится в состоянии две электронные пары образуют ковалентные связи О—Н, а остальные четыре электрона представляют собой две неподеленных электронных пары. Атом кислорода в молекуле воды находится в состоянии  -гибридизации. Поэтому валентный угол НОН (104,3°) близок к тетраэдрическому (109,5°) . Электроны, образующие связи О—Н, смещены к более электроотрицательному атому кислорода. В результате атомы водорода приобретают эффективные положительные заряды, так что на этих атомах создаются два положительных полюса. Центры отрицательных зарядов неподеленных электронных пар атома кислорода, находящиеся на гибридных -гибридизации. Поэтому валентный угол НОН (104,3°) близок к тетраэдрическому (109,5°) . Электроны, образующие связи О—Н, смещены к более электроотрицательному атому кислорода. В результате атомы водорода приобретают эффективные положительные заряды, так что на этих атомах создаются два положительных полюса. Центры отрицательных зарядов неподеленных электронных пар атома кислорода, находящиеся на гибридных  - орбиталях, смещены относительно ядра атома и создают два отрицательных полюса - орбиталях, смещены относительно ядра атома и создают два отрицательных полюса  Молекулярная масса парообразной воды равна 18 и отвечает ее простейшей формуле. Однако молекулярная масса жидкой воды, определяемая путем изучения ее растворов в других растворителях оказывается более, высокой. Это свидетельствует о том, что в жидкой воде происходит ассоциация молекул, т.е. соединение их в более сложные агрегаты. Такой вывод подтверждается и аномально высокими значениями температур плавления и кипения воды. Ассоциация молекул воды вызвана образованием между ними водородных связей. В твердой воде (лед) атом кислорода каждой молекулы участвует в образовании двух водородных связей с соседними молекулами воды согласно схеме, Молекулярная масса парообразной воды равна 18 и отвечает ее простейшей формуле. Однако молекулярная масса жидкой воды, определяемая путем изучения ее растворов в других растворителях оказывается более, высокой. Это свидетельствует о том, что в жидкой воде происходит ассоциация молекул, т.е. соединение их в более сложные агрегаты. Такой вывод подтверждается и аномально высокими значениями температур плавления и кипения воды. Ассоциация молекул воды вызвана образованием между ними водородных связей. В твердой воде (лед) атом кислорода каждой молекулы участвует в образовании двух водородных связей с соседними молекулами воды согласно схеме,   в которой водородные связи показаны пунктиром. Схема объемной структуры льда изображена на рисунке. Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются друг с другом своими разноименными полюсами. Молекулы образуют слои, причем каждая из них связана с тремя молекулами, принадлежащими к тому же слою, и с одной — из соседнего слоя. Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры наименее плотным структурам, в ней существуют пустоты, размеры которых несколько превышают размеры молекулы в которой водородные связи показаны пунктиром. Схема объемной структуры льда изображена на рисунке. Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются друг с другом своими разноименными полюсами. Молекулы образуют слои, причем каждая из них связана с тремя молекулами, принадлежащими к тому же слою, и с одной — из соседнего слоя. Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры наименее плотным структурам, в ней существуют пустоты, размеры которых несколько превышают размеры молекулы  . При плавлении льда его структура разрушается. Но и в жидкой воде сохраняются водородные связи между молекулами: образуются ассоциаты — как бы обломки структуры льда, — состоящих из большего или меньшего числа молекул воды. Однако в отличие ото льда каждый ассоциат существует очень короткое время: постоянно происходит разрушение одних и образование других агрегатов. В пустотах таких “ледяных” агрегатов могут размещаться одиночные молекулы воды; при этом упаковка молекул воды становится более плотной. Именно поэтому при плавлении льда объем, занимаемый водой, уменьшается, а ее плотность возрастает. По мере нагревания воды обломков структуры льда в ней становится все меньше, что приводит к дальнейшему повышению плотности воды. В интервале температур от 0 до 4°С этот эффект преобладает над тепловым расширением, так что плотность воды продолжает возрастать. Однако при нагревании выше 4°С преобладает влияние усиления теплового движения молекул и плотность воды уменьшается. Поэтому при 4°С вода обладает максимальной плотностью. При нагревании воды часть теплоты затрачивается на разрыв водородных связей (энергия разрыва водородной связи в воде составляет примерно 25 кДж/моль) . Этим объясняется высокая теплоемкость воды. Водородные связи между молекулами воды полностью разрываются только при переходе воды в пар. 3. Диаграмма состояния воды. Диаграмма состояния (или фазовая диаграмма) представляет собой графическое изображение зависимости между величинами, характеризующими состояние системы, и фазовыми превращениями в системе (переход из твердого состояния в жидкое, из жидкого в газообразной и т.д.) . Диаграммы состояния широко применяются в химии. Для однокомпонентных систем обычно используются диаграммы состояния, показывающие зависимость фазовых превращений от температуры и давления; они называются диаграммами состояния в координатах Р—Т. На рисунке приведена в схематической форме (без строгого соблюдения масштаба) диаграмма состояния воды. Любой точке на диаграмме отвечают определенные значения температуры и давления. Диаграмма показывает те состояния воды, которые термодинамически устойчивы при определенных значениях температуры и давления. Она состоит из трех кривых, разграничивающих все возможные температуры и давления на три области, отвечающие льду, жидкости и пару. . При плавлении льда его структура разрушается. Но и в жидкой воде сохраняются водородные связи между молекулами: образуются ассоциаты — как бы обломки структуры льда, — состоящих из большего или меньшего числа молекул воды. Однако в отличие ото льда каждый ассоциат существует очень короткое время: постоянно происходит разрушение одних и образование других агрегатов. В пустотах таких “ледяных” агрегатов могут размещаться одиночные молекулы воды; при этом упаковка молекул воды становится более плотной. Именно поэтому при плавлении льда объем, занимаемый водой, уменьшается, а ее плотность возрастает. По мере нагревания воды обломков структуры льда в ней становится все меньше, что приводит к дальнейшему повышению плотности воды. В интервале температур от 0 до 4°С этот эффект преобладает над тепловым расширением, так что плотность воды продолжает возрастать. Однако при нагревании выше 4°С преобладает влияние усиления теплового движения молекул и плотность воды уменьшается. Поэтому при 4°С вода обладает максимальной плотностью. При нагревании воды часть теплоты затрачивается на разрыв водородных связей (энергия разрыва водородной связи в воде составляет примерно 25 кДж/моль) . Этим объясняется высокая теплоемкость воды. Водородные связи между молекулами воды полностью разрываются только при переходе воды в пар. 3. Диаграмма состояния воды. Диаграмма состояния (или фазовая диаграмма) представляет собой графическое изображение зависимости между величинами, характеризующими состояние системы, и фазовыми превращениями в системе (переход из твердого состояния в жидкое, из жидкого в газообразной и т.д.) . Диаграммы состояния широко применяются в химии. Для однокомпонентных систем обычно используются диаграммы состояния, показывающие зависимость фазовых превращений от температуры и давления; они называются диаграммами состояния в координатах Р—Т. На рисунке приведена в схематической форме (без строгого соблюдения масштаба) диаграмма состояния воды. Любой точке на диаграмме отвечают определенные значения температуры и давления. Диаграмма показывает те состояния воды, которые термодинамически устойчивы при определенных значениях температуры и давления. Она состоит из трех кривых, разграничивающих все возможные температуры и давления на три области, отвечающие льду, жидкости и пару.
 = —239,9 °С, = —239,9 °С,  = 1,30 МПа, для хлора = 1,30 МПа, для хлора  =144°С, =144°С,  =7,71 МПа, для воды =7,71 МПа, для воды  = 374,2 °С, = 374,2 °С,  =22,12 МПа. Одной из особенностей воды, отличающих ее от других веществ, является понижение температуры плавления льда с ростом давления. Это обстоятельство отражается на диаграмме. Кривая плавления ОС на диаграмме состояния воды идет вверх влево, тогда как почти для всех других веществ она идет вверх вправо. Превращения, происходящие с водой при атмосферном давлении, отражаются на диаграмме точками или отрезками, расположенными на горизонтали, отвечающей 101,3 кПа (760 мм рт. ст.) . Так, плавление льда или кристаллизация воды отвечает точке D, кипение воды—точке Е, нагревание или охлаждение воды — отрезку DE и т.п. Диаграммы состояния изучены для ряда веществ, имеющих научное или практическое значение. В принципе они подобны рассмотренной диаграмме состояния воды. Однако на диаграммах состояния различных веществ могут быть особенности. Так, известны вещества, тройная точка которых лежит при давлении, превышающем атмосферное. В этом случае нагревание кристаллов при атмосферном давлении приводит не к плавлению этого вещества, а к его сублимации - превращению твердой фазы непосредственно в газообразную. 4. Химические свойства воды. Молекулы воды отличаются большой устойчивостью к нагреванию. Однако при температурах выше 1000 °С водяной пар начинает разлагаться на водород и кислород: 2Н =22,12 МПа. Одной из особенностей воды, отличающих ее от других веществ, является понижение температуры плавления льда с ростом давления. Это обстоятельство отражается на диаграмме. Кривая плавления ОС на диаграмме состояния воды идет вверх влево, тогда как почти для всех других веществ она идет вверх вправо. Превращения, происходящие с водой при атмосферном давлении, отражаются на диаграмме точками или отрезками, расположенными на горизонтали, отвечающей 101,3 кПа (760 мм рт. ст.) . Так, плавление льда или кристаллизация воды отвечает точке D, кипение воды—точке Е, нагревание или охлаждение воды — отрезку DE и т.п. Диаграммы состояния изучены для ряда веществ, имеющих научное или практическое значение. В принципе они подобны рассмотренной диаграмме состояния воды. Однако на диаграммах состояния различных веществ могут быть особенности. Так, известны вещества, тройная точка которых лежит при давлении, превышающем атмосферное. В этом случае нагревание кристаллов при атмосферном давлении приводит не к плавлению этого вещества, а к его сублимации - превращению твердой фазы непосредственно в газообразную. 4. Химические свойства воды. Молекулы воды отличаются большой устойчивостью к нагреванию. Однако при температурах выше 1000 °С водяной пар начинает разлагаться на водород и кислород: 2Н О О  2Н 2Н +О +О Процесс разложения вещества в результате его нагревания называется термической диссоциацией. Термическая диссоциация воды протекает с поглощением теплоты. Поэтому, согласно принципу Ле Шателье, чем выше температура, тем в большей степени разлагается вода. Однако даже при 2000 °С степень термической диссоциации воды не превышает 2%, т.е. равновесие между газообразной водой и продуктами ее диссоциации — водородом и кислородом — все еще остается сдвинутым в сторону воды. При охлаждении же ниже 1000 °С равновесие практически полностью сдвигается в этом направлении. Вода — весьма реакционноспособное вещество. Оксиды многих металлов и неметаллов соединяются с водой, образуя основания и кислоты; некоторые соли образуют с водой кристаллогидраты; наиболее активные металлы взаимодействуют с водой с выделением водорода. Вода обладает также каталитической способностью. В отсутствие следов влаги практически не протекают некоторые обычные реакции; например, хлор не взаимодействует с металлами, фтороводород не разъедает стекло, натрий не окисляется в атмосферы воздуха. Вода способна соединяться с рядом веществ, находящихся при обычных условиях в газообразном состоянии, образуя при этом так: называемые гидраты газов. Примерами могут служить соединения Хе Процесс разложения вещества в результате его нагревания называется термической диссоциацией. Термическая диссоциация воды протекает с поглощением теплоты. Поэтому, согласно принципу Ле Шателье, чем выше температура, тем в большей степени разлагается вода. Однако даже при 2000 °С степень термической диссоциации воды не превышает 2%, т.е. равновесие между газообразной водой и продуктами ее диссоциации — водородом и кислородом — все еще остается сдвинутым в сторону воды. При охлаждении же ниже 1000 °С равновесие практически полностью сдвигается в этом направлении. Вода — весьма реакционноспособное вещество. Оксиды многих металлов и неметаллов соединяются с водой, образуя основания и кислоты; некоторые соли образуют с водой кристаллогидраты; наиболее активные металлы взаимодействуют с водой с выделением водорода. Вода обладает также каталитической способностью. В отсутствие следов влаги практически не протекают некоторые обычные реакции; например, хлор не взаимодействует с металлами, фтороводород не разъедает стекло, натрий не окисляется в атмосферы воздуха. Вода способна соединяться с рядом веществ, находящихся при обычных условиях в газообразном состоянии, образуя при этом так: называемые гидраты газов. Примерами могут служить соединения Хе 6Н 6Н О, CI О, CI  8H 8H O, С O, С Н Н  6Н 6Н О, С О, С Н Н  17Н 17Н О, которые выпадают в виде кристаллов при температурах от 0 до 24 °С (обычно при повышенном давлении соответствующего газа) . Подобные соединения возникают в результате заполнения молекулами газа (“гостя” ) межмолекулярных полостей, имеющихся в структуре воды (“хозяина” ) ; они называются соединениями включения или клатратами . В клатратных соединениях между молекулами “гостя” и “хозяина” образуются лишь слабые межмолекулярные связи; включенная молекула не может покинуть своего места в полости кристалла преимущественно из-за пространственных затруднений. Поэтому клатраты — неустойчивые соединения, которые могут существовать лишь при сравнительно низких температурах. Клатраты используют для разделения углеводородов и благородных газов. В последнее время образование и разрушение клатратов газов (пропана и некоторых других) успешно применяется для обессоливания воды. Нагнетая в соленую воду при повышенном давлении соответствующий газ, получают льдоподобные кристаллы клатратов, а соли остаются в растворе. Похожую на снег массу кристаллов отделяют от маточного раствора и промывают, Затем при некотором повышении температуры или уменьшении давления клатраты разлагаются, образуя пресную воду и исходный газ, который вновь используется для получения клатрата. Высокая экономичность и сравнительно мягкие условия осуществления этого процесса делают его перспективным в качестве промышленного метода опреснения морской воды. 5. Тяжелая вода. При электролизе обычной воды, содержащей наряду с молекулами Н О, которые выпадают в виде кристаллов при температурах от 0 до 24 °С (обычно при повышенном давлении соответствующего газа) . Подобные соединения возникают в результате заполнения молекулами газа (“гостя” ) межмолекулярных полостей, имеющихся в структуре воды (“хозяина” ) ; они называются соединениями включения или клатратами . В клатратных соединениях между молекулами “гостя” и “хозяина” образуются лишь слабые межмолекулярные связи; включенная молекула не может покинуть своего места в полости кристалла преимущественно из-за пространственных затруднений. Поэтому клатраты — неустойчивые соединения, которые могут существовать лишь при сравнительно низких температурах. Клатраты используют для разделения углеводородов и благородных газов. В последнее время образование и разрушение клатратов газов (пропана и некоторых других) успешно применяется для обессоливания воды. Нагнетая в соленую воду при повышенном давлении соответствующий газ, получают льдоподобные кристаллы клатратов, а соли остаются в растворе. Похожую на снег массу кристаллов отделяют от маточного раствора и промывают, Затем при некотором повышении температуры или уменьшении давления клатраты разлагаются, образуя пресную воду и исходный газ, который вновь используется для получения клатрата. Высокая экономичность и сравнительно мягкие условия осуществления этого процесса делают его перспективным в качестве промышленного метода опреснения морской воды. 5. Тяжелая вода. При электролизе обычной воды, содержащей наряду с молекулами Н О также незначительное количество молекул D О также незначительное количество молекул D O, образованных тяжелым изотопом водорода, разложению подвергаются преимущественно молекулы Н O, образованных тяжелым изотопом водорода, разложению подвергаются преимущественно молекулы Н О. Поэтому при длительном электролизе воды остаток постепенно обогащается молекулами D О. Поэтому при длительном электролизе воды остаток постепенно обогащается молекулами D O. Из такого остатка после многократного повторения электролиза в 1933 г. впервые удалось выделить небольшое количество воды состоящей почти на 100% из молекул D O. Из такого остатка после многократного повторения электролиза в 1933 г. впервые удалось выделить небольшое количество воды состоящей почти на 100% из молекул D О и получившей название тяжелой воды. По своим свойствам тяжелая вода заметно отличается от обычной воды (таблица) . Реакции с тяжелой водой протекают медленнее, чем с обычной. Тяжелую воду применяют в качестве замедлителя нейтронов в ядерных реакторах. О и получившей название тяжелой воды. По своим свойствам тяжелая вода заметно отличается от обычной воды (таблица) . Реакции с тяжелой водой протекают медленнее, чем с обычной. Тяжелую воду применяют в качестве замедлителя нейтронов в ядерных реакторах.
| |||||






















