Основные физические свойства воды, снега и льда. Свойства воды и льда
строение, механические и физические свойства льда
Лед – это твердое вещество, находящееся агрегатном состоянии, которому свойственно иметь газообразную или жидкую форму при комнатной температуре. Свойства льда начали изучать сотни лет назад. Около двухсот лет тому назад ученые обнаружили, что вода – не простое соединение, а сложный химический элемент, состоящий из кислорода и водорода. После открытия формула воды стала иметь вид Н2О.

Строение льда
Н2О состоит из двух атомов водорода и одного атома кислорода. В спокойном состоянии водород располагается на вершинах атома кислорода. Ионы кислорода и водорода должны занимать вершины равнобедренного треугольника: кислород располагается на вершине прямого угла. Такое строение воды называется диполем.
Лед состоит на 11.2% процента из водорода, а остальное – это кислород. Свойства льда зависят от его химического строения. Иногда в нем присутствуют газообразные или механические образования – примеси.
Лед встречается в природе в виде немногочисленных кристаллических видов, которые устойчиво сохраняют свое строение при температурах от нуля и ниже, но при нуле и выше он начинает плавиться.
Структура кристаллов
Свойства льда, снега и пара совершенно разные и зависят от структуры кристаллов. В твердом состоянии Н2О находится в окружении четырех молекул, расположенных в углах тетраэдра. Так как координационная численность низкая, то лед может иметь ажурную структуру. Это отображается на свойствах льда и его плотности.

Формы льда
Лед относится к распространенным в природе веществам. На Земле есть следующие его разновидности:
- речной;
- озерный;
- морской;
- фирновый;
- глетчерный;
- грунтовый.
Есть лед, напрямую образующийся сублимационным путем, т.е. от парообразного состояния. Такой вид принимает скелетовидную форму (мы их называем снежинки) и агрегатов дендритного и скелетного роста (изморозь, иней).
Одной из самых распространенных форм являются сталактиты, т. е. сосульки. Они растут по всему миру: на поверхности Земли, в пещерах. Этот вид льда образуется путем стекания капель воды при разнице температур около нуля градусов в осенне-весенний период.
Образования в виде ледяных полос, появляющихся по краям водоемов, на границе воды и воздуха, а также по краю луж, называются ледяными заберегами.
Лед может образовываться в пористых грунтах в виде волокнистых прожилок.
Свойства льда
Вещество может находиться в разных состояниях. Исходя из этого, возникает вопрос: а какое свойство льда проявляется в том или ином состоянии?
Ученые выделяют физические и механические свойства. Каждое из них имеет свои особенности.

Физические свойства
К физическим свойствам льда относят:
- Плотность. В физике неоднородная среда представлена пределом отношения массы вещества самой среды к объему, в котором она заключена. Плотность воды, как и других веществ, является функцией температур и давления. Обычно в расчетах используют постоянную плотность воды, равную 1000 кг/м3. Более точный показатель плотности учитывается только тогда, когда необходимо очень точно провести расчеты ввиду важности получаемого результата разности плотностей.При проведении расчетов плотности льда учитывается, какая вода стала льдом: как известно, плотность соленой воды выше, чем дистиллированной.
- Температура воды. Обычно кристаллизация воды происходит при температуре ноль градусов. Процессы замерзания происходят скачками с выделением теплоты. Обратный процесс (таяние) происходит при поглощении того же количества тепла, которое было выделено, но без скачков, а постепенно. В природе встречаются условия, при которых происходит переохлаждение воды, но она не замерзает. Некоторые реки сохраняют жидкое состояние воды даже при температуре -2 градуса.
- Теплоемкость. Это количество теплоты, которое поглощается при нагревании тела на каждый градус. Есть удельная теплоемкость, которая характеризуется количеством теплоты, необходимой для нагрева килограмма дистиллированной воды на один градус.
- Сжимаемость. Еще одно физическое свойство снега и льда – сжимаемость, влияющая на уменьшение объема под воздействием повышенного внешнего давления. Обратная величина называется упругостью.
- Прочность льда.
- Цвет льда. Это свойство зависит от поглощения света и рассеивания лучей, а также от количества примесей в замерзшей воде. Речной и озерный лед без посторонних примесей виден в нежно-голубом свете. Морской лед может быть совершенно другим: голубым, зеленым, синим, белым, коричневым, иметь стальной оттенок. Иногда можно увидеть черный лед. Такой цвет он приобретает из-за большого количества минералов и различных органических примесей.

Механические свойства льда
Механические свойства льда и воды определяются сопротивлением воздействию внешней среды по отношению к единице площади. Механические свойства зависят от структуры, солености, температуры и пористости.
Лед – это упругое, вязкое, пластичное образование, но бывают условия, при которых он становится твердым и очень хрупким.
Морской лед и пресноводный различаются: первый намного пластичнее и менее прочный.

При прохождении кораблей обязательно учитываются механические свойства льда. Также это важно при использовании ледяных дорог, переправ и не только.
Вода, снег и лед обладают схожими свойствами, которые определяют характеристики вещества. Но в то же время на эти показания влияют и многие другие факторы: температура окружающей среды, примеси в твердом веществе, а также исходный состав жидкости. Лед - это одно из самых интересных веществ на Земле.
fb.ru
Физические свойства воды и льда
Вода имеет молекулярную массу примерно равную 18,02 и может существовать в состояниях жидкости, пара и льда, характеризующихся следующими показателями фазовых переходов:
| Точка при 101,3 кПа (1 атм), °С замерзания (плавления) | 0,00 |
| кипения | 100,00 |
| Тройная точка | |
| температура, °С | 0,0099 |
| давление, Па (мм рт. ст.) | 610,4 (4,579) |
| Теплота, кДж/моль (ккал/моль) | |
| плавления при 0°С | 6,01 (1,435) |
| парообразования при 100°С | 40,63 (9,704) |
| сублимации при 0°С | 50,91 (12,16) |
Как видно из этих данных, для воды характерны высокая температура кипения и плавления, высокие значения теплоты фазовых переходов (плавления, парообразования, сублимации). По этим свойствам вода существенно отличается от гидридов некоторых элементов, расположенных близко к кислороду в периодической системе (СН4, Nh4, HF, h3S, HC1). Это иллюстрируется некоторыми сведениями, представленными в табл. 10.1.
Вода обладает аномально высокой теплоемкостью. Это имеет большое значение в жизни природы — в ночное время, а также при переходе
Таблица 10.1. Физические свойства некоторых гидридов
| Вещество | Точка плавления, °С | Точка кипения, °С | Теплота парообразования при 100 °С, ккал/моль |
| Ch5 | -184 | -161 | 2,20 |
| Nh4 | -78 | -33 | 5,55 |
| HF | -92 | +19 | 7,22 |
| Н20 | +100 | 9,70 |
от лета к зиме вода остывает медленно, а днем или при переходе от зимы к лету так же медленно нагревается, являясь, таким образом, регулятором температуры на земном шаре.
Вода обнаруживает необычное свойство расширяться при замерзании, вследствие чего плотность льда ниже, чем воды при той же температуре (табл. 10.2), что нехарактерно для других веществ при переходе из жидкого состояния в твердое. Среди других аномалий воды следует отметить высокое значение поверхностного натяжения и диэлектрической постоянной и значительную теплопроводность (табл. 10.2). Теплопроводность воды выше, чем других жидкостей, а льда — больше, чем других неметаллических твердых веществ. Следует также отметить, что теплопроводность льда при 0°С приблизительно в четыре раза больше, чем воды при той же температуре, т. е. лед проводит тепло значительно быстрее, чем иммобилизованная (неподвижная) вода, находящаяся в тканях. Если при этом учесть, что температуропроводность льда на порядок выше, чем воды, становится понятным, почему ткани замерзают быстрее, чем оттаивают, если задается одинаковая (но обратная) разность температур.
Таблица 10.2. Влияние температуры на некоторые свойства воды и льда
| Показатели | Вода при температуре, ° С | Лед при температуре, ° С | ||
| -20 | ||||
| Плотность, г/см 3 | 0,9982 | 0,9998 | 0,9168 | 0,9193 |
| Давление водяного пара, Па (мм рт. ст.) | 2337 (17,53) | 610,4 (4,58) | 610,4 (4,580) | 103,4 (0,77) |
| Вязкость, Па ∙ с | 1,002 ∙ 10-3 | 1,787 ∙ 10-3 | — | — |
| Поверхностное натяжение, Н/мм | 72,75 ∙ 10-3 | 75,6 ∙ 10 -3 | — | — |
| Теплоемкость, Дж/кг ∙ К | 4,18 | 4,22 | 2,10 | 1,95 |
| Теплопроводность, Дж/м ∙ с ∙ К | 5,98 ∙ 102 | 5,64 ∙102 | 22,40 ∙ 102 | 24,33 ∙ 102 |
| Температуропроводность, м2/с | 1,4 ∙ 10-5 | 1,3 ∙ 10-5 | 1,1 ∙10-4 | 1,1 ∙10-4 |
| Диэлектрическая постоянная | 80,36 |
Похожие статьи:
poznayka.org
Что такое лед, свойства льда :: SYL.ru
Сегодня мы будем говорить про свойства снега и льда. Стоит уточнить, что лед образуются не только из воды. Кроме водяного льда бывает аммиачный и метановый. Не так давно ученые изобрели сухой лед. Свойства его уникальны, их рассмотрим чуть позже. Он образуется при замораживании углекислоты. Свое название сухой лёд получил благодаря тому, что при таянии он не оставляет луж. Находящийся в его составе углекислый газ тут же испаряется в воздух из замороженного состояния.
Определение льда
Прежде всего, подробнее рассмотрим лед, который получают из воды. Внутри него правильная кристаллическая решетка. Лед – это распространенный природный минерал, получаемый во время замерзания воды. Одна молекула этой жидкости связывается с четырьмя ближайшими. Ученые заметили, что такое внутреннее строение присуще различным драгоценным камням и даже минералам. Например, такое строение имеет алмаз, турмалин, кварц, корунд, берилл и другие. Молекулы удерживаются на расстоянии кристаллической решеткой. Эти свойства воды и льда говорят о том, что плотность такого льда будет меньше плотности воды, благодаря которой он образовался. Поэтому лед плавает на поверхности воды и не тонет в ней.

Миллионы квадратных километров льда
А вы знаете, сколько льда на нашей планете? Согласно последним исследованиям ученых, на планете Земля имеется примерно 30 миллионов квадратных километров замороженной воды. Как вы уже догадались, основная масса этого природного минерала находится на полярных шапках. В некоторых местах толщина ледяного покрова достигает 4 км.
Как получить лед
Сделать лед совсем несложно. Этот процесс не составит большого труда, как и не требует особых навыков. Для этого необходима низкая температура воды. Это единственное неизменное условие процесса образования льда. Вода замерзнет тогда, когда ваш термометр покажет температуру ниже 0 градусов по Цельсию. В воде начинается процесс кристаллизации благодаря низким температурам. Молекулы ее строятся в интересную упорядоченную структуру. Этот процесс называют образованием кристаллической решетки. Он одинаков и в океане, и в луже, и даже в морозильной камере.

Исследования процесса замерзания
Проводя исследование на тему замерзания воды, ученые пришли к выводу, что кристаллическая решетка выстраивается в верхних слоях воды. На поверхности начинают образовываться микроскопические ледяные палочки. Чуть позже между собой они смерзаются. Благодаря этому образуется тончайшая пленка на поверхности воды. Крупные водоемы замерзают намного дольше по сравнению с неподвижной водой. Это связано с тем, что ветер колышет и колеблет поверхность озера, пруда или реки.
Ледяные блины
Ученые провели ещё одно наблюдение. Если при низкой температуре продолжается волнение, то тончайшие пленки собираются в блины диаметром около 30 см. Далее они смерзаются в один слой, толщина которого не меньше 10 см. На ледяные блины сверху и снизу намерзает новый слой льда. Так образуется толстый и прочный ледяной покров. Его прочность зависит от видов: самый прозрачный лед будет в несколько раз прочнее белого льда. Экологи заметили, что 5-сантиметровый лёд выдерживает вес взрослого человека. Слой в 10 см способен выдержать легковую машину, но следует помнить, что выходить на лед в осеннее и весеннее время очень опасно.

Свойства снега и льда
Физики и химики долгое время изучали свойства льда и воды. Самое известное, а также важное свойство льда для человека – это его способность легко таять уже при нулевой температуре. Но для науки важны и другие физические свойства льда:
- лед обладает прозрачностью, поэтому он хорошо пропускает солнечный свет;
- бесцветность - лед не имеет цвета, но его с легкостью можно покрасить при помощи цветных добавок;
- твердость – ледяные массы прекрасно сохраняют форму без каких-либо наружных оболочек;
- текучесть – это частное свойство льда, присущее минералу только в некоторых случаях;
- хрупкость – кусок льда можно с легкостью расколоть, не прикладывая больших усилий;
- спайность – лед с легкостью раскалывается в тех местах, где он сросся по кристаллографической линии.

Лед: свойства вытеснения и чистоты
По своему составу у льда высокая степень чистоты, так как кристаллическая решетка не оставляет свободного места различным посторонним молекулам. Когда вода замерзает, то она вытесняет различные примеси, которые в ней когда-то растворились. Таким же образом можно получить очищенную воду в домашних условиях.
Но некоторые вещества способны затормаживать процесс замерзания воды. Например, соль в морской воде. Лёд в море образуется только при очень низких температурах. Удивительно, но процесс замерзания воды каждый год способен поддерживать самоочищение от разных примесей в течение многих миллионов лет подряд.
Секреты сухого льда
Особенности этого льда в том, что в своём составе он имеет углерод. Такой лед образуется только при температуре -78 градусов, но тает он уже при -50 градусах. Сухой лед, свойства которого позволяют пропустить стадию жидкостей, при нагревании сразу образуется пар. Сухой лед, как и его собрат – водяной, не имеет запаха.
А вы знаете, где применяют сухой лед? Благодаря его свойствам, этот минерал используют при транспортировке продуктов питания и медикаментов на дальние расстояния. А гранулы этого льда способны потушить воспламенение бензина. Ещё, когда сухой лед тает, он образует густой туман, поэтому его применяют на съемочных площадках для создания спецэффектов. Помимо всего перечисленного, сухой лед можно брать с собой в поход и в лес. Ведь когда он тает, то отпугивает комаров, различных вредителей и грызунов.

Что касается свойств снега, то эту удивительную красоту мы можем наблюдать каждую зиму. Ведь каждая снежинка имеет форму шестигранника - это неизменно. Но помимо шестиугольной формы, снежинки могут выглядеть по-разному. На формирование каждой из них влияет влажность воздуха, атмосферное давление и другие природные факторы.
Свойства воды, снега, льда удивительны. Важно знать ещё несколько свойств воды. Например, она способна принимать форму сосуда, в который ее наливают. При замерзании вода расширяется, а также у нее есть память. Она способна запоминать окружающую энергетику, а при замерзании она «сбрасывает» информацию, которую в себя впитала.
Мы рассмотрели природный минерал – лед: свойства и его качества. Продолжайте изучать науку, это очень важно и полезно!
www.syl.ru
Свойства льда | Всё о воде
Лед – является кристаллическим состоянием воды. Этот минерал имеет химическую формулу h3O.
Каковы же свойства льда?
Химический состав: Н – 11,2%, О – 88,8%. Бывает, что во льде содержатся твердые механические и газообразные примеси. В природной среде лед, преимущественно, существует в форме одной из немногочисленных кристаллических модификаций, которая устойчива в диапазоне температур 0 – 80°C. Точка плавления равна 0°С.
Структура кристаллов льда схожа со структурой алмаза: любая молекула h3O находится в окружении четырех ближайших к ней молекул, которые располагаются на равных 2,76А расстояниях от нее и находящихся в углах правильного тетраэдра. Поскольку координационное число низкое, то лед имеет ажурную структуру, что сказывается на его плотности (0,917).
Свойства льда: является бесцветным. Синеватый оттенок лед получает в немалых скоплениях. Имеет стеклянный блеск. Прозрачный. Не обладает спайностью. Твердость – 1,5. Непрочный. Показатель преломления весьма низкий (nm = 1,309, n = 1,310). Оптически лед положителен.
Формы нахождения: Лед – минерал весьма распространенный в природе. В коре Земли существуют такие разновидности льда, как озерный лед, морской, речной, фирновый, грунтовый и глетчерный. Чаще всего он создает агрегатные множества мелкокристаллических зерен. Являются известными кристаллы льда, образованные сублимационным путем, то есть напрямую из парообразного состояния. В данных случаях лед принимает вид кристаллов скелетной формы (снежинки) и агрегатов дендритного и скелетного роста (иней, пещерный лед, изморозь). Очень редко встречаются большие кристаллы прекрасной огранки.
Всем знакомы ледяные сталактиты, по-простому названные «сосульками». Эти сталактиты растут везде на поверхности нашей планеты при медленной кристаллизации (замерзании) капающей и стекающей воды при разнице температур около 0° в осенне-зимние сезоны. «Сосульки» обыденны и в ледяных пещерах. Полосы ледяного покрывала, образующегося по краям водоемов на границе воздух-вода, называются ледяными заберегами. Они кристаллизуются на берегах рек, прудов, озер и водохранилищ, на краях луж и т.п. при остающейся нетронутой льдом остальной поверхности воды. Ледяной покров, полностью покрывающий поверхность водоема, образуется при полнейшем срастании ледяных заберегов. Лед также создает в пористых грунтах агрегаты в виде волокнистых прожилок параллельно-шестоватого типа и ледяные антолиты на их поверхности.
Месторождения и образование льда: Образуется лед, главным образом, в водных бассейнах при снижении температуры в воздухе. Ледяная каша, составленная из иголочек льда, образуется при этом на поверхности воды. Снизу эта каша обрастает вытянутыми кристалликами льда, у которых симметричные оси шестого порядка располагаются под прямым углом к наружности корочки. На рис. при разных условиях продемонстрированы соотношения между кристаллами льда. Везде, где есть вода и температура снижается ниже 0° , есть и лед. В некоторых областях лед в грунте оттаивает только на небольшую глубину, глубже которой расположилась вечная мерзлота. Районы вечной мерзлоты – так называются эти места. В местах распространения многолетнемерзлых пород в верхних слоях коры Земли можно встретить подземные льды, среди которых выделяют современный подземный ископаемый лед. Ледники покрывают 10 % площади суши планеты.
Ледниковый лед – так называется ледяная монолитная порода, слагающая ледники. Ледниковый лед появляется в результате преобразования и уплотнения скоплений снега. Ледовый покров занимает практически всю Антарктиду и 75% всей площади Гренландии. Возле станции Бэрд, что в Антарктиде, установлена самая большая (4330 м.) мощность ледников. 3200 м – такова толщина льда в центральной Гренландии.
Месторождения льда известны всем. В местах с долгой холодной зимой и кратким летом, а еще в высокогорных областях, появляются ледниковые пещеры со сталагмитами и сталактитами. Среди всех этих пещер наибольший интерес вызывают Кунгурская, что в Пермской области, и пещера Добшине, расположенная в Словакии. Морской лед образуется после замерзания морской воды. Соленость и пористость – вот типичные признаки морского льда. Эти свойства определяют диапазон его плотности: 0,85 – 0,94 г/см3. Это весьма малая плотность, поэтому льдины возвышаются на 1/7 – 1/10 своей толщины над водной поверхностью. Таянье морского льда начинается при температуре, превышающей -2,3° С. Этот лед труднее поддается раздроблению, чем пресноводный, и он более эластичен.
sitewater.ru
Лёд – твердое состояние воды - Вода
Лёд – это хорошо известное, для большинства из нас, твердое состояние воды, которое мы можем встретить в естественных природных условиях.
Он образуется при понижении температуры воды ниже 0 градусов по Цельсию. Эта температура называется температурой Кристаллизации воды. лёд, как и снег, состоит из кристаллов льда, с формами которых вы можете ознакомиться в нашей статье «Снег кружится».
Приведем несколько точных определений.
Большой Энциклопедический словарь
Лед – вода в твердом состоянии. Известны 11 кристаллических модификаций льда и аморфный лед. В природе обнаружена только одна форма льда – с плотностью 0,92 г/см³, теплоемкостью 2,09 кДж/(кг.К) при 0°C, теплотой плавления 324 кДж/кг, которая встречается в виде собственно льда (материкового, плавающего, подземного), снега и инея. На Земле ок. 30 млн. км³ льда. Используется для хранения, охлаждения пищевых. продуктов, получения пресной воды, в медицине.
Большой Энциклопедический словарь. 2000
Морской словарь
Лед (Ice) — вода в твердом состоянии. Обыкновенный лед легче воды, удельный вес при 0° — 0,9175. Сто объемов Льда образуются из 92 объемов воды, этим объясняется разрушительное действие воды при замерзании в закрытых сосудах, трубопроводах, отсеках и т. п.
Самойлов К. И. Морской словарь. – М.-Л.: Государственное Военно-морское Издательство НКВМФ Союза ССР, 1941
Словарь по географии
Лед – Твердая форма воды, образуемая в природе путем замерзания воды на реках, озерах и морях, конденсации атмосферного водяного пара в ледяные кристаллы, уплотнения снега и т.п.
Словарь по географии. 2015
В результате процесса образования льда – кристаллизации воды, выделяется некоторое количество газов и солей. Это свойство используется для очистки питьевой воды, подробно про это мы писали в материале «Талая вода, приготовление в домашних условиях».
Лёд имеет меньшую плотность, чем жидкая вода, поэтому он и не тонет. Это свойство аномальное, как правило, большинство веществ, в твердом состоянии имеет большую плотность. Меньшая плотность льда говорит о том, что вода при замерзании увеличивается в объеме. Этот факт необходимо учитывать в быту. Например, если замерзнет водопровод, то образовавшийся в процессе этого лёд может «порвать» трубы, что, в принципе, всем хорошо известно.
Перечислим наиболее значимые свойства льда (некоторые их них мы уже описали выше).
Свойства льда
- Температура образования льда – 0°C;
- Объем льда больше объёма жидкой воды, т. е. плотность льда меньше плотности жидкой воды, удельный вес льда при 0° = 0,917 и соответственно удельный вес воды при 0° = 0,9999;
- При дальнейшем понижении температуры, лёд сжимается, чем и объясняются трещины на больших лёдовых пространствах;
- Теплоемкость льда ниже, чем у воды практически в 2 раза;
- Температура замерзания морской воды выше чем пресной и равняется ~ 1,80С (при условии солености воды на уровне средне-взвешенного уровня по мировому океану) .
Лёд и его разновидности
- Почвенный лёд – лёд, образовавшийся в границах земной коры;
- Речной лёд;
- Льды, образовавшиеся при замерзании озер;
- Морские льды.
Применение льда
Лёд имеет большое хозяйственное применение. Он используется для понижения температуры продуктов питания, что существенно повышает срок их хранения. Вполне очевидно, что в этом контексте особое значение имеет производство искусственного льда, или если можно так сказать искусственного холода. Также лёд широко используется в медицине, для обеспечения и проведения ряда некоторых специфических процедур. Широко используют кубики льда в косметических процедурах и в кулинарии, особенно при приготовлении напитков.
 Лёд является строительным материалом для таких важных для нашей планеты объектов как ледники, которые являются индикаторами и регуляторами многих процессов происходящих на нашей планете. ледникам посвящена наша публикация – «Ледник – хранитель пресной воды».
Лёд является строительным материалом для таких важных для нашей планеты объектов как ледники, которые являются индикаторами и регуляторами многих процессов происходящих на нашей планете. ледникам посвящена наша публикация – «Ледник – хранитель пресной воды».
Лёд, впрочем, как практически все, что связано с водой, имеет уникальное сочетание формы и содержания. Художники создают из него восхитительные скульптуры, а технологи используют для промышленных нужд.
Лёд – твердое состояние воды
Янв 21, 2015 13:28 Watermanvodamama.com
Основные физические свойства воды, снега и льда — КиберПедия
Общие сведения. Вода имеет большое значение в жизни Земли. Являясь одним из распространенных и наиболее подвижных природных тел, она участвует почти во всех физических, климатических и биологических процессах, совершающихся на Земле.
При анализе гидрологических явлений принимается, что количество свободной воды на Земле сохраняется постоянным. Вода в результате некоторых процессов вступает в прочные соединения с другими веществами и перестает существовать как свободное образование, однако в глубоких слоях земной коры имеют место и обратные процессы: при высоких давлениях и температурах вновь образуется некоторое количество воды.
Жидкая вода в тонких слоях бесцветна, в толстых имеет голубовато-зеленый оттенок. Чистая вода, без примесей, почти не проводит электрический ток. Температура замерзания дистиллированной воды принята за 0° С, а температура кипения при нормальном давлении - за 100°.
Природная вода никогда не бывает совершенно чистой. Наиболее химически чистой является дождевая вода, но и она содержит различные примеси, которые захватывает из воздуха. Попадая на землю, дождевая вода отчасти стекает по поверхности, отчасти просачивается в почво-грунты, образуя подземные воды. Стекая по поверхности земли и в толще почво-грунтов, вода растворяет различные вещества и превращается в раствор. Качественный и количественный характер изменений химического состава растворенных веществ и физических свойств воды весьма различен и зависит от всего комплекса физико-географических условий, в которых совершается процесс круговорота воды на Земле.
Строение воды. Вода состоит из 11,11 % водорода и 88,89 % кислорода (по весу). При образовании воды с одним атомом кислорода соединяются два атома водорода. В молекуле воды атомы водорода и кислорода расположены по углам равнобедренного треугольника: при вершине находится атом кислорода, а в углах при основании-по атому водорода; угол при вершине треугольника около 105°, а расстояние между ядрами водорода и кислорода около 0,97∙10-8 см и между ядрами водорода 1,53∙10-8 см (рис.1).
Рис. 1. Схема строения молекулы воды
Молекула воды характеризуется значительной полярностью вследствие того, что в ней оба атома водорода располагаются не на прямой, проведенной через центр атома кислорода, а как бы по одну сторону от атома кислорода. Это приводит к неравномерности распределения электрических зарядов. Сторона молекулы с атомом кислорода имеет некоторый избыток отрицательного заряда, а противоположная сторона, в которой размещены атомы водорода, - избыток положительного заряда электричества. Наличием полярности и некоторых других сил обусловлена способность молекул воды объединяться в агрегаты по несколько молекул.
Простейшую формулу h3O имеет молекула парообразной воды. Молекула воды в жидком состоянии представляет собой объединение двух простых молекул (Н2O)2, молекула льда - объединение трех простых молекул (Н20)3. Простая, не объединившаяся с другой молекула воды Н20 называется гидроль, образование из двух объединившихся молекул воды, т. е. (Н20)2, - дигидроль, а соединение из трех простых молекул (Н20)3 - тригидроль. Образование дигидроля и тригидроля происходит вследствие притяжения молекул воды друг к другу в результате отмеченного выше эффекта полярности, свойственного молекулам воды.
Во льду преобладают молекулы тригидроля, имеющие наибольший объем, а простые, необъединившиеся молекулы в нем отсутствуют. В парообразном состоянии при температуре свыше 100° С, вода состоит главным образом из молекул гидроля, так как значительная скорость движения молекул при этой температуре нарушает ассоциацию (объединение) молекул. В жидком состоянии вода представляет собой смесь гидроля, дигидроля и тригидроля, соотношение между которыми меняется с изменением температуры. Между формами молекул воды в зависимости от температуры установлено следующее соотношение (табл. 5)
Таблица 5
Формы молекулы воды в зависимости от температуры (в процентах)
| Форма молекулы | Лед | Вода | |||
| 0оС | 4оС | 38оС | 98оС | ||
| Н2О | |||||
| (Н2О)2 | |||||
| (Н2О)3 |
Существует и вторая модель строения воды. Исследование воды при помощи спектрального анализа показывает, что структура расположения кристаллов в молекуле воды при температурах ниже 4° С, включая и фазу льда, сходна со строением кристалла тридимита, а при более высоких температурах - со строением кристалла кварца. При понижении температуры кварцевая структура воды постепенно замещается тридимитовой. Принимая во внимание, что лед по структуре сходен с тридимитом (т. е. подобен графиту), и предполагая, что строение воды подобно строению кварца (т. е. алмаза), можно понять, что замещение одной структуры другой приводит к возникновению аномалий воды, в частности к уменьшению плотности при замерзании.
Плотность и удельный объем. Под плотностью воды r понимается отношение ее массы m к объему V, занимаемому ею при данной температуре, т.е.
r = m/V
где r - в г/см3.
За единицу плотности принята плотность дистиллированной воды при 4° С.
Величина, обратная плотности, т. е. отношение единицы объема к единице массы, называется удельным объемом (в см3/г):
v = V/m
Плотность воды зависит от ее температуры, минерализации, давления, количества взвешенных частиц и растворенных газов. С повышением температуры плотность всех жидкостей, как правило, уменьшается. Вода в этом отношении ведет себя аномально: при температурах выше 4° С плотность ее с повышением температуры уменьшается, а в интервале температур 0-4° С увеличивается. Аномальное изменение плотности воды объясняется особенностями ее строения. При нагревании воды идут два параллельных процесса: первый - нормальное увеличение объема за счет увеличения расстояния между молекулами, второй - уменьшение объема благодаря возникновению более плотных гидролей и дигидролей.
В зоне температур выше 4° С интенсивнее происходит первый процесс, в интервале 0-4°С - второй. В момент выравнивания влияния, оказываемого этими процессами на изменение объема воды, наступающего при 4° С, наблюдается наибольшая плотность, С точки зрения структурной модели строения воды аномальное изменение плотности при изменениии температуры объясняется постепенной заменой при повышении температуры от 0 до 4° С тридимитовой рыхлой упаковки более плотной кварцевой.
Изменения плотности воды на один градус температуры в различных интервалах температуры неодинаковы. Они очень малы около температуры наибольшей плотности и быстро возрастают по мере удаления от нее. Так, при температуре, близкой к 4°С, изменение плотности воды на один градус температуры составляет 8∙10-6, при температуре около 30°С - до 3∙10-4.
При переходе воды из жидкого состояния в твердое (лед) плотность резко, скачкообразно изменяется приблизительно на 9 %; плотность дистиллированной воды при 0°С равна 0,99987, а плотность льда, образовавшегося из той же воды при 0°С, равна 0,9167.
С понижением температуры плотность чистого льда несколько возрастает и при -20° С достигает 0,92.
Своеобразный режим изменения плотности воды в связи с изменениями температуры имеет колоссальное значение в природе. Благодаря этому естественные водоемы (например, озера) при отрицательных температурах воздуха зимой даже в условиях сурового климата не промерзают до дна в случае достаточной глубины водоема. При этом под ледяным покровом остается жидкая вода, потому что при промерзании лед, значительно более легкий, чем вода, остается на поверхности водоема, на дно которого опускаются охладившиеся до 4°С наиболее плотные массы воды.
Изменение плотности воды оказывает существенное влияние на режим водоемов, вызывая конвекционные токи и течения, стремящиеся выровнять возникшую неравномерность в распределении плотности.
Плотность снега в гидрометеорологии выражается в виде отношения веса снега к весу воды, взятых в равных объемах, или отношения веса снега Р в граммах к его объему W в кубических сантиметрах
rс = P/W
Слой воды hв, содержащийся в снеге, выражается как произведение высоты снега hс на его плотность rс , т. е. hв = rс hс. С плотностью снега непосредственно связаны пористость, теплопроводность, водоудерживающая способность, твердость и другие механические и водно-физические свойства снежного покрова.
Плотность снега колеблется в широких пределах как по времени, так и по площади. Наименьшей плотностью, порядка 0,01 г/см3, обладает свежий снег, выпавший при низкой температуре и безветренной погоде. С течением времени под влиянием ветра и оттепелей снег уплотняется. Сильно промокший и затем смерзшийся снег обладает плотностью до 0,70 г/см3.
В районах с устойчивым снежным покровом обнаруживается некоторая закономерность увеличения плотности снега к началу таяния в направлении с севера на юг. Так, на севере Европейской территории России плотность снега в конце зимы находится в пределах 0,22-0,28 г/см3, в средней полосе - в пределах 0,24- 0,32 г/см3. На юге она изменяется в широких пределах - от 0,22- 0,23 в районах, не подвергшихся действию оттепелей, до 0,34- 0,36 г/см3 при наличии зимних оттепелей.
Плотность снега в начале таяния изменяется в среднем от 0,18 до 0,35, в период интенсивного таяния от 0,35 до 0,45 и в конце таяния доходит до 0,50. Плотность снега в лесу в среднем на 10-15 % меньше, чем на открытых участках. Для северных и северозападных районов, где влияние оттепелей на плотность снега сравнительно невелико, отмечается прямая связь плотности с высотой снежного покрова. Это позволяет устанавливать эмпирические зависимости непосредственно между запасом воды в снежном покрове и его высотой.
Возможность перехода воды из одного агрегатного состояния в другое (из жидкого в лед или в пар и обратно) определяется температурой и давлением. Диаграмма состояния воды изображена на рис. 2. Линия АВ показывает границу равновесия между парообразной и твердой водой, линия ВС - между парообразной и жидкой водой. При температуре 0,0075°С и давлении 6,1 мб в устойчивом равновесии могут одновременно существовать лед, пар и жидкая вода (точка В на графике).
Если очень чистую воду охлаждать, тщательно предохраняя ее от сотрясения, то лед долго не образуется, несмотря на низкую температуру; практически такое охлаждение производилось до -72° С. Однако переохлажденная вода малоустойчива: при внесении в нес кристаллика льда или при встряхивании она сразу же превращается в лед. Переохлаждение воды в естественных водоемах на 0,005-0,01° С встречается весьма часто. В грунтах вследствие повышенной минерализации переохлаждение воды может быть более значительным.
Рис. 2. Диаграмма состояния воды
1 - твердая, 2 - жидкая, 3 - газообразная фазы
Структура снега бывает относительно простой непосредственно после его выпадения: в последующем под влиянием ветрового переноса, оттепелей и собственного веса снега она подвергается весьма значительным изменениям. Вместе с ней изменяются и другие физические характеристики снега.
В снежном покрове, залегающем на земной поверхности, помимо ледяных кристаллов снега, содержится также воздух, а иногда и жидкая вода.
Весовое содержание заключенного в снежном покрове воздуха мало и лишь при плотностях снега менее 0,10 г/см3 оно составляет несколько процентов от веса снега. Напротив, объем воздуха в снежном покрове весьма велик. Принимая плотность льда равной 0,916 г/см3, получим, что при плотности снежного покрова 0,46 г/см3 занимаемые в нем воздухом и льдом объемы равны. При плотности менее 0,46 г/см3 объем содержащегося в снежном покрове воздуха превышает объем льда в несколько раз и становится меньше последнего лишь при плотностях более 0,46 г/см3.
Изменение структуры снежного покрова связано с изменением с течением времени состояния и структуры ледяных (снежных) кристаллов. Снег, выпадающий в безветренную погоду, состоит из разнообразных по форме ледяных звездочек, хлопьев или тончайших игл. Эти первичные ледяные образования, хаотически и непрочно соединяясь между собой, создают рыхлый с малой плотностью свежевыпавший снег. Под влиянием ветров, собственного веса и оттепелей снежный покров уплотняется, снежинки хотя и сохраняют кристаллическую структуру, но форма их подвергается значительным изменениям. Такой уплотненный (лежалый) снег имеет плотность 0,20- 0,60 г/см3 в зависимости от степени его увлажненности и условий уплотнения.
Лежалый снег в дальнейшем переходит в стадию старого (фирнизированного) снега, полностью утрачивающего свою первичную структуру и формы кристаллов снежинок. Плотность такого снега 0,30-0,70 г/см3. Он состоит из ледяных зерен диаметром 1-5 мм и более. Зернистая структура характерна для снега, подвергавшегося действию оттепелей. Возникновение зернистой структуры происходит под действием частичного таяния и повторного замерзания ледяных кристаллов, которые в ходе этого процесса обволакиваются пленкой талой воды и смерзаются. Этому, в частности, способствуют суточные колебания температуры в период весеннего снеготаяния.
Водоудерживающая способность (влагоемкость) снега. Образовавшаяся при таянии снега вода первоначально содержится в виде пленочной и подвешенной капиллярной влаги, удерживаемой прочно на поверхности частиц снега и в промежутках между ними молекулярными и капиллярными силами.
Относительное количество воды, которое снег способен удерживать в своих порах и капиллярных промежутках вне зоны капиллярного поднятия в виде гигроскопической, пленочной и частично гравитационной воды, представляет собой водоудерживающую способность (влагоемкость) снега Y, определяемую отношением количества жидкой воды hж к общему количеству воды hх, содержащейся в данном объеме снега в жидкой и твердой фазах. Водоудерживающая способность снега может быть выражена в процентах или в долях единицы
Y = hж/hх ∙100%.
где hж - количество жидкой воды в данном объеме снега в миллиметрах; hх - общее количество воды, содержащейся в данном объеме снега в жидкой и твердой фазах, в миллиметрах.
Водоудерживающая способность (влагоемкость) снега зависит от степени его перекристаллизации и плотности. Мелкозернистый метелевый снег обладает большей водоудерживающей способностью, чем крупнозернистый при одной и той же плотности. В процессе таяния мелкозернистый снег быстро перекристаллизовывается и его Водоудерживающая способность убывает.
Под влиянием различных явлений погоды в зависимости от степени перекристаллизации и плотности Водоудерживающая способность снега по мере его .таяния непрерывно меняется.
Влажность снега наряду с максимальной влагоемкостью характеризует его водные свойства. Влажностью снега называется количество воды, содержащейся в нем в рассматриваемый момент времени, выраженное в процентах к общему весу пробы влажного снега.
Водоотдача. С развитием процесса таяния промежутки между частицами снега заполняются водой, сила тяжести которой превосходит капиллярные силы. Появляется так называемая гравитационная вода, которая под действием силы тяжести передвигается вниз, пока не достигает почвы, и пока, таким образом, не наступит момент водоотдачи.
Водоотдачей называется процесс поступления воды из снега на почву; интенсивность водоотдачи определяется количеством воды (обычно в миллиметрах слоя), поступающей из снега на поверхность почвы за единицу времени.
Когда на поверхности почвы появляется вода, в слое снега, прилегающем к почве, образуется зона капиллярного поднятия. Предельная высота ее зависит от размеров пор снега в этом слое и составляет для мелкозернистого снега 5-6 см, среднезернистого 2-3 см и для крупнозернистого около 1 см.
Между началом таяния и водоотдачи имеет место процесс удержания талой воды снежным покровом, обусловливающий разрыв между таянием и водоотдачей по времени наступления и величине. Разрыв этот особенно значителен в начальный период снеготаяния, когда вся талая вода уходит на образование пленок, заполнение капиллярных промежутков и вообще на увлажнение всей массы снега, без чего процесс водоотдачи из снега невозможен. Когда же процесс таяния достигает известного развития, водоотдача в отдельные промежутки времени может превысить слой воды, образовавшийся за счет стаявшего в этот период снега.
Кроме задержания талых вод снежным покровом вследствие его влагоемкости, имеет место также временное задержание воды, текущей по поверхности склонов, в результате запруживания понижений, в которых течет вода под снегом.
Химический состав вод
Процесс формирования химического состава природных вод весьма сложен; он совершается под воздействием разнообразных факторов. Среди них можно различать главные и второстепенные, а также прямые и косвенные. Прямыми называются такие, которые непосредственно обогащают воду солями (почвы, горные породы), к косвенным относятся те факторы, которые действуют опосредованно, т. е. через посредство других факторов.
Физико-географические условия (рельеф, климат, процессы выветривания и почвенный покров). Рельеф является косвенным фактором формирования состава вод. Он оказывает влияние на условия водообмена, а от последних зависит минерализация и химический состав природных вод. Степень расчлененности рельефа определяет размеры по верхностного стока и дренированность подземных вод. Рельеф перераспределяет выпадающие на земную поверхность осадки. На возвышенностях и их склонах усиливается поверхностный сток, а условия питания подземных вод ухудшаются. Наоборот, в пониженных формах рельефа поверхностный сток замедляется, вследствие чего увеличивается инфильтрация вод в почву. С рельефом местности связаны солевой режим почв, а также заболоченность местности, обусловливающая специфический состав вод.
Роль рассматриваемого фактора более четко выступает в горных районах, где расчлененный рельеф создает отдельные орографические единицы с самостоятельным гидрологическим режимом, в которых можно уловить тесную связь химического состава вод с составом горных пород. На равнинных пространствах, в условиях мелкобугристого рельефа, минерализация и состав природных вод изменяются в больших пределах. В областях с аридным климатом рельеф выступает в качестве одного из ведущих факторов формирования природных вод. Если бессточная котловина собирает поверхностный сток и одновременно дренирует подземные воды (является местом их разгрузки), то вследствие высокой испаряемости в котловине образуется соляное или самосадочное озеро. Если дно бессточной котловины лежит выше уровня грунтовых вод и в то же время она аккумулирует поверхностные воды, то при достаточной проницаемости пород, слагающих ее дно, сформируется линза грунтовых пресных или солоноватых вод, ниже которой иногда залегают соленые грунтовые воды.
Климат прежде всего определяет метеорологические условия, от которых зависит водный режим поверхностных и подземных вод. К основным метеорологическим элементам, воздействующим на состав природных вод, относятся атмосферные осадки, температура и испарение.
Первая стадия формирования химического состава вод осуществляется в атмосфере. Из всех природных вод наиболее быстрые изменения минерализации и состава во времени и пространстве наблюдаются у атмосферных осадков. И тем не менее, несмотря на такую неустойчивость, состав осадков является в общем характерным для данной местности, отражая тип ее географического ландшафта. Минерализация атмосферных осадков, как правило, ниже минерализации речных и озерных вод. Выпадающие осадки обычно уменьшают минерализацию поверхностных и подземных вод. Минеральные соли, содержащиеся в атмосферных осадках, в той или иной степени оказывают влияние на формирование химического состава поверхностных вод. Это влияние бывает особенно заметным на слабоминерализованных водах. В так называемых ультрапресных (весьма пресных) водах ионы хлора иногда целиком поступают из атмосферы.
Химический состав поверхностных и грунтовых вод нередко похож на состав атмосферных осадков на территории их выпадения. Это сходство прослеживается в районах с местным аэрозольным питанием. Различия заключаются в минерализации и содержании биогенных компонентов. Причина сходства, очевидно, заключается не в том, что ионный состав поверхностных и грунтовых вод сформировался за счет привноса солей осадками, а в том, что поверхностные, грунтовые и метеорные воды имеют один и тот же источник солевого питания — почвы и горные породы данной местности.
Под воздействием достаточно минерализованных обильных осадков может временно сформироваться химический тип вод, совершенно чуждый для состава водоносных пород того или иного района. Подобные явления происходят в результате переноса воздушными течениями аэрозолей (ядер конденсации) из других областей с иными физико-географическими условиями. Повышенное содержание хлоридов в грунтовых водах морских побережий может быть связано с осадками морского происхождения.
С изменением температуры атмосферного воздуха связано промерзание и оттаивание почв и пород в зоне годовых колебаний температуры, что сказывается на условиях питания поверхностных и грунтовых вод, и, следовательно, на их минерализации и химическом составе. Всякие колебания температуры воды обусловливают изменение растворимости солей, присутствующих в природных растворах. Здесь мы коснемся влияния на химию природных вод температуры воздуха как метеорологического фактора, воздействующего прежде всего на поверхностные водоемы.
Влияние температуры воздуха может отражаться на составе вод самосадочных озер и пресных поверхностных вод. В последнем случае изменение состава воды совершается в результате вы падения из нее карбонатов кальция при повышении температуры. Поэтому летом в условиях жаркого климата может происходить садка кальцита в мелководных хорошо прогреваемых водоемах.
Под воздействием процессов промерзания химический состав воды метаморфизуется. Между льдом и промерзающим раствором происходит перераспределение солей. В лед соли поступают избирательно. Одновременно с кристаллизацией льда выделяются труднорастворимые соединения, а в растворах сохраняются наиболее легкорастворимые при низких температурах соединения, к которым принадлежат хлориды кальция, магния и натрия.
Испарение — один из мощных факторов формирования минерализации и химического состава поверхностных и грунтовых вод. Наиболее действенным этот фактор становится в тех районах, где отношение суммарного испарения к сумме атмосферных осадков оказывается наибольшим, т. е. в области пустынь, полупустынь и сухих степей. В засоляющихся под влиянием испарения поверхностных водоемах происходит выпадение солей (минералообразование), сначала менее, а потом более растворимых. В результате этого гидрокарбонатные воды преобразуются сначала в сульфатные, а затем сульфатно-хлоридные и даже хлоридные.
В засушливой зоне земного шара процесс испарения обусловливает постепенное концентрирование солей в грунтовых водах. Явление это хорошо прослеживается на примере грунтовых вод, формирующихся в замкнутых межгорных впадинах.
Процессы выветривания. Существенное значение в формировании химического состава природных вод имеет физическое (механическое), химическое и биологическое выветривание горных пород. Основным фактором химического выветривания является атмосферная вода, действие которой усиливается растворенной в ней углекислотой. Значительную роль в процессах химического выветривания играет также кислород воздуха.
Химическое выветривание горных пород складывается из следующих более простых процессов: растворения, гидролиза, гидратации, окисления. Все перечисленные процессы являются экзотермическими, т. е. протекают с выделением тепла. Процессы растворения играют большую роль при выветривании некоторыхосадочных пород, например известняков, доломитов и гипсоносных пород. Значительно сложнее вопрос о растворимости магматических пород, так как практически невозможно отделить при действии на них воды процессы простого растворения от гидролитических процессов. В результате выветривания магматических пород получаются продукты трех типов: 1 — остаточные образования, 2 — переотложенные осадки и 3 — растворимые соли. Последние как раз и формируют ионный состав вод современной коры выветривания изверженных пород.
Различают два вида химического выветривания: углекислотное и сернокислотное. Наиболее характерным для формирования состава природных вод является углекислотное выветривание с его главным агентом — углекислотой. Интенсивность этого вида выветривания определяется концентрацией СО2 в водах, однако не вся углекислота способна взаимодействовать с породой, а только часть ее, называемая агрессивной углекислотой.
Сущность углекислотного выветривания заключается в протекании реакции:
Если углекислотному выветриванию подвергается кальциевый силикат, то, как видно из второй реакции, образуется слаборастворимый СаСОз, однако под воздействием продолжающегося процесса углекислотного выветривания образуется более растворимое соединение кальция в соответствии с первой реакцией.
Основным агентом сернокислотного выветривания является серная кислота, образующаяся при окислении сульфидов (например, FeS2). Сернокислотное выветривание осуществляется по схеме:
В горных породах сульфиды имеют спорадическое распространение, и поэтому сернокислотное выветривание интенсивно проявляется местами, в соответствующих условиях.
Особенно интенсивно сернокислотное выветривание проявляется на участках сульфидных месторождений. Подземные воды, несущие растворенный кислород, соприкасаясь с веществом руды, оказывают окисляющее действие на сульфиды, разрушают их. На месторождении возникает зона окисления. Образуются воды ярко выраженного сульфатного класса. Специфической особенностью подобных вод является сильная кислотность и высокое содержание тяжелых металлов Fe, Al, Сu и др.
Биологическим выветриванием называют процесс механического разрушения и химического изменения минералов горных пород под воздействием поселившихся на них организмов, продуктов их жизнедеятельности и продуктов разложения органических остатков. Важный агент выветривания — растительность. Особенно интенсивно выветривание протекает там, где количество атмосферных осадков превышает испаряемость, а температура достаточно высока. Здесь создается мощная концентрация организмов, которые выделяют колоссальные массы органических кислот, активно способствующих преобразованию кристаллических решеток первичных минералов. Гумусовые кислоты имеют большое значение для формирования состава природных вод. Они наряду с двуокисью углерода придают воде свойства агрессивности к горным породам не только карбонатным, но и изверженным. Это значит, что состав природных вод обусловливается не простыми абиотическими реакциями гидролиза и растворения, а более сложным, хотя и более быстро протекающим процессом.
Почвы, как известно, обогащают воду ионами, газами, органическим веществом. Влияние почвенного покрова на формирование вод двояко: с одной стороны, почвы могут увеличивать минерализацию фильтрующихся через них атмосферных осадков, а с другой — изменять уже сложившийся химический состав грунтовых вод, вступающих с почвами во взаимодействие. Количественная сторона этих процессов определяется типом почв. Если вода просачивается через бедные солями торфянисто-тундровые или болотные почвы, то она обогащается органическим веществом и лишь в очень малой мере — ионами. Примерно то же самое наблюдается в подзолистых почвах. Значительно больше солей отдают в воду черноземные и каштановые почвы. И особенно сильно воздействуют на минерализацию фильтрующихся вод солончаковые почвы.
В ходе просачивания воды через почву вследствие окисления кислородом органического вещества изменяется также состав растворенных газов. Содержание кислорода при этом уменьшается, а количество СО2 соответственно увеличивается. Выделяющаяся углекислота служит источником образования гидрокарбонатных ионов:
При взаимодействии грунтовых вод с почвами, кроме выщелачивания солей, происходит преобразование состава воды под влиянием ионного обмена, процессов минералообразования или замещения уже имеющихся в почвах минералов другими. Интенсивность преобразования зависит от типа почвы, от содержания в ней коллоидов, обладающих способностью адсорбировать ионы, а также обменивать поглощенные ионы на ионы водных растворов.
Поглощенный комплекс почв по своему характеру разнообразен. Почвы средних широт, например черноземы, имеют обычно в составе поглощенного комплекса на первом месте кальций, на втором — магний. В меньших количествах присутствуют другиекатионы. Почвы северных широт сильно выщелочены, и в поглощенный комплекс их наряду с Na, Ca и Mg входят ионы водорода.
В районах с местным водным питанием почвенный покров является одним из ведущих факторов формирования грунтовых вод. Для пополнения запасов грунтовых вод имеет существенное значение проницаемость почв, а для их химического состава — наличие воднорастворимых солей в почве. По отношению к поверхностным водам роль почвенного покрова становится еще более важной. По выражению В. И. Вернадского (1933—1936), почвенные растворы «определяют характер всех поверхностных вод биосферы» и, в частности, «основную составляющую часть солевого состава речных вод».
Горные породы. Горные породы — ведущий фактор формирования минерализации и химического состава природных вод. В водоносных горизонтах, заключенных в осадочных толщах, обогащение вод ионами, осуществляется непосредственно за счет выщелачивания растворимых минералов, находящихся в породах. Большое значение при этом имеет состояние водоносной толщи. При одном и том же минеральном составе рыхлая или сильно трещиноватая порода будет в большей степени отдавать в воду ионы, чем порода плотная или монолитная. Кроме того, при медленной циркуляции воды, имеющей место в мелкозернистой, содержащей коллоиды среде, формирование химического состава усложняется катионным обменом и другими сопутствующими явлениями. В последнем случае вопрос о происхождении тех или иных ассоциаций ионов (солей) в воде не может быть решен путем простого сопоставления химического состава воды с таковым вмещающей породы.
В мономинеральных породах химический состав природных вод находится в соответствии с химическим составом и растворимостью самих пород. В полиминеральных породах химический состав воды отражает главным образом состав хорошо растворимых минералов. При большой разнице в растворимости сильно- и слаборастворимых минералов, образующих полиминеральную породу, влияние вторых может вообще не сказываться на химическом облике воды.
Главнейшими растворимыми минералами, определяющими в основном химию природных вод, являются галит NaCl, гипс СaSO4*2h3O, кальцит СаСО3, доломит CaMg(CO3)2. Такие хорошо растворимые минералы, как мирабилит, астраханит, глаубе-рит, имеют узкое локальное распространение. Залегающая на глубине каменная соль обогащает воды хлоридами натрия. Минерализация в этом случае резко повышается. Хлоридные натриевые высокоминерализованные воды и рассолы встречаются во многих районах земного шара. Их развитие совпадает с распространением соленосных фаций, при выщелачивании которых они и образуются.
Наличие в недрах гипсоносных фаций служит причиной появления сульфатных кальциевых вод. Минерализация этих вод обычно 2—3 г/л, что определяется растворимостью гипса. В концентрированном растворе хлористого натрия растворимость возрастает до 6—7 г/л. Воды с преобладанием ионов SO4 и Са2 встречаются очень редко, так как гипсоносные отложения часто сопровождаются соленосными.
Химический состав многих химических типов природных вод формируется путем растворения и выщелачивания горных пород. Гидрокарбонатные кальциевые воды чаще всего образуются при растворении карбонатов кальция, которые широко распространены в природе (известняки, известковый цемент в песчаниках, известковистые почвы и т. д.). В отсутствии углекислоты растворимость СаСО3 в нормальных условиях всего 13 мг/л, Растворимость карбонатов щелочных земель резко возрастает при наличии в воде СО2. Растворение СаСО3 идет по схеме:
В результате этой реакции в воде появляются гидрокарбонаты кальция, растворимость которых в обычных условиях достигает 200—300 мг/л. В присутствии больших количеств углекислоты растворимость СаСО3 может превосходить 1 г/л (углекислые минеральные воды).
Гидрокарбонатные кальциевые воды пользуются региональным распространением в массивах изверженных пород, не содержащих карбонатов. В результате углекислотного выветривания кальциевых полевых шпатов (анортита), входящего в состав изверженных пород, воды снабжаются гидрокарбонатами кальция, причем в этом случае Са берется из породы, а НСО3 образуется из двуокиси углерода воздушного и биохимического происхождения.
Гидрокарбонатные магниевые воды среди осадочных пород встречаются как исключение, ввиду редкого нахождения минерат лов соответствующего состава. В доломитовых CaMg(CO3)2 толщах формируются обычно гидрокарбонатные магниево-кальциевые или кальциево-магниевые воды. Ярко выраженные магнезиальные воды образуются путем углекислотного выветривания богатых магнием изверженных пород (перидотиты, габбро, дуниты). В обычных условиях их минерализация не превосходит 500— 600 мг/л.
Происхождение гидрокарбонатных натриевых (содовых) вод представляется более сложным. Появление их в осадочных и изверженных породах нельзя объяснить процессами растворения или выщелачивания содоносных пород или пластовых ископаемых залежей соды, поскольку последние пока известны только в одном пункте земного шара (штат Вайоминг, США). Содовые воды (HCO3>Mg2+ + Ca2+) чаще всего формируются при выветривании содержащих натрий массивно-кристаллических и осадочных пород. При этом анионы HCO3, возникая путем растворения в воде СО2, имеют главным образом биохимическое и частично воздушное происхождение. Появление ионов натрия в сочетании с НСО3 наблюдается при выветривании натриевых полевых шпатов, полимиктовых песчаных отложений, аркозовых песков и других пород подобного состава. В условиях засушливого климата содовые воды, скопляясь в бессточных впадинах, концентрируются до стадии насыщения, в результате чего формируются содовые самосадочные озера (Кулундинская и Барабинская степи).
Чтобы разобраться в механизме образования гидрокарбо
cyberpedia.su
Основные физические свойства воды, снега и льда
Химические и физические свойства природных вод.
Общие сведения. Вода имеет большое значение в жизни Земли. Являясь одним из распространенных и наиболее подвижных природных тел, она участвует почти во всех физических, климатических и биологических процессах, совершающихся на Земле.
При анализе гидрологических явлений принимается, что количество свободной воды на Земле сохраняется постоянным. Вода в результате некоторых процессов вступает в прочные соединения с другими веществами и перестает существовать как свободное образование, однако в глубоких слоях земной коры имеют место и обратные процессы: при высоких давлениях и температурах вновь образуется некоторое количество воды.
Жидкая вода в тонких слоях бесцветна, в толстых имеет голубовато-зеленый оттенок. Чистая вода, без примесей, почти не проводит электрический ток. Температура замерзания дистиллированной воды принята за 0° С, а температура кипения при нормальном давлении - за 100° С.
Природная вода никогда не бывает совершенно чистой. Наиболее химически чистой является дождевая вода, но и она содержит различные примеси, которые захватывает из воздуха. Попадая на землю, дождевая вода отчасти стекает по поверхности, отчасти просачивается в почво-грунты, образуя подземные воды. Стекая по поверхности земли и в толще почво-грунтов, вода растворяет различные вещества и превращается в раствор. Качественный и количественный характер изменений химического состава растворенных веществ и физических свойств воды весьма различен и зависит от всего комплекса физико-географических условий, в которых совершается процесс круговорота воды на Земле.
Строение воды. Вода состоит из 11,11% водорода и 88,89% кислорода (по весу). При образовании воды с одним атомом кислорода соединяются два атома водорода. В молекуле воды атомы водорода и кислорода расположены по углам равнобедренного треугольника: при вершине находится атом кислорода, а в углах при основании - по атому водорода (Рис.1).
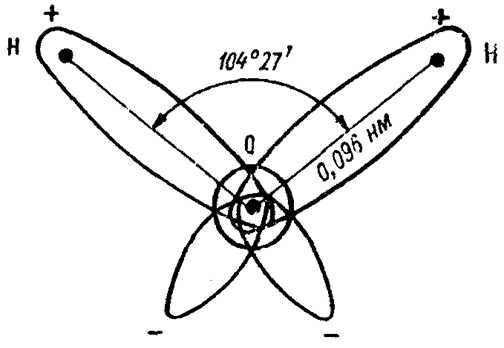
РИС. 1. СХЕМА СТРОЕНИЯ МОЛЕКУЛ ВОДЫ
Молекула воды характеризуется значительной полярностью вследствие того, что в ней оба атома водорода располагаются не на прямой, проведенной через центр атома кислорода, а как бы по одну сторону от атома кислорода. Это приводит к неравномерности распределения электрических зарядов. Сторона молекулы с атомом кислорода имеет некоторый избыток отрицательного заряда, а противоположная сторона, в которой размещены атомы водорода, - избыток положительного заряда электричества. Наличием полярности и некоторых других сил обусловлена способность молекул воды объединяться в агрегаты по несколько молекул.
Простейшую формулу h3O имеет молекула парообразной воды - гидроль.
Молекула воды в жидком состоянии представляет собой объединение двух простых молекул (Н2O)2 - дигидроль.
Молекула льда - объединение трех простых молекул (Н20)з - тригидроль.
В парообразном состоянии при температуре свыше 100° С, вода состоит главным образом из молекул гидроля, так как значительная скорость движения молекул при этой температуре нарушает ассоциацию (объединение) молекул.
В жидком состоянии вода представляет собой смесь гидроля, дигидроля и тригидроля, соотношение между которыми меняется с изменением температуры.
Во льду преобладают молекулы тригидроля, имеющие наибольший объем, а простые, необъединившиеся молекулы в нем отсутствуют.
Возможность перехода воды из одного агрегатного состояния в другое (из жидкого в лед или в пар и обратно) определяется температурой и давлением. Диаграмма состояния воды изображена на рис. 2.
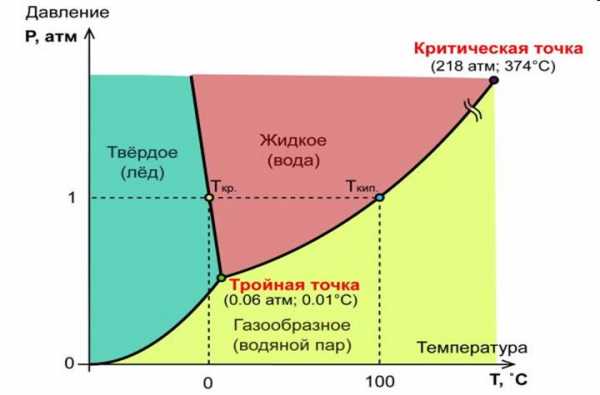
РИС. 2. ДИАГРАММА СОСТОЯНИЯ ВОДЫ
Линия АВ показывает границу равновесия между парообразной и твердой водой, линия ВС - между парообразной и жидкой водой. При температуре 0,0075°С и давлении 6,1 мб в устойчивом равновесии могут одновременно существовать лед, пар и жидкая вода (точка В на графике).
Если очень чистую воду охлаждать, тщательно предохраняя ее от сотрясения, то лед долго не образуется, несмотря на низкую температуру; практически такое охлаждение производилось до -72° С. Однако переохлажденная вода малоустойчива: при внесении в нес кристаллика льда или при встряхивании она сразу же превращается в лед. Переохлаждение воды в естественных водоемах на 0,005-0,01° С встречается весьма часто. В грунтах вследствие повышенной минерализации переохлаждение воды может быть более значительным.
Похожие статьи:
poznayka.org