Физические свойства льда, воды и водяного пара. Основные свойства воды и водяного пара
1.4.20. Основные параметры воды и водяного пара
Сначала рассмотрим параметры для воды. Удельный объём воды при 00С и любом давлении равен 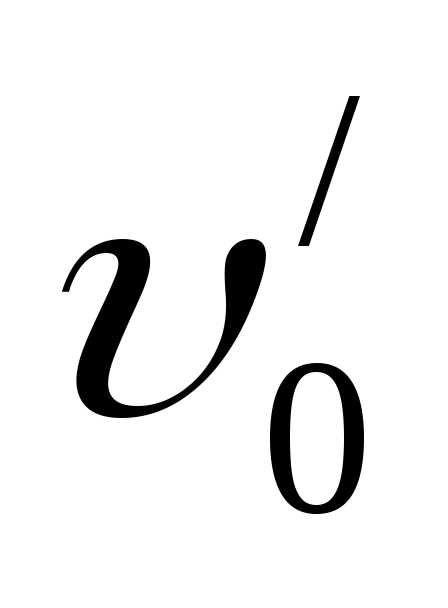 =0,001 м3/кг, следовательно, плотность воды в этих состояниях будет равен кг/м3. Для всех остальных параметров состояние воды при 00С и при не очень высоких давлениях внутренняя энергия, энтропия и энтальпия равны нулю, то есть .
=0,001 м3/кг, следовательно, плотность воды в этих состояниях будет равен кг/м3. Для всех остальных параметров состояние воды при 00С и при не очень высоких давлениях внутренняя энергия, энтропия и энтальпия равны нулю, то есть .
Буквы, обозначающие параметры жидкости, имеют индекс штрих (/), а нижний индекс указывает, что температура воды 00С. Значения параметров воды при других температурах определяют по таблицам Ривкина. В таблицах термодинамических свойств воды у Ривкина имеются три таблицы: таблицы I и II относятся к насыщенному пару. Разница между этими двумя таблицами состоит в том, они построены по разным независимым переменным: таблица I построена по параметру температура, а таблица II ― по параметру давление.
Во втором вертикальном столбце таблицы I стоят значения давления насыщения, то есть того давления, при котором вода при данной температуре начинает превращаться в пар.
Например, для воды при 600С процесс парообразования начнётся, если давление воды будет 0,02 МПа. Для воды при температуре 1250С процесс парообразования начнётся, если давление будет 0,232 МПа.
Во втором столбце таблицы II указаны значения температуры кипения (насыщения), то есть температуры при которой начинается кипение, если вода находится при соответствующем ей давлении, значение которого находится в первом столбце.
Температура сухого насыщенного пара однозначно определяется его давлением и наоборот. Значения параметров такого пара обозначаются двумя штрихами. Буквой r обозначается скрытая теплота парообразования, или теплота фазового перехода, то есть количество тепла, необходимое для превращения воды, нагретой до температуры насыщения при данном давлении, в сухой насыщенный пар.
Когда к жидкости, находящейся в состоянии кипения, подводится при постоянном давлении количество тепла, равное скрытой теплоте парообразования, это не вызывает увеличения температуры. Подведённое количество тепла в этом случае идёт на преодоление сил сцепления между молекулами и на работу расширения.
Обозначим r=d+w, где d называется внутренней теплотой парообразования. Это то количество тепла, которое идёт на преодоление сил сцепления между молекулами жидкости; w ― это работа, производимая при увеличении объёма во время перехода из состояния жидкости в состояние сухого насыщенного пара, и называется внешней теплотой парообразования.
Значение внутренней энергии сухого насыщенного пара можно получить из уравнения u+pv=h. Тогда u//=h//-pv//. Здесь все величины, стоящие в правой части уравнения известны и могут быть взяты из таблиц Ривкина.
Мы уже знаем, что влажный насыщенный пар представляет собой смесь кипящей воды и сухого насыщенного пара. Объём v 1 кг влажного пара состоит из объёма х кг сухого пара и (1-х) кг воды, где х – массовая доля сухого пара, содержащегося во влажном паре; (1-х) ― массовая доля воды во влажном паре. Так как удельный объём сухого пара v//, а удельный объём кипящей воды v/, то удельный объём влажного пара составит: v=v//x+v/(1-x). Величина v/(1-x) часто оказывается очень малой по сравнению с v//x, поэтому для влажного пара приближённо, но достаточно точно для большинства технически важных расчётов можно принять: v=v//x.
Из сказанного видно, что удельный объём влажного пара меньше удельного объёма сухого пара. Внутренняя энергия влажного пара находится по уравнению:
u=h-pv, где все величины относятся к тому состоянию влажного пара, для которого определяется внутренняя энергия u.
Перегретый пар по своим свойствам соответствует идеальному газу в том смысле, что его состояние определяется, если заданы два параметра: давление и температура и сильно отличается от свойств насыщенного пара. Чем выше температура перегретого пара и чем ниже его давление, тем меньше отклоняется перегретый пар от свойств идеального газа. При высоких давлениях и при температурах, близких к состоянию насыщения, перегретый пар будет значительно отклоняться от свойств идеального газа.
Однако удельный объём перегретого пара при заданных давлении и температуры не может быть найден по уравнению идеального газа. Для водяного пара было предложено большое число характеристических уравнений (то есть уравнений состояния). При этом чем точнее какое-либо из них описывает определённые экспериментально свойства водяного пара, тем оно более сложно и менее удобно для расчётов. Поэтому для вычисления удельного объёма и других параметров перегретого пара удобнее всего пользоваться таблицами, составленными по экспериментальным данным с использованием уравнения состояния, например, таблицами по Ривкину.
Количество теплоты, которое подводится к 1 кг сухого насыщенного пара при превращении его в перегретый, называется теплотой перегрева и обозначается qпе. Эту теплоту можно найти их уравнения: qпе=сpm(t-tн), где:
t ― температура перегретого пара;
сpm ― средняя массовая изобарная теплоёмкость перегретого пара.
Теплоёмкость перегретого пара сpm зависит от давления и температуры.
1.4.21. h,s-диаграмма водяного пара
Кроме табличного метода расчётов тепловых процессов, на практике широко применяется графический метод с использованием h,s-диаграммы.
Эта диаграмма впервые была предложена в 1904 году немецким физиком Молье. В настоящее время в системе СИ пользуются диаграммой Вукаловича и Ривкина. Строится диаграмма по данным таблицы термодинамических свойств воды и водяного пара.
Практически h,s-диаграмма вся не изображается. Часть её, соответствующую очень влажному пару, опускают, что даёт возможность выполнить рабочую часть диаграммы в более крупном масштабе. А это повышает точность определения параметров пара и, следовательно, расчёта всех процессов при помощи этой диаграммы.
Повторю основные положения пройденного материала.
Паром называется всякий реальный газ, который в условиях его применения способен переходить в жидкость.
Скрытая теплота парообразования, или теплота фазового перехода ― это количество тепла, необходимое для превращения воды, нагретой до температуры насыщения при данном давлении, в сухой насыщенный пар.
Теплотой перегрева называется количество теплоты, которое подводится к 1 кг сухого насыщенного пара при превращении его в перегретый.
studfiles.net
Вода, водяной пар и их свойства | | Вода
Водяной пар — газовая фаза воды
Водяной пар образуется не только, когда вода кипит. Этот термин применим и к туману.
Туман — это пар, который становится видимым из-за капелек воды, которые образуются в присутствии охладителя воздуха — пар конденсируется.
При более низких давлениях, например, в верхних слоях атмосферы или в верхней части высоких гор, вода кипит при более низкой температуре, чем номинальная 100 ° C (212 ° F). При нагревании в дальнейшем становится перегретым паром.
Как газ, водяной пар может содержать только определенное количество водяного пара (количество зависит от температуры и давления).
Пар-жидкость равновесие является состоянием, при котором жидкость и пар (газовая фаза) находятся в равновесии друг с другом, это такое состояние, когда скорость испарения (жидкие изменения в пар) равна скорости конденсации (превращения пара в жидкость) на молекулярном уровне, что в целом означает взаимопревращения «пар-вода» . Хотя в теории равновесия можно достичь в относительно замкнутом пространстве, когда вода и ее пары соотносятся в контакте друг с другом достаточно долго без каких-либо помех или вмешательств извне. Когда газ поглотил свое максимальное количество, он, как говорят, находится в жидком паровом равновесии, но если в нем больше воды, он описывается как ‘влажный пар’.
Вода, водяной пар и их свойства на Земле
Вода в условиях окружающей среды это жидкость , но часто она сосуществует на Земле в твердом состоянии ( лед) , и газообразном состоянии (водяной пар или пар). Вода также существует в жидкокристаллическом состоянии — вблизи гидрофильных поверхностей. Вода на Земле находится в непрерывном движении, совершая свой круговой цикл в виде испарения и осаждения, обычно достигая моря.
Вода покрывает 70,9% поверхности Земли и является жизненно важным источником для всех известных форм жизни. Предметом Гидрологии является изучение движения, распространения, и качества воды на Земле. Изучением распределения воды занимается гидрография . Изучением распределения и движения подземных вод гидрогеология, ледников — гляциология, внутренних вод — лимнология, распределением океанов -океанография. Экологические процессы гидрологии находятся в фокусе экогидрологии.
Вода, водяной пар и их свойства во Вселенной
Большая часть воды Вселенной образуется в качестве побочного продукта звездообразования . Когда звезды рождаются, их рождение сопровождается сильным извержением газа и пыли. При этом отток материала в конечном итоге влияет на окружающий газ, ударные волны, которые создаются компресс и тепло газа. Воды быстро увлекаются в этот теплый поток плотного газа.
22 июля 2011 года в докладе Гарвард-Смитсоновского центра астрофизики описано открытие гигантского облака водяного пара, содержащего в 140 триллионов раз больше воды, чем все океаны Земли вместе взятые, вокруг квазара, который находится в 12 миллиардах световых лет от Земли. По словам исследователей, открытие показывает, что вода была распространенной во Вселенной во все время своего существования. Вода была обнаружена в межзвездных облаках в пределах нашей галактики, Млечного Пути. Вода, вероятно, существует в изобилии в других галактиках, потому что ее компоненты, водород и кислород, являются одними из самых распространенных элементов во Вселенной. Межзвездные облака в конце концов конденсируются в солнечные туманности и солнечные системы , подобные нашей.
Водяной пар присутствует в атмосфере Меркурия : 3,4%, Венеры : 0,002%, Земли : ~ 0,40% по сравнению с полной атмосферой, как правило, 1-4% на поверхностиАтмосфера Марса : 0.03%Атмосфера Юпитера : 0,0004%Атмосфера Сатурна — в льдов толькоЭнцелад (спутник Сатурна): 91%экзопланет, известных как HD 189733 и HD 209458 б .Вода лед присутствует на Земле — в основном, как ледниковые щиты
- полярных шапок льда на Марсе
- Луна
- Титан
- Европа
- Кольца Сатурна
- Энцелад
- Плутон и Харон
- Кометы и кометы источником населения ( пояса Койпера и облаком Оорта объектов).
Вода-лед может присутствовать на Церере и Тетис. Вода и другие летучие вещества, вероятно, составляют большую часть внутренних структур Урана и Нептуна и воды в глубокие слои могут быть в виде ионной воды, в которой молекулы распадаются на суп из водорода и ионы кислорода, и глубже, как суперионные воды, в которой кислород кристаллизуется, но ионы водорода плавают свободно в пределах кислорода решетки.
Некоторые из полезных ископаемых Луны содержат молекулы воды. Например, в 2008 году лаборатории устройство, которое собирает и определяет частицы, обнаружены небольшие количества соединений, внутри вулканического жемчуга, привезенного с Луны на Землю Аполлон-15 экипаж в 1971 году. НАСА сообщили об обнаружении молекул воды НАСА Луна минералогии Mapper на борту Чандраян-1 корабля Индийской организации космических исследований в сентябре 2009 года.
Области применения пара
Пар используется в широком спектре отраслей промышленности. Общие приложения для пара, например, связаны с паровым обогревом процессов на фабриках и заводах и на паровых приводных турбинах на электростанциях…
Вот некоторые типичные приложения для пара в промышленности: Отопление / Стерилизация, Движение / привод, Распыление, Очистка, Увлажнение…
Связь воды и пара, давления и температуры
Насыщение (сухого) пара результат процесса, когда вода нагревается до температуры кипения, а затем испаряется с дополнительным выделением тепла (скрытое отопление).
Если эта пара затем дополнительно нагревается выше точки насыщения, пар становится перегретым паром (фактическое отопление).
Насыщенный пар
Насыщенный пар образуется при температурах и давлениях, где пар (газ) и вода (жидкость) могут сосуществовать. Другими словами, это происходит, когда скорость испарения воды равна скорости конденсации.
Преимущества использования насыщенного пара для отопления
Насыщенный пар обладает многими свойствами, которые делают его отличным источником тепла, особенно при температуре 100 ° C (212 ° F) и выше.
Влажный пар
Это наиболее распространенная форма пара, которую на самом деле испытывает на себе большинство растений. Когда пар произведен, используя котел, он обычно содержит влажность от невыпаренных молекул воды, которые перенесены в распределенный пар. Даже самые лучшие котлы могут распустить пар, содержащий от 3% до 5% влажности. Когда вода подходит к состоянию насыщения и начинает испаряться, немного воды, как правило, оседает в виде тумана или капель. Это одна из ключевых причин, почему образуется конденсат из распределенных пар.
Перегретый пар
Перегретый пар создается при дальнейшем нагревании влажного или насыщенного пар вне точки насыщенного пара. Это дает пар, который имеет более высокую температуру и низкую плотность, чем у насыщенного пара при том же давлении. Перегретый пар используется в основном в двигателе / ??приводе турбины, и обычно не используется для теплопередачи.
Сверхкритическая вода
Сверхкритическая вода есть вода в состоянии, которое превышает его критическую точку: 22.1MPa, 374 ° C (3208 PSIA, 705 ° F). В критической точке, скрытая теплота пара равна нулю, а его удельный объем точно такой же, будь то жидкое или газообразное состояние. Иными словами, вода, которая находится при более высоком давлении и температуре, чем критическая точка, находится в неразличимом состоянии, которое не является ни жидкостью, ни газом.
Сверхкритических вода используется для привода турбин на электростанциях, которые требуют более высокой эффективности. Исследование сверхкритической воды выполняется с акцентом на его использование в качестве жидкости, которая имеет свойства как жидкости, так и газа, и в частности о его пригодности в качестве растворителя для химических реакций.
Различные состояния Воды
Ненасыщенные воды
Это вода в ее наиболее узнаваемом состоянии. Около 70% веса человеческого тела из воды. В жидком виде вода имеет устойчивые водородные связи в молекуле воды. Ненасыщенные воды относительно компактные, плотные, и стабильные структуры.
Насыщенный пар
Насыщенные молекулы пара невидимы. Когда насыщенный пар поступает в атмосферу, будучи вентилируемый из трубопроводов, часть его конденсируется, передавая свое тепло окружающему воздуху, и образуются клубы белого пара (крошечные капельки воды). Когда пар включает в себя эти крошечные капельки, это называется влажным паром.
В паровой системе, паровые потоки, идущие от конденсатоотводчиков часто неправильно называют насыщенными парами, в то время как это на самом деле пар вторичного вскипания . Разница между ними состоит в том, что насыщенный пар невидим сразу на выходе из трубы, в то время как облако пара содержит видимые капли воды, которые мгновенно в нем образуются.
Перегретый пар
Перегретый пар не будет конденсироваться, даже если он вступает в контакт с атмосферой и на него воздействуют перепады температуры. В результате, облака пара не образуются.
Перегретый пар сохраняет больше тепла, чем насыщенный пар при том же давлении, и движение его молекул происходит быстрее, поэтому он имеет более низкую плотность (т. е. его удельный объем больше).
Сверхкритическая вода
Хотя не возможно сказать визуальным наблюдением, это — вода в форме, которая не является ни жидкой, ни газообразной. Общее представление имеет молекулярное движение, которое является близко к тому из газа, и плотности, которая ближе к той из жидкости.
Хотя нельзя сказать, путем визуального наблюдения, это вода в какой форме, она не является ни жидкой, ни газообразной. Общее представление имеет молекулярное движение, близкое к газу, а плотность такой воды ближе к жидкости.
Вода из иного мира. Уважайте воду!
Земля — Планета, на которой живёт вода
Твоё отношение к воде
Живая и мертвая вода
voda.molodostivivat.ru
Основные свойства воды и водного пара. Термодинамические диаграммы воды и водного пара. Первый закон термодинамики. Цикл Карно. Второй закон термодинамики.
Термодинамика - наука об энергии и ее свойствах - представляет собой важнейшую отрасль естествознания. Основой термодинамики служат два экспериментально установленных закона, называемых иначе первым и вторым началом термодинамики. Термодинамика как самостоятельная наука получила развитие, когда были открыты эти два закона. Первый из них рассматривается как приложение к тепловым явлениям всеобщего закона сохранения и превращения энергии, а второй характеризует направление протекающих в окружающей нас природе процессов.
В технической термодинамике рассматривают частный случай общего закона сохранения и превращения энергии, устанавливающий эквивалентность между теплотой и механической работой. По этому закону теплота может превращаться в механическую работу или, наоборот, работа в теплоту в строго эквивалентных количествах. Это означает, что из данного количества теплоты в случае ее полного превращения в работу получается строго определенное и всегда одно и то же количество ра-
боты, точно так же, как и из данного количества работы при ее полном превращении в тепло получается строго определенное и всегда одно и то же количество теплоты.
Поскольку в системе СИ теплота и работа выражаются в одних и тех же единицах, приведенное выше положение может быть записано следующим образом:
(31)
где Q - тепло; L - полученная в результате его использования работа.
Первый закон термодинамики устанавливает взаимозависимость между количеством сообщенного рабочему телу или отведенного от него тепла, величиной изменения его внутренней энергии и совершенной рабочим телом работы изменения объема.
Из первого закона термодинамики следует, что полная энергия термодинамической системы в конце любого термодинамического процесса равна алгебраической сумме энергий ее в начале процесса и количества энергий, подведенных к системе и отведенных от нее в ходе процесса. Применительно к рассматриваемым в технической термодинамике процессам энергия к рабочему телу подводится или отводится от него лишь в форме тепла или механической работы. Поэтому
(32) гдеЈ? - суммарное количество подведенного к термодинамической системе тепла; АС/ - изменение внутренней энергии термодинамической системы; L - суммарная работа изменения объема термодинамической системы.
Применительно к 1 кг рабочего тела уравнение (32) принимает вид
(32') или в дифференциальной форме
(32")
Выражения (32), (32'), (32") представляют собой общее уравнение первого закона термодинамики и означают, что в общем случае все подводимое к термодинамической системе тепло расходуется на изменение ее внутренней энергии и на работу изменения объема системы.
В развернутом виде уравнения (32), (32') и (32") записывают следующим образом:
(33) (33') (33")
Второй закон термодинамики представляет собой обобщение изложенных выше положений и заключается в том, что: 1) самопроизвольное протекание естественных процессов возникает и развивается при отсутствии равновесия между участвующей в процессе термодинамической системой и окружающей средой; 2) самопроизвольно происходящие в природе естественные процессы, работа которых может быть использована человеком, всегда протекают лишь в одном направлении от более высокого потенциала к более низкому; 3) ход самопроизвольно протекающих процессов происходит в направлении, приводящем к установлению равновесия термодинамической системы с окружающей средой, и по достижении этого равновесия процессы прекращаются; 4) процесс может протекать в направлении, обратном самопроизвольному процессу, если энергия для этого заимствуется из внешней среды.
Формулировки второго закона термодинамики, данные различными учеными, вылились в форму постулатов, полученных в результате развития положений, высказанных французским ученым Сади Карно.
В частности, постулат немецкого ученого Клаузиуса состоит в том, что теплота не может переходить от холодного тела к теплому без компенсации. Сущность постулата английского ученого Томсона заключается в том, что невозможно осуществить цикл теплового двигателя без переноса некоторого количества теплоты от источника теплоты с более высокой температурой к источнику с более низкой температурой.
Из определения термического КПД следует, что понятие об этой величине тесно увязывается с сущностью второго закона термодинамики. Вопрос о максимальной доле теплоты, которая может быть при заданных условиях превращена в механическую энергию, решил Сади Карно, который предложил цикл, получивший название цикла Карно (рис. 18).
Рис. 18. Цикл Карно.
Выбор для цикла Карно двух изотерм и двух адиабат вполне обоснован, ибо процессы подвода и отвода теплоты в цикле могут осуществляться только по изотермам, так как изотермический процесс - это единственный обратимый процесс, который может находиться под воздействием одного источника теплоты.
Очевидно, работа в цикле Карно Ацв pv-диаграмме измеряется площадью 1-2-3-4, ограниченной двумя изотермами 1-2 и 3-4 и двумя адиабатами 2-3 и 4-1, а полезная теплота qwв Ts-диаграмме измеряется площадью прямоугольника 1-2-3-4.
Термический КПД для рассмотренного обратимого цикла Карно можно выразить так:
Водяной пар чрезвычайно широко применяется в различных отраслях промышленности главным образом в качестве теплоносителя в теплообменных аппаратах и как рабочее тело в паросиловых установках. Это
объясняется повсеместным распространением воды, ее дешевизной и безвредностью для здоровья человека.
Имея высокое давление и относительно низкую температуру, пар, используемый в тепловых агрегатах, близок к состоянию жидкости, поэтому пренебрегать силами сцепления между его молекулами и их объемом, как в идеальных газах, нельзя. Следовательно, не представляется возможным использовать для определения параметров состояния водяного пара уравнения состояния идеальных газов, т. е. для napapv Ф RT, ибо водяной пар является реальным газом.
Особую роль для пара имеет уравнение, предложенное Ван-дер-Ваальсом в 1873 году:
Являясь приближенным при количественных расчетах, уравнение Ван-дер-Ваальса качественно хорошо отображает физические особенности газов, так как позволяет описать общую картину изменения состояния вещества с переходом его в отдельные фазовые состояния. В этом уравнении а и b для данного газа являются постоянными величинами, учитывающими: первая - силы взаимодействия, а вторая - размер молекул.
Учеными М. П. Вукаловичем и И. И. Новиковым в 1939 году было получено уравнение для реальных газов с учетом ассоциации и диссоциации их молекул.
Это уравнение можно применять к любому реальному газу, и в частности к перегретому водяному пару. Но в связи с тем, что практически это сложное уравнение использовать трудно, с его помощью были вычислены основные физические величины перегретого водяного пара при различных р и Т, составлены таблицы и построена диаграмма в is-координатах, на основании которых и проводятся расчеты процессов изменения состояния водяного пара.
Пары бывают насыщенные и перегретые. Насыщенные пары разделяются на сухие насыщенные (или просто сухие) и влажные насыщенные (или просто влажные).
Испарением называется парообразование, происходящее только с поверхности жидкости и при любой температуре. Процесс, обратный парообразованию, называется конденсацией. Этот процесс превращения пара в жидкость также происходит при постоянной температуре, если давление остается постоянным. Жидкость, образующаяся при конденсации пара, называется конденсатом.
При испарении жидкости в ограниченное пространство (а это бывает в паровых котлах) одновременно происходит и обратное явление -конденсация пара, обусловленная тем, что некоторые из молекул пара, движущиеся в паровом пространстве по всем направлениям, ударяясь о поверхность жидкости, попадают в сферу влияния ее молекул и остаются в ней. Если скорость конденсации станет равной скорости испарения, то в системе наступает динамическое равновесие. Пар в этом состоянии имеет максимальную плотность и называется насыщенным. Следовательно, под насыщенным понимают пар, находящийся в равновесном состоянии с жидкостью, из которой он образуется. Основное свойство этого пара состоит в том, что он имеет температуру, являющуюся функцией его давления, одинакового с давлением той среды, в которой происходит кипение.
Если объем пара уменьшается, то часть пара переходит в жидкость (конденсация больше испарения). Но в обоих случаях давление пара остается постоянным. Пар образуется до тех пор, пока не испарится последняя капля жидкости.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
zdamsam.ru
Физические свойства льда, воды и водяного пара
Лед может находиться в нескольких кристаллических состояниях. При температуре тройной точки (практически при 0°) удельный объем льда равен 1,091 см3/г. При охлаждении льда ниже 0° объем его уменьшается, но настолько медленно, что его можно считать постоянным. Удельная теплоемкость льда составляет примерно половину теплоемкости воды.
Вода имеет наименьший удельный объем и наибольшую плотность при температуре 4°. При этой температуре удельный объем воды и плотность ее равны единице: Vв=1 см3/г; рв=1 г/см3
При изменении температуры в ту и другую сторону от 4° удельный объем воды увеличивается, а плотность уменьшается. В этом отношении вода ведет себя аномально по сравнению со всеми другими известными телами. Хотя удельный объем и плотность воды изменяются с температурой, но практически воду можно считать несжимаемой. Так, например, при температуре 100° удельный объем воды 1,043 см3/г, т. е. всего лишь на 4% отличается or удельного объема при температуре 4°.
Удельная теплоемкость воды несколько изменяется с температурой, но настолько незначительно, что ее также можно считать постоянной величиной, равной Сv —4,1868 • 107 эрс/г •град = 1 кал/г • град.
До достижения состояния насыщения водяной пар по своим свойствам близок к идеальному газу. Уравнением состояния водяного пара служит
e=RпрпТ
где е — упругость, рп — плотность, Rп — удельная газовая постоянная водяного пара.
Удельные теплоемкости ненасыщенного водяного пара можно считать независящими от температуры и равными:
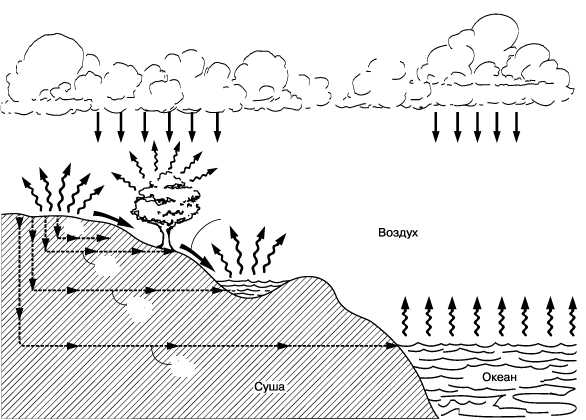
Cтруктура и взаимосвязь различных звеньев гидрологического цикла
Гидрологический цикл удобно представить в виде системы из четырех взаимосвязанных резервуаров (океан, материки, криосфера, атмосфера), между которыми происходит непрерывный процесс циркуляции и перераспределения природных вод
Рис 1
Самым большим водным резервуаром является Мировой океан (МО), содержащий 96,5% общих запасов воды на Земле. Самым малым резервуаром, содержащим влагу, является атмосфера, где находится всего лишь 0,001% общих запасов природных вод. Несмотря на это, значение атмосферной влаги для гидрологического цикла, чрезвычайно велико.
В отличие от МО и атмосферы, на материках и в криосфере наблюдается большое многообразие видов природных вод. Так, материковые воды можно разделить на речные, озерные, болотные, почвенные, подземные (включая гравитационные и. капиллярные) и биологические. Суммарное. их количество оценивается в 2,475 % общих запасов вод на Земле.
К криосфере Земли относятся материковые ледяные щиты, горные ледники, льды вечной мерзлоты, сезонный снежный покров и морские льды. Приближенно суммарный объем воды в криосфере можно оценить в 1,76 % общего запаса природных вод.
По современным представлениям общие запасы природных вод в течение длительного периода, измеряемого геологическими эпохами, практически остаются неизменными, т. е. поступление воды из земных недр и космического пространства на поверхность Земли очень мало и почти компенсируется потерей воды в космос вследствие рассеивания водяного пара в верхних слоях атмосферы.
Хотя ГГЦ является замкнутой системой, внутри нее между от дельными резервуарами постоянно происходит перераспределение вод, в результате которого запасы вод в каждом резервуаре меняются во времени. Эти колебания могут быть разного масштаба: короткопериодными, сезонными, многолетними, вековыми и много вековыми. Наиболее мощными являются сезонные и многовековые колебания.
Многовековые колебания в истории Земли связаны с эпохами оледенения, которые кардинально изменяли климатический и гидрологический режимы планеты. При этом происходило перераспределение природных вод. В ледниковые эпохи, когда океан от ступал, площадь криосферы значительно увеличивалась, и наобо рот, при потеплении происходила перекачка вод криосферы в МО.
Очевидно, все оценки межвековых колебаний в значительной степени гипотетичны. По-видимому, лучшим их индикатором является средний уровень МО. Естественно, что наиболее достоверными являются сведения от изменениях уровня в настоящую эпоху. Так, можно полагать, что за последние 20 тыс. лет уровень МО повысился по чти на 100 м, а в текущем столетии, за 1900— 1960 гг., он повысился на 12,5 см, что изменило его объем всего на 0,002 %.
Каждый резервуар вместе со всеми видами вод, заключенными р нем, а также с потоками вод внутри него и на границах можно рассматривать в качестве самостоятельного звена ГЦ, т. е. процессы влагообмена для каждого звена ГЦ можно считать относительно независимыми друг от друга. Таким образом, имеем четыре звена ГЦ: океаническое, материковое (наземное), криосферное и атмосферное, которые будем считать основными структурными единицами ГЦ.
Учитывая, что все звенья ГЦ связаны между собой, имеет смысл взаимодействующие звенья рассматривать как единые гидрологические системы (ГС). В результате имеем шесть таких ГС, из которых наиболее важными следует, очевидно, признать системы океан-—атмосфера и литосфера— атмосфера.
Одновременно с этим каждое из звеньев ГЦ можно разделить на более мелкие сравнительно однородные части (например, океаническое звено ГЦ разделяется на ГЦ отдельных океанов, морей, заливов, проливов и т. п.), которые назовем гидрологическими подсистемами (ГП). Самой малой частью ГП является единичная масса воды, льда, воздуха или почвы. Математической моделью ГЦ является уравнение водного баланса, которое отражает универсальный закон сохранения вещества и в самом общем виде в алгебраической записи может быть представлено следующим образом:
Где -сумма аккумуляционных составляющих водного баланса, характеризующих изменение запасов вод во времени;
- сумма приходных компонентов водного баланса, означающих увеличение объема вод; -сумма расходных компонентов, характеризующих уменьшение объема вод. Для закрытой системы, какой является ГГЦ,, а правая часть обращается в очевидное тождество
Из которого следует равенство глобальных оценок осадков (Pgl)и испарения (Egl). Все остальные гидрологические системы являются уже открытыми, а для них аккумуляционные составляющие
могут обращаться в нуль лишь для средних многолетних условий и то не во всех случаях. С уменьшением пространственных масштабов уравнение водного баланса обычно усложняется, причем иногда члены уравнения (1.2) не могут быть количественно оценены.
Приведенная. схема ГЦ может быть представлена в более детальном виде, причем степень детальности будет зависеть прежде всего от целей исследования. Теоретически можно даже учесть все виды вод и их потоки для каждого резервуара, какими бы малыми они не были. Однако практически осуществить это в компактной форме вряд ли возможно.
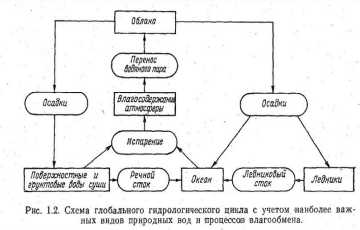
Поэтому рассмотрим такую схему ГЦ, в которой, по мнению автора, учтены лишь наиболее важные виды природ ных вод и наиболее важные процессы влагообмена. Первые из них помещены в прямоугольники, а вторые -в овалы. Из данной схемы отчетливо видна центральная роль атмосферного звена ГЦ в системе глобального водного баланса. И это не случайно, так как атмосфера является единственным источником возобновления в природе пресных вод (испарение) и главным источником пополнения и перераспределения запасов вод (осадки) как между от дельными резервуарами, так и между различными частями одногои того же резервуара.
Атмосфера представляет собой единственную оболочку планеты, содержащую воду во всех трех агрегатных состояниях (газообразном, твердом, жидком), из которых газообразное (водяной пар) является важнейшим и не содержится более ни в одной другой оболочке. В атмосфере постоянно происходят фазовые пере ходы воды, из которых важнейшим является процесс конденсации, сопровождающийся выделением огромного количества тепла, 'которое в свою очередь играет весьма значительную роль для под держания общей циркуляции атмосферы (ОЦА).
Атмосфера является наиболее подвижным компонентом ГЦ. Так, характерная скорость переноса атмосферной влаги на поря док больше скорости движения речных вод и на два порядка— типичной скорости океанских течений. В соответствии с этим период полного возобновления атмосферной влаги составляет 7—9 сут, что значительно меньше, чем в других резервуарах.
Разумеется, здесь перечислены далеко не все специфические особенности атмосферы, но даже они наглядно свидетельствуют о большом значении атмосферных процессов для познания внутренних закономерностей̆ движения воды в крупномасштабных гидрологических системах. Поэтому, рассматривая относительную значимость отдельных резервуаров, можно вполне определенно утверждать, что атмосферное звено играет центральную роль в ГЦ, а следовательно, проблема изучения атмосферного водного баланса является центральной̆ в крупномасштабных исследованиях ГЦ.
С другой̆ стороны, нельзя не отметить огромной̆ роли океана в поддержании ГГЦ. Он является самым большим резервуаром природных вод, главной̆ причиной̆ существования круговорота влаги на земном шаре и основным поставщиком энергии для атмосферы (через испарение). Кроме того, океан вследствие превышения испарения над осадками предопределяет существование водных ресурсов (речного стока) на континентах и ледникового стока с Антарктиды и Гренландии. Поэтому изучение водного баланса системы океан— атмосфера также следует отнести к числу главнейших приоритетов в исследованиях ГГЦ.
studfiles.net