Физические свойства уксусной кислоты. Физические свойства уксусной кислоты и воды
Формула уксусной кислоты в химии
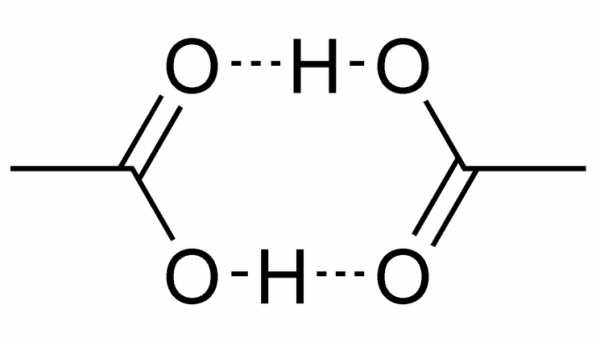
Химическая и структурная формулы уксусной кислоты
Химическая формула: Ch4COOH
Брутто-формула: C2h5O2
Структурная формула:
Молярная масса: 60,05 г/моль.
Уксусная кислота – предельная одноосновная карбоновая кислота. Образует соли – ацетаты.
Слабая кислота, константа диссоциации Ka=1,75 •10–5, рКа = 4,76.
Физические свойства уксусной кислоты
Уксусная кислота — бесцветная жидкость с резким характерным запахом, кислым вкусом. Гигроскопична, неограниченно растворяется в воде. Существует в виде димеров. Безводная уксусная кислота называется ледяной, поскольку при замерзании образует льдовидную массу.
Химические свойства уксусной кислоты
Уксусная кислота проявляет все основные свойствами карбоновых кислот.
- Взаимодействует с активными металлами с образованием водорода и соответствующих солей (ацетатов):
- Взаимодействует с оксидами металлов:
- Взаимодействует с гидроксидами металлов:
- В присутствии серной кислоты вступает в реакцию этерификации с образованием сложных эфиров:
- Вступает в реакции галогенирования с образованием галогенуксусных кислот:
- Реакция горения:
Качественной реакцией на соли уксусной кислоты является взаимодействие с сильными кислотами. Уксусная кислота слабая и вытесняется сильными кислотами из растворов солей, при этом появляется ее характерный запах:
Получение. Наиболее экономически выгодный промышленный способ получения уксусной кислоты – карбонилирование метанола моноксидом углерода, катализатор – соли родия, промотор – иодид-ионы:
Биохимический способ – окисление этанола:
Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260), бытовой кулинарии, и консервировании. Уксусную кислоту применяют для получения лекарственных и душистых веществ, в качестве растворителя.
|
Концентрированная уксусная кислота (с концентрацией более 30%) способна вызывать химические ожоги. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей |
Примеры решения задач
ru.solverbook.com
Уксусная кислота – свойства, области применения, пищевая добавка Е-260
Одной из первых кислот, которая стала известна людям еще в древности, стала уксусная кислота. Обнаружено это было случайно – вследствие появления уксуса при скисании вина. В 1700 году Шталь получил концентрированную разновидность химической разновидности жидкости, а в 1814 – Берцелиус установил точный его состав.
Получение уксусной кислоты возможно разными путями, а применяется она достаточно широко во многих направлениях хозяйственной деятельности.
Что такое уксусная кислота?
Уксусная кислота является синтетическим продуктом брожения углеводов и спиртов, а также естественного скисания сухих виноградных вин. Принимая участие в процессе обмена веществ в организме человека, данная кислота является пищевой добавкой, используемой для приготовления маринадов и консервации.
Производными кислоты считаются уксус – 3-9%, и уксусная эссенция – 70-80%. Эфиры и соли уксусной кислоты называются ацетатами. В состав обычного уксуса, к которому привыкла каждая хозяйка, входит аскорбиновая, молочная, яблочная, уксусная кислоты. Ежегодно в мире производится почти 5 миллионов тонн уксусной кислоты.
Транспортировка кислоты на разные расстояния осуществляется в железнодорожных или автомобильных цистернах, изготовленных из специализированных марок нержавеющей стали. В складских условиях она хранится в герметичных емкостях, контейнерах, бочках под навесами или в помещениях. Заливать и хранить вещество в полимерной таре можно в течение одного календарного месяца.
Качественные характеристики уксусной кислоты
Бесцветная жидкость с кислым привкусом и резковатым запахом, которой является уксусная кислота, имеет ряд определенных преимуществ. Конкретные свойства делают кислоту незаменимой во многих химических соединениях и продуктах бытового назначения.
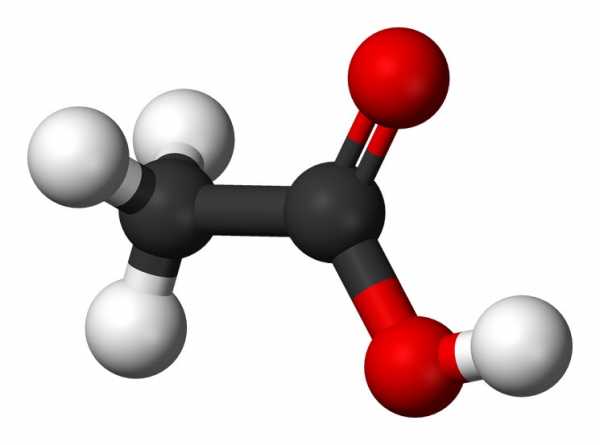
Уксусная кислота, как одна из представителей карбоновых, имеет способность к проявлению высокой реакционной способности. Вступая с самыми разными веществами в реакции, кислота становится инициатором соединений с функциональными производными. Благодаря подобным реакциям, становится возможным:
- Образование солей;
- Образование амидов;
- Образование сложных эфиров.
К уксусной кислоте предъявляется ряд определенных технических требований. Жидкость должна растворяться в воде, не иметь механических примесей и иметь установленные пропорции качественных составляющих.
Основные области применения уксусной кислоты Е-260
Разнообразие сфер, в которых применима уксусная кислота, достаточно велико. Данная кислота является непременным компонентом многих лекарственных препаратов – например, фенацетина, аспирина и других разновидностей. Ароматические амины Nh3-группы защищаются в процессе нитрования введением ацетильной группы СН3СО – это также одна из наиболее распространенных реакций, в которые вступает уксусная кислота.
Довольно важную роль играет вещество при изготовлении ацетилцеллюлозы, ацетона, различных синтетических красителей. Не обходится без ее участия производство разнообразной парфюмерии и негорючих пленок.

Часто применима уксусная кислота в пищевой промышленности – в качестве пищевой добавки Е-260. Консервирование и бытовая кулинария также являются успешным полем действия и применения качественной натуральной добавки.
При крашении основные типы солей уксусной кислоты играют роли специальных протрав, обеспечивая стабильную связь текстильных волокон с красителем. Эти соли часто применяются в борьбе с самыми стойкими разновидностями растений-вредителей.
Меры предосторожности при работе с уксусной кислотой
Уксусная кислота считается легковоспламеняющейся жидкостью, которой присвоен третий класс опасности – в соответствии с классификацией веществ по степени опасного воздействия на организм. При любых работах с данным видом кислоты специалисты пользуются индивидуальными современными средствами защиты (фильтрующими противогазами).

Даже пищевая добавка Е-260 может оказаться токсичной для человеческого организма, однако зависеть степень воздействия будет от качества разбавления водой концентрированной уксусной кислоты. Растворы, концентрация кислоты в которых превышает уровень в 30%, считаются опасными для жизни. Соприкасаясь с кожей и слизистыми оболочками, уксусная кислота высокой концентрации вызовет сильнейшие химические ожоги.
При этом способ получения кислоты не играет особой роли в ее токсикологической направленности, а смертельной может быть доза от 20 мл. Различные последствия могут стать губительными для многих человеческих органов – начиная от ротовых слизистых и дыхательных путей и заканчивая желудком и пищеводом.
При неосторожном попадании кислоты внутрь важно пить как можно больше жидкости до приезда медиков, но ни в коем случае не вызывать рвоту. Повторное прохождение веществ по организму может повторно обжечь органы. В дальнейшем необходимым будет промывание желудка при помощи зонда и госпитализация.
www.sciencedebate2008.com
Уксусная кислота — Циклопедия
| Уксусная кислота | |
| Химическая формула | Ch4COOH |
| Состояние | бесцветная жидкость |
| Молярная масса | 60,05 г/моль |
| Плотность | 1,0492 г/см³ |
| Т. плав. | 16,75 °C |
| Т. кип. | 118,1 °C |
| Кр. точка | 321,6 °C, 5,79 МПа |
| Мол. теплоёмк. | 123,4 Дж/(моль·К) |
| Энтальпия образования | −487 кДж/моль |
| pKa | 4,76 (Ka=1,75*10-5) |
| Показатель преломления | 1,372 |
| Дипольный момент | 1,74 Д |
| Рег. номер CAS | 64-19-7 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
 Уксусная кислота Химия 41. Состав уксуса. Уксусная кислота — Академия занимательных наук
Уксусная кислота Химия 41. Состав уксуса. Уксусная кислота — Академия занимательных наук Уксусная кислота (этановая кислота, метанкарбоновая кислота) — одноосновная органическая карбоновая кислота, имеющая формулу Ch4COOH.
Открытие уксусной кислоты приписывают Марии Гебре, Джабир ибн Хайяну, но первым её и её некоторые свойства описал Теофраст.
[править] Физические свойства
Уксусная кислота — бесцветная, растворимая в воде жидкость с острым характерным запахом. Молярная масса = 60,05 г/моль. Плотность = 1,0492 г/см³. Температура плавления = + 16,75 °C. Температура кипения = + 118,1 °C.
[править] Химические свойства
При взаимодействии с активными металлами образует соли — ацетаты.
Например, ацетат свинца (II):
PbО + 2СН3СООН → (СН3СОО)2Pb + h3O
Ацетат калия:
2Ch4COOH + K2CO3 → 2Ch4COOK + CO2 + h3O
Ацетат магния:
Mg + 2Ch4COOH → (Ch4COO)2Mg + h3
Ацетат кальция:
CaO + 2Ch4COOH → (Ch4COO)2Ca + h3O
Ацетат натрия:
Ch4COOH + NaOH → Ch4COONa + h3O
При нагревании ацетатов с этанолом в присутствии серной кислоты h3SO4 происходит реакция этерификации с образованием уксусно-этилового эфира (этилацетата):
СН3СООН + С2Н5ОН → СН3СООC2H5 + 2h3O
При взаимодействии с такими газами как хлор, водород замещается:
Ch4COOH + Cl2 → Ch3ClCOOH + HCl
Получилась хлоруксусная кислота. Аналогично, водород может замещаться например на фтор, с образованием фторуксусной кислоты Ch3FCOOH или иод с образованием иодуксусной кислоты Ch3ICOOH.
Горение этой кислоты разлагает её на углекислоту и воду:
Ch4COOH + 2O2 → 2CO2 + 2h3O
Уксусную кислоту получают окислением ацетальдегида кислородом в присутствии катализатора — ацетата марганца (II) Mn(Ch4COO)2 при температуре 50-60 °С:
2Ch4CHO + O2 → 2Ch4COOH
Либо окисление н-бутана при температуре 150—200 °C и давлении 150 атм., с использованием в качестве катализатора ацетата кобальта:
2C4h20 + 5O2 → 4Ch4COOH + 2h3O
Другим способом получения данной кислоты является карбонилирование метанола (метиловый спирт Ch4OH) моноксидом углерода (CO):
Ch4OH + CO → Ch4COOH
Также можно окислить этанол (этиловый спирт С2Н5ОН):
С2Н5ОН + О2 → СН3СООН + Н2О
[править] Аналитический анализ
Для выявления присутствия уксусной кислоты при проведении анализа (см. Аналитическая химия), проводят реакцию с хлоридом железа (III) FeCl3, при этом к ацетат-ионам появляется красная окраска, обусловленная образованием основного ацетата железа:
8СН3СОО− + 3Fe3+ + Н2О → [Fe3(ОН)2(СН3СОО)6]+ + 2СН3СООН
[править] Медицинский аспект
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. При попадании концентрированной (свыше 30 %) уксусной кислоты на кожу и ткани, она способна вызывать химические ожоги, с развитием коагуляционных некрозов прилегающих тканей различной протяженности и глубины.
При попадании в желудочно-кишечный тракт концентрированной уксусной кислоты возникает тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка. Возможны ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлым желудочно-кишечным кровотечением. Из-за потери плазмы через обожжённую слизистую оболочку, возникает значительное сгущение крови, что может вызвать шок. Опасными осложнениями отравления уксусной эссенцией является острая почечная недостаточность и токсическая дистрофия печени.
Предельно допустимая концентрация уксусной кислоты — 5 мг/м3. При работе с этой кислотой нужно применять фильтрующие противогазы для защиты от паров.[1]
cyclowiki.org
Физические свойства уксусной кислоты | Разработки уроков, презентации, планирование, конспекты занятий
Агрегатное состояние Жидкое
Цвет Бесцветная прозрачная жидкость
Запах Резкий уксусный
Растворимость в воде Хорошая
Температура кипения 1180С
Температура плавления 170С
Эксперимент: Учитель помещает заранее демонстрационную пробирку в стакан со льдом. Теперь в пробирку он наливает 2 – 3 мл концентрированной уксусной кислоты, которая кристаллизуется.
Замерзающая уксусная кислота называется «ледяной»
Зависимость физических свойств карбоновых кислот от строения молекулы:
Низшие карбоновые кислоты – Жидкости; высшие – Твердые вещества
Чем больше Относительная молекулярная масса кислоты, тем меньше ее Запах.
С увеличением Относительной молекулярной массы кислоты Растворимость уменьшается
Чем больше Относительная масса кислоты, тем выше Температура кипения
Температура кипения кислот с Нормальным строением углеродного радикала выше, чем Температура кипения кислот Изомерного строения.
Проблема: Что влияет на физические свойства карбоновых кислот?
Электронное строение молекулы. Давайте рассмотрим электронное строение молекул карбоновых кислот.
IV. Электронное строение. Сила кислот
Рассмотреть электронное строение молекул карбоновых кислот и выявить закономерности, определяющие силу кислот.
Вопрос – ответ:
Рассмотрите строение молекулы карбоновой кислоты. Из каких двух самостоятельных групп состоит карбоксильная группа?
Карбонил: - С = О
׀
Гидроксил: - ОН
Какова особенность электронного строения карбонильной группы?
Связь С=О полярная, плотность смещена к атому кислорода.
Какие свойства придает спиртам наличие гидроксила?
За счет подвижности атома водорода спирты проявляют слабые кислотные свойства.
И вот две эти функциональные группы соединены между собой.
Проблема: Как распределена электронная плотность в получившемся фрагменте? Как это отражается на свойствах карбоновых кислот?
1. По сравнению с альдегидами и кетонами углеродный атом – С = О несет меньший положительный заряд. Это происходит благодаря положительному мезомерному эффекту атома кислорода гидроксильного фрагмента, имеющего неподеленную электронную пару. Таким образом, карбонильная группа становится не способна к реакциям присоединения, характерным для альдегидов и кетонов.
2. Вместе с тем, возрастает полярность связи – О — Н гидроксильного фрагмента, ион водорода легче отщепляется, Кислотные свойства карбоновых кислот значительно сильнее по сравнению со спиртами.
Проблема: Ученые, путем незамысловатых действий, пришли к выводу, что лимонный сок обладает большей кислотностью, чем томатный, а кислотность томатного выше, чем пота и мочи. Как определить кислотность, и от чего она зависит?
Работа со схемой (числовая прямая рН)
Для наглядности предлагаю расставить достаточно известные всем кислоты в порядке увеличения их кислотности на числовой оси.
Описание:
На первом месте окажется рекордсмен по кислотности – Лимонная кислота, которая так же является рекордсменом по плодам и ягодам, в которых она содержится: это крыжовник, листья махорки, хвоя, малина, свекловичный сок, листья хлопчатника, недозрелые лимоны и китайский лимонник (соответственно 80 и 70%).
На втором месте располагается Щавелевая кислота, содержащаяся в листьях щавеля, ревеня, шпината, клевера и даже плодах томата. Но с данной кислотой нужно держать «ухо в остро». Ее соли – оксалаты – нерастворимы в воде, поэтому «любители щавеля» могут заработать себе камни в почках и мочевом пузыре.
Ниже располагаются винная и молочная кислоты. Они различаются по строению, и тем не менее, их кислотность приблизительно одинакова. Винная кислота содержится во многих растениях, но особенно много ее в виноградном соке. При достаточно длительном брожении виноградного сока в сосуде может выпасть серовато – красноватый осадок «винного камня» - соли виной кислоты. О Молочной кислоте мы уже говорили. Она есть везде, где есть сахар, в том числе в моче и поте человека.
Янтарная кислота уже относится к разряду слабых кислот. Это деление, конечно, условно, поскольку и она вызывает химические ожоги на коже человека.
Однако Бензойная кислота еще слабее, чем янтарная. Большое количество бензойной кислоты содержится в клюкве и бруснике.
Вопрос: Вы, наверняка, знаете, какими свойствами характеризуется эта ягода?
Медицинское антисептическое средство. Клюквенный сок вызывает гибель стафилококков, ответственных за воспалительные процессы организма. Благодаря этой способности клюква и брусника не гниют и могут долго сохраняться в свежем виде. Благодаря своим свойствам бензойная кислота используется как пищевая добавка - консервант Е210.
Вопросы – подсказки:
· Что подразумевается под словом «кислотность»?
· Чем определяется сила кислоты?
· Какие особенности строения влияют на силу кислот?
Выводы по схеме:
При введении в молекулу более ЭО элемента, электронная плотность переходит к нему, оттягивая за собой электронную плотность от атома О Þ атом водорода становится более подвижным Þ сила кислоты увеличивается. Чем больше карбоксильных групп, тем сильнее кислота. Чем больше R, тем меньше сила кислоты, т. к., электронная плотность теряется по молекуле.
Задание: Дополните ряд кислот в нужной последовательности, используя приведенные ниже примеры. Подтвердите свои выводы экспериментальным путем.
Формулы веществ:
СООН НООС – СН – СН2 – СООН Н3С – СООН НСООН
ОН
ОСОСН3 яблочная уксусная муравьиная
Ацетилсалициловая
Цель: Выполнив задания № 5, вы сможете сопоставить строение кислот и их силу, сравнив теоретические выводы с данными, полученными экспериментальным путем.
| Группа | Задание |
| I |
1) Опустите Лакмусовую бумагу в растворы кислот 2) Сравните Цвет Бумаги со стандартной шкалой. J Чем меньше рН, тем сильнее кислота |
| II |
1) Опустите Лакмусовую бумагу в растворы кислот 2) Сравните Цвет Бумаги со стандартной шкалой. J Чем меньше рН, тем сильнее кислота |
| III |
1) Опустите Лакмусовую бумагу в растворы кислот 2) Сравните Цвет Бумаги со стандартной шкалой. J Чем меньше рН, тем сильнее кислота |
| IV |
|
www.testsoch.com