ВОДА, ЛЕД И ПАР. Вода пар
ВОДА, ЛЕД И ПАР | Энциклопедия Кругосвет
Содержание статьиВОДА, ЛЕД И ПАР, соответственно жидкое, твердое и газообразное состояния химического соединения молекулярной формулы Н2О.
Историческая справка.
Идея древних философов о том, что все в природе образуют четыре элемента (стихии): земля, воздух, огонь и вода, просуществовала вплоть до Средних веков. В 1781 Г.Кавендиш сообщил о получении им воды при сжигании водорода, но не оценил в полной мере важности своего открытия. Позже (1783) А.Лавуазье доказал, что вода вовсе не элемент, а соединение водорода и кислорода. Й.Берцелиус и П.Дюлонг (1819), а также Ж.Дюма и Ж.Стас (1842) установили весовой состав воды, пропуская водород через оксид меди, взятый в строго определенном количестве, и взвешивая образовавшиеся медь и воду. Исходя из этих данных, они определили отношение Н:О для воды. Кроме того, в 1820-х годах Ж.Гей-Люссак измерил объемы газообразных водорода и кислорода, которые при взаимодействии давали воду: они соотносились между собой как 2:1, что, как мы теперь знаем, отвечает формуле Н2О.
Распространенность.
Вода покрывает 3/4 поверхности Земли. Тело человека состоит из воды примерно на 70%, яйцо – на 74%, а некоторые овощи – это почти одна вода. Так, в арбузе ее 92%, в спелых томатах – 95%.
Вода в природных резервуарах никогда не бывает однородной по составу: она проходит через горные породы, соприкасается с почвой и воздухом, а потому содержит растворенные газы и минеральные вещества. Более чистой является дистиллированная вода.
Морская вода.
Состав морской воды различается в разных регионах и зависит от притока пресных вод, скорости испарения, количества осадков, таяния айсбергов и т.д. См. также ОКЕАН.
Минеральная вода.
Минеральная вода образуется при просачивании обычной воды сквозь породы, содержащие соединения железа, лития, серы и других элементов.
Мягкая и жесткая вода.
Жесткая вода содержит в больших количествах соли кальция и магния. Они растворяются в воде при протекании по породам, сложенным гипсом (СaSO4), известняком (СаСО3) или доломитом (карбонаты Mg и Са). В мягкой воде этих солей мало. Если вода содержит сульфат кальция, то говорят, что она обладает постоянной (некарбонатной) жесткостью. Ее можно умягчить добавлением карбоната натрия; это приведет к осаждению кальция в виде карбоната, а в растворе останется сульфат натрия. Соли натрия не вступают в реакцию с мылом, и расход его будет меньше, чем в присутствии солей кальция и магния.
Вода, обладающая временной (карбонатной) жесткостью, содержит бикарбонаты кальция и магния; ее можно умягчить несколькими способами: 1) нагреванием, приводящим к разложению бикарбонатов на нерастворимые карбонаты; 2) добавлением известковой воды (гидроксида кальция), в результате чего бикарбонаты превращаются в нерастворимые карбонаты; 3) с помощью обменных реакций.
Вода, содержащая в большом количестве растворенный диоксид углерода, просачиваясь через известняковые породы, растворяет их, что приводит к образованию пещер. При повышении температуры начинается обратный процесс: бикарбонат разлагается и вновь образуется известняк. Именно из него состоят сталактиты и сталагмиты.
Молекулярная структура.
Анализ данных, полученных из спектров поглощения, показал, что три атома в молекуле воды образуют равнобедренный треугольник с двумя атомами водорода в основании и кислородом в вершине:
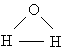
Валентный угол НОН равен 104,31°, длина связи О–Н составляет 0,99 Å (1 Å = 10–8 см), а расстояние Н–Н равно 1,515 Å. Атомы водорода так глубоко «внедрены» в атом кислорода, что молекула оказывается почти сферической; ее радиус – 1,38 Å.
ВОДА
Физические свойства.
Благодаря сильному притяжению между молекулами у воды высокие температуры плавления (0° С) и кипения (100° С). Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей. Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Чистая вода – плохой проводник электричества, ее удельная электропроводность равна 1,5Ч10–8 Ом–1Чсм–1 при 0° С. Сжимаемость воды очень мала: 43Ч10–6 см3 на мегабар при 20° С. Плотность воды максимальна при 4° С; это объясняется свойствами водородных связей ее молекул.
Давление паров.
Если оставить воду в открытой емкости, то она постепенно испарится – все ее молекулы перейдут в воздух. В то же время вода, находящаяся в плотно закупоренном сосуде, испаряется лишь частично, т.е. при определенном давлении водяных паров между водой и воздухом, находящимся над ней, устанавливается равновесие. Давление паров в равновесии зависит от температуры и называется давлением насыщенного пара (или его упругостью). Когда давление насыщенного пара сравнивается с внешним давлением, вода закипает. При обычном давлении 760 мм рт.ст. вода кипит при 100° С, а на высоте 2900 м над уровнем моря атмосферное давление падает до 525 мм рт.ст. и температура кипения оказывается равной 90° С.
Испарение происходит даже с поверхности снега и льда, именно поэтому высыхает на морозе мокрое белье.
Вязкость воды с ростом температуры быстро уменьшается и при 100° С оказывается в 8 раз меньше, чем при 0° С.
Химические свойства.
Каталитическое действие.
Очень многие химические реакции протекают только в присутствии воды. Так, окисление кислородом не происходит в сухих газах, металлы не реагируют с хлором и т.д.
Гидраты.
Многие соединения всегда содержат определенное число молекул воды и называются поэтому гидратами. Природа образующихся при этом связей может быть разной. Например, в пентагидрате сульфата меди, или медном купоросе CuSO4Ч5h3O, четыре молекулы воды образуют координационные связи с ионом сульфата, разрушающиеся при 125° С; пятая же молекула воды связана так прочно, что отрывается лишь при температуре 250° С. Еще один стабильный гидрат – серная кислота; она существует в двух гидратных формах, SO3Чh3O и SO2(OH)2, между которыми устанавливается равновесие. Ионы в водных растворах тоже часто бывают гидратированы. Так, Н+ всегда находится в виде иона гидроксония Н3О+ или Н5О2+; ион лития – в виде Li (h3O)6+ и т.д. Элементы как таковые редко находятся в гидратированной форме. Исключение составляют бром и хлор, которые образуют гидраты Br2Ч10 h3O и Cl2Ч6h3О. Некоторые обычные гидраты содержат кристаллизационную воду, например хлорид бария BaCl2Ч2h3O, английская соль (сульфат магния) MgSO4Ч7h3O, питьевая сода (карбонат натрия) Na2CO3Ч10 h3O, глауберова соль (сульфат натрия) Na2SO4Ч10 h3O. Соли могут образовывать несколько гидратов; так, сульфат меди существует в виде CuSO4Ч5h3O, CuSO4Ч3h3O и CuSO4Чh3O. Если давление насыщенного пара гидрата больше, чем атмосферное давление, то соль будет терять воду. Этот процесс называется выцветанием (выветриванием). Процесс, при котором соль поглощает воду, называется расплыванием.
Гидролиз.
Гидролиз – это реакция двойного разложения, в которой одним из реагентов является вода; трихлорид фосфора PCl3 легко вступает в реакцию с водой:
PCl3 + 3h3O = P (OH)3 + 3HCl
Аналогичным образом гидролизуются жиры с образованием жирных кислот и глицерина.
Сольватация.
Вода – полярное соединение, а потому охотно вступает в электростатическое взаимодействие с частицами (ионами или молекулами) растворенных в ней веществ. Образовавшиеся в результате сольватации молекулярные группы называются сольватами. Слой молекул воды, связанный с центральной частицей сольвата силами притяжения, составляет сольватную оболочку. Впервые понятие сольватации было введено в 1891 И.А.Каблуковым.
Тяжелая вода.
В 1931 Г.Юри показал, что при испарении жидкого водорода его последние фракции оказываются тяжелее обычного водорода вследствие содержания в них в два раза более тяжелого изотопа. Этот изотоп называется дейтерием и обозначается символом D. По своим свойствам вода, содержащая вместо обычного водорода его тяжелый изотоп, существенно отличается от обычной воды.
В природе на каждые 5000 массовых частей Н2О приходится одна часть D2O. Это соотношение одинаково для речной, дождевой, болотной воды, подземных вод или кристаллизационной воды. Тяжелая вода используется в качестве метки при исследовании физиологических процессов. Так, в моче человека соотношение между Н и D тоже равно 5000:1. Если дать пациенту выпить воду с большим содержанием D2O, то, последовательно измеряя долю этой воды в моче, можно определить скорость выведения воды из организма. Оказалось, что около половины выпитой воды остается в организме даже спустя 15 сут. Тяжелая вода, вернее, входящий в ее состав дейтерий – важный участник реакций ядерного синтеза.
Третий изотоп водорода – тритий, обозначаемый символом Т. В отличие от первых двух он радиоактивен и обнаружен в природе лишь в малых количествах. В пресноводных озерах соотношение между ним и обычным водородом равно 1:1018, в поверхностных водах – 1:1019, в глубинных водах он отсутствует. См. также ВОДОРОД.
ЛЕД
Лед, твердая фаза воды, используется в основном как хладагент. Он может находиться в равновесии с жидкой и газообразной фазами или только с газообразной фазой. Толстый слой льда имеет голубоватый цвет, что связано с особенностями преломления им света. Сжимаемость льда очень низка.
Лед при нормальном давлении существует только при температуре 0° С или ниже и обладает меньшей плотностью, чем холодная вода. Именно поэтому айсберги плавают в воде. При этом, поскольку отношение плотностей льда и воды при 0° С постоянно, лед всегда выступает из воды на определенную часть, а именно на 1/5 своего объема. См. также АЙСБЕРГИ.
ПАР
Пар – газообразная фаза воды. Вопреки общепринятому мнению, он невидим. Тот «пар», который вырывается из кипящего чайника, – это на самом деле множество мельчайших капелек воды. Пар обладает свойствами, очень важными для поддержания жизни на Земле. Хорошо известно, например, что под действием солнечного тепла вода с поверхности морей и океанов испаряется. Образующиеся водяные пары поднимаются в атмосферу и конденсируются, а затем выпадают на землю в виде дождя и снега. Без такого круговорота воды наша планета давно превратилась бы в пустыню.
Пар имеет множество применений. С одними мы хорошо знакомы, о других только слышали. Среди наиболее известных устройств и механизмов, работающих с применением пара, – утюги, паровозы, пароходы, паровые котлы. Пар вращает турбины генераторов на тепловых электростанциях. См. также КОТЕЛ ПАРОВОЙ; ДВИГАТЕЛЬ ТЕПЛОВОЙ; ТЕПЛОТА; ТЕРМОДИНАМИКА.
www.krugosvet.ru
это вода. Опыты которые интересно провести самому

Существует много опытов, в основе которых находится вода. Очень интересными опытами считаются опыты с кипящей водой, когда образуется пар. С помощью пара и сосуда вытесняется воздушная масса, а как только происходит охлаждение и пар конденсируется, в емкости резко понижается температурный режим и в атмосферном давлении происходят настоящие чудеса. Опыты, в которых участвует вода, интересны не только детям, но и взрослым. Интересны эти опыты и любителям физики и всем увлекающимся экспериментальными работами. Кипением называется явление, когда жидкость образует пар с образованием пузырьков. Пузырьки всплывают на поверхность, а вверх поднимается туман.
Советы на все случаи жизни
В опытах наблюдаются быстрые протекания физически явлений и очень хорошо, если для наглядного примера остальным, чтобы не показывать опыт вы его снимите на видео. Этот факт буден интересен и вам для анализа, который можно будет провести, пересмотрев опыты. Для того чтобы провести опыты, необходимо обзавестись специальным оборудованием. Первый рассматриваемый опыт лучше всего проводить под присмотром руководителя, остальные опыты можно проводить и самостоятельно. В любом случае обязательно соблюдается осторожность и аккуратность. Если воздух из сосуда убран, то атмосферное давление, которое давит на стенку сосуда, составляет 10 ньютонов на 1 см 2. Эта цифра эквивалентна массе в один килограмм. Внутри сосуда остается водяной пар, который в обычных условия имеет давление 30 мм ртутного столба. Это более чем в 20 раз меньше давления атмосферы. Если же при вытеснении паром в сосуде остается воздух, то давления хватит для проведения следующих опытов.
Опыты с использованием колбы
 Берется сосуд, имеющий плоское дно, это может быть коническая или круглая колба, достаточно объема от 0.3-0.5 литра. Наливаем в эту колбу 50 мл воды. Используем огнеупорную колбу, ее легко узнать по матовому оттенку. Закройте горлышко пробкой из резины с выходной стеклянной трубочкой, на которую нужно надеть полуметровый шланг. Колбу ставят на плитку, в сосуд, который ставится рядом, опускается трубочка. В нем должна быть вода в количестве 300 мл, подкрасьте ее. Примерно на 1 см шланг не должен касаться дна второго сосуда. Вода нагревается и доводится до кипения за 3 минуты и чуть-чуть кипит. Вода будет кипеть, а во второй сосуд будет поступать большое количество пузырьков. Как только пузырьки перестанут идти, возьмите тряпку и вместо плиты поставьте подставку одинаковой высотой с плитой. Можно просто поменять плиту горячую на холодную. Вскоре начнет происходить остывание воздуха, а водяной пар начнет превращаться в конденсат. Давление будет ниже атмосферного давления, вода будет стекать в колбу. Как только ускорится конденсирование, колба заполнится водой. Опыт показывает, что кипение воды образует пар, который начинает вытеснять воздух.
Берется сосуд, имеющий плоское дно, это может быть коническая или круглая колба, достаточно объема от 0.3-0.5 литра. Наливаем в эту колбу 50 мл воды. Используем огнеупорную колбу, ее легко узнать по матовому оттенку. Закройте горлышко пробкой из резины с выходной стеклянной трубочкой, на которую нужно надеть полуметровый шланг. Колбу ставят на плитку, в сосуд, который ставится рядом, опускается трубочка. В нем должна быть вода в количестве 300 мл, подкрасьте ее. Примерно на 1 см шланг не должен касаться дна второго сосуда. Вода нагревается и доводится до кипения за 3 минуты и чуть-чуть кипит. Вода будет кипеть, а во второй сосуд будет поступать большое количество пузырьков. Как только пузырьки перестанут идти, возьмите тряпку и вместо плиты поставьте подставку одинаковой высотой с плитой. Можно просто поменять плиту горячую на холодную. Вскоре начнет происходить остывание воздуха, а водяной пар начнет превращаться в конденсат. Давление будет ниже атмосферного давления, вода будет стекать в колбу. Как только ускорится конденсирование, колба заполнится водой. Опыт показывает, что кипение воды образует пар, который начинает вытеснять воздух.
Пар это вода опыты с использованием алюминиевой банки из-под спрайта
Возьмем пустую алюминиевую банку из-под любого напитка или аналогичную банку. Не открываем банку, а прокалываем с помощью шила две дырочки на расстоянии друг от друга и выливаем жидкость, дырочки не должны быть более 3 мм. Наливаем в банку немного воды, облегчит задачу использование шприца. Возьмите две спички застрогайте и, чтобы они плотно закрывали отверстия. Через отверстие в открывашке банке проденьте нитку или проволоку. На руку оденьте перчатку, чтобы не обжечься, возьмите банку за привязанную ниточку. Поднимите банку и начните нагревать ее до того момента, пока не закипит вода. Кипение вызовет туман, который будет сопровождаться капельками воды. Быстро поставьте банку и заткните отверстия, банку поместите в сосуд, где холодная вода. Туман из банки быстро будет конденсироваться и банка сомнется. Силу вычислить просто измеряется диаметр т высота, получается площадь и вычисляется действующая при этом сила. Этот опыт очень нравится начинающим физикам.
Опыты с кастрюлями
Не все опыты можно провести в одиночку, например в данном случае понадобится от 2-4 человек. Следует взять кастрюлю примерно с диаметром в 15 см. Беспокоиться не стоит, прочитав предыдущий опыт, так как эмалированную кастрюлю раздавить с помощью атмосферного давления не получится. Привяжите веревку к ручкам и к крышке кастрюли. Сделайте тесто и этим тестом намажьте стенки крышки, соприкасающейся с краем кастрюли. Можно использовать замазку, пластилин или что-то другое, но тесто конечно самое простое решение, отмыть будет легко. На дно кастрюли в 1 см налейте воды и поставьте на огонь для кипения с открытой крышкой, огонь должен быть хорошим, чтобы водяной пар выдавил воздушные массы и выдал туман. Как только горелку вы выключите, сразу плотно прижимайте крышку к кастрюле. Для охлаждения налейте воды в раковину и поставьте остужаться туда кастрюлю. Потрогайте кастрюлю, если она остыла, не прилагайте большого усилия и попытайтесь приоткрыть крышку. Если крышка не открывается, то продолжаем, если открывается, то начинаем заново. Подобный опыт проводился великим ученым Отто Герике в 1654 году, этот опыт изучается в седьмом классе. Внимание, если атмосферное давление больше, то может оторваться ручка от кастрюли. Для этого опыта не берите мамину любимую кастрюлю. Растяните веревки с двух сторон и начинайте тянуть, пытаясь открыть крышку. Сила давления вычисляется следующим образом F=pS, так что если крышка в диаметре 20 см, соответственно крышка примерно 300 см квадратных, а значит, крышка прижимается на 3000 Н.
Опыты кастрюля и стекло
Возьмите кастрюлю с диаметром в 20 см. Из обычного стекла вырезается квадрат и точно такой же квадрат из картона. Необходимо перевернуть кастрюлю и поставить ее на квадрат из бумаги, провести обводку карандашом. Стекло нужно намазать клеем, абсолютно любым. Бумагу прижимаем к стеклу таким образом, чтобы сквозь него было видно окружность сделанную карандашом. Чтобы сделать герметичную поверхность соединения нанесите замазку. Наливаем в кастрюлю воду в 1 см и начинаем ее кипятить, пока не появится водяной пар или как его еще называют туман. Кастрюлю, как закипит вода, быстро снимите с горелки и прикройте стеклом, чтобы замазка по всему периметру прилипла к крышке. Наливаем в тазик холодную воду и туда ставим кастрюлю, ожидаем, пока вода остынет. Пар начнет конденсироваться уже после первой минуты остывания, так называемый туман, исчезнет. Давление внутри уменьшается по сравнению с атмосферным и просто выдавливает стекло. Все провалится вовнутрь кастрюли.
Самым первым тепловым двигателем, который стали применять на практике стал пароатмосферный двигатель. При закипании воды образуется туман или пар, он поступает в цилиндр, благодаря этому поднимается поршень не в один десяток дециметров квадратных. После в цилиндр добавляли воду, туман прекращался в конденсат и поршень опускался при помощи рычага.
Над промышленными предприятиями зачастую можно увидеть явление конденсации водяного пара и туман. Облака и тучи тоже представляют собой такие явления как парообразование и конденсацию водяного пара. Возьмите две ватки, одну смочите в холодной воде, а другую в горячей, одинаково и отожмите и проведите по стеклу с матовым отблеском. Посмотрите на стекло, площадь следа начинает уменьшаться, причем от горячей воды быстрее, чем от холодной. Если схематически отобразить насыщенный пар, то испарение это то, что движется вверх, а конденсация, это то, что опускается вниз. Динамическое равновесие же представляет насыщенный пар.
Еще одним интересным опытом является следующее: Поставим колбу на огонь и доведем ее до кипения, затем плотно прикроем крышкой и дадим немного остыть, переворачиваем колбу и сверху польем постепенно холодную воду. Вода в колбе начнет кипеть, хоть и ее температура не будет превышать 100 градусов Цельсия.
Холодный воздух и теплый воздух содержит разное количество водяного пара, в холод окно потеет внутри помещения. Если посмотреть на небо когда летит самолет, вы увидите белый след – это своего рода тоже конденсация воды. То же самое с зеркальцем, если на него дыхнуть зеркало запотеет, стоит его оставить остывать, оно начнет принимать свою постоянную форму и все исчезнет. Наблюдать за опытами с водой и паром интересно, а говорить о ни можно бесконечно, поэтому каждый должен попробовать выполнить какой-то интересный для себя опыт или понаблюдать за определенным явлением.
Вконтакте
Google+
voday.ru
Вода, лёд и пар - Helperia

Вода, лёд и пар, соответственно жидкое, твердое и газообразное состояния химического соединения молекулярной формулы Н2О.
Идея древних философов о том, что все в природе образуют четыре элемента (стихии): земля, воздух, огонь и вода, просуществовала вплоть до Средних веков. В 1781 Г.Кавендиш сообщил о получении им воды при сжигании водорода, но не оценил в полной мере важности своего открытия. Позже (1783) А.Лавуазье доказал, что вода вовсе не элемент, а соединение водорода и кислорода. Й.Берцелиус и П.Дюлонг (1819), а также Ж.Дюма и Ж.Стас (1842) установили весовой состав воды, пропуская водород через оксид меди, взятый в строго определенном количестве, и взвешивая образовавшиеся медь и воду.
Исходя из этих данных, они определили отношение Н:О для воды. Кроме того, в 1820-х годах Ж.Гей-Люссак измерил объемы газообразных водорода и кислорода, которые при взаимодействии давали воду: они соотносились между собой как 2:1, что, как мы теперь знаем, отвечает формуле Н2О.
Распространенность
Вода покрывает 3/4 поверхности Земли. Тело человека состоит из воды примерно на 70%, яйцо – на 74%, а некоторые овощи – это почти одна вода. Так, в арбузе ее 92%, в спелых томатах – 95%.
Вода в природных резервуарах никогда не бывает однородной по составу: она проходит через горные породы, соприкасается с почвой и воздухом, а потому содержит растворенные газы и минеральные вещества. Более чистой является дистиллированная вода.
Морская вода
Состав морской воды различается в разных регионах и зависит от притока пресных вод, скорости испарения, количества осадков, таяния айсбергов и т.д.
Минеральная вода
Минеральная вода образуется при просачивании обычной воды сквозь породы, содержащие соединения железа, лития, серы и других элементов.
Мягкая и жесткая вода
Жесткая вода содержит в больших количествах соли кальция и магния. Они растворяются в воде при протекании по породам, сложенным гипсом (СaSO4), известняком (СаСО3) или доломитом (карбонаты Mg и Са). В мягкой воде этих солей мало. Если вода содержит сульфат кальция, то говорят, что она обладает постоянной (некарбонатной) жесткостью. Ее можно умягчить добавлением карбоната натрия; это приведет к осаждению кальция в виде карбоната, а в растворе останется сульфат натрия. Соли натрия не вступают в реакцию с мылом, и расход его будет меньше, чем в присутствии солей кальция и магния.
Вода, обладающая временной (карбонатной) жесткостью, содержит бикарбонаты кальция и магния; ее можно умягчить несколькими способами:
- нагреванием, приводящим к разложению бикарбонатов на нерастворимые карбонаты;
- добавлением известковой воды (гидроксида кальция), в результате чего бикарбонаты превращаются в нерастворимые карбонаты;
- с помощью обменных реакций.
Вода, содержащая в большом количестве растворенный диоксид углерода, просачиваясь через известняковые породы, растворяет их, что приводит к образованию пещер. При повышении температуры начинается обратный процесс: бикарбонат разлагается и вновь образуется известняк. Именно из него состоят сталактиты и сталагмиты.
Молекулярная структура
Анализ данных, полученных из спектров поглощения, показал, что три атома в молекуле воды образуют равнобедренный треугольник с двумя атомами водорода в основании и кислородом в вершине:
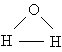
Валентный угол НОН равен 104,31°, длина связи О–Н составляет 0,99 Å (1 Å = 10–8 см), а расстояние Н–Н равно 1,515 Å. Атомы водорода так глубоко «внедрены» в атом кислорода, что молекула оказывается почти сферической; ее радиус – 1,38 Å.
Физические свойства
Благодаря сильному притяжению между молекулами у воды высокие температуры плавления (0° С) и кипения (100° С). Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей. Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Чистая вода – плохой проводник электричества, ее удельная электропроводность равна 1,5•10–8 Ом– 1•см–1 при 0° С. Сжимаемость воды очень мала: 43•10–6 см3 на мегабар при 20° С. Плотность воды максимальна при 4° С; это объясняется свойствами водородных связей ее молекул.
Давление паров
Если оставить воду в открытой емкости, то она постепенно испарится – все ее молекулы перейдут в воздух. В то же время вода, находящаяся в плотно закупоренном сосуде, испаряется лишь частично, т.е. при определенном давлении водяных паров между водой и воздухом, находящимся над ней, устанавливается равновесие. Давление паров в равновесии зависит от температуры и называется давлением насыщенного пара (или его упругостью). Когда давление насыщенного пара сравнивается с внешним давлением, вода закипает. При обычном давлении 760 мм рт.ст. вода кипит при 100° С, а на высоте 2900 м над уровнем моря атмосферное давление падает до 525 мм рт.ст. и температура кипения оказывается равной 90° С.
Испарение происходит даже с поверхности снега и льда, именно поэтому высыхает на морозе мокрое белье.
Вязкость воды с ростом температуры быстро уменьшается и при 100° С оказывается в 8 раз меньше, чем при 0° С.
Химические свойства
Каталитическое действие
Очень многие химические реакции протекают только в присутствии воды. Так, окисление кислородом не происходит в сухих газах, металлы не реагируют с хлором и т.д.
Гидраты
Многие соединения всегда содержат определенное число молекул воды и называются поэтому гидратами. Природа образующихся при этом связей может быть разной. Например, в пентагидрате сульфата меди, или медном купоросе CuSO4•5h3O, четыре молекулы воды образуют координационные связи с ионом сульфата, разрушающиеся при 125° С; пятая же молекула воды связана так прочно, что отрывается лишь при температуре 250° С. Еще один стабильный гидрат – серная кислота; она существует в двух гидратных формах, SO3•h3O и SO2(OH)2, между которыми устанавливается равновесие. Ионы в водных растворах тоже часто бывают гидратированы. Так, Н всегда находится в виде иона гидроксония Н3О или Н5О2 ; ион лития – в виде Li (h3O)6 и т.д. Элементы как таковые редко находятся в гидратированной форме.
Исключение составляют бром и хлор, которые образуют гидраты Br2•10 h3O и Cl2•6h3О. Некоторые обычные гидраты содержат кристаллизационную воду, например хлорид бария BaCl2•2h3O, английская соль (сульфат магния) MgSO4•7h3O, питьевая сода (карбонат натрия) Na2CO3•10 h3O, глауберова соль (сульфат натрия) Na2SO4•10 h3O. Соли могут образовывать несколько гидратов; так, сульфат меди существует в виде CuSO4•5h3O, CuSO4•3h3O и CuSO4•h3O. Если давление насыщенного пара гидрата больше, чем атмосферное давление, то соль будет терять воду. Этот процесс называется выцветанием (выветриванием). Процесс, при котором соль поглощает воду, называется расплыванием.
Гидролиз
Гидролиз – это реакция двойного разложения, в которой одним из реагентов является вода; трихлорид фосфора PCl3 легко вступает в реакцию с водой:
PCl3 3h3O = P (OH)3 3HCl
Аналогичным образом гидролизуются жиры с образованием жирных кислот и глицерина.
Сольватация
Вода – полярное соединение, а потому охотно вступает в электростатическое взаимодействие с частицами (ионами или молекулами) растворенных в ней веществ. Образовавшиеся в результате сольватации молекулярные группы называются сольватами. Слой молекул воды, связанный с центральной частицей сольвата силами притяжения, составляет сольватную оболочку. Впервые понятие сольватации было введено в 1891 И.А.Каблуковым.
В 1931 Г.Юри показал, что при испарении жидкого водорода его последние фракции оказываются тяжелее обычного водорода вследствие содержания в них в два раза более тяжелого изотопа. Этот изотоп называется дейтерием и обозначается символом D. По своим свойствам вода, содержащая вместо обычного водорода его тяжелый изотоп, существенно отличается от обычной воды.
В природе на каждые 5000 массовых частей Н2О приходится одна часть D2O. Это соотношение одинаково для речной, дождевой, болотной воды, подземных вод или кристаллизационной воды. Тяжелая вода используется в качестве метки при исследовании физиологических процессов. Так, в моче человека соотношение между Н и D тоже равно 5000:1. Если дать пациенту выпить воду с большим содержанием D2O, то, последовательно измеряя долю этой воды в моче, можно определить скорость выведения воды из организма. Оказалось, что около половины выпитой воды остается в организме даже спустя 15 сут. Тяжелая вода, вернее, входящий в ее состав дейтерий – важный участник реакций ядерного синтеза.
Третий изотоп водорода – тритий, обозначаемый символом Т. В отличие от первых двух он радиоактивен и обнаружен в природе лишь в малых количествах. В пресноводных озерах соотношение между ним и обычным водородом равно 1:1018, в поверхностных водах – 1:1019, в глубинных водах он отсутствует.
Лед, твердая фаза воды, используется в основном как хладагент. Он может находиться в равновесии с жидкой и газообразной фазами или только с газообразной фазой. Толстый слой льда имеет голубоватый цвет, что связано с особенностями преломления им света. Сжимаемость льда очень низка.
Лед при нормальном давлении существует только при температуре 0° С или ниже и обладает меньшей плотностью, чем холодная вода. Именно поэтому айсберги плавают в воде. При этом, поскольку отношение плотностей льда и воды при 0° С постоянно, лед всегда выступает из воды на определенную часть, а именно на 1/5 своего объема.
Пар – газообразная фаза воды. Вопреки общепринятому мнению, он невидим. Тот «пар», который вырывается из кипящего чайника, – это на самом деле множество мельчайших капелек воды. Пар обладает свойствами, очень важными для поддержания жизни на Земле. Хорошо известно, например, что под действием солнечного тепла вода с поверхности морей и океанов испаряется. Образующиеся водяные пары поднимаются в атмосферу и конденсируются, а затем выпадают на землю в виде дождя и снега. Без такого круговорота воды наша планета давно превратилась бы в пустыню.
Пар имеет множество применений. С одними мы хорошо знакомы, о других только слышали. Среди наиболее известных устройств и механизмов, работающих с применением пара, – утюги, паровозы, пароходы, паровые котлы. Пар вращает турбины генераторов на тепловых электростанциях.
Правило фаз
Литература
Эйзенберг Д., Кауцман В. Структура и свойства воды. Л., 1975
Зацепина Г.Н. Физические свойства и структура воды. М., 1987
helperia.ru
ВОДА, ЛЕД И ПАР - это... Что такое ВОДА, ЛЕД И ПАР?
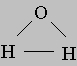 Валентный угол НОН равен 104,31°, длина связи О-Н составляет 0,99 (1 = 10-8 см), а расстояние Н-Н равно 1,515 . Атомы водорода так глубоко "внедрены" в атом кислорода, что молекула оказывается почти сферической; ее радиус - 1,38 .ВОДАФизические свойства. Благодаря сильному притяжению между молекулами у воды высокие температуры плавления (0° С) и кипения (100° С). Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей. Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Чистая вода - плохой проводник электричества, ее удельная электропроводность равна 1,5Ч10-8 Ом-1Чсм-1 при 0° С. Сжимаемость воды очень мала: 43Ч10-6 см3 на мегабар при 20° С. Плотность воды максимальна при 4° С; это объясняется свойствами водородных связей ее молекул.Давление паров. Если оставить воду в открытой емкости, то она постепенно испарится - все ее молекулы перейдут в воздух. В то же время вода, находящаяся в плотно закупоренном сосуде, испаряется лишь частично, т.е. при определенном давлении водяных паров между водой и воздухом, находящимся над ней, устанавливается равновесие. Давление паров в равновесии зависит от температуры и называется давлением насыщенного пара (или его упругостью). Когда давление насыщенного пара сравнивается с внешним давлением, вода закипает. При обычном давлении 760 мм рт.ст. вода кипит при 100° С, а на высоте 2900 м над уровнем моря атмосферное давление падает до 525 мм рт.ст. и температура кипения оказывается равной 90° С. Испарение происходит даже с поверхности снега и льда, именно поэтому высыхает на морозе мокрое белье. Вязкость воды с ростом температуры быстро уменьшается и при 100° С оказывается в 8 раз меньше, чем при 0° С.Химические свойства. Каталитическое действие. Очень многие химические реакции протекают только в присутствии воды. Так, окисление кислородом не происходит в сухих газах, металлы не реагируют с хлором и т.д.Гидраты. Многие соединения всегда содержат определенное число молекул воды и называются поэтому гидратами. Природа образующихся при этом связей может быть разной. Например, в пентагидрате сульфата меди, или медном купоросе CuSO4*5h3O, четыре молекулы воды образуют координационные связи с ионом сульфата, разрушающиеся при 125° С; пятая же молекула воды связана так прочно, что отрывается лишь при температуре 250° С. Еще один стабильный гидрат - серная кислота; она существует в двух гидратных формах, SO3*h3O и SO2(OH)2, между которыми устанавливается равновесие. Ионы в водных растворах тоже часто бывают гидратированы. Так, Н+ всегда находится в виде иона гидроксония Н3О+ или Н5О2+; ион лития - в виде Li (h3O)6+ и т.д. Элементы как таковые редко находятся в гидратированной форме. Исключение составляют бром и хлор, которые образуют гидраты Br2*10h3O и Cl2*6h3О. Некоторые обычные гидраты содержат кристаллизационную воду, например хлорид бария BaCl2*2h3O, английская соль (сульфат магния) MgSO4*7h3O, питьевая сода (карбонат натрия) Na2CO3*10h3O, глауберова соль (сульфат натрия) Na2SO4*10h3O. Соли могут образовывать несколько гидратов; так, сульфат меди существует в виде CuSO4*5h3O, CuSO4*3h3O и CuSO4*h3O. Если давление насыщенного пара гидрата больше, чем атмосферное давление, то соль будет терять воду. Этот процесс называется выцветанием (выветриванием). Процесс, при котором соль поглощает воду, называется расплыванием.Гидролиз. Гидролиз - это реакция двойного разложения, в которой одним из реагентов является вода; трихлорид фосфора PCl3 легко вступает в реакцию с водой: PCl3 + 3h3O = P (OH)3 + 3HCl Аналогичным образом гидролизуются жиры с образованием жирных кислот и глицерина.Сольватация. Вода - полярное соединение, а потому охотно вступает в электростатическое взаимодействие с частицами (ионами или молекулами) растворенных в ней веществ. Образовавшиеся в результате сольватации молекулярные группы называются сольватами. Слой молекул воды, связанный с центральной частицей сольвата силами притяжения, составляет сольватную оболочку. Впервые понятие сольватации было введено в 1891 И. А. Каблуковым.Тяжелая вода. В 1931 Г. Юри показал, что при испарении жидкого водорода его последние фракции оказываются тяжелее обычного водорода вследствие содержания в них в два раза более тяжелого изотопа. Этот изотоп называется дейтерием и обозначается символом D. По своим свойствам вода, содержащая вместо обычного водорода его тяжелый изотоп, существенно отличается от обычной воды. В природе на каждые 5000 массовых частей Н2О приходится одна часть D2O. Это соотношение одинаково для речной, дождевой, болотной воды, подземных вод или кристаллизационной воды. Тяжелая вода используется в качестве метки при исследовании физиологических процессов. Так, в моче человека соотношение между Н и D тоже равно 5000:1. Если дать пациенту выпить воду с большим содержанием D2O, то, последовательно измеряя долю этой воды в моче, можно определить скорость выведения воды из организма. Оказалось, что около половины выпитой воды остается в организме даже спустя 15 сут. Тяжелая вода, вернее, входящий в ее состав дейтерий - важный участник реакций ядерного синтеза. Третий изотоп водорода - тритий, обозначаемый символом Т. В отличие от первых двух он радиоактивен и обнаружен в природе лишь в малых количествах. В пресноводных озерах соотношение между ним и обычным водородом равно 1:1018, в поверхностных водах - 1:1019, в глубинных водах он отсутствует. См. также ВОДОРОД.ЛЕД Лед, твердая фаза воды, используется в основном как хладагент. Он может находиться в равновесии с жидкой и газообразной фазами или только с газообразной фазой. Толстый слой льда имеет голубоватый цвет, что связано с особенностями преломления им света. Сжимаемость льда очень низка. Лед при нормальном давлении существует только при температуре 0° С или ниже и обладает меньшей плотностью, чем холодная вода. Именно поэтому айсберги плавают в воде. При этом, поскольку отношение плотностей льда и воды при 0° С постоянно, лед всегда выступает из воды на определенную часть, а именно на 1/5 своего объема.См. также АЙСБЕРГ.ПАР Пар - газообразная фаза воды. Вопреки общепринятому мнению, он невидим. Тот "пар", который вырывается из кипящего чайника, - это на самом деле множество мельчайших капелек воды. Пар обладает свойствами, очень важными для поддержания жизни на Земле. Хорошо известно, например, что под действием солнечного тепла вода с поверхности морей и океанов испаряется. Образующиеся водяные пары поднимаются в атмосферу и конденсируются, а затем выпадают на землю в виде дождя и снега. Без такого круговорота воды наша планета давно превратилась бы в пустыню. Пар имеет множество применений. С одними мы хорошо знакомы, о других только слышали. Среди наиболее известных устройств и механизмов, работающих с применением пара, - утюги, паровозы, пароходы, паровые котлы. Пар вращает турбины генераторов на тепловых электростанциях.См. такжеКОТЕЛ ПАРОВОЙ;ДВИГАТЕЛЬ ТЕПЛОВОЙ;ТЕПЛОТА;ТЕРМОДИНАМИКА.ЛИТЕРАТУРА Эйзенберг Д., Кауцман В. Структура и свойства воды. Л., 1975 Зацепина Г.Н. Физические свойства и структура воды. М., 1987
Валентный угол НОН равен 104,31°, длина связи О-Н составляет 0,99 (1 = 10-8 см), а расстояние Н-Н равно 1,515 . Атомы водорода так глубоко "внедрены" в атом кислорода, что молекула оказывается почти сферической; ее радиус - 1,38 .ВОДАФизические свойства. Благодаря сильному притяжению между молекулами у воды высокие температуры плавления (0° С) и кипения (100° С). Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей. Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Чистая вода - плохой проводник электричества, ее удельная электропроводность равна 1,5Ч10-8 Ом-1Чсм-1 при 0° С. Сжимаемость воды очень мала: 43Ч10-6 см3 на мегабар при 20° С. Плотность воды максимальна при 4° С; это объясняется свойствами водородных связей ее молекул.Давление паров. Если оставить воду в открытой емкости, то она постепенно испарится - все ее молекулы перейдут в воздух. В то же время вода, находящаяся в плотно закупоренном сосуде, испаряется лишь частично, т.е. при определенном давлении водяных паров между водой и воздухом, находящимся над ней, устанавливается равновесие. Давление паров в равновесии зависит от температуры и называется давлением насыщенного пара (или его упругостью). Когда давление насыщенного пара сравнивается с внешним давлением, вода закипает. При обычном давлении 760 мм рт.ст. вода кипит при 100° С, а на высоте 2900 м над уровнем моря атмосферное давление падает до 525 мм рт.ст. и температура кипения оказывается равной 90° С. Испарение происходит даже с поверхности снега и льда, именно поэтому высыхает на морозе мокрое белье. Вязкость воды с ростом температуры быстро уменьшается и при 100° С оказывается в 8 раз меньше, чем при 0° С.Химические свойства. Каталитическое действие. Очень многие химические реакции протекают только в присутствии воды. Так, окисление кислородом не происходит в сухих газах, металлы не реагируют с хлором и т.д.Гидраты. Многие соединения всегда содержат определенное число молекул воды и называются поэтому гидратами. Природа образующихся при этом связей может быть разной. Например, в пентагидрате сульфата меди, или медном купоросе CuSO4*5h3O, четыре молекулы воды образуют координационные связи с ионом сульфата, разрушающиеся при 125° С; пятая же молекула воды связана так прочно, что отрывается лишь при температуре 250° С. Еще один стабильный гидрат - серная кислота; она существует в двух гидратных формах, SO3*h3O и SO2(OH)2, между которыми устанавливается равновесие. Ионы в водных растворах тоже часто бывают гидратированы. Так, Н+ всегда находится в виде иона гидроксония Н3О+ или Н5О2+; ион лития - в виде Li (h3O)6+ и т.д. Элементы как таковые редко находятся в гидратированной форме. Исключение составляют бром и хлор, которые образуют гидраты Br2*10h3O и Cl2*6h3О. Некоторые обычные гидраты содержат кристаллизационную воду, например хлорид бария BaCl2*2h3O, английская соль (сульфат магния) MgSO4*7h3O, питьевая сода (карбонат натрия) Na2CO3*10h3O, глауберова соль (сульфат натрия) Na2SO4*10h3O. Соли могут образовывать несколько гидратов; так, сульфат меди существует в виде CuSO4*5h3O, CuSO4*3h3O и CuSO4*h3O. Если давление насыщенного пара гидрата больше, чем атмосферное давление, то соль будет терять воду. Этот процесс называется выцветанием (выветриванием). Процесс, при котором соль поглощает воду, называется расплыванием.Гидролиз. Гидролиз - это реакция двойного разложения, в которой одним из реагентов является вода; трихлорид фосфора PCl3 легко вступает в реакцию с водой: PCl3 + 3h3O = P (OH)3 + 3HCl Аналогичным образом гидролизуются жиры с образованием жирных кислот и глицерина.Сольватация. Вода - полярное соединение, а потому охотно вступает в электростатическое взаимодействие с частицами (ионами или молекулами) растворенных в ней веществ. Образовавшиеся в результате сольватации молекулярные группы называются сольватами. Слой молекул воды, связанный с центральной частицей сольвата силами притяжения, составляет сольватную оболочку. Впервые понятие сольватации было введено в 1891 И. А. Каблуковым.Тяжелая вода. В 1931 Г. Юри показал, что при испарении жидкого водорода его последние фракции оказываются тяжелее обычного водорода вследствие содержания в них в два раза более тяжелого изотопа. Этот изотоп называется дейтерием и обозначается символом D. По своим свойствам вода, содержащая вместо обычного водорода его тяжелый изотоп, существенно отличается от обычной воды. В природе на каждые 5000 массовых частей Н2О приходится одна часть D2O. Это соотношение одинаково для речной, дождевой, болотной воды, подземных вод или кристаллизационной воды. Тяжелая вода используется в качестве метки при исследовании физиологических процессов. Так, в моче человека соотношение между Н и D тоже равно 5000:1. Если дать пациенту выпить воду с большим содержанием D2O, то, последовательно измеряя долю этой воды в моче, можно определить скорость выведения воды из организма. Оказалось, что около половины выпитой воды остается в организме даже спустя 15 сут. Тяжелая вода, вернее, входящий в ее состав дейтерий - важный участник реакций ядерного синтеза. Третий изотоп водорода - тритий, обозначаемый символом Т. В отличие от первых двух он радиоактивен и обнаружен в природе лишь в малых количествах. В пресноводных озерах соотношение между ним и обычным водородом равно 1:1018, в поверхностных водах - 1:1019, в глубинных водах он отсутствует. См. также ВОДОРОД.ЛЕД Лед, твердая фаза воды, используется в основном как хладагент. Он может находиться в равновесии с жидкой и газообразной фазами или только с газообразной фазой. Толстый слой льда имеет голубоватый цвет, что связано с особенностями преломления им света. Сжимаемость льда очень низка. Лед при нормальном давлении существует только при температуре 0° С или ниже и обладает меньшей плотностью, чем холодная вода. Именно поэтому айсберги плавают в воде. При этом, поскольку отношение плотностей льда и воды при 0° С постоянно, лед всегда выступает из воды на определенную часть, а именно на 1/5 своего объема.См. также АЙСБЕРГ.ПАР Пар - газообразная фаза воды. Вопреки общепринятому мнению, он невидим. Тот "пар", который вырывается из кипящего чайника, - это на самом деле множество мельчайших капелек воды. Пар обладает свойствами, очень важными для поддержания жизни на Земле. Хорошо известно, например, что под действием солнечного тепла вода с поверхности морей и океанов испаряется. Образующиеся водяные пары поднимаются в атмосферу и конденсируются, а затем выпадают на землю в виде дождя и снега. Без такого круговорота воды наша планета давно превратилась бы в пустыню. Пар имеет множество применений. С одними мы хорошо знакомы, о других только слышали. Среди наиболее известных устройств и механизмов, работающих с применением пара, - утюги, паровозы, пароходы, паровые котлы. Пар вращает турбины генераторов на тепловых электростанциях.См. такжеКОТЕЛ ПАРОВОЙ;ДВИГАТЕЛЬ ТЕПЛОВОЙ;ТЕПЛОТА;ТЕРМОДИНАМИКА.ЛИТЕРАТУРА Эйзенберг Д., Кауцман В. Структура и свойства воды. Л., 1975 Зацепина Г.Н. Физические свойства и структура воды. М., 1987 Энциклопедия Кольера. — Открытое общество. 2000.
dic.academic.ru



















