Справочник химика 21. Вода кристаллизированная
Вода кристаллизованная - Справочник химика 21
Раствор, содержащий 0,53 г карбоната натрия в 200 г воды, кристаллизуется при —0,13°С. Вычислить кажущуюся степень диссоциации соли. [c.131]Пример 5, Раствор, содержащий 0,85 г хлорида цинка в 125 г воды, кристаллизуется при - 0,2 3 С. Определить кажущуюся степень диссоциации Zrt tj . [c.56]
Хлорид кальция обладает большой растворимостью в воде и резко изменяет температуру ее кипения и кристаллизации раствор, содержащий 305 г соли в 100 г воды, кипит при 178° С, а содержащий 42,5 г соли в 100 г воды, кристаллизуется при —54,9° С (криогидратная точка). Последним раствором пользуются в холодильных установках. [c.50]
Регенерация растворителя из раствора гача (петролатума) производится в три ступени сначала в двух отгонных К-1а и К-2а, затем в отпарной колонне К-За. Тепло для испарения паров растворителя из раствора гача подводится пароподогревателями Т-4, Т-5а и Т-1Эа. С верха колонн К-1а и К-2а отходят пары не сухого, а влажного растворителя, поскольку содержаш,аяся в растворе сырья вода кристаллизуется в процессе охлаждения и при фильтровании остается в лепешке гача. [c.263]Пример 7. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при - 0,297°С. Вычислите мольную массу глицерина. [c.58]
Без воды кристаллизуются сульфаты К, РЬ, Сз, Ад, Н , Т1, Зг, Ва, На, РЬ, ЗЬ, В1, а соли остальных металлов выделяются обычно в виде кристаллогидратов того или иного состава. При этом для ряда двухвалентных катионов (Мд, V, Сг, Мп, Ре, Со, N1, 2п) [c.487]
Соли кислородсодержащих кислот и комплексные соединения. Сульфаты элементов подгруппы галлия бесцветны и легко растворяются в воде. Кристаллизуются из растворов с различным содержанием молекул воды. С сульфатами металлов в степени окисления +1 сульфат галлия и сульфат индия образуют квасцы. Бесцветные нитраты Ga(-f-3), 1п(-ЬЗ) и Т1(+3) также выделяются из воды в виде кристаллогидратов. Все это свидетельствует об определенной комплексообразовательной способности элементов подгруппы галлия. [c.343]
Продукт легко растворим в ледяной уксусной кислоте, спирте, горячей воде, кристаллизуется в виде бесцветных игл ст. пл. 87°. [c.391]
АМИНОТОЛУОЛ-2-СУЛЬФОКИСЛОТА, крист, (из воды кристаллизуется моногидрат) растворяется в воде, не раств. в СП., эф, Получ. восст, 4-нитротолуол- [c.40]
А М И Н ОТО Л У О Л-З-СУЛ ЬФОКИСЛОТА, светло-желтые крист, (из воды кристаллизуется полугидрат) it,л 132 С [c.40]
Фолиевая кислота из воды кристаллизуется в виде желтых листочков. При нагревании кристаллы не плавятся, но темнеют и при температуре 250° С обугливаются [13]. Растворимость в воде при 0° — 1 jua/lOO мл при температуре 100° С—50 мг/ЮО мл [14]. Концентрированная соляная кислота легко растворяет фолиевую кислоту, которая при разбавлении водой почти полностью выделяется. Растворимость двунатриевой соли при температуре 100° С — 1,5 г/100 мл. Цинковые, свинцовые и серебряные соли фолиевой кислоты в воде нерастворимы [13, 14]. Соли щелочных металлов хорошо растворимы в воде, из растворов они могут быть осаждены спиртом. [c.214]
Вода кристаллизуется при 0°С, следовательно, температуры кристаллизации раствора О - 0,21 = -0,21°С. / [c.58]
Подобные растворы кристаллизуются при температуре, которая на определенное число градусов ниже температуры кристаллизации чистых растворителей. Это понижение температуры кристаллизации называется молярным понижением температуры кристаллизации данного растворителя или его криоскапической константой. Криоскопическая константа воды составляет 1,86° это значит, что растворы, содержащие по 1 молю любого неэлектролита на 1000 г воды, кристаллизуются при температуре — 1,86°С. [c.98]
Диэлектрическая проницаемость воды 78,3. Электропроводность Еолы чрезвычайно мала. Вода кристаллизуется в решетке молекулярного типа. [c.57]
Вода кипиг при 100 С, следовательно, температура киненм расгвора 100 +0,06 = 100,06 С вода кристаллизуется при 0°С, следовательно, температура кристаллизации раствора 0-0,21 = -0.21 °С. [c.37]
Рассмотрим сначала один из простых случаев — кристаллизация при отсутствии в системе кристаллогидратов,/Двойных или тройных солей и твердых растворов и при условии, что обе тройные точки являются конгруэнтными (рис. 5.66). Если начальный состав солевой массы ненасыщенного раствора характеризуется точкой т, то при изотермическом испарении воды положение этой точки на диаграмме не изменится, пока раствор не станет насыщенным солью СХ (точка т — в поле кристаллизации СХ). При дальнейшем испарении воды кристаллизуется соль СХ, и точка солевой массы раствора перемещается вдоль прямого луча кристаллизации СХ—т по отрезку тт . В точке щ раствор станет насыщенным двумя солями — СХ и ВХ, и при дальнейшем удалении воды кристаллизуются обе эти соли, а точка солевой массы раствора перемещается ио линии miEi, одновременно состав осадка изменяется вдоль отрезка СХ—s. Когда раствор окажется эвтоническим и точкой его солевой массы будет Еу, состав осадка изобразится точкой s, так как точка солевой массы системы т и точки солевых масс раствора El и осадка s всегда находятся на одной прямой. [c.183]
Ацетанилид (Н-фенилацетамид, антифебрин, Ы-ацетиланилин, фениламид уксусной кислоты) — бесцветное кристаллическое вещество без запаха. Из воды кристаллизуется в виде ромбических листочков. Растворяется в диэтиловом эфире, хлороформе, этиловом спирте (36,9 г в 100 мл), умеренно растворим в воде (0,56 г в 100 мл при 25°С и 3,5 г в 100 мл при 80°С). Т. п. 114°С. [c.170]
Слегка желтый 1,6-дииодгексан при охлаждении смесью льда с водой кристаллизуется в виде белых игл. Если прибавить к желтому препарату несколько капель ртути, то жидкость становится почти бесцветной. [c.167]
В,Ь-Винная к-та (виноградная к-та) из воды кристаллизуется в виде дигидрата 2HjO (т. пл. 73 °С), из спирта-в безводной форме (т. пл. 205"С) К, 1,02-10" , Кг 4,0-10 (25°С) р-римость дигидрата (г в 100 г р-рителя) в воде-20,6, этаноле-2,08 (15°С эфире-1,08. [c.375]
К. из растворов используют преим, для выделения ценных компонентов из р-ров, а также их концентрирования (см. Вымораживание) и очистки в-в от примесей, В-ва, р-римость к-рых сильно зависит от т-ры (иапр., KNO3 в воде), кристаллизуют охлаждением горячих р-ров, при этом исходное кол-во р-рителя, к-рый содержится в маточной жидкости, в системе ие изменяется (изогидрическая К,), В малотоннажных произ-вах применяют емкостные кристаллизаторы периодич, действия, снабженные охлаждаемыми рубашками. В таких аппаратах р-р охлаждают при [c.529]
ХРОМОТРОПОВАЯ КИСЛОТА (4,5-дигвдрокси-2,7-наф-таливдисульфокислота), мол. м. 320,3, бесцв. кристаллы хорошо раств. в воде (кристаллизуется с 2 молекулами Н2О). Динатриевая соль Х.к. (хромотроп) - реагент в аналит. химии, кристаллизуется в виде белых игл с [c.322]
Дифениловый эфир (фениловый эфир, феноксибензол, дифенилоксид) — бесцветное кристаллическое вещество с запахом герани (в насыщающих концентрациях запах может быть неприятным). Хорошо растворяется в бензоле и ледяной уксусной кислоте, растворяется в диэтиловом эфире, трудно растворим в воде Кристаллизуется из этилового спирта в виде бесцветных пластинок. Температура плавления 27—28°С, температура кипения 259°С 4° (ТВ.) — 1,148 [c.92]
В структурах кремнезема тетраэдрические группы 5104 соединены через общие атомы кислорода. Мы отмечали выше (рис. 3.32), что такими же топологическими возможностями обладают молекулы НаО, а также молекулы или ионы типа ОгМ(ОН)2. Имеется несколько форм кристаллической воды (т. е. льда). В добавление к формам, устойчивым только при высоком давлении, которые описаны в разд. 1.5.1, существуют две формы льда, стабильные при атмосферном давлении. Обычный лед (лед-1п) имеет структуру тридимита, но прп температуре, близкой к —130 °С, вода кристаллизуется со структурой кристобалита. Тридимитовая структура подобна сетке, изображенной на рис. 3.35, в, которая представляет собой структуру гексагонального алмаза здесь то же соотношение, что и между кристобалитом и кубической алмазной сеткой, показанной на рис. 3.35, а. Две структуры АХ, родственные сеткам на рис. 3.35, а и в, но с чередующимися атомами А и X — это структуры цинковой обманки и вюртцита, которые изображены на рис. 3.35,6 и г. Таким образом, и НгО, и 5102 кристаллизуются как в виде кубических, так и в виде гексагональных структур АХг [c.155]
К раствору добавляют этанол или ацетои, в результате осаждается соль, не содержащая кристаллизационной воды. Ее фильтруют с отсасыванием и промывают растворителем, взятым для высаживания. Для повышения выхода раствор перед началом кристаллизации можно упарить в вакууме. Однако из чистой воды кристаллизуется моногидрат, который можно обезводить над P4O1U. Продукт можно перекристаллизовать из водно-спиртовых растворов. Sr(N3)j получают аналогично. [c.1003]
Свойства. Коричневый порошок. ИК-спектр 2140 (с.), 2100 (с.) и 2050 (с.) см- (полоса при 780 см- обусловлена присутствием примеси КзКе02(СЫ)4). Диамагнетик. Из воды кристаллизуется с 1 моль Н2О. [c.1734]
Ионное произведение воды при 25 °С равно 1 10 , и оно сравнительно мало меняется при понижении температуры. Аммиак при обычных условиях — газ он превращается в жидкость при атмосферном давлении только при -33,4 °С, При этой температуре вода кристаллизуется, получается лед. Тем не менее очень небольшое количество воды может находиться в жидком аммиаке в растворенном состоянии. Ионное произведение (константа автопротолиза) аммиака при -40 составляет 1 10-33. [c.27]
Мак Касланд [962] описал метод, позволяющий легко получить чистую хинолин-8-сульфокислоту. Хинолин сульфируется 35%-ным олеумом при 90 в течение 40 час. Если смесь вылить в воду, кристаллизуется 8-сульфокислота (выход 54%). Из маточных растворов могут быть выделены более растворимые [c.218]
chem21.info
Кристаллическая вода - Справочник химика 21
Структура жидкой и кристаллической воды обусловлена прежде всего наличием у атома кислорода в молекуле воды двух неподеленных пар /)-электронов, за счет которых и осуществляется водородная связь с протонами соседних молекул воды. Легко видеть, что за счет двух неподеленных пар электронов и двух протонов каждая молекула воды участвует в образовании четырех водородных связей. При этом величина заряда в каждом из четырех центров составляет 0,17е [5]. [c.9] Фундаменты печей. Фундамент проектируют с усилением под несущими стойками каркаса печи и сооружают из монолитного или сборного железобетона. Площадь опорной плиты рассчитывают с учетом нормативного допускаемого напряжения сжатия бетона. Правильность расположения фундамента и его осей, а также высотных опорных отметок регламентирована нормами предельных отклонений от проектных размеров отклонение осей фундамента и размещения отверстий для фундаментных болтов 10 мм минимальный зазор для подливки между опорной плитой рамы и опорными плоскостями фундамента 25—30 мм. Для защиты бетона от разрушения грунтовыми водами предусматривают при возведении фундаментов дренажные приспособления и гидроизоляцию. Фундаменты конструктивно изолируют от воздействия высоких температур устройством каналов для циркуляции воздуха, так как цемент бетона при 300—400 °С теряет кристаллическую воду, поэтому его прочность снижается. [c.44]Наличие кристаллической воды в молекулах вещества существенно сказывается на процессе сушки в электромагнитном поле, так как при переходе ее в жидкое состояние (78 С) изменяется диэлектрическая проницаемость и [c.15]
Сульфат натрия легко образует пересыщенные растворы. Содержащий кристаллическую воду сульфат натрия обычно называют глауберовой солью. [c.225]
V---------у стояние кристаллической воды [c.194]
При переходе от газа к жидкости н к кристаллу происходит усложнение структурной организации вещества увеличивается число связей между частицами. Например, газообразная вода (пар) состоит из одиночных молекул и их небольших объединений. Жидкая вода содержит одиночные молекулы, димеры, три-меры и т.д. вплоть до больших агрегатов молекул, обладающих специфическими свойствами, присущими кристаллу. Кристаллическая вода имеет структуру, в которой каждая молекула связана с четырьмя другими. В том же направлении происходит и увеличение энергии связи между частицами. Таким образом, усложнение структурной организации вещества теснейшим образом связано с изменением характера движения частиц. [c.7]
Водород бывает окклюдированным в метеоритах и в ряде минералов и пород (гранит, гнейс, базальт и др.). Он присутствует в больших количествах на солнце и на большинстве звезд, что доказано анализом их спектров [1,3]. Связанный водород распространен в природе в виде соединений со многими элементами, в основном с кислородом, углеродом, серой, азотом, хлором. Менее распространены соединения водорода с фосфором, иодом, бромом и др. Вода содержит около 11 масс.водорода [з]. В литосфере водород входит в состав горючих ископаемых природных газов, нефти, угля, а также является компонентом многих минералов и пород. присутствуя в них в форме гидратов или кристаллической воды. Кроме того, водород входит в состав тканей живых организмов я растений [c.7]
При изучении кристаллического состояния вещества путем сравнения их энергий в кристаллическом и газообразном состояниях (разность этих энергий соответствует энергии сублимации) очень важно знать состав газовой фазы. Действительно, в зависимости от температуры при переводе кристаллической воды в газовую фазу могут протекать процессы с образованием различных продуктов, например [c.212]
ЖИТ 1 ИЛИ 1 /2 мол. кристаллической воды средняя натриевая соль кристаллизуется с 4 мол. воды. [c.104]
Гидросфера состоит из пресной и соленой воды на поверхности Земли, а также из кристаллической воды, которая образует континентальный снег и лед. Согласно данным Гольдшмидта, на каждый квадратный сантиметр земной поверхности приходится 273 л воды, причем 268,5 л из этого количества находится в виде океанической воды, 0,1 л в виде пресной воды, а 4,5 л в виде континентального льда. [c.443]
Например, углерод существует в форме алмаза и графита, диоксид кремния - в форме кварца, тридимита и кристобаллита. Привычная нам форма кристаллической воды - обычный лед -существует при давлениях ниже 2 10 кПа, а в интервале 2 10 -2,5 10 кПа устойчивы еще, по крайней мере, шесть различных полиморфных модификаций льда, одна из которых плавится при 82 °С под давлением 2,19 10 кПа. [c.91]
Фундаменты дымовых труб изготовляют из железобетона. При высоких температурах порядка 300—380"С портландцемент бетона постепенно теряет кристаллическую воду, вследствие чего снижается его прочность, что иногда приводит к нарушению монолитности фундамента и появлению трещин, а также осадка фундамента. Во время ревизии фундамента выясняют, являются ли трещины сквозными или поверхностными. Сквозные трещины фундамента можно определить с помощью зажженной свечи. Если пламя свечи втягивается в трещину — значит она сквозная. [c.147]
Пл Приготовление водных растворов силикатов, алюминатов, щелочей. Нагревание геля при перемешивании от 50 до 350 °С. Высушивание отделенного от маточного раствора и промытого микрокристаллического осадка при более высоких температурах. Удаление кристаллической воды 350—450 °С. Кристаллы размером 10 см, перемешанные с 15—20% глины, формуются в шарики или цилиндрические гранулы диаметром [c.534]
В литосфере водород составляет часть горючих ископаемых нефти, угля и других, а также является компонентом многих минералов и пород, присутствуя в них в форме гидратов или кристаллической воды. В сухом веществе горючих ископаемых водо род соединен преимущественно с углеродом, образуя большей частью углеводороды. Многим породам и горючим ископаемым водород сопутствует в виде гигроскопической воды. [c.39]
Бергман привел количественный состав очень многих кристаллических солей, полученных из водных растворов, но не описал детально метод определения и не привел записей результатов взвешивания. Например, состав сульфата калия он выразил следующим образом [137] (в скобках приведены истинные значения) 52 части щелочи (54,05 КгО), 40 частей серной кислоты (45,95 SO3) и 8 частей кристаллической воды (0,0). Он замечает также, что при температуре 15° одна часть соли растворяется в 16 частях воды. На вкус она довольно горькая. Плавится с трудом и не разлагается при умеренном нагревании, но разрушается при энергичном нагревании . [c.71]
Есть некоторое основание думать, что при распадении глауберовой соли гидрат, образующий пересыщенный раствор, содержит больше 10 наев кристаллической воды в твердом виде такого соединения не получено. Отсюда можпо вывести, что образование растворов не основывается на образовании тех только гидратов, какие известны в твердом виде... [c.232]
Правильность расположения фундамента и его осей, а также высотных опорных отметок регламентирована нормами предельных отклонений от проектных размеров отклонение осей фундамента и размещения отверстий для фундаментных болтов 10 мм минимальный зазор для подливки между опорной плитой рамы и опорными плоскостями фундамента 25...30 мм. Для защиты бетона от разрушения грунтовыми водами предусматривают при возведении фундаментов дренажные приспособления и гидроизоляцию. Фундаменты конструктивно изолируют от воздействия высоких температур устройством каналов для циркуляции воздуха, так как цемент бетона при 300...400 °С теряет кристаллическую воду, поэтому его прочность снижается. [c.173]
На рис.8 представлена зависимость изменения температуры от времени при энергетической нагрузке 1--750Вт/кт 2-500Вт/кг 3-375Вт/кг. Как видно из графиков при переходе вещества в состояние расплава (5-ая минута) темп роста температуры резко снижается. Что соответствует увеличению глубины проникновения излучения при переходе вещества в состояние расплава. Такую особенность поведения веществ с кристаллической водой необходимо учитывать при проектировании промышленных установок. [c.17]
Исследованы алмазосодержащие пасты - продукт взрыва тринитротолуола в воде. Впервые обнаружен эпитаксиальньш слой кристаллической воды на поверхности нанокристаллов алмазов при комнатной температуре. Обнаружены карбиновые цепочки в составе суспензии. Показано образование ультрадисперсного алмаза (УДА) из цепочек карбина. Исследована атомная и электронная структура кристаллитов УДА и показано, что они являются бездефектными с деформированными приповерхностными слоями. Степегь деформации зависит от химической структуры поверхности. Обоснована методика расчета кристаллического потенциала в частицах УДА, основанная на обратном Фурье преобразовании формы дифракционной линии. [c.59]
Приборы и реактивы. Весы техно-хнмические. Разновесы. Чассоые стркла. Стаканы химические вместимостью 100 мл. Стеклянные палочки. Воронка Бюхнера. Колба Бунзена. Насос водоструйный. Штатив с кольцом. Фильтровальная бумага. Шпатель. Сетка асбестированная. Л икроскоп. Предметные стекла. Сульфат калия. Сульфат алюминия, кристаллический. Вода дистиллироваиная. [c.190]
В структурах кремнезема тетраэдрические группы 5104 соединены через общие атомы кислорода. Мы отмечали выше (рис. 3.32), что такими же топологическими возможностями обладают молекулы НаО, а также молекулы или ионы типа ОгМ(ОН)2. Имеется несколько форм кристаллической воды (т. е. льда). В добавление к формам, устойчивым только при высоком давлении, которые описаны в разд. 1.5.1, существуют две формы льда, стабильные при атмосферном давлении. Обычный лед (лед-1п) имеет структуру тридимита, но прп температуре, близкой к —130 °С, вода кристаллизуется со структурой кристобалита. Тридимитовая структура подобна сетке, изображенной на рис. 3.35, в, которая представляет собой структуру гексагонального алмаза здесь то же соотношение, что и между кристобалитом и кубической алмазной сеткой, показанной на рис. 3.35, а. Две структуры АХ, родственные сеткам на рис. 3.35, а и в, но с чередующимися атомами А и X — это структуры цинковой обманки и вюртцита, которые изображены на рис. 3.35,6 и г. Таким образом, и НгО, и 5102 кристаллизуются как в виде кубических, так и в виде гексагональных структур АХг [c.155]
В зависимости от температуры и давления твердые вещства могут находиться в нескольких кристаллических формах, как, например, кристаллическая вода (рис. 5.11) или система, показанная на рис. 5.25,ж. [c.406]
Значительный интерес представляет экспериментальное исследование мёссбауэровского поглощения в набухающих глинах, о котором упоминалось в разделе 2 13. С ростом толи ны водного промежутка от значения, близкого к нулю, до значения, соответствующего примерно четырем монослоям воды, мёссбауэровское поглощение падает. Это указывает на постепенный переход воды, заключенной между алюмосиликатными пластинами, из кристаллического состояния, близкого к состоянию льда-1, в состояние жидкой воды. Несмотря на то, что увеличение толщины водного зазора происходит скачкообразно, мёссбауэровское поглощение, согласно экспериментальным данным [12], падает плавно (рис. 3.13). Таким образом, согласно этим данным, упорядочение, соответствующее кристаллической воде, при набухании постепенно уменьшается, и плав- ление воды заканчивается, когда толщина водного промежутка составляет 20 А. [c.56]
Диэлектрические постоянные водосодержащих. кристаллов исследовал Вецлар он изуч ал различные типы связи в цеолитах и пермутитах, (см. С. П, 121). В кристаллической воде отчетливо выражены дипольные свойства, причем зависимость диэлектрической постоянной от длины волны (Л) и частоты ( ) может служить мерой подвижности ее в каркасе структуры. Согласно Дебаю, время релаксации [c.656]
Тизелиус показал, что, согласно структурному анализу, произведенному Тейлором, молекулы воды в цеолитах занимают вполне определенные места в структуре, подобно кристаллической воде в истинных гидратах,. Они оставляют эти места не вследствие особой разрыхленности цеолитовой связи , а вследствие того, что теплота сорбции воды представляет величину того же порядка, что и теплота испарения в кристаллических гидратах. Только в степени подвижности сорбированных молекул воды заключается характерное различие соединений обоих видов. [c.666]
Перборат натрия — соль надборной кислоты МаВОзНгОгЗНгО бесцветные кристаллы, разлагается при температуре выше 40° С, содержит активного кислорода около 10,4%. При удалении кристаллической воды активность [c.229]
Приборы и реактивы. Весы техно-химические. Разновесы. Часовые стекла Стаканы химические 100 мл. Стеклянные палочки. Воронка Бюхнера. Отсасыва-тельная колба. Насос водоструйный. Штатив с кольцом. Фильтровальная бумага. Шпатель. Плитка электрическая. Сетка асбестированная. Микроскоп, Предметные стекла. Сульфат калия. Сульфат алюминия, кристаллический. Вода дистиллированная. [c.242]
В Записках Спб. Академии Наук 1861 г. помещена моя статья о соединениях предельных углеродистых водородов. До тех пор, хотя многие присоединения, совершающиеся с углеводородами и их производными, были известны, но не обобщались и даже неоднократно толковались, как случаи замещения. Так, соединение С Н с С1 рассматривали нередко как образование продуктов замещения С-№С1 и НС1, которые, предполагали, удерживаются между собою как кристаллическая вода при солях. Уже ранее (1857, Записки Петр. Академии) я рассматривал подобные случаи как истинные соединения. Вообще, по закону предела, непредельный углеводород или его производное, соединяясь с чем-либо, дает вещертво предельное или приближающееся к пределу. Исследования Франкланда над многими металлоорганическими соединениями ясно показали предел металлических соединений, к которому в дальнейшем изложении мы многократно будем обращаться, но и для углерода есть свой предел, достигаемый в С Н ". [c.554]
Благодаря гидратации вещество из раствора выделяется в виде кристаллогидратов вполне определенной формы, содержащих то или иное, влолне определенное количество молекул растворителя (воды), причем наличие кристаллической воды в кристаллах сказывается не только на их фооме, но и на свойствах. Так, например, безводный сульфат меди (Си304) — бесцветное соединение, кристаллизующееся в призматических иголках ромбической системы, а пятивод-яый гидрат того же самого сульфата меди (Си804 БНгО) образует крупные синие кристаллы триклинической системы. При нагревании до 100° этот гидрат теряет 4 молекулы воды, а при [c.365]
Выбор между двумя этими механизмами можно сделать после сравнения дрейфовой подвижности протонов в жидкой и кристаллической воде. В последнем случае, когда концентрация протонов крайне низка, а дезориентацией решетки при перескоках протона можно пренебречь, имеет место механизм а . Правильная тетраэдричная решетка структуры из водородных мостиков дает возможность протонам свободно проникать через нее. [c.323]
С другой стороны, представления Грэма о кислотах фосфора не нарушали дуалистической системы Берцелиуса. Новым в этих взглядах было то, что гидратная , или кристаллическая , вода кислот приобретала определенный химический смысл, подтверждая идеи, высказанные ранее Дэви и Дюло-ном. Однако выводы Грэма многие химики рассматривали как частный случай и не распространяли их на все кислоты. Сам Берцелиус придерживался того мнения, что особенность многоосновных кислот и их солей связана с различным расположением атомов, т. е. с изомерией. Это давало ему возможность ограничить распространение выводов Грэма на все кислоты. [c.209]
Упомянутые выше последние исследования Мариньяка, появившиеся после статьи Раммельсберга, дают основание утверждать, что закись церия действительно изоморфна с окисями лантана и дидима, т. е. что соответствующие соли последних, в особенности сложные двойные соединения, имеют эквивалентный состав и часто выступают в совпадающих кристаллических формах, хотя в более простых солях изоморфизм не всегда имеет место. К сон алению, Мариньяк не попытался получить смешанные кристаллы, которые дают единственно надежную гарантию полного изоморфизма. То обстоятельство, что соответствующие соли соединяются с равными массами кристаллической воды и других солей (Pt l, NH NQ3), еще не доказывает полного изоморфизма ведь в этом отношении могут быть сходными соли окисей, обладающие очень различным составом. Так, например, нитраты A1(N03)3, r(N03)3, Ге (N03)3, так же как Mn(N03)2, Mg(N03)2, o(NQ3)3, Ur02(NQ3)2, содержат эквивалентные массы воды, а именно ЗН О на каждый радикал N03. Ныне неизвестно, сохраняется ли при этом кристаллическая форма или нет есть некоторое основание предполагать, что изоморфизм может иметь место при различном составе окисей и одинаковом содержании кристаллической воды, ибо, как показано выше, массы, имеющие разный состав, но эквивалентные между собой, часто бывают изоморфными. [c.473]
Кроме активированного угля и силикагелей, в качестве сорбента в адсорбционных насосах все чаще применяют цеолиты. Это объясняется тем, что воздух поглощается цеолитом (5А, 10Х, 13Х) лучше, чем другими пористыгии со1рбентатаи. Природные цеолиты представляют собой алюмосиликаты натрия, кальция и бария. Обычно это кристаллическое вещество типа МагЛиОзяЗЮг Н2О. После прогрева цеолита кристаллическая вода удаляется без существенного изменения кристаллической структуры, благодаря чему во много раз увеличивается пористость материала. Следует отметить, что цеолиты обладают большим постоянством и воспроизводимостью сорбционных свойств, причем каждый вид цеолита обладает порами одинакового диаметра. Благодаря этому цеолиты имеют селективный характер поглощения молекул различных газов и получили название молекулярных сит. Размеры пор у различных видов цеолитов [c.116]
С Н (К0 ) 0). Так, нагретый раствор пикриновой кислоты в бензине при охлаждении выделяет светложелтые кристаллы С №(ЫО )Ю-4-С №. При охлаждении кипящего спиртового раствора пикриновой кислоты и нафталина (С Н ) выделяются желтые кристаллы. Углеродистые водороды в этих соединениях заключаются, вероятно, в том виде, в каком кристаллическая вода во многих солях и других соединениях, потому что, будучи нагреты, они распадаются,, причем углеродистые водороды улетучиваются. Пользуясь только что указанной особенностью, можно отделить высшие углеродистые водороды от низших. [c.398]
Осторожнее Рассмотрим природу довольно спецн-с предсказа- фического молекулярного кристалла киями кристаллической воды. Не раз мы уже [c.96]
Было бы интересно, конечно, рас-загадки сматрпвая особенности структуры и химической связи в кристаллах льда, выяснить некоторые другие важные вопросы, касающиеся природы кристаллической воды. Например, почему при не слишком низкой температуре оказывается выгодной гексагональная кристаллическая форма льда Почему кубическая полиморфная модификация устойчива только при —80°С Какую роль в этом играют водородные связи, а какую— силы Ван-дер- [c.99]
chem21.info
Кристаллическая решетка льда и воды
Трехмерное состояние жидкой воды трудно исследовать, но многое было изучено путем анализа структуры кристаллов льда. Четыре соседних атома кислорода с водородным взаимодействием занимают вершины тетраэдра (тетра = четыре, гедрон = плоскость). Средняя энергия, необходимая для разрушения подобной связи во льду, оценивается в 23 кДж / моль-1.

Способность молекул воды образовывать данное количество водородных цепей, а также указанная прочность создает необычно высокую температуру плавления. Когда он тает, то удерживается жидкой водой, структура которой нерегулярна. Большая часть водородных связей искажается. Для разрушения кристаллической решетки льда с водородной связью требуется большая масса энергии в виде тепла.
Особенности появления льда (Ih)
Многие из обывателей задаются вопросом о том, какая кристаллическая решетка у льда. Необходимо отметить, что плотность большинства веществ возрастает при замораживании, когда молекулярные движения замедляются и образуются плотно упакованные кристаллы. Плотность воды также увеличивается, когда она остывает до достижения максимума при 4°C (277K). Затем, когда температура опускается ниже этого значения, она расширяется.
Это увеличение обусловлено образованием открытого водородно-связанного кристалла льда с его решеткой и меньшей плотностью, в котором каждая молекула воды жестко связана указанным выше элементом и четырьмя другими значениями, и при этом двигается достаточно быстро, чтобы обладать большей массой. Поскольку происходит подобное действие, жидкость замерзает сверху вниз. Это имеет важные биологические результаты, вследствие которых слой льда на пруду изолирует живых существ подальше от сильного холода. Кроме того, два дополнительных свойства воды связаны с его водородными характеристиками: удельной теплоемкостьюи испарением.
Детальное описание структур
Первый критерий представляет собой количество, необходимое для повышения температуры 1 грамма вещества на 1°С. Для повышения градусов воды требуется относительно большая часть тепла, потому что каждая молекула участвует в многочисленных водородных связях, которые должны быть разрушены, чтобы кинетическая энергия увеличивалась. Кстати, обилие h3O в клетках и тканях всех крупных многоклеточных организмов означает, что флуктуация температуры внутри клеток сведена к минимуму. Эта особенность имеет решающее значение, поскольку скорость большинства биохимических реакций чувствительна.
Теплота испарения воды также значительно выше, чем у многих других жидкостей. Для преобразования этого тела в газ требуется большое количество тепла, потому что водородные связи должны быть разрушены, чтобы молекулы воды могли дислоцироваться друг от друга и войти в указанную фазу. Изменяемые тела представляют собой постоянные диполи и могут взаимодействовать с другими подобными соединениями и теми, что ионизируются и растворяются.
Иные вещества, указанные выше, могут вступать в контакт только при наличии полярности. Именно такое соединение участвует в строении этих элементов. Кроме того, оно может выравниваться вокруг этих частиц, образованных из электролитов, так что отрицательные атомы кислорода молекул воды ориентированы на катионы, а положительные ионы и атомы водорода, ориентированы на анионы.
В твердых веществах образуются, как правило, молекулярные кристаллические решетки и атомные. То есть если йод построен таким образом, что в нем присутствует I2, то в твердом диоксиде углерода, то есть в сухом льде, в узлах кристаллической решетки находятся молекулы CO2. При взаимодействии с подобными веществами, ионную кристаллическую решетку имеет лед. Графит, например, обладающий атомной структурой, в основе которой углерод, не способен ее менять, также как и алмаз.
Что происходит, когда кристалл столовой соли растворяется в воде: полярные молекулы притягиваются к заряженным элементам в кристалле, что приводит к образованию подобных частиц натрия и хлорида на его поверхности, в результате эти тела дислоцируются друг от друга, и он начинает растворяться. Отсюда можно наблюдать, что лед имеет кристаллическую решетку с ионной связью. Каждый растворенный Na + притягивает отрицательные концы нескольких молекул воды, тогда как каждый растворенный Cl - притягивает положительные концы. Оболочка, окружающая каждый ион, называется сферой спасения и, обычно, содержит несколько слоев частиц растворителя.
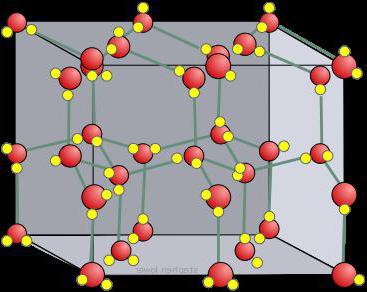
Кристаллическая решетка сухого льда
Говорят, что переменные или ион, окруженные элементами, являются сульфатированными. Когда растворителем выступает вода, такие частицы гидратируются. Таким образом, любая полярная молекула имеет тенденцию к сольватации элементами жидкого тела. У сухого льда тип кристаллической решетки образует в агрегатном состоянии атомные связи, которые неизменны. Другое дело кристаллический лед (замороженная вода). Ионные органические соединения, такие как карбоксилазы и протонированные амины, должны обладать растворимостью в гидроксильной и карбонильной группах. Частицы, содержащиеся в таких структурах, двигаются между молекулами, причем их полярные системы образуют водородные связи с этим телом.
Конечно, количество последних указанных групп в молекуле влияет на ее растворимость, которая также зависит от реакции различных структур в элементе: например, одно-, двух- и трех углеродные спирты смешиваются с водой, но более крупные углеводороды с одиночными гидроксильными соединениями гораздо менее разбавляемы в жидкости.
Шестиугольный Ih схож по форме с атомной кристаллической решеткой. У льда и всего естественного снега на Земле она выглядит именно так. Об этом свидетельствует симметрия кристаллической решетки льда, выращенная из водяного пара (то есть снежинок). Находится в космической группе P 63/мм с 194; D 6h, класса Лауэ 6/мм; аналогичный β-, имеющей кратную 6-ти винтовую ось (вращение вокруг в дополнение к сдвигу вдоль нее). Он обладает довольно открытой структурой с низкой плотностью, где эффективность низкая (~ 1/3) по сравнению с простыми кубическими (~ 1/2) или гранецентрированными кубическими (~ 3/4) структурами.
По сравнению с обычным льдом, кристаллическая решетка сухого льда, связанная молекулами CO2, статична и меняется лишь при распаде атомов.
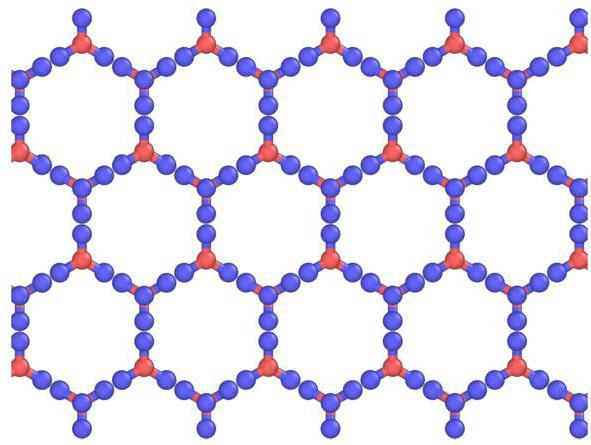
Описание решеток и входящих в них элементов
Кристаллы можно рассматривать, как кристаллические модели, состоящие из листов, расположенных друг над другом. Водородная связь упорядочена, тогда как в действительности она случайна, поскольку протоны могут перемещаться между молекулами воды (льда) при температурах выше примерно 5 К. Действительно, вполне вероятно, что протоны ведут себя, как квантовая жидкость в постоянном туннелированном потоке. Это усиливается рассеянием нейтронов, показывающих плотность их рассеяния на полпути между атомами кислорода, что указывает на локализацию и согласованное движение. Здесь наблюдается схожесть льда с атомной, молекулярной кристаллической решеткой.
Молекулы имеют ступенчатое расположение водородной цепи по отношению к трем своим соседям в плоскости. Четвертый элемент имеет затмеваемое расположение водородной связи. Существует небольшое отклонение от идеальной шестиугольной симметрии, как элементарной ячейки на 0,3% короче в направлении этой цепи. Все молекулы испытывают одинаковые молекулярные среды. Внутри каждой "коробки" достаточно места для удержания частиц интерстициальной воды. Хотя это, как правило, не считается, недавно они были эффективно обнаружены нейтронной дифракцией порошкообразной кристаллической решеткой льда.
Изменение веществ
Шестиугольное тело имеет тройные точки с жидкой и газообразной водой 0,01 ° C, 612 Па, твердыми элементами – три -21,985 ° C, 209,9 МПа, одиннадцать и два -199,8 ° C, 70 МПа, а также -34,7 ° C, 212,9 МПа. Диэлектрическая проницаемость гексагонального льда составляет 97,5.
Кривая плавления этого элемента дается МПа. Уравнения состояния доступны, кроме них некоторые простые неравенства, связывающие изменение физических свойств с температурой гексагонального льда и его водных суспензий. Твердость колеблется в зависимости от градусов, возрастающих примерно от или ниже гипса (≤2) при 0°С, до уровня полевого шпата (6 по шкале Мооса) при -80 ° С, аномально большое изменение абсолютной твердости (> 24 раза).
Шестиугольная кристаллическая решетка льда образует гексагональные пластины и столбцы, где верхняя и нижняя грани являются базальными плоскостями {0 0 0 1} с энтальпией 5,57 мкДж · см -2, а другие эквивалентные боковые называются частями призмы {1 0 -1 0} с 5,94 мкДж · см -2. Вторичные поверхности {1 1 -2 0} с 6.90 μJ ˣ см -2 могут быть сформированы по плоскостям, образованными сторонами структур.
Подобное строение показывает аномальное уменьшение теплопроводности с увеличением давления (как и кубический, и аморфный лед низкой плотности), но отличается от большинства кристаллов. Это связано с изменением водородной связи, уменьшающей поперечную скорость звука в кристаллической решетке льда и воды.
Существуют методы, описывающие, как подготовить большие образцы кристалла и любую желаемую поверхность льда. Предполагается, что водородная связь на поверхности гексагонального исследуемого тела будет более упорядоченной, чем внутри объемной системы. Вариационная спектроскопия с генерацией по частоте колебаний с фазовой решеткой показала, что существует структурная асимметрия между двумя верхними слоями (L1 и L2) в подповерхностной HO цепи базальной поверхности гексагонального льда. Принятые водородные связи в верхних слоях шестиугольниках (L1 O ··· HO L2) сильнее, чем принятые во втором слое к верхнему накоплению (L1 OH ··· O L2). Доступны интерактивные структуры гексагонального льда.
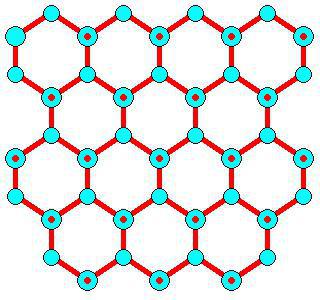
Особенности развития
Минимальное количество молекул воды, необходимых для зарождения льда, примерно 275 ± 25, как и для полного икосаэдрического кластера 280. Образование происходит с коэффициентом 10 10 на поверхности раздела воздух-вода, а не в объемной воде. Рост кристаллов льда зависит от разных темпов роста различных энергий. Вода должна быть защищена от замерзания при крио консервировании биологических образцов, пищи и органов.
Обычно это достигается быстрыми скоростями охлаждения, использованием небольших образцов и крио консерватора, а также увеличением давления для образования зародышей льда и предотвращения повреждения клеток. Свободная энергия льда / жидкости увеличивается от ~ 30 мДж/м2 при атмосферном давлении до 40 мДж/м-2 при 200 МПа, что указывает на причину, по которой происходит подобный эффект.
Какой тип кристаллической решетки характерен для льда
В качестве альтернативы они могут расти быстрее с поверхностей призмы (S2), на случайно нарушенной поверхности быстрозамороженных или взволнованных озер. Рост от граней {1 1 -2 0}, по крайней мере, такой же, но превращает их в основания призмы. Данные о развитии кристалла льда были полностью исследованы. Относительные скорости роста элементов разных граней зависят от способности образовывать большую степень совместной гидратации. Температура (низкая) окружающей воды определяет степень разветвления в кристалле льда. Рост частиц ограничивается скоростью диффузии при низкой степени переохлаждения, то есть <2 ° C, что приводит к большему их количеству.

Но ограничено кинетикой развития при более высоких уровнях понижения градусов >4°C, что приводит к игольчатому росту. Эта форма схожа со строением сухого льда (имеет кристаллическую решетку с шестиугольной структурой), различными характеристиками развития поверхности и температурой окружающей (переохлажденной) воды, которая находится за плоскими формами снежинок.
Зарождение льда в атмосфере глубоко влияет на образование и свойства облаков. Полевые шпаты, обнаруженные в пустынной пыли, которая попадает в атмосферу миллионами тонн в год, являются важными образователями. Компьютерное моделирование показало, что это связано с зарождением плоскостей призматических кристаллов льда на плоскостях поверхности высоких энергий.
Некоторые другие элементы и решетки
Растворенные вещества (за исключением очень небольшого гелия и водорода, которые могут входить в междоузлия) не могут быть включены в структуру Ih при атмосферном давлении, но вытесняются на поверхность или аморфный слой между частицами микрокристаллического тела. В узлах кристаллической решетки сухого льда находятся некоторые иные элементы: хаотропные ионы, такие как Nh5 + и Cl -, которые включены в более легкое замораживание жидкости, чем другие космотропные, такие как Na + и SO42-, поэтому удаление их невозможно, ввиду того, что они образуют тонкую пленку из оставшейся жидкости между кристаллами. Это может привести к электрической зарядке поверхности из-за диссоциации поверхностной воды, уравновешивающей оставшиеся заряды (что также может привести к магнитному излучению) и изменению рН остаточных жидких пленок, например, NH 42SO4 становится более кислым и NaCl становится более щелочным.
Они перпендикулярны граням кристаллической решетке льда, показывающей присоединенный следующий слой (с атомами О-черный). Им характерна медленно растущая базальная поверхность {0 0 0 1}, где прикрепляются только изолированные молекулы воды. Быстро растущая {1 0 -1 0} поверхность призмы, где пары вновь присоединенных частиц могут связываться друг с другом водородом (одна его связь/две молекулы элемента). Наиболее быстро растущая грань {1 1 -2 0} (вторичная призматика), где цепочки вновь присоединенных частиц могут взаимодействовать друг с другом водородной связью. Одна ее цепочка/ молекула элемента – это форма, образующая хребты, которые делят и поощряют превращение в две стороны призмы.
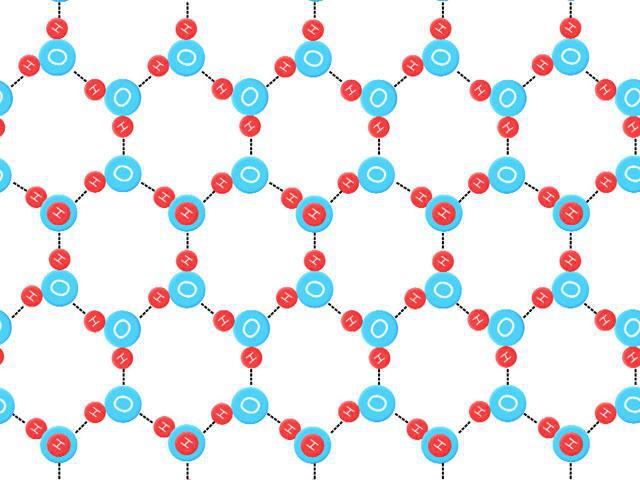
Энтропия нулевой точки
Может быть определена, как S 0 = k B ˣ Ln (N E0), где k B – это постоянная Больцмана, NE– эточисло конфигураций при энергии E, а E0 - наименьшая энергия. Это значение для энтропии гексагонального льда при нулевом кельвине не нарушает третьего закона термодинамики «Энтропия идеального кристалла при абсолютном нуле ровно равна нулю», поскольку эти элементы и частицы не идеальны, имеют неупорядоченное водородное связывание.
В этом теле водородная связь является случайной и быстро меняющейся. Эти структуры не точно равны по энергии, а распространяются на очень большое количество энергетически близких состояний, подчиняются «правилам льда». Энтропия нулевой точки – это беспорядок, который оставался бы, даже если материал мог бы быть охлажден до абсолютного нуля (0 K = -273,15 ° C). Порождает экспериментальную путаницу для гексагонального льда 3,41 (± 0,2) ˣ моль -1 ˣ K -1. Теоретически, можно было бы вычислить нулевую энтропию известных ледяных кристаллов с гораздо большей точностью (пренебрегая дефектами и разбросом энергетических уровней), чем определить ее экспериментально.
Ученые и их труды в этой сфере
Может быть определена, как S 0 = k B ˣ Ln (N E0), где k B – это постоянная Больцмана, NE– эточисло конфигураций при энергии E, а E0 - наименьшая энергия. Это значение для энтропии гексагонального льда при нулевом кельвине не нарушает третьего закона термодинамики «Энтропия идеального кристалла при абсолютном нуле ровно равна нулю», поскольку эти элементы и частицы не идеальны, имеют неупорядоченное водородное связывание.
В этом теле водородная связь является случайной и быстро меняющейся. Эти структуры не точно равны по энергии, а распространяются на очень большое количество энергетически близких состояний, подчиняются «правилам льда». Энтропия нулевой точки – это беспорядок, который оставался бы, даже если материал мог бы быть охлажден до абсолютного нуля (0 K = -273,15 ° C). Порождает экспериментальную путаницу для гексагонального льда 3,41 (± 0,2) ˣ моль -1 ˣ K -1. Теоретически, можно было бы вычислить нулевую энтропию известных ледяных кристаллов с гораздо большей точностью (пренебрегая дефектами и разбросом энергетических уровней), чем определить ее экспериментально.

Хотя порядок протонов в объемном льду не упорядочен, поверхность, вероятно, предпочитает порядок указанных частиц в виде полос свисающих Н-атомов и О-одиночных пар (нулевая энтропия с упорядоченными водородными связями). Найден беспорядок нулевой точки ZPE, J ˣ mol -1 ˣ K -1 и других. Из всего вышеизложенного видно и понятно, какие типы кристаллических решеток характерны для льда.
fb.ru

















