Справочник химика 21. Этилацетат вода
Этилацетат с водой - Справочник химика 21
Изопропанол - вода (4 1) Этилацетат-пиридин - вода (12 5 4) и-Пропанол этилацетат-вода (7 1 2) [c.396]Сопоставляя различные методы выбора разделяющих агентов, необходимо иметь в виду, что все свойства растворов взаимосвязаны и их значения определяются свойствами компонентов и интенсивностью их взаимодействия друг с другом. Поэтому о характере отклонений от идеального поведения можно судить не по одному, а по ряду свойств. Так, к заключению о пригодности воды в качестве разделяющего агента для системы этанол—этилацетат можно прийти, основываясь на том, что смеси этилацетата и воды имеют более низкие температуры кипения, чем такого же состава смеси этанола и воды. К этому же выводу можно прийти, основываясь на том, что азеотроп этилацетат—вода имеет более глубокий минимум температуры кипения, а также принимая во внимание наличие ограниченной взаимной растворимости в системе этилацетат—вода, в противоположность системе этанол—вода. Из этого следует, что все методы выбора разделяющих агентов по свойствам растворов практически равноценны. Выбор же того или иного метода должен в каждом конкретном случае определяться степенью полноты имеющихся данных о свойствах растворов и трудностью их экспериментального определения. [c.71]
Из этих таблиц видно, что отношение концентраций уксусной кислоты и воды приближается к отношению этих компонентов в исходной смеси между 8-й и 9-й тарелками при, / =оон на десятой тарелке — при У = 0,333. Выше этих тарелок, в укрепляющей части, концентрации воды и этилацетата практически постоянны и близки к концентрациям этих веществ в азеотропе этилацетат—вода. В укрепляющей части колонн происходит только отделение уксусной кислоты, концентрация которой по мере приближения к верху колонны быстро уменьщается. [c.241]Уксусная кислота Этилацетат. . . Вода...... [c.242]
Суммарная концентрация в равновесной смеси уксусной кислоты этилового спирта этилацетата воды [c.255]
Выход 9 г ( 40%), считая на соединение УП, Rf 0,35 на силуфоле (изобутиловый спирт пропанол этилацетат вода = 2 4 1 3) (рис. 7.12, спектр поглощения в воде). [c.227]
Значения Rf для полиспиртов при разделении смесью пропанол—этилацетат—вода (7 1 2) инозит 0,11 сорбит, дульцит 0,31 маннит 0,34 арабит 0,44 глицерин 0,58. [c.187]
Золото определяют [719] полуколичественпо в рудах, почвах и породах после отделения от сопутствуюш,их ионов методом восходяш ей хроматографии на бумаге. Растворителем является смесь этанол — этилацетат — вода — HNO3 (20 20 20 0,7). Не мешают Ag и Hg. Распределительную хроматографию на бумаге применяют До1я определения золота в силикатных, глинистых и сульфидных рудах [1168, 1169], ювелирных сплавах [1403], монетных сплавах, содержаш,их Си и Fe [795], для обнаружения золота в присутствии платиновых металлов [82J. [c.101]
Пропанол-2 — этилацетат — вода (25 65 11) [c.195]
Пропанол — этилацетат — вода (15 2 3) [c.195]
Ацетон, спирты, диоксан, ацетонитрил Диэтиловый эфир, бензол, углеводороды Диэтиловый эфир, этилацетат, углеводороды Вода, диэтиловый эфир, углеводороды Вода, углеводороды, этилацетат Вода [c.427]
Ацетон, спирты, диоксан, ацетонитрил Диэтиловый эфир, этилацетат, углеводороды Диэтиловый эфир, бензол, углеводороды Ацетон, углеводороды, этилацетат, бензол, четыреххлорнстый углерод Этанол, углеводороды Вода, диэтиловый эфир, углеводороды Вода, углеводороды, этилацетат Вода, диэтиловый эфир, углеводороды Вода, диэтиловый эфир, бензол Вода, бензол, диэтиловый эфир Диэтиловый эфир, углеводороды, беизол Вода, углеводороды, этилацетат Вода [c.427]
Va к-пропанол — этилацетат — вода — 25%-ный аммиак (50 + 10 + + 30 + 10) V6 то же, что Va с соотношением объемов (60 + 10 + 20 + 10), Vb то же, что Va с соотношением объемов (60 + 10 + 30 + 10). [c.458]
VI -пропанол — этилацетат — вода — ледяная уксусная кислота (40 + 10 + 40 + 10), VII к-бутанол — ледяная уксусная кислота — вода (60 + 30 + 10), [c.458]
Этилформиат — этанол Этилформиат — вода Ацетон — метилацетат Метилацетат — этанол Метилацетат— вода Этилацетат — этанол Этилацетат — МЭК Этилацетат — вода Этанол — МЭК Этанол — изобутилформиат Этанол — вода Этанол — пропилацетат Этанол — метилпропилкетон МЭК —вода [c.117]
Размерности концентраций. Методы расчета распределения, рассмотренные выше, предусматривали выражение концентраций в мольных долях. Коэффициенты распределения, выраженные в весовых долях, отличаются по численному значению от коэффициентов распределения в мольных долях, но характер распределения в обоих случаях обычно одинаков. Лишь в редких случаях, при необычной комбинации молекулярных весов, он может изменяться. Например, в системе этанол — этилацетат— вода равновесные концентрации выше в водном слое, если их выражать в весовых долях, и, наоборот, выше в эфирном слое, если пользоваться для выражения концентраций мольными долями. [c.122]
Предложенная модель была использована для расчета расслаивания ситемы этилацетат—вода. Число узлов разбиения по переменной t составляло 10. Сходящееся решение было получено при соотношении величин шагов по времени и координате, равном Аг/ДА 5 7/6. Погрешность расчета оценивалась по количеству дисперсной фазы, прошедшей через границу в течение полного времени расслаивания, а ее максимально допустимое значение не превышало 10%. [c.298]
На основании материального баланса определяются составы кубовой жидкости и дистиллата. Из точек на диагонали диаграммы 91, а и 91,6, отвечающих составу кубовой жидкости, проводится рабочая линия с углом наклона, определяемым соотношением расходов жидкости и пара на тарелке, расположенной над кубом. Затем путем графического построения определяются концентрации уксусной кислоты и воды. Концентрация этилацетата 01пределяется по разности. На ближайших к кубу тарелках концентрация этилацетата в рассматриваемом примере мала, поэтому конценГрации уксусной кислоты и воды определяются ступенчатым построением между рабочей линией и кривой равновесия для бинарной системы уксусная кислота— вода. Начиная с тятой тарелки, содержание этилацетата достигает величины, при которой он существенно влияет на условия фазового равновесия. Соответственно с этим изменяется характер построения. Как видно из рис. 91, концентрация уксусной кислоты по высоте колонны все время убывает. Концентрация же воды до восьмой тарелки возрастает, а затем резко падает, приближаясь к величине, отвечающей составу азеотропа этилацетат—вода. На вышележащих тарелках относительное содержание воды и этилацетата сохраняется таким же как в азеотропе, образуемом этими веществами. [c.236]
Отличительной особенностью рассмотренных примеров является чрезвычайно низкая концентрация разделяющего агента в кубовой жидкости. Поэтому в исчерпы-Ьающей части колонны концентрация разделяющего агента оказываетс.ч значительно ниже, чем в азеотропе этилацетат—вода. С целью улучшения условий разделения в исчерпывающей части колонны часто оказывается целесообразным допускать большее содержание разделяющего агента [c.243]
К диализованному раствору, содержащему окисленный полисахарид добавляют 1,1 г боргидрида натрия и оставляют стоять при комнатной температуре в течение 10 ч. Затем к смеси добавляют по каплям 1 н. раствор соляной кислоты для разрушения избытка боргидрида и нейтральный раствор концентрируют в вакууме при 40° С до 150 м.л. К полученному нейтральному раствору полиола добавляют соляную кислоту до 0,5 и. концентрации и подкисленный раствор оставляют при комнатной температуре на 8 ч. Для удаления ионов хлора и натрия гидролизат последовательно обрабатывают анионитом А-4 (ОН -форма) и катионитом Щ-120 (Н+-форма), а затем упаривают досуха в вакууме при 40° С. Остаток трижды упаривают со 150 мл метанола для удаления борной кислоты в виде летучего метилбората. Исследование нейтрального гидролизата методом хроматографии на бумаге в системе пиридин — этилацетат—вода (2 5 7 по объему) показывает наличие в нем эритрита и ряда менее подвижных гликозидов эритрита. Для идентификации разделенных хроматографией веществ вырезают участки хроматограммы, соответствующие отдельным соединениям, элюируют водой, элюаты фильтруют и упаривают в вакууме досуха. В табл- 16 приведена характеристика очищенных продуктов. [c.115]
Для анализа электрофореграммы разрезают на отрезки по 2 см, полисахариды с полученных отрезков элюируют водой, элюаты гидролизуют и углеводный состав гидролизатов определяют хроматографией на бумаге с растворителем пиридин— этилацетат—вода (1 5 5). Состав углеводов на хроматограммах, соответствующих отрезкам —6 электрофореграмм (рис. 26), дает возможность представитв распределение на электрофореграммах 4-0-метилглюкуроноарабоксилана и галактуроноарабогалактана. Наличие только двух пиков на электрофореграмме свидетельствует об однородности разделенных полисахаридов. [c.177]
Этот случай (рис. 10) сходен со случаем гомоазеотропии различие их состоит в том, что жидкая гетероазеотропная смесь, как и в случае гетерозеотропии, может разделяться на два слоя, которые при температуре кипения дают пар постоянного состава Х . Это состояние изменяет- я только тогд когда вследствие постоянного испарения исчезает одна 13 жидких фаз. В данном случае перегонка не приводит к полному разделению смеси на чистые компоненты. Примером смесей такого типа могут служить вода—анилин, вода—этилацетат, вода—изобутиловый спирт. [c.29]
Дальнейшую очистку перимицина осуществляют противоточным распределением в системе пиридин—этилацетат—вода (3,5 6,5 8,3), К=2,2. [c.87]
Фотометрическое определение кобальта нитрозо- -солью после экстракции дитизонатов и разделения хроматографией на бумаге [493]. Почву обрабатывают раствором соляной кислоты и экстрагируют кобальт и другие элементы из цитратного буферного раствора при pH 8,3 хлороформным раствором дитизона. Удаляют хлороформ выпариванием и разрушают дитизонаты азотной или хлорной кислотой при нагревании. Остаток выпаривают два-три раза с соляной кислотой, хлориды металлов растворяют в 6 N растворе соляной кислоты и разделяют медь и кобальт методом радиальной хроматографии на бумаге. Растворителем служит смесь ацетон — этилацетат — вода — соляная кислота (пл. 1,19) в соотношении 45 45 5 5. Кобальт идентифицируют на высушенной и обработанной ам(миак0м хроматО(Грам-ме опрыскиванием 0,1%-ным этанольным раствором рубеановодородной кислоты. Соответствующий сектор хроматограммы озоляют и определяют кобальт в растворе золы фотометрически нитрозо-К-солью. Предложено также концентрировать кобальт из солянокислых почвенных вытяжек посредством анионообменной окиси алюминия, пропитанной нитрозо-К-солью. Избыток нитрозо-К-соли после поглощения кобальта вымывают из колонки горячей азотной кислотой, а затем десорбируют кобальтовый комплекс нитрозо-К-соли пропусканием через колонку раствора серной кислоты. Далее в лолученном растворе определяют кобальт фотометрически [1378]. [c.211]
Исследовалась массопередача уксусной кислоты в системах этиленгликоль — этилацетат, вода — изобутиловьп спирт и вода — этилацетат. Прп определенной величине возмущений наблюдались псевдостационарные полигональные конвективные ячейки. Этот тип межфазных явлений был назван микромасштабным межфазным движением в отличие от макромасштабного, под которым Беккер ы др. понимали движение, обусловленное потоками и геометрией межфазной новерхности. Средняя площадь ячейки возрастает во времени, причем ячейки большого размера растут за счет меньших. Для систем гликоль — ацетат и вода — изобутиловый эфир соотношение между средней площадью и временем было найдено линейным при массопередаче из гликоля или изобутилового спирта. Это означает, что линейный размер ячейки нропорционален корню квадратному из времени. Определяя глубину проникновения в случае молекулярной диффузии как было показано, что поря- [c.236]
Волленвебером [56], а также в других лабораториях [541 для идентификации был опробован анализ методом ХТС, причем было найдено, что приведенные в табл. 82 красители могут быть отчетливо разделены на слоях целлюлозного порошка МК 300 С с использованием одного-единственного растворителя. Растворители I — н-пропанол — этилацетат — вода (60 + 4-10 + 30) [54] и II — 2,5%-ный водный раствор ацетата натрия — 25%-ный раствор аммиака (80 + 20) [56] отличаются по разделительной способности и поэтому с успехом могут быть использованы для двумерной ХТС. Время анализа для растворителя I составляет 90 мин. [c.351]
Растворители I атилацетат-иаопропанол-вода (65+23,5 + 11,5), II бенаол - ледяная уксусная кислота — метанол (20+20+60), III метилэтилкетон — ледяная уксусная кислота — метанол (60+ +20+20), Va н-пропанол - этилацетат - вода - 25%-ный аммиак (50+10+30+10), Vb то же, что Va, но (60+10+30+10), VII н-бутанол - ледяная уксусная кислота - вода (60+30 + 10). [c.455]
VIII хлороформ — ацетон — ледяная уксусная кислота (60 + 30 + 10) (отделение ацетонсорбозы), IX -пропанол — этилацетат — вода (70 + 20 + 10) [6]. [c.458]
Первоначально в куб заливают смесь 92—93 % ной уксус ной кислоты и этилового спирта в молярном соотношении 1 0,2 и 2—3% катализатора — крепкой серной кислоты (считая от 100 % ной уксусной кислоты) После разогрева аппарата и ра боты колонны на себя в течение 1,5—2 ч для создания в си стеме некоторого запаса эфира (состояние равновесия) в куб 4 начинают непрерывно подавать через барботер парожидкост ную смесь исходных компонентов (смешанных заранее в мо лярном соотношении 1 1,1) Одновременно с этим начинают отбор дистиллята (через флорентину) Уровень жидкости в ре акторе поддерживают постоянным, выравнивая подачу исход ной смеси и отбор дистиллята Массовая доля уксусной кислоты в кубе должна быть не ниже 70—75 %, воды 8—13 /о, давление в нижней части колонны 8—9 кПа, температура вверху ко лонны 68—72 °С В реакционной смеси спирта должно быть меньше, чем требуется для образования тройной, нерасслаи вающейся азеотропной смеси Если же дистиллят близок к двойной легкорасслаивающейся смеси этилацетат — вода со става 91,5 8,5% с температурой отгона 70 4 °С, то с этой смесью при определенной величине флегмового числа из реак тора уходит почти вся вода, что сдвигает реакцию в сторону эфирообразования Конденсат, поступающий во флорентину, охлаждается до 20—25 °С Это улучшает условия расслоения его на эфироводу и эфир сырец, при этом снижается и растворимость воды в эфире до 3—4 % [c.126]
Рис 7-38 Хроматофамма экстракта содержащего хелатные комплексы диэ-тилдитиокарбамата кадмия (П) марганца (П) свиица(П) кобальта (П) желе за(Ш) циика(П) и меди(П) Колонка 0 5 мм (внутр диам) х 15 см непод вижиая фаза силикагель, модифицированный ОДС (5 мкм) подвижная фаза метаиол/этилацетат/вода/раствор диэтиддитиокарбамата натрия (О 05 моль/л) (66 5/5/24/5) обьемная скорость 4 мкл/мнн детектор УФ 265 нм объем пробы 0,4 мкл [c.194]
I - этилацетат - вода, насыцеиная этилацетатоы (сплошная фаза) физико-химические свойства систем изменялись в следующих пределах [c.239]
VII-1. Необходимо разделить смесь пропан-1,1-днкарбоновой (В) (50 вес.%) и пропан-1,3-днкарбоновой (С) кислот. Для этого смесь кислот растворяют в насыщенном водой этилацетате и экстрагируют в перекрестном токе насыщенной этилацетатом водой (Л). Коэффициенты распределения равны П1л=2,48 и тс = 0,75 (т = концентрация в воде/концентрация в этил-ацетаге, кг растворенного вещества на 1 кг растворителя). [c.676]
chem21.info
Этилацетат — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
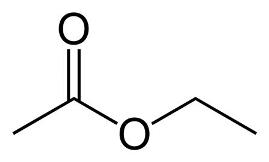
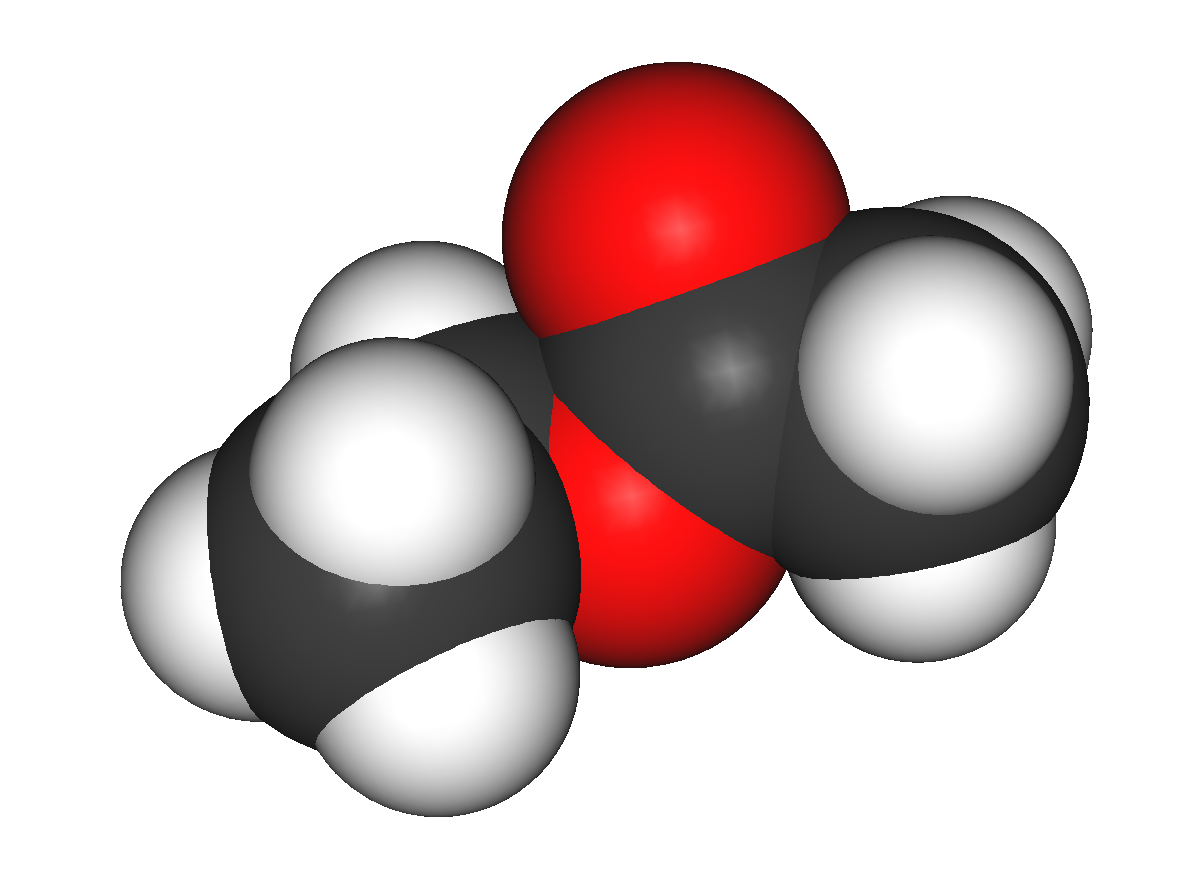 Этилацетат (этиловый эфир уксусной кислоты) СН3-СОО-Ch3-Ch4 — бесцветная летучая жидкость с резким запахом.
Этилацетат (этиловый эфир уксусной кислоты) СН3-СОО-Ch3-Ch4 — бесцветная летучая жидкость с резким запахом.
Получение
Этилацетат образуется при прямом взаимодействии этанола с уксусной кислотой:
<math>\mathsf{CH_3COOH + C_2H_5OH \rightarrow CH_3COOC_2H_5 + H_2O}</math>Лабораторный метод получения этилацетата заключается в ацетилировании этилового спирта хлористым ацетилом или уксусным ангидридом:
<math>\mathsf{CH_3COCl + C_2H_5OH \rightarrow CH_3COOC_2H_5 + HCl}</math>К промышленным способам синтеза этилацетата относятся:
- Перегонка смеси этилового спирта, уксусной и серной кислот.
- Обработке этилового спирта кетеном.
- По реакции Тищенко из ацетальдегида при 0-5 °C в присутствии каталитических количеств алкоголята алюминия:
Физические свойства
Бесцветная подвижная жидкость с резким запахом эфира. Молярная масса 88,11 г/моль, температура плавления −83,6 °C, температура кипения 77,1 °C, плотность 0,9001 г/см³, n204 1,3724. Растворяется в воде 12 % (по массе), в этаноле, диэтиловым эфире, бензоле, хлороформе; образует двойные азеотропные смеси с водой (т. кип. 70,4 °C, содержание воды 8,2 % по массе), этанолом (71,8; 30,8), метанолом (62,25; 44,0), изопропанолом (75,3; 21,0), CCl4 (74,7; 57), циклогексаном (72,8; 54,0) и тройную азеотропную смесь Э.: вода: этанол (т. кип. 70,3 °C, содержание соотв. 83,2, 7,8 и 9 % по массе). [1]
Применение
Этилацетат широко используется как растворитель, из-за низкой стоимости и малой токсичности, а также приемлемого запаха. В частности, как растворитель нитратов целлюлозы, ацетилцеллюлозы, жиров, восков, для чистки печатных плат, в смеси со спиртом — растворитель в производстве искусственной кожи. Годовое мировое производство в 1986 году составляло 450—500 тысяч тонн. Мировое производство этилацетата на 2014 год составляет около 3,5 млн. тонн в год.
Один из самых популярных ядов, применяемых в энтомологических морилках для умерщвления насекомых. Насекомые после умерщвления в его парах гораздо мягче и податливее в препарировании, чем после умерщвления в парах хлороформа.
Применяется как компонент фруктовых эссенций. Зарегистрирован в качестве пищевой добавки E1504.
Лабораторное применение
Этилацетат часто используется для экстракции, а также для колоночной и тонкослойной хроматографии. Редко в качестве растворителя для проведения реакций из-за склонности к гидролизу и переэтерефикации.
Используется для получения ацетоуксусного эфира[2]:
<math>\mathsf{2CH_3COOC_2H_5 \rightarrow CH_3COCH_2COOC_2H_5}</math>Очистка и сушка
Продаваемый этилацетат обычно содержит воду, спирт и уксусную кислоту. Для удаления этих примесей его промывают равным объёмом 5%-го карбоната натрия, сушат хлоридом кальция и перегоняют. При более высоких требованиях к содержанию воды несколько раз (порциями) добавляют фосфорный ангидрид, фильтруют и перегоняют, защищая от влаги. С помощью молекулярного сита 4А содержание воды в этилацетате можно снизить до 0,003 %.
Безопасность
ЛД50 для крыс составляет 11,6 г/кг, показывая низкую токсичность. Пары этилацетата раздражают слизистые оболочки глаз и дыхательных путей, при действии на кожу вызывают дерматиты и экземы. ПДК в воздухе рабочей зоны 200 мг/м³. ПДК в атмосферном воздухе населенных мест 0,1 мг/м³[3].
Температура вспышки — 2 °C, температура самовоспламенения — 400 °C, концентрационные пределы взрыва паров в воздухе 2,1-16,8 % (по объему).
Безопасность при транспортировке. В соответствии с ДОПОГ (ADR) класс опасности 3, код по реестру ООН 1253.
Напишите отзыв о статье "Этилацетат"
Примечания
- ↑ Химическая энциклопедия, Москва 1998, стр. 494
- ↑ Органикум. Том 2. Москва, Мир, 1992, стр. 180
- ↑ [www.dioxin.ru/doc/gn2.1.6.1338-03.htm Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест]
Отрывок, характеризующий Этилацетат
– Наверное? – сказала она. Лицо княгини изменилось. Она вздохнула. – Да, наверное, – сказала она. – Ах! Это очень страшно… Губка Лизы опустилась. Она приблизила свое лицо к лицу золовки и опять неожиданно заплакала. – Ей надо отдохнуть, – сказал князь Андрей, морщась. – Не правда ли, Лиза? Сведи ее к себе, а я пойду к батюшке. Что он, всё то же? – То же, то же самое; не знаю, как на твои глаза, – отвечала радостно княжна. – И те же часы, и по аллеям прогулки? Станок? – спрашивал князь Андрей с чуть заметною улыбкой, показывавшею, что несмотря на всю свою любовь и уважение к отцу, он понимал его слабости. – Те же часы и станок, еще математика и мои уроки геометрии, – радостно отвечала княжна Марья, как будто ее уроки из геометрии были одним из самых радостных впечатлений ее жизни. Когда прошли те двадцать минут, которые нужны были для срока вставанья старого князя, Тихон пришел звать молодого князя к отцу. Старик сделал исключение в своем образе жизни в честь приезда сына: он велел впустить его в свою половину во время одевания перед обедом. Князь ходил по старинному, в кафтане и пудре. И в то время как князь Андрей (не с тем брюзгливым выражением лица и манерами, которые он напускал на себя в гостиных, а с тем оживленным лицом, которое у него было, когда он разговаривал с Пьером) входил к отцу, старик сидел в уборной на широком, сафьяном обитом, кресле, в пудроманте, предоставляя свою голову рукам Тихона. – А! Воин! Бонапарта завоевать хочешь? – сказал старик и тряхнул напудренною головой, сколько позволяла это заплетаемая коса, находившаяся в руках Тихона. – Примись хоть ты за него хорошенько, а то он эдак скоро и нас своими подданными запишет. – Здорово! – И он выставил свою щеку. Старик находился в хорошем расположении духа после дообеденного сна. (Он говорил, что после обеда серебряный сон, а до обеда золотой.) Он радостно из под своих густых нависших бровей косился на сына. Князь Андрей подошел и поцеловал отца в указанное им место. Он не отвечал на любимую тему разговора отца – подтруниванье над теперешними военными людьми, а особенно над Бонапартом. – Да, приехал к вам, батюшка, и с беременною женой, – сказал князь Андрей, следя оживленными и почтительными глазами за движением каждой черты отцовского лица. – Как здоровье ваше? – Нездоровы, брат, бывают только дураки да развратники, а ты меня знаешь: с утра до вечера занят, воздержен, ну и здоров. – Слава Богу, – сказал сын, улыбаясь. – Бог тут не при чем. Ну, рассказывай, – продолжал он, возвращаясь к своему любимому коньку, – как вас немцы с Бонапартом сражаться по вашей новой науке, стратегией называемой, научили. Князь Андрей улыбнулся. – Дайте опомниться, батюшка, – сказал он с улыбкою, показывавшею, что слабости отца не мешают ему уважать и любить его. – Ведь я еще и не разместился. – Врешь, врешь, – закричал старик, встряхивая косичкою, чтобы попробовать, крепко ли она была заплетена, и хватая сына за руку. – Дом для твоей жены готов. Княжна Марья сведет ее и покажет и с три короба наболтает. Это их бабье дело. Я ей рад. Сиди, рассказывай. Михельсона армию я понимаю, Толстого тоже… высадка единовременная… Южная армия что будет делать? Пруссия, нейтралитет… это я знаю. Австрия что? – говорил он, встав с кресла и ходя по комнате с бегавшим и подававшим части одежды Тихоном. – Швеция что? Как Померанию перейдут? Князь Андрей, видя настоятельность требования отца, сначала неохотно, но потом все более и более оживляясь и невольно, посреди рассказа, по привычке, перейдя с русского на французский язык, начал излагать операционный план предполагаемой кампании. Он рассказал, как девяностотысячная армия должна была угрожать Пруссии, чтобы вывести ее из нейтралитета и втянуть в войну, как часть этих войск должна была в Штральзунде соединиться с шведскими войсками, как двести двадцать тысяч австрийцев, в соединении со ста тысячами русских, должны были действовать в Италии и на Рейне, и как пятьдесят тысяч русских и пятьдесят тысяч англичан высадятся в Неаполе, и как в итоге пятисоттысячная армия должна была с разных сторон сделать нападение на французов. Старый князь не выказал ни малейшего интереса при рассказе, как будто не слушал, и, продолжая на ходу одеваться, три раза неожиданно перервал его. Один раз он остановил его и закричал: – Белый! белый! Это значило, что Тихон подавал ему не тот жилет, который он хотел. Другой раз он остановился, спросил: – И скоро она родит? – и, с упреком покачав головой, сказал: – Нехорошо! Продолжай, продолжай. В третий раз, когда князь Андрей оканчивал описание, старик запел фальшивым и старческим голосом: «Malbroug s'en va t en guerre. Dieu sait guand reviendra». [Мальбрук в поход собрался. Бог знает вернется когда.] Сын только улыбнулся. – Я не говорю, чтоб это был план, который я одобряю, – сказал сын, – я вам только рассказал, что есть. Наполеон уже составил свой план не хуже этого.wiki-org.ru
Вода, диметилформамид, диметилсульфоксид, тетрагидрофуран, этилацетат и другие растворители в органической химии
 Это небольшая часть того, что каждый день используется в лаборатории Если вы считаете, что химия - это сливание разных растворчиков вместе, то вы в принципе недалеки от истины. Подавляющее число реакций требуют растворителя - в противном случае реагенты не провзаимодействуют или реакция пройдёт не до конца. Существуют исключения (например, твёрдофазный синтез), а также иногда растворителем является один из реагентов. Но сейчас о более классических случаях. Вода. В отличие от неорганической химии, целый раздел которой посвящён реакциям в водной среде (реакции ионного обмена), в органике далеко не каждый реагент будет растворяться в воде в разумных количествах. В основном в воде ведут реакции с участием неорганических соединений например, реакции окисления). Вода считается относительно химически активной: например, сложные эфиры медленно разлагаются в присутствии воды, не говоря уже об ангидридах кислот, алкоголятах и металлоорганических соединениях. Однако, если в реакции удаётся заменить органический растворитель на воду, то это считается хорошим достижением (особенно в промышленности) и называется "Green Chemistry", поскольку вода впоследствии легко очищается, регенерируется или другим способом утилизируется. Наиболее близкими к воде по свойствам являются, пожалуй, спирты. Но по сравнению с водой, их растворяющая способность (за исключением неорганики) выше. Спирты так же, как и вода, являются полярными, то есть положительные и отрицательные заряды в молекуле расположены неравномерно. Благодаря этому низшие спирты смешиваются с водой и в той или иной степени растворяют неорганические соединения. Также они растворяют жиры и прочие неполярные соединения. Некоторых случаях спирт сам вступает в реакцию, образуя побочные продукты. Преимуществом низших спиртов является лёгкость их выпаривания (особенно под вакуумом), а изопропанол утягивает с собой при этом ещё порядка 15% воды, что позволяет при необходимости легко удалить воду из раствора в довольно щадящих условиях.
Это небольшая часть того, что каждый день используется в лаборатории Если вы считаете, что химия - это сливание разных растворчиков вместе, то вы в принципе недалеки от истины. Подавляющее число реакций требуют растворителя - в противном случае реагенты не провзаимодействуют или реакция пройдёт не до конца. Существуют исключения (например, твёрдофазный синтез), а также иногда растворителем является один из реагентов. Но сейчас о более классических случаях. Вода. В отличие от неорганической химии, целый раздел которой посвящён реакциям в водной среде (реакции ионного обмена), в органике далеко не каждый реагент будет растворяться в воде в разумных количествах. В основном в воде ведут реакции с участием неорганических соединений например, реакции окисления). Вода считается относительно химически активной: например, сложные эфиры медленно разлагаются в присутствии воды, не говоря уже об ангидридах кислот, алкоголятах и металлоорганических соединениях. Однако, если в реакции удаётся заменить органический растворитель на воду, то это считается хорошим достижением (особенно в промышленности) и называется "Green Chemistry", поскольку вода впоследствии легко очищается, регенерируется или другим способом утилизируется. Наиболее близкими к воде по свойствам являются, пожалуй, спирты. Но по сравнению с водой, их растворяющая способность (за исключением неорганики) выше. Спирты так же, как и вода, являются полярными, то есть положительные и отрицательные заряды в молекуле расположены неравномерно. Благодаря этому низшие спирты смешиваются с водой и в той или иной степени растворяют неорганические соединения. Также они растворяют жиры и прочие неполярные соединения. Некоторых случаях спирт сам вступает в реакцию, образуя побочные продукты. Преимуществом низших спиртов является лёгкость их выпаривания (особенно под вакуумом), а изопропанол утягивает с собой при этом ещё порядка 15% воды, что позволяет при необходимости легко удалить воду из раствора в довольно щадящих условиях. 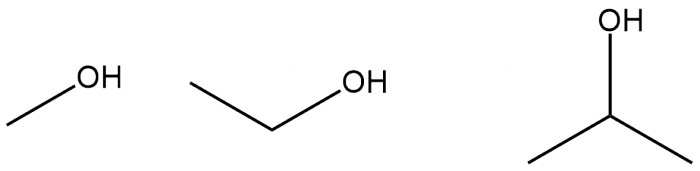 Спирты: метанол этанол, изопропанол Есть курьёзный случай использования а также других алкогольных напитков – по сути растворов спирта в воде как растворителя в реакции. (см. ссылки)
Спирты: метанол этанол, изопропанол Есть курьёзный случай использования а также других алкогольных напитков – по сути растворов спирта в воде как растворителя в реакции. (см. ссылки)Если нужен полярный растворитель (а от полярности растворителя часто зависит скорость и направление протекания реакции), то также можно взять диметилформамид (ДМФ). Это относительно дешёвый растворитель, производящийся промышленностью в огромных количествах. За счёт отсутствия OH-групп ДМФ более химически инертен и в большинстве случаев может быть нагрет аж до температуры кипения (153°С). Однако высокая температура кипения имеет свои минусы: упаривать его имеет смысл только под вакуумом. Зато ДМФ смешивается с водой, поэтому при выделении продукта часто реакционную смесь выливают в воду и отделяют продукт в виде осадка (для твёрдых и нерастворимых соединений), либо в виде отдельного слоя (если продукт-жидкость), либо экстрагируют из получившегося раствора или эмульсии. Хотя на самом деле ДМФ без проблем отгоняется/перегоняется на роторном испарителе при ~35мм.рт.ст.
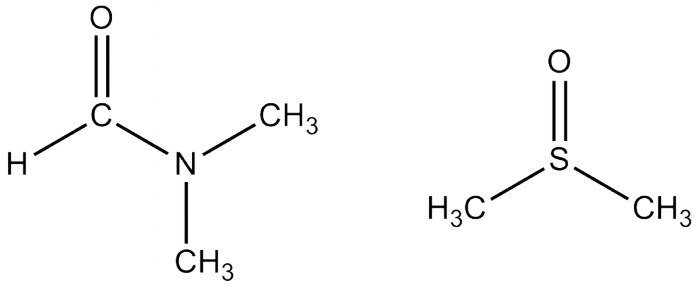 Формулы ДМФ и диметилсульфоксида Ещё один растворитель, смешивающийся с водой - это ДиМетилСульфОксид (ДМСО). ДМСО в чём-то похож на воду: он сильно полярен, вследствие чего растворяет многие неорганические соли. ДМСО смешивается с водой и удивительно нетоксичен: аптечный препарат "димексид" - это чистый диметилсульфоксид. Некоторые неудобства доставляет его высокая температура кипения (189°С) и удивительно высокая температура замерзания (18°С). В большинстве случаев целевой продукт выделяют так же, как и с ДМФ - разбавляя раствор в несколько раз водой. ДМСО, однако, представляет некоторую опасность, т.к. растворённые в нём вещества при попадании на кожу могут беспрепятственно всасываться, что нежелательно, когда это токсичные, ядовитые или раздражающие вещества. Из числа смешивающихся с водой растворителей хочется выделить ТетраГидроФуран, который гораздо менее полярен, чем ДМФ, ДМСО и спирты, но зато более стабилен, поскольку с химической точки зрения является простым эфиром. Кислоты и основания ему нипочём, органику он растворяет отлично (в тяжёлых случаях им можно отмывать посуду, но ДМФ дешевле), при атмосферном давлении кипит при 66°C, что очень удобно. ТГФ - один из немногих растворителей, подходящих для металлорганических соединений (магний- и даже литийорганики). Но он ощутимо дороже большинства растворителей и уже несколько лет считается прекурсором.
Формулы ДМФ и диметилсульфоксида Ещё один растворитель, смешивающийся с водой - это ДиМетилСульфОксид (ДМСО). ДМСО в чём-то похож на воду: он сильно полярен, вследствие чего растворяет многие неорганические соли. ДМСО смешивается с водой и удивительно нетоксичен: аптечный препарат "димексид" - это чистый диметилсульфоксид. Некоторые неудобства доставляет его высокая температура кипения (189°С) и удивительно высокая температура замерзания (18°С). В большинстве случаев целевой продукт выделяют так же, как и с ДМФ - разбавляя раствор в несколько раз водой. ДМСО, однако, представляет некоторую опасность, т.к. растворённые в нём вещества при попадании на кожу могут беспрепятственно всасываться, что нежелательно, когда это токсичные, ядовитые или раздражающие вещества. Из числа смешивающихся с водой растворителей хочется выделить ТетраГидроФуран, который гораздо менее полярен, чем ДМФ, ДМСО и спирты, но зато более стабилен, поскольку с химической точки зрения является простым эфиром. Кислоты и основания ему нипочём, органику он растворяет отлично (в тяжёлых случаях им можно отмывать посуду, но ДМФ дешевле), при атмосферном давлении кипит при 66°C, что очень удобно. ТГФ - один из немногих растворителей, подходящих для металлорганических соединений (магний- и даже литийорганики). Но он ощутимо дороже большинства растворителей и уже несколько лет считается прекурсором. 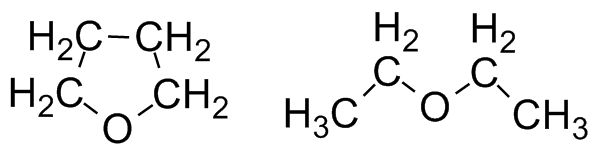 Тетрагидрофуран и диэтиловый эфир С химической точки зрения ближайшим родственником ТГФ можно назвать диэтиловый эфир. Если говорят "эфир", то обычно именно он и подразумевается. Эфир неполярен (в отличие от ТГФ!) и мало растворяется в воде, что позволяет проводить экстракцию органики из водного раствора. Он очень легко испаряется (Ткип 36°С), и надо быть всегда очень осторожным из-за его выдающейся пожароопасности. Ещё из неприятных свойств - у него очень характерный навязчивый запах, а в больших концентрациях пары эфира вызывают наркоз. Но при соблюдении предосторожности эфир очень удобен в работе, а иногда совершенно незаменим. При невозможности купить его - синтезируют из этанола. Говоря об экстракции, приходит на ум ещё один очень распространённый экстрагент - это петролейный эфир, представляющий собой лёгкие фракции бензина. При соответствующих возможностях используют чистый пентан, гексан или гептан. Вообще алканы обладают довольно слабой растворяющей способностью, и в большинстве случаев стоит использовать что-нибудь другое. Набор реакций, которые можно проводить в петролейном эфире, тоже очень ограничен. В основном петролейный эфир используют для очистки веществ - кристаллизации и хроматографии.
Тетрагидрофуран и диэтиловый эфир С химической точки зрения ближайшим родственником ТГФ можно назвать диэтиловый эфир. Если говорят "эфир", то обычно именно он и подразумевается. Эфир неполярен (в отличие от ТГФ!) и мало растворяется в воде, что позволяет проводить экстракцию органики из водного раствора. Он очень легко испаряется (Ткип 36°С), и надо быть всегда очень осторожным из-за его выдающейся пожароопасности. Ещё из неприятных свойств - у него очень характерный навязчивый запах, а в больших концентрациях пары эфира вызывают наркоз. Но при соблюдении предосторожности эфир очень удобен в работе, а иногда совершенно незаменим. При невозможности купить его - синтезируют из этанола. Говоря об экстракции, приходит на ум ещё один очень распространённый экстрагент - это петролейный эфир, представляющий собой лёгкие фракции бензина. При соответствующих возможностях используют чистый пентан, гексан или гептан. Вообще алканы обладают довольно слабой растворяющей способностью, и в большинстве случаев стоит использовать что-нибудь другое. Набор реакций, которые можно проводить в петролейном эфире, тоже очень ограничен. В основном петролейный эфир используют для очистки веществ - кристаллизации и хроматографии. 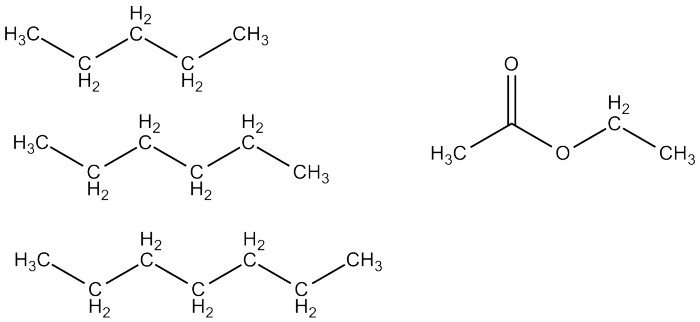 Некоторые из компонентов петролейного эфира и этилацетат (справа) Хорошим экстрагентом является, например, этилацетат (этиловый эфир уксусной кислоты). Он относительно дёшев и нетоксичен, хотя и напоминает запахом лак для ногтей. Он растворяет довольно широкий спектр различной органики, но не очень стоек - в присутствии кислоты или щёлочи распадается, что, кстати, ограничивает возможности экстракции. Смеси этилацетата с петролейным эфиром в разных соотношениях используют для хроматографического разделения веществ, и на это занятие можно спокойно извести за день по нескольку литров каждого компонента. Продолжая тему несмешивающихся с водой растворителей, было бы неправильно обойти стороной хлорорганические растворители: дихлорметан и хлороформ. Они растворяют широкий спектр органики (вплоть до солей аминов), практически не растворяют в себе воду и очень легко испаряются (Ткип 40°С и 61°С соответственно). Важным отличием их является плотность: оба они почти в полтора раза плотнее воды, и поэтому при экстракции органический слой оказывается внизу, что иногда бывает удобно.
Некоторые из компонентов петролейного эфира и этилацетат (справа) Хорошим экстрагентом является, например, этилацетат (этиловый эфир уксусной кислоты). Он относительно дёшев и нетоксичен, хотя и напоминает запахом лак для ногтей. Он растворяет довольно широкий спектр различной органики, но не очень стоек - в присутствии кислоты или щёлочи распадается, что, кстати, ограничивает возможности экстракции. Смеси этилацетата с петролейным эфиром в разных соотношениях используют для хроматографического разделения веществ, и на это занятие можно спокойно извести за день по нескольку литров каждого компонента. Продолжая тему несмешивающихся с водой растворителей, было бы неправильно обойти стороной хлорорганические растворители: дихлорметан и хлороформ. Они растворяют широкий спектр органики (вплоть до солей аминов), практически не растворяют в себе воду и очень легко испаряются (Ткип 40°С и 61°С соответственно). Важным отличием их является плотность: оба они почти в полтора раза плотнее воды, и поэтому при экстракции органический слой оказывается внизу, что иногда бывает удобно.  Дихлорметан и хлороформ Дихлорметан считается относительно безопасным растворителем, а вот хлороформ может вызывать серьёзные отравления и повреждение печени, поэтому без вытяжки работать с ним не рекомендуется. Это, однако, не мешало ему когда-то использоваться как средство для ингаляционного наркоза. Также хлороформ при стоянии на воздухе и свету образует примесь фосгена, которая и является, скорее всего, основной причиной токсичности. Храните ваш хлороформ в тёмном и прохладном месте! Для поиска свойств растворителей удобнее всего использовать Wikipedia, но можно использовать бумажные справочники (см. ниже), а также каталоги поставщиков хим. реактивов, например:
Дихлорметан и хлороформ Дихлорметан считается относительно безопасным растворителем, а вот хлороформ может вызывать серьёзные отравления и повреждение печени, поэтому без вытяжки работать с ним не рекомендуется. Это, однако, не мешало ему когда-то использоваться как средство для ингаляционного наркоза. Также хлороформ при стоянии на воздухе и свету образует примесь фосгена, которая и является, скорее всего, основной причиной токсичности. Храните ваш хлороформ в тёмном и прохладном месте! Для поиска свойств растворителей удобнее всего использовать Wikipedia, но можно использовать бумажные справочники (см. ниже), а также каталоги поставщиков хим. реактивов, например:http://www.merckmillipore.com/RU/ru/product/Diethyl-ether,MDA_CHEM-100931?https://www.alfa.com/ru/catalog/042254/http://www.sigmaaldrich.com/catalog/product/sial/276855?lang=en®ion=RU
Справочники:CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010.Справочник по растворимости. - М.-Л.: ИАН СССР, 1962.Справочник химика. - Л.-М.: Химия, 1964.
Журнал “Green Chemistry”: http://pubs.rsc.org/en/journals/journalissues/gc#!recentarticles&advРеакции в пиве и прочих напитках: https://www.chemistryworld.com/news/alcoholic-drinks-perfect-solvents-for-polymerisation-/6682.article
chemiday.com
Этиловый спирт — вода — этилацетат)
Так, при нагревании влажного толуола сначала при постоянной температуре 84,1 °С перегоняется смесь толуола с 19,6% (масс.) воды. Когда таким образом будет удалена вся влага, температура паров повышается до 110,5 °С и перегоняется безводный толуол. Использование эффективных колонок или дефлегматоров (см. стр. 143) облегчает разделение азеотропных смесей. Подобным образом могут быть высушены четыреххлористый углерод, этилацетат, дихлорэтан, бензол и его гомологи, гексан, анилин, нитробензол, диметилформамид и многие другие растворители. Способностью указанных жидкостей образовывать азеотропные смеси с водой пользуются для осушки ряда других растворителей, например для получения абсолютного, т, е. безводного, этилового спирта. Азеотропная смесь спирта с водой перегоняется при 78,15 °С и содержит 4,4% (масс.) воды. Таким образом, при ректификации сырого спирта он [c.164] Этилацетат — этиловый спирт — вода [14] [c.231]Азеотропная смесь этилацетат — этиловый спирт — вода конденсируется в теплообменнике 3 и конденсаторе 4. Часть конденсата возвращается на верхнюю тарелку эфиризатора, а основная масса направляется в ректификационную колонну 5. Кубовый продукт этой колонны, состоящий преимущественно из спирта и воды, поступает на одну из нижних тарелок реактора 2, а погон конденсируется в аппарате б, разбавляется приблизительно равным по объему количеством воды, необходимой для расслоения конденсата, и попадает в сепаратор 7. Нижний (водный) слой из аппарата 7 подается на одну из средних тарелок колонны 5, а верхний (органический) направляется в ректификационную колонну S, в которой от эфира отгоняется низкокипящий тройной азеотроп эфир—спирт—вода, возвращаемый в колонну 5. Этилацетат из куба колонны 8 направляется на окончательную очистку. Суммарный выход эфира приближается к 95% от теоретически возможного. [c.240]
Этиловый спирт — вода — этилацетат [32] [c.249]
Технологическая схема производства этилацетата представлена на рис. 7.11. Смесь уксусной кислоты, этилового спирта и серной кислоты из смесителя 1 непрерывно поступает на верхнюю тарелку колонны-эфиризатора 2, в куб которой подается острый пар. Образующийся этилацетат вместе с парами воды и спирта отгоняется с верха колонны, а жидкость по мере продвижения вниз по тарелкам обогащается водой. Благодаря отгонке летучего компонента и избытку спирта этернфикация протекает почти до полного превращения уксусной кислоты. [c.240]
Белый кристаллический порошок т. пл. 133° С Практически нерастворим в воде. Хорошо растворим в этиловом спирте, ацетоне, этилацетате, хлористом метилене, четыреххлористом углероде и бензоле. Слабо растворим в бензине. Относительно мало токсичен. Относится к числу неокрашивающих стабилизаторов. [c.43]
Для некоторых процессов в водных растворах вода является непосредственным участником реакции. Примером наиболее изученных реакций подобного типа является гидролиз ( расщепление водой ) этилацетата с образованием уксусной кислоты и этанола (этилового спирта [c.208]
Превращение одноосновных алифатических спиртов в соответствующие эфиры, например этилового спирта в этилацетат (60%), пропилового спирта в пропилпропионат (55%) и бутилового спирта в бутилбутират (70%), при 180 — 350° ведется с медным катализатором, приготовляемым осаждением раствора уксуснокислой меди раствором щелочи при 50—95° и последующим добавлением 0,5—7,0% уксуснокислого урана в отфильтрованный осадок. Затем осадок обрабатывают концентрированным раствором едкого натра полученный черный осадок промывают сначала холодной водой, а затем водой, нагретой до 70 —80°, после чего его высушивают при 120 —200°, превращают в порошок и нагревают в токе водорода до 200 — 300° [231]. [c.299]
ЭТИЛАЦЕТАТ—ЭТИЛОВЫЙ СПИРТ—ВОДА [c.447]
С в о ii с т в а. М.— бесцветные кристаллы без запаха т. пл. 111 °С теплота полимеризации 56,57 кдж/моль (13,5 ккал/.иоль). М. хорошо растворим в воде, метиловом и этиловом спиртах, ацетоне, этилацетате плохо — в гептане, бензоле, толуоле. [c.89]
ЭТИЛАЦЕТАТ —этиловый СПИРТ —ВОДА [c.354]
Легко растворим в хлористом метилене растворим в бензоле плохо растворим в четыреххлористом углероде, этилацетате, ацетоне практически нерастворим в бензине, этиловом спирте, воде [c.410]
Растворимость Растворим в метиленхлориде плохо растворим в бензоле четыреххлористом углероде, этилацетате, ацетоне, бензине практически нерастворим в этиловом спирте, воде Очень хорошо растворим в бензоле, четыреххлористом углероде, метиленхлориде легко растворим в ацетоне растворим в этилацетате плохо растворим в бензине, этиловом спирте практически нерастворим в воде [c.418]
Белый порошок со слабым характерным запахом d= 1,08 т. пл. 124° С. Легко растворяется в этиловом спирте, ацетоне, этилацетате, четыреххлористом углероде и бензоле, трудно — в бензине практически нерастворим в воде. Растворимость в каучуке 2%. Нетоксичен. Нелетуч. Стабилен при хранении. При длительном хранений может приобрести рыжевато-коричневый оттенок, что, однако, не отражается на защитном действии и на цвете резин. [c.342]
Белый кристаллический порошок d = 1,08 т. пл. 118° С. Растворим в этиловом спирте, ацетоне, этилацетате, четыреххлористом углероде и бензоле трудно растворяется в бензине, практически нерастворим в воде. Нетоксичен. Нелетуч. Стабильность при хранении неограниченная. [c.343]
Желтовато-белый порошок =1,42 т. пл. 290° С. Растворим в этиловом спирте, ацетоне, этилацетате нерастворим в четыреххлористом углероде, бензоле, бензине, воде. Стабилен при хранении. [c.347]
Сопоставляя различные методы выбора разделяющих агентов, необходимо иметь в виду, что все свойства растворов взаимосвязаны и их значения определяются свойствами компонентов и интенсивностью их взаимодействия друг с другом. Поэтому о характере отклонений от идеального поведения Можно судить не по одному, а по ряду свойств. Так, к заключению о пригодности воды в качестве разделяющего агента для системы этиловый спирт — этилацетат можно прийти, основываясь на том, что смеси этилацетата и воды имеют более низкие температуры кипения, чем такого же состава смеси этилового спирта и воды. К этому же выводу можно прийти, основываясь на том, что азеотроп этилацетат — вода имеет более глубокий минимум температуры кипения, а также принимая во внимание наличие ограниченной взаимной растворимости в системе этилацетат — вода, в противоположность системе этиловый спирт — вода. Все методы выбора разделяющих агентов по свойствам растворов практически равноценны. Выбор того или иного метода в каждом конкретном случае определяется степенью полноты имеющихся данных о свойствах растворов и трудностью их экспериментального определения. [c.100]
Получены хорошие результаты при определении ацетона с применением в качестве реактива солянокислого гидроксиламина и индикатора метилкрасного. Реактив (1—2 г) растворяют в конической колбе емкостью 200 мл в небольшом количестве воды и нейтрализуют по метилкрасному. Затем прибавляют анализируемое вещество и смесь титруют 0,1 н. раствором едкой щелочи. Автор считает, что для анализа проб, содержащих этиловый спирт или этилацетат, этот метод лучше, чем иодометрический метод. [c.281]
Этилацетат. . . Этиловый спирт Вода..... [c.103]
Белый порошок с характерным запахом т. пл. 112°С. Растворяется в бензоле, четыреххлористом углероде, хлористом метилене, сероуглероде. Ограниченно растворяется в этилацетате, ацетоне. Практически не растворяется в бензине, этиловом спирте, воде. Устойчив при хранении- Нетоксичен. [c.149]
Пары этилового спирта, бензола, этилацетата, бутилацетата и воды поступают по медному трубопроводу в медный трубчатый конденсатор, а образовавшийся конденсат идет в стальной отстойник (диаметр 1 м, высота [c.199]
Из сказанного следует, что прибегать к перегонке можно, только составив полное представление о при- роде возможных примесей и их относительной летучести. Во многих случаях вещество может быть получено с меньшими затратами труда и в более чистом виде, если перегонку совместить с другими методами очистки. Например, технический этилацетат в качестве основных примёсей содержит этиловый спирт, уксусную кислоту и воду. В соответствии с этим один из возможных методов его очистки включает в себя обработку хлоридом кальция для поглощения спирта и большей части воды, обработку безводным поташом для удаления следов кислоты и дальнейшей сушки, выдержку над цеолитами для окончательной сушки и, наконец, перегонку для освобождения от возможных нелетучих примесей. [c.129]
Изопропиловый спирт Циклогексиловый спирт Циклогексилацетат Этиллактат Диизопропилкетои Смесь этилового спирта и этилацетата Этиловый спирт безводный Смесь этилового спирта (85%). этилацетата (6%). бутилового спирта (3%) и бензола (6%) Циклогексаион Четыреххлористый углерод Диэтилацеталь Смесь бензола и амилового спирта Четыреххлористый углерод Композиция из нерастворимых в воде оргаии ческих растворителей (т. кип. 157—182 С) Бутиллактат Бутилцеллозольв Дипропнлкетон З-Метоксибутилацетат Бутилбутират [c.150]
Разделение фаз может быть также иногда вызвано добавлением одной из составных частей азеотропа. Например, тройная азеотропная смесь этилацетат—этиловый спирт—вода представляет собой гомогенную жидкость при комнатной температуре. Однако после добавления избытка воды получаются два слоя один, состоящий в основном из воды и этилацетата, и другой—из этанола и воды, насыщенный этилацетатом. Первый водно-этилацетатовый слой при комнатной температуре содержит вдвое меньше воды по сравнению с двойным азеотропом. Поэтому разгонкой можно получить в остатке этилацетат, свободный от воды вода удаляется в виде нижекипящего двойного азеотропа. [c.310]
Образование амидной связи. Лучшим растворителем для реакции образования амидной связи является абсолютный этилацетат. При использовании гидроксилсодержащих растворителей выходы бывают низкими, а в бензоле, хлороформе, диоксане и ацетонитриле реакция протекает сравнительно медленно. Этиленгликоль, который обычно является катализатором аминолиза сложного эфира, уменьшает скорость аминолиза цианметилового эфира гиппуровой кислоты [302]. В идентичных условиях М-бензилгиппуриламид был получен из цианметилового эфира гиппуровой кислоты в этилацетате с выходом 82%, в метиловом спирте — с выходом 60%, в смеси этиловый спирт — вода (1 -))—с выходом 56% и в смеси диметилформамид — вода (2 3)—с выходом 74% [316]. [c.254]
Из смесей этого типа техническое значение ил1еют следующие смеси этиловый спирт-бензол-вода этилацетат-этиловый спирт-бензол хлоро-форм-этиловый спирт-вода и др. [c.53]
Смесь этилацетат-этиловый спирт-вода, имеющая значение в дермантинном производстве, представляет собой пример смеси трех неограниченно растворимых друг в друге жидкостей, обладающей максимумом упругости паров. Этот максимум имеет место при следующем составе раствора [c.54]
Часто употреб.пяются смеси метиловый спирт — вода, этиловый спирт — вода, ацетон — вода. Они имеют то преимущество, что компонент с большой растворяющей способностью является и более летучим (исключение представляют сахара). Обратное явление наблюдается в часто употребляемых смесях этилового спирта, бензола, этилацетата с фракциями петролейного эфира. При отгонке и концентрировании летучей части вещество сде,па-лось бы еще легче растворимым в остатке. Об этом пе нужно забывать. При изготов,лепии растворов в подобных смесях растворение начинают в слабо растворяюще жидкости, а затем осторожно, иногда каплями, прибавляют сильны растворитель до полного растворения вещества. Чтобы из маточных растворов такого рода добыть растворенное вещество, лучше всего выпарить маточный раствор досуха. [c.113]
ЭТИЛАЦЕТАТ-этиловый СПИРТ—ВОДА № 797 С Нзба—СаНбО-НаО [c.354]
Этанол (метилкарбинол, этиловый спирт) — бесцветная подвижная жидкость с жгучим вкусом и характерным запахом. Температура кипения этанола 78,4°С, температура плавления -114,15°С, плотность 0,794 т/м . Этанол смешивается во всех отношениях в водой, спиртами, глицерином, диэтиловым эфиром и другими органическими растворителями. С некоторыми из них (водой, бензолом, этилацетатом, хлороформом) он образует азеотропные смеси различного состава. Азеотропная смесь с водой, содержащая 95,6% об. этанола, кипит при постоянной температуре 78,1°С. Поэтому, для получения безводного ( абсолютного ) этанола в промышленности используют специальные методы его обезвоживания, например, абсолютирование бензолом. Этанол образует алкоголяты с солями кальция и магния, например СаС12 4С2Н50Н и МяСЬ бСгНбОН. [c.270]
Для получения ПаГС с закономерно уменьшающейся концентрацией компонентов применяют многократную замену равновесной газовой фазы на чистый газ. Статический метод позволяет получать микроконцентрации ПаГС ацетона, метил-этилкетона, этилового спирта, диоксана, этилацетата, бутил-ацетата, бензола, толуола и других летучих веществ в воздухе. Статический метод при использовании в качестве растворителя воды и при 25 °С создает РаГС с закономерно уменьшающимся содержанием ароматических углеводородов и ряда кислородсодержащих соединений в интервале концентраций от 3,74 10 до 16 мг/м . [c.44]
При пользовании безводным этиловым спиртом получается этилацетат, а уксусная кислота образуется в незначительном количестве. Офазование уксусной кислоты в этом случае происходит исключительно за счет воды, выделяющейся при побочных реакциях. Так например, вследствие реакции ацетальдегида со спиртом получается некоторое количество ацеталя и воды [c.199]
Методы получения эфиров первой группы могут быть проиллюстрированы на примере синтеза этнлацетата — многотоннажного продукта, используемого как растворитель для СК, эфиров целлюлозы и т. д. Этилацетат, этиловый спирт и вода образуют азеотропную смесь, кипящую при 72 °С и содержащую около 83% (масс.) эфира, 8,5% воды и 8,5% спирта. [c.240]
chem21.info
Этилацетат определение воды - Справочник химика 21
Сопоставляя различные методы выбора разделяющих агентов, необходимо иметь в виду, что все свойства растворов взаимосвязаны и их значения определяются свойствами компонентов и интенсивностью их взаимодействия друг с другом. Поэтому о характере отклонений от идеального поведения можно судить не по одному, а по ряду свойств. Так, к заключению о пригодности воды в качестве разделяющего агента для системы этанол—этилацетат можно прийти, основываясь на том, что смеси этилацетата и воды имеют более низкие температуры кипения, чем такого же состава смеси этанола и воды. К этому же выводу можно прийти, основываясь на том, что азеотроп этилацетат—вода имеет более глубокий минимум температуры кипения, а также принимая во внимание наличие ограниченной взаимной растворимости в системе этилацетат—вода, в противоположность системе этанол—вода. Из этого следует, что все методы выбора разделяющих агентов по свойствам растворов практически равноценны. Выбор же того или иного метода должен в каждом конкретном случае определяться степенью полноты имеющихся данных о свойствах растворов и трудностью их экспериментального определения. [c.71] Муравьиная кислота в присутствии уксусного ангидрида быстро дегидратируется [уравнение (2.23)]. Соединения с двойными связями, включая ароматические соединения и фураны, мешают определению гидроксилсодержащих соединений в методиках с использованием этилацетата (растворитель), так как при этом частично реагируют с уксусным ангидридом. К другим классам соединений, мешающим при определении воды и гидроксильных групп, относятся альдегиды, первичные амиды, имиды, гидразины, оксимы, амины и меркаптаны, так как все они в различной степени частично реагируют с уксусным ангидридом. [c.52]Таким путем были получены удовлетворительные результаты (в пределах 5%) при определении воды в бензоле, циклогексане, спиртах, кетонах, этилацетате, четыреххлористом углероде и диизопропиловом эфире [210]. [c.304]
НИИ воды 0,3—2,5%. Была также показана возможность определения воды в ацетоне, гидропероксиде кумола и изопропаноле после 20-кратного разбавления образцов этилацетатом. Поглощение измерялось при 3640 см- . Чувствительность метода составляла 0,5%. Эта методика не пригодна для анализа спиртов. При использовании в качестве разбавителя этилацетата для каждого спирта необходимо построение собственного градуировочного графика. [c.426]
Задача систематического исследования химического равновесия сводилась на первом этапе к экспериментальному определению равновесных составов. Эксперименты по изучению равновесия реакций этерификации и гидролиза изучаемой системы этилацетат — этанол — вода — уксусная кислота проводились в термостатированном сосуде с мешалкой [1], при температуре 70°. [c.51]
Взятый для определения этилацетат сушили, а затем перегоняли над пятиокисью фосфора после обработки этилацетат содержал воды не более 0,1 % и спирта 0,2%. [c.344]
Скорость реакции достаточно велика, что позволяет использовать эту реакцию в титриметрических методах. Конечную точку титрования устанавливают, пользуясь в качестве внешнего индикатора спиртовым раствором гидрохлорида гидроксиламина и хлорида железа (HI), которые с ангидридами кислот образуют гидроксамат железа фиолетового цвета, (см. раздел П-Е гл. 6). Этот метод был использован для определения воды в уксусной кислоте, ацетонитриле, этилацетате, ацетоне, бензоле, четыреххлористом углероде и спиртах. Определять воду в аминах этим методом нельзя из-за образования солей с хлорной кислотой. Необходимость работать с внешним индикатором делает метод мало подходящим для анализа в микромасштабе. [c.434]
Определение примеси железа роданидным методом возможно с применением этилацетата при исходной кислотности в растворе 0 05—0,1 М и концентрации роданида 0,5—1,0 М. Равновесие экстракции устанавливается за 1—2 мин. Молярный коэффициент поглощения равен 1,8-10 . Метод имеет предел обнаружения (5—10)-10- % (масс.), но низкую воспроизводимость (см. табл. 3.6, 3.7). Растворимость этилацетата в воде высока — [c.99]
Методы определения и очистки. Антибиотик очищают путем противоточного распределения между этилацетатом и водой с последующей перекристаллизацией из этилацетата [75]. [c.195]
Вода в больших количествах также может мешать выполнению анализа растворителей. Ее обнаруживают по образованию мути или собирающихся на дне капель при смешении растворителя с избытком углеводородов. Низшие спирты способствуют удерживанию в растворе больших количеств воды, чем такие растворители, как, например, сложные эфиры. Бензин, состоящий в основном из алифатических углеводородов, удерживает меньшие количества воды, нежели бензол. Весьма малые количества воды, а в смесях, содержащих мало спиртов, даже следы, ее находят при помощи прозрачного раствора этилата алюминия в этилацетате. Этилат алюминия гидролизуется водой до гидроокиси алюминия, которая осаждается в виде мути. Большие количества спиртов препятствуют этой реакции. Для обнаружения и количественного определения воды наиболее пригоден реагент К. Фишера (стр. 321). [c.936]
Титрование реактивом Фишера представляет собой единственный метод, универсально применимый для определения воды в сложных эфирах и в близких к ним веществах. Большинство других методов обычно неприменимо для низших эфиров, вследствие высокого давления их паров и легкости, с которой эти соединения подвергаются гидролизу. В литературе опубликовано мало экспериментальных данных относительно определения воды в сложных эфирах. Однако некоторые исследователи указывали на то, что метод Фишера может быть применен и для этих соединений [4, 29]. Сообщая, что этилацетат можно анализировать на содержание воды по методу Фишера, Кауфман и Функе [34] утверждают, что для этого соединения неизвестно ни одного другого пригодного метода. Для низших эфиров муравьиной кислоты, действительно, пригоден только метод Фишера, однако этилацетат может быть проанализирован на содержание воды и другими методами, например методом, основанным на применении хлористого ацетила [26], при котором гидролиз происходит при сравнительно мягких условиях. Типичные представители сложных эфиров, лактонов, карбаматов, ортоэфиров, а также эфиров неорганических кислот, определение воды в которых было произведено в лаборатории авторов, приведены в табл. 28. [c.119]
Гарди, Боннер и Нойес С76] сравнили четыре разных метода определения воды в не содержащих растворителей нитроглицериновых порохах (т. е. в смесях нитроцеллюлозы с нитроглицерином, к которым добавлены небольшие количества стабилизаторов, пластификаторов и неорганических солей). По первому методу 10 г образца толщиной 1—2 мм помещали в эксикатор над концентрированной серной кислотой эти образцы выдерживали в эксикаторе до постоянного веса. Для анализа требовалось по меньшей мере 4 дня, однако время фактической занятости лица, проводящего анализ этим методом, было меньше, чем в случае применения любого из других изученных методов. По второму методу 10 г образца (такой же толщины) помещали на алюминиевую пластинку, плотно прикрываемую стеклянной воронкой, и переносили в баню, нагреваемую паром при атмосферном давлении (баня закрытая). Через 2 часа образец вынимали из бани и охлаждали в течение ночи в эксикаторе [77]. Третий метод был основан на азеотропной перегонке с четыреххлористым углеродом для анализа брали 100 г образца. При четвертом методе применяли титрование реактивом Фишера образцы весом по 5 г, толщиной приблизительно 1 мм, вносили 6 колбу для электрометрического титрования (см. стр. 81), содержавшую 60 мл предварительно оттитрованной смеси из 1 части эфира и 1 части метанола или из 1 части пиридина и 1 части этилацетата. Смесь перемешивали в течение 30—60 мин., затем добавляли определенный. избыток реактива Фишера и после 1 мин. перемешивания электрометрически оттитровывали стандартным раствором воды в метаноле. Результаты, полученные тремя из этих четырех методов, приведены в табл. 83 истинное содержание воды в образцах было неизвестно. В этой же таблице приведены дополнительные данные, полученные при исследовании образцов, предварительно высушенных до постоянного веса, к которым затем были прибавлены известные количества воды. Гарди с сотрудниками [76] пришли к выводу, что метод высушивания и метод титрования реактивом Фишера являются наилучшими. [c.224]
Работа 4. Определение диметилформамида и этилацетата в сточных водах [c.198]
Работа 5. Определение этилацетата и этанола в сточных водах [c.199]
Определение состава смеси сахаров. Исследованию подвергают одну из следующих смесей 1 %-ных растворов сахаров в 15%-ном спирте глюкоза — лактоза ксилоза — лактоза смесь всех трех сахаров. Растворы сахаров наносят, как описано в предыдущей работе, на хроматографическую пластинку размером 25 х75 мм или 45 х 120 мм с закрепленным слоем силикагеля. В качестве элюента используют смесь этилацетата и 65 %-ного водного раствора 2-пропанола 1 1. После хроматографирования высушенную пластинку опрыскивают раствором, приготовленным из 0,93 г анилина, 1,66 г фталевой кислоты и 100 мл насыщенного водой 1-бутанола, затем пластинку нагревают так же, как в предыдущей работе. В тех местах, где находятся сахара, появляются коричневые пятна. Находят значения R , сравнивают их между собой и определяют состав исследуемой смеси. [c.270]
Для определения содержания урана как в соленых, так и пресных водах в качестве соосадителя урана можно применять фосфат алюминия [92]. Осадок фосфатов растворяют в азотной кислоте, и уран из раствора экстрагируют этилацетатом в присутствии нит-рата алюминия. По данным Смита и Гримальди, прн однократном осаждении фосфата алюминия в осадок переходит более 95 0 урана. [c.162]
Для гравиметрического определения воды в органических растворителях Хенле [168] отделял гидроксид алюминия фильтрацией, прокаливал осадок при температуре выше 300 °С и взвешивал получающийся оксид алюминия. Автор сообщает, что предел обнаружения воды составляет 0,05% для этанола 0,1% для метанола 0,005% для диэтилового эфира 0,1% для этилацетата и ацетальдегида и 1% для ацетона [168]. [c.187]
Применение пористых полимерных сорбентов позволило улучшить форму пиков воды при газохроматографических определениях. Относительная ошибка определения воды в пропаноле при использовании порапака К (140 С) составляла 20% при размере пробы 0,01 мг, а для пробы массой 1 мг — 8% [213]. Используя колонку с порапаком р при 110 °С, Коттон и сотр. [88] определяли 5—10 мг воды в 50 мл раствора хлорофилла с воспроизводимостью 10%. Сообщают также о применении порапака рЗ для определения 0,15 мг воды в 1 мл раствора декстрана [223]. Хоган и сотр. [144] установили, что при использовании порапака Q содержание воды Б 100 мл органического растворителя, равное 1 мг, может быть определено правильностью около 20%. Гоух и Симпсон [126] пришли к заключению, что количественное элюирование воды и этанола осуществляется лишь при концентрации воды не менее 35%. Это побудило их исследовать влияние размера пробы и содержания воды на процесс элюирования воды и спирта из колонок с пористым полимерным сорбентом [127]. В ходе работы были изучены порапак Q, порапак QS и порапак Р-НМОЗ (обработанный гексаметилдисилазаном). При этом отмечали существенное изменение количества адсорбированных продуктов при переходе от одной партии порапака к другой. Такое заключение было сделано на основании экспериментов с использованием ВзО и последующим анализом покидающих колонку продуктов при разных температурах методом масс-спектрометрии. При выборе соответствующего наполнителя колонки можно было удовлетворительно определять концентрацию воды до 1%. Установлено, что термическая обработка или силанизация наполнителя колонки по существу не улучшает полноту элюирования. Однако Селлерс [263] получал удовлетворительные результаты при определении воды в органических жидкостях при ее концентрации порядка нескольких миллионных долей с применением колонки с порапаком Р при 100 °С или с порапаком ф при 120 °С. В этой работе были применены колонки из нержавеющей стали размером 170x0,6 см. После заполнения колонок сорбентом их кондиционировали в течение 12 ч при 180 С. При определении воды в гексане, бензоле, дихлорэтане и этилацетате в диапазоне концентраций от 10 млн до 4% воспроизводимость составляла 3%, [c.327]
Содержание воды определяли по градуировочному графику. При анализе 12 образцов с содержанием воды 0,1—0,6% ошибка определения составляла в среднем 0,04%. Пирсон [190] отмечает, что закон Ламберта—Бзра выполнялся до содержания воды в этилацетате 0,42%. Отклонения от линейности вне этого интервала обусловлены ассоциацией молекул воды. Имеются данные об аналогичных отклонениях при определении воды в метилацетате и этилпропионате [190]. [c.420]
В соответствии с данными Вендта [254], измерение поглощения в ближней ИК-области спектра примерно при 1 мкм можно использовать для определения воды в ацетоне, уксусной кислоте, метаноле, этаноле, глицерине и пиридине. Излучение нужной длины волны для работы с сернистосеребряным фотоэлементом выделялось с помощью специального фильтра. Содержание воды определялось с помощью набора стандартных кривых, полученных при анализе смесей известного состава. Такая же методика может быть использована для определения воды (вплоть до насыщения) в бутаноле, этилацетате, диэтиловом эфире, бензоле, толуоле и хлороформе. В работе Александрова [4] показано, что использование для определения воды измерений интегральной интенсивности поглощения в интервале 700—200 см эквивалентно по чувствительности измерениям при 3600 см" , а также при более высокой частоте 5200 см . [c.422]
Этилацетат, определение в воздухе 6703 воды в нем 3357 Этилглиоксаль, полярография 6699 [c.401]
При обнаружении реактивом Т-171 чувствительность определения составляет 0,5 мкг. Глюкуроновую, галакту-роновую, гулуроновую и маннуроновую кислоты, лактоны маннуроновой и гулуроновой кислот разделяли методом двойного элюирования смесью этилацетат—пиридин—вода (2 1 2) на целлюлозе ММЗООНН [113]. [c.570]
Штейнеггер и ван дер Вальт [165] разделили на силикагеле некоторые сердечные гликозиды, полученные из подснежника, применив в качестве растворителя верхнюю фазу смеси этилацетат—пиридин—вода (5 1 4), а Штейдле [166] провел количественное определение соединений этой группы. Разделяющим растворителем служил метилэтилкетон, насыщенный водой. Соединения элюировали с пластин и анализировали элюат спектрофотометрически. [c.221]
Проведенные нами предварительные эксперименты по экстракции фосфат-ионов различными органическими растворителями показали, что наиболее приемлемым является этилацетат. К аликвотной части раствора для образования фосфорномолибденовой кислоты в зависимости от содержания фосфатов Р2О5) добавляли по частям рассчитанное количество молибденовой жидкости [7] исходя из того, что введение 1. ил этой жидкости, как нами установлено экспериментально, дает возможность экстрагировать 1 мг Р2О5. Необходимость внесения молибденовой жидкости определенными порциями обусловлена стремлением избежать выпадения осадка фосфоромолибдата аммония, так как в этом случае фосфор не переходит в органическую фазу. Каждая добавляемая порция молибденовой жидкости должна приводить к образованию в растворе фосфорномолибденовой кислоты (не более 3—5 мг в пересчете на Р2О5). В этом случае образования осадка не наблюдается и кислота количественно экстрагируется этилацетатом. Количество этилацетата, вносимого в делительную воронку, должно обеспечивать полную экстракцию гетерополикислоты. Отношение органической фазы к водной находилось в пределах 3 1—2 1. Необходимую для количественной экстракции величину pH 0,6 поддерживали введением едкого кали. После экстракции фосфорномолибденовой гетерополикислоты водный слой, находящийся в нижней части делительной воронки, полностью переносится в мерную колбу и доводится до метки водой. Необходимость применения мерной колбы обусловлена значительной растворимостью этилацетата в воде (8,6 г/100 г воды при 20°С), что вызывает увеличение объема водной фазы и должно быть учтено при анализе. Из полученного раствора титруют кальций. [c.16]
Диагностическое значение определения этилацетата и этилового спирта в биосубстратах. Несмотря на высокое значение ко-эфф1щпента растворимости паров этилацетата в воде (225,920=). его быстрое расщепление в организме теоретически не исключает возможность возникновения острого отравления. Исходя из экспериментальных данных, можно рекомендовать при диагностике острого отравления пытаться определить в крови этилацетат и этиловый спирт, а при выяснении причины хронического отравления — этиловый спирт. [c.229]
Чистякова В.А.. Луйксаар И.В. - Зав.лаб.. 1975,М,408-409. Газохроматогра-фическое определение примесей этилацетата и воды в акриловой кислоте. [c.63]
Джинджел с сотрудниками [11] в обзоре, посвященном вопросу о применении безводного спирта в органических синтезах, отмечает, что титрование по методу Фишера и метод, основанный на применении натрия и этилацетата, являются наилучшими для определения воды. Рекомендуемая ими величина образцов с содержанием приблизительно 0,5 г воды, является, по всей вероятности, ошибочной, так как такое количество воды потребовало на титрование более 150 мл реактива Фишера. Образец, содержащий около 0,05 г воды, повидимому, является более подходящим. [c.118]
Колориметрический способ определения редуцирующих сахаров, широко используемый в биохимических и клинических лабораториях, нашел применение и при анализе пищевых продуктов, как об этом сообщается в работе [336], сравнивающей этот иетод с методом Менсона — Уокера. Метод окисления феррицИани-дом калия приспособлен для определения лактозы и сахарозы в молочных продуктах [356] однако в присутствии других редуцирующих сахаров он неприменим. Для анализа смеси глюкозы, галактозы, рамнозы, присутствующих в гидролизате глюкозидов флавона из гречихи, пригодно определение медного числа по Шор-лю [321 ] до и после сбраживания дрожжами, способными селективно сбраживать одну глюкозу или глюкозу и галактозу вместе. Для идентификации сахаров использована хроматография на бумаге [384]. Для смесей простых гексоз и пентоз процесс был весьма упрощен применением смешанных растворителей этилацетат-уксусная кислота-вода и этилацетат-пиридин-вода, в которых сахара имеют низкий коэффициент Rp [359]. [c.158]
ДИ НИТРОФЕНИЛ ГИД РАЗИН (N02)2 6h4NHNh3, красные крист, с фиолетовой флуоресценцией fnji 194— 198°С (с разл.) пе раств. в воде, раств. в анилине, этилацетате, р-рах минер, к-т, диглиме, плохо — в сп., эф., бензоле, S2. Взрыво- и огнеопасен. Получ. действием гид-ралина па 2,4-динитрохлорбензол. Реагент для качеств, и количеств, определения карбонильных соед. ВВ (по заруб, данным). [c.176]
ГИДРОКСИЛЬНОЕ число, масса KOH (в мг), эквивалентная кол-ву СН3СООН, образующейся в результате гидролиза избытка уксусного ангидрида после ацилирования 1 г исследуемого в-ва. Характеризует число гидроксильных групп в в-ве. При определении Г.ч. запаянную трубку с навеской в-ва и ацетилирующей смесью (р-р уксусного ангидрида в этилацетате) помещают в стакан с водой и кипятят 1 ч иногда ацетилирование проводят при комнатной т-ре с добавкой НСЮ в кач-ве катализатора. После завершения р-ции непрореагировавший уксусный ангидрид гидролизуют в присут. пиридина кол-во образовавшейся СН3СООН определяют титриметрически. Г. ч. = = 56,Ш( 2 - )М где Fj и Vj-объемы (в мл) р-ра КОН нормальности N, пошедшие на титрование соотв. в холостом опыте и в опыте с пробой, d-навеска в-ва (в г). Г. ч. определяют у первичных и вторичных алифатич. спиртов и нолов. Определению мешают первичные и вторичные амины, низкомол. альдегиды. Е.А. Бондаревская. [c.560]
При определении содержания этилового спирта в смеси с толуолом и водой к 1,000 г смеси добавили уксусный ангидрид и пиридин. Дистиллят, содержащий этилацетат, обработали 23,75 мл 1,000 М NaOH, провели омыление эфира и оттитровали избыток щелочи 15,25 мл 1,000 М раствора НС1 в присутствии фенолфталеина. Вычислить массовую долю (%) этилового спирта в смеси. [c.97]
Галлеин — темно-зеленые с металлическим блеском кристаллы. Растворим в горячем этаноле, ацетоне, бутаноле, метилбутилкетоне, изоамиловом спирте, циклогексаноле, этилацетате, в растворах щелочей. Мало растворим в воде (лучше в горячей), хлороформе, бензоле, толуоле. При pH выше 8 растворы неустойчивы. Очищают осаждением из этанольных растворов добавлением воды. Применяют для определения олова. [c.132]
Бесцветные кристаллы. Мало растворим в воде, растворим в хлороформе, тетрахлориде углерода, бензоле, этилацетате, бутилацетате и л-бутаноле. Применяют при определении меди в рудах с содержанием до 0,1 мг в пробе. [c.152]
Для этого плав, полученный сплавлением 0,1 г анализируемого образца с 1 г смеси буры и соды (1 1), растворяют в 15 мл азотной кислоты (3 7). К полученному раствору в мерной колбе емкостью 50 мл добавляют азотную кислоту до достижения ее концентрации в конечном объеме (после разбавления водой до метки), равной 7%. 5 мл этого раствора помещают в делительную воронку, прибавляют 9,5 г нитрата алюминия и нагревают на водяной бане до растворения. Затем прибавляют 50 мг фосфата натрия, для связывания циркония, снова нагревают и после охлаждения добавляют 10 мл этилацетата. Встряхивают в течение 10 мин. и отделяют водную фазу. Органический слой фильтруют для удаления следов водной фазы через сухой фильтр. Для выделения урана из экстракта его сжигают в платиновой чашке, охлаждаемой снизу водой, и затем остаток прокаливают. Определение рекомендуется заканчивать флуорометрнческнм методом. [c.300]
chem21.info
Формула Этилацетата структурная химическая
Структурная формула
 |
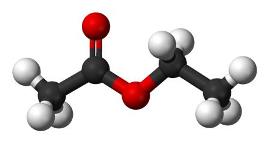 |
Истинная, эмпирическая, или брутто-формула: C4H8O2
| C | Углерод | 12,011 | 4 | 54,5% |
| H | Водород | 1,008 | 8 | 9,2% |
| O | Кислород | 15,999 | 2 | 36,3% |
Молекулярная масса: 88,106
Этилацетат — (этиловый эфир уксусной кислоты) СН3-СОО-Ch3-Ch4 — бесцветная летучая жидкость с резким запахом.
Получение
Этилацетат образуется при прямом взаимодействии этанола с уксусной кислотой: Ch4COOH + C2H5OH → Ch4COOC2H5 + h3O Лабораторный метод получения этилацетата заключается в ацетилировании этилового спирта хлористым ацетилом или уксусным ангидридом: Ch4COCl + C2H5OH → Ch4COOC2H5 + HCl К промышленным способам синтеза этилацетата относятся: Перегонка смеси этилового спирта, уксусной и серной кислот. Обработке этилового спирта кетеном. По реакции Тищенко из ацетальдегида при 0-5 °C в присутствии каталитических количеств алкоголята алюминия: 2Ch4CHO → Ch4COOC2H5
Физические свойства
Бесцветная подвижная жидкость с резким запахом эфира. Молярная масса 88,11 г/моль, температура плавления −83,6 °C, температура кипения 77,1 °C, плотность 0,9001 г/см³, n204 1,3724. Растворяется в воде 12 % (по массе), в этаноле, диэтиловом эфире, бензоле, хлороформе; образует двойные азеотропные смеси с водой (т. кип. 70,4 °C, содержание воды 8,2 % по массе), этанолом (71,8; 30,8), метанолом (62,25; 44,0), изопропанолом (75,3; 21,0), CCl4 (74,7; 57), циклогексаном (72,8; 54,0) и тройную азеотропную смесь Э.: вода: этанол (т. кип. 70,3 °C, содержание соотв. 83,2, 7,8 и 9 % по массе).
Применение
Этилацетат широко используется как растворитель, из-за низкой стоимости и малой токсичности, а также приемлемого запаха. В частности, как растворитель нитратов целлюлозы, ацетилцеллюлозы, жиров, восков, для чистки печатных плат, в смеси со спиртом — растворитель в производстве искусственной кожи. Годовое мировое производство в 1986 году составляло 450—500 тысяч тонн. Мировое производство этилацетата на 2014 год составляет около 3,5 млн. тонн в год. Один из самых популярных ядов, применяемых в энтомологических морилках для умерщвления насекомых. Насекомые после умерщвления в его парах гораздо мягче и податливее в препарировании, чем после умерщвления в парах хлороформа. Применяется как компонент фруктовых эссенций. Зарегистрирован в качестве пищевой добавки E1504.
Лабораторное применение
Этилацетат часто используется для экстракции, а также для колоночной и тонкослойной хроматографии. Редко в качестве растворителя для проведения реакций из-за склонности к гидролизу и переэтерефикации. Используется для получения ацетоуксусного эфира: 2Ch4COOC2H5 → Ch4COCh3COOC2H5
Очистка и сушка
Продаваемый этилацетат обычно содержит воду, спирт и уксусную кислоту. Для удаления этих примесей его промывают равным объёмом 5%-го карбоната натрия, сушат хлоридом кальция и перегоняют. При более высоких требованиях к содержанию воды несколько раз (порциями) добавляют фосфорный ангидрид, фильтруют и перегоняют, защищая от влаги. С помощью молекулярного сита 4А содержание воды в этилацетате можно снизить до 0,003 %.
Безопасность
ЛД50 для крыс составляет 11,6 г/кг, показывая низкую токсичность. Пары этилацетата раздражают слизистые оболочки глаз и дыхательных путей, при действии на кожу вызывают дерматиты и экземы. ПДК в воздухе рабочей зоны 200 мг/м³. ПДК в атмосферном воздухе населенных мест 0,1 мг/м³. Температура вспышки — 2 °C, температура самовоспламенения — 400 °C, концентрационные пределы взрыва паров в воздухе 2,1-16,8 % (по объему). Безопасность при транспортировке. В соответствии с ДОПОГ (ADR) класс опасности 3, код по реестру ООН 1253.
formula-info.ru
Этилацетат — Википедия
Этилацетат (этиловый эфир уксусной кислоты) СН3-СОО-Ch3-Ch4 — бесцветная летучая жидкость с резким запахом.
Этилацетат образуется при прямом взаимодействии этанола с уксусной кислотой:

Лабораторный метод получения этилацетата заключается в ацетилировании этилового спирта хлористым ацетилом или уксусным ангидридом:

К промышленным способам синтеза этилацетата относятся:
- Перегонка смеси этилового спирта, уксусной и серной кислот.
- Обработке этилового спирта кетеном.
- По реакции Тищенко из ацетальдегида при 0-5 °C в присутствии каталитических количеств алкоголята алюминия:

Физические свойства[править]
Бесцветная подвижная жидкость с резким запахом эфира. Молярная масса 88,11 г/моль, температура плавления −83,6 °C, температура кипения 77,1 °C, плотность 0,9001 г/см³, n204 1,3724. Растворяется в воде 12 % (по массе), в этаноле, диэтиловым эфире, бензоле, хлороформе; образует двойные азеотропные смеси с водой (т. кип. 70,4 °C, содержание воды 8,2 % по массе), этанолом (71,8; 30,8), метанолом (62,25; 44,0), изопропанолом (75,3; 21,0), CCl4 (74,7; 57), циклогексаном (72,8; 54,0) и тройную азеотропную смесь Э.: вода: этанол (т. кип. 70,3 °C, содержание соотв. 83,2, 7,8 и 9 % по массе). [1]
Этилацетат широко используется как растворитель, из-за низкой стоимости и малой токсичности, а также приемлемого запаха. В частности, как растворитель нитратов целлюлозы, ацетилцеллюлозы, жиров, восков, для чистки печатных плат, в смеси со спиртом — растворитель в производстве искусственной кожи. Годовое мировое производство в 1986 году составляло 450—500 тысяч тонн. Мировое производство этилацетата на 2014 год составляет около 3,5 млн. тонн в год.
Один из самых популярных ядов, применяемых в энтомологических морилках для умерщвления насекомых. Насекомые после умерщвления в его парах гораздо мягче и податливее в препарировании, чем после умерщвления в парах хлороформа.
Применяется как компонент фруктовых эссенций. Зарегистрирован в качестве пищевой добавки E1504.
Лабораторное применение[править]
Этилацетат часто используется для экстракции, а также для колоночной и тонкослойной хроматографии. Редко в качестве растворителя для проведения реакций из-за склонности к гидролизу и переэтерефикации.
Используется для получения ацетоуксусного эфира[2]:

Очистка и сушка[править]
Продаваемый этилацетат обычно содержит воду, спирт и уксусную кислоту. Для удаления этих примесей его промывают равным объёмом 5%-го карбоната натрия, сушат хлоридом кальция и перегоняют. При более высоких требованиях к содержанию воды несколько раз (порциями) добавляют фосфорный ангидрид, фильтруют и перегоняют, защищая от влаги. С помощью молекулярного сита 4А содержание воды в этилацетате можно снизить до 0,003 %.
ЛД50 для крыс составляет 11,6 г/кг, показывая низкую токсичность. Пары этилацетата раздражают слизистые оболочки глаз и дыхательных путей, при действии на кожу вызывают дерматиты и экземы. ПДК в воздухе рабочей зоны 200 мг/м³. ПДК в атмосферном воздухе населенных мест 0,1 мг/м³[3].
Температура вспышки — 2 °C, температура самовоспламенения — 400 °C, концентрационные пределы взрыва паров в воздухе 2,1-16,8 % (по объему).
Безопасность при транспортировке. В соответствии с ДОПОГ (ADR) класс опасности 3, код по реестру ООН 1253.
wp.wiki-wiki.ru


















