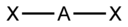3. Типы гибридизации орбиталей атомов углерода (sp3-, sp2-, sp- гибритизация). Вода гибридизация
Гибридизация (химия) - это... Что такое Гибридизация (химия)?

 Модель молекулы метана, образованной sp3-гибридными орбиталями
Модель молекулы метана, образованной sp3-гибридными орбиталями Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Концепция гибридизации
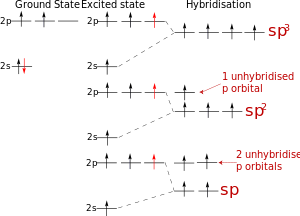
 Схема гибридизации атомных орбиталей атома углерода
Схема гибридизации атомных орбиталей атома углерода Концепция гибридизации валентных атомных орбиталей была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.
Представления о гибридизации занимают центральное место в методе валентных связей. Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи, в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул как вода. В настоящее время используется в основном в методических целях и в синтетической органической химии.
В 1954 году Нобелевский комитет удостоил Л.Полинга премии по химии «За изучение природы химической связи и его применение к объяснению строения сложных молекул». Но сам Л.Полинг не был удовлетворён введением σ,π — описания для двойной и тройной связи и сопряжённых систем.
В 1958 году на симпозиуме, посвящённом памяти Кекуле, Л.Полинг развил теорию изогнутой химической связи, учитывающую кулоновскую электронную корреляцию. По этой теории двойная связь описывалась как комбинация двух изогнутых химических связей, а тройная связь как комбинация трёх изогнутых химических связей.[1]
Этот принцип нашёл отражение в теории отталкивания электронных пар Гиллеспи — Найхолма. Первое и наиболее важное правило которое формулировалось следующим образом:
«Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга, т.е электронные пары ведут себя так, как если бы они взаимно отталкивались»[2].Второе правило состоит в том, что «все электронные пары, входящие в валентную электронную оболочку, считаются расположенными на одинаковом расстоянии от ядра».[2]
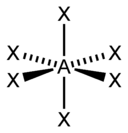
Виды гибридизации
sp-гибридизация

 sp-гибридизация
sp-гибридизация Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
sp2-гибридизация

 sp2-гибридизация
sp2-гибридизация Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
sp3-гибридизация

 sp3-гибридизация
sp3-гибридизация Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Гибридизация и геометрия молекул
Представления о гибридизации атомных орбиталей лежат в основе теории отталкивания электронных пар Гиллеспи-Найхолма. Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)[3].
| sp | 2 | Линейная | 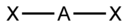 | BeF2, CO2, NO2+ |
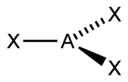
| sp2 | 3 | Треугольная | 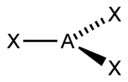 | BF3, NO3-, CO32- |
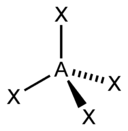
| sp3 | 4 | Тетраэдрическая | 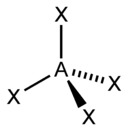 | Ch5, ClO4-, SO42-, Nh5+ |
| dsp2 | 4 | Плоскоквадратная |  | Ni(CO)4, XeF4 |
| sp3d | 5 | Гексаэдрическая | 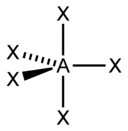 | PCl5, AsF5 |
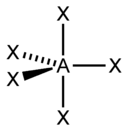
| sp3d2 | 6 | Октаэдрическая | 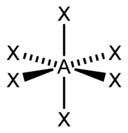 | SF6, Fe(CN)63-, CoF63- |
Ссылки
Литература
- Паулинг Л. Природа химической связи / Пер. с англ. М. Е. Дяткиной. Под ред. проф. Я. К. Сыркина. — М.; Л.: Госхимиздат, 1947. — 440 с.
- Полинг Л. Общая химия. Пер. с англ. — М.: Мир, 1974. — 846 с.
- Минкин В. И., Симкин Б. Я., Миняев Р. М. Теория строения молекул. — Ростов-на-Дону: Феникс, 1997. — С. 397-406. — ISBN 5-222-00106-7
- Гиллеспи Р. Геометрия молекул / Пер. с англ. Е. З. Засорина и В. С. Мастрюкова, под ред. Ю. А. Пентина. — М.: Мир, 1975. — 278 с.
См. также
Примечания
- ↑ Под редакцией Р. Х. Фрейдлиной. Теоретическая органическая химия. — пер. с англ. канд. хим. наук Ю.Г.Бунделем. — М.: Издательство иностранной литературы, 1963. — Т. 1. — С. 11. — 365 с.
- ↑ 1 2 Гиллеспи Р. Геометрия молекул / Пер. с англ. Е. З. Засорина и В. С. Мастрюкова, под ред. Ю. А. Пентина. — М.: Мир, 1975. — С. 18-19. — 278 с.
- ↑ Здесь A — центральный атом, X — гибридные связывающие орбитали
dic.academic.ru
Урок №10. Пространственное строение молекул неорганических и органических веществ
Повторите!
Электронная природа химических связей в органических соединениях
Часто химические связи образуются за счёт электронов, расположенных на разных атомных орбиталях (например, s – и р – орбитали). Несмотря на это, связи оказываются равноценными и расположены симметрично, что обеспечено гибридизацией атомных орбиталей.
Гибридизация орбиталей - это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
В результате гибридизации появляются новые гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы после их перекрывания с орбиталями других атомов образующиеся электронные пары оказались максимально удалёнными друг от друга. Это сводит к минимуму энергию отталкивания электронов в молекуле.
Гибридизация не является реальным процессом. Это понятие введено для описания геометрической структуры молекулы. Форма частиц, возникающих при образовании ковалентных связей, в которых участвуют гибридные атомные орбитали, зависит от числа и типа этих орбиталей. При этом σ – связи создают жёсткий «скелет» частицы:
| Орбитали участвующие в гибридизации | Тип гибридизации | Пространственная форма молекулы | Примеры |
| s, p | sp – гибридизация  | Линейная  | BeCl2 CO2 C2h3 ZnCl2 Beh3 Две sp - орбитали могут образовывать две σ - связи (Beh3, ZnCl2). Еще две p- связи могут образоваться, если на двух p - орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2h3). |
| s, p, p | sp2 – гибридизация  | Треугольная (плоская тригональная)  | Bh4 BF3 C2h5 AlCl3 Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется σ - связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется π - связь. Три sp2- орбитали могут образовывать три σ - связи (BF3, AlCl3). Еще одна связь (π - связь) может образоваться, если на p- орбитали, не участвующей в гибридизации, находится электрон (этилен C2h5). |
| s, p, p, p | sp3 – гибридизация  | Тетраэдрическая  | Сh5 Nh5+ PO43- BF4- |
На практике вначале экспериментально устанавливают геометрическую структуру молекулы, после чего описывают тип и форму атомных орбиталей, участвующих в её образовании. Например, пространственная структура молекул аммиака и воды близка к тетраэдрической, но угол между связями в молекуле воды равен 104,5˚, а в молекуле Nh4 – 107,3˚.
Чем это можно объяснить?
| Аммиак Nh4 |
 Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Атом азота находится в sp3- гибридном состоянии; из четырех гибридных орбиталей азота три участвуют в образовании одинарных связей N–H, а четвертая sp3 - гибридная орбиталь занята неподеленной электронной парой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония Nh5+, а также является причиной отклонения от тетраэдрического угла в строении |
| Вода h3O |
 Молекула воды имеет угловое строение: представляет собой равнобедренный треугольник с углом при вершине 104,5°. Атом кислорода находится в sp3- гибридном состоянии; из четырех гибридных орбиталей кислорода две участвуют в образовании одинарных связей О–H, а две другие sp3 - гибридные орбитали заняты неподеленными электронными парами, их действие является причиной уменьшения угла от 109,28˚ до 104,5°. |
sites.google.com
Готовимся к углубленному изучению химии : 3.8 Гибридизация орбиталей
3.8. Гибридизация орбиталей. Пространственная форма молекул Образование одинаковых связей из атомных орбиталей разного вида потребовало введения такого понятия, как ГИБРИДИЗАЦИЯ (то есть “смешивание”) атомных орбиталей. Почему это понятие стало необходимо? Вернемся к уже знакомой нам молекуле BeCl2. Ее образование вполне понятно из электронного строения атомов бериллия и хлора, которое изображается формулами Льюиса: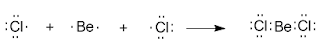 Электронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние:
Электронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние:  Если бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а другой - за счет 2p-электрона бериллия, то связи Be—Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены под углом 180о. Чтобы объяснить равноценность связей Be—Cl, говорят о sp-гибридизации валентных атомных орбиталей бериллия, при которой одна s-орбиталь и одна p-орбиталь (они обведены овалом на орбитальной диаграмме) как бы смешиваются и выравниваются по форме и энергии, давая две одинаковые sp-гибридные орбитали.
Если бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а другой - за счет 2p-электрона бериллия, то связи Be—Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены под углом 180о. Чтобы объяснить равноценность связей Be—Cl, говорят о sp-гибридизации валентных атомных орбиталей бериллия, при которой одна s-орбиталь и одна p-орбиталь (они обведены овалом на орбитальной диаграмме) как бы смешиваются и выравниваются по форме и энергии, давая две одинаковые sp-гибридные орбитали. 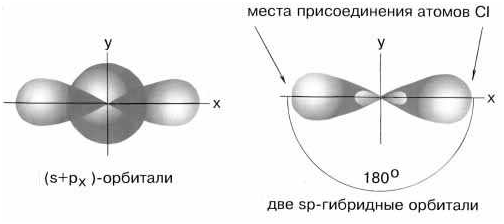 sp-гибридизация валентных орбиталей бериллия в соединении BeCl2 Каждая гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные орбитали бериллия лежат на одной прямой. Считается, что благодаря sp-гибридизации молекула BeCl2 имеет линейную форму и все три ее атома находятся на одной прямой, а обе связи Be—Cl совершенно одинаковы. Такова геометрия и у всех других sp-гибридизованных молекул - независимо от элементов, которые входят в эти молекулы. Если валентная оболочка атома включает электроны на одной s-орбитали и двух p-орбиталях, то имеет место sp2-гибридизация орбиталей. Примером может служить sp2-гибридизация бора при образовании молекулы BF3. На орбитальной диаграмме обведены одна s- и две p-орбитали, которые “смешиваются”, то есть гибридизуются. Из ОВЭП мы уже знаем, что sp2-гибридные фрагменты молекул имеют форму плоского треугольника.
sp-гибридизация валентных орбиталей бериллия в соединении BeCl2 Каждая гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные орбитали бериллия лежат на одной прямой. Считается, что благодаря sp-гибридизации молекула BeCl2 имеет линейную форму и все три ее атома находятся на одной прямой, а обе связи Be—Cl совершенно одинаковы. Такова геометрия и у всех других sp-гибридизованных молекул - независимо от элементов, которые входят в эти молекулы. Если валентная оболочка атома включает электроны на одной s-орбитали и двух p-орбиталях, то имеет место sp2-гибридизация орбиталей. Примером может служить sp2-гибридизация бора при образовании молекулы BF3. На орбитальной диаграмме обведены одна s- и две p-орбитали, которые “смешиваются”, то есть гибридизуются. Из ОВЭП мы уже знаем, что sp2-гибридные фрагменты молекул имеют форму плоского треугольника. 
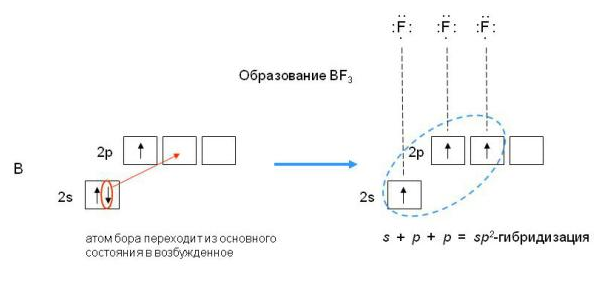
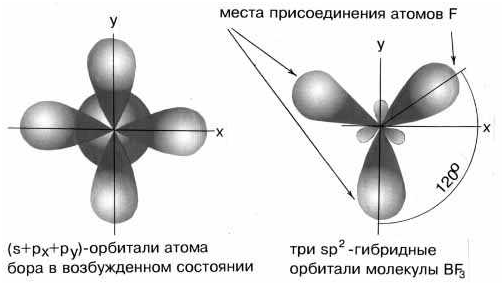 sp2-гибридизация валентных орбиталей бора в соединении BF3 Три sp2-гибридные орбитали бора лежат в одной плоскости под углом 120o. Наконец, когда смешиваются одна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра (рис. 3-9). Примером может служить молекула метана СН4.
sp2-гибридизация валентных орбиталей бора в соединении BF3 Три sp2-гибридные орбитали бора лежат в одной плоскости под углом 120o. Наконец, когда смешиваются одна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра (рис. 3-9). Примером может служить молекула метана СН4. 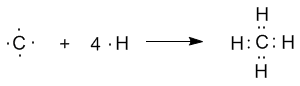
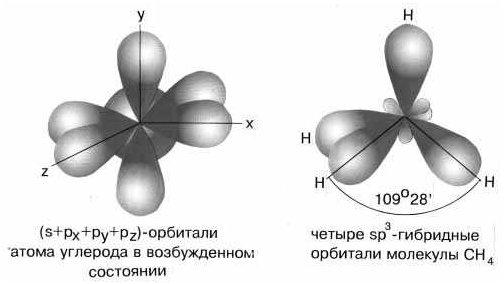 sp3-гибридизация валентных орбиталей углерода Четыре sp3-гибридные орбитали углерода направлены в вершины правильного тетраэдра. Атом углерода находится в центре тетраэдра. Углы между всеми связями равны и составляют 109°28'. Существует важное правило: При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ ОРБИТАЛЕЙ. Если все гибридные орбитали связаны с одинаковыми атомами, то связи ничем не отличаются друг от друга. В других случаях встречаются небольшие отклонения от стандартных валентных углов. Например, в молекуле воды h3O кислород - sp3-гибридный, находится в центре неправильного тетраэдра, в вершины которого "смотрят" два атома водорода и две неподеленные пары электронов (рис. 3-10а). Форма молекулы угловая, если смотреть по центрам атомов. Валентный угол HОН составляет 105о, что довольно близко к теоретическому значению 109о.
sp3-гибридизация валентных орбиталей углерода Четыре sp3-гибридные орбитали углерода направлены в вершины правильного тетраэдра. Атом углерода находится в центре тетраэдра. Углы между всеми связями равны и составляют 109°28'. Существует важное правило: При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ ОРБИТАЛЕЙ. Если все гибридные орбитали связаны с одинаковыми атомами, то связи ничем не отличаются друг от друга. В других случаях встречаются небольшие отклонения от стандартных валентных углов. Например, в молекуле воды h3O кислород - sp3-гибридный, находится в центре неправильного тетраэдра, в вершины которого "смотрят" два атома водорода и две неподеленные пары электронов (рис. 3-10а). Форма молекулы угловая, если смотреть по центрам атомов. Валентный угол HОН составляет 105о, что довольно близко к теоретическому значению 109о. 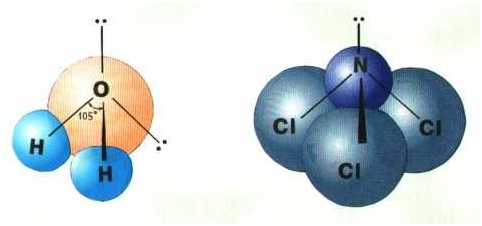 sp3-гибридизация атомов кислорода и азота в молекулах а) h3O и б) NCl3 Если бы не происходило гибридизации (“выравнивания” связей O-H), валентный угол HOH был бы равен 90°, потому что атомы водорода были бы присоединены к двум взаимно перпендикулярным р-орбиталям. В этом случае наш мир выглядел бы, вероятно, совершенно по-другому. Пространственная форма молекул Формулы Льюиса многое говорят об электронном строении и устойчивости молекул, но пока ничего не могут сказать об их пространственном строении. В теории химической связи существуют два хороших подхода к объяснению и предсказанию геометрии молекул. Они хорошо согласуются между собой. Первый подход называется теорией отталкивания валентных электронных пар (ОВЭП). Несмотря на “страшное” название, суть этого подхода очень проста и понятна: химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга. Поясним на конкретных примерах. В молекуле BeCl2 есть две связи Be—Cl. Форма этой молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах располагались как можно дальше друг от друга:
sp3-гибридизация атомов кислорода и азота в молекулах а) h3O и б) NCl3 Если бы не происходило гибридизации (“выравнивания” связей O-H), валентный угол HOH был бы равен 90°, потому что атомы водорода были бы присоединены к двум взаимно перпендикулярным р-орбиталям. В этом случае наш мир выглядел бы, вероятно, совершенно по-другому. Пространственная форма молекул Формулы Льюиса многое говорят об электронном строении и устойчивости молекул, но пока ничего не могут сказать об их пространственном строении. В теории химической связи существуют два хороших подхода к объяснению и предсказанию геометрии молекул. Они хорошо согласуются между собой. Первый подход называется теорией отталкивания валентных электронных пар (ОВЭП). Несмотря на “страшное” название, суть этого подхода очень проста и понятна: химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга. Поясним на конкретных примерах. В молекуле BeCl2 есть две связи Be—Cl. Форма этой молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах располагались как можно дальше друг от друга:  Это возможно только при линейной форме молекулы, когда угол между связями (угол ClBeCl) равен 180о. Другой пример: в молекуле BF3 имеется 3 связи B—F. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника, где все углы между связями (углы FBF) равны 120о :
Это возможно только при линейной форме молекулы, когда угол между связями (угол ClBeCl) равен 180о. Другой пример: в молекуле BF3 имеется 3 связи B—F. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника, где все углы между связями (углы FBF) равны 120о : 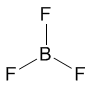 Еще один пример: в молекуле Ch5 имеется 4 связи C—H. Все эти 4 связи расположатся максимально далеко друг от друга только тогда, когда молекула примет форму тетраэдра, у которого в центре находится атом C, а в вершинах - атомы H. Кстати, в "квадратной" молекуле расстояние между атомами водорода было бы меньше, поэтому реальная молекула Ch5 имеет форму тетраэдра:
Еще один пример: в молекуле Ch5 имеется 4 связи C—H. Все эти 4 связи расположатся максимально далеко друг от друга только тогда, когда молекула примет форму тетраэдра, у которого в центре находится атом C, а в вершинах - атомы H. Кстати, в "квадратной" молекуле расстояние между атомами водорода было бы меньше, поэтому реальная молекула Ch5 имеет форму тетраэдра: 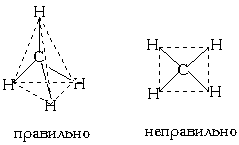 В молекуле Ch5 угол НСН такой же, как в математическом тетраэдре: 109о28’. Последний пример: молекула h3O в своем составе имеет две связи O—H и две неподеленные пары электронов. Вывод: эта молекула также должна иметь форму, похожую на тетраэдр.
В молекуле Ch5 угол НСН такой же, как в математическом тетраэдре: 109о28’. Последний пример: молекула h3O в своем составе имеет две связи O—H и две неподеленные пары электронов. Вывод: эта молекула также должна иметь форму, похожую на тетраэдр. 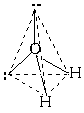 Реально этот тетраэдр слегка искажен, потому что неподеленные пары отталкиваются между собой несколько сильнее, чем от поделенных пар, и чем поделенные пары отталкиваются друг от друга. Поэтому реальный угол HOH составляет не 109о, а немногим менее 105о. Однако по центрам атомов, как можно видеть, молекула воды имеет угловую форму. Если ввести обозначения: н.п - неподеленная пара, п.п - поделенная пара, то относительное отталкивание между ними дает такой ряд: (н.п/н.п) > (н.п/п.п) > (п.п/п.п). Теория отталкивания валентных электронных пар (ОВЭП) проста и наглядна. Она опирается на классическую геометрию и позволяет правильно предсказывать форму молекул.
Реально этот тетраэдр слегка искажен, потому что неподеленные пары отталкиваются между собой несколько сильнее, чем от поделенных пар, и чем поделенные пары отталкиваются друг от друга. Поэтому реальный угол HOH составляет не 109о, а немногим менее 105о. Однако по центрам атомов, как можно видеть, молекула воды имеет угловую форму. Если ввести обозначения: н.п - неподеленная пара, п.п - поделенная пара, то относительное отталкивание между ними дает такой ряд: (н.п/н.п) > (н.п/п.п) > (п.п/п.п). Теория отталкивания валентных электронных пар (ОВЭП) проста и наглядна. Она опирается на классическую геометрию и позволяет правильно предсказывать форму молекул.  1. Какие электроны атомов (например, углерода или азота) называют неспаренными? Решение: Электроны, которые находятся по одному на орбитали, называют неспаренными электронами. Например, в электронографической формуле возбужденного атома углерода – четыре неспаренных электрона, а у атома азота – три:
1. Какие электроны атомов (например, углерода или азота) называют неспаренными? Решение: Электроны, которые находятся по одному на орбитали, называют неспаренными электронами. Например, в электронографической формуле возбужденного атома углерода – четыре неспаренных электрона, а у атома азота – три: 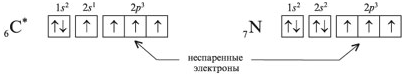 _____________________________________________________________ 2. Что означает понятие «общие электронные пары» в соединениях с ковалентной связью (например, СН4 или Н2S)? Решение: Два электрона, участвующие в образовании одной химической связи, называют общей электронной парой. Обычно до образования химической связи один из электронов этой пары принадлежал одному атому, а другой электрон – другому атому:
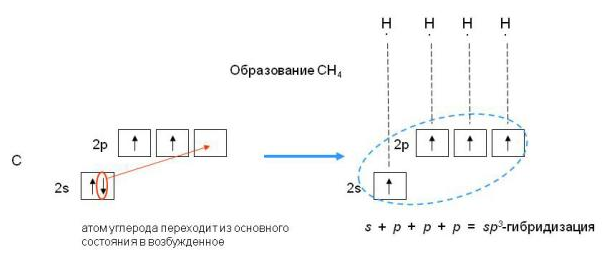
_____________________________________________________________ 2. Что означает понятие «общие электронные пары» в соединениях с ковалентной связью (например, СН4 или Н2S)? Решение: Два электрона, участвующие в образовании одной химической связи, называют общей электронной парой. Обычно до образования химической связи один из электронов этой пары принадлежал одному атому, а другой электрон – другому атому: 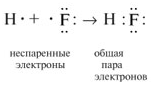 _____________________________________________________________ 3. Какие электронные состояния атомов (например, С или N) называют основными, а какие возбужденными? Решение: Электронное состояние атома, в котором соблюдается порядок заполнения электронных орбиталей: 1s2, 2s2, 2p2, 3s2, 3p2, 4s2, 3d2, 4p2 и т.д., называют основным состоянием. Ввозбужденном состоянии один из валентных электронов атома занимает свободную орбиталь с более высокой энергией, такой переход сопровождается разъединением спаренных электронов. Схематически это записывают так:
_____________________________________________________________ 3. Какие электронные состояния атомов (например, С или N) называют основными, а какие возбужденными? Решение: Электронное состояние атома, в котором соблюдается порядок заполнения электронных орбиталей: 1s2, 2s2, 2p2, 3s2, 3p2, 4s2, 3d2, 4p2 и т.д., называют основным состоянием. Ввозбужденном состоянии один из валентных электронов атома занимает свободную орбиталь с более высокой энергией, такой переход сопровождается разъединением спаренных электронов. Схематически это записывают так:  Тогда как в основном состоянии было только два валентных неспаренных электрона, то в возбужденном состоянии таких электронов становится четыре. _____________________________________________________________ 4. Какие типы гибридизации известны для атома углерода и в чем они заключаются? Решение: Для атома углерода известны три типа гибридизации: sp3, sp2 и sp.
Тогда как в основном состоянии было только два валентных неспаренных электрона, то в возбужденном состоянии таких электронов становится четыре. _____________________________________________________________ 4. Какие типы гибридизации известны для атома углерода и в чем они заключаются? Решение: Для атома углерода известны три типа гибридизации: sp3, sp2 и sp. Какие химические связи называют δ и какие π? Укажите δ- и π-связи в соединениях:
 _____________________________________________________________ 5. Для атомов углерода приведенных ниже соединений укажите: а) тип гибридизации; б) типы его химических связей; в) валентные углы.
_____________________________________________________________ 5. Для атомов углерода приведенных ниже соединений укажите: а) тип гибридизации; б) типы его химических связей; в) валентные углы. 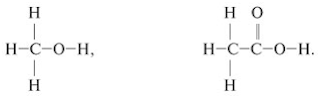
Решение:
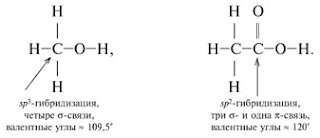 _____________________________________________________________ ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 1. Какое геометрическое строение характерно для молекул, которые содержат sp-гибридизованные атомы. 2. Какова геометрическая форма молекул типа АВ3, которые содержат sp2-гибридизованный атом А. 3. Какова геометрическая форма молекул типа АВ4, которые содержат sp3-гибридизованный атом А. 4. Назовите известные вам виды пространственного строения молекул. Приведите примеры молекул. 5. Какие типы гибридизации являются наиболее важными. 6. Сколько гибридных орбиталей образуется в результате: sp-, sp2-, sp3-гибридизации. 7. Для атомов элементов 2-го и 3-го периодов напишите электронные и электронно-графические формулы внешнего электронного слоя в возможных возбужденных состояниях. 8. Какой тип гибридизации характерен для кремния в SiCl4. Нарисуйте схему перекрывания электронных облаков в данной молекуле. 9. Какой тип гибридизации характерен для кремния в MgBr2. Нарисуйте схему перекрывания электронных облаков в данной молекуле. 10. Какие из следующих молекул являются полярными и какие неполярными, почему:
_____________________________________________________________ ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 1. Какое геометрическое строение характерно для молекул, которые содержат sp-гибридизованные атомы. 2. Какова геометрическая форма молекул типа АВ3, которые содержат sp2-гибридизованный атом А. 3. Какова геометрическая форма молекул типа АВ4, которые содержат sp3-гибридизованный атом А. 4. Назовите известные вам виды пространственного строения молекул. Приведите примеры молекул. 5. Какие типы гибридизации являются наиболее важными. 6. Сколько гибридных орбиталей образуется в результате: sp-, sp2-, sp3-гибридизации. 7. Для атомов элементов 2-го и 3-го периодов напишите электронные и электронно-графические формулы внешнего электронного слоя в возможных возбужденных состояниях. 8. Какой тип гибридизации характерен для кремния в SiCl4. Нарисуйте схему перекрывания электронных облаков в данной молекуле. 9. Какой тип гибридизации характерен для кремния в MgBr2. Нарисуйте схему перекрывания электронных облаков в данной молекуле. 10. Какие из следующих молекул являются полярными и какие неполярными, почему: 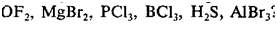

| 1. Укажите неполярную молекулу: | |
| 2. Укажите неполярную молекулу с ковалентными полярными связями: | |
| 3. У какой частицы есть sр3-гибридные орбитали: | |
| 4. По какому типу гибридизованы валентные орбитали в молекуле ВеН2: | |
| 5. Какое свойство не присуще ковалентной связи: | |
| а) насыщенность | б) валентность |
| в) направленность | г) поляризуемость |
| 6. sр3 –гибридизация атомных орбиталей центрального атома может дать такие геометрические конфигурации молекул: | |
| в) тригональная пирамида | |
| 7. Чем оценивается степень полярности ковалентной связи: | |
| а) разностью электроотрицательностей | б) величиной эффективных зарядов |
| в) значением электрического момента диполя | г) длиной диполя |
| 8. Характеристиками ионной связи являются: | |
| а) насыщаемость | б) координационное число |
| в) направленность | г) разность электроотрицательностей |
| 9. Укажите соединение с ионной связью: | |
| 10. У какого соединения более ярко выражена ковалентная полярная связь: | |
himiy88.blogspot.ru
3. Типы гибридизации орбиталей атомов углерода (sp3-, sp2-, sp- гибритизация).
Гибридизация – выравнивание (смешивание) атомных орбиталей (s и р) с образованием новых атомных орбиталей, называемых гибридными орбиталями.
Атомная орбиталь – это функция, которая описывает плотность электронного облака в каждой точке пространства вокруг ядра атома. Электронное облако – это область пространства, в которой с высокой вероятностью может быть обнаружен электрон
Sp-гибридизация
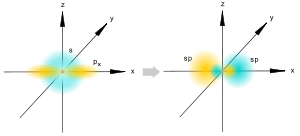
Происходит при смешивании одной s- и одной p-орбиталей. Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
Sp2-гибридизация
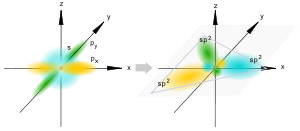
Происходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
Sp2-гибридизация
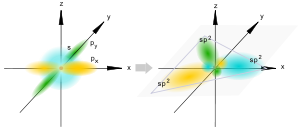
Происходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)
| Тип гибридизации | Число гибридных орбиталей | Геометрия | Структура | Примеры |
| sp | 2 | Линейная |
| BeF2, CO2, NO2+ |
| sp2 | 3 | Треугольная |
| BF3, NO3-, CO32- |
| sp3 | 4 | Тетраэдрическая |
| Ch5, ClO4-, SO42-, Nh5+ |
| dsp2 | 4 | Плоскоквадратная |
| Ni(CO)4, [PdCl4]2- |
| sp3d | 5 | Гексаэдрическая |
| PCl5, AsF5 |
| sp3d2, d2sp3 | 6 | Октаэдрическая |
| SF6, Fe(CN)63-, CoF63- |
4. Электровалентная, ковалентная, донорно-акцепторная, водородная связи. Электронное строение σ и π связи. Основные характеристики ковалентной связи: энергия связи, длина, валентный угол, полярность, поляризуемость.
Если между двумя атомами или двумя группами атомов имеет место электростатическое взаимодействие приводящее к сильному притяжению и образованию химической связи, то такая связь называется электровалентной или гетерополярной.
Ковалентная связь-химическая связь, образованная перекрытием пары валентных электронных облаков. Обепечивающие связь электронные облака называется общей электронной парой.
Донорно-акцепторная связь –это химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободного уровня другого атома (акцептора). Это связь отличается от ковалентной связи происхождением связи электронов.
Водородная связь-это вид химического взаимодейсвия атомов в молекуле отличающийся тем, что существенное участие в нем принимает атом водорода, уже связанный ковалентной связью с другими атомами
σ связь-это первая и более прочная связь, которая образуется при перекрывании электронных облаков в направлении прямой, соединяющий центры атомов.
σ связь-это обычные ковалентные связи атомов углерода с атомами водорода. Молекулы предельных углеродов содержат только σ связи.
π связь это менее прочная связь, которая образуется при перекрывании электронных плоскости атомов ядер
Электроны π и σ связи теряют свою принадлежность к определенному атому.
Особенности σ и π связи: 1)вращение атомов углерода в молекуле возможна в случае, если они соединены σ связью 2)появление π связи лишает атома углерода в молекуле в свободного вращения.
Длина связи-это расстояние между центрами связанных атомов.
Валентный угол-это угол между двумя связями, имеющий общий атом.
Энергия связи-энергия, выделяющаяся при образовании хим. связи и характеризующаяся ее прочность
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные. Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
5. Ионная связь (электровалентная)— очень прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью. Ковалентная связь – возникает за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону. Донорно акцепторная связь (координационная связь) химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора).пример Nh5 Для возникновения водородных связей важно, чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но электроотрицательными атомами, например: O, N, F. Это создает заметный частичный положительный заряд на атомах водорода. С другой стороны, важно, чтобы у электроотрицательных атомов были неподеленные электронные пары. Когда обедненный электронами атом водорода одной молекулы (акцептор) взаимодействует с неподеленной электронной парой на атоме N, O или F другой молекулы (донор), то возникает связь, похожая на полярную ковалентную. При образовании ковалентной связи в молекулах органических соединений общая электронная пара заселяет связывающие молекулярные орбитали, имеющие более низкую энергию. В зависимости от формы МО – σ-МО или π-МО – образующиеся связи относят к σ- или p-типу. σ-Связь – ковалентная связь, образованная при перекрывании s-, p- и гибридных АО вдоль оси, соединяющей ядра связываемых атомов (т. е. при осевом перекрывании АО) . π-Связь – ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов.  π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи) . π-Связь слабее σ-связи из-за менее полного перекрывания р-АО.
π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи) . π-Связь слабее σ-связи из-за менее полного перекрывания р-АО. 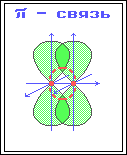 Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей. 1.σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами. 2.По σ-связям возможно внутримолекулярное вращение атомов, т. к. форма σ-МО допускает такое вращение без разрыва связи (cм аним. Картинку внизу)) . Вращение по двойной (σ + π) связи невозможно без разрыва π-связи! 3.Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей. 1.σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами. 2.По σ-связям возможно внутримолекулярное вращение атомов, т. к. форма σ-МО допускает такое вращение без разрыва связи (cм аним. Картинку внизу)) . Вращение по двойной (σ + π) связи невозможно без разрыва π-связи! 3.Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные — двухатомная молекула состоит из одинаковых атомов (h3, Cl2, N2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождаядипольный момент молекулы).
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер.
6.Номенклатура представляет собой систему правил, позволяющих дать однозначное название каждому индивидуальному соединению. Для медицины знание общих правил номенклатуры имеет особенно большое значение, так как в соответствии с ними строятся названия многочисленных лекарственных средств. В настоящее время общепринята систематическая номенклатура ИЮПАК (IUPAC - Международный союз теоретической и прикладной химии)*.
Однако до сих пор сохраняются и широко применяются (особенно в медицине) тривиальные (обыденные) и полутривиальные названия, использовавшиеся еще до того, как становилось известным строение вещества. В этих названиях могут отражаться природные источники и способы получения, особо заметные свойства и области применения. Например, лактоза (молочный сахар) выделена из молока (от лат. lactum - молоко), пальмитиновая кислота - из пальмового масла, пировиноградная кислота получена при пиролизе виноградной кислоты, в названии глицерина отражен его сладкий вкус (от греч. glykys - сладкий).
Тривиальные названия особенно часто имеют природные соединения - аминокислоты, углеводы, алкалоиды, стероиды. Употребление некоторых укоренившихся тривиальных и полутривиальных названий разрешается правилами ИЮПАК. К таким названиям относятся, например, «глицерин» и названия многих широко известных ароматических углеводородов и их производных.
Рациональная номенклатура предельных углеводородов
В отличие от тривиальной названия основываются на строении молекул. Названия сложных структур состовляют из названия блоков те радикалов связанных с основным навиболее важным узлом молекулы по этой номенклатуре алканы рассматриваются как производные метана у которого атомы водорода замещены соответствующими радикалами. Выбор метанового углерода произвольный поэтому 1 соедин может иметь неск названий.по этой номенклатуре алкены рассматривают как производные этилена а алкины-ацетилена.
7. Гомология органических соединений или закон гомологов — состоит в том, что вещества однойхимической функции и одинакового строения, отличающиеся друг от друга по своему атомному составу лишьна nСН 2, оказываются сводными и во всем своем остальном хим. характере, а различие их физическихсвойств возрастает или вообще изменяется правильно по мере увеличения разницы в составе,определяемой числом n групп СН 2. Такие хим. сходственные соединения образуют так наз. гомологическийряд, атомный состав всех членов которого возможно выразить общею формулою в зависимости от составапервого члена ряда и числа атомов углерода; органические вещества одного названия типо алканы только.
Изомеры- соединения имеющие одинаковый состав но разное строение и свойства.
8. Нуклеофильные и электрофильные реагенты. Участвующие в замещения реакциях реагенты подразделяются на нуклеофильные и электрофильные. Нуклеофильные реагенты, или нуклеофилы, предоставляют свою паруэлектронов на образование новой связи и вытесняют из молекулы RX уходящую группу (X) с парой электронов, образовывавшей старую связь, например:
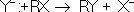
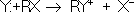
(где R — органический радикал).
К нуклеофилам относятся отрицательно заряженные ионы (Hal-, ОН-, CN-, NO2-, OR-, RS-, Nh3-, RCOO- и др.), нейтральные молекулы, обладающие свободной парой электронов (например, Н2О, Nh4, R3N, R2S, R3P, ROH, RCOOH), и металлоорганич. соединения R — Me с достаточно поляризованной связью С — Me+, т. е. способные быть донорами карбанионов R-. Реакции с участием нуклеофилов (нуклеофильное замещение) характерны главным образом Для алифатических соединений, например гидролиз (ОН-, Н2О), алкоголиз (RO-, ROH), ацидолиз (RCOO-, RСООН), аминирование (NH-2, Nh4, RNh3 и др.), цианирование (CN-) и т. д.
Электрофильные реагенты, или электрофилы, при образовании новой связи служат акцепторами пары электронов и вытесняют уходящую группу в виде положительно заряженной частицы. К электрофилам относятся положительно заряженные ионы (например, Н+, NO2+), нейтральные молекулы с электронным дефицитом, например SO3, и сильно поляризованные молекулы (СН3СОО-Br+ и др.), причём поляризация особенно эффективно достигаетсякомплексообразованием с коэффициентами Льюиса (Hal+ — Hal- · А, R+ — Cl- · A, RCO+ — Cl- · А, где A= A1C13, SbCl5, BF3 и др.). К реакциям с участием электрофилов (электрофильное замещение) относятся важнейшие реакцииароматических углеводородов (например, нитрование, галогенирование, сульфирование, реакция Фриделя — Крафтса):
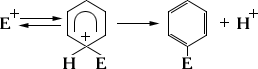
(E+ = Hal+, NO+2, RCO+, R+ и др.)
В определённых системах реакции с участием нуклеофилов осуществляются в ароматическом ряду, а реакции с участием электрофилов — в алифатическом (чаще всего в ряду металлоорганических соединений).
53. взаимодействие оксосоединений с металлорганическими (кетон или альдегид плюс металорганика)
Реакции широко используются для получения спиртов.при присоединении к формальдегиду реактива гриньяра(R-MgX) образуется первичный спирт, другим альдегидом вторичные, а кетонам тритичные спирты
studfiles.net

ТОП 10: |
Ковалентная химическая связь характеризуется направленностью, что обусловлено определенными ориентациями атомных электронных облаков (АО) в пространстве. Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется σ-связью. Она возникает при перекрывании s-орбиталей, s- и p-орбиталей, р-, d-орбиталей, d- и s-орбиталей и т. д. (рис. 7) Связь, образованная перекрывание АО по обе стороны линии, соединяющей ядра взаимодействующих атомов, называется π-связью. Она возникает при перекрывании р – р-орбиталей, p – d-орбиталей, d – d-орбиталей, f – p-орбиталей и пр. (рис. 8). Гибридизация орбиталей - это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. В результате гибридизации появляются новые гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы после их перекрывания с орбиталями других атомов образующиеся электронные пары оказались максимально удалёнными друг от друга. Это сводит к минимуму энергию отталкивания электронов в молекуле. Гибридизация не является реальным процессом. Это понятие введено для описания геометрической структуры молекулы. Форма частиц, возникающих при образовании ковалентных связей, в которых участвуют гибридные атомные орбитали, зависит от числа и типа этих орбиталей. При этом σ – связи создают жёсткий «скелет» частицы:
На практике вначале экспериментально устанавливают геометрическую структуру молекулы, после чего описывают тип и форму атомных орбиталей, участвующих в её образовании. Например, пространственная структура молекул аммиака и воды близка к тетраэдрической, но угол между связями в молекуле воды равен 104,5˚, а в молекуле Nh4 – 107,3˚. Чем это можно объяснить?
9.Термодинамика, ее основные понятия: внутренняя энергия, температура, теплота, работа. Закон сохранения энергии. Первое начало термодинамики. Внутренняя энергия тела - это сумма кинетической энергии хаотического теплового движения частиц, составляющих тело, и потенциальной энергии их взаимодействия. Внутренняя энергия тела не зависит от его движения и его положения относительно других тел. Теплота Q есть форма передачи энергии от одного тела другому посредством соударения микрочастиц, составляющих тела является микрофизической характеристикой процесса передачи энергии. Если контакта между телами нет и нет никакого посредника для передачи кинетической энергии, следовательно нет соударений между микрочастицами тел и Q = 0. Работа А – это форма обмена энергией системы с окружающей средой посредством направленного движения макросистемы как целого. Например, газ в цилиндре под поршнем расширяется и совершает работу, поднимает груз на некоторую высоту. (рис. 35). Работа совершается за счет энергии нагревателя, передаваемой в форме теплоты. Газ совершает направленное движение, перемещая поршень с грузом, поэтому работа является макрофизической формой обмена энергией системы и окружающей среды. Первое начало термодинамики. Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение работы над внешними телами:
В изохорном процессе газ работы не совершает, и ΔU = Q. В изобарном процессе A = pΔV = p (V2 – V1). В изотермическом процессе ΔU = 0, и A = Q; вся теплота, переданная телу, идет на работу над внешними телами. Графически работа равна площади под кривой процесса на плоскости p, V |