Масса молекул. Постоянная Авогадро. Масса молекулы воды
Масса молекул. Постоянная Авогадро | Физика
Масса молекулы воды. Массы отдельных молекул и атомов очень малы. Например, в 1 г воды содержится 3,7 · 1022 молекул. Следовательно, масса одной молекулы равна:
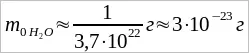 . (1.1)
. (1.1)
Массу такого же порядка имеют и молекулы других веществ, исключая огромные молекулы органических веществ.
Относительная молекулярная масса. Так как массы молекул очень малы, удобно использовать в расчетах не абсолютные значения масс, а относительные. По международному соглашению (как вам известно из курса химии VII класса) массы всех атомов и молекул сравнивают с  массы атома углерода (так называемая углеродная шкала атомных масс). (Сравнение масс атомов молекул именно с
массы атома углерода (так называемая углеродная шкала атомных масс). (Сравнение масс атомов молекул именно с  массы атома углерода обусловлено тем, что в этом случае относительные массы атомов оказываются наиболее близкими к целым числам. Таким образом, в углеродной шкале атомных масс масса атома углерода принимается равной 12. Это примерно в 12 раз больше массы самого легкого атома – атома водорода.) Относительной молекулярной (или атомной) массой вещества Mr называют отношение массы молекулы (или атома) m0 данного вещества к
массы атома углерода обусловлено тем, что в этом случае относительные массы атомов оказываются наиболее близкими к целым числам. Таким образом, в углеродной шкале атомных масс масса атома углерода принимается равной 12. Это примерно в 12 раз больше массы самого легкого атома – атома водорода.) Относительной молекулярной (или атомной) массой вещества Mr называют отношение массы молекулы (или атома) m0 данного вещества к  массы атома углерода m0C:
массы атома углерода m0C:
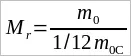 . (1.2)
. (1.2)
В настоящее время относительные атомные массы всех химических элементов весьма точно измерены. Складывая относительные атомные массы атомов, входящих в состав молекулы, можно вычислить относительную молекулярную массу. Так, например, относительная молекулярная масса углекислого газа CO2 приблизительно равна 44, так как относительная атомная масса углерода равна 12, а кислорода – примерно 16: 12 + 2 · 16 = 44.
Количество вещества. Чем больше атомов или молекул в макроскопическом теле, тем, очевидно, больше вещества содержится в данном теле. Число молекул в макроскопических телах огромно. Поэтому удобно указывать не абсолютное число атомов или молекул, а относительное.Принято сравнивать число молекул или атомов в данном теле с числом атомов в 0,012 кг углерода. Относительное число атомов или молекул в теле характеризуется особой физической величиной, называемой количеством вещества. Количеством вещества ν называют отношение числа молекул N в данном теле к числу NA атомов в 0,012 кг углерода:
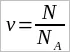 (1.3)
(1.3)
(Если вещество состоит из отдельных атомов, не объединенных в молекулы, то здесь и в дальнейшем под числом молекул надо подразумевать число атомов.)
Зная количество вещества ν и число NA, мы тем самым знаем число N молекул в веществе. Количество вещества выражают в молях. Моль – количество вещества, содержащего столько же молекул, сколько содержится атомов в 0,012 кг углерода. Если количество вещества равно, например, 2,5 моль, то это означает, что число молекул в теле в 2,5 раза превышает число атомов в 0,012 кг углерода.
Постоянная Авогадро. Число молекул или атомов NA в моле вещества называют постоянной Авогадро, в честь итальянского ученого XIX в. Согласно определению моля постоянная Авогадро одинакова для всех веществ. Она равна, в частности, числу атомов в моле углерода, т. е. в 0,012 кг углерода.
Для определения постоянной Авогадро надо найти массу одного атома углерода (или любого другого атома). Грубая оценка массы может быть произведена так, как это было сделано выше для массы молекулы воды (наиболее точные методы основаны на отклонении пучков ионов электромагнитным полем). Измерения дают для массы атома углерода: m0C = 1,995 · 10–26 кг. Отсюда постоянная Авогадро равна:
 (1.4)
(1.4)
Наименование моль–1 указывает, что NA – число атомов любого вещества, взятого в количестве одного моля. Если количество вещества ν = 2,5 моль, то число молекул в теле N = νNA ≈ 1,5 · 1024.
Существует много других методов определения постоянной Авогадро, не связанных с нахождением масс атомов. Все они приводят к одним и тем же результатам. Постоянная Авогадро играет важнейшую роль во всей молекулярной физике и является универсальной постоянной.
Огромная величина постоянной Авогадро показывает, насколько малы микроскопические масштабы по сравнению с макроскопическими: тело, обладающее количеством вещества 1 моль, имеет привычные для нас макроскопические размеры.
Молярная масса. Наряду с относительной молекулярной массой Mr в физике и химии широко используется молярная масса M. Молярной массой называют массу вещества, взятого в количестве одного моля.
Согласно этому определению молярная масса равна произведению массы молекулы на постоянную Авогадро:
M = m0NA (1.5)
Молярную массу M можно выразить через относительную молекулярную массу. Подставляя в (1.5) выражения m0 из (1.2) и NA из (1.4), получим:
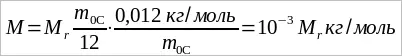 (1.6)
(1.6)
Так, например, молярная масса углекислого газа CO2 равна 0,044 кг/моль, так как относительная молекулярная масса углекислого газа приближенно равна 44.
Масса m любого количества вещества ν, равная произведению массы одной молекулы m0 на число молекул N, выражается через молярную массу и количество вещества так:
m = m0N = m0NAν = Mν, (1.7)
поскольку N = νNA (формула 1.3).
Так, масса 3 моль углекислого газа равна: m = 3 моль × 0,044 кг/моль = 0,132 кг.
1. Перечислите основные положения молекулярно-кинетической теории. 2. Приведите известные вам доказательства существования молекул. 3. Что называют относительной молекулярной массой? 4. Чему равна относительная молекулярная масса воды? 5. Что называют количеством вещества? 6. Дайте определение единицы количества вещества – моля. 7. Чему равна постоянная Авогадро? 8. Дайте определение молярной массы. 9. Какова связь между массой тела и количеством вещества в нем? 10. Выразите число молекул в теле через его массу, молярную массу и постоянную Авогадро.
phscs.ru
Масса и размер молекул | Физика для всех
Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами. Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около 10-8 см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*10-8 см.
Для характеристики атомов используют представление об атомных радиусах, которые дают возможность приближённо оценить межатомные расстояния в молекулах, жидкостях или твёрдых телах, так как атомы по своим размерам не имеют чётких границ. То есть атомный радиус – это сфера, в которой заключена основная часть электронной плотности атома (не менее 90…95%).
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Моль вещества
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса) вещества Мr – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Мr = (m0) : (m0C / 12)
где m0 – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.
Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С12. Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
Атомная единица массы – это 1/12 массы изотопа углерода С12. Точные измерения показали, что атомная единица массы составляет 1,660*10-27 кг, то есть
1 а.е.м. = 1,660 * 10-27 кг
Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м., то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Зачем измерять массу молекул и атомов в а.е.м., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет:
m0Mg = 24,305 * 1 a.e.м. = 24,305 * 1,660 * 10-27 = 40,3463 * 10-27 кг
Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н2О) будет равна:
m0Н2О = 2 * m0H + m0O = 2 * 1,00794 + 15,9994 = 18,0153 a.e.м. = 29,905 * 10-27 кг
Количество вещества принято считать пропорциональным числу частиц. Количество вещества – это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).
Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С12. То есть, если у нас есть система с каким-либо веществом, и в этой системе столько же молекул этого вещества, сколько атомов в 0,012 кг углерода, то мы можем сказать, что в этой системе у нас 1 моль вещества.
Постоянная Авогадро
Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
ν = N / NA
где N – количество молекул в данном теле, NA – количество молекул в 1 моле вещества, из которого состоит тело.
NA – это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
В 1 моле любого вещества содержится одинаковое количество частиц.
NA = 6,02 * 1023 моль-1
Молярная масса – это масса вещества, взятого в количестве одного моля:
μ = m0 * NA
где m0 – масса молекулы.
Молярная масса выражается в килограммах на моль (кг/моль = кг*моль-1).
Молярная масса связана с относительной молекулярной массой соотношением:
μ = 10-3 * Mr [кг*моль-1]
Масса любого количества вещества m равна произведению массы одной молекулы m0 на количество молекул:
m = m0N = m0NAν = μν
Количество вещества равно отношению массы вещества к его молярной массе:
ν = m / μ
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
m0 = m / N = m / νNA = μ / NA
Более точное определение массы атомов и молекул достигается при использовании масс-спректрометра – прибора, в котором происходит разделение пучком заряженных частиц в пространстве в зависимости от их массы заряда при помощи электрических и магнитных полей.
Для примера найдём молярную массу атома магния. Как мы выяснили выше, масса атома магния равна m0Mg = 40,3463 * 10-27кг. Тогда молярная масса будет:
μ = m0Mg * NA = 40,3463 * 10-27 * 6,02 * 1023 = 2,4288 * 10-2 кг/моль
То есть в одном моле «помещается» 2,4288 * 10-2 кг магния. Ну или примерно 24,28 грамм.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Атомная масса магния равна 24,305 а.е.м. (г/моль).Можете посчитать молярную массу для различных элементов и убедиться в правоте этого утверждения. Для расчёта молярной массы можно использовать простой калькулятор, который находится внизу страницы:
av-mag.ru
Как найти массу одной молекулы вещества
Молекула вещества является одновременно минимально возможной его порцией, а потому именно ее свойства являются определяющими для вещества в целом. Эта частица принадлежит микромиру, поэтому рассмотреть, а тем более взвесить ее, не представляется возможным. Но массу одной молекулы можно рассчитать.
Вам понадобится
- - периодическая таблица химических элементов;
- - понятие о строении молекулы и атома;
- - калькулятор.
Инструкция
Если известна химическая формула вещества , определите его молярную массу . Для этого определите атомы, из которых состоит молекула, и найдите их относительные атомные массы в периодической системе химических элементов. Если один атом встречается в молекуле n раз, умножьте его массу на это число. Затем сложите найденные значения и получите молекулярную массу данного вещества , которая равна его молярной массе в г/моль. Найдите массу одной молекулы , поделив молярную массу вещества M на постоянную Авогадро NА=6,022 10^23 1/моль, m0=M/ NА.
Пример Найдите массу одной молекулы воды. Молекула воды (Н2О) состоит из двух атомов водорода и одного атома кислорода. Относительная атомная масса водорода равна 1, для двух атомов получим число 2, а относительная атомная масса кислорода равна 16. Тогда молярная масса воды будет равна 2+16=18 г/моль. Определите массу одной молекулы : m0=18/(6,022^23) 3 10^(-23) г.
Массу молекулы можно рассчитать, если известно количество молекул в данном веществе. Для этого поделите общую массу вещества m на количество частиц N (m0=m/N). Например, если известно, что в 240 г вещества содержится 6 10^24 молекул, то масса одной молекулы составит m0=240/(6 10^24)=4 10^(-23) г.
Определите массу одной молекулы вещества с достаточной точностью, узнав количество протонов и нейтронов, которые входят в состав ее ядер атомов, из которых она состоит. Массой электронной оболочки и дефектом масс в данном случае следует пренебречь. Массу протона и нейтрона берите равной 1,67 10^(-24) г. Например, если известно, если молекула состоит из двух атомов кислорода, какова ее масса? Ядро атома кислорода имеет в своем составе 8 протонов и 8 нейтронов. Общее количество нуклонов 8+8=16. Тогда масса атома равна 16 1,67 10^(-24)=2,672 10^(-23) г. Поскольку молекула состоит из двух атомов, то ее масса равна 2 2,672 10^(-23)=5,344 10^(-23) г.
Внимание, только СЕГОДНЯ!Все интересное
Под термином «молярная масса вещества» понимается масса одного его моля, то есть такого количества вещества, которое содержит 6,022х10^23 атомов, ионов или молекул. Измеряется эта масса в граммах/моль. Инструкция 1Как можно рассчитать…
Химические вещества можно измерять не только в килограммах или миллилитрах, но и в молях. Моль – единица количества вещества, появившаяся благодаря тому факту, что вещества состоят из молекул и атомов. Что такое моль в химии: определениеМоль…
Относительная молекулярная масса – это безразмерная величина, показывающая во сколько раз масса молекулы больше 1/12 массы атома углерода. Соответственно, масса атома углерода равна 12 единиц. Определить относительную молекулярную массу химического…
Молекула, хоть размеры ее и ничтожны, имеет массу, которую можно определить. Вы можете выразить массу одной молекулы газа как в относительных атомных единицах, так и в граммах. Вам понадобится- ручка;- бумага для записей;- калькулятор;- таблица…
Молекула является объектом микромира. Поэтому непосредственное измерение ее кинетической энергии невозможно. Средняя кинетическая энергия является статистическим понятием. Это усредненное значение кинетических энергий всех молекул, входящих в…
Относительная молекулярная масса вещества показывает, во сколько раз молекула данного вещества тяжелее 1/12 атома чистого углерода. Ее можно найти в том случае, если известна его химическая формула, используя периодическую таблицу элементов…
Молярная масса эквивалента показывает массу одного моля вещества. Обозначается большой буквой М. 1 моль - это такое количество вещества, которое содержит число частиц (атомов, молекул, ионов, свободных электронов), равное числу Авогадро (постоянная…
Количество молекул в веществе измерить обычными методами практически невозможно. Это связанно с тем, что молекула вещества слишком мала для того, чтобы ее увидеть. Поэтому количество молекул в данной массе вещества рассчитывается с помощью…
Масса 1 моль вещества называется его молярной массой и обозначается буквой М. Единицы измерения молярной массы – г/моль. Способ расчета этой величины зависит от заданных условий. Вам понадобится- периодическая система химических элементов Д.И.…
Для того, чтобы найти молярную массу вещества, определите его химическую формулу и с помощью периодической таблицы Менделеева рассчитайте его молекулярную массу. Она численно равна молярной массе вещества в граммах на моль. Если известна масса одной…
Количество молекул в веществе измерить обыкновенными способами фактически немыслимо. Это связанно с тем, что молекула вещества слишком мала для того, дабы ее увидеть. Следственно число молекул в данной массе вещества рассчитывается с подмогой особых формул.
Вам понадобится
- — периодическая таблица химических элементов;
- — весы;
- — калькулятор.
Инструкция
1. Зная такую величину, как число вещества?, обнаружьте число молекул в нем. Для этого число вещества, измеренное в молях, умножьте на непрерывную Авогадро (NА=6,022?10^23 1/моль), которая равна числу молекул в 1 моле вещества N=?/ NА. Скажем, если имеется 1,2 моль поваренной соли, то в ней содержится N=1,2?6,022?10^23 ?7,2?10^23 молекул .
2. Если знаменита химическая формула вещества, с поддержкой периодической таблицы элементов обнаружьте его молярную массу. Для этого по таблице обнаружьте относительные ядерные массы атомов, из которых состоит молекул а, и сложите их. В итоге получите относительную молекул ярную массу вещества, которая численно равна его молярной массе в граммах на моль. После этого, на весах измерьте массу исследуемого вещества в граммах. Дабы обнаружить число молекул в веществе, умножьте массу вещества m на непрерывную Авогадро (NА=6,022?10^23 1/моль) и поделите итог на молярную массу M (N=m? NА/M).
3. Пример Определите число молекул , которое содержится в 147 г серной кислоты. Обнаружьте молярную массу серной кислоты. Ее молекул а состоит из 2-х атомов водорода одного атома серы и 4-х атомов кислорода. Их ядерные массы равны 1, 32 и 16. Относительная молекул ярная масса равна 2?1+32+4?16=98. Она равна молярной массе, следственно М=98 г/моль. Тогда число молекул , содержащихся в 147 г серной кислоты, будет равно N=147?6,022?10^23/98?9?10^23 молекул .
4. Дабы обнаружить число молекул газа в типичных условиях при температуре 0?С и давлении 760 мм рт. столба, обнаружьте его объем. Для этого измеряйте либо высчитайте объем емкости V, в которой он находится в литрах. Дабы обнаружить число молекул газа поделите данный объем на 22,4 л (объем одного моля газа в типичных условиях), и умножьте на число Авогадро (NА=6,022?10^23 1/моль) N= V? NА/22,4.
А. Авогадро в 1811 году, в самом начале становления ядерной теории сделал предположение, что в равном числе безупречных газов при идентичном давлении и температуре содержится идентичное число молекул. Позже это предположение подтвердилось и стало нужным следствием для кинетической теории. Сейчас эта теория носит наименование – Авогадро.

Инструкция
1. Закон Авогадро:Один моль идеально всякого газа, если температура и давление идентичны, будет занимать такой же объем молекул. При типичных условиях данный объем равен – 22,41383 л. Данная величина определяет молярный объем газа.
2. Постоянная Авогадро показывает, число атомов либо молекул, которые содержатся в одном моле вещества.Число молекул, при условии, что система является однокомпонентной, а содержащиеся в ней молекулы либо атомы одного вида, дозволено обнаружить по особой формуле
Видео по теме
Молекула — это электрически нейтральная частица, владеющая всеми химическими свойствами, присущими данному определенному веществу. В том числе и газам: кислороду, азоту, хлору и т.д. Как дозволено определить число молекул газа?

Инструкция
1. Если вам нужно подсчитать, сколько молекул кислорода содержится в 320 граммах этого газа при типичных условиях, раньше каждого, определите, какое число молей кислорода заключено в этом числе. По таблице Менделеева, дозволено увидеть, что округленная ядерная масса кислорода – 16 ядерных единиц. От того что молекула кислорода – двухатомная, масса молекулы составит 32 ядерные единицы. Следственно, число молей 320/32 = 10.
2. Дальше вам поможет универсальное число Авогадро, названное в честь ученого, предположившего, что равные объемы безукоризненных газов при непрерывных условиях содержат идентичные числа молекул. Оно обозначается символом N(A) и дюже огромно – примерно составляет 6,022*10(23). Умножьте это число на вычисленное число молей кислорода и вы узнаете, что желанное число молекул в 320 граммах кислорода – 6,022*10(24).
3. А если вам знаменито давление кислорода, а также объем, занимаемый им, и температура? Как вычислить число его молекул при таких данных? И здесь нет ничего трудного. Нужно лишь записать универсальное уравнение Менделеева-Клапейрона для безукоризненных газов:PV = RTM/m Где P – давление газа в паскалях, V – его объем в кубических метрах, R – универсальная газовая непрерывная, M – масса газа, а m – его молярная масса.
4. Cлегка преобразуя это уравнение, вы получите:M = PVm/RT
5. От того что у вас есть все нужные данные (давление, объем, температура заданы первоначально, R = 8,31, а молярная масса кислорода = 32 грамма/моль), вы элементарно обнаружите массу газа при данном объеме, давлении и температуре. А дальше задача решается верно так же, как и в вышеописанном примере: N(A)M/m. Произведя вычисления, вы узнаете, сколько молекул кислорода содержится при заданных условиях.
6. Дозволено еще больше упростить решение, от того что в полученной дроби N(A)PVm/RTm молярные массы сокращаются, и остается: N(A)PV/RT. Подставив в формулу вестимые вам величины, вы получите результат.
Видео по теме
Полезный совет Ни один настоящий газ (включая кислород), безусловно же, не является безукоризненным, следственно уравнение Менделеева-Клапейрона дозволено применять для расчетов лишь при условиях, не дюже крепко отличающихся от типичных.
Молекула владеет настоль мизерными размерами, что число молекул даже в крошечной крупинке либо капле какого-нибудь вещества будет легко колоссальным. Оно не поддается измерению с подмогой обыкновенных способов исчисления.

Что такое «моль» и как с его поддержкой находить число молекул в веществе
Для определения, сколько молекул находится в том либо другом числе вещества, применяется представление «моль». Моль – это такое число вещества, в котором находится 6,022*10^23 его молекул (либо атомов, либо ионов). Эта огромная величина носит наименование «непрерывная Авогадро», она названа в честь известного итальянского ученого. Величина обозначается NA. С поддержкой непрерывной Авогадро дозволено дюже легко определить, сколько молекул содержится в любом числе молей всякого вещества. Скажем, в 1,5 молях содержится 1,5*NA = 9,033*10^23 молекул. В тех случаях, когда требуется дюже высокая точность измерения, нужно применять значение числа Авогадро с огромным числом знаков позже запятой. Особенно полная его величина составляет: 6,022 141 29(27)*10^23.
Как дозволено обнаружить число молей вещества
Определить, сколько молей содержится в каком-то числе вещества, дюже легко. Для этого надобно только иметь точную формулу вещества и таблицу Менделеева под рукой. Представим, у вас есть 116 граммов обычной поваренной соли. Вам необходимо определить, сколько молей содержится в таком числе (и, соответственно, сколько там молекул)?Раньше каждого припомните химическую формулу поваренной соли. Она выглядит дальнейшим образом: NaCl. Молекула этого вещества состоит из 2-х атомов (вернее, ионов): натрия и хлора. Какова ее молекулярная масса? Она складывается из ядерных масс элементов. С поддержкой таблицы Менделеева вы знаете, что ядерная масса натрия примерно равна 23, а ядерная масса хлора – 35. Следственно, молекулярная масса этого вещества составляет 23 + 35 = 58. Масса измеряется в ядерных единицах массы, где за стандарт принят самый легкий атом – водорода.А зная молекулярную массу вещества, вы здесь же сумеете определить и ее молярную массу (то есть массу одного моля). Дело в том, что численно молекулярная и молярная масса всецело совпадают, у них только различные единицы измерения. Если молекулярная масса измеряется в ядерных единицах, то молярная – в граммах. Следственно, 1 моль поваренной соли весит примерно 58 граммов. А у вас, по условиям задачи, 116 граммов поваренной соли, то есть 116/58 = 2 моля. Умножив 2 на непрерывную Авогадро, вы определите, что в 116 граммах хлорида натрия находится приблизительно 12,044*10^23 молекул, либо приблизительно 1,2044*10^24.
Молекула — это наименьшая единица вещества, которая по-прежнему сохраняет характеристики этого вещества. Она обладает очень малыми размерами, ее нельзя рассмотреть невооруженным глазом или взвесить. Каким образом рассчитать массу молекулы?
Моль и атомарный вес молекулы
Чтобы рассчитать массу молекулы, применяют единицу, называемую моль, и измерение, называемое атомарным весом. Моль — это величина равная числу Авогадро, которое составляет примерно 6.022 x 10 ^ 23. Атомарный вес представляет собой вес одного атома вещества в единицах атомарной массы. Вес одного моля элемента равен атомарному весу элемента. Зная это, возможно вывести массу каждой молекулы из ее химической формулы и атомарных весов ее элементов, как описано в Периодической таблице.
Установите химическую формулу молекулы
- Найдите атомарный вес каждого атома в молекуле. Вы можете найти эту информацию в Периодической таблице; это обычно десятичное число, указанное выше или ниже символа химического элемента.
- Например, атомарная масса водорода составляет 1,0079, а атомарная масса кислорода — 15,999. Один моль каждого элемента весит такое же количество в граммах.
- Далее, исходя из уже известной нам формулы, вычисляем сумму всех атомов молекулы.
- В частности, молекула воды содержит два атома водорода и один атом кислорода. В этом случае молярная масса воды равна 1,0079 + 1,0079 + 15,999, или 18,0148 г на моль (г / моль).
- Разделите сумму молекул на моль или число Авогадро (6.022 x 10 ^ 23).
- Например, 18.0148 / 6.022 x 10 ^ 23 = 2.991 x 10 ^ 23. Таким образом, одна молекула воды весит 2,991 х 10 ^ 23 г.

Как видно из вышеописанного примера, применяя Периодическую таблицу Менделеева, можно получить все необходимые показатели для вычисления массы молекул различных веществ.
Количество молекул в веществе измерить обычными методами практически невозможно. Это связанно с тем, что молекула вещества слишком мала для того, чтобы ее увидеть. Поэтому количество молекул в данной массе вещества рассчитывается с помощью специальных формул.
Вам понадобится
- - периодическая таблица химических элементов;
- - весы;
- - калькулятор.
Инструкция
Зная такую величину, как количество вещества?, найдите число молекул в нем. Для этого количество вещества, измеренное в молях, умножьте на постоянную Авогадро (NА=6,022 10^23 1/моль), которая равна числу молекул в 1 моле вещества N=?/ NА. Например, если имеется 1,2 моль поваренной соли, то в ней содержится N=1,2 6,022 10^23 ?7,2 10^23 молекул .
Если известна химическая формула вещества, с помощью периодической таблицы элементов найдите его молярную массу. Для этого по таблице найдите относительные атомные массы атомов, из которых состоит молекул а, и сложите их. В результате получите относительную молекул ярную массу вещества, которая численно равна его молярной массе в граммах на моль. Затем, на весах измерьте массу исследуемого вещества в граммах. Чтобы найти количество молекул в веществе , умножьте массу вещества m на постоянную Авогадро (NА=6,022 10^23 1/моль) и поделите результат на молярную массу M (N=m NА/M).
Пример Определите количество молекул , которое содержится в 147 г серной кислоты. Найдите молярную массу серной кислоты. Ее молекул а состоит из 2-х атомов водорода одного атома серы и 4-х атомов кислорода. Их атомные массы равны 1, 32 и 16. Относительная молекул ярная масса равна 2 1+32+4 16=98. Она равна молярной массе, поэтому М=98 г/моль. Тогда количество молекул , содержащихся в 147 г серной кислоты, будет равно N=147 6,022 10^23/98?9 10^23 молекул .
Чтобы найти количество молекул газа в нормальных условиях при температуре 0?С и давлении 760 мм рт. столба, найдите его объем. Для этого измеряйте или высчитайте объем емкости V, в которой он находится в литрах. Чтобы найти количество молекул газа поделите этот объем на 22,4 л (объем одного моля газа в нормальных условиях), и умножьте на число Авогадро (NА=6,022 10^23 1/моль) N= V NА/22,4.
Внимание, только СЕГОДНЯ!Все интересное
Молекула вещества является одновременно минимально возможной его порцией, а потому именно ее свойства являются определяющими для вещества в целом. Эта частица принадлежит микромиру, поэтому рассмотреть, а тем более взвесить ее, не представляется…
Молекулярная формула вещества показывает, какие именно химические элементы и в каком количестве входят в состав этого вещества. На практике ее определяют различными способами, как экспериментальными, с помощью методов количественного и качественного…
Масса вещества находится при помощи прибора, который называется весы. Можно также рассчитать массу тела, если известно количество вещества и его молярная масса или его плотность и объем. Количество чистого вещества можно находите по его массе или…
Для того, чтобы найти молярную массу вещества, определите его химическую формулу и с помощью периодической таблицы Менделеева рассчитайте его молекулярную массу. Она численно равна молярной массе вещества в граммах на моль. Если известна масса одной…
Чтобы найти объем одного моля вещества в твердом или жидком состоянии, найдите его молярную массу и поделите на плотность. Один моль любого газа в нормальных условиях имеет объем 22,4 л. В том случае если условия изменяются, рассчитайте объем одного…
arhub.ru


















