Справочник химика 21. Литий вода
Литий взаимодействие с водой - Справочник химика 21
Сопоставьте активность взаимодействия лития с водой, кислородом, азотом с его положением в ряду напряжений металлов. Можно ли однозначно ставить вопрос о том, какой из щелочных металлов наиболее активен [c.159]Взаимодействие воды с металлами, оксидами и солями. Наиболее активные металлы (металлы подгруппы лития, а также кальций, стронций и барий) взаимодействуют с водой уже при комнатной температуре, образуя соответствующий гидроксид и выделяя водород, например [c.38]
С водой реагирует, образуя ЫОН. При этом выделяется водород. Реакция протекает менее энергично, чем у натрия и калия,— без плавления металла и вспышки однако при недостаточном охлаждении он может воспламениться. Взаимодействие расплавленного лития с водой сопровождается взрывом. [c.8]
Очевидно, чем больше различаются между собой стандартные потенциалы обоих электродов, тем выше будет эдс элемента. Однако в электрохимических системах с высокой эдс часто наблюдается самопроизвольное химическое взаимодействие веществ электродов с компонентами электролита. Рациональный выбор электрохимических пар электродов весьма ограничен и определяется анализом всех свойств материалов электродов. Например, несмотря на весьма отрицательный потенциал, литиевый электрод практически трудно использовать в водных растворах из-за бурного взаимодействия лития с водой, а калий в таких растворах даже взрывается. [c.19]Вычислите AH°29s и AG°29g реакции взаимодействия оксида лития с водой, если известно [c.167]
Взаимодействие расплавленного лития с водой сопровождается взрывом. [c.15]
Однако выщелачивание едкого лития в воду проходит зна--чительно полнее, если в пульпе присутствует избыток СаО. Это привело к выводу, что процесс может быть представлен по аналогии с взаимодействием натриевого алюмосиликата с окисью кальция как [c.126]
Химические свойства гидрида лития, метана и фтористого водорода соответствуют приведенным выше определениям. С таким соединением, как вода, которое может как отдавать, так и принимать протоны, гидрид-ион гидрида лития взаимодействует, отрывая протон и образуя молекулу водорода [c.16]
В том, что скорость зависит от природы реагирующих веществ, можно убедиться, изучая самые разнообразные реакции. Например, при взаимодействии калия, натрия и лития с водой наглядно видно, что калий реагирует более энергично, чем натрий, натрий — энергичнее, чем литий. Известно, что фтор реагирует с водородом со взрывом даже в темноте, хлор же с водородом в темноте взаимодействует настолько медленно, что реакцию почти невозможно заметить. [c.91]
Вместе с тем, на первый взгляд многие факты противоречат отмеченной закономерности снижения химической активности от лития к цезию. Известно, что от лития к цезию усиливается способность самовозгорания металла на воздухе (рубидий и цезий воспламеняются без нагревания). Цезий гораздо энергичнее лития взаимодействует с водой. В действительности эти наблюдения не противоречат тому, что рубидий и цезий менее активны по отношению к кислороду и воде, чем литий. Несмотря на то, что при окислении и взаимодействии с водой рубидий и цезий выделяют меньше теплоты, чем литий, эта энергия достаточна для быстрого плавления этих металлов (рубидий, цезий и литий плавятся при 39, 28,5 и 179°С, соответственно). Расплавленный металл окисляется значительно быстрее и, наконец, вспыхивает. [c.368]
Взаимодействие алюмогидрида лития с водой может быть использовано для определения концентрации полученного раствора реактива. Взаимодействие осуществляется по уравнению [c.104]
Бериллий — двухвалентный металл, менее активен по сравнению с литием с водой не взаимодействует и ее не разлагает. Гидроксид бериллия Ве(0Н)2 практически нерастворим в воде. [c.106]
При взаимодействии карбида лития с водой образуется ацетилен и гидроокись лития [60, 64 [ [c.53]
Реакция взаимодействия лития с водой протекает менее энергично, чем натрия и калия. Литий бурно взаимодействует с [c.6]
| Рис. 243. Температурная зависимость свободной энергии взаимодействия лития с водой | 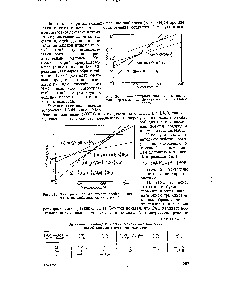 |
С азотом щелочные металлы, за исключением Li, иеиосред-стзеиь о НС реагируют. Литий взаимодействует с азотом даже прн KOMiriTHOi температуре, образуя нитрид Li-N, который легко pea-r ...v T с водой [c.304]
В атмосфере хлора и фтора щелочные металлы самовоспламеняются. С жидким бромом литий и натрий реагируют замедленно, остальные металлы — бурно, со взрывом. С иодом взаимодействие протекает менее энергично. Литий с водой взаимодействует спокойно, для натрия наблюдается значительный тепловой эф( зект, но выделяющийся водород обычно не воспламеняется. У калия взаимодействие с водой сопровождается самовоспламенением водорода, рубидий и цезий реагируют с водой со взрывом, вытесняют водород из воды (льда) даже при —108 °С. Щелочные металлы взаимодействуют ие только с водой, но и с другими водородсодержащими соединениями, например со спиртами [c.252]
С азотом щелочные металлы, за исключением U, непосредственно не реагируют. Литий взаимодействует с аз гтом даже при комнатной температуре, образуя нитркд UjN, который легко релгирует с водой [c.324]
Важной характеристикой химической активности ЩМ является их реакция с водой. Наиболее сдержан металлический литий, его реакция с водой протекает спокойно, без взрыва и образования пламени (водород-кислородного) Li+h3U = LiOH + 0,5h3. Можно поставить эксперимент таким образом, чтобы водород, выделяющийся при взаимодействии лития с водой, накапливался под стеклянной воронкой, прикрывающей фарфоровую чашку, где идет реакция. После проверки водорода на чистоту, его можно поджечь у носика воронки. Пламя окрашивается в карминово-красный цвет за счет следов соединений лития, содержащихся в парах воды. [c.11]
Эта реакция протекает не для всех щелочных металлов одинаково. Выделение водорода при взаимодействии лития с водой идет спокойно без воспламенения, и сам металл при этом не плавится. Реакция натрия с водой протекает более знергично если натрию дать свободно двигаться по поверхности воды, то водород не загорается в противном случае происходит воспламенение, и пламя окрашивается в характерный для этого металла желтый цвет при этом натрий расплавляется. Взаимодействие калия с водой происходит бурно и сопровождается воспламенением металла. Рубидий и цезий реагируют с водой с сильным взрывом. Таким образом, чем больше порядковый номер атома, т. е. чем дальше от ядра отстоит валентный электрон, тем энергичнее совершается окисление металла, сопровождаемое выделением водорода. [c.233]
КЬ и Сз очень бурно реагируют с водой в процессе реакции они плавятся, выделяющийся из воды водород воспламеняется Химическая активность калия близка к химической активности КЬ и Сз. Натрий взаимодействует с водой также бурно, но без вое пламенения водорода. Реакция лития с водой протекает без ра зогревания. [c.488]
В этой последовательности вслед за элементом наименьшего атомного веса — водородом — идет литий. По своим свойствам он относится к металлам. Этим словом физики обозначают простые вещества, которые, в противоположность неметаллам, отличаются непрозрачностью, характерным металлическим блеском, ковкостью, тягучестью, хорошей теплопроводностью и высокой электропроводностью. Для химиков гораздо, интереснее, чем эти физические свойства, то, что окислы металлов (соединения их с кислородом) при химическом взаимодействии с водой образуют так назьгваемые основания (растворимые в воде основания называются щелочами) в отличие от окислов неметаллов, которые с водой образуют кислоты. А так как у лития способность вступать в химическое взаимодействие выражена очень ярко — на воздухе, например, он столь активно соединяется с кислородом, что моментально покрывается рыхлой пленкой окисла, и основание, образующееся йз окисла лития и воды, обладает настолько сильным разъедаю- щим действием на многие вещества, что причисляется к группе едких щелочей, — химики называют литий типичным, активным, ярко выраженным металлом. [c.165]
Конечно, обнаруживая явное фами Ц)Ное сходство, родственники из разных рядов отличаются друг от друга степенью проявления присущих им свойств. Так, литий взаимодействует с водой быстро, но спокойно, натрий очень бурно, а калий даже с воспламенением. Напротив, активнейший неметалл из второго ряда — хлор— немного спокойнее фтора — своего родственника из пер- [c.168]
Застывший электролит дробят на куски и выщелачивают горячей водой. Нерастворимый остаток отфильтровывают и направляют в отвал. Фильтрат имеет сильнощелочную реакцию за счет взаимодействия включений металлического лития с водой, поэтому фильтрат нейтрализуют соляной кислотой до слабощелочной реакции. Раствор, содержащий хлориды лития и калия, упаривают досуха полученную смесь солей после соответствующей корректировки соотношения Li l K l направляют на электролиз [14]. [c.178]
Взаимодействие алюмогидрида лития с водой может быть использовано для определения концентрации полученного раствора реактива. Взаимодействие осуществляется по уравнению ПА Н + 4НоО ЫОН + А1 (ОН)з + 4Н,, а при избытке реактива [c.80]
Описан метод определения металлического лития, диспергированного в нефти, в присутствии солей лития [629]. Принцип метода заключается во взаимодействии лития с водой при пропускании тока кислорода, каталитическом окислении водорода кислородом и определении количества образовавшейся воды, а также титровании образовавшегося LiOH соляной кислотой. [c.152]
Гидриды щелочных и щелочноземельных металлов (лития, натрия, калия, рубидия, цезия, кальция, стронция, бария) при взаимодействии с водой образуют водород и гидроксид соответствующего металла. Так, при реакции гидрида лития с.водой образуются водород, гидроксид лития LiOH и выделяется теплота [c.19]
chem21.info
Химики нашли способ эффективно опреснять воду и добывать литий из рассола с помощью MOF-мембран, как в живых клетках
Дефицит лития — одна из главных причин дороговизны литий-ионных аккумуляторов, а как следствие, дороговизны электромобилей, где аккумуляторы составляют более половины стоимости. Если бы не сложность с его добычей, то мы жили бы сегодня в совершенно другом мире, где альтернативная энергетика, возможно, была бы гораздо шире распространена, а о сжигании углеводородов на транспорте люди стали бы постепенно забывать. Но реальность такова, что богатых месторождений не так много: они находятся в Аргентине, Боливии, Чили, Китае, США, России и нескольких других странах.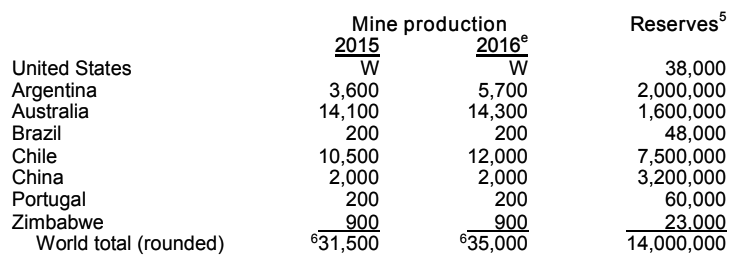
Мировые запасы лития сами по себе велики. Только в России 1 млн тонн лития, но здесь после распада СССР его больше не добывают: отечественные предприятия импортируют литийсодержащий концентрат из Конго и Китая. Добыча карбоната лития Li2CO3 предполагает выпаривание рассола в сильносолёных озёрах (Чили, Боливия, Аргентина, США) или кислотную переработку, как в случае с российской рудой. После выпаривания производится хлорирование карбоната с получением LiCl, электролиз () и вакуумная дистилляция. Всего на мировых месторождениях добывается около 35 000 тонн лития в год.
К счастью, всё больший процент литий-ионных аккумуляторов повторно перерабатывается, так что сейчас вторичная переработка даёт заметный процент всего лития, который поступает на производственные предприятия.
Но лития всё равно не хватает. Спрос на литий постоянно превышает предложение — и растёт с каждым годом. Возможно, эту проблему получится решить неординарным способом. Дело в том, что гигантские запасы лития содержит Мировой океан (в нём также растворены огромные запасы золота и других металлов). Вопрос в том, как дёшево и эффективно добыть эти богатства. Новый эффективный способ извлечения лития и других металлов из морской воды предложили химики из Техасского университета в Остине (США), Университета Монаша и Государственного объединения научных и прикладных исследований (оба — Австралия).
Они предложили технологический процесс с использованием металл-органических каркасных мембран (MOF), которые копируют механизм фильтрации — ионную селективность — мембран биологических клеток в живых организмах. Этот высокоэффективный легко отделяет ионы металлов. За его открытие в живых клетках была присуждена Нобелевская премия 2003 года по химии. Его можно использовать не только для переработки морской воды, но и горных руд.
 Схематическая иллюстрация переноса ионов через мембрану ZIF-8/GO/AAO
Схематическая иллюстрация переноса ионов через мембрану ZIF-8/GO/AAO
Другой побочный продукт после фильтрации металлов в солёной воде — пресная вода, пригодная для питья. То есть техпроцесс одновременно выдаёт ценную руду и пресную воду. «Перспектива использования MOF для устойчивой фильтрации воды невероятно интересна с точки зрения общественной пользы, в то время как лучший способ извлечения ионов лития для удовлетворения глобального спроса поможет создать новые отрасли промышленности», — сказала Анита Хилл (Anita Hill), ведущий научный сотрудник Государственного объединения научных и прикладных исследований.
Эффективное опреснение воды — главная задача, которую ставили перед собой исследователи. «Но это лишь малая часть возможного потенциала этого феномена, — говорит Хуантин Ван (Huanting Wang), профессор Университета Монаша. — Мы продолжим исследовать селективность этих мембран к ионам лития для практического использования. Ионы лития в обильном количестве присутствуют в морской воде, так что открытие может иметь большое значение для горнодобывающей промышленности, где сейчас используются неэффективные химические методы извлечения лития из горных пород и рассолов. Мировой спрос на литий, необходимый для электроники и батарей, очень высокий. Эти мембраны позволяют очень эффективно извлекать ионы лития из морской воды».
Так что в будущем Мировой океан может стать богатым и легкодоступным ресурсом лития. Возможно, кроме лития мембраны научатся использовать для фильтрации золота и других металлов, необходимых промышленности.
Научная статья опубликована 9 февраля 2018 года в журнале Science Advances (doi: 10.1126/sciadv.aaq0066).
geektimes.ru
Литий — Мегаэнциклопедия Кирилла и Мефодия — статья
Литий встречается в природе в виде двух стабильных нуклидов 6Li (7,52% по массе) и 7Li (92,48%). В периодической системе Д. И. Менделеева литий расположен во втором периоде, группе IA и принадлежит к числу щелочных металлов. Конфигурация электронной оболочки нейтрального атома лития 1s22s1. В соединениях литий всегда проявляет степень окисления +1.Металлический радиус атома лития 0,152 нм, радиус иона Li+ 0,078 нм. Энергии последовательной ионизации атома лития 5,39 и 75,6 эВ. Электроотрицательность по Полингу 0,98, самая большая у щелочных металлов.
В виде простого вещества литий — мягкий, пластичный, легкий, серебристый металл.
Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене LiAl[Si2O6] и в лепидолите KLi1.5Al1.5[Si3AlO10](F,OH)2. Свое название получил из-за того, что был обнаружен в «камнях» (греч. Litos — камень). Характерное для соединений лития красное окрашивание пламени впервые наблюдал немецкий химик Х.Г.Гмелин в 1818 году. В этом же году английский химик Г. Дэви электролизом расплава гидроксида лития получил кусочек металла. Получить свободный металл в достаточных количествах удалось впервые только в 1855 году путем электролиза расплавленного хлорида:2LiCl = 2Li + Cl2
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси). В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Литий довольно широко распространен в земной коре, его содержание в ней составляет 6,5·10–3% по массе. Как уже упоминалось, основные минералы, содержащие литий, — это петалит (содержит 3,5-4,9 % Li2O), сподумен (6-7 % Li2O), лепидолит (4-6 % Li2,O) и амблигонит LiAl [PO4] — 8-10 % Li2,O. В виде примеси литий содержится в ряде породообразующих минералов, а также присутствует в рапе некоторых озер и в минерализованных водах. В морской воде содержится около 2·10-5 % лития.Из металлов литий самый легкий, его плотность 0,534 г/см3 . Температура плавления 180,5 °C, температура кипения 1326 °C. При температурах от –193 °C до температуры плавления устойчива кубическая объемно центрированная модификация лития с параметром элементарной ячейки а=0,350 нм.
Из-за небольшого радиуса и маленького ионного заряда литий по своим свойствам больше всего напоминает не другие щелочные металлы, а элемент группы IIA магний. Литий химически очень активен. Он способен взаимодействовать с кислородом и азотом воздуха при обычных условиях, поэтому на воздухе он быстро окисляется с образованием темного налета продуктов взаимодействия:4Li + O2 = 2Li2O,
6Li + N2 = 2Li3N
При контактах с галогенами литий самовоспламеняется при обычных условиях. Подобно магнию, нагретый литий способен гореть в CO2:
4Li + CO2 = C + 2Li2O
Стандартный электродный потенциал Li/Li+ имеет наибольшее отрицательное значение (E°298 = –3,05 B) по сравнению со стандартными электродными потенциалами других металлов. Это обусловлено большой энергией гидратации маленького иона Li+, что значительно смещает равновесие в сторону ионизации металла:
Liтвердый Li+раствор + e–
Для слабо сольватирующих растворителей значение электродного потенциала лития соответствует его меньшей химической активности в ряду щелочных металлов.
Соединения лития — соли — как правило, бесцветные кристаллические вещества. По химическому поведению соли лития несколько напоминают аналогичные соединения магния или кальция. Плохо растворимы в воде фторид LiF, карбонат Li2CO3, фосфат Li2PO4, хорошо растворим хлорат лития LiClO3 — это, пожалуй, одно из самых хорошо растворимых соединения в неорганической химии (при 18°C в 100 г воды растворяется 313,5 г LiClO3).
Оксид лития Li2O — белое твердое вещество — представляет собой типичный щелочной оксид. Li2O активно реагирует с водой с образованием гидроксида лития LiOH.
Этот гидроксид получают электролизом водных растворов LiCl:
2LiCl + 2h3O = 2LiOH + Cl2 + h3
LiOH — сильное основание, но оно отличается по свойствам от гидроксидов других щелочных металлов. Гидроксид лития уступает им в растворимости. При прокаливании гидроксид лития теряет воду:
2LiOH = Li2O + h3O
Большое значение в синтезе органических и неорганических соединений имеет гидрид лития LiH, который образуется при взаимодействии расплавленного лития с водородом:
2Li + h3 = 2LiH
LiH — ионное соединение, строение кристаллической решетки которого похоже на строение кристаллической решетки хлорида натрия NaCl. Гидрид лития можно использовать в качестве источника водорода для наполнения аэростатов и спасательного снаряжения (надувных лодок и т.п.), так как при его гидролизе образуется большое количество водорода (1 кг LiH дает 2,8 м3 h3):
LiH + h3O = LiOH + h3
Он также находит применение при синтезе различных гидридов, например, борогидрида лития:
BCl3 + 4LiH = Li[Bh5] + 3LiCl.
Литий образует соединения с частично ковалентной связью Li—C, т. е. литийорганические соединения. Например, при реакции иодбензола C6H5I с литием в органических растворителях протекает реакция:
C6H5I + 2Li = C6H5Li + LiI.
Литийорганические соединения широко используются в органическом синтезе и в качестве катализаторов.
Из лития изготовляют аноды химических источников тока, работающих на основе неводных твердых электролитов. Жидкий литий может служить теплоносителем в ядерных реакторах. С использованием нуклида 6Li получают радиоактивный тритий 31H (Т):
63Li + 10n = 31H + 42He.
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий, в черной и цветной металлургии (для раскисления, повышения пластичности и прочности сплавов), для получения пластичных смазок. Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
Литий в незначительных количествах присутствует в живых организмах, но по-видимому, не выполняет никаких биологических функций. Установлено его стимулирующее действие на некоторые процессы в растениях, способность повышать их устойчивость к заболеваниям.
В организме среднего человека (масса 70 кг) содержится около 0,7 мг лития. Токсическая доза 90-200 мг.
Как и другие щелочные металлы, металлический литий способен вызывать ожоги кожи и слизистых, особенно в присутствии влаги. Поэтому работать с ним можно только в защитной одежде и очках. Хранят литий в герметичной таре под слоем минерального масла. Отходы лития нельзя выбрасывать в мусор, для уничтожения их следует обработать этиловым спиртом:
2С2Н5ОН + 2Li = 2С2Н5ОLi + Н2
Образовавшийся этилат лития затем разлагают водой до спирта и гидроксида лития LiOH.
- Плющев В. Е., Степин Б. Д. Химия и технология соединений лития, рубидия и цезия. М., 1970.
- Полуэктов Н. С., Мешкова С. Б., Полуэктова Е. Н. Аналитическая химия лития. М., 1975.
megabook.ru



















