Химические свойства. Фенилхлорметан вода
Бензилхлорид — WiKi
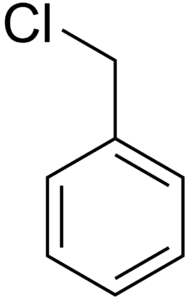
Бензилхлорид (хлористый бензил) — бесцветная жидкость с резким запахом, нерастворимая в воде, смешивается с этанолом, хлороформом и другими органическими растворителями. Лакриматор, огнеопасен.
| Бензилхлорид | |
 | |
 | |
| бензилхлорид, хлорметилбензол, α-хлортолуол | |
| C6H5Ch3Cl | |
| C7H7Cl | |
| жидкость | |
| 126,58 г/моль | |
| 1,100 г/см³ | |
| −39 °C | |
| 179,3 °C | |
| 153±1 °F[1] | |
| 1,1±0,1 об.%[1] | |
| 1±1 мм.рт.ст.[1] | |
| не растворим | |
| смешивается | |
| смешивается | |
| смешивается | |
| 1,5391 | |
| 100-44-7 | |
| 7503 | |
| 202-853-6 | |
| XS8925000 | |
| 615597 | |
| 1738 | |
| 13840690 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Получение
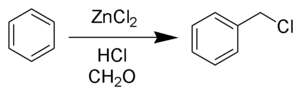
В промышленности бензилхлорид получают жидкофазным радикальным хлорированием толуола:
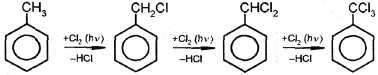
C6H5Ch4+Cl2→C6H5Ch3Cl+HCl{\displaystyle {\mathsf {C_{6}H_{5}CH_{3}+Cl_{2}\rightarrow C_{6}H_{5}CH_{2}Cl+HCl}}}Таким способом получают около 100,000 тонн бензилхлорида в год[2]. Побочными продуктами являются бензальхлорид и бензотрихлорид (C6H5CHCl2 и C6H5CCl3).
Существует несколько вариантов процесса: хлорирование толуола в присутствии 1 % PCI3 при 90—100 °C, хлорирование при УФ-облучении или в присутствии 2,2'-азо-бис-изобутиронитрила.
Кроме хлорирования при высокой температуре, реакция прекрасно протекает и при комнатной в отсутствие катализаторов при простом пропускании хлора в толуол, находящийся по возможности в высоком сосуде для более эффективного растворения газа, на солнечном свету(предпочтительно) или при искусственном освещении. При данном способе хлорирования, содержание влаги в толуоле и хлоре не оказывает сколько-нибудь заметного влияния на скорость реакции. Существует и ещё более простой оригинальный метод получения бензилхлорида в лаборатории — хлорирование толуола на поверхности раствора гипохлорита натрия или кальция (хлорной извести), введением по трубке доходящей до дна сосуда раствора соляной или серной кислоты в раствор гипохлорита. Образующийся хлор эффективно экстрагируется находящимся на поверхности слоем толуола(достаточно толщины слоя в 3-4 см) и при освещении этого слоя быстро происходит реакция. Реакция проводится также при комнатной температуре.
Бензилхлорид также может быть получен хлорированием толуола сульфурилхлоридом SO2Cl2, хлорметилирование по Блану бензола:
В лаборатории получают реакцией бензилового спирта с концентрированной соляной кислотой
Применение и реакции
- Бензилхлорид применяют для получения бензилового спирта и особенно бензилцеллюлозы (см. Целлюлоза), широко используемой в производстве пластических масс, плёнок, электроизоляционных покрытий и лаков.
- В промышленности бензилхлорид играет роль прекурсора к бензиловым эфирам, которые используются как пластификаторы, ароматизаторы и парфюмерия.
- Фенилуксусную кислоту, прекурсор к фармацевтическим препаратам, получают через бензилцианид, который образуется при обработке бензилхлорида цианидом натрия.
- Четвертичные аммониевые соли, используемые в качестве поверхностно-активных веществ, легко образуются алкилированием третичного амина бензилхлоридом:
- С карбоновыми кислотами, даёт соответствующие бензильные сложные эфиры[3].
- Бензойная кислота (C6H5COOH) может быть получена окислением бензилхлорида щелочным раствором перманганата калия (KMnO4).
- Он может быть использован в синтезе наркотиков класса амфетаминов, и по этим причинам продажи бензилхлорида находятся под мониторингом в США List II
- Бензилхлорид также легко реагирует с металлическим магнием давая реактив Гриньяра. Он предпочтительнее чем бензил бромид для получения реагента Гриньяра, так как бромид даёт в качестве продукта также продукт сочетания по Вюрцу — 1,2-дифенилэтан.
Бензилирование гетероатомных функциональных групп
Бензилхлорид — удобный бензилирующий агент для гетероатомных функциональных групп и наиболее часто используется для введения этой защитной группы[4]. Бензилирование спиртов этим реагентом достигается в условиях катализа сильным основанием таким как KOH, и в спиртовых растворителях[5] и в условиях фазового переноса с n-Bu4NHSO4[6] Оксид серебра в ДМФА также эффективен[7]Фенолы могут также быть бензилированы в условиях основного катализа [8].
Амино группы легко бензилируются при обработке бензилхлоридом в присутствии карбоната или гидроксида[9] при этом дибензилирование является конкурентной реакцией[10]. Тиолы бензилируются в присутствии гидроксида натрия или цезия карбоната и полярных растворителях, таких как этанол или ДМФА[11].
Амиды могут быть N-бензилированы бензилхлоридом при действии сильных оснований таких как метал гидриды[12] 11
Бензилирование метиленактивных соединений
Анионы и дианионы β-кетоэфиров,[13], замещённые малоновые эфиры,[14] β-кетоальдегиды,[15] β-дикетоны,[16] β-кетоамиды,[17] и β-кетонитрилы[18] все эффективно реагируют давая С-бензилированные продукты. Когда генерируется дианион из β-кетоамида, β-кетоэфир или β-дикетоне бензилируется менее кислотное положение. Нитрил стабилизированные карбанионы легко бензилируются в эфирных растворителях, аммиаке или ДМСО[19] Бензилхлорид также реагирует с карбанионами генерированными из кетонов,[20] эфиров[21], иминов (металлоенаминов) и гидразонов[22], оксимы[23].
Безопасность
Бензилхлорид является алкилирующим агентом. Он реагирует с водой, гидролизуясь до бензилового спирта и хлороводорода. Так как бензилхлорид достаточно летуч при комнатной температуре и раздражает слизистые оболочки глаз и кожу, является лакриматором.
Работу с ним ведут в вытяжном шкафу и с соответствующей защитой кожи. Бензилхлорид является мутагеном и, возможно, канцерогеном.
Ссылки
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0053.html
- ↑ Furniss, B. S.; Hannaford, A. J.; Smith, P. W. G.; Tatchell, A. R. (1989), Vogel’s Textbook of Practical Organic Chemistry (5th ed.), Harlow: Longman, p. 864, ISBN 0-582-46236-3
- ↑ Shaw, J. E.; Kunerth, D. C.; Sherry, J. J. Tetrahedron Lett. 1973, 689.
- ↑ (a) Greene, T. W.; Wuts, P. G. M., Protective Groups in Organic Synthesis, 2nd ed.; Wiley: New York, 1991. (b) Protective Groups in Organic Chemistry, McOmie, J. F. W., Ed.; Plenum: New York, 1973.
- ↑ Fletcher, H. G., Methods Carbohydr. Chem. 1963, 166.
- ↑ Freedman, H. H.; Dubois, R. A. Tetrahedron Lett. 1975, 3251.
- ↑ Kuhn, R.; Löw, I.; Trischmann, H. Chem. Ber. 1957, 90, 203.
- ↑ Heer, J.; Billeter, J. R.; Miescher, K. Helv. Chim. Acta 1945, 28, 991
- ↑ Yamashita, M.; Takegami, Y. Synthesis 1977, 803.
- ↑ Velluz, L.; Amiard, G.; Heymès, R. Bull. Soc. Chim. Fr., Part 2 1954, 1012.
- ↑ (a) Frankel, M.; Gertner, D.; Jacobson, H.; Zilkha, A. J. Chem. Soc. 1960, 1390. (b) Vogtle, F.; Klieser, B. S 1982, 294.
- ↑ (a) Xia, Y.; Kozikowski, A. P. J. Am. Chem. Soc. 1989, 111, 4116. (b) Bryant, D. R.; Work, S. D.; Hauser, C. R. J. Org. Chem. 1964, 29, 235.
- ↑ (a) Elsinger, F. OS 1973, 5, 76. (b) Stork, G.; McElvain, S. M. J. Am. Chem. Soc. 1946, 68, 1053
- ↑ Cope, A. C.; Holmes, H. L.; House, H. O. Org. React. 1957, 9, 107.
- ↑ Ravikumar, V. T.; Sathyamoorthi, G.; Thangaraj, K.; Rajagopalan, K. Indian J. Chem., Sect. B 1985, 24, 959
- ↑ Hauser, C. R.; Harris, T. M. J. Am. Chem. Soc. 1958, 80, 6360.
- ↑ Hubbard, J. S.; Harris, T. M. Tetrahedron Lett. 1978, 4601.
- ↑ Baraldi, P. G.; Pollini, G. P.; Zanirato, V. Synthesis 1985, 969.
- ↑ Arseniyadis, S.; Kyler, K. S.; Watt, D. S. Org. React. 1984, 31, 1.
- ↑ Bates, G. S.; Ramaswamy, S. Can. J. Chem. 1980, 58, 716.
- ↑ Muller-Uri, C.; Singer, E. A.; Fleischacker, W. J. Med. Chem. 1986, 29, 125
- ↑ (a) Stork, G.; Dowd, S. R. J. Am. Chem. Soc. 1963, 85, 2178. (b) Hosomi, A.; Araki, Y.; Sakurai, H. J. Am. Chem. Soc. 1982, 104, 2081
- ↑ Henoch, F. E.; Hampton, K. G.; Hauser, C. R. J. Am. Chem. Soc. 1969, 91, 676.
ru-wiki.org
Реакции электрофильного характера
⇐ ПредыдущаяСтр 3 из 4Следующая ⇒28. Напишите схему реакции гидратации пропена (пропилена).
Опишите её механизм.
Назовите продукт реакции по ЗН ИЮПАК.
Объясните отличие этой реакции от гидратации акриловой (пропеновой) кислоты, опираясь на современную трактовку правила Марковникова.
Ответ
Схема реакции гидратации пропена:
Ch4CH=Ch3 + h3O Ch4CH(OH)Ch4
Механизм реакции.
Реакция протекает в три стадии. На первой стадии, при взаимодействии с катализатором кислотного характера (Н3РО4) образуется -комплекс ( устойчивый карбокатион). На второй стадии к нему присоединяется молекула воды, на третьей происходит отщепление водородного протона.
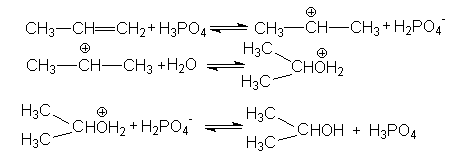
В результате реакции получается пропанол-2.
Отличие этой реакции от гидратации акриловой (пропеновой) кислотызаключается в том, что атом водорода присоединяется к менее гидрированному атому углерода в составе двойной связи:
СН2=СН-СООН+Н2О = СН2ОН-СН2-СООН
Причиной этого является распределение электронной плотности в молекуле акриловой кислоты:
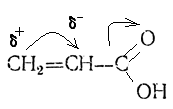
Вследствие сопряжения электронных плотностей π-связей карбоксильной группы и двойной связи и смещения общей электронной плотности в сторону более электроотрицательного атома кислорода на менее гидрированном атоме С возникает частичный отрицательный заряд, на более гидрированном – частичный положительный заряд. В соответствии с современной трактовкой правила Марковникова присоединение электрофильной частицы Н+ происходит в соответствии с распределением электронной плотности, к частице с повышенной электронной плотностью.
29. Напишите схему реакции бромирования анилина.
Опишите её механизм.
Назовите продукт бромирования по ЗН ИЮПАК.
Укажите ориентирующее действие аминогруппы.
Объясните, что легче бромируется бензол или анилин.
Решение
1. Схема реакции бромирования анилина
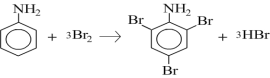
Механизм реакции - электрофильное замещение в ароматическом ядре. Специфической особенностью является избыточная электронная плотность в о- и п-положениях, обусловленная +М-эффектом аминогруппы. Реакция проходит в две стадии. На первой стадии (электрофильное присоединение) в о- и п-положениях образутся нестойкий δ-комплекс, лишенный ароматической структуры, с четырьмя π –электронами, делокализованными в сфере воздействия ядер пяти углеродных атомов. Шестой углеродный атом при этом переходит из состояния sp2-гибридизации в состояние sp3, приобретая таким образом тетраэдрическую симметрию. Оба заместителя Br и Н лежат в плоскости, перпендикулярной к плоскости кольца. На второй стадии лабильный δ-комплекс превращается в стабильный 2,4,6 триброманилин с потерей 3 протонов
Ориентирующее действие аминогруппы происходит в положения 2,4,6:

Бромирование анилина происходит легче, чем бромирование бензола, вследствие сопряжения неподеленной электронной пары азота с электронами ароматического ядра. Это, в свою очередь, приводит к увеличению электронной плотности в бензольном кольце, что способствует более быстрому протеканию реакции электрофильного замещения.
30. Напишите схему реакции бромирования бензойной кислоты (катализатор FеBr3).
Опишите её механизм.
Назовите продукт бромирования по ЗН ИЮПАК.
Укажите ориентирующее действие заместителя.
Объясните, что легче бромируется – бензол или бензойная кислота.
Ответ
Схема реакции бромирования бензойной кислоты (катализатор FеBr3):
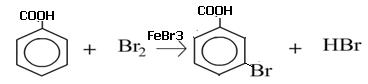
Механизм реакции - электрофильное замещение в ароматическом ядре. Специфической особенностью является повышенная по сравнению с другими атомами электронная плотность в м-положении, обусловленная -М-эффектом карбоксильной группы. Реакция проходит в две стадии. На первой стадии (электрофильное присоединение) в м-положении образуется нестойкий δ-комплекс, лишенный ароматической структуры, с четырьмя π –электронами, делокализованными в сфере воздействия ядер пяти углеродных атомов. Шестой углеродный атом при этом переходит из состояния sp2-гибридизации в состояние sp3, приобретая таким образом тетраэдрическую симметрию. Оба заместителя Br и Н лежат в плоскости, перпендикулярной к плоскости кольца. На второй стадии лабильный δ-комплекс превращается в стабильную 3-бромбензойную кислоту с потерей 1 протона.Название продукта бромирования по ЗН ИЮПАК -3-бромбензойная кислотаОриентирующее действие заместителя обусловлено отрицательным мезомерным эффектом карбоксильной группы, усиливающим электронную плотность в м-положении(3 и 5- положение):
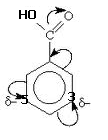
Легче бромируется бензол, так как вследствие отрицательного мезомерного эффекта карбоксильной группы происходит уменьшение электронной плотности на бензольном кольце.
31. Напишите схемы реакций алкилирования бензола третичным изобутанолом и пропеном в кислой среде.
Опишите механизм этих реакций.
Назовите продукты алкилирования по ЗН ИЮПАК.
Ответ
Схемы реакций алкилирования бензола пропеном (реакция (а) и третичным изобутанолом (реакция (b) в кислой среде:
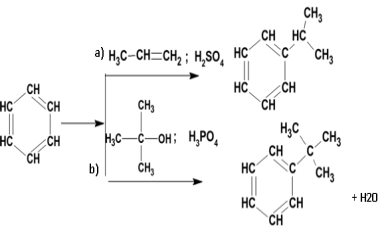
.Механизм этих реакций –электрофильное замещение, катализируемое минеральными кислотами. В качестве электрофильной частицы выступает карбкатион, который образуется либо при присоединении протона к олефину, либо при отщеплении воды от молекулы спирта под действием протона.
В обеих рассматриваемых реакциях (а и b) образуется один продукт алкилирования – изопропилбензол (кумол). В реакции b) также выделяется вода.
3. Реакции нуклеофильного характера
32. Напишите схему реакции взаимодействия 1-бромпропана с этилатом натрия.
Опишите ее механизм.
Укажите нуклеофил, субстрат, уходящую группу.
Ответ
Схема реакции взаимодействия 1-бромпропана с этилатом натрия:

Механизм реакции: замещение нуклеофильное, бимолекулярное, SN2
Реакция происходит в одну стадию. При этом атака нуклеофила и отщепление уходящей группы происходит одновременно:
C3H7Br + C2H5O- → [C2H5O-⋯ C3H7⋯ Br]− → C2H5-O-C3H7+ Br –
Нуклеофил - этилат-анион C2H5O-,
субстрат - 1-бромпропан, СН3СН2СН2Br,
уходящая
33. Напишите схему реакции гидролиза бензилхлорида (фенилхлорметана).
Опишите её механизм.
Укажите нуклеофил, субстрат, уходящую группу.
Объясните причину повышенной устойчивости бензильного катиона.
Ответ

2.Гидролиз бензилхлорида в щелочном водном растворе является реакцией нуклеофильного замещения (Sn). Механизм реакции: замещение нуклеофильное, бимолекулярное, SN2.
Реакция происходит в одну стадию. При этом атака нуклеофила и отщепление уходящей группы происходит одновременно:
C6H5СН2Cl + -OH → [OH ⋯ C6H5СН2⋯ Cl]− → C6H5СН2 OH + Cl –
3.Нуклеофил - гидроксил-анион -OH ,
субстрат - бензилхлорида, C6H5СН2Cl,
уходящая группа - Cl –
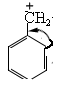
4. Причина повышенной устойчивости бензильного катиона –сопряжение электронной плотности метиленовой группировки СН2 с электронной плотностью бензольного кольца:
34. Напишите схему реакции получения полуацеталя и ацеталя из пропаналя и этанола.
Опишите механизм этой реакции.
Обоснуйте роль кислотного катализатора.
Ответ
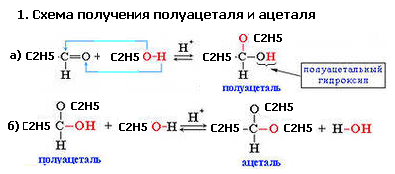
2. Механизм реакции – ионная реакция нуклеофильного приcоединения АN
Процесс – ступенчатый. На первом этапе происходит образование нуклеофильной частицы. Затем она атакует двойную связь и образуется отрицательно заряженный комплекс. Далее происходит его нейтрализации путем протонирования. В присутствии следов минеральной кислоты процесс продолжается и приводит к образованию ацеталей
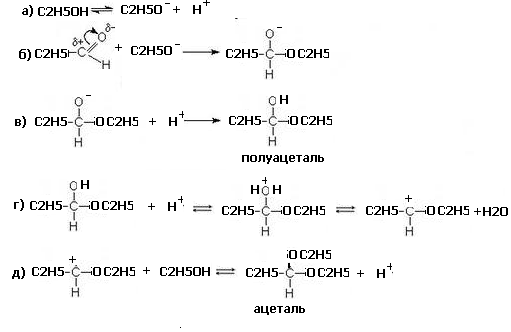
3. Роль кислотного катализатора заключается в протонировании полуацеталя на стадии г)
35. Напишите схему реакции взаимодействия этаналя с метиламином.
Опишите механизм этой реакции.
Обоснуйте роль кислотного катализатора.
Объясните возможность протекания реакции гидролиза полученного имина в кислой и щелочной среде.
Ответ

2.Механизм этой реакции –нуклеофильное присоединение с последующим отщеплением молекулы воды
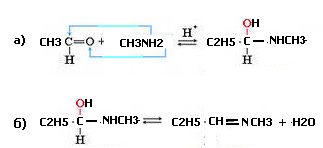
3. Роль кислотного катализатора – протонирование на стадии а)
4. В присутствии разбавленных кислот имины гидролизуются водой с образованием карбонильных соединений и аминов, эта реакция обратна реакции синтеза иминов:
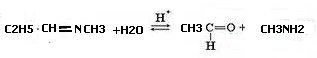
В присутствии щелочи гидролиз не идет
Читайте также:
lektsia.com
Химические свойства
Ароматичность определяет химические свойства бензола и его гомологов. Шестиэлектронная π-система является более устойчивой, чем обычные двухэлектронные π-связи. Поэтому реакции присоединения менее характерны для ароматических УВ, чем для непредельных УВ. Наиболее характерными для аренов являются реакции замещения. Таким образом, ароматические УВ по своим химическим свойствам занимают промежуточное положение между предельными и непредельными УВ.
Свойства бензола
| Тип, название реакции | Уравнения реакций |
| I. Реакции замещения 1. Галогенирование (с Cl2, Вr2) | AlCl3
Хлорбензол (илиFeCl3) |
| 2. Нитрование | h3SO4(конц.)
(конц.) нитробензол |
| 3. Сульфирование | H+,T
бензолсульфокислота (конц.) (сульфобензол) |
| 4. Алкилирование (образуются гомологи бензола) — реакции Фриделя-Крафтса | AlCl3
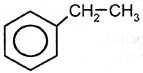
толуол Алкилирование бензола происходит также при его взаимодействии с алкенами: AlCl3,T
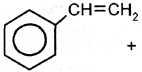
этилбензол Дегидрированием этилбензола получают стирол (винилбензол): Kat,T
|
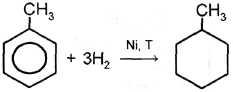
| II. Реакции присоединения 1. Гидрирование | Ni,T,P
|
| 2. Хлорирование | hv(УФ)
гексахлорциклогексан (гексахлоран) |
| III. Реакции окисления 1. Горение | Т 2C6H6 + 15O2 12CO2 + 6h3O |
| 2. Окисление под действием КМnО4, К2Сr2О7, HNO3 и др. | Не происходит (сходство с алканами) |
Свойства гомологов бензола
В гомологах бензола различают ядро и боковую цепь (алкильные радикалы). По химическим свойствам алкильные радикалы подобны алканам; влияние бензольного ядра на них проявляется в том, что в реакциях замещения всегда участвуют атомы водорода у атома углерода, непосредственно связанного с бензольным ядром, а также в более легкой окисляемости С–Н связей. Влияние электронодонорного алкильного радикала (например, –СН3) на бензольное ядро проявляется в повышении эффективных отрицательных зарядов на атомах углерода в орто- и пара-положениях; в результате облегчается замещение связанных с ними атомов водорода. Поэтому гомологи бензола могут образовывать тризамещенные продукты (а бензол обычно образует монозамещенные производные).
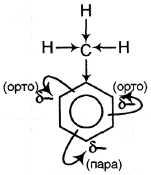
| Тип, название реакции | Уравнения реакций |
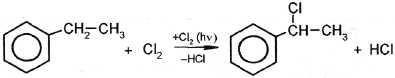
| I. Реакции с участием боковой цепи 1. Галогенирование |
толуол фенилхлорметан фенилдихлорметан фенил- трихлорметан
этилбензол 1-фенил-1 хлорэтан |
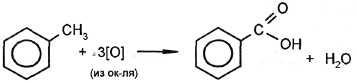
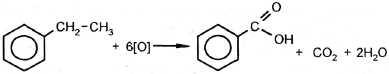
| 2. Окисление под действием KMnO4, HNO3 и др. |
толуол бензойная кислота
этилбензол бензойная кислота
о-ксилол о-фталевая кислота |
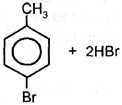
| II. Реакции с участием бензольного ядра 1. Галогенирование |
толуол о-бромолуол n-бромолуол При избытке галогена:
толуол 2,4,6-трибромтолуол |
| 2. Нитрование | h3SO4(конц.)
Т толуол 2,4,6-тринитротолуол(тротил) |
| 3. Гидрирование |
толуол метилциклогексан |
studfiles.net


![{\displaystyle {\mathsf {C_{6}H_{5}CH_{2}Cl{\xrightarrow[{}]{NaCN}}C_{6}H_{5}CH_{2}CN{\xrightarrow[{}]{H_{2}O}}C_{6}H_{5}CH_{2}COOH}}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/b9c65d785b7a0daac3171ddfe45b74bd18e6a56f)
![{\displaystyle {\mathsf {R_{3}N+C_{6}H_{5}CH_{2}Cl\rightarrow [R_{3}N(C_{6}H_{5}CH_{2})]^{+}Cl^{-}}}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/60f446137c8a356400fae69c4748bd2f5a8002fb) C6H5Ch3Cl→ROHC6H5Ch3OR→Pdh3ROH+C6H5Ch4{\displaystyle {\mathsf {C_{6}H_{5}CH_{2}Cl{\xrightarrow[{}]{ROH}}C_{6}H_{5}CH_{2}OR{\xrightarrow[{Pd}]{H_{2}}}ROH+C_{6}H_{5}CH_{3}}}}
C6H5Ch3Cl→ROHC6H5Ch3OR→Pdh3ROH+C6H5Ch4{\displaystyle {\mathsf {C_{6}H_{5}CH_{2}Cl{\xrightarrow[{}]{ROH}}C_{6}H_{5}CH_{2}OR{\xrightarrow[{Pd}]{H_{2}}}ROH+C_{6}H_{5}CH_{3}}}}![{\displaystyle {\mathsf {C_{6}H_{5}CH_{2}Cl{\xrightarrow[{}]{ROH}}C_{6}H_{5}CH_{2}OR{\xrightarrow[{Pd}]{H_{2}}}ROH+C_{6}H_{5}CH_{3}}}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/5f2481cdd4506614eceefa19048a1478d2126362)
![{\displaystyle {\mathsf {C_{6}H_{5}CH_{2}Cl{\xrightarrow[{OH^{-}}]{KMnO_{4}}}C_{6}H_{5}COOH}}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/49c375ed5f43a9fed9a23a44f89a7f83bdee891a)
 + Cl2
+ Cl2  +HCl
+HCl + HO–NO2
+ HO–NO2  + h3O
+ h3O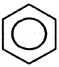 + HO–SO3H
+ HO–SO3H 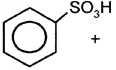 h3O
h3O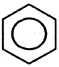 + Ch4Cl
+ Ch4Cl 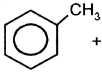 HCl
HCl + Ch3=Ch3
+ Ch3=Ch3 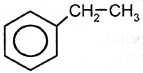
 h3
h3 + 3h3
+ 3h3  циклогексан
циклогексан + 3Cl2
+ 3Cl2 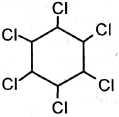
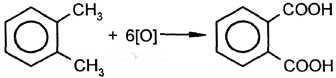
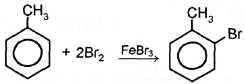 +
+
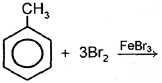
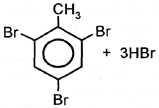
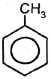 + 3HO–NO2
+ 3HO–NO2 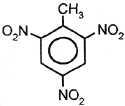 +3HBr
+3HBr