Справочник химика 21. Дипольность воды
Неорганические вещества в клетке. Вода, соли.
Большинство химических соединений, которые входят в состав клетки, встречаются только в живой природе. Почти все молекулы за небольшим исключением, встречающиеся в клетке, относятся к соединениям углерода и рассматриваются в курсе органической химии. Однако вода встречается и в живой, и в неживой природе. В среднем почти 70% от массы живых организмов составляет вода. Но содержание воды в клетке может колебаться в зависимости, например, от ее конкретного вида или возраста. Помимо воды в клетках в значительных количествах встречаются некоторые соли, которые важны для осуществления функций живых организмов.
Вода.
Вода (h3O) представляет собой вещество, которое в физическом и химическом отношении существенно отличается от других растворителей. Жизнь возникла в первичном океане, и в процессе дальнейшего развития природа использовала уникальные свойства воды.
У воды в отличии от других жидкостей необычайно высокие температуры кипения и плавления и высокая удельная теплоемкость. Также отличительными особенностями воды являются большая удельная теплота испарения, плавления и высокое поверхностное натяжение. Вода имеет все эти свойства благодаря тому, что ее молекулы более прочно связаны друг с другом в отличии от молекул других растворителей.
Эти уникальные свойства воды оказывают большое влияние на жизнедеятельность клеток. Например, высокая теплоемкость воды, т.е. способность поглощать тепло при незначительном изменении своей собственной температуры, предохраняет клетки от резких изменений температуры. Высокую теплоту испарения воды живые организмы используют для предохранения от перегрева. Вспомним, что испарение жидкости животными и растениями — это защитная реакция на повышение температуры. Благодаря высокой теплопроводности воды обеспечивается равномерное распределение теплоты по всему организму, а благодаря тому, что вода плохо сжимается, клетки обладают упругостью и могут поддерживать свою форму.
Свои уникальные физические и химические свойства вода получила благодаря особенностям структуры своей молекулы, а точнее, благодаря тому, как именно в молекуле воды располагаются электроны в атомах кислорода и водорода. Два электрона, располагающиеся на внешней электронной орбите атома кислорода в молекуле воды, объединяются с двумя электронами, принадлежащими атомам водорода (у атома водорода на внешней орбите только один электрон). Благодаря этому в молекуле воды образуются две ковалентные связи (между атомом кислорода и двумя атомами водорода). Электроотрицательность* атома кислорода выше, чем у атомов водорода, благодаря чему, электроны притягиваются к нему сильнее. В результате этого на атоме кислорода появляется частично отрицательный заряд, а на атомах водорода — частично положительный. Между более отрицательно заряженными атомами кислорода одних молекул воды и более положительно заряженными атомами водорода других молекул воды образуются так называемые водородные связи, и молекулы воды оказываются связанными между собой.
* Электроотрицательность — это способность атома в молекуле смещать к себе общие электронные пары. Относится к фунадментальным свойствам атома и выражается в количественных характеристиках.

5 молекул воды с водородными связями между ними
На рисунке изображены молекулы воды. Ковалентные связи связывают атомы кислорода и водорода внутри каждой молекулы (сплошные линии), а водородные связи образуются между соседними молекулами (пунктирные линии).
Водородные связи примерно в 20 раз более слабые, чем ковалентные. Поэтому они легко образуются и разрываются. Даже при температуре кипения (100°С) взамодействие между молекулами воды остается достаточно сильным. Именно водородные связи обеспечивают структурированность воды и объясняют такие ее свойства, как высокие температуры кипения и плавления, а также высокую теплоемкость.
Другое важное свойство молекулы воды — ее дипольность. В молекуле воды, как отмечалось ранее, атомы кислорода имеют небольшой отрицательный заряд, а атомы водорода — положительный. Т.к. угол между связями H-O-H составляет 104.5°, получается, что отрицательный заряд в молекуле воды сосредотачивается на одной стороне, а положительный — на другой. Благодаря дипольности молекулы воды имеют способность к ориентации в электрическом поле. Это свойство объясняет, что вода является уникальным растворителем. Если в молекулах веществ присутствуют заряженные группы атомов, они, вступая в электростатическое взаимодействие с молекулами воды, растворяются в ней. Такие вещества с заряженными или полярными группами, растворяющиеся в воде, называются гидрофильными.

Растворение NaCl в воде.
Способность воды растворять кристалл NaCl зависит от электростатического притяжения между полярными молекулами воды и заряженными ионами натрия и хлора.
К гидрофильным соединениям, которые в большом количестве есть в клетках, относятся соли, некоторые низкомолекулярные органические соединения (органические кислоты, аминокислоты, простые сахара), а также полимеры: некоторые полисахариды, белки, нуклеиновые кислоты. Однако существует ряд веществ, почти не имеющих заряженных атомов, и, поэтому, не растворяющихся в воде. Такие вещества называются гидрофобными. К ним, например, относятся липиды (жиры). Гидрофобные вещества не взаимодействуют с водой, но могут взаимодействовать друг с другом. Поэтому они хорошо растворяются в некоторых органических растворителях, как, например, хлороформ. Липиды, относящиеся к гидрофобным соединениям, формируют двумерные структуры (биологические мембраны), практически непроницаемые для воды.
По сравнению с другими растворителями вода может растворить больше химических веществ, благодаря своей полярности. Жизнедеятельность клетки невозможна без многочисленных химических реакций, которые осуществляются в ее водной среде, где растворены различные химические вещества. Также вода растворяет и продукты реакций. Затем в растворенном виде они выводятся из клеток и многоклеточных организмов. За счет перемещения воды в организмах животных и растений осуществляется обмен различными веществами между тканями. Еще одним важным свойством воды является то, что, как химическое соединение, вода вступает во многие химические реакции, которые протекают в клетке. Такие реакции называют реакциями гидролиза. В свою очередь, молекулы воды сами образуются в результате многих реакций в клетках живых организмов.
Т.к. масса атома водорода мала, а атом кислорода в молекуле воды удерживает его единственный электрон, протон (ядро атома водорода, лишенное электрона) способен отрываться от молекулы воды. В результате этого из молекулы воды образуются гидроксильный ион (ОН—) и протон (Н+).
h3O <—> H+ + OH—
Данный процесс называют диссоциацией воды. Гидроксильные ионы и протоны, которые образуются при диссоциации воды, являются, в свою очередь, участниками многих важных реакций в живых организмах.
Соли.
В жизнедеятельности клетки также очень важны соли, растворенные в воде. Главным образом соли представлены катионами калия (К+), натрия (Na+), магния (Mg2+), кальция (Ca2+) и других металлов, а также анионами соляной (Cl—), угольной (НСО3—) и фосфорных кислот (Н2РО4—, НРО42-).
Многие катионы характеризуются неравномерным распределением между клеткой и окружающей ее средой. Например, для цитоплазмы характерна более высокая концентрация К+, чем для окружающей клетку среды, между тем, в той же цитоплазме концентрация Na+ и Са2+ будет ниже, чем снаружи клетки. В качестве внешней среды по по отношению к клетке может выступать не только природная среда, например, океан, но и жидкости внутри живого организма, такие как кровь или тканевая жидкость, близкие по своему ионному составу к морской воде. В процессе жизнедеятельности неравномерное распределение катионов между клетками и окружающей их средой постоянно поддерживается, на это затрачивается значительная часть энергии в клетках. Такая неравномерная концентрация ионов между клетками и окружающей их средой необходима для многих процессов жизнедеятельности, к примеру, для передачи возбуждения по нервным и мышечным клеткам или сокращения мышц. Когда клетка умирает, концентрация катионов внутри нее и снаружи быстро становится одинаковой.
Кислотность цитоплазмы клетки в процессе жизнедеятельности практически нейтральная (т.е. значение концентрации ионов водорода (рН) в цитоплазме находится в диапазоне 6,5-7,5). Это происходит несмотря на то, что в процессе жизнедеятельности в клетке образуются и щелочи, и кислоты. Важную роль в поддержании нейтральной кислотности играют анионы слабых кислот (НСО3—, НРО42-), содержащиеся в клетке. Анионы слабых кислот нейтрализуют внутриклеточную среду, связывая протоны кислот и гидроксильные ионы щелочей.
Необходимо отметить, что анионы слабых кислот вступают в химические реакции, происходящие в клетке. Например, для синтеза АТФ, одного из важных соединений для клетки, необходимы анионы фосфорной кислоты. О синтезе АТФ я расскажу более подробно позднее. Неорганические вещества в живых организмах содержатся не только в растворенном, но и в твердом состоянии. В качестве примера можно привести кости, где преобладает фосфат кальция и в меньшем количестве фосфат магния. В раковинах моллюсков преобладает карбонат кальция.
Перейти к оглавлению.
from your own site.
www.studentguru.ru
Свойства воды дипольные - Справочник химика 21
Все галогеноводороды хорошо растворимы в воде. Водные растворы их обладают кислотными свойствами и носят название галогеноводородных кислот. Объясняется это сильной полярностью связей Н — Г, приводящей к диссоциации под действием дипольных молекул воды по этой связи НГ + (п + т) Нр -> Н+ пИЛ + Г- тН О = НЧ- Г. [c.63]Трифторид азота NF3 в обычных условиях — бесцветный газ (т. кип. —129°С, т. пл. —209°С). Получают его при окислении аммиака фтором. Молекула NFs имеет пирамидальное строение (см. рис. 38), dNF=l,37A, FNF=102°. В отличие от h4N дипольный момент NF3 очень мал, всего 0,2D (стр. 81). Электронодонорных свойств NF3 практически не проявляет. По отношению к нагреванию и различным химическим воздействиям трифторид весьма устойчив, вступает в реакции только выше 100°С. В воде он практически нерастворим, гидролиз начинает протекать лишь при пропускании электрической искры через смесь его с водным паром. [c.397]
Эта формула дает лучшую сходимость с опытом, чем формула Борна. Метод Ван-Аркеля и де-Бура отличается от борновского тем, что в нем процесс гидратации разделяется на два этапа. Энергия образования первого гидратного слоя вычисляется на основе взаимодействия между газообразным ионом и полярными молекулами воды, т. е. взаимодействия, происходящего вне сферы жидкой фазы. Такой способ расчета позволяет учесть свойства отдельных молекул воды (их дипольные моменты, поляризуемость и т. п.). Поэтому при рассмотрении процесса образования первого гидратного слоя, где эти свойства особенно важны, появляется возможность отказаться от представления о воде лишь как о среде с определенной диэлектрической пропицаемостью. Поскольку на второй стадии цикла в воду вносится ион, уже частично гидратированный, с радиусом, зиачителглю большим, чем радиус исходного иона, то одна и та же ошибка в его определении здесь будет иметь меньи ее значение. Возмуихения, вызванные введением такого гидратированного иоиа в воду, будут меньшими, и представление о воде как о непрерывной среде с определенной диэлектрической проницаемостью, а следовательно, и применение формулы (2.14) оказываются более оправданными, чем в методе Борна. Молекулу воды Ван-Аркель и де-Бур представляют себе в виде с([)еры с радиусом 0,125 нм и электрическим моментом диполя, равкым 6,17-10 ° Кл.м (1,85 0). [c.59]При рассмотрении электрических свойств молекул было показано, как ведут себя дипольные молекулы в поле заряженной частицы или иона. Попытаемся распространить изложенное воззрение на процесс обезвоживания веществ активны.ми молекулами или ионами. Процесс обезвоживания сводится к удалению из вещества молекул растворителя. Если растворителем вещества являются жидкости, молекулы которых обладают постоянным дипольным моментом, то при сообщении (ему энергии первыми, как правило, вырвутся из него молекулы, обладающие максимальным дипольным моментом. По всей вероятности, такие молекулы лри вылете из вещества могут иметь и своих спутников — молекул с меньшим дипольным моментом. При этом вылет комплексных молекул из вещества происходит в результате взаимодействия молекул с различным дипольным моментом. Дипольные молекулы в силу асимметрии обладают большей способностью к колебательным и вращательным движениям и находятся как бы в неустойчивом положении в веществе. В качестве примера можно привести процесс обезвоживания окрашенной ацетилцеллюлозы (вальцмассы), растворителем которой являются ацетон и вода. Дипольный момент [c.187]
Особенно показательно сопоставление структур и физических свойств воды и диметилового эфира. В жидкой воде молекулы держатся вместе благодаря диноль-дипольным взаимодействиям между положительными атомами водорода и отрицательными атомами кислорода. Форма молекулы воды допускает разнообразные расположения в молекулярных агрегатах лишь бы только частичные заряды были обращены к (противоположным) зарядам близлежащих молекул. В молекулах диметилового эфира эти частичные заряды загорожены относительно неполярными углерод-водородными связями. Отсюда следует, что диполь-дипольные взаимодействия должны преодолевать большие расстояния и их эффект соответственно уменьшается. Модели молекулярных агрегатов воды и эфира изображены на рис. 7.4. [c.161]
Многие свойства воды, такие, как значительный дипольный момент, амфотерный характер, большая диэлектрическая проницаемость и, наконец, ее доступность и легкость очистки, ставят воду как растворитель в особое положение. Но в некоторых случаях неводные среды могут быть применены с большим успехом. Началом исследований в этой области является применение теории Дебая—Хюккеля к неводным растворителям, используемым в качестве среды в органических реакциях. Некоторые неводные растворители, например безводный фтористый водород, применяются в промышленном масштабе. Поэтому удивительно, что еще так мало известно о многих неводных растворителях. [c.505]
Наиболее важным свойством молекулы воды является наличие у нее дипольного момента. Именно это определяет ее структуру (см. гл. V) и в значительной мере функциональную активность растворенных в ней макромолекул. Молекулы, играющие основную роль в живых клетках, при растворении в воде оказываются заряженными и подвергаются гидратации. Они окружены оболочками из молекул воды, которые притягиваются к ним, благодаря взаимодействию электрических зарядов. Небольшая, но все-таки ощутимая диссоциация воды на ионы Н+ и ОН позволяет регулировать кислотно-основное равновесие в клетках. Все эволюционное развитие определялось и формировалось в соответствии со свойствами воды. Однако если бы все части клетки были раство- [c.176]
Полярность карбонильной группы обусловливает многие из свойств альдегидов и кетонов. Температуры кипения для низших членов этих рядов на 50—80° выше, чем для углеводородов той же молекулярной массы это можно видеть из данных табл. 14-3 (физические свойства альдегидов и кетонов) и табл. 3-3 (физические свойства -алканов). Дипольные моменты большинства альдегидов и кетонов близки к 2,7 Д, что соответствует 40—50% ионного характера связи в карбониле. Для альдегидов и кетонов с низкой молекулярной массой характерна большая растворимость в воде. [c.470]
Каждое вещество в данном растворителе и при данных условиях характеризуется определенной степенью ионизации. Степенью ионизации вещества в растворе называется отношение числа ионизированных молекул к общему числу растворенных. Степень ионизации в основном определяется электроно-донорными и электроно-акцеп-торными свойствами растворенного вещества и растворителя. Для многих соединений наиболее сильно ионизирующими растворителями являются вода, жидкие аммиак и фторид водорода. Эти соединения состоят из дипольных молекул и склонны к донорно-акцепторному взаимодействию и образованию водородной связи. Например, НС1 хорошо ионизируется в воде, что связано с превращением водородной связи НаО- -H l в донорно-акцепторную [НгО—Н] + [c.161]
Внимательный анализ показывает, что это не так. Свойства воды в сущности не неожиданны, это вполне закономерный переход количественных факторов в качественные. Размеры молекул гидридов теллура, селена, серы и кислорода уменьшаются от теллура к кислороду, дипольный момент растет, напряженность электрического поля около молекулы увеличивается. Вместе с тем уменьшается число электронов, окружающих атом неметалла, от- [c.40]
Наличие дипольных моментов у адсорбционных комплексов влияет на структуру и структурно-механические свойства паст и суспензий, а также частично и на процессы твердения вяжущих веществ. Две формы связей воды с поверхностью твердых частиц (адсорбционная и свободная) оказывают влияние и на процессы сушки сырьевых смесей. [c.260]
Водородные связи. Соединения, содержащие кислород-водородные или азот-водородные связи, обнаруживают признаки ассоциации, которая, если судить по молекулярному весу, дипольным моментам и молекулярной поляризуемости этих соединений, превышает все ожидания. К примеру, вода, у которой атомы не обладают высокой поляризуемостью, плавится при 0° и кипит при 100°, между тем как диметиловый эфир, метиловый спирт и ацетон-соединения с более высоким молекулярным весом — кипят при —24, 65 и 57° соответственно и плавятся при очень низких температурах. Нет большой разницы и в дипольных моментах этих веществ. Следовательно, исключительно высокая степень ассоциации воды должна объясняться каким-то коротко дистанционным взаимодействием, которое находит свое отражение не во всех макроскопических свойствах молекул воды. Из сопоставления физических свойств воды, метилового спирта и диметилового эфира следует, что гидроксильная группа имеет резко выраженное специфическое влияние на физические свойства. [c.161]
Спектроскопические исследования молекул воды в газообразном состоянии позволили сделать вывод о нелинейном их строении. Ядра атомов молекулы воды образуют равнобедренный треугольник с двумя протонами в основании и кислородом в вершине. Причем угол связи Н—О—Н для низшего колебательного уровня равен 105° 03, а межъядерные расстояния О—Н и Н—Н 0,9568 и 1,54 A [66,319] молекуле воды свойственен дипольный момент 1,86 D, но несмотря на это, при решении многих вопросов правильное истолкование свойств воды возможно только на основе изучения строения электронного облака ее молекулы. Описание молекулы воды в этом плане проводят при помощи электростатических моделей, моделей, [c.159]
Из предыдущего изложения видно, что определенные свойства воды можно довольно удовлетворительно объяснить исходя из величины углов, образуемых химическими связями, и из электростатических сил, обусловленных распределением зарядов. Поскольку размеры и заряды простых ионов сравнимы с размерами и заряда ш молекул воды, естественно ожидать, что ионы должны притягивать эти молекулы, следствием чего будет образование ион-дипольных связей. Поэтому в растворах, содержащих ионы, структура воды должна быть существенно изменена. [c.15]
Ассоциация воды и спиртов приводит к заметному изменению их физических свойств. По сравнению с веществами, не образующими водородных связей, они при относительно малом дипольном моменте имеют более высокую температуру кипения, более высокую диэлектрическую проницаемость и т. д. [c.248]
Точные нейтронографические исследования показали, что чем короче (сильнее) связь А-Н, тем длиннее (слабее) водородная связь А-Н...В. Водородная связь является важнейшей формой взаимодействия между молекулами воды и обусловливает вместе с электростатическим притяжением электрических дипольных моментов удивительные свойства воды и льда. Водородная связь ограничивает размеры белковых молекул и обусловливает их геометрическую структуру. [c.74]
Эти величины, выраженные в логарифмических единицах и приведенные в последней графе таблицы, изменяются от 3,5 для уксусной кислоты до 0,8 для 2,6-динитрофенола. Это показывает, что различное влияние ацетона на силу кислот при переходе от смеси диоксана с водой (смешанный растворитель обладает химическими свойствами, близкими к воде, но диэлектрической проницаемостью ацетона) определяется прежде всего отличием в энергии сольватации (взаимодействия) анионов кислот с дипольными [c.338]
Рассмотрим результаты расчета некоторых свойств объемной фазы воды для двух моделей. В модели межмолекулярного потенциала ST2 [340] используются четыре точечных заряда, расположенных в вершинах тетраэдра. Электростатическое взаимодействие плавно выключается при малых расстояниях между молекулами. Короткодействующие силы отталкивания учитываются потенциалом Леннарда — Джонса 6-12 между атомами кислорода. Дипольный момент. молекулы воды равен 2,35 Д, а абсолютный минимум энергии.-димера воды составляет 28,4 кДж/моль при расстоянии 0,285 нм между атомами кислорода. [c.120]
Наиболее удобными методами изучения кластеров (НгО) (л>2) являются различные варианты масс-спектроскопической техники [363]. Естественно, что чем ниже температура эксперимента, тем более крупные кластеры (с большим п) удается наблюдать. Так, удалось зарегистрировать в спектре пик, соответствующий п= [368] и /г = 36 (температура 77 К) [369]. При температуре жидкого азота были зарегистрированы положительно заряженные кластеры с л от 1 до 40 [370]. В работе [371] удалось наблюдать отрицательно заряженные кластеры, содержащие вплоть до 50 молекул воды. В этой работе была сделана попытка изучить структуру этих кластеров методом электронной дифракции. Авторы приходят к выводу, что по своей структуре эти кластеры не являются фрагментами кристаллов льда, а аморфны. Были также оценены дипольные моменты кластеров с л от 2 до 6 дипольные моменты кластеров с п = = 3- 6 близки к нулю, что, по мнению авторов, свидетельствует о циклическом характере их структуры [361]. Много экспериментальных данных о существовании и свойствах кластеров, состоящих из нескольких десятков молекул воды, приводится в работе [372]. [c.133]
В работе [43] показано, что изменение диэлектрической проницаемости и тангенса угла диэлектрических потерь пленочной воды с утончением пленки свидетельствует о вырождении дипольной ориентационной поляризуемости молекул воды в пленке, обусловленном действием полей поверхностных молекул сорбента. Поэтому уменьшается вклад пленочной воды в диэлектрические свойства обрабатываемого материала по мере утончения пленки. Если принять, что фактор потерь связанной жидкости зависит от толщины пленки h по некоторому закону 62" = Л )> то формулу (7.34) можно записать в [c.168]
Эти свойства жидкой воды связаны с необычайностью ее структуры, которая и заключается в наличии водородной связи, образующейся в молекулах воды вследствие существования неподелен-ных электронных пар. Электронные пары расположены на двух орбиталях, лежащих в плоскости, перпендикулярной к плоскости НОН (рис. 1.5). За счет неподеленных пар электронов в каждой молекуле воды могут возникнуть две водородные связи. Еще две связи могут обеспечить два водородных атома. Таким образом, только одна молекула воды в состоянии образовать четыре водородных связи. Благодаря этому результирующее распределение зарядов в молекуле воды напоминает тетраэдр, два угла которого заряжены положительно, а два — отрицательно. Результирующий центр положительных зарядов находится посредине между протонами. Он отделен от результирующего центра отрицательных зарядов, расположенного вблизи атома кислорода с противоположной Т5Т протона стороны. Вследствие этого молекула воды оказывается электрическим диполем с дипольным моментом, равным Кл-м (отсюда и высокая диэлектрическая проницаемость воды, и связанная с ней способность растворять ионные вещества). [c.23]
Углеводородный радикал (в простейшем случае прямая насыщенная алкильная цепочка) имеет дипольный момент, равный нулю или близкий к таковому, и проявляет гидрофобные свойства, т. е. практически не имеет молекулярного сродства к воде. Вместе с тем он проявляет сродство к близким по полярности фазам — углеводородам и другим нерастворимым или слаборастворимым в воде органическим соединениям (маслам). [c.5]
Укажите строение молекул по методу молекулярных орбиталей, их протолитические (по отношению к воде), окислительно-кос-становительные, обменные, лигандные и другие (по Вашему выбору) свойства, склонность молекул к димеризации. Составьте уравнения необходимых для ответа реакций. На основе этих сведений сделайте вывод о реакционной способности указанных веп еств. При ответе воспользуйтесь справочными данными по энергии и длине связи, дипольному моменту, стандартной энтальпии и энергии Гиббса образования, стандартной энтропии и растворимости в воде. [c.154]
Ни одна из предложенных моделей не учитывает сразу все три типа взаимодействий, однако подход с позиций микроскопииеской модели позволяет учесть также и ион-дипольные эффекты. Наличие кислотных или основных групп в молекулах N приводит к появлению дополнительных взаимодействий, описываемых с помощью других механизмов, а именно с помощью изменения сольватации неэлектролита в результате образования водородных связей, которое определяется нарушением кислотно-основных свойств воды- Специфические взаимодействия, учитываемые уравнением (1.29), имеют такую же природу, как и всякая сольватация ионов вообще (см. гл. 2, разд. 6). [c.53]
Поскольку вода является сильно ассоциированной жидкостью, а энергия водородных связей составляет в среднем 20 кДж-моль связей, то следует ожидать определяющего вклада Н-связей в термодинамические свойства воды. С другой стороны, по этой причине логично сопоставлять свойства воды прежде всего со свойствами жидкостей, также характеризуемых наличием сильных межмолекулярных взаимодействий, т. е. с другими ассоциированными жидкостями (спирты, амины и т. д.), а также жидкостями с сильными диполь-дипольными взаимодействиями (диметилсульф-оксид — ДМСО, пропиленкарбонат — ПК, ацетон и др.). [c.7]
Угловое расположение атомов в молекуле воды и образование ионо-дипольиых и водородных связей между молекулами имеют суш,ественное значение для свойств воды. В этом проявляется дипольная природа молекул воды. [c.59]
Диэлектрическая постоянная воды. Одним из наиболее важных свойств воды, которое необходимо рассмотреть в связи со свойствами растворов электролитов, является ее диэлектрическая постоянная. Как отмечалось выше, молекула воды имеет дипольный момент. Этого, естественно, можно было ожидать из нашего описания строения молекулы воды, содержащего представление олокализации положительных зарядов на одной стороне молекулы и отрицательных — на другой. Электрический диполь будет стремиться ориентироваться в электрическом поле таким образом, чтобы уменьшить энергию системы, и, кроме того, электронные оболочки молекул будут несколько деформированы благодаря взаимной поляризуемости. Предположим, что мы имеем два электрических заряда и е . Предположим, далее, что эти заряды удалены друг от друга настолько, что они взаимодействуют как точечные заряды. Если бы они находились в вакууме, [c.394]
Другим свойством воды, которое имеет решающее значение для ее характеристики как растворителя, является способность создавать ионизованную среду с высокой диэлектрической проницаемостью. Этим и объясняется ее поразительная растворяющая способность полимерных электролитов. Необходимо, например, заметить, что такие материалы, как полиакрилат натрия и поливинилпиридинийхлорид, обладающие высоким сродством к воде и смешивающиеся с ней во всех соотношениях, совсем нерастворимы (и мало набухают) даже в метаноле, который по своим свойствам весьма напоминает воду. Следует предположить, что понижение диэлектрической проницаемости приводит к почти полной ассоциации фиксированных зарядов полимера с противоионами и что взаимодействие ионных пар слишком сильно и не может быть нарушено под действием сил сольватации. То же замечание можно сделать и в отношении взаимодействия диполей в полимерных амфолитах, в частности белках [136], хотя в последнее время и было показано, что, например, гидразин, этилендиамин [137] и безводный фтористый водород [138] — активные растворители для белков (см. обзор Зингера [139]). При работе с синтетическими амфотерными полимерами следует помнить, что дипольная структура иона имеет большее значение лишь в том случае, если незаря- [c.70]
Во времена алхимии универсальный растворитель искали так же ревностно, как философский камень. Нечего и говорить, что эти поиски оказались тщетными. Спустя много столетий вода — наиболее известный, удобный и часто используемый растворитель — оказалась ближе всего к такому универсальному растворителю. Из-за удобства в обращении с ней и разнообразия свойств она едва ли когда-нибудь будет заменена другим растворителем. В самом деле, до 1900 г. считали, что только вода растворяет ионные соединения. В нлстоящее время признана неправильность этой точки зрения, и можно только удивляться, почему ее так долго придерживались. С начала нового столетия сделаны большие успехи в изучении и использовании неводных растворов. Несмотря на все усилия, свойства неводных растворов знают еще поверхностно они представляют собой малоизученную область. Многие свойства воды, такие, как значительный дипольный момент, амфотерный характер, большая диэлектрическая проницаемость и, наконец, ее доступность и легкость очистки ставят воду в особое положение как растворитель. Однако в некоторых случаях неводные среды могут быть применены с большим успехом. Началом исследований в этой области является применение теории Дебая — Хюккеля к неводным растворителям, используемым в качестве среды в органических реакциях. Некоторые неводные растворители, например безводный фтористый водород, применяются в промышленном масштабе. Поэтому удивительно, что так мало известно о многих возможных неводных растворителях. [c.334]
Соли Ре + во мнбгом похожи на соли Mg +, что обусловлено близостью радиусов ионов (у Nig + г, = 66 пм, у Ре + п — 74 пм] , Это сходство относится к свойствам, определяемым, в основном, межионными и ион-дипольными взаимодействиями (кристаллическая структура, энергия решетки, энтропия, растворимость в воде, состав и структура кристаллогидратов, способность к комплексообразованию с лигандами, обладающими слабым полем). Наоборот, не проявляется аналогия в свойствах, связанных с электронными взаимодействиями (способность к реакциям окисления-восстановления, образование комплексов со значительной долей "ковалентной связи). На рис. 3.127 сопоставлены энтропии кристаллических соединений Ре + и М +. При сравнении рис. 3.127 и 3.125 прослеживается степень сходства и различия двухвалентных состояний элементов семейства железа между собой и между Ре и Мд, принадлежащим к разным группам периодической системы элементов. [c.562]
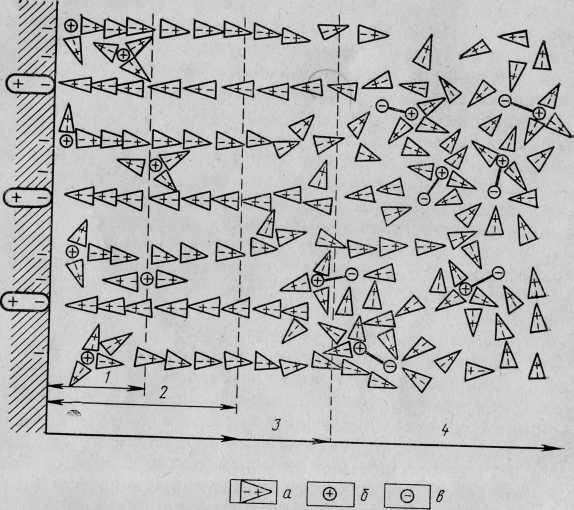
Мицеллы воды в водно-тоштивных эмульсиях также не проявляют свойств дипольности. Картина резко меняется при наложении на эмульсию внешнего электрического поля, когда молекулы воды в каплях получают строгую ориентацию и капли превращаются в диполи. Одинаковая напряженность электрического поля во всех его точках, а также равенство отрицательного и положительного зарядов капли приводят к тому, что она растягивается. Это происходит до тех пор, пока силы поверхностного натяжения, стремящиеся придать капле сферическую форму, не станут равными электростатическим силам внутреннего давления, стремящимся разорвать каплю. [c.45]
Подобная С груктура объясняет физические свойства аминокислот. У них высокие температуры плавления (200.. 300 °С), они не испаряются, а разлагаются, обладают большими дипольны. ш моментами. у минокислоты не растворяются в неполярш>1х органических растворителях, но довол1зНо хорошо растворимы в воде. Константы кислотности и огкпвности у них очень малы. [c.239]
При растворении вещества, сосюящего из полярных молекул или имеющего ионное строение, в жидкости, также составленной из полярных молекул, между молекулярными диполями растворителя и молекулами или кристаллами растворяемого вещества возникают электростатические силы диполь-дипольного или ион-дипольного взакмоде с твия, способствующие распаду растворяемого вещества на ионы. Поэтому жидкости, состоящие из полярных молекул, проявляют свойства ионизирующих растворителей, т. е. способствуют электролитической диссоциации растворенных в них веществ. Так, хлороводород растворяется и в воде, и в бензоле, но его растворы в воде хорошо проводят электрический ток, что свидетельствует о практически полной диссоциации молекул НС1 на ионы, тогда как растворы НС1 в бензоле не обладают заметной электрической проводимостью. [c.142]
Электростатические представления оправдываются для целого ряда других комплексных соединений, содержащих дипольные молекулы. Молекула воды (диполь, характеризующийся большой жесткостью) обладает дипольным моментом, равным 1,8. Дипольный момент молекулы ЫНз равен 1,5 (по сравнению с Н2О отличается меньшей жесткостью). Так как величина дипольного момента ЫНз меньше, чем у Н2О, то аммиакаты должны быть менее устойчивыми, чем гидраты. Действительно в случае соединений лития дело обстоит именно таким образом. Однако в некоторых случаях могут наблюдаться обратные соотношения. Часто устойчивость соединений нельзя объяснить с позиций электростатических представлений. Например, известно большое количество соединений с формально нульвалентным центральным атомом. Сюда относится ряд комплексных соединений платины, палладия и других металлов, например комплекс палладия с фенилизонитрилом, для которого были изучены реакции замещения с триарилфосфитами. Подобные реакции не могут сопровождаться окислительно-восстановительными процессами, так как оба вступающих в реакцию вещества характеризуются восстановительными свойствами. [c.239]
Явление сольватации обязано тому,, что заряженная частица (ион), появившаяся среди молекул растворителя, изменяет свойства и порядок распределения последних в растворе. Если молекулы растворителя имеют дипольный момент, то они взаимодействуют с ионами, образуя сольватные оболочки. При этом электростатическое бзаимодействие не является единственной причиной сольватации ионов. Сольватация может возникать и за счет некулоповских — химических сил. Многие соли образуют гидраты и сольваты не только в растворах, но и в твердом состоянии. К такому комплексообразованию склонны почти все соли. Например, образование гидратов солей меди является типичным процессом комплексообразования. В таких соединениях связь между ионами и молекулами воды чисто химическая, она обусловлена обычной координационной валентностью, типичной для комплексных соединений. [c.137]
Отсутствие направленности ионной связи приводит к важному свойству — ненасыщаемости связи. Это, в частности, означает, что электрические поля, например катионов, могут взаимодействовать с частицами, расположенными вне кристалла. Так, катионы на поверхности кристалла могут притягивать дипольные молекулы воды. Это явление обусловливает существование кристаллогидратов многих солей, содержащих в своем составе несколько молекул воды (например, Си504-5Н20). Это же явление лежит в основе процессов поглощения воды поверхностью минералов и смачивания минералов. [c.162]
При использовании метода Хартри—Фока—Рутаана главной характеристикой расчетной модели является выбор базиса орбита-лей. Чем полнее этот базис, тем точнее воспроизводится полная энергия молекулы. Однако способность расчета предсказывать другие молекулярные свойства не всегда монотонно зависит от выбранного базиса и учета корреляционных эффектов. Наглядный пример — расчет дипольного момента (/х) молекулы воды при минимальном базисе /i = 1,82 D, в расширенном почти до хартри-фоковского предела 6ii3H e ц = 2,57 D, в расширенном базисе с наложением конфигурационного взаимодействия ц=1,99 D, в эксперименте /i=l,85 D. Аналогичные примеры можно найти и для некоторых других характеристик. Важно знать, какие ряды базисных орбита-лей следует использовать для получения надежных результатов в расчетах различных характеристик молекул. [c.205]
chem21.info
Дипольный момент молекул воды - Справочник химика 21
Для исследования изменений структуры водородных связей в приповерхностных слоях воды необходимо проанализировать, ориентационные характеристики ее молекул. Ориентация молекул может быть задана углами Эйлера. Однако для большей наглядности целесообразно рассмотреть ориентацию в пространстве вектора дипольного момента молекулы воды и вектора й, нормального к плоскости, в которой расположены атомы молекулы. Введем параметр порядка [c.125]Пример lV-1. Зная дипольные моменты молекул воды и диметилового эфира (табл. IV-2), рассчитать дипольный момент молекулы метанола. Углы между связями приведены в табл. IV-1. [c.67]
Дипольный момент молекулы воды равен [c.28]
В связи с принятием дипольной модели Мищенко и Сухотин вводят поправку р = 0,025 нм (р = 0,25 А), связанную с асимметрией положения дипольного момента в молекуле воды. Дипольный момент молекулы воды расположен несимметрично. Из-за асимметрии расстояние между центром иона и центром противоположного заряда диполя различно для катиона и аниона. Для катиона оно больше на величину р, а для аниона меньше. Величину радиуса молекулы воды Мищенко и Сухотин, в отличие от Бернала и Фаулера, принимают равной 0,193 нм (1,93 А), а не 0,138 нм (1,38 А). Величина 0,193 нм (1,93 А) получена расчетом, исходя из плотности воды при 25 °С. [c.176]
Следовательно, уравнения (1.15) нельзя использовать для расчета дипольного момента молекул воды, спиртов, карбоновых кислот и других веществ, способных участвовать в образовании водородной связи. [c.10]
Дипольные моменты функциональных групп торфа примерно равны, а в некоторых случаях превышают дипольный момент молекул воды в свободном состоянии [208]. Именно функциональные группы органического вещества торфа, обеспечивающие реализацию водородных связей, являются первичными центрами сорбции молекул воды. В дальнейшем первично сорбированные молекулы воды становятся вторичными центрами сорбции. [c.65]
Расчетный дипольный момент молекул сорбированной воды в этом случае получается выше, чем дипольный момент молекулы воды в парообразной фазе [213]. В то же время, по данным исследований методом спинового эха, подвижность протонов связанной воды на два порядка ниже, чем воды в свободном объеме [214]. [c.66]
Рассмотрим результаты расчета некоторых свойств объемной фазы воды для двух моделей. В модели межмолекулярного потенциала ST2 [340] используются четыре точечных заряда, расположенных в вершинах тетраэдра. Электростатическое взаимодействие плавно выключается при малых расстояниях между молекулами. Короткодействующие силы отталкивания учитываются потенциалом Леннарда — Джонса 6-12 между атомами кислорода. Дипольный момент. молекулы воды равен 2,35 Д, а абсолютный минимум энергии.-димера воды составляет 28,4 кДж/моль при расстоянии 0,285 нм между атомами кислорода. [c.120]
При растворении сильных электролитов в воде, имеющей большую диэлектрическую постоянную, электростатические силы между ионами уменьшаются и так же, как при плавлении, ионы приобретают подвижность. Это обусловлено взаимодействием дипольных моментов молекул воды с зарядами ионов, т. е. гидратацией. Такое взаимодействие может быть не только электростатическим, но и химическим. Так, ион водорода образует с водой ион гидроксония Н3О+, имеющий природу молекулы типа аммиака. [c.112]
На рис. 7.6, б показано распределение значений дипольного момента молекул воды в цилиндрических порах. Дипольные моменты ориентируются преимущественно параллельно оси цилиндра, так как в отличие от плоских пленок эта ось является дополнительным выделенным направлением. Этот эффект приводит к электростатическому отталкиванию между образовавшимися каплями, что усиливает тенденцию к пространственному разделению системы. [c.126]
Отсюда видно, что энергия взаимодействия между ионами и образовавшимися ионными двойниками зависит от дипольного момента ионного двойника и расстояния между ионом и центром тяжести противоположных зарядов молекулы. Этот путь учета энергии пригоден и к рассмотрению взаимодействия между любыми молекулами и ионами при гидратации ионов молекулами воды взаимодействие будет определяться зарядом иона и дипольным моментом молекулы воды, так как выведенное уравнение применимо для любого взаимодействия между ионом и дипольными молекулами. [c.121]
Фрумкиным было показано, что благодаря большому дипольному моменту молекул воды электрический потенциал фо на поверхности капелек водяного тумана может достигать 250 мВ. Согласно выражению (X—3), при оседании частиц с м и т 5-10-з г при п 10 ° частиц/мз (что характерно для кучевых облаков), т] иТ-Ю- пуаз (1,7-10- Па-с), юл 4-10- См/м могут возникать электрические поля с напряженностью Е порядка киловольт на см. В нестационарных условиях (при конвекции) значения Е могут быть выше и достигать значений, при которых происходит пробой воздуха электрическим зарядом — молния. [c.273]
А. Н. Фрумкин показал, что (благодаря большому дипольному моменту молекул воды электрический потенциал ро на [c.332]
Дипольный момент молекулы воды не равен н/лю, следовательно, молекула воды является полярной moj скулой, т. е. диполем. [c.100]
Дипольный момент молекулы можно считать векторной суммой дипольных моментов отдельных связей. Дипольные моменты связей можно рассчитать, зная дипольный момент молекулы (о его экспериментальном измерении см. ниже) и точную ее геометрию углы между валентными направлениями, межатомные расстояния. Так из дипольного момента молекулы воды (в газообразном состоянии), равного 1,84 О, и угла [c.346]
А. По мере увеличения числа молекул, входящих в комплексы, расстояние между молекулами сокращается на 0,1 — 0,4 А, а длины ОН-связей увеличиваются до 0,99 А. Угол между ОН-связями уменьшается до 100°, а между неподеленными парами — до 116°. Дипольный момент молекулы воды при этом остается практически неизменным — 1,82—2,19/). [c.15]
Рассмотрим несколько общих вопросов, связанных с нахождением ЭОП молекул вообще. Поскольку ни направление дипольного момента молекулы воды, ни знак перед квадратным корнем из интенсивности полосы из опыта получены быть не могут, то при вычислении значений ЭОП в зависимости от соотношения выбранных знаков можно составить 2 = 16 различных наборов исходных уравнений и из них получить такое же количество наборов искомых ЭОП. Выбор общепринятого направления дипольного момента связи Год от атома кислорода к атому водорода уменьшает число возможных вариантов вдвое. Никаких оснований для предпочтения того или иного выбора знаков перед корнями из абсолютных интенсивностей ни теория, ни эксперимент дать не могут. [c.98]
Действительно, во-первых, дипольные моменты не только ОН-связей молекулы паров воды, ее растворов [144] и воды в жидкой фазе [300], но и ОН-связей спиртов [77, 377] и даже радикала ОН [372] остаются в пределах 1,4—1,65 D. Все это позволяло считать, что цри образовании водородных связей дипольный момент молекулы воды меняется слабо [161] и поэтому в первом приближении в наших расчетах он может быть положен неизменным и равным дипольному моменту свободной молекулы воды р,он = = 1,50 D и = 1,84 D [144]. [c.100]
Некоторое совпадение с экспериментальными данными в пределах 30% были получены только тогда, когда при расчетах радиус сольватирующих молекул спирта был вычислен из соотношения величин дипольных моментов молекул воды и спирта [c.343]
В связи с принятием дипольной модели Мищенко и Сухотин вводят поправку р=0,25 А, связанную с асимметрией по.чожения дипольного момента в молекуле воды. Дипольный момент молекулы воды расположен несимметрично. Из-за асимметрии расстояние между центром иона и, [c.204]
Анализ показывает, что такая структура молекул воды наблюдается как в газообразной, так и в конденсированной фазе. Это подтверждается наличием дипольного момента молекул воды, а также проверкой значений физических констант. Числовые определения величины угла и сторон треугольника НОН проведены на основе изучения спектров поглощения для паров воды. Дипольный момент молекулы воды равен 1,84- ед. СОЗЕ. [c.103]
Вода хорошо растворяет соли потому, что она обладает очень высокой диэлектрической проницаемостью и ее молекулы имеют тенденцию соединяться с ионами и образовывать гидратированные ионы. Оба эти свойства обусловлены большим электрическим дипольным моментом молекулы воды. [c.167]
Несмотря на поляризацию, любой элемент объема капельки, содержащий достаточно большое число молекул, остается нейтральным, что обусловлено взаимной компенсацией противоположных по знаку зарядов диполей, расположенных один возле другого. Иначе обстоит дело в тонких слоях у поверхности капельки. Эта часть поверхности, в которую входят силовые линии внеишего поля, имеет избыток отрицательных зарядов - отрицательно заряженных концов молекул - диполей. У противоположной поверхности, из которой выходят силовые линии, возникает избыточный положительный заряд. Эти поляризационные заряды, связанные с поверхностью капельки, только в незначительной степени нейтрализуются противоположными зарядами молекул внешней, нефтяной среды, примыкающих к цоверхности капельки, так как их дипольный момент ничтожен по сравнению с дипольным моментом молекул воды. [c.48]
Б ернал и Фаулер считали, что прежде всего вокруг иона образуется оболочка из молекул воды. Этот процесс вызывает основное изменение энергии. Авторы подсчитали энергию присоединения одной молекулы воды, а затем энергию присоединения п молекул воды. Эта величина определяется произве дением из заряда иона на дипольный момент молекулы воды, деленным на квадрат радиуса сольватированного иона, который равен (гЧ-Гсо), где г ,—радиус молекул воды. Выражение для энергии этого процесса получается из рассмотрения сил притяжения и сил отталкивания между ионом и полярной молекулой. [c.334]
Как отмечалось выше, в сильнокислой среде (интервал от 5 и более молярных растворов сильных кислот до pH около 2) состав пе-рекисных комплексов весьма постоянен. Это обстоятельство указывает, что лигандом в данном случае является молекула Н2О2. Образование ионов-лигандов НО2 , а тем более ионов Оа , сильно зависит от pH в ЗТ1ИХ случаях состав, а также прочность комплексов должны зависеть от кислотности, что в действительности не имеет места. Следует иметь в виду, что дипольный момент молекулы перекиси (2,26) значительно выше по сравнению с дипольным моментом молекулы воды (1,84). Поэтому связь молекулы Н2О2 с ионами высоковалентных металлов вполне возможна и должна быть выше, чем энергия гидратации тех же ионов. [c.253]
chem21.info