Справочник химика 21. Этан вода
Этан Википедия
| Этан | |
 | |
  | |
| Этан | |
| C2H6 | |
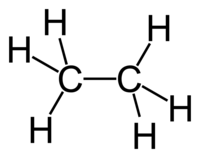
| Н3CСН3 | |
| газ | |
| 30,07 г/моль | |
| 1,2601 кг/м³ в стандартных условиях по ГОСТ 2939—63; при н.у. (0С) 0,001342 г/см³ | |
| −182,8 °C | |
| −88,6 °C | |
| 152 °C | |
| 152 °C | |
| 472 °C | |
| 52,65 Дж/(моль·К) | |
| -84,67 кДж/моль | |
| 2,379 МПа (0°С) | |
| 42 (вода, 20°С) | |
| 74-84-0 | |
| 6324 | |
| 200-814-8 | |
| Kh4800000 | |
| 42266 и 42260 | |
| 1035 | |
| 6084 | |
| Обладает слабым наркотическим действием | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Эта́н (лат. Ethanum), C2H6 — органическое соединение, второй член гомологического ряда алканов. В природе содержится в составе природного газа, нефти и других углеводородах. По сравнению с метаном и пропаном более пожаро- и взрывоопасен. Малотоксичен. Обладает наркотическим действием, которое ослабляется ничтожной растворимостью в воде и крови. Класс опасности — четвёртый[1].
Свойства
Физические свойства
Этан при н. у. — бесцветный газ, без запаха и вкуса. Молярная масса — 30,07. Температура плавления −182,81 °C, кипения −88,63 °C[2]. Плотность ρгаз.=0,001342 г/см³ или 1,342 кг/м³ (н. у.), ρжидк.=0,561 г/см³ (T=-100 °C). Давление паров при 0 °С — 2,379 МПа[3]. Нерастворим в воде.
Химические свойства
Химическая формула C2H6 (рациональная СН3СН3). Наиболее характерны реакции замещения водорода галогенами, проходящие по свободно радикальному механизму.
Термическое дегидрирование этана при 550—650 °С приводит к этилену, при температурах свыше 800 °С — к ацетилену (образуются также бензол и сажа). Прямое хлорирование при 300—450 °С — к этилхлориду, нитрование в газовой фазе даёт смесь (3:1) нитроэтана и нитрометана.
Физиологическое действие
Обладает слабым наркотическим и галлюциногенным действием (ослаблено за счёт низкой растворимости в жидкостях организма).
Получение
В промышленности
В промышленности получают из нефтяных и природных газов, где он составляет до 10 % по объёму. В России содержание этана в нефтяных газах очень низкое. В США и Канаде (где его содержание в нефтяных и природных газах высоко) служит основным сырьём для получения этилена.
В лабораторных условиях
Получают из иодметана по реакции Вюрца, из ацетата натрия электролизом по реакции Кольбе, сплавлением пропионата натрия с щёлочью, из этилбромида по реакции Гриньяра, гидрированием этилена (над Pd) или ацетилена (в присутствии никеля Ренея).
Применение
Основное использование этана в промышленности — получение этилена.
Интересные факты
Предположительно, на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси[4].
Примечания
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, нбутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003)
- ↑ Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л.: Химия, 1977. — С. 197.
- ↑ ЭТАН — Химическая энциклопедия на ХиМиК.Ру
- ↑ Mousis O., Schmitt B. (апрель 2008). «Sequestration of Ethane in the Cryovolcanic Subsurface of Titan». The Astrophysical Journal 677. DOI:10.1086/587141.
Литература
wikiredia.ru
Этан
Эта́н (лат. Ethanum), C2H6 — органическое соединение, второй член гомологического ряда алканов. В природе содержится в составе природного газа, нефти и других углеводородах. По сравнению с метаном и пропаном более пожаро- и взрывоопасен. Малотоксичен. Обладает наркотическим действием, которое ослабляется ничтожной растворимостью в воде и крови. Класс опасности — четвёртый.Содержание
- 1 Свойства
- 1.1 Физические свойства
- 1.2 Химические свойства
- 1.3 Физиологическое действие
- 2 Получение
- 2.1 В промышленности
- 2.2 В лабораторных условиях
- 3 Применение
- 4 Интересные факты
- 5 Примечания
- 6 Литература
Свойства
Физические свойства
Этан при н. у. — бесцветный газ, без запаха и вкуса. Молярная масса — 30,07. Температура плавления −182,81 °C, кипения −88,63 °C. Плотность ρгаз.=0,001342 г/см³ или 1,342 кг/м³ (н. у.), ρжидк.=0,561 г/см³ (T=-100 °C). Давление паров при 0 °С — 2,379 МПа.
Химические свойства
Химическая формула C2H6 (рациональная СН3СН3). Наиболее характерны реакции замещения водорода галогенами, проходящие по свободно радикальному механизму.
Термическое дегидрирование этана при 550—650 °С приводит к этилену, при температурах свыше 800 °С — к ацетилену (образуются также бензол и сажа). Прямое хлорирование при 300—450 °С — к этилхлориду, нитрование в газовой фазе дает смесь (3:1) нитроэтана и нитрометана.
Физиологическое действие
Обладает слабым наркотическим действием (ослаблено за счет низкой растворимости в жидкостях организма).
Получение
В промышленности
В промышленности получают из нефтяных и природных газов, где он составляет до 10 % по объёму. В России содержание этана в нефтяных газах очень низкое. В США и Канаде (где его содержание в нефтяных и природных газах высоко) служит основным сырьём для получения этилена.
В лабораторных условиях
Получают из иодметана по реакции Вюрца, из ацетата натрия электролизом по реакции Кольбе, сплавлением пропионата натрия с щелочью, из этилбромида по реакции Гриньяра, гидрированием этилена (над Pd) или ацетилена (в присутствии никеля Ренея).
Применение
Основное использование этана в промышленности — получение этилена.
Интересные факты
Предположительно, что на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси.
Примечания
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, нбутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003)
- ↑ Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л.: Химия, 1977. — С. 197.
- ↑ ЭТАН — Химическая энциклопедия на ХиМиК.Ру
Литература
- Тутурин Н. Н.,. Этан // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
| Метан • Этан • Пропан • Бутан • Пентан • Гексан • Гептан • Октан • Нонан • Декан • Ундекан • Додекан • Тридекан • Тетрадекан • Гексадекан • Гептадекан • Октадекан • Нонадекан • Эйкозан • Докозан • Гектан |
| Этилен • Пропен • Бутены • Пентены • Гексены • Гептены • Октен |
| Ацетилен • Пропин • Бутин |
| Пропадиен • Бутадиен • Изопрен • Циклобутадиен |
| Винилацетилен • Диацетилен • Каротин |
| Циклопропан • Циклобутан • Циклопентан • Циклогексан • Декалин • Индан • Инден |
| Бензол • Толуол • Диметилбензолы • Этилбензол • Пропилбензол • Кумол • Стирол • Фенилацетилен • Индан • Дифенил • Дифенилметан • Трифенилметан • Тетрафенилметан • Инден |
| Нафталин • Антрацен • Бензантрацен • Пентацен • Фенантрен • Пирен • Бензпирен • Азулен • Хризен |
Этан Информация о
ЭтанЭтанЭтан Информация Видео
Этан Просмотр темы.Этан что, Этан кто, Этан объяснение
There are excerpts from wikipedia on this article and video
www.turkaramamotoru.com
Этан - это... Что такое Этан?
углеводород предельного ряда С2h5; встречается в природе, в выделениях из почвы нефтеносных местностей. Искусственно получен в первый раз Кольбе и Франкландом в 1848 г. при действии металлического калия на пропионнитрил, ими же в следующем 1849 году в больших количествах при электролизе уксусно-калиевой соли и действием цинка и воды на йодистый этил. В настоящее время Э. получается посредством всех вообще реакций, которые применяются для получения предельных углеводородов, т. е. 1) восстановлением галоидопроизводных этилового спирта, для чего употребляют водород in statu nascendi, йодистый водород, амальгаму натрия, цинк и медно-цинковую пару в присутствии воды или спирта:
Ch4Ch3I + HI = Ch4Ch4 + 1/2Ch4Ch3I + h3 = C2H6 + HI.
2) Действием воды на цинкэтил: (C2H5)Zn + h3O = C2h5 + Zn(HO)2. 3) Действием цинка или натрия на галоидгидрин метилового спирта: 2Ch4I + 2Na = Ch4Ch4 + 2NaI. При нагревании до 150° в запаянных трубках или по А. Волкову и Б. Меншуткину действием цинковой пыли при слабом нагревании. 4) Электролизом солей уксусной кислоты. 5) Присоединением водорода к непредельным углеводородам, а именно ацетилену и этилену при нагревании до 500° или при обыкновенной температуре при контактном действии платиновой черни C2h3 + 2Н2 = C2H6; С2h5 + Н2 = C2H6. Подробный разбор реакций см. Парафины.
Э. — газ, легко обращающийся в жидкость, его критические данные, по Ольшевскому, следующие:
--------------------------------------------------------------------------------------------------------------------------------------
| | Крит. давление | |
|------------------------------------------------------------| |
| + 35,0° | 50,2 атм. | |
|------------------------------------------------------------| |
| + 29,0° | 46,7 атм. | |
|------------------------------------------------------------| |
| + 23,5° | 40,4 атм. | |
|------------------------------------------------------------| |
| 0,0° | 23,8 атм. | |
|-------------------------------------------------------------------------------------------------------------------------------------|
| —93,0° | 1,0 атм. | Температура кипения жидкого Э. Он остается |
| | | жидким. |
|-------------------------------------------------------------------------------------------------------------------------------------|
| —151,0° | | |
--------------------------------------------------------------------------------------------------------------------------------------
Э. мало растворим в воде при обыкновенном давлении, при более высоких давлениях и сильном охлаждении растворимость возрастает; по опытам Villard'a, при этих условиях Э. образует с водой кристаллическое соединение, упругость диссоциации которого при 0° равна 6 атм., при 12° — 18 атм., при +12° этот кристаллогидрат разлагается. Производные Э. см. Этиламин, Этил йодистый, Этил бромистый и т. д.
Н. Тутурин.
dic.academic.ru
Физические свойства этана C2H6: плотность, вязкость, теплопроводность
 Рассмотрены тепловые и физические свойства этана C2H6 в газообразном и сжиженном состояниях. Свойства этана представлены в виде таблиц при различных температурах.
Рассмотрены тепловые и физические свойства этана C2H6 в газообразном и сжиженном состояниях. Свойства этана представлены в виде таблиц при различных температурах.
Этан представляет собой органический газ, относящийся к газам метанового ряда, он входит в состав природного и нефтяного газов, содержится в нефти. В основном применяется в качестве сырья для синтеза этилена, каучука, бензина, а также спиртов и многих других органических веществ.
По своим физическим свойствам этан представляет собой газ с температурой кипения минус 88°С, без цвета и запаха, имеет молекулярную массу 30,07 и газовую постоянную 276,5 Дж/(кг·К).
Основные тепловые и некоторые физические свойства этана представлены в следующей таблице:
| Молекулярная масса μ | — | 30,0694 |
| Плотность газа при с. у. | кг/м3 | 1,342 |
| Плотность жидкости при -180°С | кг/м3 | 648,8 |
| Газовая постоянная R | Дж/(кг·К) | 276,507 |
| Температура в тройной точке Tтр | °С | -182,802 |
| Давление в тройной точке Ртр | МПа | 1,13·10-6 |
| Температура кипения при 101325 Па | °С | -88,58 |
| Критическая температура Ткр | °С | 32,18 |
| Критическое давление, Ркр | МПа | 4,8714 |
| Критический объем vкр | м3/кг | 4891·10-6 |
| Теплота сублимации при 0°С | кДж/кг | 968,43 |
| Коэффициент теплопроводности при с. у. | Вт/(м·К) | 0,018 |
Плотность этана
Плотность этана почти в два раза выше, чем плотность метана и при стандартных условиях (0°С и 105 Па) составляет 1,342 кг/м3. Наибольшую плотность газообразный этан имеет вблизи температуры кипения — она может достигать более двух килограмм на кубометр. Этан немногим тяжелее воздуха: плотность воздуха при стандартных условиях имеет значение 1,293 кг/м3.
Плотность этана, как и других газов, становится меньше при нагревании. Например, при температуре 300°С и нормальном атмосферном давлении она составляет всего 0,63 кг/м3.
В таблице представлены значения плотности этана газообразного при различных температурах в интервале от -88 до 427°С и нормальном атмосферном давлении (101325 Па).
| 185 | -88 | 2,03 | 440 | 167 | 0,82 |
| 190 | -83 | 1,97 | 450 | 177 | 0,81 |
| 200 | -73 | 1,86 | 460 | 187 | 0,79 |
| 210 | -63 | 1,76 | 470 | 197 | 0,77 |
| 220 | -53 | 1,68 | 480 | 207 | 0,75 |
| 230 | -43 | 1,6 | 490 | 217 | 0,74 |
| 240 | -33 | 1,53 | 500 | 227 | 0,72 |
| 250 | -23 | 1,47 | 510 | 237 | 0,71 |
| 260 | -13 | 1,41 | 520 | 247 | 0,7 |
| 270 | -3 | 1,35 | 530 | 257 | 0,68 |
| 273 | 0 | 1,34 | 540 | 267 | 0,67 |
| 280 | 7 | 1,3 | 550 | 277 | 0,66 |
| 290 | 17 | 1,26 | 560 | 287 | 0,65 |
| 300 | 27 | 1,21 | 570 | 297 | 0,63 |
| 310 | 37 | 1,17 | 580 | 307 | 0,62 |
| 320 | 47 | 1,14 | 590 | 317 | 0,61 |
| 330 | 57 | 1,1 | 600 | 327 | 0,6 |
| 340 | 67 | 1,07 | 610 | 337 | 0,59 |
| 350 | 77 | 1,04 | 620 | 347 | 0,58 |
| 360 | 87 | 1,01 | 630 | 357 | 0,57 |
| 370 | 97 | 0,98 | 640 | 367 | 0,57 |
| 380 | 107 | 0,96 | 650 | 377 | 0,56 |
| 390 | 117 | 0,93 | 660 | 387 | 0,55 |
| 400 | 127 | 0,91 | 670 | 397 | 0,54 |
| 410 | 137 | 0,88 | 680 | 407 | 0,53 |
| 420 | 147 | 0,86 | 690 | 417 | 0,52 |
| 430 | 157 | 0,84 | 700 | 427 | 0,52 |
Плотность сжиженного этана в температурном диапазоне -182…-93°С составляет от 549,7 до 652,4 кг/м3. Этан может находиться в жидком состоянии при температурах ниже минус 88°С. В этих условиях плотность этана может иметь значение до 652 кг/м3 (при температуре до -182°С). При нагревании плотность сжиженного этана, так же как и газообразного, — снижается.
| 91 | -182 | 652,4 | 135 | -138 | 602,8 |
| 92 | -181 | 650,4 | 140 | -133 | 597 |
| 95 | -178 | 645,7 | 145 | -128 | 591,4 |
| 100 | -173 | 640 | 150 | -123 | 585,6 |
| 105 | -168 | 635 | 155 | -118 | 579,8 |
| 110 | -163 | 630 | 160 | -113 | 573,9 |
| 115 | -158 | 624,8 | 165 | -108 | 568 |
| 120 | -153 | 619,5 | 170 | -103 | 562 |
| 125 | -148 | 614 | 175 | -98 | 555,9 |
| 130 | -143 | 608,5 | 180 | -93 | 549,7 |
Вязкость этана
В таблице приведены значения коэффициента динамической вязкости этана в газообразном и жидком состояниях в интервале температуры от -172 до 600 градусов Цельсия.
При стандартных условиях вязкость газа этана составляет 85,5·10-7 Па·с и при нагревании увеличивается. Однако сжиженный этан, как и многие другие жидкости, при росте температуры становится менее вязким.
Этан в жидком виде намного более вязкий, чем в газообразном состоянии. При температуре, например -100°С коэффициент динамической вязкости сжиженного C2H6 почти в 30 раза больше, чем газообразного.
| -100 | 55,2 | 100 | 115 |
| -75 | 62,3 | 150 | 128 |
| -50 | 70,3 | 200 | 141 |
| -25 | 78 | 250 | 152,5 |
| 0 | 85,5 | 300 | 164 |
| 25 | 92,9 | 400 | 190 |
| 50 | 102 | 500 | 214 |
| 75 | 107 | 600 | 238 |
| -172 | 8780 | -101 | 1750 |
| -169 | 7870 | -87 | 1370 |
| -167 | 7290 | -72 | 1140 |
| -165 | 6750 | -58 | 970 |
| -162 | 6240 | -43 | 900 |
| -123 | 2710 | -30 | 820 |
| -113 | 2360 | -3 | 670 |
| -106 | 2070 | 15 | 550 |
Теплопроводность этана
Значения коэффициентов теплопроводности газообразного этана представлены в таблице в диапазоне температуры от -40 до 300°С. Теплопроводность этана при стандартных условиях ниже значения коэффициента теплопроводности метана и составляет 0,018 Вт/(м·град).
При нагревании коэффициент теплопроводности этана увеличивается и при температуре 300°С становится равным 0,0659 Вт/(м·град). По сравнению с воздухом при низких температурах этан является менее теплопроводным, но при нагревании выше 120°С становится лучшим проводником тепла.
| -40 | 0,0138 | 140 | 0,0378 |
| -20 | 0,0157 | 160 | 0,041 |
| 0 | 0,018 | 180 | 0,0443 |
| 20 | 0,0206 | 200 | 0,0477 |
| 40 | 0,0232 | 220 | 0,0511 |
| 60 | 0,0259 | 240 | 0,0547 |
| 80 | 0,0288 | 260 | 0,0584 |
| 100 | 0,0317 | 280 | 0,0621 |
| 120 | 0,0347 | 300 | 0,0659 |
Источники:
- Варгафтик Н. Б. Справочник по теплофизическим свойствам газов и жидкостей.
- Сычев В. В., Вассерман А. А. и др. Термодинамические свойства этана: ГСССД. М.: Издательство стандартов, 1982. — 304 с.
thermalinfo.ru
Растворимость этана в воде - Справочник химика 21
Фазовые диаграммы систем углеводородный газ — вода резко отличаются от фазовых диаграмм бинарных смесей углеводородных газов с жидкими УВ. Из фазовых диаграмм давление— состав систем этан — вода и метан — вода (рис. 26) можно видеть, что при температурах ниже 300°С граничные кривые газа и жидкости в системе этан — вода очень слабо сближаются, что объясняется их слабой взаимной растворимостью. [c.52] Растворенные газы присутствуют во всех подземных водах, но содержание их различное от следов до нескольких процентов. В основном в подземных водах содержатся углекислый газ, азот и метан. Кроме того, в подземных водах растворены кислород, сероводород, аргон, гелий, этан, пропан, бутан. Хорошо растворимы в воде СО2, Нз, N2, МНз. Небольшой растворимостью обладают углеводородные газы, азот, водород, кислород, а также благородные газы. [c.256]Предельные углеводороды, в том числе этан и пропан, ие растворимы в воде. [c.222]
Объясните, почему метиловый спирт (т. кип. 64,7°) кипит значительно выше, чем фтористый метил (т. кип. — 78,2°), а также этан (т. кип. —88,6°), хотя молекулярные веса их близки. Чем обусловлена хорошая растворимость в воде низших спиртов [c.44]
Этан и этилен представляют собой бесцветные газы со слабым приятным запахом, довольно хорошо растворимые в воде. Этилен химически активен, этан химически инертен. В смеси с воздухом создают взрывоопасные концентрации. Не корродируют металлы. [c.330]
В других растворителях, например жидком аммиаке, органических жидкостях, газы растворимы гораздо больше, чем в воде. Использовать другие жидкости, как использовали воду, уже нельзя. Летучесть жидкости в фазе-датчике значительно изменяется при растворении в ней газа из критической фазы. Поэтому во второй серии опытов фазами-датчиками были аммиакаты различных солей 118—21]. Вследствие обратимой реакции диссоциации над аммиакатом устанавливается равновесное давление аммиака. Над многими аммиакатами оно измерено [20]. Газами — растворителями в серии опытов с аммиакатами служили ацетилен, этан, шестифтористая сера. [c.82]
При прохождении скрубберов абсорбент поглощает из газа почти весь бутадиен и другие вещества, растворимые в спирте. В отходящем газе после скрубберов остаются водород, окислы углерода, предельные углеводороды (метан и этан), этилен, пропилен, воздух, некоторые количества спирта и бутадиена. После промывки водой с целью удаления спирта газ используют для топливных целей. [c.56]
Температуры плавления, наоборот, повышаются с ростом разветвленности углеродной цепи. Как показывают рентгенографические исследования, в твердом состоянии алканы нормального строения имеют правильную зигзагообразную конформацию (стр. 41). Плотности всех алканов меньше единицы. Они практически нерастворимы в воде, однако растворимы в эфире и других органических растворителях. Метан и этан почти лишены запаха, углеводороды Сз—С15 имеют всем хорошо известный запах бензина или керосина, высшие члены ряда лишены запаха из-за их малой летучести. [c.47]
Температуры плавления, наоборот, повышаются с ростом разветвленности углеродной цепи. Плотности всех алканов меньше диницы. Они практически нерастворимы в воде, однако растворимы в эфире и других органических растворителях. Метан и этан почти лишены запаха, углеводороды Сз—С15 имеют всем хорошо известный запах бензина или керосина, высшие члены ряда лишены запаха из-за их малой летучести. [c.54]
Хроматографический анализ этих продуктов (жидких при обычной температуре) показал, что они состояли в основном из ароматических углеводородов бензола, толуола, ксилола и парафиновых углеводородов выше пропана. Поэтому перед процессом сжижения газа необходимо было хотя бы частично удалить эти нежелательные компоненты — так же как это обычно делается в отношении воды, содержащих серу соединений и углекис.того газа. Для этого понадобилось предварительно определить растворимость этих компонентов в метане, этане и пропане при —161° С и найти среднее содержание в лакском газе тяжелых углеводородов. Аппаратура для определения [c.46]
Этан — бесцветный газ, не обладающий запахом и горящий слабо светящимся пламенем. Растворимость его в воде невелика в спирте этан растворяется немного лучше. Этан образует гидрат состава СгНо-УНгО. [c.40]
Отмечено, что метан [1], этан [1] и пропан [2] медленно раствр-ряются в дымящей серной кислоте, но полученные при этом соединения, очевидно, выделены не были. Изобутан [3] растворяется легко, образуя вещество, которое, судя по его низкой растворимости в воде, вероятно, не является 2-метилпропансульфокисло-той. При взаимодействии н-гексана, н-гептана и н-октана [41 с дымящей серной кислотой получаются соединения, представляющие собой, согласно анализам, моносульфокислоты. Обработка серным ангидридом при температуре кипения углеводорода дает дисульфированные продукты. Последующее исследование [5] показало, что эти соединения представляют собой скорее сложные-эфиры оксисульфокислот, чем дисульфокислоты. Окисление, пови- [c.105]
После того, как газ пройдет через электрическую дугу, его охлаждают до 150 впрыскиванием воды. Сажу, образовавшуюся в результате полного отщепления водорода от углеводородов, удаляют в циклопе, а оставшуюся часть улавливают суконным фильтром. Образующиеся при пиролизе смолистые полимеры отмывают маслом, синильную кислоту удаляют водой, сероводород — окисью железа. Очищенньи таким образом газ сжимают при охла/] дении, причем давление в четыре приема доводят до 18 ат. После этого газ под давлением промывают маслом, чтобы освободиться от диацетилена и других побочных продуктов, а затем улавливают ацетилен водой, по отношению к которой он ведет себя подобно угольной кислоте. В отличие от других газов — таких, как водород, этилен, этан, очень мало растворимых в воде, — ацетилен почти полностью поглощается водой. [c.127]
Газообразные гомологи метана — тяжелые углеводороды — ТУВ (этан С2Н6, пропан СзН , бутан С4Н10) имеют большую по сравнению с метаном сорбционную способность и низкий коэффициент диффузии, что позволяет им концентрироваться в газах закрытых пор. Этан имеет наибольшую из всех УВ газов растворимость в воде (0,047 м /м при 20°С). Смеси этих газов с воздухом так же взрывоопасны. Содержание каждого из гомологов в газах чисто газовых залежей обычно менее 0,5%, в нефтяных попутных газах достигает 30%. Газообразные гомологи метана — ценное сырье нефтехимической промышленности они используются в производстве синтетического каучука, полиэтилена, пластмасс. Промышленное значение имеют газы, содержащие не менее 2-3% ТУВ. [c.45]
Исследованием молекулярной растворимости углеводородов и нефтей в воде занималась А.Н. Гусева, Е.Н. Парнов, Л. Прайс и др. В работах Л. Прайса анализировалась растворимость углеводородов и нефтей при температурах до 400°С и давлениях до 200 МПа. При поверхностных условиях давления и температуры 20-25°С жидкие углеводороды слабо растворяются в воде. Наибольшую растворимость (от 150 до 1700 мг/л) имеют арены, а наименьшую (24-62 мг/л) — н-алканы. Цикланы занимают промежуточное положение. Растворимость некоторых углеводородов (в мл/л) следующая метан — 24,4 этан — 60,4 пропан — 62,4 н-бутан — 61,4 изобутан — 48,9 н-пергган — 38,5 изопентан — 48,8. Растворимость жидких углеводородов уменьшается с увеличением их молекулярной массы. Растворимость н-октана при обычных условиях составляет 0,66, а н-нонана — 0,122 мг/л. Особенно резкое уменьшение растворимости н-алканов наблюдается начиная с н-декана. При росте температуры растворимость алканов в воде возрастает, особенно в интервале 130 150°С (рис. 5.1). Растворимость у н-парафинов растет больше, чем у ароматических углеводородов. Из кривых на рис. 5.2 следует, что относительная растворимость плохо растворимых в воде углеводородов с большей молекулярной массой увеличивается с ростом температуры значительно сильнее, чем углеводородов с меньшей молекулярной массой. Возрастание давления несколько уменьшает растворимость. Различные компоненты, находяшиеся в нефтях (смо-листо-асфальтеновые соединения, нафтеновые кислоты и др.), растворяются в воде пропорционально их содержанию и в зависимости от соотношения индивидуальных растворимостей. [c.200]
Присутствие в воде растворенного газа также влияет на растворимость в ней углеводородов. Влияние газа зависит от степени насыщения им воды, состава газа, температуры и характеристики самого растворяющегося углеводорода. Судя по имеющимся данным, насыщение газом оказывает отрицательное воздействие на растворимость углеводородов до 180°С и положительное при более высоких температурах. О влиянии состава газов можно судить из опьггов с различными газами. Отрицательное влияние газов на растворимость в воде жидких углеводородов при температурах до 150°С увеличивается в ряду азот-метан-этан-углекислый газ-пропан. [c.201]
ЭТАН м, jHg. Насыщенный углеводород, плохо растворимый в воде газ компонент природного газа. [c.513]
Образование комплексных ионов. Известно несколько примеров образования комплексных борсодержащих ионов путем координации отрицательного органического иона с молекулой алкил-бора. Один из них — тетраметилборат лития Ь1В(СНз)4 (литийтетраметилбор), образующийся при взаимодействии метиллития и триметилбора в эфирном растворе. Это соединение растворимо в воде, и раствор его на воздухе только в небольшой степени подвергается разложению. Водный раствор проводит электрический ток, и при электролизе получается смесь газообразных углеводородов, содержащая метан, этан и циклопропан. Подкисление раствора вызывает быструю диссоциацию с освобождением триметилбора [6], который на воздухе воспламеняется и горит зеленым пламенем. [c.152]
ДДД. 1,1-Дихлор-бкс-(4гХлорфенил)этан. Белое, твердое, плохо растворимое в воде вещество. По своим физическим и химическим свойствам ДДД очень близок к ДДТ. Препараты ДДД — смачивающиеся порошки, концентраты эмульсий, дусты. Применяют как контактный инсектицид против тех же вредителей, против которых эффективен ДДТ, но дозы его несколько выше, а результаты борьбы не такие устойчивые, как при применении ДДТ. Для человека несколько менее ядовит, чем ДДТ. [c.83]
Практически сила действия М. У. очень ослабляется вследствие ничтожной растворимости в воде и в крови, благодаря чему необходимы высокие концент1иции их в воздухе, чтобы создались опасные концентрации в крови. Поэтоиму практически (при обычном давлении) низшие М. У. (метан, этан) физиологически индиферентны и могут вызывать острые отравления только в очень высоких концент.рациях, вызывая асфиксию вследствие понижения содержания кислорода в воздухе. Наркотическое действие метана обнаруживается только при воздействии его на животных под давлением в 2,5—3 ат (Мейер и Гопф Лазарев, 1941). С увеличением числа атомов углерода наблюдается увеличение силы наркотического действия М. У. (в соответствии с общим правилом Ричардсона о возрастании силы наркотического действия в гомологических рядах), так что, несмотря на плохую раствормость, их наркотические свойства проявляются и при ингаляционном способе их проникания в организм. Нормальные М. У. действуют сильнее соответствующих изосоединений. [c.15]
Структура адсорбционного слоя. Гидратация частиц растворяемого вещества является первой и обязательной стадией всякого процесса растворения в воде. В связи с этим вещества, хорошо растворимые в воде, можно назвать гидрофильны-м и. Примером гидрофильного вещества может служить хлористоводородный газ НС1, растворимый в воде в огромных количествах. Такие газы, как метан СН4, этан СНз-СНз, пропан СНз СНг СНз и т. д., плохо растворяются в воде. Эти вещества можно назвать гидрофобными . Могут быть гидрофильные жидкости (например, h3SO4), гидрофильные твердые тела (например, NaOH, KJ и др.). Гексан СбНи, бензол СеНв могут служить примером гидрофобных жидкостей, а нафталин СюНа—примером гидрофобного твердого тела. [c.242]
Как установлено ранее, бензол-, этан- и метансульфонилбенза-мидоксимы (ББО, ЭБО, МБО) в зависи.мости от условий образуют с рутением растворимые в воде окрашенные комплексные соединения которые используются для его фотометрического определения [П. [c.86]
Щавелевая кислота, или этан дикислота, A idum oxali um, НООС —СООН, широко распространена в растительном мире. Кристаллы кальциевой соли щавелевой кислоты — оксалата кальция — плохо растворимы в воде и обладают характерной формой. В щавеле щавелевая кислота содержится в значительном количестве в виде кислой калиевой соли НСЮС — OOK. Кристаллы оксалата кальция появляются в моче человека при некоторых патологических состояниях. [c.189]
Простейший гликоль, этиленгликоль, представляет собой густую жидкость сладкого вкуса, растворимую в воде. Температура его кипения 197,5°. Интересно отметить влияние вхождения гидроксильной группы на некоторые свойства. Этан — газ, его моно-гидроксильное производное (этиловый спиртТ жидкость с температурой кипения 78,3° дигидроксильное производное этана, (гликоль) кипит при 197,5°, то есть больше, чем на 100° выше. Накопление гидроксильных групп в молекуле увеличивает растворимость вещества в воде. Растворимость одноатомных спиртов падает с увеличением их молекулярного веса, многоатомные спирты (трех- четырех- и выше) все растворимы в воде. Наконец, очень многие полигидроксильные производные имеют сладкий вкус. [c.246]
Гомологи метана (ТУВ) - этан (С2Н6), пропан (СЗН8), бутан (С4Н10) имеют большую, по сравнению с метаном сорбционную способность и низкий коэффициент диффузии, что позволяет им концентрироваться в газах закрытых пор. Наибольшая из всех УВ газов растворимость в воде у этана (0,047 м /м при 20° С). Смеси этих газов с воздухом взрывоопасны. Содержание каждого из гомологов в газах чисто газовых залежей обычно менее 0,5 %, в нефтяных попутных газах достигает 30 %. [c.7]
Этан-1,2-диол (этиленгликоль) (СН20Н)2 — простейший устойчивый двухатомный спирт (диол). Это бесцветная ядовитая жидкость (с т. кип. 197 °С), легко смешивается с водой (используется как антифриз), но ограниченно растворима в эфире. Этиленгликоль можно получить из этилена прямым гидрокси-лированием (разд. 3.3.3) или следующими путями [c.80]
Водородные связи также обусловливают ограниченную растворимость многих гидроксисодержащих соединений в апротонных растворителях. Так, если этанол смешивается с эфиром, то этан-1,2-диол плохо растворим в эфире (так же, как и вода), а глицерин фактически нерастворим в эфире, петро-лейном эфире, бензоле и хлороформе. Однако этанол, вода и этан-],2-диол смешиваются друг с другом в любых пропорциях, поскольку каждое соединение имеет водород, связывающий гидроксильную группу. [c.179]
Бензодиоксан-2-ил) -1 - (2,3-эпоксипропокси) этан, С13Н16О4, мол. вес 236,27—светло-коричневые кристаллы, хорошо растворимые в толуоле, метаноле, ацетоне, растворимые в эфире, бензоле и нерастворимые в воде, петролейном эфире. [c.14]
Тетрафтор-1,2-бис(п-толил)этан [434, 437] (примечание 2). В полиэтиленовый реактор емкостью 80 мл, снабженный полиэтиленовым обратным холодильником со счетчиком пузырьков, заполненным концентрированной h3SO4, и полиэтиленовой капельной воронкой (примечание 3), помещают тщательно растерты-е 4,88 г (0,02 моль) т-ранс-1,2-дифтор-1,2-бис(п-толил)этилена и 10,7г (0,045 моль) РЬОз- Охлаждают реактор ледяной водой и постепенно, помешивая от руки, прибавляют из капельной воронки 37 мл (1,8 моль) безводного HF. После окончания энергичной реакции температуру постепенно повышают до 20—25 °С и оставляют на 30—40 мин, периодически помешивая от руки. Смесь осторожно выливают в 500—600 мл воды со льдом и нейтрализуют О /о-ным раствором КОН. Осадок отфильтровывают, промывают водой и сушат. Органическое вещество извлекают толуолом в аппарате Сокслета, толуольный раствор упаривают на роторном вакуум-испарителе до начала выпадения кристаллов и отфильтровывают менее растворимый в толуоле 1,2-дифтор-1,2-бис(п-толил)- [c.245]
Нагреванием в трубке диметилртути с магнием был получен диметилмаг-ний в виде твердой массы, самовоспламенявшейся на воздухе, реагировавшей с водой и спиртом с выделением газа при нагревании в токе водорода при 245° С выделялся этан. Флек показал, что диметилмагний и диэтил-магний растворимы в смеси безводного бензола и эфира, причем при действии хлористого ацетила на диметилмагний был получен триметилкарбинол. Вага из дифенилртути и магния получил дифенилмагний. [c.9]
В табл. 44 приведены данные по растворимости некоторых газов в воде. Из таблицы следует, что углекислый газ растворяется в несколько раз больше, чем метан и этан. Самый же существенный вывод заключается в том, что при более высоких температурах и давлениях растворилюсть метана в воде доста- [c.97]
Из дибромэтана нужно удалить примесь брома. Для этого пользуются той же реакцией его со щёлочью. Полученный продукт сливают из пробирок в делительную воронку (предварительно проверить её и смазать пробки), добавляют в воронку слабый раствор щёлочи и перемешивают жидкости, встряхивая воронку в течение нескольких минут. Затем дают жидкости расслоиться, осторожно сливают через кран в стаканчик нижний слой дибромэтана и отдельно выливают водный раствор. Дибром-этан снова наливают в делительную воронку и промывают ещё один или два раза щёлочью, до полного обесцвечивания продукта. После удаления брома в дибромэтане остаётся некоторое (растворимое) количество бромистых солей. Для удаления их ди-бромэтан промывают в делительной воронке несколькими порциями воды. После этого для школьных опытов препарат можно считать достаточно чистым. [c.86]
chem21.info





















