Формула этилового спирта. Этанол вода
Формула этилового спирта в химии
Определение и формула этилового спирта
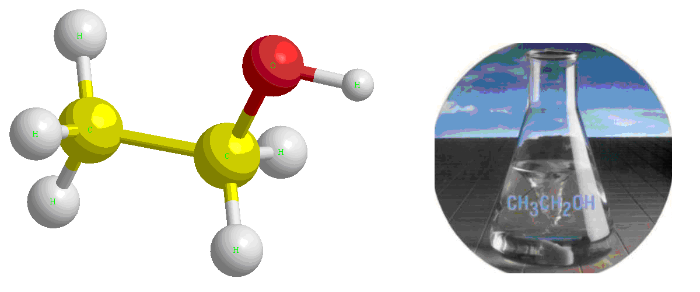
Формула – 
Молярная масса равна 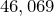 г/моль.
г/моль.
Физические свойства – бесцветная летучая горючая жидкость с характерным спиртовым запахом, имеющая жгучий вкус.
Смешивается с водой в любых соотношениях и образует с ней нераздельно кипящую смесь, которая имеет состав 95,57% спирта и 4,43% воды.
В технике этанол занимает первое место по объему производства среди других органических веществ.
Химические свойства этилового спирта
- Для этанола характерны слабые кислотные свойства, которые проявляются при взаимодействии с щелочными металлами. При этом образуются алкоголяты и происходит выделение газообразного водорода:
![Rendered by QuickLaTeX.com \[ C_2H_5OH + 2K = C_2H_5OK + H_2 \uparrow \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1e69d2234a31b6e7ef303a5337088fe7_l3.png)
- Этанол легко воспламеняется и горит при достаточном поступлении воздуха голубоватым пламенем:
![Rendered by QuickLaTeX.com \[ C_2H_5OH+3O_2\rightarrow 2CO_2+3H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ffc4b6c6e31f70b5821a06169c344d29_l3.png)
- Вступает в катализируемую сильными минеральными кислотами обратимую реакцию этерификации с карбоновыми кислотами с образованием сложного эфира и воды:
![Rendered by QuickLaTeX.com \[ C_2H_5OH+RCOOH\leftrightharpoons RCOOC_2H_5+H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7cf17650e385b32e9fc7ef52f5797003_l3.png)
- Этиловый спирт реагирует с галогеноводородами:
![Rendered by QuickLaTeX.com \[ C_2H_5OH+HCl = C_2H_5Cl+H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-adf7545a56d773d86dc81819127baeea_l3.png)
- Этанол по-разному обратимо ведет себя при нагревании с водоотнимающими средствами:
![Rendered by QuickLaTeX.com \[ 2C_2H_5OH\xrightarrow[120^{\circ} \text{C}]{H_2SO_4}C_2H_5-O-C_2H_5+H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-96bf6a3acd49de39208dc60cb43d783e_l3.png)
![Rendered by QuickLaTeX.com \[ CH_3-CH_2-OH\xrightarrow[200^{\circ} \text{C}]{H_2SO_4}CH_2=CH_2+H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-af1c7202c880950ed3c73d370b8ef05c_l3.png)
Качественной реакцией на этанол является йодоформная проба. При взаимодействии спирта, йода и щелочи происходит образование желтоватого осадка йодоформа:
![Rendered by QuickLaTeX.com \[ C_2H_5OH+6NaOH+4I_2=CHI_3+HCOONa+5NaI+H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-8296458c9e705c7408fc35be82f2b625_l3.png)
Способ получения этанола основывается на брожении сахаристых веществ (виноградного сахара) под влиянием энзимов и дрожжей. Общую схему можно представить как:
![Rendered by QuickLaTeX.com \[ C_6H_{12}O_6\rightarrow C_2H_5OH+2CO_2 \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d3b1950bb7b7dc67ceda73f6a71821c1_l3.png)
Данный способ является весьма неэкономичным, поэтому стоит задача полной замены пищевых продуктов непищевым сырьем. Здесь существует два основных направления. Первый, замена крахмала (целлюлозы) клетчаткой. Второй — синтез спирта из этилена его гидратацией.
Применение
Этиловый спирт в огромных количествах используется в производстве дивинила, этилового эфира, хлороформа, этилацетата и других сложных эфиров, используемых в качестве растворителей лаков и душистых веществ.
Также этанол применяется в качестве растворителя в производстве фармацевтических, душистых, красящих веществ. Этанол — очень хорошее антисептическое средство.
Примеры решения задач

| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
4 Этиловый спирт, свойства и характеристика. Способы получения.
Этиловый спирт (С2Н5ОН) представляет собой бесцветную прозрачную жидкость с характерным запахом и жгучим вкусом; химически чистый спирт имеет нейтральную реакцию, а применяемый в пищевой промышленности (из-за содержащихся в нем органических кислот) — слабокислую реакцию.
При нормальном давлении этиловый спирт кипит при 78,3 оС. Плотность спирта и его растворов зависит от температуры и с повышением ее уменьшается. Этиловый спирт очень гигроскопичен; легко поглощает влагу из воздуха, а также из растительных и животных тканей. Употребление неразбавленного спирта может вызвать ожог слизистой оболочки пищевода. Прием небольшой дозы алкоголя оказывает пьянящее действие на человека, в больших количествах вызывает состояние, близкое к наркозу. Пары спирта вредны для человека. Предельно допустимая концентрация их в воздухе 1000 мг/м3, токсическая — 1600 мг/м3. Запах паров спирта ощущается в воздухе при концентрации 250 мг/м3.
Спирт смешивается с водой в любых соотношениях. Процесс смешения сопровождается выделением тепла, повышением температуры, называемой теплотой смешения, величина которой зависит от соотношения смешиваемых жидкостей и их температуры.Спирт более летуч, чем вода. Если водно-спиртовый раствор хранить в открытом, широком сосуде, то крепость раствора в связи с более быстрым испарением спирта будет снижаться и в сосуде через некоторое время может остаться только вода.Этиловый спирт и его крепкие водные растворы легко воспламеняются и горят бледно-голубым слабосветящимся пламенем, образуя в качестве конечных продуктов воду и углекислый газ.
Спирт-сырец (ГОСТ 131-85) – прозрачная бесцветная жидкость без посторонних веществ, вкус и запах характерен для спирта-сырца из соответствующего сырья, крепостью не ниже 88 об. %. Предельное содержание примесей нормируется по виду сырья
Этиловый спирт (ГОСТ Р 51652-2000) - прозрачная бесцветная жидкость со жгучим вкусом относительная плотность d=0,789; Ткип =78,3 оС, гигроскопичен, Спирт смешивается с водой в любых соотношениях, пары спирта вредны для человека ПДК их в воздухе 1000 мг\м3.
Способы получения спирта. Этиловый спирт принадлежит к числу продуктов, применяемых во многих отраслях народного хозяйства. В настоящее время отечественная промышленность вырабатывает пищевой и технический этиловый спирт.
Пищевой спирт получают из зерна, картофеля, мелассы, сахарной свеклы. Его применяют для приготовления ликероводочных изделий, спиртования виноградных и плодово-ягодных вин, в производстве парфюмерных изделий, в медицине и фармацевтической промышленности и для выработки пищевого уксуса.
Технический спирт получают из этиленсодержащих газов (синтетический спирт), древесины (гидролизный спирт) и сульфитных щелоков — отхода производства целлюлозы из древесины по сульфитному способу (сульфитный спирт). Технический спирт применяют как растворитель в производстве синтетического каучука, синтетического волокна, искусственных шелка и кожи, пластических масс, органического стекла, лаков и красок и для других целей.
Этиловый спирт получают микробиологическим и химическим способами.
Химический способ основан на присоединении воды к этилену. Спирт, полученный химическим способом, называется синтетическим. Производство синтетического спирта экономически выгодно, себестоимость его примерно в 4 раза меньше, чем спирта из пищевого сырья, и в 2 раза меньше, чем гидролизного. Синтетический спирт используют только для технических целей; для пищевых целей его применять запрещается.
Микробиологическим путем спирт получают из различного растительного сырья.
Производство этилового спирта из зерна, картофеля, сахарной свеклы и мелассы основано на ферментативном гидролизе крахмала сырья и сбраживании образующихся сахаров и сахаров, содержащихся в сахарной свекле и мелассе, дрожжами (одноклеточными неподвижными микроорганизмами).
Производство пищевого спирта складывается из следующих основных процессов:
- разваривание растительного сырья с водой с целью нарушения его клеточной структуры и растворения крахмала;
- охлаждение разваренной массы и осахаривание крахмала ферментами солода (проращенного зерна) или культурами плесневых грибов;
- сбраживание сахаров дрожжами;
- отгонка спирта из бражки и его ректификация.
Спиртовое брожение - сложный биохимический процесс, протекающий через ряд промежуточных стадий с участием большого числа ферментов, вносимых в затор (разваренная масса крахмалистого сырья) с солодом или культурами плесневых грибов.
Перегонка и ректификация. Спирт-сырец содержит около 0,5% примесей, в состав которых входит около 50 веществ, которые можно разделить на следующие группы: спирты, альдегиды, эфиры, кислоты.
Ректификацией спирта называют процесс освобождения этилового спирта от примесей. Все примеси спирта-сырца по их степени летучести можно разделить на 3 группы: головные, промежуточные и хвостовые.
В настоящее ректификованный спирт из бражки получают на брагоректификационных установках, что считается экономически более целесообразным. При этом сокращаются затраты труда, пара, потери спирта.
Характеристика примесей и их влияние на качество продукции. Спиртовые заводы выпускают этиловый спирт-сырец и ректификованный этиловый спирт.
Спирт-сырец. Это спирт, получаемый при перегонке зрелой бражки, не очищенный от примесей. В этиловом спирте-сырце содержится большое количество различных примесей, которые могут быть разделены на четыре основные группы: альдегиды, эфиры, высшие спирты и кислоты. Каждая из этих групп объединяет большое число соединений, присутствие которых обусловливает вкус и аромат спирта.
В этиловом спирте-сырце обнаружено более 50 соединений. Состав его непостоянен, так как количество и характер примесей зависят от вида сырья, из которого получают спирт, и качества сырья, от соблюдения технологического режима, конструкции применяемого оборудования.
По виду исходного сырья пищевой спирт-сырец подразделяют на три группы:
1 - спирт из зерна, картофеля или из их смеси;
2 - из смеси зерна, картофеля, сахарной свеклы и мелассы в различных соотношениях;
3 - спирт из мелассы.
Спирт-сырец — это прозрачная бесцветная жидкость без посторонних частиц, вкус и запах его характерны для спирта-сырца, выработанного из соответствующего сырья.
Содержание этилового спирта (крепость) в спирте-сырце должно быть не менее 88 % об.
Общее количество примесей в спирте-сырце колеблется в пределах 0,3—0,5 % от содержания в нем безводного спирта.
Значительная часть примесей содержится в количествах, не обнаруживаемых принятыми в промышленности методами анализа, однако присутствие их в спирте даже в самых ничтожных количествах ухудшает органолептические показатели спирта, придавая ему неприятный запах и горький вкус. Поэтому очистка (ректификация) спирта-сырца от примесей является обязательным и непременным условием при последующем использовании спирта для приготовления водок и ликероводочных изделий.
Ректификованный этиловый спирт. Это спирт, полученный ректификацией спирта-сырца или брагоректификацией зрелой бражки.
Ректификация спирта-сырца основана на отделении примесей, имеющих другую по сравнению с этиловым спиртом температуру кипения. Очистка спирта многократной перегонкой основана на различной летучести этилового спирта и его примесей, вследствие чего они кипят и испаряются при разной температуре.
Примеси спирта-сырца в зависимости от степени их летучести можно разделить на три группы: головные, хвостовые и промежуточные.
Головными примесями называют те, у которых температура кипения ниже температуры кипения этилового спирта. К ним относятся альдегиды и эфиры, например уксусный альдегид, муравьиноэтиловый, уксуснометиловый, уксусноэтиловый и др., которые удаляются в виде эфироальдегидной фракции (ЭАФ).
Хвостовыми примесями называют такие, температура кипения которых выше температуры кипения этилового спирта. К ним относятся высшие спирты (пропиловый, изопропиловый, изобутиловый, амиловый, изоамиловый и т. д.) и жирные кислоты. Большинство хвостовых примесей нерастворимы в воде и имеют маслянистый вид, поэтому они объединены под общим названием «сивушное масло». К хвостовым примесям также относят фурфурол, ацетали и некоторые другие вещества.
Промежуточные продукты представляют собой группу примесей, которые наиболее трудно отделяются от этилового спирта и в зависимости от условий перегонки могут быть и головными, и хвостовыми. В эту группу входят изомасляно-этиловый и изовалериано-этиловый эфиры. Эти вещества при высокой концентрации этилового спирта в процессе перегонки равномерно распределяются между паром и жидкостью, «размазываются» по колонне и могут отходить как с головными, так и с хвостовыми примесями.
До последнего времени значительное количество ректификованного спирта получали из спирта-сырца на ректификационных аппаратах периодического или непрерывного действия. Для получения на периодически действующих аппаратах спирта высокого качества ректификованный спирт вторично перегоняли. При работе на непрерывно действующих аппаратах спирт высшей очистки и экстра получают изменением режима работы ректификационной установки (замедленная сгонка, уменьшенный отбор спирта и т. д.).
В настоящее время широко применяют брагоректификационные аппараты, в которых ректификованный спирт получают непосредственно из бражки. Сочетание в одном аппарате процессов получения спирта-сырца из бражки и его ректификация позволяет уменьшить расход воды, пара и сократить потери спирта.
Брагоректификационные аппараты состоят из бражной, эпюрационной и ректификационной колонн. В бражной колонне из бражки Выделяют этиловый спирт и другие летучие вещества; в эпюрационной отделяют головные примеси; в ректификационной получают ректификованный спирт.
При ректификации из спирта-сырца полностью удаляется фурфурол, значительно снижается количество сивушных масел, альдегидов и эфиров. Ректификация позволяет снизить общее содержание примесей приблизительно в 100 раз. Однако оставшаяся незначительная часть микропримесей оказывается достаточной, чтобы в той или иной степени отразиться на качестве водок.
Основными микропримесями являются ацетальдегид, ацетон, метилацетат, этилацетат, пропанол, бутанол, изобутанол, амиловый и изоамиловый спирты, уксусная кислота, метиловый спирт и др.
Ацетальдегид и ацетон обладают жгучим вкусом и неприятным раздражающим запахом. Все высшие спирты — пропанол, бутанол, изобутанол, изоамилол и др. — имеют жгучий вкус и острый сивушный запах, остающийся при любом разведении. Пары изоамилового спирта раздражают слизистую оболочку рта и вызывают кашель. Органические кислоты обладают острым неприятным запахом с оттенками прогорклого масла, валерианы и др.
В составе мелассного спирта иногда встречаются примеси летучих азотистых соединений, например, триметиламина, запах которого напоминает запах рыбьего жира.
Примесь метилового спирта, обладающего запахом этилового спирта, на органолептические показатели отрицательного влияния не оказывает. Однако он токсичен и обладает способностью накапливаться в организме человека, вызывать отравление, потерю зрения. Его содержание в этиловом спирте ограничивается.
Содержащиеся в спирте эфиры обладают слабым, но приятным тонким фруктовым ароматом.
Таким образом, на формирование органолептических свойств ликероводочных изделий отрицательное действие могут оказывать ацетальдегид, ацетон, все высшие спирты и органические кислоты, поэтому их содержание в ректификованном этиловом спирте ограничивается.
5. Вода питьевая. Характеристика и свойства. Вода, так же как и спирт, является главной составной частью водок и ликеро-водочных изделий, поэтому ее качество в значительной степени определяет прозрачность, вкус, запах, а также стойкость этих напитков при хранении. В связи с этим качеству воды в ликерно-водочном производстве уделяют большое внимание.
Общий расход воды в ликерно-водочном производстве составляет 9-12 дал на 1 дал перерабатываемого спирта (в пересчете на абсолютный алкоголь). Из этого количества 2,0-2,5 дал расходуется на технологические цели, 5-6 дал на мойку бутылок, 1-2 дал на получение пара, остальное количество на хозяйственные нужды.
В ликерно-водочном производстве используется вода из городского водопровода, артезианских скважин, рек и других источников водоснабжения.
Не зависимо от источника водоснабжения, вода должна удовлетворять требованиям ГОСТа «Вода питьевая». Она должна быть бесцветной, прозрачной, без запаха, приятной на вкус и не содержать вредных примесей.
Природная вода никогда не бывает химически чистой. В ней всегда содержатся в различных количествах минеральные соли, углекислота, кислород, азот, аммиак. Особенно большое влияние на вкус воды оказывают минеральные вещества.
studfiles.net
ФАЗОВОЕ РАВНОВЕСИЕ В СИСТЕМЕ ЭТАНОЛ — ВОДА
Количество просмотров публикации ФАЗОВОЕ РАВНОВЕСИЕ В СИСТЕМЕ ЭТАНОЛ — ВОДА - 291
ПОЛУЧЕНИЕ СПИРТА-СЫРЦА
Летучесть отдельных компонентов смеси характеризуют коэффициентом испарения (К= Y/X) —отношением концентрации данного вещества в паровой фазе Y к концентрации его в жидкой фазе X при равновесном состоянии фаз.
Летучая часть бражки состоит в основном, из воды и этилового спирта͵ в связи с этим в процессе выделения спирта бражку рассматривают как бинарную смесь этилового спирта и воды. Зависимость между составом паровой и жидкой фазы летучих веществ определяется законами Д. П. Коновалова и М. С. Вревского.
В верхней части рис. 1 линия 1 изображает зависимость равновесного состава пара У от состава жидкости X при атмосферном давлении и температуре кипения для смеси этиловый спирт — вода. Она представляет собой геометрическое место точек значений коэффициентов испарения этилового спирта Kэ.c = Y/X из водно-спиртовой смеси. При малых концентрациях спирта в смеси значения Kэ.c максимальны (около 13), при больших — минимальны (около 1).
Линия равновесного состава в точке А пересекает диагональ, следовательно, в этой точке состав паровой и жидкой фазы одинаковый. Эта точка получила название азеотропной точки, или точки нераздельного кипения. Стоит сказать, что для нее Y=X, или Kэ.c = 1. При нормальном давлении нераздельнокипящая смесь системы этиловый спирт - вода содержит 97,2 об.% (95,57 мас.%) этилового спирта при температуре кипения 78,15°С; при том же давлении температура кипения этилового спирта равна 78,3°С, а воды 100°С.
Рис. 1 Зависимость равновесного содержания пара. Температуры кипения и упругости пара от концентрации водно-спиртового раствора при давлении:
1 – атмосферное; 2 – ниже атмосферного; 3 – выше атмосферного.
В соответствии с законом Вревского при повышении давления растворы с низкой концентрацией спирта͵ примерно до 30— 40 мас.%, образуют пары с большим содержанием спирта͵ а растворы с высокой концентрацией спирта — пары с меньшим содержанием спирта͵ что наглядно показано в верхней части рис. 1 пунктирной линией. Из рисунка также видно, что с изменением давления сдвигается и положение азеотропной точки. Так, при давлении 93 кПа (температура кипения 27°С) нераздельнокипящая точка смещается вправо вплоть до Х= 100, т. е. при этом давлении пар всегда будет иметь большую концентрацию спирта͵ чем исходная жидкость (вплоть до 100%).
Анализируя положение кривой фазового равновесия, легко установить, что при атмосферном давлении пары над жидкостью будут обогащаться этиловым спиртом только до азеотропной тонки. Следовательно, путем ректификации (многократного испарения и конденсации) при атмосферном давлении можно достигнуть максимальной крепости спирта 97,2 об. %. Чтобы получить спирт большей крепости, крайне важно уменьшить давление; тогда азеотропная точка сдвинется вправо, т. е. в область требующейся крепости. Этим приемом иногда пользуются на практике при получении абсолютного спирта.
Фазовое равновесие в бинарной смеси, этиловый спирт — вода при атмосферном давлении изучено В. Н. Стабниковым и О. Г. Мудравской. По их данным строят график фазового равновесия, который широко применяют для расчета процесса ректификации и анализа работы ректификационных колонн. В ряде случаев возникает крайне важно сть иметь аналитическую зависимость указанного равновесия, которая по тем же данным установлена П. С. Цыганковым (табл.1).
Таблица 1.
| Интервалы концентраций, мол. % | Уравнения для Y, мол. % | |
| 0—23 | Х/(0,014595 + 0,0773) | |
| 23—55 | 0,395 Х + 45,52 | |
| 55-66,5 | 0,5087Х + 39,27 | |
| 66,5—82 | 0,6548X +29,56 | |
| 82—89,4 . | 0,8113Х + 15,08 |
Наличие сухих веществ в водно-спиртовых растворах, как показано работами С. Е. Харина и В. М. Перелыгина, немного увеличивает концентрацию спирта в парах, однако в практических расчетах обычно пользуются кривой фазового равновесия для чистых водно-спиртовых растворов.
referatwork.ru
ФАЗОВОЕ РАВНОВЕСИЕ В СИСТЕМЕ ЭТАНОЛ — ВОДА
Количество просмотров публикации ФАЗОВОЕ РАВНОВЕСИЕ В СИСТЕМЕ ЭТАНОЛ — ВОДА - 105
ПОЛУЧЕНИЕ СПИРТА-СЫРЦА
Летучесть отдельных компонентов смеси характеризуют коэффициентом испарения (К= Y/X) —отношением концентрации данного вещества в паровой фазе Y к концентрации его в жидкой фазе X при равновесном состоянии фаз.
Летучая часть бражки состоит в основном, из воды и этилового спирта͵ в связи с этим в процессе выделения спирта бражку рассматривают как бинарную смесь этилового спирта и воды. Зависимость между составом паровой и жидкой фазы летучих веществ определяется законами Д. П. Коновалова и М. С. Вревского.
В верхней части рис. 1 линия 1 изображает зависимость равновесного состава пара У от состава жидкости X при атмосферном давлении и температуре кипения для смеси этиловый спирт — вода. Она представляет собой геометрическое место точек значений коэффициентов испарения этилового спирта Kэ.c = Y/X из водно-спиртовой смеси. При малых концентрациях спирта в смеси значения Kэ.c максимальны (около 13), при больших — минимальны (около 1).
Линия равновесного состава в точке А пересекает диагональ, следовательно, в этой точке состав паровой и жидкой фазы одинаковый. Эта точка получила название азеотропной точки, или точки нераздельного кипения. Стоит сказать, что для нее Y=X, или Kэ.c = 1. При нормальном давлении нераздельнокипящая смесь системы этиловый спирт - вода содержит 97,2 об.% (95,57 мас.%) этилового спирта при температуре кипения 78,15°С; при том же давлении температура кипения этилового спирта равна 78,3°С, а воды 100°С.
Рис. 1 Зависимость равновесного содержания пара. Температуры кипения и упругости пара от концентрации водно-спиртового раствора при давлении:
1 – атмосферное; 2 – ниже атмосферного; 3 – выше атмосферного.
В соответствии с законом Вревского при повышении давления растворы с низкой концентрацией спирта͵ примерно до 30— 40 мас.%, образуют пары с большим содержанием спирта͵ а растворы с высокой концентрацией спирта — пары с меньшим содержанием спирта͵ что наглядно показано в верхней части рис. 1 пунктирной линией. Из рисунка также видно, что с изменением давления сдвигается и положение азеотропной точки. Так, при давлении 93 кПа (температура кипения 27°С) нераздельнокипящая точка смещается вправо вплоть до Х= 100, т. е. при этом давлении пар всегда будет иметь большую концентрацию спирта͵ чем исходная жидкость (вплоть до 100%).
Анализируя положение кривой фазового равновесия, легко установить, что при атмосферном давлении пары над жидкостью будут обогащаться этиловым спиртом только до азеотропной тонки. Следовательно, путем ректификации (многократного испарения и конденсации) при атмосферном давлении можно достигнуть максимальной крепости спирта 97,2 об. %. Чтобы получить спирт большей крепости, крайне важно уменьшить давление; тогда азеотропная точка сдвинется вправо, т. е. в область требующейся крепости. Этим приемом иногда пользуются на практике при получении абсолютного спирта.
Фазовое равновесие в бинарной смеси, этиловый спирт — вода при атмосферном давлении изучено В. Н. Стабниковым и О. Г. Мудравской. По их данным строят график фазового равновесия, который широко применяют для расчета процесса ректификации и анализа работы ректификационных колонн. В ряде случаев возникает крайне важно сть иметь аналитическую зависимость указанного равновесия, которая по тем же данным установлена П. С. Цыганковым (табл.1).
Таблица 1.
| Интервалы концентраций, мол. % | Уравнения для Y, мол. % | |
| 0—23 | Х/(0,014595 + 0,0773) | |
| 23—55 | 0,395 Х + 45,52 | |
| 55-66,5 | 0,5087Х + 39,27 | |
| 66,5—82 | 0,6548X +29,56 | |
| 82—89,4 . | 0,8113Х + 15,08 |
Наличие сухих веществ в водно-спиртовых растворах, как показано работами С. Е. Харина и В. М. Перелыгина, немного увеличивает концентрацию спирта в парах, однако в практических расчетах обычно пользуются кривой фазового равновесия для чистых водно-спиртовых растворов.
referatwork.ru
Этиловый спирт этанол азеотропная смесь с водой
В промьпиленности для абсолютирования обычно пользуются методом тройных нераздельно кипящих (азеотропных) смесей. Суть его заключается в следующем. К ректификованному спирту прибавляют бензол. Тройная смесь этанол—вода—бензол образует азеотропную смесь, состоящую из 19,5 % (масс.) этанола, 7,4 % (масс.) воды и 74,1 % (масс.) бензола и кипящую при 64,85 °С. Азеотропная смесь ведет себя в колонне как легколетучий компонент (ЛЛК), при охлаждении она разделяется на два слоя верхний, состоящий в основном из бензола, и нижний — из смеси этанола и воды. При температуре 15 °С в верхнем слое содержится (% масс.) бензола 85, этилового спирта 13,3 и воды 1,7 в нижнем—спирта 49,7, воды 41,3 и бензола 9. [c.1015] Этиловый спирт этанол, винный спирт) имеет характерный алкогольный запах, жгучий вкус. Обычный спирт содержит около 4,5% воды. Эта нераздельно перегоняющаяся, так называемая азеотропная смесь кипит при температуре 78,15°С (760 мм рт. ст.). [c.174]Был предложен [324] метод получения безводного этанола путем азеотропной ректификации, с использованием в качестве разделяющего агента диэтилового эфира, дающего с водой азеотропную смесь с минимумом температуры кипения. Для того чтобы повысить содержание воды в азеотропе, процесс проводится под давлением 6—11 ати. Конденсат азеотропа эфир— вода расслаивается. Эфирный слой возвращается в колонну, а отбирается только водный слой, из которого затем отгоняется содержащийся в нем эфир. Абсолютный этиловый спирт получается в процессе азеотропной ректификации в виде кубовой жидкости. [c.283]
Этиловый спирт. (Темп. кип. 78,33° С Этиловый спирт широко используется в виде ректификата, который представляет собой азеотропную смесь, содержащую 95,6% этанола и 4,4% воды. Температура кипения этой смеси 78,17° С. [c.56]
Этиловый спирт (т. кип. 78,33 С рГ 0,789 п о 1,3616). Широко используется в виде ректификата, который представляет собой азеотропную смесь с температурой кипения 78,17 С, содержащую 95,6% этанола и 4,4% воды (ТУ 19П-39—69). Содержание воды в спирте определяют по плотности, пользуясь соответствующими таблицами. Ректификат применяется в качестве растворителя при проведении целого ряда синтезов и для кристаллизации органических соединений. [c.70]
Промышленный этиловый спирт представляет собой азеотропную смесь (т. е. смесь, которую невозможно разделить дальнейшей перегонкой на отдельные фракции), состоящую из 95,57% этанола и 4,43% воды. Так как температура кипения этой смеси (78,2° С) ниже, чем у так называемого абсолютного спирта (78,3° С), невозможно получить 100%-ный этанол простой перегонкой смеси, добавляя к ней воду или этанол получается только 95,57%-ный этанол. Почти весь этиловый спирт, за редким исключением, используется в виде 95,57 %-ного. Для получения абсолютного спирта последний обрабатывают негашеной известью (СаО), или используют другие способы абсолютирования. [c.406]
Этиловый спирт-ректификат содержит 4—5% воды. Безводный этанол имеет темп. кип. 78,3° С, =0,7936. Нередко в качестве заменителя этилового спирта применяют весьма доступный изопропиловый спирт, который по температуре кипения (82,4°) и растворяющей способности довольно близок к этиловому спирту. Надо, однако, помнить, что изопропиловый спирт образует с водой азеотропную смесь (12,1% воды), кипящую при почти той же температуре (80,4° С), что и безводный изопропиловый спирт. Различать водный и безводный изопропиловый спирт проще всего по плотности (плотность безводного спирта 1 = =0,789, плотность водного "=0,821). [c.56]
Этиловый спирт (этанол) С2Н5ОН является жидкостью, кипящей при 78,3 °С с воздухом образует взрывоопасные смеси в пределах концентраций 3—20% (об.). С водой дает азеотропную смесь, содержащую 95,6% спирта и кипящую при 78,1 °С. В виде такого ректификата этанол обычно и употребляют в технике. [c.187]
Этиловый спирт—(этанол) кипит при 78,3°С смесь С2Н5ОН [30% (об.)] с воздухом взрывоопасна с водой спирт образует азеотропную смесь, содержащую 95,6% С2Н5ОН кипящую при 78,1 °С. Этиловый спирт широко применяется в пищевой и медицинской промышленности, является компонентом жидкостного ракетного топлива, антифризом и т. д. Особенно широко этанол, используется как полупродукт органического синтеза, и, в частности, [c.327]
Этиловый спирт (этанол) С2Н5ОН — жидкость ( кип = 78,4 °С, 4атв=114,2°С). Хорощо растворяется в воде. Водный раствор, содержащий 95,6% С2Н5ОН, представляет собой азеотропную смесь, кипящую при 78,1 °С. [c.215]
Этиловый спирт — этанол С2Н5ОН — представляет собой жидкость с характерным запахом и жгучим вкусом. Его температура кипения 78,3° С, температура замерзания—112° С и уд. вес при 20° С—0,789. Этиловый спирт в воде растворяется во всех отношениях и образует с ней азеотропную смесь, содержащую 95,6% спирта с температурой кипения 78,ГС. Его пары с воздухом взрывоопасны, предел взрываемости 4—14% (объемных). [c.260]
Этанол (метилкарбинол, этиловый спирт) — бесцветная подвижная жидкость с жгучим вкусом и характерным запахом. Температура кипения этанола 78,4°С, температура плавления -114,15°С, плотность 0,794 т/м . Этанол смешивается во всех отношениях в водой, спиртами, глицерином, диэтиловым эфиром и другими органическими растворителями. С некоторыми из них (водой, бензолом, этилацетатом, хлороформом) он образует азеотропные смеси различного состава. Азеотропная смесь с водой, содержащая 95,6% об. этанола, кипит при постоянной температуре 78,1°С. Поэтому, для получения безводного ( абсолютного ) этанола в промышленности используют специальные методы его обезвоживания, например, абсолютирование бензолом. Этанол образует алкоголяты с солями кальция и магния, например СаС12 4С2Н50Н и МяСЬ бСгНбОН. [c.270]
При обезвоживании этилового спирта сырец S состава, близкого к двойной азеотропной смеси этанол— вода (96 масс.% этанола), вводится в колонну, которая орощается флегмой О, содержащей бензол (рис. VI-49). В результате разделения согласно правилу прямой линии отгоняется более летучая тройная азеотропная смесь Аз (18,5 масс.% этанола, 74,1 масс.% бензола и 7,4 масс.% воды, т. кип. 64,85°С). В качестве остатка (исчерпанной жидкости) получается безводный этанол А. После охлаждения до соответствующей температуры азеотропная смесь распадается на две жидких фазы бензольную О (84,5 масс.% бензола, 14,5 масс.% воды) и водную О (36масс.% воды, 53 масс.% этанола). Бензольная фаза поступает на верхнюю тарелку разделительной колонны, а водная фаза дистиллируется во второй колонне и дает по правилу прямой линии в качестве дистиллята тройную азеотропную смесь Аз и исчерпанную жидкость D, содержащую только этанол и воду. Водный раствор подвергается ректификации в третьей колонне получается двойная азеотропная смесь S, которая направляется вместе с сырцом в первую колонну, и вода. По такому методу производится полное разделение спирта и воды в присутствии бензола. [c.509]
Спирты. Продажный этиловый спирт-ректифнкат представляет собой азеотропную смесь, содержащую обычно 95,6% этанола и 4,47о воды. Для многих целей используется спирт, называемый абсолютным , с содержанием основного вещества не менее 99,5%. В промышленности такой спирт получают азеотропной перегонкой с бензолом, а в лаборатории — обезвоживанием с помощью свежеприготовленного оксида кальция. Для получения последнего в муфельной печн прокаливают небольшие кускн чистого мрамора прн 800... 1000 С в течение 4...6 ч. Сразу после охлаждения образовавшийся оксид переносят в хорошо закрывающуюся банку нлн в колбу для абсолютирования спирта. Продажный оксид рекомендуется перед употреблением прокалить в течение 1. ..2 ч. [c.44]
Этиловый спирт — бесцветная, подвижная жидкость с ха-)актерным запахом р = 0,789 кип = 78,3°С пл = —111,8 °С. игроскопичен с водой образует азеотропную смесь, содержащую 95,57 % этанола и кипящую при 78,1 °С. Приблизительно такая же концентрация этанола в имеющемся в продаже спирте-ректификате. Этиловый спирт смешивается с водой, эфиром и многими другими органическими растворителями. Растворяет некоторые неорганические вещества и многие органические соединения. Легко воспламеняется, пары его с воздухом образуют взрывоопасные смеси, нижний предел 3,28 %, верхний 19,0 % С бензином смешивается в равных объемах. Абсолютный этанол прижигает слизистые оболочки и действует на организм как яд. [c.255]
Разделение фаз может быть также иногда вызвано добавлением одной из составных частей азеотропа. Например, тройная азеотропная смесь этилацетат—этиловый спирт—вода представляет собой гомогенную жидкость при комнатной температуре. Однако после добавления избытка воды получаются два слоя один, состоящий в основном из воды и этилацетата, и другой—из этанола и воды, насыщенный этилацетатом. Первый водно-этилацетатовый слой при комнатной температуре содержит вдвое меньше воды по сравнению с двойным азеотропом. Поэтому разгонкой можно получить в остатке этилацетат, свободный от воды вода удаляется в виде нижекипящего двойного азеотропа. [c.310]
Этанол (этиловый спирт) С,Н ОН — бесцветная жидкость со слабым запахом, легко воспламеняется. Смешивается с водой во всех соотношениях. Прчем внутрь даже небольших количеств этанола понижает восприимчивость органов чувств, вызывает сильное поражение центральной нервной системы. Широко используется в промышленном органическом синтезе. В фармации применяется для приготовления настоек и экстрактов в медицинской практике — как наружное антисептическое средство для дезинфекции рук и хирургических инструментов. Безводный (абсолютный) спирт кипит при 78,37 С. Получаемый в промышленности спирт-ректификат представляет собой смесь 95,6% этанола и 4,4% воды, которая кипит при постоянной температуре — 78,15 °С (смеси определенного состава, кипящие при постоянной температуре, называют азеотропными смесями). Основной промышленный способ получения этанола — гидратация этилена под давлением. [c.177]
Азеотропная перегонка. Если экстракционная перегонка применяется для разделения иарафивовых углеводородов, то азеот-ропную перегонку используют для разделения ароматических углеводородов. Процесс идет также в присутствии третьего компонента, образующего с одним или несколькими компонентами разделяемой смеси азеотропную смесь. Растворитель может образовывать с компонентами азеотропные смеси с минимумом или максимумом на кривой кипения. При разделении бинарной смеси могут получаться азеотропные смеси с минимум температур кипения, но один из азеотропов обычно кипит ниже, чем второй. Растворитель может образовывать гомогенные азеотропные смеси (полная взаимная растворимость растворителя и выделяемого компонента смеси) и гетерогенные азеотропы. Примером последнего служит тройной азеотроп этанол—вода-бензол с Гкип- = 64,9°С (74,1% бензола, 18,5% спирта и 7,4% воды), образующийся при обезвоживании этилового спирта бензолом. [c.55]
Этиловый (винный) спирт, этанол С2Н5ОН —бесцветная жидкость с характерным спиртовым запахом т. кип. 78,3° С (рис. 27). Смешивается с водой в любых соотношениях и образует с ней азеотропную (нераздельно кипящую) смесь 95,57% спирта и 4,43% воды. Для получения совершенно чистого безводного, или абсолютного, спирта пользуются преимущественно двумя методами. К водному раствору спирта прибавляют немного бензола и полученную смесь подвергают фракционированной разгонке. При этом сперва гонится смесь воды, спирта и бензола, затем спирта с бензолом и, наконец, чистый спирт. По другому методу нагревают 96%-ный спирт с окисью кальция или прокаленным сульфатом меди. При этом основная масса воды удаляется, но 0,2— [c.131]
При наличии ()Инарной смеси с азеотропной точкой и ограниченно растворимого третьего комионента ие всегда образуется тройная смесь с азеотропной точкой. Так, изоамиловый спирт ограниченно растворим в воде, а смесь этанол — вода имеет азеотропную точку. Однако тройная смесь изоамиловый спирт — этанол — вода не имеет азеотропной точки это объясняется тем, ЧТС1. 4. с. этанол — вода имеет более низкую температуру кипения, чем изоамштовЕлй спирт — вода в присутствии этано.па. Это обстоятельство но-зво.г1яет отделить изоамиловый спирт от смеси этанол — вода и практически используется для удаления сивушного мас ла в процессе ректификации этилового спирта брожения. [c.27]
chem21.info



















