Большая Энциклопедия Нефти и Газа. Диполь воды
Диполь - вода - Большая Энциклопедия Нефти и Газа, статья, страница 3
Диполь - вода
Cтраница 3
Механизм диссоциации кислот представлен на рис. 57: вокруг полярных молекул ориентируются диполи воды и в результате диполь-дипольного взаимодействия полярные молекулы превращаются в ионные, а последние - в гидратированные ионы. [31]
Механизм диссоциации кислот представлен на рис. 47: вокруг полярных молекул ориентируются диполи воды и в результате диполь-дипольного взаимодействия полярные молекулы превращаются в ионные, а последние - в гидратированные ионы. [32]
Механизм диссоциации кислот представлен на рис. 26: вокруг полярных молекул ориентируются диполи воды и в результате взаимодействия полярные молекулы превращаются в ионные, а последние - - в гидратированные ионы ( стр. [33]
Механизм диссоциации кислот представлен на рис. 5.6: вокруг полярных молекул ориентируются диполи воды и в результате взаимодействия полярные молекулы превращаются в ионные, а последние - - в гидратированные ионы. [34]
Экспериментально установлено, что в нефтяной эмульсии, помещенной в электрическое поле, диполи воды ориентируются вдоль его силовых линий. Это приводит к резкому увеличению электропроводности эмульсий. [35]
Среди комплексных соединений различают: 1) аквакомплексы, у которых лигандами являются диполи воды [ А1 ( Н2О) б ] С1з, [ Со ( Н2О) б ] С12 и др.; 2 ацидокомплексы с анионами в качестве лиган-дов K2 [ PtCl6 ], Na2 [ SiFe ] и др.; 3) полигалоген иды, у которых комплек-сообразователем служит ион галогена, а лигандами - молекулы галогенов, например К [ 1 ( 1г) ] - трииодид калил. [36]
Если в водном растворе имеются ионы какого-нибудь электролита, то вокруг них ориентируются диполи воды, так как ион является носителем электрического заряда. В электрическом поле катиона диполи воды располагаются к поверхности иона своим отрицательным концом, в поле аниона - концом положительным. Это связывание воды ионами получило название электростатической гидратации и легко подтверждается экспериментально. Используя рентгенографический метод, можно точно определить радиусы того или иного иона. [37]
Действие гальванопар FeS-Fe позволяет создать более концентрированную атмосферу протонов вокруг двойного слоя железо - диполи воды. Отрицательный заряд возрастает и большее количество Н притягивается к поверхности железа. [39]
Пожалуй, наилучшим примером молекул, взаимодействующих таким образом, могут служить гидраты ксенона, в которых диполь воды индуцирует диполь в первоначально сферически симметричном, но очень легко поляризуемом атоме ксенона. [40]
Mg, Fe2, Ce3, F -), обладающими достаточно сильным электрическим полем, способным ориентировать диполи воды, находящиеся на периферии ( на поверхности) этих ионов, в направлении силовых линий. [41]
Когда, например, в водной среде оказывается кристалл соли ( например, хлорида натрия), то диполи воды немедленно притягиваются к ионам, находящимся на поверхности кристалла; энергия взаимодействия иона и диполей воды настолько велика, что ионы покидают свои места в кристаллической решетке и уходят в водную среду, окруженные оболочками из молекул воды. Велики ли эти водяные шубы. У различных ионов они неодинаковы. Чем меньше размер иона и больше его заряд, тем прочнее удерживаются диполи воды в гидратной оболочке - шубе иона, вполне прочно удерживаются лишь 4 - 6 молекул воды. [42]
Для одновалентных ионов мы в дальнейших рассуждениях делаем допущение, что практически вся химическая теплота сольватации связана с взаимодействием ион - диполи воды в этом первом слое. [43]
Мы приняли для е значение между е, и п2, поскольку колебания поля, обусловленные туннельными переходами, происходят быстро, и диполи воды не успевают на них реагировать. Зависимость между е и vo обсуждается в следующем разделе. [44]
ПРИ адсорбции анилина из водных растворов составляет 5 83 кдж / молъ, а при адсорбции ге-амино-бензойной кислоты - 7 кдж / молъ, поскольку при ионизации я-аминобензойной кислоты диполи воды ориентируются как в поле С00 - - групп, так и в поле NHs - групп биполярных ионов. Введение в ароматическое ядро производных бензола, которые являются слабыми электролитами, гидрофильных полярных функ-ционных групп, образующих Н - связи с водой в растворе, вызывает по той же причине резкое уменьшение разности & Fa адсорбции двух органических ионов, различающихся этой группой. [45]
Страницы: 1 2 3 4 5
www.ngpedia.ru
Диполь - вода - Большая Энциклопедия Нефти и Газа, статья, страница 4
Диполь - вода
Cтраница 4
Неорганическое вещество ( твердая соль или ее концентрированный раствор), поступая в водный раствор газа, ионизируется, образуя ионы с положительным и отрицательным зарядами, которые притягивают к себе диполи воды, окружая при этом ионы. Молекулярная структура раствора при высоких концентрациях соли, постепенно приближается к структуре кристаллогидрата соли. Взаимодействие между диполями воды и ионами ингибитора носит электростатический характер, обладая при этом более сильным взаимодействием между молекулами газа и воды. Существующая при этом квазикристаллическая структура воды нарушается, и растворимость газа падает. Данное явление называется высаливанием и проявляется, когда полярности компонентов раствора отличаются. [46]
Так как диэлектрическая постоянная твердых частиц сильно отличается от диэлектрической постоянной воды, то при соприкосновении частиц грунта с водой возникает электрическое поле с избыточной энергией на поверхности частиц грунта и диполи воды притягиваются к поверхности минеральных частиц. [47]
При достижении критического солесодержания котловой воды на поверхности паровых пузырьков образуются проточные квазитвердые пленки, в создании которых участвуют коллоидные частицы определенной степени дисперсности ( окислы железа, соли жесткости), ионы солей и диполи воды. Эти пленки не позволяют пузырькам сливаться, в результате чего эмульсия состоит из большого количества мелких медленно всплывающих пузырьков, что и приводит к увеличению набухания уровня и образованию пены. Кроме того, увеличение давления внутри пузырьков, обусловленное уменьшением их диаметра, наряду с общим увеличением поверхности раздела фаз приводит к уменьшению размера капель влага, выбрасываемой в паровое пространство барабана, и общему увеличению ее количества. [48]
Согласно Б о р н у, чем меньше диаметр свободного иона, тем он сильнее гидратирован и следовательно тем больше диаметр гидратированного иона, так как электрическое поле сосредоточено в меньшем объеме и сильнее при-тйгивает диполи воды. [49]
При погружении куска металла в воду, в раствор должны переходить преимущественно ионы металла, так как они подвергаются не только кинетическому воздействию ударяющих о поверхность металла молекул воды, но и гидратации, которая облегчается как наличием положительного заряда, так и тем, что ориентированные по отношению к этому заряду диполи воды могут подойти к нему значительно ближе, чем к незаряженному атому. [51]
В случае использования водорастворимых КПАВ при насыщении двух обратноориентированных слоев ПАВ на электрохимических флокулах они смачиваются водой. Диполи воды ориентируются нормально к поверхности флокул, поэтому плотность воды в пленке повышена и структурная составляющая расклинивающего давления Па положительна. В результате этого, даже в случае резкого утончения водных прослоек, они все равно препятствуют слипанию пленочных флокул. [52]
Молекулы воды, ориентированные вокруг заряженной глинистой частицы, образуют пленку адсорбционно связанной водой, которая находится в ином физическом состоянии, чем капель-но-жидкая. Диполи воды, соприкасающиеся с поверхностью кристаллов, взаимодействуют с электрическими зарядами на этой поверхности и располагаются в определенном порядке, приближающемся к порядку расположения кислородных атомов на поверхности, вследствие чего структура слоя воды становится близкой к структуре данного кристалла. Толщина такого слоя ( нежидкой воды) изменяется от 1 до 10 нм и составляет от 4 до 40 молекулярных слоев. Пленка нежидкой воды, входящей в диффузный слой, обладает свойствами псевдотвердого тела. Она не способна увеличивать текучесть шлама и создает дополнительное сопротивление. [54]
Ионы кристалла взаимодействуют с дипольными молекулами воды: к ионам натрия молекулы воды притягиваются своими отрицательными полюсами, а к ионам хлора-положительными. Постепенно диполи воды проникают между ионами Na и СГ. В результате образуются свободные гидрати-рованные ионы натрия и хлора, которые и обеспечивают электропроводность водного раствора NaCl и другие свойства, характерные для жидкого электролита. [56]
Другая родственная адсорбции область поверхностных явлений была исследована акад. При адсорбции диполи воды в поверхностном слое ориентированы так, что кислород обращен в сторону газообразной фазы, а водород-в сторону соли. [57]
При высокочастотной сушке паковки помещаются в пространство между двумя электродами. Расположенные вначале хаотично диполи воды под действием токов высокой частоты ориентируются в пространстве в соответствии с электрическим полем, располагаясь перпендикулярно к электродам. Вследствие возникающего при этом трения нагревается материал, причем степень нагрева в данном случае зависит от диэлектрических характеристик волокна. [59]
Легче всего диссоциируют вещества с ионной связью. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов иа кристалла раствор. [60]
Страницы: 1 2 3 4 5
www.ngpedia.ru
Диполь - вода - Большая Энциклопедия Нефти и Газа, статья, страница 3
Диполь - вода
Cтраница 3
Механизм диссоциации кислот представлен на рис. 57: вокруг полярных молекул ориентируются диполи воды и в результате диполь-дипольного взаимодействия полярные молекулы превращаются в ионные, а последние - в гидратированные ионы. [31]
Механизм диссоциации кислот представлен на рис. 47: вокруг полярных молекул ориентируются диполи воды и в результате диполь-дипольного взаимодействия полярные молекулы превращаются в ионные, а последние - в гидратированные ионы. [32]
Механизм диссоциации кислот представлен на рис. 26: вокруг полярных молекул ориентируются диполи воды и в результате взаимодействия полярные молекулы превращаются в ионные, а последние - - в гидратированные ионы ( стр. [33]
Механизм диссоциации кислот представлен на рис. 5.6: вокруг полярных молекул ориентируются диполи воды и в результате взаимодействия полярные молекулы превращаются в ионные, а последние - - в гидратированные ионы. [34]
Экспериментально установлено, что в нефтяной эмульсии, помещенной в электрическое поле, диполи воды ориентируются вдоль его силовых линий. Это приводит к резкому увеличению электропроводности эмульсий. [35]
Среди комплексных соединений различают: 1) аквакомплексы, у которых лигандами являются диполи воды [ А1 ( Н2О) б ] С1з, [ Со ( Н2О) б ] С12 и др.; 2 ацидокомплексы с анионами в качестве лиган-дов K2 [ PtCl6 ], Na2 [ SiFe ] и др.; 3) полигалоген иды, у которых комплек-сообразователем служит ион галогена, а лигандами - молекулы галогенов, например К [ 1 ( 1г) ] - трииодид калил. [36]
Если в водном растворе имеются ионы какого-нибудь электролита, то вокруг них ориентируются диполи воды, так как ион является носителем электрического заряда. В электрическом поле катиона диполи воды располагаются к поверхности иона своим отрицательным концом, в поле аниона - концом положительным. Это связывание воды ионами получило название электростатической гидратации и легко подтверждается экспериментально. Используя рентгенографический метод, можно точно определить радиусы того или иного иона. [37]
Действие гальванопар FeS-Fe позволяет создать более концентрированную атмосферу протонов вокруг двойного слоя железо - диполи воды. Отрицательный заряд возрастает и большее количество Н притягивается к поверхности железа. [39]
Пожалуй, наилучшим примером молекул, взаимодействующих таким образом, могут служить гидраты ксенона, в которых диполь воды индуцирует диполь в первоначально сферически симметричном, но очень легко поляризуемом атоме ксенона. [40]
Mg, Fe2, Ce3, F -), обладающими достаточно сильным электрическим полем, способным ориентировать диполи воды, находящиеся на периферии ( на поверхности) этих ионов, в направлении силовых линий. [41]
Когда, например, в водной среде оказывается кристалл соли ( например, хлорида натрия), то диполи воды немедленно притягиваются к ионам, находящимся на поверхности кристалла; энергия взаимодействия иона и диполей воды настолько велика, что ионы покидают свои места в кристаллической решетке и уходят в водную среду, окруженные оболочками из молекул воды. Велики ли эти водяные шубы. У различных ионов они неодинаковы. Чем меньше размер иона и больше его заряд, тем прочнее удерживаются диполи воды в гидратной оболочке - шубе иона, вполне прочно удерживаются лишь 4 - 6 молекул воды. [42]
Для одновалентных ионов мы в дальнейших рассуждениях делаем допущение, что практически вся химическая теплота сольватации связана с взаимодействием ион - диполи воды в этом первом слое. [43]
Мы приняли для е значение между е, и п2, поскольку колебания поля, обусловленные туннельными переходами, происходят быстро, и диполи воды не успевают на них реагировать. Зависимость между е и vo обсуждается в следующем разделе. [44]
ПРИ адсорбции анилина из водных растворов составляет 5 83 кдж / молъ, а при адсорбции ге-амино-бензойной кислоты - 7 кдж / молъ, поскольку при ионизации я-аминобензойной кислоты диполи воды ориентируются как в поле С00 - - групп, так и в поле NHs - групп биполярных ионов. Введение в ароматическое ядро производных бензола, которые являются слабыми электролитами, гидрофильных полярных функ-ционных групп, образующих Н - связи с водой в растворе, вызывает по той же причине резкое уменьшение разности & Fa адсорбции двух органических ионов, различающихся этой группой. [45]
Страницы: 1 2 3 4 5
www.ngpedia.ru
Диполь - вода - Большая Энциклопедия Нефти и Газа, статья, страница 2
Диполь - вода
Cтраница 2
По отношению к ионам натрия диполи воды ориентируются своими отрицательными полюсами, а к ионам хлора-положительными. [17]
Поскольку ион электростатически связывает вокруг себя диполи воды, постольку он передвигается вместе со всей водной оболочкой, а это ведет к увеличению поверхности трения и замедляет передвижение иона. Значит, чем меньше в радиусе ион, тем больше его гидратация. Оболочка из ориентированной вокруг ионов воды называется гидратавдюнной оболочкой. [18]
Притягивая к себе молекулу или ион, диполи воды ослабляют, а затем и разрывают межмолекулярные или ионные связи. В частности, вода уменьшает прочность ионной связи между ионами Na и С1 - или ионами Na и Вг-примерно в 80 раз. Отделившиеся молекулы или ионы под влиянием теплового движения всех частиц раствора перемещаются ( диф - фундируют), равномерно распределяясь между молекулами растворителя. [20]
ОН -, способных притягивать и ориентировать диполи воды, приводит к развитию у таких оболочек из эттрингита явления набухания в воде. При поглощении воды происходит разбухание диффузных слоев коллоидного эттрингита ( или других гидратов), их соприкосновение друг с другом и взаимное отталкивание, приводящее к раздвиганию частиц и расширению системы. В зависимости от заряда коллоидных частиц ( отрицательный или положительный) наибольший расклинивающий электроосмотический эффект проявляется при разной концентрации Са2 в водном растворе. Величина осмотического давления в твердеющем цементном камне может достигать больших значений. [21]
Но не только ионы притягивают к себе диполи воды. Молекулы воды с такой же силой притягивают к себе ионы, как бы стремясь оторвать их от кристалла. Удары других молекул способствуют отрыву ионов натрия и хлора от кристалла и постепенному переходу их в раствор. В сущности при диссоциации образуются не ионы, а соединения ионов с молекулами растворителя. [23]
В этом случае вокруг полярной молекулы вещества ориентируются диполи воды, которые притягиваются своими отрицательными полюсами к положительному полюсу молекулы и положительными полюсами - к отрицательному полюсу. [25]
Как уже говорилось, к полярным группировкам притягиваются диполи воды, образующие вокруг коллоидной частицы сплошную ( или почти сплошную) водную оболочку. Спонслер нашел, что одна группа ОН притягивает 3 молекулы воды, СООН - 4 молекулы, С О - 2 молекулы, NH - 2 молекулы, Nh3 - 3 молекулы. [26]
Разумеется, по только ионы притягивают к себе диполи воды. Молекулы воды с такой же силой притягивают к себе ионы, как бы стремясь оторвать их от кристалла. Толчки со стороны других молекул способствуют отрыву ионов натрия и хлора от кристалла и постепенному переходу их в раствор. [27]
Если молекулы или макромолекулы содержат заряженные группировки, то диполи воды образуют вокруг них гидратные оболочки. Такая вода называется связанной. Слой воды вокруг белка может достигать 1 5 - 2 0 нм, что существенно влияет на строение и свойства последнего. Таким образом, вода в организме присутствует в свободной и связанной формах. Большой интерес представляет структура воды при переходе в твердое состояние. В кристалле льда молекулы воды образуют гексагональную структуру. Предполагается, что именно льдообразная вода ( рис. 1.2) поддерживает третичную структуру ряда макромолекул. Часть связанной воды локализована внутри надмолекулярных структур и также участвует в стабилизации конформации макромолекул. [29]
Жесткие доноры и акцепторы, обладая высокими электростатическим характеристиками, упорядочивают диполи воды в гидратационные структуры. При образовании комплекса эти структуры разрушаются и энтропия системы возрастает. Этот эффект не компенсируется уменьшением AS0, связанным с ассоциацией между М и L. Значения AS - 0 благоприятствуют комплек сообразованию. Устойчивость большинства электростатических комплексов в водных растворах обусловлена энтропийным фактором. Такие комплексы могут быть устойчивы, несмотря на эндо-термичность реакции их образования. [30]
Страницы: 1 2 3 4 5
www.ngpedia.ru
Структура молекул воды и их ассоциатов :: Живая вода
«Мир чарующий и фантастический», - такими словами лауреат Нобелевской премии Альберт Сент-Дьердьи характеризует ощущения исследователя, изучающего структуру воды. Результаты тем сильнее впечатляют, что очень уж обычен сам объект изучения.
Вода начинается с молекулыИтак, молекула воды (1h316O) состоит из двух атомов водорода (1H) и одного атома кислорода (16O). Оказывается, что едва ли не все многообразие свойств воды и необычность их проявления определяется, в конечном счете, физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.
В отдельно рассматриваемой молекуле воды атомы водорода и кислорода, точнее их ядра, расположены так, что образуют равнобедренный треугольник. В вершине его – сравнительно крупное кислородное ядро, в углах, прилегающих к основанию, – по одному ядру водорода. Модель молекулы воды, предложенная Нильсом Бором, показана на рис. 1.5.
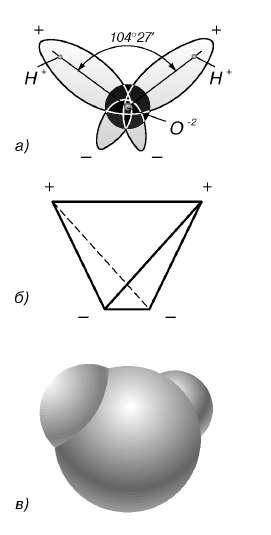 Рис. 1.5. Строение молекулы водыа – угол между связями O-H;б – расположение полюсов заряда;в – внешний вид электронного облака молекулы воды.
Рис. 1.5. Строение молекулы водыа – угол между связями O-H;б – расположение полюсов заряда;в – внешний вид электронного облака молекулы воды.Электронное строение молекулы воды
В соответствии с электронным строением атомов водорода и кислорода молекула воды располагает пятью электронными парами. Они образуют электронное облако. Облако неоднородно – в нем можно различить отдельные сгущения и разрежения. У кислородного ядра создается избыток электронной плотности. Внутренняя электронная пара кислорода равномерно обрамляет ядро: схематически она представлена окружностью с центром - ядром O2 (рис. 1.5а). Четыре внешних электрона группируются в две электронные пары, тяготеющие к ядру, но частично не скомпенсированные. Схематически суммарные электронные орбитали этих пар показаны в виде эллипсов, вытянутых от общего центра – ядра O2-. Каждый из оставшихся двух электронов кислорода образует пару с одним электроном водорода. Эти пары также тяготеют к кислородному ядру. Поэтому водородные ядра – протоны – оказываются несколько оголенными, и здесь наблюдается недостаток электронной плотности.
Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер). Для большей наглядности можно представить, что полюса занимают вершины деформированного тетраэдра, в центре которого находится ядро кислорода (рис. 1.5б).
Общий вид электронного облака молекулы воды показан на рис. 1.5в.
Вода - диполь: полярность водыПочти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула воды является миниатюрным диполем с высоким дипольным моментом – 1,87 дебая (Дебай – внесистемная единица электрического дипольного 3,33564·1030 Кл·м). Под воздействием диполей воды в 80 раз ослабевают межатомные или межмолекулярные силы на поверхности погруженного в нее вещества. Иначе говоря, вода имеет высокую диэлектрическую проницаемость, самую высокую из всех известных нам соединений.Также, последние исследования установили полярность кластеров воды.
Вода растворяет все!Во многом благодаря диэлектрической проницаемости, вода проявляет себя как универсальный растворитель. Ее растворяющему действию в той или иной мере подвластны и твердые тела, и жидкости, и газы.
Постоянно соприкасаясь со всевозможными веществами, вода фактически всегда представляет собой раствор различного, зачастую очень сложного состава.
Даже из свежевыпавшей дождевой воды можно выделить различные минеральные и органические вещества, растворенные в ней (до нескольких десятков миллиграммов на литр).
Минеральный состав водыВ пресных природных водах – речных, озерных – содержание растворенных веществ обычно не превышает 1 г/л. От нескольких единиц до десятков граммов на литр колеблется содержание солей в морской воде: например, в Балтийском море их не более 5 г/л, в Черном – 18, а в Красном море – около 40 г/л. В среднем в 1 л океанской воды растворено 34...35 г солей. Общее количество их настолько велико, что, выделенные из воды, они покрыли бы поверхность земного шара слоем стометровой толщины.
Солевой состав речных и морских вод различен не только количественно, но и качественно. На 89% морские соли состоят из хлоридов (преимущественно – натрия и кальция), на 10% – из сульфатов (натрия, калия и магния), на 1% – из карбонатов (натрия и кальция), а также незначительных количеств других солей. В пресных водах набор минеральных примесей выглядит иначе. Больше всего здесь карбонатов (натрия и кальция) – до 80%. Сульфатов (натрия, кальция и магния) – около 13%. Остальные 7% приходятся на хлориды (натрия и кальция) и другие соли.
Из газов в пресных и морских водах наиболее широко представлены кислород, азот, углекислый газ, сероводород. В чистых холодных истоках горных рек содержание кислорода может достигать 6 мг/л. В глубинных слоях Черного моря высока концентрация сероводорода – до 100 мг/л. Этот ядовитый газ присутствует и в нижних слоях некоторых озер.
В пресных и морских водах в небольших количествах имеются и разнообразные органические компоненты – растворимые соединения типа белков, сахаров, спиртов, углеводородов и т.п. Это продукты жизнедеятельности и распада животных и растительных организмов, населяющих водоемы и их берега, а также отходы промышленности и сельского хозяйства.
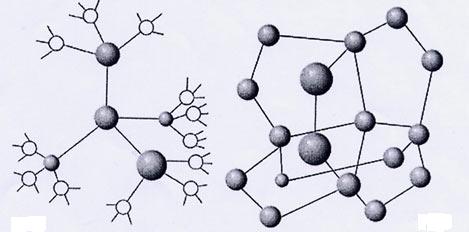
Формирование кластеров водыПолярность молекул воды, наличие в них частично нескомпенсированных электрических зарядов порождает склонность к группировке молекул в укрупненные «сообщества» – ассоциаты. Оказывается, полностью соответствует формуле Н2O лишь вода, находящаяся в парообразном состоянии. Это показали результаты определения молекулярной массы водяного пара. В температурном интервале от 0 до 100°С концентрация отдельных (мономерных молекул) жидкой воды не превышает 1%. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой (h3O)x
Непосредственной причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды. Правда, эти связи в десятки раз слабее, чем «стандартные» внутримолекулярные химические связи, и достаточно обычных движений молекул, чтобы разрушить их. Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа. Возникновение и распад ассоциатов можно выразить схемой:
x·h3O↔ (h3O)x
Поскольку электронные орбитали в каждой молекуле воды образуют тетраэдричес-кую структуру, водородные связи могут упорядочить расположение молекул воды в виде тетраэдрических координированных ассоциатов
Возможны и другие модели водной структуры. Тетраэдрически связанные молекулы воды образуют своеобразные "рои" довольно стабильного состава. Пространства между "роями" заполняют мономерные молекулы воды.
Исследователи раскрывают все более тонкие и сложные механизмы «внутренней организации» водной массы. Кроме льдоподобной структуры, жидкой воды и мономерных молекул, описан и третий элемент структуры – нететраэдрической.
Определенная часть молекул воды ассоциирована не в трехмерные каркасы, а в линейные кольцевые объединения. Кольца, группируясь, образуют еще более сложные комплексы ассоциатов.
Изучение структуры жидкой воды еще не закончено; оно дает все новые факты, углубляя и усложняя наши представления об окружающем мире. Развитие этих представлений помогает нам понять многие аномальные свойства воды и особенности взаимодействия ее, как растворителя, с другими веществами.
zhivaja-voda.webnode.cz
Дипольный момент - молекула - вода
Дипольный момент - молекула - вода
Cтраница 1
Дипольный момент молекулы воды возникает по двум причинам: во-первых, каждая из связей О - Н полярна и на том конце, где находится ядро водорода, имеется избыток положительного заряда, а на кислородном конце избыток отрицательного, а во-вторых, пары электронов, неиспользованные для связей, создают дополнительную плотность отрицательного заряда на атоме кислорода. [2]
Дипольный момент молекулы воды равен 1.86 D, а молекулы углекислого газа нулю. [3]
На рис. 7.6 6 показано распределение значений дипольного момента молекул воды в цилиндрических порах. Дипольные моменты ориентируются преимущественно параллельно оси цилиндра, так как в отличие от плоских пленок эта ось является дополнительным выделенным направлением. Этот эффект приводит к электростатическому отталкиванию между образовавшимися каплями, что усиливает тенденцию к пространственному разделению системы. [5]
Оба типа взаимодействия существенным образом зависят от дипольного момента гидратной молекулы воды, который отличается от дипольного момента свободной молекулы воды. [6]
На рис. 7.6, б показано распределение значений дипольного момента молекул воды в цилиндрических порах. Дипольные моменты ориентируются преимущественно параллельно оси цилиндра, так как в отличие от плоских пленок эта ось является дополнительным выделенным направлением. Этот эффект приводит к электростатическому отталкиванию между образовавшимися каплями, что усиливает тенденцию к пространственному разделению системы. [8]
Следовательно, уравнения (1.15) нельзя использовать для расчета дипольного момента молекул воды, спиртов, карбоновых кислот и других веществ, способных участвовать в образовании водородной связи. [9]
Так как сдвиг полосы тесно связан с увеличением дипольного момента ОН-групп молекул воды в поле катиона, то это означает, что он непосредственно связан с взаимодействием катиона и воды типа взаимодействия ион - индуцированный диполь, или, точнее, с взаимодействием катиона и индуцированным им диполем. Ион-дипольное взаимодействие не может существенно изменять положение полосы, так как оно не меняет структуры молекул воды. [10]
Пониманию природы взаимодействия между молекулами диоксана и воды способствует тот факт, что дипольный момент молекул воды, растворенных в диоксане, больше дипольного момента свободных молекул воды. Связь между молекулами воды и диоксана подтверждена и измерениями вязкости [92], на основании чего было сделано заключение, что в растворах с мольной долей диоксана 0 2 на одну молекулу диоксана приходится четыре молекулы воды. Образование подобного рода комплексов приводит к упрочнению структуры жидкости и, следовательно, к увеличению вязкости. При высоких концентрациях диоксана содержание воды уже недостаточно для образования таких ассоциатов, а потому вязкость растворов уменьшается. [11]
Согласно [31], количество сорбированного лигносульфоната из водных сред намного больше, чем из раствора диметилсульфоксида, в связи с тем, что высокое значение дипольного момента молекул воды приводит к их ориентации относительно поверхности гексагональной фазы. [12]
Этот путь учета энергии пригоден и к рассмотрению взаимодействия между любыми молекулами и ионами; при гидратации ионов молекулами воды взаимодействие будет определяться зарядом иона и дипольным моментом молекулы воды, так как выведенное уравнение применимо для любого случая взаимодействия между ионом и дипольными молекулами. [13]
Здесь U - потенциальная энергия внутренней координационной сферы иона; п - число молекул воды в координационной сфере иона; ze - заряд на ионе; i - дипольный момент молекулы воды; d - расстояние между ионом и атомом кислорода; и т - некоторые постоянные. Это уравнение не учитывает влияния поля лигандов. [14]
Во-вторых, как было впервые показано Берналом и Фаулером [16], между молекулами в кристалле льда получается приблизительно правильная величина энергии связи, если в каждой молекуле Н2О отрицательный заряд локализовать на ядре О и два компенсирующих положительных заряда - на ядрах Н; эти заряды должны иметь такую величину, чтобы получался правильный дипольный момент молекулы воды. Тогда полное электростатическое взаимодействие между зарядами на одной молекуле и зарядами на всех остальных молекулах непосредственно дает энергию двух водородных связей, относящихся к данной молекуле. Правда, необходимы [388, 226, 338] некоторые уточнения; следует учесть дополнительный дипольный момент, наведенный в каждой молекуле воды полем соседних молекул, дисперсионные силы, смещение отрицательного заряда на атоме кислорода в сторону атомов водорода. Более серьезная трудность возникает в связи с фактом, рассмотренным в разделе 8.10, именно в связи с тем, что дипольный момент молекулы воды в основном обусловлен четырьмя несвязывающими электронами. Если эти электроны занимают приблизительно тетраэдрические орбитали, то в каждой молекуле воды будут скорее два отрицательных и один положительный заряд, чем наоборот. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Ориентация - диполя - вода
Ориентация - диполя - вода
Cтраница 1
Ориентация диполей воды в результате взаимодействия с полипептидами приводит к уменьшению энтропии системы & ST. [2]
Ориентация диполей воды вокруг ионов оказывает двойное влияние. Во-первых, поскольку противоположные заряды размещаются друг возле друга, энергия системы уменьшается. Это облегчает отрыв ионов от кристалла хлористого натрия и переход их в раствор. Кроме того, ориентация молекул вокруг ионов - закрепление их около ионов - способствует упорядоченному расположению частиц в растворе. [4]
Ориентация диполей воды вокруг иона сопровождается дальнейшим изменением энергии. Экзотермический эффект является только главным эффектом; кроме него происходят и другие эффекты. Одним из эффектов является поляризация молекулы воды вокруг иона; под влиянием электрического заряда изменяется дипольный момент воды. [5]
Ориентация диполей воды вокруг иона сопровождается дальнейшим изменением энергии. Экзоэффект А является только главным эффектом; кроме его происходят и другие эффекты. Одним из эффектов является поляризация молекулы воды вокруг иона; под влиянием электрического заряда изменяется дипольный момент воды. [6]
Ориентация диполей воды вокруг иона сопровождается дальнейшим изменением энергии. Экзотермический эффект является только главным эффектом; кроме него происходят и другие эффекты. Одним из эффектов является поляризация молекулы воды вокруг иона; под влиянием электрического заряда изменяется дипольный момент воды. [7]
Известно, что ориентация диполей воды вокруг электрических зарядов не везде одинакова. Слои воды, находящиеся непосредственно у поверхности коллоидных частиц, связаны с частицами наиболее прочно и являются наиболее упорядоченными. [8]
В процессе течения нарушается ориентация диполей воды, а поэтому плотность и вязкость диффузных слоев жидкости, вовлеченной в фильтрационный процесс, могут быть приняты такими же, как для обычной воды, например при скоростях порядка 1 мм / с вязкость очень быстро достигает нормальной величины. При этом упругость пара, химический потенциал и свободная энергия могут повышаться за счет работы внешних сил, затраченной при движении слоя жидкости, сверх той, которая рассеивается в тепло. При полной дезориентации ди-польной структуры молекул воды прежние аномальные свойства ее не могут восстанавливаться ( хотя этому и соответствовало бы уменьшение химической активности) из-за потенциального барьера, появление которого обусловлено приложенным внешним давлением. Барьер может быть преодолен, если первоначальная аномальная структура не была до конца деформирована. [9]
По-видимому, оба процесса связаны с ориентацией диполей воды. [10]
Вблизи этих поверхностей плотность воды понижена ( возникает ориентация диполей воды параллельно поверхности), и давление становится меньше, чем в жидкой объемной среде. Так как расклинивающее давление П5 отрицательно, то это ведет к притяжению аналогичной поверхности гидрофобных флокул в водной среде. Контакт воды с несмачиваемой ею поверхностью термодинамически невыгоден, поэтому вода самопроизвольно под действием сил структурного притяжения выдавливается из пространства между гидрофобными пленками, и флокулы слипаются. [11]
На рис. 25 видно, что ассоциация вызывается ориентацией диполей воды друг к другу противоположными полюсами. Склонностью к ассоциации объясняются большая теплоемкость воды и относительно высокая температура ее кипения. [12]
В первичной оболочке, которая на рисунке заключена внутри пунктирной линии, ориентация диполей воды перерастает в химическую связь. Время жизни молекул воды в ней может достигать нескольких часов. [13]
Согласно Бокрису, Деванатхану и Мюллеру [37], разность потенциалов, обусловленная ориентацией диполей воды, не превышает 0 1 в, а полярная группа органического соединения не должна влиять на распределение потенциала, как находящаяся вне пределов двойного слоя. [14]
Молекулы и ионы поверхностно-активных веществ, проникая на поверхность капли, могут менять ориентацию поверхностных диполей воды, а тем самым и общий знак скачка потенциала в поверхностном слое. [15]
Страницы: 1 2 3
www.ngpedia.ru


















