Химические свойства ацетиленовых углеводородов. Диметилацетилен вода
органика для медиков

АЛКИНЫ
Номенклатура, суффиксин
HC≡CH этин, ацетилен
Ch4-C≡CHпропин, метилацетилен
Ch4-Ch3-C≡CHбутин-1,этилацетилен
Ch4-C≡C-Ch4 бутин-2,диметилацетилен
Строение алкинов
1.Атом углерода находится в sp-гибридизации.
2.Строение этина (ацетилена):
| π1 |
|
|
| H | C | C | H |
H | C | π | C | H | ||||
|
|
| 2 |
|
|
|
|
|
Длина связи С≡С 0,120 нм Энергия связи С≡С Е= 837 Кдж/моль (для сравнения см. стр. 21 и 26).
Молекула имеет цилиндрическую симметрию. Н→С≡С←Н
Электроотрицательность атомов С:
вsp3 - гибридизации 2.5
вsp2 - гибридизации 2.8
вsp - гибридизации 3.1
электроотрицательность атома Н 2.1
Связи СSP –Нполяризованы сильнее, чем СSP2 –Ни СSP3 –Н.Ацетилен и алкилацетилены проявляют свойстваСН-кислот,атомы водорода при тройной связи (терминальные) способны замещаться на атомы металлов. Значения рКА дляСН-кислотприведены в задачнике[1].
Таким образом, для алкинов характерны реакции присоединения по
тройной связи и реакции замещения терминальных атомов водорода.
42

Качественные реакции на наличие тройной связи: обесцвечивание водных растворов Вr2 и KMnO4 при 200С, при наличии терминального атома водорода – образование осадков при реакции с Cu2CI2 и Ag(Nh4)2OH.
Реакционная способность
I. Реакции присоединения
1.Электрофильное присоединение (AdE)
Алкины труднее, чем алкены вступают в реакции AdE. Главным образом, это связано с меньшей стабильностью промежуточного катиона по сравнению с катионом, образующимся из алкена.
E C  C E C
C E C C
C
A B
катион А стабильнее катионаВ
В катионе (В) вакантная орбиталь и π-связьвзаимноперпендикулярны,π-связьне участвует в делокализации положительного заряда, что придает дополнительную нестабильность этому катиону.
а) Галогенирование (присоединение 1 моля реагента).
H C C | H | Cl2 | H C | C H |
|
|
|
акт.С |
|
|
| ||||
|
|
| Cl | Cl |
|
|
|
|
|
| 1,2-дихлорэтен |
|
|
| |
Механизм AdE |
|
|
| Cl |
|
| |
H C C | H |
| H C | C H | H C | C H | |
Cl |
| ||||||
|
|
|
|
|
|
| |
Cl | Cl |
|
| Cl |
| Cl | Cl |
|
|
|
|
|
| ||
π - комплекс |
|
| σ - комплекс |
|
|
| |
б) Гидрогалогенирование
H |
| C |
| C |
| H | HCl |
| C |
| H | AdE | ||
|
|
|
| Ch3 |
|
| ||||||||
|
|
|
|
|
| |||||||||
|
|
|
|
| ||||||||||
|
|
|
|
|
|
| HgCl2 |
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| Cl |
| |||
|
|
|
|
|
|
| 1-хлорэтен,хлористый винил |
| ||||||
Присоединение 2-гомоля НСl к молекуле хлористого винила происходит в соответствии с поляризацией молекулы хлористого винила.
43

−δ | +δ | +δ | −δ | 2 | 1 | Cl |
H | Cl | |||||
Ch3 CH | Cl |
|
| Ch4 | CH | Cl |
+M | -I |
|
|
|
| |
| 1,1-дихлорэтан(геминальное | |||||
|
|
| расположение галогенов) | |||
Пояснения
1.НПЭ атома хлора находятся в сопряжении с π-связью(р,π- сопряжение), при чем галоген является донором электронной плотности, сопряженная система в хлористом виниле поляризована. Галоген проявляет+М-эффект,-I-эффектгалогена при этом подавлен (см. также тему «Основные понятия»).
2.Реакция протекает по механизму AdE . После присоединения протона образуются два возможных катиона:
A. CH | 3 | CH | Cl | CH | 3 | CH | Cl B. Ch3 Ch3 | Cl |
|
|
|
|
|
|
|
Ch4 CH
 Cl
Cl
В катионе (А) электронная плотность делокализована с участием атома углерода и хлора (описан методом резонанса), следовательно этот катион более устойчив, чем (В), что и подтверждается преимущественно образованием 1,1- дихлорэтана.
Аналогично будут реагировать в реакциях AdE с ННаl следующие молекулы:
−δ |
|
| +δ |
| +M | |
| +I | −δCh3 CH |
| OR+δ | ||
Ch3 | C | R | -I | |||
|
| -I |
|
|
| |
+M | Hal |
| R - алкил |
| ||
|
|
|
| для всех структур: +М>-I | ||
|
|
|
|
|
| |
Аналогично:
−δ |
|
|
|
|
|
|
| +δ | −δ |
|
|
|
|
|
| |||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||
|
|
| O+δ |
|
|
| H |
| Br |
|
|
|
|
|
| |||||
Ch3 |
| CH |
|
|
| Ch4 |
| CH |
| CH |
| OCH | ||||||||
|
|
|
|
|
|
| ||||||||||||||
|
|
|
|
|
|
|
|
|
|
| ||||||||||
|
|
| -I |
|
|
|
|
|
|
|
|
|
|
| 3 |
|
|
| 3 | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||
|
|
|
|
|
| +M |
|
|
|
|
|
|
|
|
|
|
| |||
|
|
|
|
|
|
|
|
|
|
|
|
| Br |
|
| |||||
метилвиниловый эфир |
|
|
|
|
| 1-метокси-1-бромэтан | ||||||||||||||
Механизм AdE
два возможных катиона после присоединения протона:
(1) Ch4 | CH | OCh4 | CH | CH | OCH | CH | 3 | CH | OCH | 3 |
|
|
| 3 |
| 3 |
|
|
|
44

(2) Ch3 Ch3 OCh4
вторичный катион (1) с делокализованной электоронной плотностью более устойчив, чем первичный катион (2).
в) Гидратация (реакция Кучерова)
условия реакции: h3O, HgSO4, конц. h3SO4
HOH |
| -δ+δ |
|
| O | этаналь, |
| Ch3=CH |
| Ch4 C |
| ||
H-C≡C-H |
|
|
| |||
H+, Hg+2 | O | H |
| H ацетальдегид | ||
|
|
|
|
| ||
|
|
|
|
|
| |
|
| промежуточный |
|
|
| |
|
| енол (неуст.) |
|
|
| |
в еноле реализуется +М - эффект ОН-группы |
|
| ||||
| +δ | -δ |
|
|
|
|
+δ-δ | H→OH |
| Ch4 |
| Ch4 | |
| Ch4 | C=Ch3 |
| |||
Ch4 C C H |
| C | ||||
|
|
| ||||
| H+, Hg+2 | O H |
| O |
| |
|
|
|
| пропанон, | ||
|
|
|
| ацетон |
| |
2. Нуклеофильное присоединение, (AdNu)
Реакции нуклеофильного присоединения первичных спиртов, карбоновых кислот, первичных аминов, тиолов и циановодорода к алкинам идут с трудом в жёстких условиях и в присутствии катализаторов. Определение нуклеофила смотри в теме «Галогенопроизводные».
а) присоединение спиртов
|
|
|
|
|
|
|
| −δ |
| +δ |
|
| ||
H |
| C |
|
| C |
| H | RO |
| H | Ch3 | CH OR | ||
|
|
|
|
| ||||||||||
|
| |||||||||||||
|
| ° | ||||||||||||
|
|
|
|
| ||||||||||
|
|
|
| |||||||||||
|
|
|
|
|
|
|
|
|
|
| ||||
|
|
|
|
|
|
| KOH, 150 C |
|
| |||||
алкоксиэтены (алкилвиниловые эфиры)
Механизм AdNu
генерация Nu:C2H5O-H+ KOH |
|
|
| C2H5 |
| O |
|
| K |
| + HOH | Nu = Ch4Ch3O |
| - этоксид анион |
|
|
|
|
|
|
| ||||||||
|
| |||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| −δ | +δ |
| H |
| ||||||||||
|
|
|
|
|
| H + C2H5 |
|
|
|
|
|
|
|
|
|
|
| C2H5O |
|
|
|
|
| H |
|
| |||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||
|
|
|
|
|
|
| O |
|
|
| HC |
| HC OC |
|
|
|
|
|
|
| |||||||||||||
H |
| C |
| C |
|
|
|
|
|
| H |
|
|
|
|
|
|
|
| H | C | C |
| OC | H | ||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 2 | 5 |
|
|
|
|
|
|
|
| 2 |
| 2 | 5 | ||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| - C2H5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| O |
|
|
|
|
|
|
| ||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||
45

б) присоединение карбоновых кислот
|
|
|
|
|
|
| Ch4 | C | O |
| |
H |
| C |
|
| C |
| H |
|
| OH | Ch4 |
|
|
|
|
|
|
| |||||
|
|
|
|
|
| ||||||
|
|
|
|
|
|
| |||||
|
|
|
|
| |||||||
ZnO, 150 C
генерация Nu:
C O |
| винилацетат (сложный эфир) |
O |
| CH=Ch3 |
|
|
| O |
|
|
|
|
|
| ZnO |
|
|
| O |
|
| Zn + h3O | ||||
Ch4 |
| C |
|
|
|
|
|
| Ch4 |
| C |
|
|
|
|
| ||||
|
|
|
|
|
|
|
|
|
|
|
| |||||||||
|
|
| 150 С |
| O | |||||||||||||||
|
|
| O |
| H |
|
|
|
|
|
|
|
|
|
| |||||
|
|
|
|
|
|
|
|
|
|
| 2 | |||||||||
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||
Nu: |
| Ch4 | C | O |
|
|
| ацетат-анион |
|
|
|
|
|
|
| |||||
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||
|
| O |
|
|
|
|
|
|
| |||||||||||
|
|
|
|
|
|
|
|
|
| |||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
в) присоединение первичных аминов
Ch4Nh3
H C  C H
C H Ch4 NH-CH=Ch3
Ch4 NH-CH=Ch3
CdO, 200
винилметиламин (вторичный амин)
генерация Nu: CH |
|
|
| CdO | CH | NH |
| Cd + h3O |
3 | NH | H |
| 2 | ||||
|
|
|
| 3 |
|
|
Nu: Ch4 NHметиламид-анион
г) присоединение тиолов
|
|
| Ch4 | SH | Ch4 S-CH=Ch3 |
| |||
H | C | C | H |
|
|
| |||
|
|
| KOH, 150 метилвинилсульфиды |
| |||||
генерация Nu: | CH |
|
| KOH | CH | S K | + h3O | ||
S | H |
| |||||||
|
|
| 3 |
|
|
| 3 |
|
|
Nu: | Ch4 | S | метилтиолат-анион |
|
|
| |||
д) присоединение цианистого водорода |
|
| |||||||
|
|
| H | C | N |
|
|
|
|
H C C H | Cu2(CN)2 |
| Ch3 CH-CN |
| |||||
|
|
|
| нитрил пропеновой кислоты | |||||
|
|
|
|
|
|
| (акрилонитрил) |
| |
Nu: | C | N | образуется за счёт обменной реакции |
| |||||
|
|
| между HCN и катализатором |
|
| ||||
46

Механизмы реакций с кислотами, аминами, тиолами и HCN аналогичны механизму, описанному для этанола.
3. Олигомеризация – это процесс присоединения небольшого количества (от2-хдо15-20)молекул непредельных соединений друг к другу. Если при этом происходит образование циклического соединения процесс называетсяциклоолигомеризацией.
а) димеризация ацетилена
2 H-C≡C-H | Cu+1 | Ch3=CH-C≡CH | бута-1-ен-3-ин, |
| винилацетилен | ||
|
|
|
б) циклотри- итетрамеризация
|
|
|
|
| H |
| ||
3 H-C≡C-H | 80°С | H |
|
|
| H |
| |
|
|
|
| |||||
|
| H |
|
|
| H |
| |
Co(CO3)3 |
|
|
| бензол | ||||
|
|
|
| |||||
|
|
|
| |||||
|
|
| H | |||||
|
|
|
|
|
| |||
Ni(CN)2
4 H-C≡C-H
p, t°
циклооктатетраен
II. Реакции с участием терминального атома водорода
1. Реакции замещения терминальных атомов водорода на металлы
Алкины, имеющие терминальный атом водорода проявляют свойства слабых СН-кислот.В ряду углеводородов такие алкины являются наиболее сильнымиСН-кислотами.
рКа | СН4 | СН2=СН2 | Н-С≡С-Н |
СН-кислот | 40-50 | 36,5 | 25 |
При взаимодействии со щелочными металлами и солями Cu+1, Ag+ алкины с терминальными атомами водорода дают солеобразные соединения, называемыми алкинилидами (IUPAC) или ацетиленидами.
| Na | H C C Na | Na | Na C C Na + h3 | |
H C C H |
| ||||
- h3 | 2000C | ||||
| этинилид натрия, | диэтинилид натрия, | |||
|
| ацетиленид натрия |
| карбид натрия |
47

Ch4 |
| C |
| C |
| Cu ↓ | CuCl | Ch4 |
|
| C |
|
| C |
| H | Ag(Nh4)2OH | Ch4 |
| C |
| C |
| Ag↓ | ||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||||||||
|
|
|
|
|
|
|
|
| -h3O |
|
|
| ||||||||||||||||||
пропинилид меди | - HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||
метилацетиленид меди |
|
|
|
|
|
|
|
|
|
| Ch4 |
| MgBr |
|
|
|
|
|
|
|
|
| ||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| метилмагнийбромид |
|
|
|
|
|
| |||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| (реактив Гриньяра) |
|
|
|
|
|
| |||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||
|
|
|
|
|
|
|
| Ch4 |
|
| C |
| C MgBr + | Ch5↑ |
|
|
|
|
|
|
| |||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||||
|
|
|
|
|
|
| пропинилмагний бромид |
|
|
|
|
|
|
|
|
| ||||||||||||||
(комплекс Иоцича)
Реакции с CuCl и Ag(Nh4)OH относятся ккачественным и позволяют различать алкены и алкины. Связь С – металл в ацетиленидах щелочных металлов ионная, в ацетиленидах Ag и Cu – ковалентная.
Ацетилениды щелочных металлов легко разлагаются водой, ацетилениды меди и серебра устойчивы по отношению к воде. Ацетилениды щелочных металлов используют в синтезе гомологов алкинов. Все ацетилениды взрывоопасны.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| HOH |
|
|
|
|
|
| H ↑ + NaOH | |
H |
|
| C |
|
|
|
| C Na | H |
| C |
| C |
| ||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||||||||
|
|
|
|
|
|
|
|
|
| +δ | - δ |
|
|
|
|
|
|
| ||||||||||
|
|
|
|
|
|
|
|
|
|
| Ch4 |
|
| I |
|
|
|
|
|
|
| |||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||
H |
| C |
|
| C |
| Ch4 |
| + NaI | |||||||||||||||||||
|
| |||||||||||||||||||||||||||
|
|
|
|
|
| |||||||||||||||||||||||
2. Реакция Фаворского
Ацетилен способен реагировать с альдегидами и кетонами с участием СН-связив присутствии щелочей, при этом образуются алкиндиолы. Реакция является первым этапом в синтезе сопряженных диенов (см. тему «Диены»).
|
| −δ |
|
|
|
|
|
|
| −δ |
|
|
| OH |
|
| OH | |||||||||
| O |
|
|
|
|
|
|
| O |
|
|
|
|
| ||||||||||||
|
| C+δ | +δ −δ −δ |
| +δ | C+δ R | ROH |
|
|
|
|
|
|
| ||||||||||||
R |
| + H |
| C |
| C |
| H + |
| R |
| C |
| C |
| C |
| C |
| R | ||||||
|
|
| ||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
| |||||||||||||||||
|
|
| ||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| R |
|
|
|
|
|
|
| R |
|
|
| R |
|
| R | |||||||||
R=Н, алкил |
|
|
|
|
|
|
|
|
|
|
|
| алкиндиол |
|
|
|
|
|
| |||||||
Механизм AdNu
генерация Nu: H C  C HKOH K
C HKOH K
 C
C CH + h3O
CH + h3O
48

| O |
|
|
| O |
|
|
|
| OH |
R C + C CH |
| R C C CH | H OH R C C CH | |||||||
| R |
|
|
| R |
|
| -OH |
| R |
|
|
|
|
|
|
|
| |||
R=Н, алкил |
|
|
|
|
|
|
|
|
| |
| OH |
|
| OH |
|
| O−δ |
| ||
R | C C CH | OH | R C C | C + | C +δ R |
| ||||
-h3O |
| |||||||||
|
|
|
|
|
|
| R |
|
| |
| R |
|
| R |
|
|
|
|
| |
| OH |
| O |
| +δ | −δ |
| OH |
| OH |
|
|
|
|
|
|
|
|
| ||
| R C C C | C | R | H | OH | R | C C C C R | |||
|
|
| ||||||||
| R |
| R |
| -OH |
|
| R |
| R |
|
|
|
|
|
|
| ||||
алкиндиол
III. Реакции окисления
а) окисление KMnO4 в нейтральных условиях при 200С
|
|
|
|
|
|
|
|
|
|
|
|
| KMnO4 | O |
| O |
H |
|
| C |
|
|
|
| C |
|
| H |
| C C | |||
|
|
|
|
|
|
|
| H O, 200C | HO | |||||||
|
|
|
| |||||||||||||
|
|
|
|
| ||||||||||||
|
|
| ||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
| OH | ||
|
|
|
|
|
|
|
|
|
|
|
|
| 2 |
| ||
|
|
|
|
|
|
|
|
|
|
|
|
| этандиовая кислота, | |||
|
|
|
|
|
|
|
|
|
|
|
|
| щавелевая (тривиальное) | |||
|
|
|
|
|
|
|
|
|
|
|
|
| KMnO4 |
|
| / |
R |
| C |
| C |
| R' | H O, 200C | R-C-C-R | ||||||||
|
|
|
| |||||||||||||
|
| |||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
| O | O | ||
|
|
|
|
|
|
|
|
|
|
|
|
| 2 |
| ||
R, R' - алкилы | α - дикетоны | |||||||||||||||
Реакция является качественной (обесцвечивание растворов KMnO4 при взаимодействии с алкинами).
б) окисление KMnO4 в присутствии k. h3SO4 при t0С
R |
| C |
| C |
| R' | KMnO4 |
|
| O | + R' |
| O |
|
|
|
| R |
| C |
| C | |||||
|
|
|
|
|
| ||||||||
|
| ||||||||||||
R, R' - алкилы | H+, t° |
|
| OH |
|
| OH | ||||||
| смеси карбоновых кислот | ||||||||||||
С помощью этой реакции можно установить положение тройной связи и строение алкина.
49

для ацетилена:
H |
| C |
|
| C |
| H | KMnO4 2 CO2 + h3O |
| ||||||||
|
|
|
| |||||
|
| |||||||
|
|
|
|
|
|
|
| H+, t° |
Методы получения алкинов
1. Синтез ацетилена
а) пиролиз метана
| 2 CH | 1000 ° | H |
| C |
|
| C |
| H + h3 | промышленный способ получения | ||||||||||||||||
| |||||||||||||||||||||||||||
|
|
|
| ||||||||||||||||||||||||
4 |
|
|
|
|
|
|
| ||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
б) гидролиз карбида кальция |
|
|
|
|
|
|
| ||||||||||||||||||||
|
| C |
| C |
| Ca |
| C |
| C |
|
|
|
|
|
| HOH | H |
| C |
| C |
| H ↑ лабораторный способ получения | |||
|
|
|
|
|
|
|
|
| -Ca(OH)2 |
|
|
| |||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||||||||
| карбид кальция |
|
|
|
|
|
|
|
|
|
| ||||||||||||||||
|
|
| или CaC2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||
2. Дегидрогалогенирование дигалогенопроизводных (лабораторный способ)
H | H | 2 KOH |
|
|
| + 2 KCl + 2 h3O | |
CH -C | C-CH | Ch4-C≡C-Ch4 | |
3 | 3 | спирт, t° |
|
Cl | Cl |
|
|
СОПРЯЖЕННЫЕ ДИЕНЫ
Углеводороды, имеющие две двойные связи относятся к диенам. По взаимному расположению двойных связей различают аллены (двойные связи находятся при одном атоме углерода, в данном пособии не рассматриваются), разделенные диены ( между двойными связями находится по меньшей мере один атом углерода, не рассматриваются) и наиболее важный класс – сопряженные диены ( определение см. в теме «Основные понятия»).
Номенклатура, суффиксдиен
Ch3=CH-CH=Ch3 | бутадиен-1,3,дивинил |
Ch3=C-CH=Ch3 | 2-метилбутадиен-1,3,изопрен |
Ch4 |
|
Ch4-CH=CH-CH=Ch3 | пентадиен-1,3,пиперилен |
| 50 |

|
|
|
|
| Строение сопряженных диенов |
|
|
| |||||||||||||
В | молекулах | сопряженных диенов | реализуется π,π |
| – | сопряжение. | |||||||||||||||
Электронная плотность | в | их молекулах | делокализована | (см. | также тему | ||||||||||||||||
«Основные понятия»). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||
Изображение молекулы бутадиена – 1,3 (вид «сверху») (р–орбитали– в | |||||||||||||||||||||
виде окружностей): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||
| H | 1 |
| 2 | H |
|
|
| H | 0,137 нм | H |
|
|
| |||||||
|
|
|
| H |
|
|
|
|
|
| |||||||||||
| H | C |
|
| C | 3 | 4 | H | C |
|
| C | 0,146 нм | H |
| ||||||
|
|
|
|
|
| ||||||||||||||||
|
|
|
|
| |||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
| C |
| C | H |
|
|
|
| C |
| C |
|
|
| |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||
|
|
|
|
| H |
|
|
|
|
|
|
|
| H |
| 0,137 нмH |
| ||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||
Хорошо видно, что перекрывание р-орбиталейимеет место не только | |||||||||||||||||||||
между | С1 – С2, С3 | – С4, но и между С2 | – С3, т.е. наблюдается делокализация | ||||||||||||||||||
электронной плотности и образование сопряжённой системы. |
|
|
| ||||||||||||||||||
Следствием делокализации электронной плотности является то, что | |||||||||||||||||||||
длины связей С1 – С2 (С3 – С4) увеличены, по сравнению с длиной двойной | |||||||||||||||||||||
связи в этилене (0,132 нм) и составляют 0,137 нм; в свою очередь, длина связи С3 – С4 меньше, чем в этане С – С (0,154 нм) и составляет 0,146 нм.
Выигрыш энергии за счёт делокализации – энергия сопряжения, в случае бутадиена – 1,3 составляет 15 кДж/моль.
Сопряженные диены имеют две конформации по взаимному расположению винильных групп относительно простой связи (s – single,простая): s-cisиs-trans.Большинство молекул диенов в обычных условиях пребывает в конформацииs-trans.
Ch3 |
|
| CH |
|
| CH | Ch3 | |||||
|
|
|
|
| ||||||||
|
|
| ||||||||||
|
|
| CH |
|
| Ch3 |
|
|
|
| CH | Ch3 |
|
|
|
|
|
|
|
| |||||
|
|
|
|
| ||||||||
|
|
|
|
|
|
| ||||||
|
|
|
|
|
|
|
|
|
|
|
| |
| s-trans |
|
| s-cis |
| |||||||
Для сопряженных диенов характерны реакции электрофильного и радикального присоединения AdE, AdR; следствием сопряжения является возможность образования двух продуктов ракции по типу1,2- и1,4-
присоединения.
I. Реакции электрофильного присоединения AdE
51
studfiles.net
Химические свойства ацетиленовых углеводородов
Алкины вступают в реакции присоединения, замещения, полимеризации, конденсации с карбонилсодержащими соединениями, окисления.
Реакции присоединения
Так как атом углерода в ацетилене поляризован и электронная плотность повышена в области связи С-С, для алкинов более характерны реакции с нуклеофильными реагентами (вода, спирт), чем с электрофильными (галогены).
1) Гидрирование в присутствии катализаторов (Pt, Pd, Ni) протекает в две стадии:
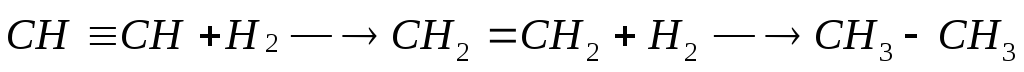
ацетилен этилен этан
2) Галогенирование

ацетилен 1,2 дибром этан 1,1,2,2 –тетрабромэтан
3) Гидрогалогенирование
Присоединение к несимметричным алкинам происходит в соответствии с правилом Марковникова, но менее активно, чем к олефинам:
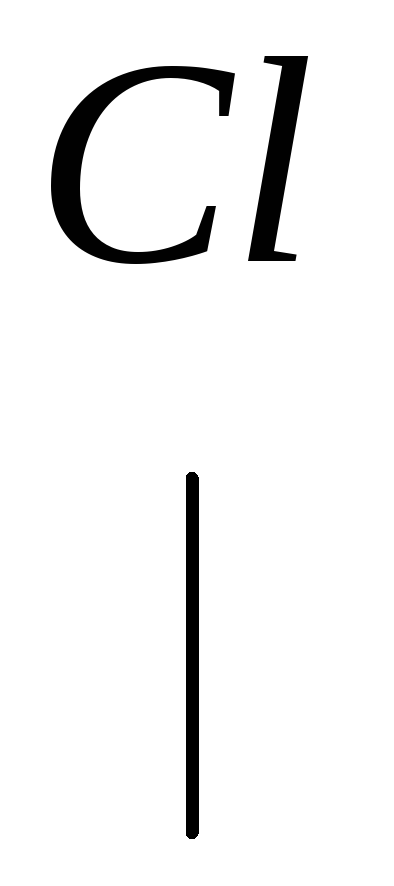
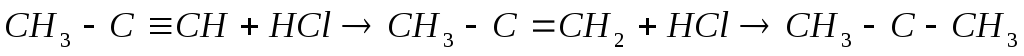
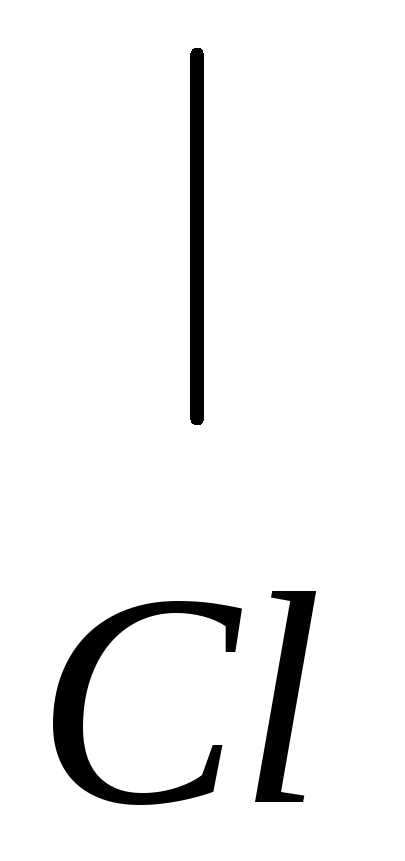
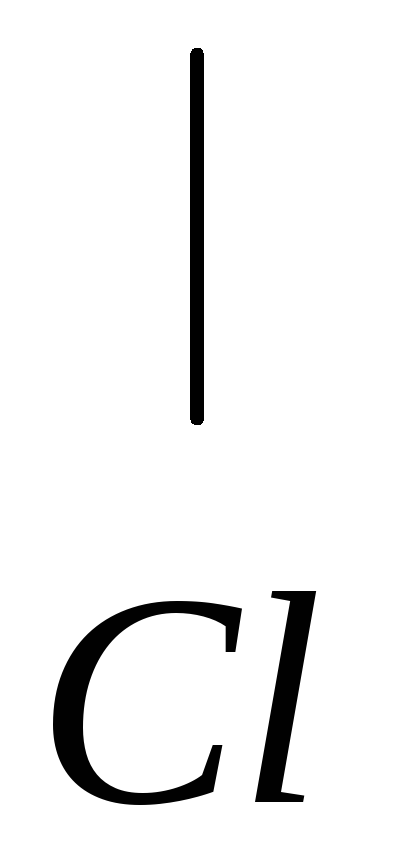
метилацетилен 2-хлорпропен 2,2-дихлорпропан
4) Присоединение воды (гидратация).
Реакция была открыта русским химиком Кучеровым в 1881 году и происходит в присутствии катализатора HgSO4 и h3SO4
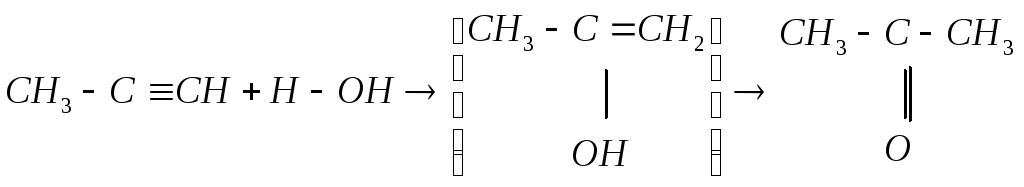
метилацетилен пропенол-2 ацетон
Образующийся пропенол-2 –это неустойчивое промежуточное соединение, так как содержит ОН-группу и двойную связь у одного и того же углеродного атома. Это соединение изомеризуется в кетон.
5) Присоединение циановодородной кислоты

ацетилен акрилонитрил
Акрилонитрил – мономер для получения синтетического волокна – полиакрилонитрила.
6) Присоединение спирта (реакция Фаворского)
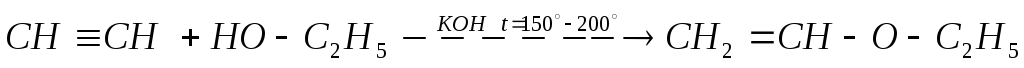
ацетилен этиловый спирт этилвиниловый эфир
Реакции замещения
Причиной поляризации связи 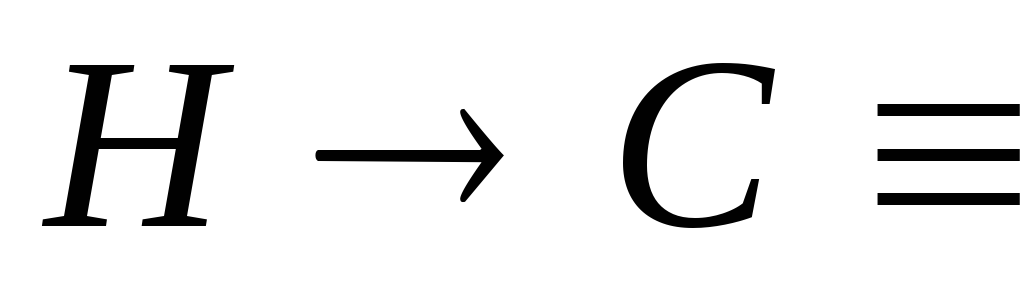 является высокая электроотрицательность атома углерода в состоянииsp- гибридизации (3,2 относительных единицы). Поэтому алкины образуют ацетилениды.
является высокая электроотрицательность атома углерода в состоянииsp- гибридизации (3,2 относительных единицы). Поэтому алкины образуют ацетилениды.
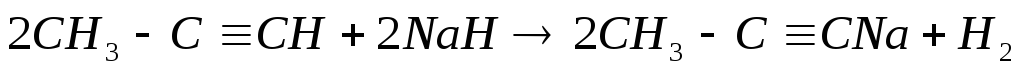
метилацетилен гидрид метилацетиленид натрия
натрия
Ацетилен более сильная кислота, чем аммиак, поэтому он вытесняет аммиак из его комплексных соединений с медью и серебром. Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор гидроксида серебра или хлорида меди (I):
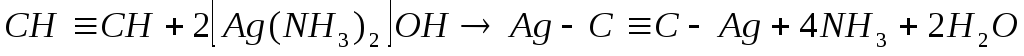 ацетилен ацетиленид серебра
ацетилен ацетиленид серебра
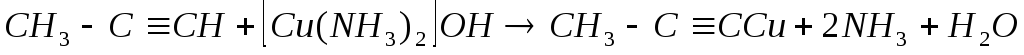 метилацетиленид меди
метилацетиленид меди
Ацетилениды серебра и меди, как соли очень слабой кислоты, легко разлагаются под действием соляной кислоты, образуя исходный алкин.

Используя реакцию образования ацетиленидов, а затем их разложения, можно выделить алкины из смеси их с другими углеводородами. Образование ацетиленидов - это качественная реакция на алкины.
studfiles.net
Непредельные углеводороды ряда ацетилена (алкины)
Алкины — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна тройная связь.
Углеводороды ряда ацетилена являются еще более непредельными соединениями, чем соответствующие им алкены (с тем же числом углеродных атомов). Это видно из сравнения числа атомов водорода в ряду:
С2Н6 C2h5 С2h3
этан этилен ацетилен
(этен) (этин)
Алкины образуют свой гомологический ряд с общей формулой, как и у диеновых углеводородов Сnh3n-2
1. Строение алкинов
Первым и основным представителем гомологического ряда алкинов является ацетилен (этин) С2Н2. Строение его молекулы выражается формулами:
Н—СºС—Н или Н:С:::С:Н
структурная электронная
формула формула
По названию первого представителя этого ряда — ацетилена — эти непредельные углеводороды называют ацетиленовыми.
В алкинах атомы углерода находятся в третьем валентном состоянии (sp-гибридизация). В этом случае между углеродными атомами возникает тройная связь, состоящая из одной s- и двух p-связей. Длина тройной связи равна 0,12 нм, а энергия ее образования составляет 830 кДж/моль. Модели пространственного строения ацетилена представлены на рис. 1.

Рис.1. Модели пространственного строения молекулы ацетилена:
а - тетраэдрическая; б - шаростержневая; в -по Бриглебу
2. Номенклатура и изомерия
Номенклатура. По систематической номенклатуре ацетиленовые углеводороды называют, заменяя в алканах суффикс -ан на суффикс -ин. В состав главной цепи обязательно включают тройную связь, которая определяет начало нумерации. Если молекула содержит одновременно и двойную, и тройную связи, то предпочтение в нумерации отдают двойной связи:
СН3
|
Н—СºС—СН2—СН3 Н3С—СºС—СН3 Н2С=С—СН2—СºСН
бутин-1 бутин-2 2-метилпентен-1-ин-4
(этилацетилен) (диметилацетилен)
По рациональной номенклатуре алкиновые соединения называют, как производные ацетилена.
Непредельные (алкиновые) радикалы имеют тривиальные или систематические названия:
Н—СºС— - этинил;
НСºС—СН2— -пропаргил
Изомерия. Изомерия алкиновых углеводородов (как и алкеновых) определяется строением цепи и положением в ней кратной (тройной) связи:
Н—СºС—СН—СН3 Н—СºС—СН2—СН2—СН3 Н3С—С=С—СН2—СН3
|
СН3
3-метилбутин-1 пентин-1 пентин-2
3. Получение алкинов
Ацетилен в промышленности и в лаборатории можно получать следующими способами:
1. Высокотемпературным разложением (крекинг) природного газа — метана:
2СН4 1500°C® НСºСН + 3Н2
или этана:
С2Н61200°C® НСºСН + 2Н2
2. Разложением водой карбида кальция СаС2, который получают спеканием негашеной извести СаО с коксом:
СаО + 3C 2500°C® CaC2 + CO
СаС2 + 2Н2O ® НСºСН + Са(ОН)2
3. В лаборатории производные ацитилена можно синтезировать из дигалогенопроизводных, содержащих два атома галогена при одном или соседних углеродных атомах, действием спиртового раствора щелочи:
Вr
|
Н3С—СН—СН—СН3 + 2КОН ® Н3С—СºС—СН3 + 2KBr + 2Н2О
|
Br
2,3-дибромбутан бутин-2
(диметилацетилен)
4. Физические и химические свойства
физические свойства. Ацетиленовые углеводороды, содержащие в молекуле от двух до четырех углеродных атомов (при обычных условиях), — газы, начиная с C5H8 — жидкости, а высшие алкины (с С16Н30 и выше) — твердые вещества. Физические свойства некоторых алкинов показаны в табл. 1.
Таблица 1. Физические свойства некоторых алкинов
| Название | Формула | t пл,°С | t кип,°С | d204 |
| Ацетилен (этан) | HCºCH | - 81,8 | -84,0 | 0,6181* |
| Метилацетилен (пропин) | НСºС—СН3 | -101,5 | -23,2 | 0,7062** |
| Этилацетилен (бутин-1) | НСºС—С2Н5 | -125,7 | +8,1 | 0,6784 |
| симм-Диметилацетилен (бутин-2) | Н3C—CºС—Ch4 | -32,3 | +27,0 | 0,6510 |
| Пропилацетилен (пентин-1) | НСºС— (СН2)2—СН3 | -90,0 | +40,2 | 0,6900 |
| Метилэтилацетилен (пентин-2) | Н3С—СºС—С2Н5 | -101,0 | +56,1 | 0,7107 |
| Бутилацетилен (гексин-1) | НСºС— (СН2)3—СН3 | -131,9 | +71,3 | 0,7155 |
*При температуре -32 °С,
**При температуре- 50 °С.
Химические свойства. Химические свойства алкинов определяются тройной связью, особенностями ее строения. Алкины способны вступать в реакции присоединения, замещения, полимеризации и окисления.
Реакции присоединения. Будучи непредельными соединениями, алкины вступают в первую очередь в реакции присоединения. Эти реакции протекают ступенчато: с присоединением одной молекулы реагента тройная связь вначале переходит в двойную, а затем, по мере дальнейшего присоединения, — в одинарную. Казалось бы, алкины, обладая двумя p-связями, гораздо активнее должны вступать в реакции электрофильного присоединения. Но это не совсем так. Углеродные атомы в молекулах алкинов расположены ближе друг к другу, чем в алкенах, и обладают большей электроотрицательностью. Это связано с тем, что электроотрицательность атома углерода зависит от его валентного состояния. Поэтому p-электроны, находясь ближе к ядрам углерода, проявляют несколько меньшую активность в реакциях электрофильного присоединения. Кроме того, сказывается, близость положительно заряженных ядер атомов, способных отталкивать приближающиеся электрофильные реагенты (катионы). В то же время алкины могут вступать в реакции нуклеофильиого присоединения (со спиртами, аммиаком и др.).
1. Гидрирование. Реакция протекает в тех же условиях, что и в случае алкенов (катализаторы Pt, Pd, Ni). При восстановлении алкинов вначале образуются алкены, а затем — алканы:
h3 h3
HCºCH —® h3C=Ch3 —® h4C—Ch4
ацетилен этилен этан
2. Галогенирование. Эта реакция протекает с меньшей скоростью, чем в ряду этиленовых углеводородов. Реакция также проходит сту пенчато:
Br2 Br2
HCºCH —® CHBr=CHBr —® CHBr2—CHBr2
1,2-дибромэтан 1,1,2,2-тетрабромэтан
3. Гидрогалогенирование. Реакции присоединения галогеноводородов, как и галогенов, идут в основном по механизму электрофильного присоединения:
HCl
HCºCH + HCl —® h3C=CHCl —® h4C—CHCl2
хлорэтен 1,1-дихлорэтан
(хлористый винил)
Вторая молекула галогеноводорода присоединяется в соответствии с правилом Марковникова.
4. Присоединение воды (реакция М.Г.Кучерова,. 1881). Катализатор — соль ртути:
HgSO4 é ù
HCºCH + HOH ——® ú h3C=CH—OHú ® h4C—C=O
ë û \ H
виниловый уксусный
спирт альдегид
(промежуточный
неустойчивый продукт)
Неустойчивое промежуточное соединение — виниловый спирт — перегруппировывается в уксусный альдегид.
5. Присоединение синильной кислоты:
НСºСН + HCN кат.® h3C=CH—CN
акрилонитрил
Акрилонитрил — ценный продукт. Он используется в качестве мономера для получения синтетического волокна — нитрон.
6. Присоединение спирта. В результате этой реакции образуются простые виниловые эфиры (реакция А. Е.Фаворского):
НСºСН + HO—C2H5KOH® h3C=CH—O—C2H5
этилвиниловый эфир
Присоединение спиртов в присутствии алкоголятов — типичная реакция нуклеофильного присоединения.
Реакции замещения. Водородные атомы в ацетилене способны замещаться на металлы (реакция металлирования). В результате образуются металлические производные ацетилена — ацетилениды. Такую способность ацетилена можно объяснить следующим образом. Углеродные атомы ацетилена, находясь в состоянии sp-гибридизации, отличаются, как известно, повышенной электроотрицательностью (по сравнению с углеродами в других гибридных состояниях). Поэтому электронная плотность связи С—H несколько смещена в сторону углерода и атом водорода приобретает некоторую подвижность:
d+ d- d- d+
H ® CºC ¬ H
Но эта "подвижность", конечно, несравнима со "свободой" протона в настоящих кислотах: соляная кислота, например, почти в 1033 раз сильнее по кислотности, чем ацетилен. Но и такая подвижность водорода достаточна, чтобы произошла его замена на металл в щелочной средe. Так, при действии на ацетилен аммиачного раствора оксида серебра образуется ацетиленид серебра:
HCºCH + 2[Ag(Nh4)2]OH ® Ag—CºC—Ag + 4Nh4 + 2h3O
ацетиленид серебра
С ацетиленидами в сухом виде следует обращаться очень осторожно: они крайне взрывоопасны.
Реакция изомеризации. Ацетиленовые углеводороды, как алканы и алкены, способны к изомеризации с перемещением тройной связи:
Н3С—СН2—СºСН Na(спирт р-р)® Н3С—СºС—СН3
бутин-1 бутин-2
Реакции полимеризации. Ацетилен в зависимости от условий реакции способен образовывать различные продукты полимеризации — линейные или циклические:
Cu2Cl2
НСºСН + НСºСН —®НСºСН—CН=Ch3
80°C
винилацетилен
(бутен-1-ин-3)
Эти вещества представляют большой интерес. Например, при присоединении к винилацетилену хлороводорода образуется хлоропрен, который в качестве мономера используется в производстве хлоропренового каучука:
Н2С=СН—CºCH + 2HCl ® Н2С=С—СН==СН2
|
С1
винилацетилен хлоропрен
Реакция окисления. Ацетилены легко окисляются. При этом происходит разрыв молекулы по месту тройной связи. Если ацетилен пропускать через окислитель (водный раствор перманганата калия), то раствор быстро обесцвечивается. Эта реакция является качественной на кратные (двойные и тройные) связи:
3НСºСН + 10KMnO4 + 2h3O ® 6CO2 + 10КОН + 10MnO2
При полном сгорании ацетилена на воздухе образуются два продукта оксид углерода (IV) и вода:
2НСºСН + 5O2 ® 4СO2 + 2Н2O
При неполном сгорании образуется углерод (сажа):
НСºСН + O2 ® С + СО + Н2О
5. Отдельные представители
Ацетилен (этин) НСºСН — бесцветный газ, без запаха (технический ацетилен имеет неприятный запах, что объясняется присутствием различных примесей). Ацетилен мало растворим в воде, хорошо — в ацетоне. На воздухе горит сильно коптящим пламенем [ высокое (в процентах) содержание углерода в молекуле]. При горении в кислороде ацетилен создает высокотемпературное пламя (до 3000 °С). Это используется для сварки и резки металлов. Смеси ацетилена с кислородом или воздухом взрывоопасны, поэтому ацетилен хранят и транспортируют в специальных баллонах (маркировка: белый баллон с красной надписью "Ацетилен"). Этот баллон заполняют пористым материалом, который пропитывают ацетоном.
Ацетилен — ценный продукт для химической промышленности. Из него получают синтетический каучук, уксусный альдегид и уксусную кислоту, этиловый спирт и многие другие вещества.
Винилацетилен (бутен-1-ин-3) НСºC—СН=CН2 — газ с неприятным запахом. При восстановлении образует бутадиен-1,3, а при присоединении хлороводорода — 2-хлорбутадиен-1,3 (хлоропрен).
Список литературы
Для подготовки данной работы были использованы материалы с сайта http://chemistry.narod.ru/
Дата добавления: 07.02.2004
www.km.ru



















