Получение и применение ацетилена. Ацетилен вода
Газ ацетилен, физические свойства ацетилена, химические свойства ацетилена.
Продажа Производство ДоставкаГазообразный
Жидкий
Ацетилен — ненасыщенный углеводород C2h3. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах.Взрывоопасный. Нельзя выпускать на открытый воздух. Частицы C2h3 есть на Уране и Нептуне.
Химические свойства
Ацетилено-кислородное пламя(температура «ядра» 3300 °C)
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекулавысокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании температура пламени достигает 3300°С. Ацетилен можетполимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метаниз эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра иодновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):

История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В промышленности ацетилен часто получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.), а также при дегидрировании двух молекул метана при температуре свыше 1400° Цельсия.
Применение
Ацетиленовая лампа
Ацетилен используют:
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидка),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
Безопасность
Поскольку ацетилен растворим в воде и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры. Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например N2, метаном или пропаном. При длительном соприкосновении ацетилена с медью или серебром образуется взрывчатая ацетиленистая медь или ацетиленистое серебро, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов). Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 "Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест". ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), т.к. концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100%. Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
tgko.ru
Ацетилен - это... Что такое Ацетилен?
Ацетиле́н (по ИЮПАК — этин) — ненасыщенный углеводород C2h3.
Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. C2h3 обнаружен на Уране и Нептуне.
Химические свойства

 Ацетилено-кислородное пламя(температура «ядра» 2621 °C)
Ацетилено-кислородное пламя(температура «ядра» 2621 °C) Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
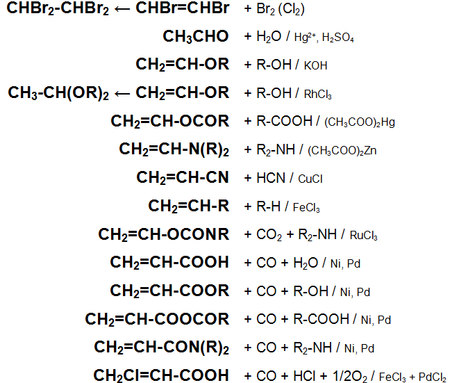
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
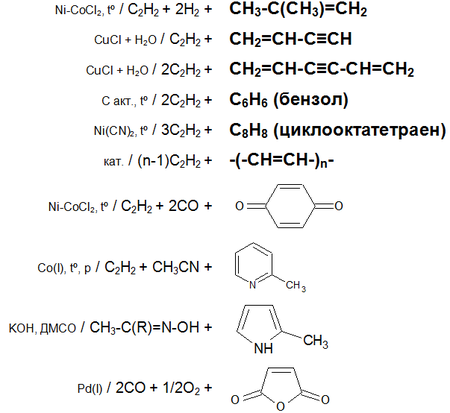
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
CaC2+ 2 Н2О = С2Н2↑ + Са(ОН)2
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
2СН4 = С2Н2↑ +3Н2↑
Применение

 Ацетиленовая лампа
Ацетиленовая лампа Ацетилен используют:
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях(вместе с аммиаком)[2]
Безопасность
Поскольку ацетилен растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном. При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
Примечания
Ссылки
dic.academic.ru
Ацетилен водой - Справочник химика 21
Одним из лучших нертутных катализаторов гидратации ацетилена в ацетальдегид оказался активированный уголь, пропитанный фосфорной кислотой [49]. Выход ацетальдегида при оптимальных условиях (350° С, ацетилен вода = 1 10) достигает 90% катализатор непрерывно работает 140 час. до потери активности. Увеличение срока службы фосфорнокислотного катализатора изучали Меликян и Бадалян они нашли количественные характеристики потери активности и предложили рациональные пути ее восстановления путем периодической подпитки носителя фосфорной кислотой [50]. [c.270] Для предупреждения накопления в системе нестабильных кислородных соединений и продуктов их разложения необходимо строго соблюдать установленный температурный режим и поддерживать в процессе димеризации избыточное давление газа, чтобы исключить подсос воздуха в систему, а также тщательно очищать от примесей кислорода ацетилен, воду и азот. [c.64]Ацетилен, Вода 1.78 . I 24 Двуокись Вода 1,96 1 1 3 5 [c.409]
Напишите равенства реакций присоединения к ацетилену водо- [c.45]Растворение в воде проводится после удаления более высоко-кипящих компонентов (диацетилена, винил- и метилацетиленов) посредством абсорбции их маслом или конденсации при низких температурах. Оставшийся газ сжимают до 16—18 ат, и из него извлекают ацетилен водой в абсорбционных тарельчатых колоннах (60—70 тарелок). [c.117]
ОТ сажи и гомологов ацетилена сжимается до давления 10—20 ат и снизу вверх проходит абсорбционную насадочную колонну 5. Содержание ацетилена в выходящем из колонны газе не превышает 0,2%. Насыщенная ацетиленом вода последовательно проходит три десорбера 6, 7 и 8, в которых поддерживается давление 1 0,2 и 0,1 ата. [c.123]
Окисление ацетилена в паровой фазе присоединение к ацетилену воды с образованием ацетальдегида, превращение его в уксусную кислоту и расщепление последней на ацетон, воду и углекислый газ Окись железа гидратированные железные руды 2805 [c.196]
На такой реакции основан, например, анализ водных растворов спиртов при использовании катарометра в качестве детектора и реактора с карбидом кальция для превращения в ацетилен воды, широкий пик которой маскирует на обычной хроматограмме анализируемые спирты [1]. [c.143]
Продуктом реакции присоединения к ацетилену воды является уксусный альдегид. Впервые этот синтез был осуществлен М. Г. Куче-ровым в 1881 г. Реакция протекает по уравнению [c.18]
Перед определением выхода ацетилена необходимо подготовить аппарат к работе и насытить ацетиленом воду в реакторе 3. Для этого [c.218]
Подготовка аппарата к определению. Перед измерениями литража необходимо подготовить аппарат к работе и насытить ацетиленом воду в реакторе 3 (см. рис. 3). [c.37]
Приготовление стандартных растворов. Стандартные растворы, т. е. растворы с известным содержанием ацетилена, готовят разбавлением насыщенной при определенной температуре ацетиленом воды и добавлением к ним реактива для поглощения ацетилена. [c.211]
Переработка газа крекинга заключается, прежде всего, в отделении сажи при помощи циклонов и фильтров, охлаждении газа до обычной температуры и очистке его от HaS и H N (том I. стр. 279). Затем газ компримируют до давления 18—20 ат и абсорбируют ацетилен водой. Отмытый от ацетилена газ направляют на разделительную установку глубокого охлаждения для выделения метана и этана (возвращаемых в электродуговую печь), этилена и водорода. Из воды, насыщенной ацетиленом под давлением, выделяют ацетилен, далее подвергаемый дополнительной очистке на специальной холодильной установке (до —55°). Отделяемые здесь высшие ацетиленовые углеводороды (в виде конденсата) присоединяются затем к газу, поступающему в электродуговую печь. [c.437]
Кат-ры d- и Са-соли, свободные к-ты и их ангидриды. Для сравнения испытаны dO и СаО. Ацетилен вода= 1 10, 390— 400°, V 150 час-, продолжительность опыта 3—5 час. [c.102]
Рассматривая свойства ацетилена, мы имели случай наблюдать присоединение к ацетилену воды под каталитическим влиянием ртутных солей, причем после внутримолекулярной перегруппировки получался альдегид [c.123]
Подобный случай уже встречался. При присоединении к ацетилену воды образуется виниловый спирт, который вследствие своей неустойчивости тотчас же перегруппировывается в альдегид. Попытка приготовить виниловый спирт действием влажной окиси серебра на бромистый винил приводит к тому же результату [c.134]
Предложены схемы, объясняющие процессы присоединения к ацетилену воды и спиртов в газовой фазе под влиянием твердых ионных катализаторов. [c.239]
Очень большое значение имеет реакция пЛхучения ацетальдегида гидратацией ацетилена, предложенная М. Г. Кучеровым еще в 1881 г. В промышленности этой реакцией широко пользуются до настоящего времени при производстве уксусной кислоты и синтетического этилового спирта. Для присоединения к ацетилену воды его вначале пропускают через раствор окиси ртути в 50%-ной серной кислоте, а затем образующийся бесцветный осадок ртутного соединения разлагают водяным паром. Реакция протекает по уравнению [c.23]
Масс-спектрометрическим и газохроматографическим методами в продуктах окисления идентифицировали окись и двуокись углерода, ацетилен, воду, дифенил, водород, фенол. Продукты, окрашивающие бензол при окислении, содержат, по данным ИК-спектроскопии, карбонильные группы ангидридного и альдегидного, но не хиноидного типов, а также фенольные гидроксильные группы. ИК-спектр окрашенного продукта полностью отличен от ИК-спектра бензола в области 700—800 см , положение полос в которой указывает на характер замещения. Совершенно определенно можно говорить о моно- и дизамещенных структурах. Обнаружение замещения эквивалентно установлению факта сшивания ароматических ядер. [c.220]
При работе с винилалкиловыми эфирами, получающимися в заводских масштабах из технического сырья (ацетилен и спирты), вероятными загрязнениями виниловых эфиров являются ацетилен, вода, спирты, альдегиды и кетоны. В ходе же процессов полимеризации в присутствии, например, спиртов, благодаря их взаимодействию с виниловыми эфирами, возникают новые примеси, в данном случае — ацетали. Дальнейшее усложнение состава реагирующих смесей происходит в случае наличия воды, а следовательно, и альдегидов вследствие легкости гидролиза исходных винилалкиловых эфиров. [c.236]
После того, как газ пройдет через электрическую дугу, его охлаждают до 150 впрыскиванием воды. Сажу, образовавшуюся в результате полного отщепления водорода от углеводородов, удаляют в циклопе, а оставшуюся часть улавливают суконным фильтром. Образующиеся при пиролизе смолистые полимеры отмывают маслом, синильную кислоту удаляют водой, сероводород — окисью железа. Очищенньи таким образом газ сжимают при охла/] дении, причем давление в четыре приема доводят до 18 ат. После этого газ под давлением промывают маслом, чтобы освободиться от диацетилена и других побочных продуктов, а затем улавливают ацетилен водой, по отношению к которой он ведет себя подобно угольной кислоте. В отличие от других газов — таких, как водород, этилен, этан, очень мало растворимых в воде, — ацетилен почти полностью поглощается водой. [c.127]
В качестве катализатора они применяли активированный уголь, пропитанный фосфорной кислотой и активированный добавками фосфата меди или цинка. При 350° и соотношении ацетилен вода от 1 10 до 1 20 образовывалось 90% ацетальдегида при производительности катализатора 1—1,5 г-мол СНОСНО на 1 л катализатора в час при непрерывной работе 100—150 час. Недостатком активированного угля является относительно быстрая дезактивация из-за выделения фосфорной кислоты с катализатора. Аналогичные катализаторы разработаны А. А. Сорокоумовым и Б. Н. Долговым, а также Ю. А. Гориным с сотрудниками. [c.519]
Полиэти- лентереф- халат Ацетальдегид, окись и двуокись углерода, ацетилен, вода, 2-метил-диоксолан, метан, бензол, терефталевая кислота, олигомеры Ацеталь- дегид 0 17,0 [c.240]
Синтетический спирт можно получать также из ацетилена (путем присоединения к ацетилену воды получают ацетальдегид, который затем восстанавливают в спирт) или из этилена путем его гидратации. Спирт, получаемый из ацетилена, сравнительно дорог этим способом его вырабатывали только в периоды острого дифицита спирта. [c.386]
Ход определения. В широкогорлую склянку емкостью 150 мл помещают 1 г преципитата туда же опускают 10 стеклянных бусинок диаметром 4—5 мм и резиновый тигель (высверленную резиновую пробку), наполненный на измельченным в тонкий порошок карбидом кальция. Склянку закрывают резиновой пробкой с отводной трубкой, имеющей резиновук> гибкую часть. Конец отводной трубки подводят под эвдиомет-рическую трубку емкостью 100 мл. Последняя должна быть наполнена водой, насыщенной ацетиленом, и опущена в сосуд с водой, тоже насыщенной ацетиленом. Воду насыщают до ощутимого запаха ацетилена. [c.309]
Хорошо известно, что присоединение к ацетиленам воды, слабых кислот и галогеноводородов катализируется ионами металлов, особенно ионами двухвалентной ртути. В промышленном отношении очень важны, например, гидратация ацетилена в ацетальдегид. Хеннион, [c.254]
chem21.info
Ацетилен: применение в медицине, промышленности
Ацетилен относится к углеводородам ненасыщенного ряда. Это соединение, а также его различные гомологи служат сырьем для синтеза большого количества химических продуктов.
Свойства и получение ацетилена
В условиях атмосферного давления и нормальной температуры ацетилен представляет собой бесцветный газ. Если температура опускается до значения -85 градусов и ниже, то это соединение переходит в другое состояние – твердое. При этом образуются кристаллы. Следует отметить, что в жидком и твердом состоянии ацетилен может легко взрываться под воздействием трения или при ударе (гидравлическом или механическом). Именно это свойство во многом обусловливает его область применения. Реакции горения ацетилена происходят в присутствии кислорода. В результате данного процесса возникает пламя, характеризующееся самыми высокими показателями температуры (3150 градусов) по сравнению с другими видами горючего.
Основным способом получения ацетилена является реакция, в которой взаимодействуют карбид кальция и вода. Данный процесс протекает при показателях температуры около 2000 градусов и является эндотермическим.
Существует такое понятие, как выход ацетилена. Это такое его количество, которое выделяется в результате разложения 1 кг карбида кальция. ГОСТ 1460-56 устанавливает конкретные значения данной величины, которая находится в прямой зависимости от степени грануляции исходного вещества. Таким образом, следствием относительно небольшого размера частиц карбида кальция является снижение выхода ацетилена.

Данная закономерность является следствием наличия в мелких частицах карбида посторонних примесей, например оксида кальция.
Существуют и другие, менее громоздкие, дорогие и энергозатратные способы получения ацетилена. Например, реакция термоокислительного пиролиза метана из природного газа; разложение нефти, керосина и других видов горючего путем электропиролиза.
Хранение и транспортировка
Все способы хранения и транспортировки предусматривают использование баллонов. Они заполняются специальной массой пористой консистенции. Ее пропитывают ацетоном, который хорошо растворяет ацетилен. Применение данного способа позволяет значительно увеличить наполняемость баллона ацетилена и, что немаловажно, понижает его взрывоопасность.
Длительное соприкосновение ацетилена с такими металлами, как медь и серебро, может привести к повышению его взрывоопасности. Следовательно, недопустимо использование материалов, которые могут содержать эти металлы, например в вентилях.

Как правило, баллоны должны иметь специальные вентили, предназначенные именно для хранения ацетилена.
Полного использования всей емкости баллона можно достигнуть, храня пустые емкости так, чтобы ацетон был распределен по всему объему баллона. А это возможно только в горизонтальном положении. Наполнение баллона должно происходить очень медленно, что важно для соблюдения условий химической реакции растворения ацетилена в ацетоне, а в частности ее скорости.
Преимущества растворенного ацетилена
Основное преимущество растворенного ацетилена перед тем, который получают с использованием переносных генераторов из карбида кальция, состоит в том, что при применении баллонов происходит повышение труда сварщика примерно на 20 %, а потери ацетилена при этом снижаются на 25 %. Также следует отметить повышение оперативности и маневренности сварочного поста, безопасность. В отличие от газа, полученного из карбида кальция, растворенный ацетилен содержит значительно меньше посторонних веществ, то есть примесей, что позволяет использовать его в особо ответственных сварочных работах.
Основные области применения ацетилена
- Сварка и резка металлов.
- Использование в качестве источника яркого, белого света. В данном случае речь идет об ацетилене, получаемом путем взаимодействия карбида кальция и воды. При этом используются автономные светильники.
- Производство взрывчатых веществ.
- Получение других соединений и материалов, которыми являются уксусная кислота, этиловый спирт, растворители, пластические массы, каучук, ароматические углеводороды.
Ацетилен: применение в строительстве и промышленности
Автогенные и сварочные работы сопровождают практически все этапы строительства. Именно в этих видах работ применяется ацетилен. В специальном устройстве под названием горелка происходит смешивание газов и непосредственно сама реакция горения. Наивысшая температура данной реакции достигается при содержании ацетилена 45 % от всего объема баллона.

Баллоны с этим газом маркируют следующим образом: окрашивают в белый цвет и большими красными буквами наносят надпись: «Ацетилен»
Строительные работы проводятся в основном на открытом воздухе. Применение ацетилена и его гомологов в этих условиях не должно проходить под воздействием прямых солнечных лучей. Небольшие перерывы должны сопровождаться перекрыванием вентилей на горелке, а длительные – перекрыванием вентилей на самих баллонах.
В химической промышленности очень востребован ацетилен. Применение его заключается в использовании данного вещества в процессе получения продуктов органического синтеза. Это синтетический каучук, пластмассы, растворители, уксусная кислота и т.д.
Ацетилен, являясь универсальным горючим, часто используется в процессах, сопровождающихся газопламенной обработкой. Важно, что применение ацетилена в промышленности возможно только при соблюдении мер безопасности, так как он является взрывоопасным газом.
Карбидные лампы
Название «карбидная лампа» обусловлено использованием в качестве источника света открытого пламени струи сжигаемого ацетилена. Он, соответственно, получен в результате взаимодействия карбида кальция с водой.
Такие лампы были широко распространены в прошлом. Их можно было увидеть на каретах, автомобилях и даже велосипедах. В современное время карбидные лампы используют только в случае острой необходимости в мощном автономном светильнике. Так, спелеологи часто пользуются ими. Отдаленные маяки снабжают именно такими лампами, ведь такой тип освещения намного выгоднее, нежели подведение линий электропередач. Достаточно распространенным является использование таких ламп на судах дальнего плавания.
Ацетилен: применение в медицине
Как используется вещество в этой сфере? Общая анестезия предполагает применение алкинов. Ацетилен является одним из тех газов, которые используются при ингаляционном наркозе. Но повсеместное его применение в этом качестве осталось в прошлом. Сейчас появились более современные и безопасные способы анестезии.
Хотя следует отметить, что и применение ацетилена не представляло большой опасности, так как прежде чем значение его концентрации во вдыхаемом воздухе дойдет до опасного предела, нижний порог горючести будет пройден.
Самым главным условием использования данного газа является соблюдение мер безопасности. Сложно переоценить, насколько опасен ацетилен. Применение его возможно только после проведения всех необходимых инструктажей с работниками различных сфер, в которых он используется.
fb.ru
Ацетилен растворимость в воде - Справочник химика 21
ОПЫТЫ с АЦЕТИЛЕНОМ Растворимость ацетилена в воде и в ацетоне [c.78]Ацетилен хорошо растворяется во многих органических жидкостях и воде. Например, при атмосферном давлении и температуре 20 °С в одном объеме воды растворяется один объем ацетилена, а в одном объеме ацетона при этих же условиях растворяется 20 объемов ацетилена. С повышением давления растворимость газа возрастает. Поэтому для предупреждения загазованности воздуха ацетиленом, выделяющимся из воды, находящейся в контакте с ацетиленом, ацетиленсодержащие воды перед сбросом их в канализацию дегазируют. [c.24]
Что касается газов, содержащихся в обычных условиях в воздухе, то углекислый газ растворяется в воде приблизительно в 60 раз больше, чем азот, и приблизительно в 30 раз больше, чем кислород. Примерно такой же растворимостью в воде, как и углекислый газ, обладает ацетилен растворимость сероводорода в воде в 3 раза больше, чем растворимость углекислого газа (табл. 22). [c.53]Чаще всего реакции проводят при обычных атмосферных условиях, и иногда важно знать, как растворяются газы, обычно содержащиеся в воздухе, в выбранном растворителе (табл. 23). Нз данных, приведенных в таблице, видно, что двуокись углерода (углекислый газ) растворяется в воде приблизительно в 60 раз больше, чем азот, и приблизительно в 30 раз больше, чем кислород. Примерно такой же растворимостью в воде, как и углекислый газ, обладает ацетилен растворимость сероводорода в воде в 3 раза больше, чем растворимость двуокиси углерода. [c.49]
Ацетилен значительно лучше, чем другие газообразные углеводороды, растворим в воде. При температуре 15°С и давлении 10 Па в одном объеме воды растворяется 1,15 объемов. В других растворителях растворимость ацетилена составляет в ацетоне 25, этаноле 6, бензоле 4, уксусной кислоте 6 объемов. Растворимость в ацетоне возрастает с повышением давления и при 1,25 МПа составляет уже 300 объемов в одном объеме. Растворимость ацетилена в различных растворителях имеет большое значение для его выделения из смесей с другими газами, а также при хранении в баллонах в виде раствора в ацетоне. [c.244]
До поступления в основной ацетиленовый абсорбер газ пиролиза промывается небольшим количеством диметилформамида для удаления высших ацетиленовых углеводородов. Со дна диаце-тиленового абсорбера растворитель подается в отпарную колонну, где потоком абгаза от него отделяются диацетиленовые углеводороды, которые направляются в печь в качестве топлива. Основной газовый поток поступает в ацетиленовый абсорбер, где промывается диметилформамидом для растворения ацетилена. Часть нерастворенного абгаза подается в отпарную колонну диацетилена, а основная его масса промывается водой для извлечения растворителя и поступает в газгольдер для использования в качестве печного топлива и для других целей. Насыщенный ацетиленом растворитель из ацетиленового абсорбера попадает в стабилизатор, где от него отделяются наименее растворимые компоненты (этилен, двуокись углерода и т. д.), а затем в отпарную колонну, в которой ацетилен отделяется от растворителя. [c.179]
Ацетилен, находящийся под давлением, особенно сжиженный, иногда взрывает под влиянием ничтожных причин. Но он безопасен, если находится под давлением в несколько атмосфер в смеси с другими газами или в растворе ацетона. Одна часть ацетона растворяет при 15° и Давлении 1 ат 25 об. ч., а при давлении 12 ат — 300 об. ч. ацетилена. Растворимость ацетилена в воде также весьма значительна (1 1 при комнатной температуре), еще больше растворимость в спирте (ср. табл. 81). [c.475]
Уксусный альдегид, или ацетальдегид, СНз-СН = 0. Легко кипящая бесцветная жидкость (темп. кип. 21 °С), с характерным запахом прелых яблок, хорошо растворима в воде. В промышленности получается присоединением воды к ацетилену в присутствии солей ртути (П) в качестве катализатора [c.575]
При применении этих способов необходимо учитывать, что ацетилен и водород растворимы в нефтепродукте, а карбоновые кислоты нефти и прочие кислые соединения могут реагировать с гидридом и карбидом кальция, металлическим натрием и калием и другими Ьеществами, как вода, давая неточные определения ее количественного содержания. [c.18]
В современном немецком процессе [9] используют двухкомпонентный абсорбент, состоящий из воды и смешивающегося с ней органического растворителя, который кипит выше 100°. При заключительной дегазации этого смешанного абсорбента часть воды испаряется и увлекает с собой примеси, более растворимые, чем ацетилен. [c.283]
Получаемый нз технического СаСг ацетилен имеет неприятный запах вследствие наличия в нем ряда примесей (Nh4, РНз, НгЗ и др.)- В чистом виде он представляет собой бесцветный газ со слабым характерным запахом, довольно хорошо растворимый в воде. [c.299]
Взрывоопасная смесь может образовываться при заполнении воздухом газометров, ранее использовавшихся для углеводородных газов, вследствие выделения ранее растворенного газа из затворной жидкости. В этом отношении наибольшую опасность представляет ацетилен, довольно хорошо растворимый в воде и дающий взрывоопасные концентрации в широких пределах. [c.8]
В качестве затворной жидкости чаще всего применяют воду и насыщенные водные растворы хлористого натрия, хлористого магния или хлористого кальция (рассолы). Применение воды менее желательно, вследствие заметной растворимости в ней некоторых углеводородных газов. Наибольшей растворимостью обладает ацетилен (при 20° С в 1 объеме воды растворяется 1,1 объема газа). Поэтому при работе с ацетиленом следует применять рассолы (лучше всего насыщенный раствор хлористого кальция), в которых растворимость газов значительно меньше. Предварительное насыщение затворной жидкости рабочим газом также исключает его растворение. Однако, при заполнении газометра газом другого состава может происходить перераспределение отдельных компонентов газовой смеси между газом и затворной жидкостью, в результате чего состав газа изменится. Поэтому для точных работ, при переходе к работе с газом другого состава, затворную жидкость в газометре следует сменить или прокипятить. [c.132]
Ацетилен получают действием воды на карбид кальция (100 -120 г). Выделяющийся газ собирают в газометр над насыщенным раствором поваренной соли или хлористого кальция для уменьшения растворимости газа в воде). [c.175]
Ацетилен газ с запахом простого эфира, незначительно растворимый в воде (лучше в ацетоне). Взрывоопасен в смеси с воздухом, особенно при концентрации ацетилена от 3 до 70 объемн.%, [c.210]
В других растворителях, например жидком аммиаке, органических жидкостях, газы растворимы гораздо больше, чем в воде. Использовать другие жидкости, как использовали воду, уже нельзя. Летучесть жидкости в фазе-датчике значительно изменяется при растворении в ней газа из критической фазы. Поэтому во второй серии опытов фазами-датчиками были аммиакаты различных солей 118—21]. Вследствие обратимой реакции диссоциации над аммиакатом устанавливается равновесное давление аммиака. Над многими аммиакатами оно измерено [20]. Газами — растворителями в серии опытов с аммиакатами служили ацетилен, этан, шестифтористая сера. [c.82]
Ацетилен представляет собой бесцветный газ со слабым запахом, довольно плохо растворимый в воде (при 20° 1,03 л [c.27]
Уксусный альдегид называют иначе ац е т а л ь д е г и д. Он представляет собой жидкость с температурой кипения +21°, хорошо растворимую в поде. Применяется главным образом для получения уксусной кислоты. Ранее уксусный альдегид нолучали окислехшем-этилового спирта. В настоя- щее время он получается по реакции, предложенной русским ученым М. Г. Кучеровым еще в 1888 г. Эта реакция состоит в том, что в присутствии катализатора окиси ртути к ацетилену присоединяется вода с образованием уксусного альдегида [c.321]
Выходящая пз реактора газовая смесь (акрилонитрнл кипит при 78°) поступает в абсорбер, где обрабатывается водой, в которой акрилонитрнл растворяется. Растворимость акрилонитрила равна 6 г в 100 мл воды. Ацетилен и моновинилацетилен разделяются затем в специальной промывочной колопне. Ацетилен возвращается в процесс. [c.247]
Другим технически важным свойством ацетилена является его раст1юримость, значительно более высокая, чем у других углеводородных газов. Так, в 1 объеме воды при 20 °С растворяется около 1 объема ацетилена, а при 60 °С растворяется 0,37 объема. Растворимость снижается в водпелх растворах солей и Са(0Н)2. Значительно выше растворимость ацетилена в органических жидкостях при 20 °С и атмосферном давлении она составляет (в объемах щетилеиа на 1 объем растворителя) в метаноле 11,2, в ацетоне 23, в диметилформамиде 32, в N-метилпирролидоне 37. Растворимость ацетилена имеет важное значение при его получении и выделении з смесей с другими газами, а также в ацетиленовых балл )нах, где для повышения их емкости по ацетилену и снижения авления используют растворитель (ацетон). [c.77]
Раствор в кубе абсорбера И содержит ацетилен и его гомологи, а акже значительное количество близкого к ним по растворимости диоксида углерода с примесью других газов. Он проходит дроссе.тьный вентиль 13 и поступает в десорбер 14 первой ступени. За счет снижения давления до 0,15 МПа и нагревания куба до 40 "С из раствора десорбируются ацетилен и менее растворимые газы. Ацетилен при своем движении вверх вытесняет из раствора диоксид углерода, который вместе с другими газами it частью ацетилена выходит с верха десорбера, предварительно отмываясь от растворителя водным конденсатом. Эти газы возвращают на компримирование. Концентрированный ацетилен выводят 13 средней части десорбера 14 промывают в скруббере 15 водой I через огнепреградитель 16 выводят с установки. [c.85]
Растворитель играет существенную роль при суспензионной полимеризации, так как растворимость пропилена и атактического полимера в разных растворителях не одинакова. Однако столь же важна и концентрация примесей в растворителе и пропилене. Известно, что ядами катализатора Циглера — Натта являются вода, кислород, монооксид и диоксид углерода, ал-лен, ацетилен, оксисульфпд углерода и серусодержащие органические соединения. Для достижения максимальной эффективности катализатора важно поддерживать концентрацию этих ядов на как можно более низком уровне — обычно менее нескольких частей на миллион. Между тем не всегда можно предсказать действие каждого яда. Например, в табл. 5 показано влияние содержания воды в гептане на промышленный катализатор Т1С1з. Хотя активность снижается с ростом концентра- [c.200]
После того, как газ пройдет через электрическую дугу, его охлаждают до 150 впрыскиванием воды. Сажу, образовавшуюся в результате полного отщепления водорода от углеводородов, удаляют в циклопе, а оставшуюся часть улавливают суконным фильтром. Образующиеся при пиролизе смолистые полимеры отмывают маслом, синильную кислоту удаляют водой, сероводород — окисью железа. Очищенньи таким образом газ сжимают при охла/] дении, причем давление в четыре приема доводят до 18 ат. После этого газ под давлением промывают маслом, чтобы освободиться от диацетилена и других побочных продуктов, а затем улавливают ацетилен водой, по отношению к которой он ведет себя подобно угольной кислоте. В отличие от других газов — таких, как водород, этилен, этан, очень мало растворимых в воде, — ацетилен почти полностью поглощается водой. [c.127]
Я) Образование ацетилена из элементов идет лишь выше 2000 °С и сопровождается поглощением тепла (54 ккал/моль). Будучи сильно эндотермичным соединением, ацетилен способен разлагаться со взрывом. В газообразном состоянии такой распад при обычных условиях не происходит, но под повышенным давлением, и особенно в жидком или твердом состоянии, может произойти от самых ничтожных воздействий (сотрясения и т. п.). Растворимость ацетилена в воде (1 1 по объему при обычных условиях) значительно меньше, чем в различных органических растворителях. Охлаждением насыщенного водного раствора может быть получен кристаллогидрат С2Н2 6Н2О. [c.534]
Для получения 2-метил-5-этилпиридина (XXXI) (т. кип. 178,3 С при 160 мм, 66 " С при 17 мм растворимость в воде 1,22%) по методу Чичи-бабина аммиак конденсируют с ацетиленом [116] в присутствии катализаторов— солей кобальта [117], кадмия, ртути и меди [118] или конденсируют с ацетальдегидом [119] в паровой фазе (в присутствии окиси алюминия). [c.302]
Процесс фирмы Майн сейфти аплайенс . Этот процесс применяется главным образом для полного удаления небольших количеств ацетилена (0,1 —1,0-10 %) и других углеводородов из воздуха, поступающего на установки низкотемпературной ректификации воздуха. Полное удаление ацетилена из таких потоков имеет исключительно важное значение из-за низкой растворимости ацетилена в жидком кислороде. Вследствие накопления твердого ацетилена на поверхностях теплообмена в отдельных точках схемы могут достигаться концентрации, превышающие нижний предел взрываемости смеси действительно, именно этим явлением и были вызваны многочисленные взрывы на установках ректификации воздуха. В присутствии гопкалита (смесь 60% двуокиси марганца и 40% окиси меди) углеводороды при сравнительно низкой температуре полностью окисляются до двуокиси углерода и воды. На этом катализаторе протекает также окисление окисп углерода в двуокись и разложение озона. Для очистки влажных воздушных потоков особенно активны промотироваиные гопкалиты, содержащие сравнительно небольшое количество серебряных солей [58]. Промышленный гопкалит позволяет практически полностью окислить ацетилен при температуре всего 152—158 С. Однако для окисления других углеводородов требуются более высокие температуры, иногда достигающие 425° С. Степень нревращения некоторых углеводородов в присутствии промышленного гоп-калитового катализатора прп разных температурах показана на рис. 13.16 [59]. [c.346]
Дцетилен—безцветное, газообразное вещество, имеющее неприятный запах светильного газа, когда он выделен из технического карбида по Муассону, чистый карбид имеет приятный запах. Плотность его по сравнению с воздухом—0,92. Химически чистый ацетилен содержит 92,3"/о углерода и 7.7°/о водорода. Он растворим в воде, в спирте, бензоле и других органических жидкостях. Особенно хорошо он растворяется в ацетоне при 15 С и под атмосферным давлением 1 об ем ацетона растворяет 25 об емов ацетилена, при- 80"С—около 2000 об емов. Растворимость ацетилена в ацетоне увеличивается с увеличением давления так, под давлением 12 атмосфер, один литр ацетона растворяет 300 литров его при обыкновенной комнатной температуре. [c.87]
Кроме того, значения коэффициентов распределения и факторов разделения могут зависеть от распределения незаряженного комплекса или ионного ассоциата между двумя фазами. Так как незаряженный комплекс в большинстве случаев имеет гидрофоб- ную поверхность, то закономерности распределения такого комплекса должны в основном совпадать с закономерностями для органических соединений. Распределение органических соединений между водой и растворителем тесно связано с растворимостью этих соединений в воде, так как растворение в этом случае можно рассматривать как распределение вещества между водой и собственной органической жидкой фазой. Хорошо известно, что растворимость в воде углеводородов, являющихся членами одного гомологического ряда, снижается по мере увеличения числа углеродных атомов. Показано [4], что для каждой группы углеводородов (парафинов, циклопарафинов, олефинов, ацетиленов, ароматических углеводородов) имеется линейная зависимость между стандартной свободной энергией растворения и молярным объемом растворенного соединения. Более того, имеющиеся данные [5] позволяют предположить, что основной вклад в изменение положительной стандартной энергии растворения в воде вносит отрицательное изменение энтропии. Низкая растворимость углеводородов в воде и энтропийный характер этого процесса являются результатом структуроформирующего поведения углеводородов. Согласно Франку и Эвансу [6], органические молекулы, растворенные в воде, повышают долю тетракоординированных молекул воды. Образование кластеров тетракоординированных молекул воды вокруг растворенных углеводородов (или подобных им соединений) эквивалентно приближению ориентации молекул воды к льдоподобной структуре. Это сопровождается существенным снижением энтропии, так как молекулы воды, образующие кластер, теряют при этом трансляционную степень свободы. [c.21]
Опубликованы данные о том, что некоторые растворимые родиевые комплексы общей формулы [КЬНгЬгЗг]" (Ь = РРЬз, РРЬгМе, РРЬМег, РМез) в присутствии небольших количеств воды, как промотора, могут действовать как гомогенные катализаторы гидрирования кетонов [231]. Альдегиды также вначале восстанавливаются, но активность катализаторов вскоре быстро падает. Комплексы способны катализировать гидрирование олефинов, диолефинов и ацетиленов. При атом, однако, восстановление олефинов ингибируется добавками воды. [c.81]
Первым исследованием типа связи в таких соединениях с помощью колебательной спектроскопии является исследование спектра комбинационного рассеяния комплексов серебра с олефинами и алкинами, проведенное Тауфеном, Марреем и Кливлендом [203]. Спектры комбинационного рассеяния чистых олефинов и алкинов были сопоставлены со спектрами насыщенных растворов этих веществ в концентрированных водных растворах перхлората или нитрата серебра. Поскольку растворимость органических лигандов в чистой воде очень мала, можно с уверенностью предположить, что в спектрах смесей не появятся линии комбинационного рассеяния некоординированных органических молекул. Для исследованных ацетиленов — этил-, пропил-, амил- и фенилаце-тиленов — частота валентного колебания С=С в комплексных молекулах оказалась пониженной на 116—124 см по сравнению со свободными молекулами. Остальная часть спектра либо была слабой, либо не наблюдалась совсем, но в ней не было обнаружено никаких заметных смещений частот. Едва ли можно сомневаться, что в этих молекулах только связь С=С (или возм ущенпая связь С С) может приводить к появлению линии при 2000 см , являющейся валентным колебанием этой связи. Поэтому полученные результаты показывают, что связь с металлом осуществляется в основном с частью лиганда —С=С—Н и приводит к ослаблению связи С = С. [c.349]
В первоначальном варианте процесса Заксе ацетилен поглощался из пиролизного газа водой под давлением. В более поздних вариантаА процесса БАСФ в качестве селективного растворителя использовался метилпнроллидон. Процесс выделения ацетилена, в общем, подобен описанному выше процессу выделения ацетилена в. процессе Вульфа. Газ пиролиза прежде всего очищается от распыленных в нем частиц смолы и сажи, а затем из него извлекаются высшие ацетиленовые углеводороды. Ацетилен нод лощается селективным растворителем, а несорбированные газы промываются для извлечения из них растворителя. Выходящий из абсорбера насыщенный ацетиленом растворитель стабилизируется, т. е. освобождается от наименее растворимых компонентов, а затем поступает в отпарную колонну, где. от него отделяют ацетилен. [c.182]
Для выделения ацетилена из газообразных продуктов пирогенетических реакций обычно пользуются растворимостью этого соединения в различных растворителях. Газ промывают водой или, еще лучше, ацетоном при слегка повышенном давлении, причем в этих условиях ацетилен, легко. растворяется. Horsley и RO ffey предложили различные другие растворители, в частности простые и сложные эфиры, кипящие выше 100°, особенно простые, сложные или смешанные эфиры многоатомных спиртов. В частности были предложены , моноэфир муравьиной кислоты и гликоля, моно- и диалкильные эфиры этиленгликоля, моно- и диацетаты глицерина, моно-, ди- и триалкильные эфиры глицерина, сложные эфиры моно- и диалкильных эфиров глицерина, эфиры фталевой кислоты и этиловый эфир молочной кислоты. [c.171]
chem21.info
Получение и применение ацетилена | Сварка и сварщик
Широкое распространение имеют два способа получения ацетилена:
- Разложением карбида кальция водой в специальных ацетиленовых генераторах. (см. статью «Карбид кальция и ацетилен друзья не разлей вода»)
- Из углеводородных продуктов, содержащихся в природных газах, нефти, газах от переработки угля и торфосланцев.
На данный момент способ получения ацетилена из карбида кальция используется редко, поскольку он довольно громоздкий, дорогой и требующий затрат большого количества электроэнергии.
Поэтому на смену ему пришел способ производства ацетилена из природного газа (метана) термоокислительным пиролизом метана с кислородом (так называемый пиролизный ацетилен).
Метан сжигают в смеси с кислородом в реакторах при температуре 1300-1500°C. В результате чего получается смесь, которая содержит:
- ацетилен - до 8%;
- водород - 54%;
- окись углерода - 25%;
- примеси – до 13%.
При помощи растворителя (диметилформамида) из нее извлекается ацетилен концентрации 99,0-99,2%. Оставшаяся часть пиролизных газов используется для производства аммиака и других продуктов.
Также ацетилен получают путем разложения жидких горючих (нефть, керосин) действием электродугового разряда, который называется электропиролизом.
Пиролизный и электропиролизный ацетилена по своим свойствам является идентичным ацетилену, получаемому из карбида кальция, но дешевле на 30-40%.
Применение ацетилена
Ацетилен применяется при всех процессах газопламенной обработки металлов (газовой сварки и газовой резки), благодаря высокой температуры пламени, достигнуть которой при использовании других горючих не удается.
Для пайки, резки, наплавки, газопламенной закалки, металлизации, газопрессовой сварки, сварки цветных металлов и сплавов с успехом применяются газы-заменители ацетилена: пропано-бутановые смеси, городской газ, природные газы, водород, пары бензина и керосина и др. По химическому составу все они, за исключением водорода, представляют собой или соединения, или смеси различных углеводородов.
Правильный выбор и использование газов-заменителей позволяет добиться высокого качества сварки и резки, а при резке металлов малых толщин дает более высокую чистоту резки.
Газовая сварка возможна при условии, что температура пламени в два раза превышает температуру плавления свариваемого металла. Поэтому газы-заменители температура пламени, которых ниже чем у ацетилена применяют для сварки металлов с температурой плавления ниже, чем у сталей
Для газовой резки выбор горючего газа основывается на его теплотворной способности, но необходимо учитывать, что газ при сгорании в смеси с кислородом должен образовывать пламя с температурой не ниже 2000°C.
Давайте остановимся еще на некоторых особенностях применения ацетилена при газовой сварке – влияние примесей в ацетилене на качество сварного шва. Вредное влияние имеют следующие примеси:
- сероводород;
- фосфористый водород.
Вышеуказанные примеси обязательно удаляются из ацетилена, не только из-за влияния на качество сварного шва, но также из-за пагубного влияния на органы дыхания и зрения сварщика (см. статью Взрывоопасность, ядовитость и самовоспламенение ацетилена).
Сероводород при сгорании образовывает серную кислоту, которая при переходе в металл сварного шва вызывает красноломкость. Установлено, что наличие сероводорода до 0,007% не оказывает вредного влияния на прочность сварного шва.
Определить наличие сероводорода в ацетилене довольно легко, необходимо поднести фильтровальную бумагу, смоченную в растворе хлористой ртути под струю ацетилена. При наличии сероводорода - бумага побелеет. Процесс очистки от сероводорода тоже довольно простой – необходимо ацетилен пропустить через воду, в результате чего сероводород растворится в воде.
Фосфористый водород при сгорании образовывает фосфорную кислоту, которая при переходе в металл сварного шва вызывает хладноломкость. Установлено, что наличие фосфористого водорода до 0,027% не оказывает вредного влияния на прочность сварного шва.
Для определения наличия фосфористого водорода необходимо кусок фильтровальной бумаги, смоченной в десятипроцентном растворе азотнокислого серебра поднести под струю ацетилена. При содержании 0,01% фосфористого водорода бумага принимает отчетливую светло- желтую окраску, при содержании более 0,02% - бумага темнеет.
Химическим путем ацетилен очищают от фосфористого водорода путем пропускания через особую очистительную массу – гератоль. Гератоль представляет собой массу желтого цвета, которая в результате взаимодействия с фосфористым водородом приобретает зеленый цвет.
Помимо газопламенной обработки ацетилен широко используют в химической промышленности в качестве основного исходного вещества для получения ряда важнейших продуктов органического синтеза: синтетического каучука, пластмасс, растворителей, уксусной кислоты и т. п.
Продуктом присоединения воды к ацетилену является уксусный альдегид. Впервые этот синтез был осуществлен М. Г. Кучеровым в 1881 г. Реакция протекает по уравнению
HC = CH + h3O → Ch4 - CHО
Реакция проводится пропусканием ацетилена через сернокислый раствор соли окиси ртути при температуре 70-80°C.
Применение этой реакции явилось началом промышленного синтеза органических веществ с использованием ацетилена в качестве исходного продукта.
При пропускании смеси ацетилена и паров воды в соотношении примерно 1:10 при температуре 430-450°C над цинк-ванадиевым катализатором происходит образование ацетона по уравнению:
2C2h3 + 3h3O → Ch4-CО-Ch4 + CО2 + h3О
Указанный процесс нашел применение в промышленных масштабах.
При взаимодействии ацетилена с хлористым водородом при 200°C над катализатором, представляющим собой двухлористую ртуть, нанесенную на активированный уголь, образуется хлористый винил по уравнению:
C2h3 + HCl → Ch3 = CHCl
C уксусной кислотой также в присутствии ртутных солей ацетилен образует винилацетат:
C2h4 + Ch4COOH → Ch3 = CH-ОCО-Ch4
Хлористый винил и винилацетат широко применяются при производстве пластмасс.
При пропускании ацетилена через насыщенный раствор однохлористой меди и хлористого аммония при температуре 50°C образуется винилацетилен.
Реакция протекает по уравнению:
CH ≡ CH + CH ≡ CH → CH ≡ C-CH ≡ Ch3
В результате присоединения хлороводорода к винилацетилену образуется хлоропрен, который способен к быстрой и самопроизвольной полимеризации с образованием каучука высоких технических качеств.
Химия винилацетилена нашла широкое теоретическое обобщение, что позволило значительно расширить область применения этого продукта.
При взаимодействии ацетилена со спиртами в щелочном растворе образуются простые виниловые эфиры.
Так, например, реакция между ацетиленом и этиловым спиртом протекает по уравнению:
C2h3 + C2H5ОH → h3C = CH-O-C2H5
Эта реакция была открыта А. Е. Фаворским в 1887 г.
weldering.com
Ацетилен — Википедия
Ацетиле́н (по ИЮПАК — этин) — непредельный углеводород C2h3. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
В лаборатории[править]
В лаборатории, а также в газосварочном оборудовании, ацетилен получают действием воды на карбид кальция[2] (Ф. Вёлер, 1862 год),

а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:

В промышленности[править]
В промышленности ацетилен получают из карбида кальция и пиролизом углеводородного сырья — метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом. Карбидный метод позволяет получать чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз менее энергозатратен, но образующийся ацетилен имеет низкую концентрацию в газовом потоке и требует выделения. Экономические оценки обоих методов многочисленны, но противоречивы[3][:стр. 274].
Получение пиролизом[править]
Электрокрекинг[править]
Метан превращают в ацетилен и водород в электродуговых печах (температура 2000—3000 °С, напряжение между электродами 1000 В). Метан при этом разогревается до 1600 °С. Расход электроэнергии составляет около 13000 кВт•ч на 1 тонну ацетилена, что относительно много (примерно равно затрачиваемой энергии по карбидному методу) и потому является недостатком процесса. Выход ацетилена составляет 50 %.
Регенеративный пиролиз[править]
Иное название — Вульф-процесс. Сначала разогревают насадку печи путем сжигания метана при 1350—1400 °С. Далее через разогретую насадку пропускают метан. Время пребывания метана в зоне реакции очень мало и составляет доли секунды. Процесс реализован в промышленности, но экономически оказался не таким перспективным, как считалось на стадии проектирования.
Окислительный пиролиз[править]
Метан смешивают с кислородом. Часть сырья сжигают, а образующееся тепло расходуют на нагрев остатка сырья до 1600 °С. Выход ацетилена составляет 30—32 %. Метод имеет преимущества — непрерывный характер процесса и низкие энергозатраты. Кроме того, с ацетиленом образуется еще и синтез-газ. Этот процесс (Заксе-процесс или BASF-процесс) получил наиболее широкое внедрение.
Гомогенный пиролиз[править]
Является разновидностью окислительного пиролиза. Часть сырья сжигают с кислородом в топке печи, газ нагревается до 2000 °С. Затем в среднюю часть печи вводят остаток сырья, предварительно нагретый до 600 °С. Образуется ацетилен. Метод характеризуется большей безопасностью и надёжностью работы печи.
Пиролиз в струе низкотемпературной плазмы[править]
Процесс разрабатывается с 1970-х годов, но, несмотря на перспективность, пока не внедрён в промышленности. Сущность процесса состоит в нагреве метана ионизированным газом. Преимущество метода заключается в относительно низких энергозатратах (5000—7000 кВт•ч) и высоких выходах ацетилена (87 % в аргоновой плазме и 73 % в водородной).
Карбидный метод[править]
Этот способ известен с XIX века, но не потерял своего значения до настоящего времени. Сначала получают карбид кальция, сплавляя оксид кальция и кокс в электропечах при 2500—3000 °С:

Известь получают из карбоната кальция:

Далее карбид кальция обрабатывают водой:

Получаемый ацетилен имеет высокую степень чистоты 99,9 %. Основным недостатком процесса является высокий расход электроэнергии: 10000—11000 кВт•ч на 1 тонну ацетилена.
Физические свойства[править]
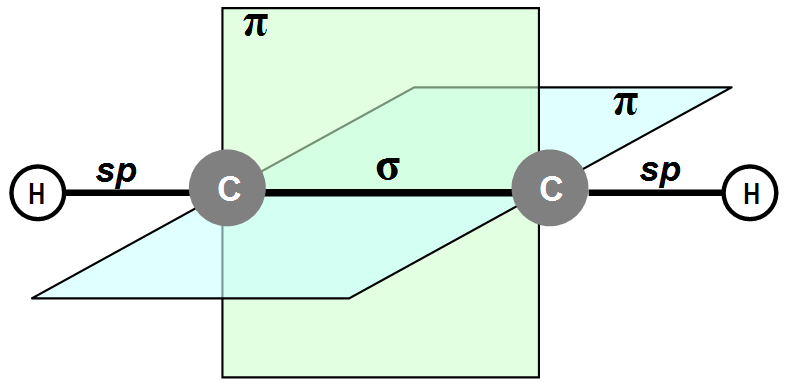 Рис.1. Пи-связи в молекуле ацетилена
Рис.1. Пи-связи в молекуле ацетилена При нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом, однако технический ацетилен содержит примеси, которые придают ему резкий запах[4]. Малорастворим в воде, хорошо растворяется в ацетоне. Температура кипения −83,6 °C[5]. Тройная точка −80,55 °C при давлении 961,5 мм рт. ст., критическая точка 35,18 °C при давлении 61,1 атм[6].
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа[7] при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном[8].
Ацетилен обнаружен на Уране и Нептуне.
Химические свойства[править]
 Ацетилено-кислородное пламя (температура «ядра» 2621 °C)
Ацетилено-кислородное пламя (температура «ядра» 2621 °C) Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> ClCH=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³ (50,4 МДж/кг). При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в ~500 °C. В присутствии катализаторов, например, трикарбонил(трифенилфосфин)никеля, температуру реакции циклизации можно снизить до 60-70 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так, ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
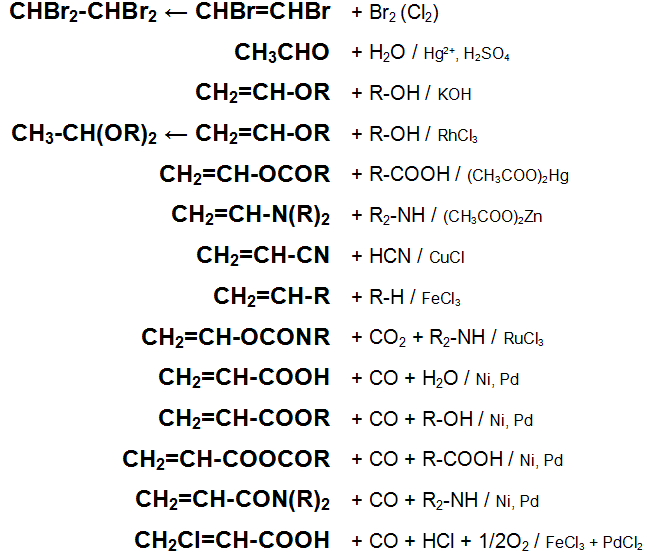
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
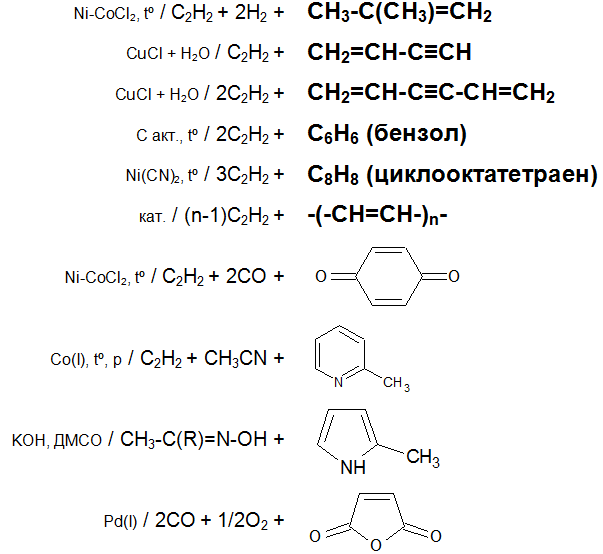
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Реагирует с аммиачными растворами солей Cu(I) и Ag(I) с образованием малорастворимых, взрывчатых ацетиленидов — эта реакция используется для качественного определения ацетилена и его отличия от алкенов (которые тоже обесцвечивают бромную воду и раствор перманганата калия).
Открыт в 1836 году Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 год).
 Ацетиленовая лампа
Ацетиленовая лампа Ацетилен используют:
- для газовой сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях (вместе с аммиаком)[9]
Поскольку ацетилен нерастворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3—80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает незначительным токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м³ согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населённых мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5—100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углём) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5—2,5 МПа.
- ↑ 1,01,1 ГОСТ 5457-75. Ацетилен растворённый и газообразный технический. Технические условия
- ↑ Видео данного процесса
- ↑ Лапидус А. Л., Голубева И. А., Жагфаров Ф. Г. Газохимия. Учебное пособие. — М.: ЦентрЛитНефтеГаз, 2008. — 450 с. — ISBN 978-5-902665-31-1.
- ↑ Большая энциклопедия нефти и газа. Неприятный запах — ацетилен. Проверено 10 октября 2013.
- ↑ Корольченко, Пожаровзрывоопасность веществ, 2004, с. 198.
- ↑ Миллер. Ацетилен, его свойства, получение и применение, 1969, с. 72.
- ↑ Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
- ↑ Ацетилен. Проверено 10 октября 2013.
- ↑ В России разработали ракетный двигатель на аммиаке — Известия
- Миллер С. А. Ацетилен, его свойства, получение и применение. — Л.: Химия, 1969. — Т. 1. — 680 с.
- Корольченко А. Я., Корольченко Д. А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х частях. Часть 1. — М.: Ассоциация «Пожнаука», 2004. — 713 с. — ISBN 5-901283-02-3.
wp.wiki-wiki.ru






















