Лекция: Автопротолиз воды. Константа автопротолиза воды. Водородный показатель. Автопротолиз воды
Лекция - Автопротолиз воды. Константа автопротолиза воды. Водородный показатель.
Автопротолиз – обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой.
h3O + h3O= h4O+ + OH–
Это равновесие называется равновесием автопротолиза воды.
Константа автопротолиза для воды обычно называется ионным произведением воды и обозначается как Kw. Ионное произведение численно равно произведению равновесных концентраций ионов гидроксония и гидроксид-анионов. Обычно используется упрощенная запись:
При стандартных условиях ионное произведение воды равно 10-14. Оно является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. Автопротолиз воды объясняет, почему чистая вода, хоть и плохо, но всё же проводит электрический ток.
pH — это водородный показатель— мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:
pH = -log[H+].
Т.е. рН определяется количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды. (Моль — единица измерения количества вещества.)
Если в воде пониженное содержание свободных ионов водорода [H+] (рН > 7) по сравнению с ионами гидроксида [ОН-], то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН < 7) — кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга и в нейтральной воде рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению значения рН.
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию.
для сильной кислоты:
pH = -log[H+]
для слабой кислоты:
pH = ½ (рКа – lgСкисл)
или pH = ½ (-lgKкисл – lgСкисл)
для сильного основания:
pH = 14- pOH; (pOH=-lg[OH]; [OH]=Cоснования; C= m / MV)
или если дано Kb, тогда pOH= ½ (pKb — Cоснования) (pKb=-lgKb; pOH= ½ (-lgKb — Cоснования; pH=14-pOH)
для слабого основания :
pH = 14 — ½pKb + ½ lgC
19 вопрос. Типы протолитических реакций. Понятие о гидролизе. Роль гидролиза в биохимических процессах. Ацидиметрия и алкалиметрия.
К протолитическим реакциям относят кислотно−основные реакции и реакции нейтрализации и гидролиза.
В соответствии с протолитической теорией кислот и оснований кислоты представляют собой атомно−молекулярные частицы, способные в обычных условиях к внутримолекулярной или межмолекулярной, полной или неполной передаче протона, а основания − частицы, способные в этих же условиях к присоединению протона, например:
Nh4(осн.1) + h3O(кисл.2) = Nh5+ (кисл.2)+ OH−(осн.2)
Сродство к протону ‒ энергия, высвобождающаяся в газофазной реакции между протоном и молекулой с образованием соответствующей сопряженной кислоты
Реакция гидролиза — необратимая химическая реакция взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц (относится к протолитическим реакциям). Реакции гидролиза записывают в виде:
а) молекулярного уравнения: KNO2 + h3O ↔ KOH + HNO2
б) ионного уравнения:
NO2− + h3O ↔ HNO2 + OH−
Nh5+ + h3O = Nh5ОН + Н+ [образующийся ион водорода обусловливает кислотную среду раствора, т. е. (рН) < 7].
Уравнение реакции гидролиза соли (гидролиз иона) на примере FeCl3 выглядит как (FeCl3 = Fe3+ + 3Cl−)
Гидролиз солей это реакции между составными частями воды и солей, сопровождающиеся образованием малодиссоциированных соединений. Гидролизу могут подвергаться не только соли, но и другие растворенные вещества (углеводы, белки, жиры, эфиры и т.д.). Реакция гидролиза часто сопровождается изменением рН раствора. Если вместо воды используется иной растворитель, то процесс носит название сольволиз.
Гидролизу подвергаются соли, являющиеся производными слабых кислот или оснований. Соли, образованные сильными кислотами и основаниями, гидролизу не подвергаются.
1)Гидролиз солей, образованных сильной кислотой и слабым основанием (гидролиз по катиону). Для характеристики полноты протекания реакции используют понятие степень гидролиза (β) – отношение концентрации молекул, подвергшихся гидролизу (сгидр) к исходной концентрации растворенной соли (сисх):
(7.37)
Степень гидролиза зависит от: 1)химической природы ионов, составляющих соль; 2)концентрации соли; 3)температуры. Степень гидролиза увеличивается с уменьшением константы диссоциации слабой кислоты или основания, уменьшением концентрации соли и повышением температуры.
Гидролиз протекает в заметной степени только в разбавленных растворах, тогда следовательно, Это произведение называется константой гидролиза (Кг):
Из выражения (7.42) следует, что уменьшение силы основания ведет к увеличению константы гидролиза, а следовательно, и степени гидролиза.
Степень гидролиза увеличивается с уменьшением силы основания и концентрации соли. Повышение температуры сопровождается увеличением КW, что также ведет к росту β.
2)Гидролиз солей, образованных слабой кислотой и сильным основанием (гидролиз по аниону).
где Ккислота – константа диссоциации слабой кислоты.
3)Гидролиз солей, образованных слабой кислотой и слабым основанием (гидролиз по аниону и катиону)
Константа гидролиза в этом случае определяется константой диссоциации слабой кислоты и слабого основания:
Реакции гидролиза играют важную роль в природных и производственных процессах. В водоочистке для удаления грубодисперсных и коллоидных примесей используют осадки гидроксидов алюминия и железа, получаемые гидролизом сульфатов железа (FeSO4.7h3O; Fe2(SO4)3.9h3O), алюминия Al2(SO4)3.18h3O), или хлорида железа (FeCl3.6h3O). Для обеспечения полноты протекания гидролиза растворы подщелачивают. Важной стадией процесса пищеварения является гидролиз пищи в желудочно-кишечном тракте. Энергия в живых организмах запасается, в основном, в виде АТФ (аденозинтрифосфорная кислота) и выделяется при ее гидролизе.
Алкалиметрия и ацидиметрия — важнейшие титриметрические методы определения кислот или же оснований, основанные на реакции нейтрализации:
Н+ + ОН− = Н2О
Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты — ацидиметрией.
www.ronl.ru
14.Автопротолиз воды. Константа автопротолиза воды. Водородный показатель.
Автопротолиз – обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой.
h3O + h3O= h4O+ + OH–
Это равновесие называется равновесием автопротолиза воды.
Константа автопротолиза для воды обычно называется ионным произведением воды и обозначается как Kw. Ионное произведение численно равно произведению равновесных концентраций ионов гидроксония и гидроксид-анионов. Обычно используется упрощенная запись:
При стандартных условиях ионное произведение воды равно 10-14. Оно является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. Автопротолиз воды объясняет, почему чистая вода, хоть и плохо, но всё же проводит электрический ток.
pH — это водородный показатель— мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:
pH = -log[H+].
Т.е. рН определяется количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды. (Моль — единица измерения количества вещества.)
Если в воде пониженное содержание свободных ионов водорода [H+] (рН > 7) по сравнению с ионами гидроксида [ОН-], то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН < 7) - кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга и в нейтральной воде рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению значения рН.
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию.
для сильной кислоты:
pH = -log[H+]
для слабой кислоты:
pH = ½ (рКа – lgСкисл)
или pH = ½ (-lgKкисл – lgСкисл)
для сильного основания:
pH = 14- pOH; (pOH=-lg[OH]; [OH]=Cоснования; C= m / MV)
или если дано Kb,тогда pOH= ½ (pKb - Cоснования) (pKb=-lgKb; pOH= ½ (-lgKb - Cоснования; pH=14-pOH)
для слабого основания :
pH = 14 - ½pKb + ½ lgC
15. Типы протолитических реакций. Понятие о гидролизе. Роль гидролиза в биохимических процессах. Ацидиметрия и алкалиметрия.
К протолитическим реакциям относят кислотно−основные реакции и реакции нейтрализации и гидролиза.
В соответствии с протолитической теорией кислот и оснований кислоты представляют собой атомно−молекулярные частицы, способные в обычных условиях к внутримолекулярной или межмолекулярной, полной или неполной передаче протона, а основания − частицы, способные в этих же условиях к присоединению протона, например:
Nh4(осн.1) + h3O(кисл.2) = Nh5+ (кисл.2)+ OH−(осн.2)
Сродство к протону ‒ энергия, высвобождающаяся в газофазной реакции между протоном и молекулой с образованием соответствующей сопряженной кислоты
Реакция гидролиза - необратимая химическая реакция взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц (относится к протолитическим реакциям). Реакции гидролиза записывают в виде:
а) молекулярного уравнения: KNO2 + h3O ↔ KOH + HNO2
б) ионного уравнения:
NO2− + h3O ↔ HNO2 + OH−
Nh5+ + h3O = Nh5ОН + Н+ [образующийся ион водорода обусловливает кислотную среду раствора, т. е. (рН) < 7].
Уравнение реакции гидролиза соли (гидролиз иона) на примере FeCl3 выглядит как (FeCl3 = Fe3+ + 3Cl−)
Гидролиз солей это реакции между составными частями воды и солей, сопровождающиеся образованием малодиссоциированных соединений. Гидролизу могут подвергаться не только соли, но и другие растворенные вещества (углеводы, белки, жиры, эфиры и т.д.). Реакция гидролиза часто сопровождается изменением рН раствора. Если вместо воды используется иной растворитель, то процесс носит название сольволиз.
Гидролизу подвергаются соли, являющиеся производными слабых кислот или оснований. Соли, образованные сильными кислотами и основаниями, гидролизу не подвергаются.
1)Гидролиз солей, образованных сильной кислотой и слабым основанием (гидролиз по катиону). Для характеристики полноты протекания реакции используют понятие степень гидролиза (β) – отношение концентрации молекул, подвергшихся гидролизу (сгидр) к исходной концентрации растворенной соли (сисх):
 (7.37)
(7.37)
Степень гидролиза зависит от: 1)химической природы ионов, составляющих соль; 2)концентрации соли; 3)температуры. Степень гидролиза увеличивается с уменьшением константы диссоциации слабой кислоты или основания, уменьшением концентрации соли и повышением температуры.
Гидролиз протекает в заметной степени только в разбавленных растворах , тогда следовательно
, тогда следовательно ,Это произведение называется константой гидролиза (Кг):
,Это произведение называется константой гидролиза (Кг):

Из выражения (7.42) следует, что уменьшение силы основания ведет к увеличению константы гидролиза, а следовательно, и степени гидролиза.
Степень гидролиза увеличивается с уменьшением силы основания и концентрации соли. Повышение температуры сопровождается увеличением КW, что также ведет к росту β.
2)Гидролиз солей, образованных слабой кислотой и сильным основанием (гидролиз по аниону).
 где Ккислота – константа диссоциации слабой кислоты.
где Ккислота – константа диссоциации слабой кислоты.
3)Гидролиз солей, образованных слабой кислотой и слабым основанием (гидролиз по аниону и катиону)
Константа гидролиза в этом случае определяется константой диссоциации слабой кислоты и слабого основания:

Реакции гидролиза играют важную роль в природных и производственных процессах. В водоочистке для удаления грубодисперсных и коллоидных примесей используют осадки гидроксидов алюминия и железа, получаемые гидролизом сульфатов железа (FeSO4.7h3O; Fe2(SO4)3.9h3O), алюминия Al2(SO4)3.18h3O), или хлорида железа (FeCl3.6h3O). Для обеспечения полноты протекания гидролиза растворы подщелачивают. Важной стадией процесса пищеварения является гидролиз пищи в желудочно-кишечном тракте. Энергия в живых организмах запасается, в основном, в виде АТФ (аденозинтрифосфорная кислота) и выделяется при ее гидролизе.
Алкалиметрия и ацидиметрия — важнейшие титриметрические методы определения кислот или же оснований, основанные на реакции нейтрализации:
Н+ + ОН− = Н2О
Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты — ацидиметрией.
studfiles.net
Автопротолиз - это... Что такое Автопротолиз?
Автопротолиз — гомофазный процесс самоионизации, обратимый процесс передачи протона от одной нейтральной молекулы жидкости к другой и образования в результате равного числа катионов и анионов.
Автопротолиз как кислотно-основное взаимодействие
Понятие автопротолиза вытекает из протонной теории кислот и оснований Брёнстеда-Лоури.
В ней понятие о кислотах и основаниях было объединено в единое целое, проявляющееся в кислотно-основном взаимодействии. Сущностью кислотно-основного взаимодействия по Брёнстеду-Лоури является передача протона от кислоты к основанию. При этом в любом кислотно-основном взаимодействии участвуют две пары сопряженных кислот и оснований (протолитов):
Растворители, которые являются протолитами по отношению к растворенным веществам, называются протонными растворителями. К их числу относятся вода h3O, аммиак Nh4, фтороводород HF, уксусная кислота Ch4COOH и др. Главное из свойств всех протонных растворителей — способность их молекул к автопротолизу: каждый протонный растворитель является амфолитом по отношению к самому себе[1].
Реакция автопротолиза в общем виде отвечает уравнению:

При этом образуются так называемые лионий (катион растворителя) h3L+ (кислота сопряженной пары h3L+ / HL) и лиат (анион растворителя) L- (основание сопряженной пары HL / L-)[1]. Так, для воды автопротолиз протекает с образованием катионов гидроксония h4O+ и гидроксид-ионов, OH-):

Это равновесие называется равновесием автопротолиза воды.
Автопротолиз характерен не только для воды, но и для многих других протонных растворителей, молекулы которых связаны между собой водородными связями, например, для аммиака, метанола и фтороводорода:



Константа автопротолиза
Применение закона действующих масс к равновесной гомофазной реакции автопротолиза позволяет получить количественную характеристику — константу автопротолиза (иначе ионное произведение) растворителя KS. Термин «константа автопротолиза» используется обычно в протолитической теории, а «ионное произведение» — в теории электролитической диссоциации[2].
Для протонного растворителя HL может быть записана соответствующая константа равновесия:
![\mathsf{K_c = \frac{[L^-] \cdot [H_2L^+]}{[HL]^2} =const = f(T)}](/800/600/http/dic.academic.ruc8eb5305230c7ad274d9435bea63cc26.png)
Степень протолиза очень мала и, следовательно, равновесная молярная концентрация непротолизованных молекул растворителя [HL] практически равна исходной концентрации этого растворителя CHL, то есть постоянна.
Объединяя постоянные Kс и [HL]2 в одну константу Kс · [HL]2 и обозначая ее Ks, получим выражение:
![\mathsf{K_s = {[L^-] \cdot [H_2L^+]} =const = f(T)}](/800/600/http/dic.academic.ruaf015e8ed9a8b2693d0a88956e964d95.png)
Величина Ks — константа автопротолиза или ионное произведение растворителя — служит количественной характеристикой реакции автопротолиза данного растворителя. Константа автопротолиза является постоянной величиной для данной температуры и данного растворителя.
Например, для уксусной кислоты:

Поскольку значения констант автопротолиза очень малы, на практике для удобства пользуются величиной, которая называется «показатель константы автопротолиза». Она рассчитывается как отрицательный десятичный логарифм константы автопротолиза:

Показатели констант автопротолиза некоторых растворителей приведены в таблице[3].
| Диметилсульфоксид | 33,3 |
| Аммиак (жидкий) | 32,5 |
| Ацетонитрил | 32,2 |
| Метилэтилкетон | 25,7 |
| Гидразин | 24,7 |
| трет-Бутиловый спирт | 22,8 |
| Изоамиловый спирт | 21,4 |
| Ацетон (енольная форма) | 21,1 |
| Уксусная кислота (безводная) | 14,45 |
| Вода | 14,0 |
| Фтороводород | 10,0 |
| Муравьиная кислота | 6,30 |
| Серная кислота | 5,0 |
Автопротолиз воды
Наиболее важное значение имеет автопротолиз воды. Константа автопротолиза для воды обычно называется ионным произведением воды и обозначается как  . Ионное произведение численно равно произведению равновесных концентраций ионов гидроксония и гидроксид-анионов. Обычно используется упрощенная запись:
. Ионное произведение численно равно произведению равновесных концентраций ионов гидроксония и гидроксид-анионов. Обычно используется упрощенная запись:
![\mathsf{K_w = [H^+] \cdot [OH^-]}](/800/600/http/dic.academic.ru3a275d75431d90da61c09f02aa8e4800.png)
При стандартных условиях ионное произведение воды равно 10−14. Оно является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. Автопротолиз воды объясняет, почему чистая вода, хоть и плохо, но всё же проводит электрический ток.
На основе ионного произведения воды вычисляются водородный показатель и константа гидролиза солей, константа сольватации (произведение растворимости) — важнейшие характеристики равновесных процессов в растворах электролитов.
Литература
- Угай Я. А. Общая и неорганическая химия. — Москва: Высшая школа, 1997. — 527 с.
- Ахметов Н.С. Общая и неорганическая химия. — Москва: Высшая школа, 2001. — С. 209. — 743 с. — ISBN 5-06-003363-5
См. также
Примечания
dic.academic.ru
Автопротолиз воды - Справочник химика 21
Уравнение (60) можно упростить введением в него константы автопротолиза воды [c.131]Величина К , называется константа автопротолиза воды или ионное произведение воды. Она постоянна при постоянной температуре. При комнатной температуре (25 °С = 298,15 К) числовое значение Kw равно [c.115]
Что такое автопротолиз воды [c.20]
Согласно современным представлениям в жидкой воде осуществляется протолитическое равновесие — автопротолиз воды [c.114]
Константа ионизации воды К = [Н+][0Н ]/[Н20] при 25°С равна 1,8 10 моль/л, а константа автопротолиза воды (ионное произведение воды) равна произведению константы ионизации на молярную концентрацию чистой воды 1,8 10 55,5 = 10 . [c.571]Кислотно-основные свойства водных растворов кислот и оснований связаны с собственной диссосшацией (автопротолизом) воды [c.123]
Равновесию автопротолиза воды отвечает уравнение реакции Н2О + Н2О [c.27]
Рассмотрим реакцию соляной кислоты с едким натром. Как уже указывалось, кислотные свойства любого водного раствора сильной кислоты объясняются исключительно тем, что в нем содержатся ионы гидроксония. В то же время в растворе натриевой щелочи содержится сильное основание — ионы гидроксила, которые образуются при взаимодействии кристаллической решетки КаОН с молекулами воды как гидратирующими частицами. Если смешать эквивалентные количества кислоты и основания, то вследствие низкой константы автопротолиза воды из ионов Н3О+ и ОН образуются недиссоциированные молекулы воды [c.383]
Следует обратить внимание на приближения, допущенные при выводе формул (4.16) и (4.17). Во-первых, не принимался во внимание автопротолиз растворителя, во-вторых, равновесная концентрация слабого протолита приравнивалась суммарной концентрации его. Эти приближения определяют границы применимости выведенных формул. Для водных растворов это отчетливо видно из рис. 6, на котором показана зависимость pH раствора от р/Сд протолитической пары и от концентрации растворенного протолита. В области, показанной пунктиром, вокруг линии с pH 7 формулы (4.16) и (4.17) не дают правильных результатов по той причине, что в этих условиях необходимо учитывать автопротолиз воды. Вдоль линий с наклоном +1 и —1, изображающих pH растворов сильных протолитов, равновесную концентрацию слабого протолита нельзя приравнять его суммарной концентрации. [c.54]
Автопротолиз воды и некоторых других растворителей изучен в широком интервале температур. Процесс диссоциации воды эндотермичен (АЯг = 56 0 70 Дж/моль), поэтому в соответствии с уравнением (2.12) с ростом температуры увеличивается. Интегрирование уравнения (2.12) и подстановка численных данных ЛЯ ионизации воды дает уравнение температурной зависимости gKw [c.38]
Константу основания ацетат-иона вычисляем, пользуясь табличным значением константы диссоциации сопряженной уксусной кислоты и константой автопротолиза воды, как показано в примере 2.7. [c.17]
Аналогично равновесию автопротолиза воды протонирован-ные катионы являются кислотами, а анионы — основаниями. [c.389]
Положительный ион, образующийся при автопротолизе воды, называют ионом гидроксония. Ион гидроксония Н3О+ — это протон, который связан с молекулой воды ковалентной связью. В воде присутствуют и более сильно гидратированные ионы, такие, как НзОа , НуОз , но они мало устойчивы. [c.123]
Количественной характеристикой автопротолиза воды является ионное произведение воды [c.121]
Исходя из константы равновесия реакции автопротолиза воды, выведите выражение для [c.123]
Определите для реакции автопротолиза воды при 25° С по известным значениям [c.123]
Выведите расчетную формулу для степени протекания реакции автопротолиза воды ( нго) при известных значениях и Сн,о (см. задачи 7.2 и 7.3). [c.123]
При выборе индикаторов следует учитывать влияние тех факторов, которые могут вызвать изменение константы К1,1пй протолитической пары индикатора или константы автопротолиза растворителя /СнзоЬ. Из этих факторов отметим температуру и ионную силу раствора, а также присутствие других растворителей. Увеличение температуры водного раствора влечет за собой увеличенпе константы автопротолиза воды, вследствие чего смещаются интервалы перехода индикаторов. Так, например, при 18° С интервал перехода метилового оранжевого лежит в пределах от pH 3,1 до pH [c.184]
Константа диссоциащш и концентрация фенола слишком малы, чтобы пренебречь автопротолизом воды. Поэтому [c.130]
Укажите, на какое свойство воды фактически оказывает влияние температура. Приведите уравнение реакции автопротолиза воды и назовите продукты реакции. При каких значениях температуры концентрация гидроксид-ионов в воде будет равна [c.43]
Для иллюстрации сказанного в табл. 2 приведены данные по автопротолизу ряда амфипротонных растворителей. При этом следует отметить, что численное значение константы автопротолиза воды зависит от температуры [c.48]
Константа автопротолиза воды при изменении температуры меняется сильнее, чем константы протолитических нар. Поэтому изменения кривых титровання водных растворов в основном зависят от изменений этой константы. [c.180]
Константа автопротолиза воды при изменении температуры меняется сильнее, чем константы протолитических пар. Поэтому изменения кривых титрования водных растворов в основном зависят от изменений этой константы. Другими словами, значительные изменения обнаруживаются в тех областях, в которых в формулах расчета pH содержится р/Сн о [c.187]
При выборе индикаторов следует учитывать влияние тех факторов, которые могут вызвать изменение константы /Сд, ind протолитической пары индикатора или константы автопротолиза растворителя HSoiv этих факторов отметим температуру и ионную силу раствора, а также присутствие других растворителей. Увеличение температуры водного раствора влечет за собой увеличение константы автопротолиза воды, вследствие чего смещаются интервалы перехода индикаторов. Так, например, при 18° С интервал перехода метилового оранжевого находится в пределах pH 3,1—4,4, а при 100° С — в пределах pH 2,5—3,7. Изменение ионной силы раствора вызывает изменение коэффициентов активности заряженных форм индикатора, следовательно, изменяется реальная константа =/Са, гпа/П . [c.191]
Численное значение константы автопротолиза воды при 25° С равно К й 1 10" . Для упрощения вычислений ионное произведение воды записывают в виде [c.13]
Записать реакции автопротолиза воды и растворителя HSolv и выражения для констант автопротолиза. Каково значение pH дистиллированной свежеперегнанной воды при 25 °С Как изменяется pH воды при повышении температуры [c.5]
Для воды ион лиония называется гидроксоний и условно обозначается Н. Константа автопротолиза воды обозначается или и называется [c.120]
Если Сна или Св ионов водорода, получившихся при автопротолизе воды, пренебречь нельзя. В этом случае общее количество Н -ионов в растворе кислоты складывается из получившейся при диссоциации кислоты и в результате автопротолиза воды. Концентрация последних равна концентрации ОН -ионов [c.126]
Если кислота диссоциирована мало (аионов водорода, получившихся при диссоциации НА, достаточно для подавления автопротолиза воды, то можно считать кислоту единственным источником их появления и полагать, что [Н ] = [А"]. С учетом этих допущений [c.127]
Если при этом учесть равновесие автопротолиза воды, то [Н"] = [А -]-[Н2А]+[0Н-] [c.129]
Равновесию автопротолиза воды отвечает уравнение реакции [c.27]
chem21.info
Реферат - Автопротолиз воды. Константа автопротолиза воды. Водородный показатель.
Автопротолиз – обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой.
h3O + h3O= h4O+ + OH–
Это равновесие называется равновесием автопротолиза воды.
Константа автопротолиза для воды обычно называется ионным произведением воды и обозначается как Kw. Ионное произведение численно равно произведению равновесных концентраций ионов гидроксония и гидроксид-анионов. Обычно используется упрощенная запись:
При стандартных условиях ионное произведение воды равно 10-14. Оно является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. Автопротолиз воды объясняет, почему чистая вода, хоть и плохо, но всё же проводит электрический ток.
pH — это водородный показатель— мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:
pH = -log[H+].
Т.е. рН определяется количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды. (Моль — единица измерения количества вещества.)
Если в воде пониженное содержание свободных ионов водорода [H+] (рН > 7) по сравнению с ионами гидроксида [ОН-], то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН < 7) — кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга и в нейтральной воде рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению значения рН.
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию.
для сильной кислоты:
pH = -log[H+]
для слабой кислоты:
pH = ½ (рКа – lgСкисл)
или pH = ½ (-lgKкисл – lgСкисл)
для сильного основания:
pH = 14- pOH; (pOH=-lg[OH]; [OH]=Cоснования; C= m / MV)
или если дано Kb, тогда pOH= ½ (pKb — Cоснования) (pKb=-lgKb; pOH= ½ (-lgKb — Cоснования; pH=14-pOH)
для слабого основания :
pH = 14 — ½pKb + ½ lgC
19 вопрос. Типы протолитических реакций. Понятие о гидролизе. Роль гидролиза в биохимических процессах. Ацидиметрия и алкалиметрия.
К протолитическим реакциям относят кислотно−основные реакции и реакции нейтрализации и гидролиза.
В соответствии с протолитической теорией кислот и оснований кислоты представляют собой атомно−молекулярные частицы, способные в обычных условиях к внутримолекулярной или межмолекулярной, полной или неполной передаче протона, а основания − частицы, способные в этих же условиях к присоединению протона, например:
Nh4(осн.1) + h3O(кисл.2) = Nh5+ (кисл.2)+ OH−(осн.2)
Сродство к протону ‒ энергия, высвобождающаяся в газофазной реакции между протоном и молекулой с образованием соответствующей сопряженной кислоты
Реакция гидролиза — необратимая химическая реакция взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц (относится к протолитическим реакциям). Реакции гидролиза записывают в виде:
а) молекулярного уравнения: KNO2 + h3O ↔ KOH + HNO2
б) ионного уравнения:
NO2− + h3O ↔ HNO2 + OH−
Nh5+ + h3O = Nh5ОН + Н+ [образующийся ион водорода обусловливает кислотную среду раствора, т. е. (рН) < 7].
Уравнение реакции гидролиза соли (гидролиз иона) на примере FeCl3 выглядит как (FeCl3 = Fe3+ + 3Cl−)
Гидролиз солей это реакции между составными частями воды и солей, сопровождающиеся образованием малодиссоциированных соединений. Гидролизу могут подвергаться не только соли, но и другие растворенные вещества (углеводы, белки, жиры, эфиры и т.д.). Реакция гидролиза часто сопровождается изменением рН раствора. Если вместо воды используется иной растворитель, то процесс носит название сольволиз.
Гидролизу подвергаются соли, являющиеся производными слабых кислот или оснований. Соли, образованные сильными кислотами и основаниями, гидролизу не подвергаются.
1)Гидролиз солей, образованных сильной кислотой и слабым основанием (гидролиз по катиону). Для характеристики полноты протекания реакции используют понятие степень гидролиза (β) – отношение концентрации молекул, подвергшихся гидролизу (сгидр) к исходной концентрации растворенной соли (сисх):
(7.37)
Степень гидролиза зависит от: 1)химической природы ионов, составляющих соль; 2)концентрации соли; 3)температуры. Степень гидролиза увеличивается с уменьшением константы диссоциации слабой кислоты или основания, уменьшением концентрации соли и повышением температуры.
Гидролиз протекает в заметной степени только в разбавленных растворах, тогда следовательно, Это произведение называется константой гидролиза (Кг):
Из выражения (7.42) следует, что уменьшение силы основания ведет к увеличению константы гидролиза, а следовательно, и степени гидролиза.
Степень гидролиза увеличивается с уменьшением силы основания и концентрации соли. Повышение температуры сопровождается увеличением КW, что также ведет к росту β.
2)Гидролиз солей, образованных слабой кислотой и сильным основанием (гидролиз по аниону).
где Ккислота – константа диссоциации слабой кислоты.
3)Гидролиз солей, образованных слабой кислотой и слабым основанием (гидролиз по аниону и катиону)
Константа гидролиза в этом случае определяется константой диссоциации слабой кислоты и слабого основания:
Реакции гидролиза играют важную роль в природных и производственных процессах. В водоочистке для удаления грубодисперсных и коллоидных примесей используют осадки гидроксидов алюминия и железа, получаемые гидролизом сульфатов железа (FeSO4.7h3O; Fe2(SO4)3.9h3O), алюминия Al2(SO4)3.18h3O), или хлорида железа (FeCl3.6h3O). Для обеспечения полноты протекания гидролиза растворы подщелачивают. Важной стадией процесса пищеварения является гидролиз пищи в желудочно-кишечном тракте. Энергия в живых организмах запасается, в основном, в виде АТФ (аденозинтрифосфорная кислота) и выделяется при ее гидролизе.
Алкалиметрия и ацидиметрия — важнейшие титриметрические методы определения кислот или же оснований, основанные на реакции нейтрализации:
Н+ + ОН− = Н2О
Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты — ацидиметрией.
www.ronl.ru
Автопротолиз — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Автопротолиз — гомофазный процесс самоионизации, обратимый процесс передачи протона от одной нейтральной молекулы жидкости к другой и образования в результате равного числа катионов и анионов.
Автопротолиз как кислотно-основное взаимодействие
Понятие автопротолиза вытекает из протонной теории кислот и оснований Брёнстеда-Лоури. В ней понятие о кислотах и основаниях было объединено в единое целое, проявляющееся в кислотно-основном взаимодействии. Сущностью кислотно-основного взаимодействия по Брёнстеду-Лоури является передача протона от кислоты к основанию. При этом в любом кислотно-основном взаимодействии участвуют две пары сопряженных кислот и оснований (протолитов):
<math>\mathsf{A1 + B2 \rightleftarrows A2 + B1}</math>Растворители, которые являются протолитами по отношению к растворенным веществам, называются протонными растворителями. К их числу относятся вода h3O, аммиак Nh4, фтороводород HF, уксусная кислота Ch4COOH и др. Главное из свойств всех протонных растворителей — способность их молекул к автопротолизу: каждый протонный растворитель является амфолитом по отношению к самому себе[1].
Реакция автопротолиза в общем виде отвечает уравнению:
<math>\mathsf{2HL \rightleftarrows H_2L^+ + L^-}</math>При этом образуются так называемые лионий (катион растворителя) h3L+ (кислота сопряженной пары h3L+ / HL) и лиат (анион растворителя) L- (основание сопряженной пары HL / L-)[1]. Так, для воды автопротолиз протекает с образованием катионов гидроксония h4O+ и гидроксид-ионов, OH-):
<math>\mathsf{2H_2O \rightleftarrows H_3O^+ + OH^-}</math>Это равновесие называется равновесием автопротолиза воды.
Автопротолиз характерен не только для воды, но и для многих других протонных растворителей, молекулы которых связаны между собой водородными связями, например, для аммиака, метанола и фтороводорода:
<math>\mathsf{2NH_3 \rightleftarrows NH_4^+ + NH_2^-}</math> <math>\mathsf{2CH_3OH \rightleftarrows CH_3OH_2^+ + CH_3O^-}</math> <math>\mathsf{2HF \rightleftarrows H_2F^+ + F^-}</math>Константа автопротолиза
Применение закона действующих масс к равновесной гомофазной реакции автопротолиза позволяет получить количественную характеристику — константу автопротолиза (иначе ионное произведение) растворителя KS. Термин «константа автопротолиза» используется обычно в протолитической теории, а «ионное произведение» — в теории электролитической диссоциации[2].
Для протонного растворителя HL может быть записана соответствующая константа равновесия:
<math>\mathsf{K_c = \frac{[L^-] \cdot [H_2L^+]}{[HL]^2} =const = f(T)}</math>Степень протолиза очень мала и, следовательно, равновесная молярная концентрация непротолизованных молекул растворителя [HL] практически равна исходной концентрации этого растворителя CHL, то есть постоянна.
Объединяя постоянные Kс и [HL]2 в одну константу Kс · [HL]2 и обозначая её Ks, получим выражение:
<math>\mathsf{K_s = {[L^-] \cdot [H_2L^+]} =const = f(T)}</math>Величина Ks — константа автопротолиза или ионное произведение растворителя — служит количественной характеристикой реакции автопротолиза данного растворителя. Константа автопротолиза является постоянной величиной для данной температуры и данного растворителя.
Например, для уксусной кислоты:
<math>\mathsf{2CH_3COOH \rightleftarrows CH_3COOH_2^+ + CH_3COO^-; \ \ \ K_s = 2,5 \cdot 10^{-13}, 20^oC}</math>Поскольку значения констант автопротолиза очень малы, на практике для удобства пользуются величиной, которая называется «показатель константы автопротолиза». Она рассчитывается как отрицательный десятичный логарифм константы автопротолиза:
<math>\mathsf{pK_s = -lgK_s}</math>Показатели констант автопротолиза некоторых растворителей приведены в таблице[3].
| Диметилсульфоксид | 33,3 |
| Аммиак (жидкий) | 32,5 |
| Ацетонитрил | 32,2 |
| Метилэтилкетон | 25,7 |
| Гидразин | 24,7 |
| трет-Бутиловый спирт | 22,8 |
| Изоамиловый спирт | 21,4 |
| Ацетон (енольная форма) | 21,1 |
| Уксусная кислота (безводная) | 14,45 |
| Вода | 14,0 |
| Фтороводород | 10,0 |
| Муравьиная кислота | 6,30 |
| Серная кислота | 5,0 |
Автопротолиз воды
Наиболее важное значение имеет автопротолиз воды. Константа автопротолиза для воды обычно называется ионным произведением воды и обозначается как <math>K_w</math>. Ионное произведение численно равно произведению равновесных концентраций ионов гидроксония и гидроксид-анионов. Обычно используется упрощенная запись:
<math>\mathsf{K_w = [H^+] \cdot [OH^-]}</math>При стандартных условиях ионное произведение воды равно 10−14. Оно является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. Автопротолиз воды объясняет, почему чистая вода, хоть и плохо, но всё же проводит электрический ток.
На основе ионного произведения воды вычисляются водородный показатель и константа гидролиза солей, константа сольватации (произведение растворимости) — важнейшие характеристики равновесных процессов в растворах электролитов.
Напишите отзыв о статье "Автопротолиз"
Литература
- Угай Я. А. Общая и неорганическая химия. — Москва: Высшая школа, 1997. — 527 с.
- Ахметов Н.С. Общая и неорганическая химия. — Москва: Высшая школа, 2001. — С. 209. — 743 с. — ISBN 5-06-003363-5.
См. также
Примечания
- ↑ 1 2 [www.alhimik.ru/protolis/glava3.htm Протонные растворители и их автопротолиз] / Протолитические равновесия. Авторы: проф. Р. А. Лидин, проф. Л. Ю. Аликберова. Под общей редакцией проф. Б. Д. Стёпина. Методическое пособие. — М., МИТХТ, 2001 г.
- ↑ [www.chem.msu.su/rus/school/zhukov/20.html#2 Константа автопротолиза (ионное произведение)] / Жуков С. Т. Химия. 10-11 класс.
- ↑ [www.chemport.ru/data/data140.shtml Показатели констант автопротолиза рКs и диэлектрические проницаемости ε некоторых неводных растворителей] (рус.). — справочная таблица. Проверено 28 августа 2011. [www.webcitation.org/6ADKlQwkW Архивировано из первоисточника 27 августа 2012].
Отрывок, характеризующий Автопротолиз
– Государь! Государь! – вдруг разнеслось по залам, и вся толпа бросилась к выходу. По широкому ходу, между стеной дворян, государь прошел в залу. На всех лицах выражалось почтительное и испуганное любопытство. Пьер стоял довольно далеко и не мог вполне расслышать речи государя. Он понял только, по тому, что он слышал, что государь говорил об опасности, в которой находилось государство, и о надеждах, которые он возлагал на московское дворянство. Государю отвечал другой голос, сообщавший о только что состоявшемся постановлении дворянства. – Господа! – сказал дрогнувший голос государя; толпа зашелестила и опять затихла, и Пьер ясно услыхал столь приятно человеческий и тронутый голос государя, который говорил: – Никогда я не сомневался в усердии русского дворянства. Но в этот день оно превзошло мои ожидания. Благодарю вас от лица отечества. Господа, будем действовать – время всего дороже… Государь замолчал, толпа стала тесниться вокруг него, и со всех сторон слышались восторженные восклицания. – Да, всего дороже… царское слово, – рыдая, говорил сзади голос Ильи Андреича, ничего не слышавшего, но все понимавшего по своему. Из залы дворянства государь прошел в залу купечества. Он пробыл там около десяти минут. Пьер в числе других увидал государя, выходящего из залы купечества со слезами умиления на глазах. Как потом узнали, государь только что начал речь купцам, как слезы брызнули из его глаз, и он дрожащим голосом договорил ее. Когда Пьер увидал государя, он выходил, сопутствуемый двумя купцами. Один был знаком Пьеру, толстый откупщик, другой – голова, с худым, узкобородым, желтым лицом. Оба они плакали. У худого стояли слезы, но толстый откупщик рыдал, как ребенок, и все твердил: – И жизнь и имущество возьми, ваше величество! Пьер не чувствовал в эту минуту уже ничего, кроме желания показать, что все ему нипочем и что он всем готов жертвовать. Как упрек ему представлялась его речь с конституционным направлением; он искал случая загладить это. Узнав, что граф Мамонов жертвует полк, Безухов тут же объявил графу Растопчину, что он отдает тысячу человек и их содержание. Старик Ростов без слез не мог рассказать жене того, что было, и тут же согласился на просьбу Пети и сам поехал записывать его. На другой день государь уехал. Все собранные дворяне сняли мундиры, опять разместились по домам и клубам и, покряхтывая, отдавали приказания управляющим об ополчении, и удивлялись тому, что они наделали.Наполеон начал войну с Россией потому, что он не мог не приехать в Дрезден, не мог не отуманиться почестями, не мог не надеть польского мундира, не поддаться предприимчивому впечатлению июньского утра, не мог воздержаться от вспышки гнева в присутствии Куракина и потом Балашева. Александр отказывался от всех переговоров потому, что он лично чувствовал себя оскорбленным. Барклай де Толли старался наилучшим образом управлять армией для того, чтобы исполнить свой долг и заслужить славу великого полководца. Ростов поскакал в атаку на французов потому, что он не мог удержаться от желания проскакаться по ровному полю. И так точно, вследствие своих личных свойств, привычек, условий и целей, действовали все те неперечислимые лица, участники этой войны. Они боялись, тщеславились, радовались, негодовали, рассуждали, полагая, что они знают то, что они делают, и что делают для себя, а все были непроизвольными орудиями истории и производили скрытую от них, но понятную для нас работу. Такова неизменная судьба всех практических деятелей, и тем не свободнее, чем выше они стоят в людской иерархии. Теперь деятели 1812 го года давно сошли с своих мест, их личные интересы исчезли бесследно, и одни исторические результаты того времени перед нами. Но допустим, что должны были люди Европы, под предводительством Наполеона, зайти в глубь России и там погибнуть, и вся противуречащая сама себе, бессмысленная, жестокая деятельность людей – участников этой войны, становится для нас понятною. Провидение заставляло всех этих людей, стремясь к достижению своих личных целей, содействовать исполнению одного огромного результата, о котором ни один человек (ни Наполеон, ни Александр, ни еще менее кто либо из участников войны) не имел ни малейшего чаяния. Теперь нам ясно, что было в 1812 м году причиной погибели французской армии. Никто не станет спорить, что причиной погибели французских войск Наполеона было, с одной стороны, вступление их в позднее время без приготовления к зимнему походу в глубь России, а с другой стороны, характер, который приняла война от сожжения русских городов и возбуждения ненависти к врагу в русском народе. Но тогда не только никто не предвидел того (что теперь кажется очевидным), что только этим путем могла погибнуть восьмисоттысячная, лучшая в мире и предводимая лучшим полководцем армия в столкновении с вдвое слабейшей, неопытной и предводимой неопытными полководцами – русской армией; не только никто не предвидел этого, но все усилия со стороны русских были постоянно устремляемы на то, чтобы помешать тому, что одно могло спасти Россию, и со стороны французов, несмотря на опытность и так называемый военный гений Наполеона, были устремлены все усилия к тому, чтобы растянуться в конце лета до Москвы, то есть сделать то самое, что должно было погубить их. В исторических сочинениях о 1812 м годе авторы французы очень любят говорить о том, как Наполеон чувствовал опасность растяжения своей линии, как он искал сражения, как маршалы его советовали ему остановиться в Смоленске, и приводить другие подобные доводы, доказывающие, что тогда уже будто понята была опасность кампании; а авторы русские еще более любят говорить о том, как с начала кампании существовал план скифской войны заманивания Наполеона в глубь России, и приписывают этот план кто Пфулю, кто какому то французу, кто Толю, кто самому императору Александру, указывая на записки, проекты и письма, в которых действительно находятся намеки на этот образ действий. Но все эти намеки на предвидение того, что случилось, как со стороны французов так и со стороны русских выставляются теперь только потому, что событие оправдало их. Ежели бы событие не совершилось, то намеки эти были бы забыты, как забыты теперь тысячи и миллионы противоположных намеков и предположений, бывших в ходу тогда, но оказавшихся несправедливыми и потому забытых. Об исходе каждого совершающегося события всегда бывает так много предположений, что, чем бы оно ни кончилось, всегда найдутся люди, которые скажут: «Я тогда еще сказал, что это так будет», забывая совсем, что в числе бесчисленных предположений были делаемы и совершенно противоположные.
wiki-org.ru
Автопротолиз воды
 Наличие водородных связей в жидкой воде объясняет еще одно интересное и важное свойство этого вещества – ее автопротолиз.
Наличие водородных связей в жидкой воде объясняет еще одно интересное и важное свойство этого вещества – ее автопротолиз.
Рассмотрим, что происходит с двумя молекулами воды, связанными водородной связью.
За счет тепловых колебаний атом водорода, образующий водородную связь, может на мгновение занять промежуточное положение между атомами кислорода.
Из частицы с таким атомом водорода с равной вероятностью могут образоваться как исходные молекулы воды, связанные водородными связями, так и два иона: гидроксид-ион и ион оксония:

То есть, в воде протекает реакция 2Н2О = Н3О + ОН
+ ОН .
.
Также легко происходит и обратный процесс – образование двух молекул воды при столкновении иона оксония с гидроксид-ионом: Н3О + ОН
+ ОН = 2Н2О.
= 2Н2О.
Обе эти реакции протекают в воде постоянно и с равной скоростью, следовательно, в воде существует равновесие: 2Н2О AН3О + ОН
+ ОН .
.
Это равновесие называется равновесием автопротолиза воды.
|
Автопротолиз –обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой. |
Прямая реакция этого обратимого процесса эндотермична, поэтому при нагревании автопротолиз усиливается, при комнатной же температуре равновесие сдвинуто влево, то есть концентрация ионов Н3О и ОН
и ОН ничтожны. Чему же они равны?
ничтожны. Чему же они равны?
По закону действующих масс
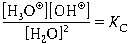
Но из-за того, что число прореагировавших молекул воды по сравнению с общим числом молекул воды незначительно, можно считать, что концентрация воды при автопротолизе практически не изменяется, и [h3O]2 = const. Тогда
[h4O ][OH
][OH ] = KC· [h3O]2.
] = KC· [h3O]2.
Произведение KC· [h3O]2 – величина постоянная. Она называется константой автопротолиза воды (устаревшее название – ионное произведение воды) и обозначается  или К(Н2О).
или К(Н2О).
Как и константа равновесия, константа автопротолиза воды зависит от температуры. Экспериментально установлено, что при 25 °С константа автопротолиза воды
 = 10–14 моль2/л2.
= 10–14 моль2/л2.
Отсюда следует, что при этих условиях в чистой воде
с(Н3О ) = с(ОН
) = с(ОН ) = 10–7 моль/л.
) = 10–7 моль/л.
При увеличении температуры значение константы автопротолиза воды несколько возрастает.
Такая низкая концентрация разноименно заряженных ионов в чистой воде объясняет, почему эта жидкость, хоть и плохо, но все же проводит электрический ток.
АВТОПРОТОЛИЗ ВОДЫ, КОНСТАНТА АВТОПРОТОЛИЗА (ИОННОЕ ПРОИЗВЕДЕНИЕ) ВОДЫ.
Ионное произведение жидкого аммиака (температура кипения –33 °С) равно 2·10–28. Составьте уравнение автопротолиза аммиака. Определите концентрацию ионов аммония в чистом жидком аммиаке. Электропроводность какого из веществ больше, воды или жидкого аммиака?
znaew.ru


















