Свойства, применение и хранение водного аммиака. Свойства аммиачная вода
Аммиачная вода (водный аммиак) | справочник Пестициды.ru
Физические и химические свойства
– раствор аммиака в воде, прозрачная жидкость, иногда с желтоватым оттенком. Имеет резкий запах.Физические характеристики
- Плотность 18,5–25%-ного раствора – 0,930–0,910 г/см3 при +15°C.
- Парциональное давление паров аммиака – 0,1 МПа (при +40°C).
- Температура выпадения твердой фазы – от –31,3 до –53,9°C.[7]
Аммиачная вода содержит до 30 % аммиака, то есть 24,6 % азота и 70 % воды. При температуре ниже +21,10°C не повышает давление, а при увеличении температуры лишь слегка повышает его. Один литр аммиачной воды весит 888 г и содержит 220 г азота.[8]
Соединение вызывает коррозию цветных металлов (цинка, олова и меди) и их сплавов (латуни, бронзы). Черные металлы и чугун устойчивы к воздействию водного аммиака. Резина и алюминий аммиачной водой не повреждаются.[9]
Аммиак может улетучиваться из аммиачной воды, чем объясняется потеря азота при перевозке, хранении и внесении.[1]
Применение аммиачной воды
Выпускается две марки аммиачной воды:
- А – для различных отраслей промышленности
- Б – для сельского хозяйства в качестве азотного удобрения.[2] (в данный момент отствует в списке разрешенных к применению).
Сельское хозяйство
Аммиачная вода вносится при основном приеме под зяблевую вспашку, а весной – под предпосевную культивацию, а также для подкормки пропашных культур.[4]
Зарегистрированые и допущеные к использованию на территории России, в качестве удобрения, марки суперфоски находятся в таблице справа.[3]
Промышленность
Аммиачная вода используется в химической промышленности для производства азотных удобрений, азотной кислоты, полимеров, соды, взрывчатых веществ, при производстве красителей, в электролитическом производстве Mn, ферросплавов. В холодильной технике это вещество применяется в качестве хладагента, а при производстве кормов – для их аммонизации.[7]
Медицина
Аммиачная вода в 10%-ной концентрации известна под названием нашатырный спирт, широко применяющийся в медицине.[7]
Поведение в почве
При внесении аммиачной воды в почву аммиак адсорбируется почвенными коллоидами, поэтому его передвижение незначительно. Впоследствии аммиачный азот нитрифицируется, приобретает большую степень подвижности и мигрирует с почвенным раствором.[9]
Внесение аммиачной воды повышает количество почвенных микроорганизмов, поскольку аммиак увеличивает количество растительных остатков, которыми питаются микроорганизмы. При этом непосредственно после внесения удобрения в почву в зоне его распространения наблюдается уменьшение количества почвенных микроорганизмов. После превращения аммиака в нитраты (это происходит весной за шесть недель) микроорганизмы сразу же размножаются в удобренной почве. Аммиачная вода убивает и дождевых червей. Однако их количество тоже быстро восстанавливается и даже увеличивается после превращения аммиака в нитраты или поглощения его растениями.[8]
Аммиачная вода подкисляет почву. Для нейтрализации 1 ц аммиачной воды требуется 0,3–0,4 ц карбоната кальция.[1]
Применение на различных типах почв
Аммиачная вода рекомендуется к применению на всех типах почв. Высокая эффективность удобрения наблюдается на тяжелых высокогумусированных и хорошо обработанных почвах, где аммиак поглощается лучше, чем на легких почвах, бедных гумусом. Из почв легкого механического состава и сухих аммиак улетучивается быстрее.
Наибольший эффект от внесения аммиачной воды наблюдается при одновременном внесении с ней органических удобрений. Не рекомендуется вносить аммиачные удобрения на одном участке подряд несколько лет, поскольку они усиливают минерализацию органического вещества почвы, а это приводит к снижению содержания органики в почве.[1]
На связных почвах аммиачную воду рекомендуют вносить осенью как основное удобрение практически под все культуры при температуре почвы +10°C или весной перед посевом. На почвах легкого гранулометрического состава аммиачная вода вносится весной.[1]
Сельскохозяйственная техника для внесения водного амиакаСельскохозяйственная техника для внесения водного амиака

Использовано изображение:[10]
Способы внесения аммиачной воды
Как и все жидкие азотные удобрения, аммиачную воду вносят с глубокой заделкой. Глубина тем больше, чем легче гранулометрический состав почвы и выше сухость.
Аммиачную воду вносят с помощью специальных машин, (фото) обеспечивающих немедленную заделку удобрения на глубину не менее 10–12 см на тяжелых почвах и 14–18 см на почвах легкого состава. Такая глубина предохраняет аммиак от испарения. Некоторые потери возможны на сильнокарбонатных почвах со щелочной реакцией.
Поверхностное внесение аммиачной воды, как и ее мелкая заделка в сухой верхний слой почвы, недопустимы.[9]
Аммиачная вода вносится и с поливной водой (фертигация) при поверхностном орошении. Однако в этом случае почва участка обеспечивается аммиаком неравномерно. Недостатком данного способа является и возможность испарения большого количества аммиака в воздух при жаркой, солнечной погоде.[8]
Влияние на сельскохозяйственные культуры
Аммиачная вода является одним из основных источников азота для растений, поскольку растения лучше всего усваивают нитраты и соли аммония. Аммиак из аммиачной воды легко поглощается почвенными коллоидами, что делает легкодоступными для питания растений катионы аммония и нитрат-ионы.[1]
Внесение аммиачной воды в качестве основного удобрения обеспечивает растения азотом на весь вегетационный период и, в частности, на период их максимального потребления. Это обеспечивает получение высоких и устойчивых урожаев всех культур с улучшенным качеством продукции, а также сохранение и воспроизводство почвенного плодородия.[5]
Получение
Аммиачную воду получают путем поглощения газообразного аммиака водой под давлением в две атмосферы.[6]
При написании статьи, также использовались:[3]
Статья составлена с использованием следующих материалов:
Литературные источники:
1.Вильдфлуш И.Р., Кукреш С.П., Ионас В.А. Агрохимия: Учебник – 2-е изд., доп. И перераб. – Мн.: Ураджай, 2001 – 488 с., ил.
2.ГОСТ 9 – 92 Аммиак водный технический. Издание официальное. Дата введения 01.01.93
3.Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, 2013 год. Министерство сельского хозяйства Российской Федерации (Минсельхоз России)
4.Минеев В.Г. Агрохимия: Учебник.– 2-е издание, переработанное и дополненное.– М.: Издательство МГУ, Издательство «КолосС», 2004.– 720 с., [16] л. ил.: ил. – (Классический университетский учебник).
5.Мязин Н.Г. Система удобрения: учебное пособие. – Воронеж: ФГОУ ВПО ВГАУ, 2009.- 350 с
6.Позин М.Е и др. Технология минеральных солей (удобрений, пестицидов, промышленных солей, окислов и кислот), ч1, издание 4-е исправленное, Л., Издательство Химия, 1974 – 798 стр.
7.Химическая энциклопедия: в пяти томах: т.1: А-Дарзана/Редкол.: Кнунянц И.Л. (гл. ред.) и др. – М.: Советская энциклопедия, 1988. – 623.: ил
8.Эндрюс Ю.Б. Применение органических и минеральных удобрений (на разных почвах и под разные культуры). Перевод с английского Т.Л. Чебановой Под редакцией и предисловием академика ВАСХНИЛ проф. Н.С. Соколова. – М.: Издательство иностранной литературы, 1959 г. – 402с.
9.Ягодин Б.А., Жуков Ю.П., Кобзаренко В.И. Агрохимия / Под редакцией Б.А. Ягодина.– М.: Колос, 2002.– 584 с.: ил (Учебники и учебные пособия для студентов высших учебных заведений).
Изображения (переработаны):
10.Fertilization, by Howard F. Schwartz, Colorado State University, Bugwood.org, по лицензии CC BY
www.pesticidy.ru
Аммиачная вода: получение, формула, применение
Бесцветный газ с резким запахом аммиак Nh4 не только хорошо растворяется в воде с выделением тепла. Вещество активно взаимодействует с молекулами h3O с образованием слабой щелочи. Раствор получил несколько названий, одно из них — аммиачная вода. Соединение обладает удивительными свойствами, которые заключаются в способе образования, составе и химических реакциях.
Образование иона аммония
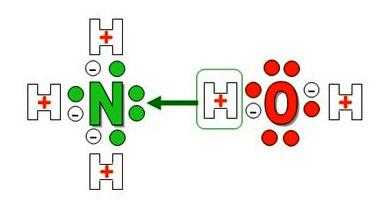 Формула аммиачной воды — Nh5OH. В составе вещества присутствует катион Nh5+, который образован неметаллами – азотом и водородом. Атомы N в молекуле аммиака используют для образования ковалентных полярных связей только 3 из 5 внешних электронов, а одна пара остается невостребованной. В сильно поляризованной молекуле воды протоны водорода H+ слабо связаны с кислородом, один из них становится донором свободной электронной пары азота (акцептора).
Формула аммиачной воды — Nh5OH. В составе вещества присутствует катион Nh5+, который образован неметаллами – азотом и водородом. Атомы N в молекуле аммиака используют для образования ковалентных полярных связей только 3 из 5 внешних электронов, а одна пара остается невостребованной. В сильно поляризованной молекуле воды протоны водорода H+ слабо связаны с кислородом, один из них становится донором свободной электронной пары азота (акцептора).
Образуется ион аммония с одним положительным зарядом и особым типом слабой ковалентной связи – донорно-акцепторной. По своим размерам, заряду и некоторым другим особенностям он напоминает катион калия и ведет себя подобно щелочным металлам. Необычное в химическом плане соединение реагирует с кислотами, образует соли, имеющие важное практическое значение. Названия, в которых отражены особенности получения и свойства вещества:
- аммиачная вода;
- гидроксид аммония;
- гидрат аммиака;
- едкий аммоний.
Меры предосторожности
Необходимо соблюдать осторожность при работах с аммиаком и его производными. Важно помнить:
- Аммиачная вода имеет неприятный запах. Выделяющийся газ раздражает слизистую поверхность носовой полости, глаз, вызывает кашель.
- При хранении нашатырного спирта в неплотно закрытых флаконах, ампулах выделяется аммиак.
- Можно обнаружить без приборов, только по запаху даже небольшое количество газа в растворе и воздухе.
- Соотношение между молекулами и катионами в растворе изменяется при разных рН.
- При значении около 7 снижается концентрация токсичного газа Nh4, увеличивается количество менее вредных для живых организмов катионов Nh5+
Получение гидроксида аммония. Физические свойства
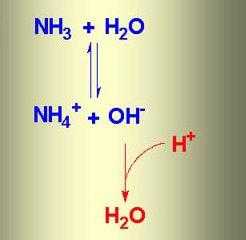
При растворении аммиака в воде образуется аммиачная вода. Формула этого вещества – Nh5OH, но на самом деле одновременно присутствуют ионы
Nh5+, OH–, молекулы Nh4 и h3O. В химической реакции ионного обмена между аммиаком и водой устанавливается равновесное состояние. Процесс можно отразить с помощью схемы, на которой противоположно направленные стрелочки указывают на обратимость явлений.
В лаборатории получение аммиачной воды проводят в опытах с азотосодержащими веществами. При смешивании аммиака с водой получается прозрачная бесцветная жидкость. При высоких давлениях растворимость газа увеличивается. Вода больше отдает растворенный в ней аммиак при повышении температуры. Для производственных нужд и сельского хозяйства в промышленных масштабах получают 25-процентное вещество при растворении аммиака. Второй способ предусматривает использование реакции коксового газа с водой.
Химические свойства гидроксида аммония
При соприкосновении две жидкости — аммиачная вода и соляная кислота - покрываются клубами белого дыма. Он состоит из частиц продукта реакции – хлорида аммония. С таким летучим веществом, как соляная кислота, реакция происходит прямо в воздухе.

Слабо-щелочные химические свойства гидрата аммиака:
- Вещество обратимо диссоциирует в воде с образованием катиона аммония и гидроксид-иона.
- В присутствии иона Nh5+ бесцветный раствор фенолфталеина окрашивается в малиновый цвет, как в щелочах.
- Химическая реакция нейтрализации с кислотами приводит к образованию солей аммония и воды: Nh5OH + HCl = Nh5Cl + h3O.
- Аммиачная вода вступает в реакции ионного обмена с солями металлов, которым соответствуют слабые основания, при этом образуется нерастворимый в воде гидроксид: 2Nh5OH + CuCl2 = 2Nh5Cl + Cu(OH)2 (синий осадок).
Аммиачная вода: применение в разных отраслях хозяйства
Необычное вещество широко используется в быту, сельском хозяйстве, медицине, промышленности. Технический гидрат аммиака применяется в сельском хозяйстве, производстве кальцинированной соды, красителей и других видов продукции. В жидком удобрении азот содержится в легкоусвояемой растениями форме. Вещество считается наиболее дешевым и эффективным для внесения в предпосевной период под все сельскохозяйственные культуры.

На производство аммиачной воды затрачивается в три раза меньше средств, чем на выпуск твердых гранулированных азотных удобрений. Для хранения и транспортировки жидкости применяются герметически закрытые цистерны из стали. Некоторые виды красок и средств для обесцвечивания волос производятся с использованием едкого аммония. В каждом медицинском учреждении есть препараты с нашатырным спиртом - 10-процентным раствором аммиака.
Соли аммония: свойства и практическое значение
Вещества, которые получают при взаимодействии гидроксида аммония с кислотами, используются в хозяйственной деятельности. Соли разлагаются при нагревании, растворяются в воде, подвергаются гидролизу. Они вступают в химические реакции со щелочами и другими веществами. Наиболее важное практическое значение приобрели хлориды, нитраты, сульфаты, фосфаты и карбонаты аммония.
Очень важно соблюдать правила и меры безопасности, проводя работы с веществами, в составе которых есть ион аммония. При хранении на складах промышленных и сельскохозяйственных предприятий, в подсобных хозяйствах не должно быть соприкосновения таких соединений с известью и щелочами. Если нарушится герметичность упаковок, то начнется химическая реакция с выделением ядовитого газа. Каждый, кому приходится работать с аммиачной водой и ее солями, обязан знать основы химии. При соблюдении требований техники безопасности используемые вещества не принесут вреда людям и окружающей среде.
fb.ru
Аммиачная вода/водный аммиак для растений, удобрение, применение
Аммиачная вода представляет собой водный раствор аммиака Nh5 для технических целей. От медицинского нашатырного спирта отличается неглубокой очисткой и большей концентрацией – 25% вместо 10%. В агротехнике больших площадей применяется механизированным способом преим. на монокультуре зерновых под зяблевую вспашку, см. рис. справа, как безбалластное азотное моноудобрение. В таком случае сказываются след. преимущества аммиачной воды как удобрения:
- Стоимость единицы массы активного вещества в 1,5-2 раза меньше, чем у самой дешевой селитры.
- Возможно и экономически оправдано ведение конкурентоспособного высокомеханизированного хозяйства.
- Отпадает необходимость в штатных единицах, производственных площадях и оборудовании для приготовления баковых и рабочих растворов – аммиачная вода представляет собой готовое удобрение.
- Резко снижается потребность почвы во влаге для преобразования аммонийной формы азота в нитратную, усваиваемую растениями, что особенно важно в засушливых местах с малоснежной зимой.
Только ли плюсы?
Однако в настоящее время использование аммиачной воды в агротехнике неуклонно сокращается. Причина – водный аммиак вне герметически закрытой емкости активно выделяет газообразную составляющую, в больших концентрациях губительную для всего живого. Поскольку нитрификация в почве (см. далее) происходит не мгновенно, регулярная обработка аммиачной водой уничтожает почвенные микроорганизмы. Земля, будучи и насыщенной питательными веществами, превращается в мертвое или полумертвое образование, но стабильную урожайность может обеспечить только биоценоз живой почвы и растительного покрова на ней.
Яркий пример отдаленных последствий погони за кратковременной выгодой – агротехника бывшего СССР. С площадей, в 60-е – 70-е дававших урожаи по 60-70 ц/га ценного и твердого зерна, ныне удается снимать по 9-14 ц/га фуражного. В РФ в настоящее время аммиачная вода выведена из списка разрешенных к применению удобрений, но пока остается в перечне допущенных. Ее использование все еще практикуется, однако в силу условий мирового рынка продовольствия все более уступает агрикультуре, основанной на поддержании плодородия живой почвы. По такому же пути идут ведущие сельскохозяйственные государства и регионы.

Внесение аммиачной воды в почву под зябь механизированным способом
В настоящее время стабильно широкое использование аммиачной воды в агротехнике имеет место только в США и на Украине. В первом случае сказывается насыщенность продовольственного рынка: малейшее снижение рентабельности делает фермерские хозяйства убыточными. Продуктивность почвы поддерживается, как в свое время в СССР, насыщением их минеральными удобрениями и централизованным вмешательством государства – компьютерным мониторингом сельхозугодий, дотациями на удобрения и т.п. Но земля при этом превращается просто в субстрат, экологичность продукции с которого оставляет желать много лучшего, и агротехника США не последняя из причин, по которой Америка не в состоянии была подписать Киотские соглашения по климату и оказалась вынуждена отказаться от Парижских.
Примечание: земляных червей для любительской рыбалки в США приходится покупать в спецмагазинах или хозяйствах, ведущих вермикультуру. Накопать самому нереально – свободная от использования земля или частная, или охраняемая, или червяков в ней просто нет.
Тем не менее, применение аммиачной воды в частных хозяйствах может быть безвредно и вполне оправдано в засушливых местностях либо в годы с сухой осенью и/или малоснежной зимой. Удобрения, содержащие готовые нитраты (селитры, нитрофос, нитрофоска) в таких условиях к весне теряют большую часть активного азота; почва, обработанная аммиачной водой, хранит его до тех пор, пока до него не доберутся корни растений.
Показания к применению
Нитрификация происходит в присутствии влаги. В водном аммиаке ее вдоволь. Внесенный в мало увлажненную землю, он жадно поглощается почвенными коллоидами. В них же азот переходит из аммиачной формы в нитратную, прочно удерживаемую коллоидными конгломератами до весеннего тепла и влаги; свободные нитраты из минеральных удобрений весной активно мигрируют и сильно вымываются, прежде чем коллоидные образования активизируются и успеют их связать. Таким образом, аммиачная вода в условиях осенне-зимнего недостатка влаги представляет собой удобрение замедленного действия, активация которого инициируется условиями, оптимальными для начала вегетации растений. Вред свободного аммиака для почвенной микрофлоры в таком случае минимален, т.к. на зиму почвенные организмы или уходят в глубину, или приобретают стойкие зимовочные формы – споры, цисты, коконы и др. К весне свободный аммиак улетучивается и нейтрализуется.
Примечание: на легких проницаемых почвах аммиак как удобрение лучше использовать в составе карбамидно-аммиачной смеси (КАС), см. далее.
Формула и химия
Полезные качества аммиачной воды на участке могут быть реализованы только при правильном ее использовании. В общем дачники и мелкие хозяева применяют аммиачную воду как и нашатырный спирт, только дозы препарата в рабочий раствор дают в 2,5 раза меньшие, см. напр. видео:
Видео: применение аммиака (нашатырного спирта) в огороде
Однако возможно и более эффективное использование аммиачной воды для растений. Производить его нужно грамотно, чтобы спустя несколько лет или даже по весне не ломать голову – что делать с убитой почвой. Так что ознакомимся вначале подробнее, что же это такое – аммиачная вода?
Химическая формула водного раствора аммиака не просто (Nh4)h3O. Растворяясь в воде, аммиак образует с ее молекулами т. наз. водородные связи, см. рис. ниже. Молекулярный азот N2 химически весьма инертен – им наполняют дешевые лампы накаливания. Но атомарный азот весьма активен и пытается «отодрать» ион водорода от ближайшей молекулы воды. Полностью ему это не удается – кислород химические еще активнее – но обе молекулы оказываются связаны; «спорный» ион водорода как бы принадлежит ими обеим. Вполне человеческая аналогия – единственный ребенок супружеской пары в процессе ее развода.
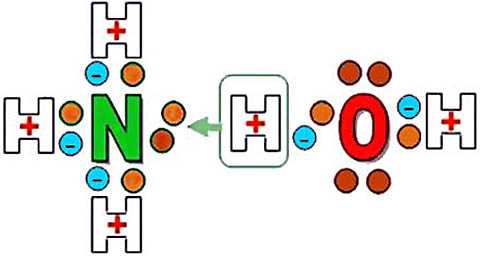
Схема образования водородной связи между молекулами воды и аммиака
Водородная связь много слабее ионной и ковалентной, поэтому такие «спарки» легко распадаются. Раствор при этом выделяет газообразный аммиак. Разрыву водородных связей способствует повышение температуры и открытая поверхность раствора. В закрытом сосуде при +20 градусах в состав раствора входит одна связанная молекула аммиака на 250 свободных, а парциальное давление его паров составляет при нуле градусов составляет прим. 0,07 МПа. При +50 парциальное давление повышается до прим. 0,4 атмосферного. Если теперь открыть сосуд, то большая часть азота «пыхнет» и улетучится в виде аммиачных паров.
Указанные свойства аммиачной воды определяют ее «замедленность» как удобрения. Связанные водородной связью молекулы проявляют свойства иона амммония Nh5+ и поэтому легко нитрифицируются до питательных нитратных NO3+. Если выход аммония Nh5+ из раствора невысок, то по законам химического равновесия его состав сдвигается в сторону образования (Nh4)h3O. Если же Nh5+ активно поглощается почвенными коллоидами, равновесие сдвигается в направлении (Nh4)h3O –> (Nh5+)(OH–), пока коллоидные агломераты не насытятся им. При дальнейшем падении наружной температуры нитрификаторы «засыпают», а весной при ее повышении отдают обратно в почву уже нитраты NO3+. Скорость выделения нитратов растет с повышением температуры примерно так же, как и скорость усвоения их растениями. Это ценное качество, которым обладают также значительно менее доступные органические удобрения. Отсюда следуют важные для сельскохозяйственной практики выводы:
- Внесение аммиачной воды в почву под вегетирующими растениями недопустимо – сгорят с корнями;
- Также недопустимо превышение норм внесения – почвенная микрофауна и микрофлора может быть убита сразу же;
- Приготовление рабочего раствора путем разбавления продажного неэффективно: количество связок (Nh5+)(OH–) в растворе от этого не увеличится, а доступность Nh5+ для почвенных нитрификаторов только падает;
- Работать с аммиачной водой на участке нужно при температуре не выше +10 (в крайнем случае +13) с использованием СИЗ. Нашатырный спирт нюхали?
- Ионы аммония химически весьма активны. Черные металлы взаимодействуют с ними слабо. Химически инертные пластики (полиэтилен, полиизопрпопилен) вообще не реагируют, но цветные металлы разрушаются ионами аммония буквально на глазах;
-

Как не надо поливать почву аммиачной водой
Аммиачная вода сразу не замерзает. Температура начала выпадения из нее твердой фазы ниже –30 градусов. Парциальное давление паров аммиака над его раствором в воде остается достаточно высоким и при нуле градусов. Поэтому полив аммиачной водой так, как показано на рис. справа, бесполезен, даже если сразу же заворачивать грунтом канавки. Водный аммиак вносится в почву или культиватором на глубину 10-5 см подачей через капилляр, или методом фертигации, см. далее.
- Внесение аммиачной воды сильно закисляет почву, поэтому спустя неделю после ее применения нужно произвести нейтрализацию известкованием. На ведро (12 л) использованной аммиачной воды по той же площади вносят 3-4 кг известковой муки. Не доломитовой – нейтрализует карбонат кальция!
Формы выпуска и свойства

Продажные формы выпуска аммиачной воды
25% аммиачная вода прозрачная жидкость плотностью 910 г/куб. дм с резким запахом. Содержит 20,5% активного азота (без учета улетучивания газообразного аммиака в процессе использования раствора). Вес 1 л 25% водного аммиака 0,88 кг; из них на азот приходится 0,22 кг. До температуры ок. 50 градусов Цельсия парциальное давление газообразного аммиака в закрытом сосуде повышается медленно, и поэтому до наружной температуры 43 градуса (для гарантии) аммиачная вода может храниться в герметичной упаковке обычной прочности. Раствор и пары токсичны, разъедают слизистые. Симптомы отравления: тошнота, головокружение, потеря ориентации, кашель, резкие боли в области живота, удушье. Меры первой помощи: покой, свежий воздух, немедленная госпитализация.
Водный аммиак выпускается марок А и Б. Обе формы – бесцветная жидкость, см. рис. справа. Для марки Б допустим желтоватый оттенок, но и она может быть совершенно прозрачной. К использованию в агротехнике допущена только марка Б, но отличить бесцветную марку Б от такой же марки А на вид и по запаху невозможно. Поэтому, приобретая препарат, убедитесь, что на упаковке значится «Марка Б», указан химический состав продукта и он соответствует приведенному в табл.:
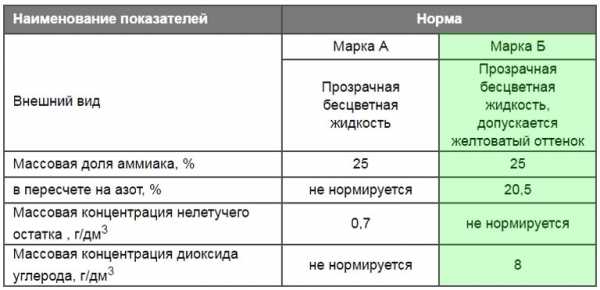
Химический состав аммиачной воды марок А и Б
Примечание: хранение аммиачной воды затруднено и в условиях большого промышленного хозяйства. Водный аммиак в мелкой расфасовке после вскрытия тары хранению не подлежит и должен быть использован весь сразу.
Порядок и нормы внесения
Как указано выше, длительное систематическое внесение аммиачной воды губит естественный почвенный биоценоз. Полученный таким образом субстрат поддается рекультивации медленно и с большими затратами. Поэтому применять аммиачную воду для растений настоятельно рекомендуется эпизодически в след. случаях:
- При остром недостатке медленно нитрифицирующихся органических удобрений: навоза, компоста, перегноя;
- В аномально сухие годы;
- После аномально малоснежной и ветреной зимы.
В первых 2-х случаях аммиачная вода вносится осенью после уборки урожая и оголения почвы. Вносить нужно в период, когда дневная температура не выше +13 градусов, среднесуточная не более +10, а ночная не опускается ниже 0. Последнее условие важно, т.к. при температуре замерзания воды и ниже почвенные нитрификаторы «засыпают». Химическое равновесие в растворе сдвигается в сторону (Nh4)h3O, и свободный аммиак отравляет почву вместо того, чтобы преобразоваться в нитраты. Обработку проводят ближе к вечеру, чтобы меньше азота выделялось в летучем аммиачном виде.
То же самое имеет место на легких проницаемых почвах, поэтому аммиак в них нужно вносить в составе карбамидно-аммиачной смеси (КАС). Она содержит все 3 формы активного азота: нитратную, аммонийную и амидную. КАС вносится весной. Температурные условия те же, что и в пред. случае, но ждать нужно уже не понижения, а повышения температуры. КАС действует ступенчато: ее нитраты сразу идут на питание растений. Взамен использованным по законам химического равновесия нитрифицируются аммонийные, а их таким же образом замещают амидные. Недостаток у КАС всего один – дороговизна.
Аммиачная вода в средние и тяжелые почвы вносится весной после иссушающей зимы. Температурные условия те же. Посев и посадка растений допускаются не ранее недели после весеннего внесения аммиачной воды. Если есть вероятность следующей ветреной сухой зимы, то в теплый сезон обязательно принимаются меры по рекультивации почвы: внесение в нее перегноя, компоста, гуматов в сочетании с достаточным поливом. Нет таких возможностей – лучше примириться с невысоким урожаем, чем рисковать угробить землю надолго.
Нормы и способы обработки
Благодаря плавному медленному действию дозировка аммиачной воды несложна: 0,4-0,5 кг на сотку для пропашных культур, 0,5-0,6 кг/сотка для овощных и травянистых ягодных и 60-70 г/10 кв. м приствольного круга или междурядья для кустарников и деревьев. В общем, если на малых участках вносить по бутылке 0,5 л на сотку, то худа не будет. Под пропашные и овощи водный аммиак вносится культиватором с дозатором на глубину 10 см на тяжелых почвах, 15 см на средних и 25-30 см на легких. Шаг борозд (расстояние между ними) 25-30 см. Если используется культиватор с 2-мя и более сошниками, расстояние между ними должно быть не менее 25 см. Больше – не страшно. Пропускная способность дозатора устанавливается исходя из скорости перемещения культиватора; при передвижении пешком за мотоблоком – 3 км/ч или 0,8 м/с.Под деревья и кустарниковые насаждения аммиачную воду удобнее вносить методом подпочвенного орошения или фертигации. Инжектор-фертигатор можно сделать своими руками из воронки, к которой приспособлена трубка из прочного химически стойкого материала, напр. нержавеющей стали, монолитного поликарбоната или акрилового пластика. Длина трубки – 35 см. Ее нижний конец заглушается заостренной пробкой. Выше пробки на 5 см вверх сверлятся 12 отверстий диаметром 2-2,5 мм. Располагаются они 4-мя вертикальными рядами по 3 в ряду; ряды распределяются равномерно по окружности.
Для использования устройства сначала по площади приствольных кругов определяют расход раствора. В порядке пользования делают не менее 6 инъекций в приствольный круг, распределяя их равномерно по его площади. В воронку каждый раз вливают часть отмеренной дозы так, чтобы вся она распределилась равномерно. Инжектор погружают в грунт на глубину, соответствующую почве, см. выше. При фертигации кустарников инъекции делают в междурядья с шагом 25-60 см не ближе 25 см к кустам.
Вывод
Аммиачную воду в качестве заменителя нашатырного спирта в небольших агрохозяйствах применяют более в качестве инсектицида в составе средств от вредителей. Дозировку при этом уменьшают в 2,5 раза: вместо аптечного пузырька на 10 мл дают 4 мл; вместо 25 мл нашатырного спирта 10 мл аммиачной воды.
Однако против тли результаты оказываются нестабильны и сомнительны. Во всяком случае, пока не изведешь на участке муравьев, от тли не избавишься. Более-менее эффективен аммиачный азот как средство против вредителей клубники, см. ролик:
Видео: аммиачный раствор как удобрение и против вредителей клубники
Что же касается азотного удобрения аммиачной водой – систематически не надо. Кратковременный эффект будет, но потом затраты на агрохимию резко возрастут, а стабильность урожайности упадет, и на малых площадях ждать этого придется не полвека, а считанные годы.
Внесение аммиачной воды в почву может выручить на следующий год после аномально жаркого и сухого. Но в таком случае обязательно постарайтесь обеспечиться на него же поливной водой, хотя бы верховой из скважины. Также обязательно найдите место для компостной кучи или ящика, с весны начинайте его заполнять и готовить компост одного сезона – земле для поддержания жизнеспособности после «аммиачного удара» потребуется полноценное питание.
udobreniya.info
Свойства, применение и хранение водного аммиака
Класс химии есть в каждой школе, каждом вузе и большинстве учебных заведений. Водный аммиак - одно из веществ, которым необходимо оснастить подобный кабинет. Рассмотрим подробнее, что это такое.
Бинарное соединение азота и водорода, химическая формула которого выглядит так: Nh4, является важнейшим из водородных соединений азота и называется аммиаком. Всего насчитывается несколько известных соединений водорода с азотом.
Водный аммиак – прозрачная жидкость, представляющая не что иное, как раствор аммиака в воде, имеющая очень резкий запах нашатыря. Другое название раствора, который иногда может иметь желтоватый оттенок – аммиачная вода.
Виды:
- аммиак технический жидкий;
- водный технический аммиак;
- водный ЧДА.
Химические свойства аммиака
Во время химических реакций во многих случаях, благодаря имеющейся в составе неделимой электронной пары, аммиак выступает в роли комплексообразователя. По-другому это называется основание Бренстеда. Аммиак относится к ряду реакционноспособных соединений. За счет имеющейся в наличии той же неподеленной электронной пары (у атома азота N), для аммиака реакции присоединения являются особенно характерными. Они являются также и легко осуществимыми.
Получение водного аммиака
Немецкий физик открыл физико-химическую основу метода получения аммиака в промышленности. Его именем и назван этот метод – процесс Габера. Этот промышленный способ получения аммиака основан на прямой реакции взаимодействия двух химических элементов: водорода и азота. Формула получения данного соединения при высокой температуре и давлении, с использованием катализатора, выглядит следующим образом:
N2 + 3h3 = 2Nh4
Для того чтобы процесс получения аммиака по формуле прошел успешно, должны быть соблюдены следующие условия:
- температура – 500 градусов по Цельсию;
- давление – 350 атмосфер;
- при использовании катализатора выход аммиака составляет 3%.
В процессе реакции происходит выделение тепла и понижение объема. В условиях промышленности чаще используют принцип циркуляции, когда аммиак удаляется, или изымается, охлаждением. Оставшиеся вне реакции азот с водородом отправляются обратно (в колонку синтеза). Этот процесс более экономичен в отличие от аналогичного, с достижением более высокого выхода, с использованием высокого давления.
Применение
Аммиак водный очень широко применяется в химической промышленности, являясь одним из важных продуктов. Ежегодно в мире производится 100 млн. тонн аммиака. Аммиачная вода используется для производства удобрений на основе азота: нитрата и сульфата аммония, мочевины. Также из нее производят азотную кислоту, кальцинированную соду и полимеры. Используется в процессах производства красителей, марганца, ферросплавов, прочих электролитов. Среди прочих азотных удобрений – аммиачная селитра, аммофоска, карбамид. Аммиачную воду используют и для получения некоторых взрывчатых веществ и прочих химпродуктов, в фармацевтической и металлургической промышленности.
Являясь слабым основанием при взаимодействии с кислотами, аммиачная вода оказывает на них нейтрализующее воздействие. Водный аммиак широко используют для холодильной техники и оборудования. Он является хладагентом (R 717), также может применяться в качестве растворителя.
Нашатырный спирт (10% - ный раствор аммиачной воды) нашел широкое применение в медицинской сфере.
Аммиак ЧДА на водной основе служит в медицине в качестве реактива для проведения анализов. Применяют его и в аналитической химии, и на химических заводах для получения чистых химических продуктов.
Аммиачная вода нашла достаточно широкое применение и в сельском хозяйстве в качестве удобрений и для аммонизации кормов в животноводстве.
Хранение и транспортировка
Перевозить аммиачную воду лучше в стеклянной, либо стальной таре. В ней она может и храниться для удобства транспортировки. Жидкий аммиак перевозят в специальных химических цистернах, предназначенных для автомобильного грузового и железнодорожного транспорта, в стальных баллонах и танкерах, а также путем перемещения по трубопроводу.
Температура жидкого аммиака, охлажденного и готового в транспортировке, не должна превышать – 31.5 градус по Цельсию. Измеряется она на фланце, который соединяет трубопровод танкера и загрузочной линии.
Водный аммиак транспортируют в герметичной таре на железнодорожном, автомобильном и водном видах транспорта в соответствии с правилами транспортировки грузов повышенной опасности, действующими на конкретном виде транспортных средств. Цистерны должны быть заполнены на 95%, не более. Люки обязаны пройти пломбировку и должны быть опечатаны.
Аммиак водный подразделяется на два вида. Продукт марки А транспортируют в аммиаковозах и железнодорожных цистернах. Марка Б перевозится в цистернах, имеющих нижний слив, и в аммиаковозах.
Меры предосторожности
При нормальных показателях температуры и атмосферного давления аммиак имеет газообразное состояние и относится к горючим газам. Аммиачный газ может самовоспламениться при температуре 650 градусов Цельсия, минимальная энергия зажигания составляет примерно 680 мДж.
Смесь аммиака и воздуха в соотношении долей 15-28 к 100 взрывоопасна, а жидкий аммиак относится к классу трудногорючих веществ.
Для тушения возгораний жидкого или газообразного аммиака используют автоматические установки пожаротушения, заправляемые водой, негорючим газом или пеной.
Аммиак является токсичным соединением с предельно допустимой концентрацией активного вещества (ПДК) в воздухе рабочих зон производственных помещений 20 мг/м3.
Газообразный аммиак способен вызвать у человека слезотечение и удушье из-за острого раздражения слизистых оболочек горла, носовой и ротовой полости, глаз.
Если струя газа или капля жидкого аммиака попадет на кожу, может получиться сильный ожог. В этом случае область поражения следует немедленно промыть струей проточной холодной воды и наложить примочки (с содержанием 3-5% лимонной или уксусной кислоты).
Если пострадавший надышался воздухом с повышенным содержанием аммиака, ему нужно срочно выйти на свежий воздух, чтобы органы дыхания очистились.
В случае попадания жидкого аммиака на слизистую оболочку глаз, следует быстро промыть глаза струей воды в большом количестве.
Предосторожности при работе с жидким аммиаком
Если ваша работа включает взаимодействие с данным веществом в любом виде, нужно соблюдать правила:
- использовать индивидуальные средства для защиты (противогаз, маску, защитный фартук или костюм;
- руки следует обезопасить от обморожения: надевать утепленные резиновые перчатки;
- для защиты ног зимой на производстве выдаются валенки на резине или войлочные сапоги с резиновой подошвой, летом обуваются резиновые сапоги или другая прорезиненная обувь.
www.vedu.ru
Аммиачная вода: получение, формула, применение
Образование 24 марта 2014Бесцветный газ с резким запахом аммиак Nh4 не только хорошо растворяется в воде с выделением тепла. Вещество активно взаимодействует с молекулами h3O с образованием слабой щелочи. Раствор получил несколько названий, одно из них — аммиачная вода. Соединение обладает удивительными свойствами, которые заключаются в способе образования, составе и химических реакциях.
Образование иона аммония
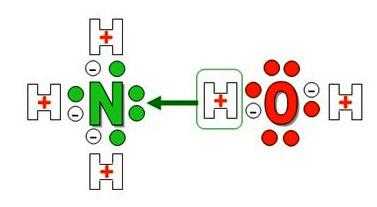 Формула аммиачной воды — Nh5OH. В составе вещества присутствует катион Nh5+, который образован неметаллами – азотом и водородом. Атомы N в молекуле аммиака используют для образования ковалентных полярных связей только 3 из 5 внешних электронов, а одна пара остается невостребованной. В сильно поляризованной молекуле воды протоны водорода H+ слабо связаны с кислородом, один из них становится донором свободной электронной пары азота (акцептора).
Формула аммиачной воды — Nh5OH. В составе вещества присутствует катион Nh5+, который образован неметаллами – азотом и водородом. Атомы N в молекуле аммиака используют для образования ковалентных полярных связей только 3 из 5 внешних электронов, а одна пара остается невостребованной. В сильно поляризованной молекуле воды протоны водорода H+ слабо связаны с кислородом, один из них становится донором свободной электронной пары азота (акцептора).
Образуется ион аммония с одним положительным зарядом и особым типом слабой ковалентной связи – донорно-акцепторной. По своим размерам, заряду и некоторым другим особенностям он напоминает катион калия и ведет себя подобно щелочным металлам. Необычное в химическом плане соединение реагирует с кислотами, образует соли, имеющие важное практическое значение. Названия, в которых отражены особенности получения и свойства вещества:
- аммиачная вода;
- гидроксид аммония;
- гидрат аммиака;
- едкий аммоний.
Меры предосторожности
Необходимо соблюдать осторожность при работах с аммиаком и его производными. Важно помнить:
- Аммиачная вода имеет неприятный запах. Выделяющийся газ раздражает слизистую поверхность носовой полости, глаз, вызывает кашель.
- При хранении нашатырного спирта в неплотно закрытых флаконах, ампулах выделяется аммиак.
- Можно обнаружить без приборов, только по запаху даже небольшое количество газа в растворе и воздухе.
- Соотношение между молекулами и катионами в растворе изменяется при разных рН.
- При значении около 7 снижается концентрация токсичного газа Nh4, увеличивается количество менее вредных для живых организмов катионов Nh5+
Видео по теме
Получение гидроксида аммония. Физические свойства
При растворении аммиака в воде образуется аммиачная вода. Формула этого вещества – Nh5OH, но на самом деле одновременно присутствуют ионы
Nh5+, OH–, молекулы Nh4 и h3O. В химической реакции ионного обмена между аммиаком и водой устанавливается равновесное состояние. Процесс можно отразить с помощью схемы, на которой противоположно направленные стрелочки указывают на обратимость явлений.
В лаборатории получение аммиачной воды проводят в опытах с азотосодержащими веществами. При смешивании аммиака с водой получается прозрачная бесцветная жидкость. При высоких давлениях растворимость газа увеличивается. Вода больше отдает растворенный в ней аммиак при повышении температуры. Для производственных нужд и сельского хозяйства в промышленных масштабах получают 25-процентное вещество при растворении аммиака. Второй способ предусматривает использование реакции коксового газа с водой.
Химические свойства гидроксида аммония
При соприкосновении две жидкости — аммиачная вода и соляная кислота - покрываются клубами белого дыма. Он состоит из частиц продукта реакции – хлорида аммония. С таким летучим веществом, как соляная кислота, реакция происходит прямо в воздухе.
Слабо-щелочные химические свойства гидрата аммиака:
- Вещество обратимо диссоциирует в воде с образованием катиона аммония и гидроксид-иона.
- В присутствии иона Nh5+ бесцветный раствор фенолфталеина окрашивается в малиновый цвет, как в щелочах.
- Химическая реакция нейтрализации с кислотами приводит к образованию солей аммония и воды: Nh5OH + HCl = Nh5Cl + h3O.
- Аммиачная вода вступает в реакции ионного обмена с солями металлов, которым соответствуют слабые основания, при этом образуется нерастворимый в воде гидроксид: 2Nh5OH + CuCl2 = 2Nh5Cl + Cu(OH)2 (синий осадок).
Аммиачная вода: применение в разных отраслях хозяйства
Необычное вещество широко используется в быту, сельском хозяйстве, медицине, промышленности. Технический гидрат аммиака применяется в сельском хозяйстве, производстве кальцинированной соды, красителей и других видов продукции. В жидком удобрении азот содержится в легкоусвояемой растениями форме. Вещество считается наиболее дешевым и эффективным для внесения в предпосевной период под все сельскохозяйственные культуры.
На производство аммиачной воды затрачивается в три раза меньше средств, чем на выпуск твердых гранулированных азотных удобрений. Для хранения и транспортировки жидкости применяются герметически закрытые цистерны из стали. Некоторые виды красок и средств для обесцвечивания волос производятся с использованием едкого аммония. В каждом медицинском учреждении есть препараты с нашатырным спиртом - 10-процентным раствором аммиака.
Соли аммония: свойства и практическое значение
Вещества, которые получают при взаимодействии гидроксида аммония с кислотами, используются в хозяйственной деятельности. Соли разлагаются при нагревании, растворяются в воде, подвергаются гидролизу. Они вступают в химические реакции со щелочами и другими веществами. Наиболее важное практическое значение приобрели хлориды, нитраты, сульфаты, фосфаты и карбонаты аммония.
Очень важно соблюдать правила и меры безопасности, проводя работы с веществами, в составе которых есть ион аммония. При хранении на складах промышленных и сельскохозяйственных предприятий, в подсобных хозяйствах не должно быть соприкосновения таких соединений с известью и щелочами. Если нарушится герметичность упаковок, то начнется химическая реакция с выделением ядовитого газа. Каждый, кому приходится работать с аммиачной водой и ее солями, обязан знать основы химии. При соблюдении требований техники безопасности используемые вещества не принесут вреда людям и окружающей среде.
Источник: fb.ruКомментарии
Идёт загрузка...Похожие материалы
Еда и напитки Деионизированная вода: получение, применение и прогнозыВода – основа не только всех жизненных процессов, но и большинства видов производства. И если для внутреннего применения она должна быть просто очищенной, без бактерий, микроорганизмов и ненужных химических включений, то для промышленных целей требуется таковая, состоящая исключительно из воды, без дополнений в виде посторонних соединений или ионов....
Образование Серная кислота. Формула, свойства, получение и применениеСерная кислота имеет историческое название: купоросное масло. Изучение кислоты началось с древних времен, в своих трудах ее описывали: греческий врач Диоскорид, римский натуралист Плиний Старший, исламские алхимики Гебер, Рази и Ибн Сина, другие. В Шумерах существовал перечень купоросов, которые классифицировались по цвету вещества. В наше время слово &la...
Домашний уют Камень шунгит для очистки воды: отзывы, свойства, применение и эффективностьШунгит для очистки воды, свойства которого с уверенностью можно назвать уникальными, стал применяться достаточно давно. Свое название горная порода, геологический возраст которой превышает 2 млрд лет, получила в чес...
Домашний уют Резервуар для воды. Классификация и применениеРезервуар для воды – это основной и самый удобный метод сохранения, накопления и выдачи запасов питьевой и технической воды. Он используется во многих сферах деятельности человека, в которых требуется запасать и хранить жидкости.
Здоровье Протиевая вода: польза, приготовление, применениеЖизнь зародилась в воде, и все живое без нее существовать не может. В том числе и человек. Наше тело состоит из воды на 70%, а некоторые органы и того больше. В мозге, например, ее около 90 процентов, а в крови – 92! Вода жизненно необходима и для кожи, и для суставов, и для костей. То есть, в ней постоянно нуждается буквально каждая клеточка нашего...
Здоровье Минеральная вода "Славяновская": состав, применение. ЗАО "Минеральные воды Железноводска"Минеральные воды создаёт сама природа. Сочетая в своём составе множество полезных микроэлементов, они оказывают благотворное воздействие на организм человека. А минеральная вода "Славяновская" обладает ещё и лечебными свойствами. Поговорим об этом более подробно.ЗАО "Минеральные воды Железноводска" (ЗАО "МВЖ")Расположено это предприятие не...
Красота Термальная вода "Урьяж" (Uriage): применение, отзывыКогда наступает жаркое лето, то у многих возникает желание оказаться на берегу какого-либо водоёма и ощутить на себе действие приятной прохладной водички. Но далеко не всем удаётся вырваться из каменных городских джунглей и поехать на морское побережье. Поэтому единственным спасением для людей в такой зной может стать термальная вода для лица Uriage. Она ...
Красота «Виши», термальная вода: описание, особенности применения и отзывыБольшинство людей считает, что лучше всего использовать термальную воду летом, когда кожа особенно подвержена вредному воздействию солнечных лучей и только это средство может спасти от удушливой жары. Но такое мнение ошибочно, так как многие специалисты утверждают, что от такого прекрасного «увлажнителя» не стоит отказываться и в холодное врем...
Красота Мятное масло: получение и применениеМятное эфирное масло – вещество, которое получают из многолетних травянистых растений семейства яснотковых, в частности из разных видов мяты, чаще всего перечной. Оно содержит множество ценных компонентов: больше всего ментола, его 70 %, а еще есть лимонен, цинеол, карвон, гераниол и многие другие ароматические соединения.
Образование Циклоалканы - это... Циклоалканы: получение, формула, химические и физические свойстваЦиклоалканы - это углеводороды, которые в своем составе имеют замкнутые структуры. Рассмотрим особенности данных соединений, их области применения.Особенности классаЧто собой представляют циклоалканы? Форму...
monateka.com
Применение аммиачной воды и карбамидо-аммиачной смеси для подкормки растений
Технические характеристики
Среди многообразия производимых предприятиями химической промышленности жидких азотных удобрений значительный объем занимает аммиачная вода(гидрат аммиака, аммиак водный технический). По сути, это 25-процентный водный раствор аммиака. Физические свойства аммиачной воды: формула NH₄OH ( концентрация в растворе достигает 25 %, плотность аммиачной воды 0,91)
Широкое распространение она получила благодаря сравнительно низкой стоимости (на 50-100% дешевле аммиачной селитры). Высокая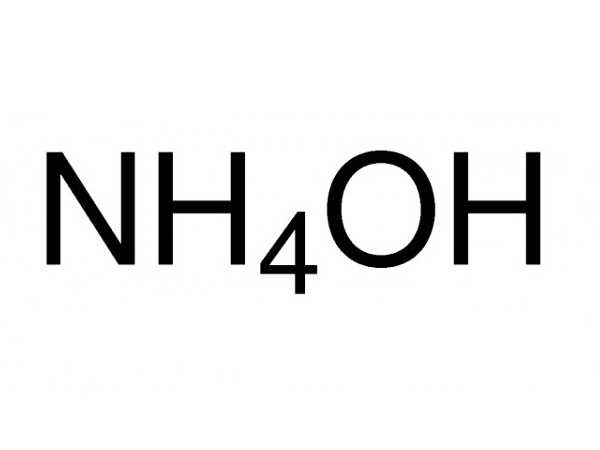 экономическая эффективность использования аммиачной воды доказана испытаниями в условиях производственных предприятий. Ее внесение не требует больших затрат времени и труда благодаря ряду преимуществ:
экономическая эффективность использования аммиачной воды доказана испытаниями в условиях производственных предприятий. Ее внесение не требует больших затрат времени и труда благодаря ряду преимуществ:
- не требуется предварительная подготовка удобрения к внесению;
- полная механизация всех операций, производимых при внесении.
Указанные факторы обуславливают активное использование аммиачной воды в предприятиях агропромышленного комплекса.
Цвет удобрения варьируется от прозрачного до желтоватого. Присутствует характерный запах нашатырного спирта. Содержание азота доходит до 20,5 процентов, в зависимости от сорта. Аммиачная вода используется для подкормки всех культур независимо от типа почвы. Получить аммиачную воду можно путем смещения жидкого аммиака без его испарения с водой в специальной системе смешения при давлении.
Особенности применения
Аммиачная вода используется для подкормки растений соединениями азота и ускорения роста зеленой массы. В результате наблюдается повышение содержания белка, что особенно значимо при возделывании культур, которым необходим его избыток (например, пивоваренный ячмень). В связи с этим важную роль играет соблюдение норм внесения, ведь слишком активный рост зеленой массы снижает урожайность зерна. Аммиачную воду вносят в междурядья или под корневую систему, исключая попадание непосредственно в зону корневой системы.
Внесение методом полива приводит к потере значительной части аммиака посредством испарения. Для наиболее рационального использования рекомендуется вносить аммиачную воду для растений в предварительно увлажненную почву.
Негативное воздействие аммиачной воды
Воздействие аммиачной воды, вызванное ее избытком или внесением на небольшую глубину, может негативно сказаться на растении, привести к повреждению корневой системы. Заблаговременное внесение (в идеале за 6 месяцев до посева) позволит полностью избежать отрицательного воздействия. При необходимости, подкормку можно провести весной и даже непосредственно перед посевом. В этом случае важно соблюдение ряда правил, которые позволяют снизить негативное влияние на растения. Под высеваемые узкими рядами культуры и зерновые удобрение вносят агрегатами с небольшим расстоянием между сошниками (от 20 до 25 см) в количестве 40-60 кг действующего вещества на 1 гектар посевов. Под овощные культуры рекомендуется вносить в расчете 50-70 кг на 1 гектар в междурядья. Дозировка действующего вещества для подкормки технических культур составляет 60-90 кг на 1 гектар.
Жидкая форма позволяет вносить аммиачную воду равномерно, на необходимую глубину, затрачивая при этом небольшое ее количество.
Положительное действие аммиачной воды
Положительное действие аммиачной воды заключается в подавлении и отпугивании почвенных насекомых, которые уничтожают прорастающие семена. Этим обуславливается необходимость внесения под корневую систему. Щелочная реакция препарата изменяет кислотность почвы.
Эмфатический способ внесения
Наиболее эффективный метод внесения - эмфатический. Внесение лучше всего проводить либо под осеннюю зяблевую вспашку, либо во время весенней предпосевной обработки. Ограничений по типу почв и возделываемых на них культур нет.
Внесение должно производиться отдельно от других форм удобрений. По данным исследований, эффект, достигаемый при воздействии на такие культуры как картофель, ячмень, озимая рожь и кукуруза сопоставим с эффектом от подкормки аммиачной селитрой.
Сложности, с которыми может столкнуться агропромышленное предприятие при внесении аммиачной воды:
- жидкая форма, для хранения которой необходима тара большего объема по сравнению с сухими удобрениями;
- необходимость наличия специальных резервуаров для хранения агрессивных растворов, в составе которых присутствует аммоний;
- необходимость наличия специальных агрегатов для внесения.
Стоимость аммиачной воды
Аммиачная вода: цена варьируется в зависимости от сезона. По завершению рекомендуемого периода внесения азотных удобрений их цена снижается. Покупка в это время наиболее выгодна. Но большой запас делать нежелательно, ведь срок хранения данного продукта ограничен. Оптимальный период, на протяжении которого хозяйство может хранить аммиачную воду, составляют 2-3 месяца. Из условий, необходимых для сохранения качества, можно отметить герметичность емкости.
Хранение аммиачной воды
Хранилище для этого препарата требует наличия специальных разрешений от органов санитарного и экологического контроля. Также необходимо иметь в наличии специальный транспорт для перевозки аммиачной воды и резервуар для хранения. Как правило, аммиачная вода  доставляется предприятием-производителем в собственной таре (цистерне), подлежащей возврату. Во избежание штрафных санкций необходимо соблюдать сроки возврата данной тары.
доставляется предприятием-производителем в собственной таре (цистерне), подлежащей возврату. Во избежание штрафных санкций необходимо соблюдать сроки возврата данной тары.
При нахождении от поставщика на расстоянии свыше 30 км необходимо позаботиться о промежуточном складском хранении. Грузоперевозка удобрения, аммиачной воды осуществляется цистернами с парой люков: сверху и снизу. Перемещение аммиачной воды из транспортировочных цистерн в прирельсовые склады производят при помощи насосов. В случае их отсутствия возможно использование автомобильных или прицепных тракторных емкостей.
Тарой для хранения аммиачной воды могут служить герметично закрывающиеся резервуары из стали, а также топливные цистерны. Доставка к месту внесения обычно происходит при помощи прицепной цистерны небольшого объема, которая снабжена препятствующими проливанию герметичными муфтами, необходимыми для заправки культиваторов. Внесение может осуществляться при помощи культиваторов различного типа.
Карбомидно-аммиачная смесь
Ближайший конкурент аммиачной воды - карбамидно-аммиачная смесь, в состав которой входит три формы азота. Она обладает способностью сохранять уровень кислотности раствора даже при смешивании с определенным объемом веществ с кислотной либо щелочной реакцией (буферные свойства). Данное преимущество КАС позволяет производить подкормку одновременно с обработкой пестицидами, смешав два рабочих раствора непосредственно в баке. Но вместе с тем карбамидно-аммиачная смесь значительно дороже. Также к недостаткам относится коррозирующее воздействие на металлы (за исключением нержавеющей стали, тары из керамики и полимеров).
Основное требование при работе с аммиачной водой - знание техники безопасности, особенностей хранения и транспортировки, а также правил внесения под сельскохозяйственные культуры.
uagro.info
Что такое аммиак? Формула и свойства аммиака
Аммиак – соединение, являющееся важнейшим источником азота для живых организмов, а также нашедшее применение в различных отраслях промышленности. Что такое аммиак, каковы его свойства? Давайте разберемся.
Что такое аммиак: основные характеристики
Аммиак (нитрид водовода) – соединение азота с водородом, имеющее химическую формулу Nh4. Форма молекулы напоминает тригональную пирамиду, в вершине которой расположен атом азота.
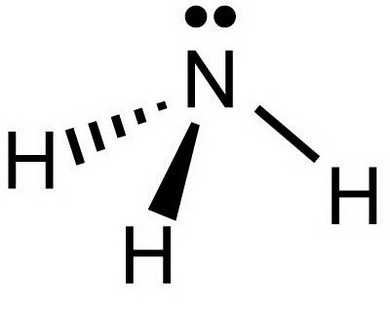
Аммиак представляет собой газ, не имеющий цвета, но обладающий резким специфическим запахом. Плотность аммиака почти в два раза меньше, чем плотность воздуха. При температуре 15 oC она составляет 0,73 кг/м3. Плотность аммиака жидкого в нормальных условиях равна 686 кг/м3. Молекулярная масса вещества - 17,2 г/моль. Отличительной особенностью аммиака является его высокая растворимость в воде. Так, при температуре 0 °C ее значение достигает около 1200 объемов в объеме воды, при 20 °C – 700 объемов. Раствор «аммиак - вода» (аммиачная вода) характеризуется слабощелочной реакцией и довольно уникальным свойством по сравнению с другими щелочами: с увеличением концентрации плотность снижается.
Как образуется аммиак?
Что такое аммиак в организме человека? Это конечный продукт азотистого обмена. Большую его часть печень конвертирует в мочевину (карбамид) – менее токсичное вещество.
Аммиак в природных условиях образуется в результате разложения органических соединений, содержащих азот. Для использования в промышленности это вещество получают искусственным путем.
Получение аммиака в промышленных и лабораторных условиях
В промышленных условиях аммиак получают путем каталитического синтеза из азота и водорода:
N2 + 3h3 → 2Nh4 + Q.
Процесс получения вещества проводят при температуре 500 °C и давлении 350 атм. В качестве катализатора используется пористое железо. Полученный аммиак удаляется охлаждением. Азот и водород, которые не прореагировали, возвращаются на синтез.
В лабораторных условиях аммиак получают в основном путем слабого нагревания смеси, состоящей из хлорида аммония и гашеной извести:
2Nh5Cl + Ca(OH)2 → CaCl2 + 2Nh4↑ + 2h3O.
Для осушения готовое соединение пропускается через смесь извести и едкого натра. Довольно сухой аммиак можно получить путем растворения в нем металлического натрия и последующей перегонки.
Где используется аммиак?
Нитрид водорода широко применяется в различных отраслях промышленности. Огромные его количества используются для производства азотной кислоты и различных удобрений (мочевина, нитрат аммония и др.), полимеров, синильной кислоты, соды, аммониевых солей и других видов продукции химического производства.

В легкой промышленности свойства аммиака применяют при очистке и окрашивании таких тканей, как шелк, шерсть и хлопок. В сталелитейном производстве он используется для увеличения твердости стали путем насыщения ее поверхностных слоев азотом. В нефтехимической промышленности при помощи нитрида водорода нейтрализуют кислотные отходы.
Благодаря своим термодинамическим свойствам жидкий аммиак используется в качестве хладагента в холодильном оборудовании.
Раствор нитрида водорода (нашатырный спирт) применяется в медицине для выведения из обморочного состояния, стимуляции рвоты, для обработки рук медперсонала, при укусах насекомых и пр.

Некоторые химические свойства аммиака
Нитрид водорода характеризуется довольно высокой химической активностью и способен вступать в реакции со многими веществами.
При взаимодействии аммиака с кислотами образуются соответствующие соли аммония. Так, к примеру, в результате реакции с азотной кислотой образуется аммиачная селитра:
Nh4 + HNO3 → Nh5NO3.
При взаимодействии с HCl образуется хлорид аммония:
Nh4+ HCl → Nh5Cl.
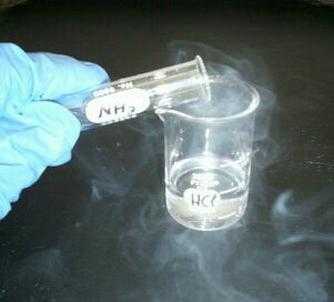
Соли аммония представляют собой твердые кристаллические вещества, разлагающиеся в воде и обладающие свойствами, присущими солям металлов. Растворы соединений, образованных в результате взаимодействия аммиака и сильных кислот, имеют слабокислую реакцию.
За счет атомов азота нитрид водорода является активным восстановителем. Восстановительные свойства его проявляются при нагревании. При горении в атмосфере кислорода он образует азот и воду. В присутствии катализаторов взаимодействие с кислородом дает оксид азота. Нитрид водорода имеет способность восстанавливать металлы из оксидов.
Галогены в результате реакции с аммиаком образуют галогениды азота – опасные взрывчатые вещества. При взаимодействии с карбоновыми кислотами и их производными нитрид водорода образует амиды. В реакциях с углем (при 1000 °С) и метаном он дает синильную кислоту.
С ионами металлов аммиак образует аминокомплексы, или аммиакаты (комплексные соединения), имеющие характерную особенность: атом азота всегда связан с тремя атомами водорода. В результате комплексообразования меняется окраска вещества. Так, к примеру, голубой раствор медного купороса при добавлении нитрида водорода приобретает интенсивный сине-фиолетовый цвет. Многие из аминокомплексов обладают достаточной устойчивостью. Благодаря этому они могут быть получены в твердом виде.

В жидком аммиаке хорошо растворяются как ионные, так и неполярные неорганические и органические соединения.
Санитарно-гигиенические характеристики
Аммиак относят к четвертому классу опасности. Предельно допустимая максимально-разовая концентрация (ПДК) в воздухе населенных пунктов равна 0,2 мг/м3, среднесуточная – 0,04. В воздухе рабочей зоны содержание аммиака не должно быть выше 20 мг/м³. При таких концентрациях запах вещества не ощущается. Фиксироваться человеческим обонянием он начинает при 37 мг/м³. То есть если запах аммиака ощущается, это означает, что допустимые нормы нахождения вещества в воздухе значительно превышены.
Влияние на человеческий организм
Что такое аммиак с точки зрения воздействия на человека? Это токсикант. Его относят к веществам, способным оказывать удушающее и нейротропное действие, ингаляционное отравление которыми может привести к отеку легких и поражению нервной системы.
Аммиачные пары раздражающе воздействуют на кожные покровы, слизистые оболочки глаз и органов дыхания. Концентрация вещества, при которой проявляется раздражение зева, составляет 280 мг на куб. метр, глаз − 490 мг на куб. метр. В зависимости количества нитрида водорода в воздухе могут возникать першение в горле, затрудненность дыхания, приступы кашля, боль в глазах, обильное слезотечение, химический ожог роговицы, потеря зрения. При содержании аммиака 1,5 г на куб. метр в течение часа развивается токсический отек легких. При контакте жидкого аммиака и его растворов (в высоких концентрациях) с кожей возможны покраснения, зуд, жжение, дерматиты. Так как сжиженный нитрид водовода при испарении поглощает тепло, возможны обморожения различной степени.
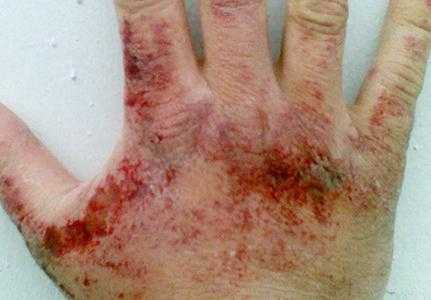
Симптомы отравления аммиаком
Отравление данным токсикантом может вызывать снижение слухового порога, тошноту, головокружение, головную боль и пр. Возможны изменения в поведении, в частности сильное возбуждение, бред. Проявление симптомов в ряде случаев имеет прерывистый характер. Они могут на некоторое время прекращаться, а потом возобновляться с новой силой.
Учитывая все возможные последствия воздействия аммиака, очень важно соблюдать меры предосторожности при работе с данным веществом и не допускать превышения его концентрации в воздушной среде.
fb.ru