Жесткость воды что это такое. Свойства жесткой воды
Жесткость воды что это такое
Жесткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворенных солей щелочноземельных металлов, главным образом, кальция и магния (так называемых «солей жесткости»). Вода – сложное природное вещество, в состав которого входит целый набор микроэлементов. В том или ином виде вода содержится во всех живых организмах. Что подразумевается под понятием жесткость, и что определяет данный показатель?
Подробнее про жесткость воды
Жесткость – это свойство воды, которое определяет ее потребительские качества и имеет важное хозяйственное значение. В процессе кипячения жесткая жидкость образует накипь на стенках и внутренних деталях нагревательных приборов, что вызывает ухудшение теплотехнических характеристик бытовой техники. Не особенно подходит она и для стирки, поскольку способствует снижению очищающих характеристик моющих средств и увеличивает их расход.
| Градусы dH | Характер воды | Жесткость в мг. х экв/л. | Эквивалент в mg/L |
| 23 — 34° | Очень жесткая | выше 12 мг х экв/л | 320 — 530 ppm |
| 13 — 22° | Жесткая | 8 – 12 мг х экв/л | 210 — 320 ppm |
| 9 — 12° | Средней жесткости | 4 – 8 мг х экв/л | 140 — 210 ppm |
| 5 — 8° | Мягкая | 1,5 – 4 мг х экв/л | 70 — 140 ppm |
| 0 — 4° | Очень мягкая | До 1,5 мг х экв/л | 0 — 70 ppm |

Откуда берется высокая жесткость? Ее определяет наличие солей магния и кальция – химических компонентов, выполняющих роль активных регуляторов различных химических процессов в окружающей среде. Естественно, что жидкость, которая берется из разных водоемов, может иметь ту или иную степень жесткости. При этом река, озеро и любой другой источник пополняются из подземных источников, протекающих в известняковых пластах. Проходя через них, вода обогащается солями жесткости, а значит, будет жесткой. Для сравнения – данный показатель у поверхностных вод всегда заметно ниже, чем у подземных. Жесткость воды в природных источниках постоянно изменяется. Максимальных отметок она достигает зимой, а минимальных – весной, во время таяния снегов.
Таким образом, жесткой является та вода, которая содержит соли магния и кальция в больших количествах. Кстати, магниевые соли растворяются хуже кальциевых, и жидкость с их высоким содержанием имеет выраженный горький вкус.
Шкала жесткости воды
Выделяются следующие виды жесткости:
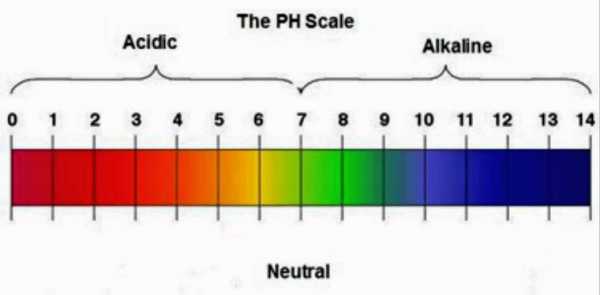
- Общая – определяется как суммарная концентрация ионов магния и кальция.
- Карбонатная – зависит от наличия в воде карбонатов, гидрокарбонатов кальция и магния. Практически полностью устраняется в ходе кипячения, поэтому второе название карбонатной жесткости – временная. В процессе нагрева гидрокарбонаты распадаются – образуется угольная кислота, а карбонаты кальция, гидроксиды магния выпадают в виде осадка.
- Некарбонатная – обусловлена присутствием магниевых и кальциевых кислотных солей. При кипячении не устраняется (то есть является постоянной).
Общая жесткость измеряется в GH. GH показывает суммарное содержание щелочноземельных металлов в виде ионов. Для примера – в воде, значение GH которой близкое к нулю, аквариумные рыбки не живут, употреблять ее в пищевых целях также не рекомендуется.
В каких единицах измеряется жесткость
В мире для измерения показателей жесткости используются разные значения. В России Госстандарт установил следующий показатель – моль на кубический метр. Числовое значение жесткости, которое выражается в молях на кубический метр, равняется числовому значению жесткости в миллиграмм-эквивалентах на литр. На западе используют немецкий (d°, dH), французский (f°), американский (ppm CaCO3) градусы.
Как повысить и понизить жесткость воды в аквариуме. Определение временной, или карбонатной жесткости
Чтобы создать комфортные условия для жизни аквариумных рыбок, важно использовать воду оптимальной жесткости, с заданным кислотно-щелочным балансом. Чтобы повысить жесткость воды, используют известняк и мрамор. Чем мягче вода, тем быстрее она повысит жесткость. Другой способ – химический, с применением хлористого кальция и магнезии. Максимальный эффект достигается при использовании обоих препаратов одновременно.
Чтобы уменьшить жесткость, воду нужно прокипятить. Как долго это следует делать? Учтите, что для снижения жесткости вдвое, кипятить воду нужно минимум в течение получаса. Другой способ – вымораживание. Воду наливают в пластиковый контейнер и помещают в морозилку. Затем лед растапливают, а полученную воду используются в пищевых или любых других целях.
Если объемы воды большие, проще будет использовать специальное оборудование. Широкое распространение в быту в последние годы получили установки обратного осмоса. Для расчета необходимого объема водопроводной воды используйте формулу – вычитание объема воды, получаемой из водопровода, из объема с заданной жесткостью, который нужно получить.
Часто методы умягчения используют комбинированно. Например, одну часть солей жесткости убирают реагентным способом, а другую с помощью катионного обмена. Приведем формулы содово-известкового способа умягчения:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3 + 2Н2О
В итоге Mg(OH)2 коагулирует, выпадая в осадок. Затем, в целях устранения некарбонатной жесткости, вводится Na2CO3. Последующие химические реакции:
Na2CO3 + CaSO4 = CaCO3 + Na2SO4 и Na2CO3 + СаС12 = СаСО3 + 2NaCl.
В итоге образуется углекислый кальций, выпадающий затем в осадок. Реагенты вводят в разные зоны:
- хлор – во всасывающие трубопроводы;
- коагулянт – в трубопровод перед смесителем либо непосредственно в смеситель;
- известь – вместе с коагулянтом;
- уголь активированный – перед фильтрами;
- хлор и аммиак – в фильтрованную воду.
Опреснение, обессоливание, удаление растворенных газов, железа, стабилизация – это специальные способы очистки. Так если для снижения жесткости используются методы катионирования или ионного обмена, речь идет об обессоливании. Вода, которая получается на выходе, не содержит ни анионов, ни катионов солей.
Как измерить жесткость
Для оценки показателей жесткости воды используются следующие способы:
- Комплексонометрическое титрование трилоном Б. Метод сложный и самый точный.
- Покупные тесты. Не на 100% точные, зато простые и недорогие.
- Измерение электропроводности. Используйте кондуктометр.
- С помощью ионометра и ионоселективных электродов.
- С применением методики титрования соляной кислотой проб воды. Сложный и не очень точный метод. То же самое можно сказать о тестах с применение хозяйственного мыла.
Под титрованием подразумевается добавление в воду реагента требуемой концентрации. Концентрация солей жесткости определяется в зависимости от реакции реагента с водой. Приготовить реактив просто – достаточно смешать кислоту с дистиллированной водой в заданных пропорциях. Готовый раствор опасности не представляет.

Проще всего использовать готовые тексты. Для этого 5 мл воды наливается в стаканчик, затем в жидкость по каплям добавляется содержимое теста, после каждой капли вода перемешивается. Делать так нужно до тех пор, пока цвет не станет зеленым вместо розового.
Влияние жесткости воды, нормативные требования и рекомендации
Какую воду можно употреблять для приготовления пищи и питья? Требования относительно жесткости жидкости зависят от условий конкретной местности. Учтите, что слишком жесткая вода имеет горький вкус и негативно влияет на работу органов пищеварения. ВОЗ конкретные цифры не называет, хотя исследований на тему связи качества воды с заболеваниями сердца, сосудов и других органов организма проводились неоднократно. Слишком мягкая вода – это тоже плохо, поскольку она нарушает водно-солевой баланс. Жидкость с жесткостью от 4 мг-экв/ чревата – главная причина образования накипи на внутренних деталях отопительных систем. Вредна она и для кожи, волос.
Вместо заключения
Жесткость – важный параметр воды, который зависит от количества и типа растворенных в ней минеральных веществ. Смягчение следует делать только после предварительного анализа. Почему? Потому что не все меды смягчения снижают содержание минеральных веществ – они могут просто превращать соли жесткости в соли, которые никак не влияют на рассматриваемый показатель.
global-aqua.ru
Подробнее про жёсткость воды — Всё самое интересное!
Продолжаем раздел «Вода» и подраздел «Теоретические основы» статьёй Подробнее про жёсткость воды. Подробнее — потому что тема жёсткости воды уже всплывала на нашем интересном и полезном сайте в статье Жёсткая вода. Жёсткость воды вспоминается в первую очередь с накипью и умягчителем воды — прибором, который должен справляться с жёсткой водой и препятствовать образованию накипи.
Подробнее про жёсткость воды мы поговорим про жёсткость воды с точки зрения химии, разновидности жёсткости воды, единицы измерения жёсткости воды (в том числе в разных странах). Рассмотрим, откуда берётся жёсткость воды и как влияет жёсткость на качество воды.
Для начала немного про термины. В статье часто упоминаются слова «катионы» и «анионы». Катионы и анионы — это положительно и отрицательно заряженные ионы. Ион (др.-греч. ἰόν — идущее) — электрически заряженная частица, образующаяся в результате потери или присоединения одного или нескольких электронов. Соответственно, если потеря — то заряд частицы положительный. Если присоединение — то заряд частицы отрицательный (поскольку электрон имеет однозначно отрицательный заряд).

Жёсткость воды с точки зрения химии
Понятие жесткости воды принято связывать с катионами кальция (Са2+) и в меньшей степени магния (Mg2+). В действительности, все двухвалентные катионы в той или иной степени влияют на жесткость. Они взаимодействуют с анионами, образуя соединения (соли жесткости) способные выпадать в осадок. Одновалентные катионы (например, натрий Na+) таким свойством не обладают.
В данной таблице приведены основные катионы металлов, вызывающие жесткость, и главные анионы, с которыми они обЪединяются.
| Катионы | Анионы |
| Кальций (Ca2+) | Гидрокарбонат (HCO3—) |
| Магний (Mg2+) | Сульфат (SO42-) |
| Стронций (Sr2+) | Хлорид (Cl—) |
| Железо (Fe2+) | Нитрат (NO3—) |
| Марганец (Mn2+) | Силикат (SiO32-) |
На практике стронций, железо и марганец оказывают на жесткость столь небольшое влияние, что ими, как правило, пренебрегают. Алюминий (Al3+) и трехвалентное железо (Fe3+) также влияют на жесткость, но при уровнях рН, встречающихся в природных водах, их растворимость и, соответственно, «вклад» в жесткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва2+).
Разновидности жесткости воды.
Различают следующие разновидности жёсткости воды:
Общая жесткость. Определяется суммарной концентрацией ионов кальция и магния. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
Карбонатная жесткость. Определяется наличием в воде гидрокарбонатов и карбонатов (при рН>8.3) кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью. При нагреве воды гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок карбоната кальция и гидроксида магния.
Некарбонатная жесткость. Обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется (постоянная жесткость).
Единицы измерения жёсткости воды.
В мировой практике используется несколько единиц измерения жесткости, все они определенным образом соотносятся друг с другом. В России Госстандартом в качестве единицы жесткости воды установлен моль на кубический метр (моль/м3). На Украине используется как моль/м3, так и мг-экв/л (миллиграмм эквивалент на литр). Численно эти значения совпадают. Кстати, л и дм3 — это одно и тоже, литр и дециметр кубический.
Кроме этого в различных странах широко используются такие единицы жесткости, как немецкий градус (do, dH), французский градус (fo), американский градус, ppm CaCO3.
Соотношение этих единиц жесткости представлено в следующей таблице:
| Единицы жесткости воды | ||||
| Моль/м3 (мг-экв/л) | Немецкий градус, do | Французский градус, fo | Американский градус | ppm (мг/дм3)СаСО3 |
| 1.000 | 2.804 | 5.005 | 50.050 | 50.050 |
Примечание:
- Один немецкий градус соответствует 10 мг/дм3 СаО или 17.86 мг/дм3 СаСО3 в воде.
- Один французский градус соответствует 10 мг/дм3 СаСО3 в воде.
- Один американский градус соответствует 1 мг/дм3 СаСО3 в воде.
Чтобы не заморачиваться пересчётами вручную, можно создать табличку пересчёта единиц жёсткости. Которую, кстати сказать, вы можете скачать по ссылке Таблица пересчёта единиц измерения жёсткости воды.
Откуда берётся жёсткость воды
Ионы кальция (Ca2+) и магния (Mg2+), а также других щелочноземельных металлов, обуславливающих жесткость, присутствуют во всех минерализованных водах. Их источником являются природные залежи известняков, гипса и доломитов. Ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов могут служить также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
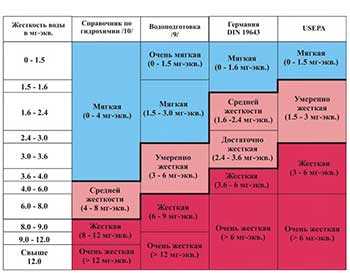
Жесткость воды колеблется в широких пределах и существует множество типов классификаций воды по степени ее жесткости. Ниже в таблице приведены целых четыре примера классификации. Две классификации из российских источников — из справочника «Гидрохимические показатели состояния окружающей среды» и учебника для вузов «Водоподготовка». A две — из иностранных: нормы жесткости немецкого института стандартизации (DIN 19643) и классификация, принятая Агентством по охране окружающей среды США (USEPA) в 1986.
Таблица наглядно иллюстрирует гораздо более «жесткий» подход к проблеме жесткости за границей. И не без причины, о чём — ниже.
Обычно в маломинерализованных водах преобладает (до 70%-80%) жесткость, обусловленная ионами кальция (хотя в отдельных редких случаях магниевая жесткость может достигать 50-60%). С увеличением степени минерализации воды содержание ионов кальция (Са2+) быстро падает и редко превышает 1 г/л. Содержание же ионов магния (Mg2+) в высокоминерализованных водах может достигать нескольких граммов, а в соленых озерах — десятков граммов на один литр воды.
В целом, жесткость поверхностных вод, как правило, меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость (десятки и сотни мг-экв/дм3).
Как влияет жёсткость на качество воды
С точки зрения применения воды для питьевых нужд, ее приемлемость по степени жесткости может существенно варьироваться в зависимости от местных условий. Порог вкуса для иона кальция лежит (в пересчете на мг-эквивалент) в диапазоне 2-6 мг-экв/л, в зависимости от соответствующего аниона, а порог вкуса для магния и того ниже. В некоторых случаях для потребителей приемлема вода с жесткостью выше 10 мг-экв/л. Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное действие на органы пищеварения.
Всемирная Организация Здравоохранения не предлагает какой-либо рекомендуемой величины жесткости по показаниям влияния на здоровье. В материалах ВОЗ говорится о том, что хотя ряд исследований и выявил статистически обратную зависимость между жесткостью питьевой воды и сердечно-сосудистыми заболеваниями, имеющиеся данные не достаточны для вывода о причинном характере этой связи. Аналогичным образом, однозначно не доказано, что мягкая вода оказывает отрицательный эффект на баланс минеральных веществ в организме человека.
Вместе с тем, в зависимости от рН и щелочности, вода с жесткостью выше 4 мг-экв/л может вызвать в распределительной системе водопровода отложение шлаков и накипи (карбоната кальция), особенно при нагревании. Именно поэтому нормами Котлонадзора вводятся очень жесткие требования к величине жесткости воды, используемой для питания котлов (0.05-0.1 мг-экв/л).
Кроме того, при взаимодействии солей жесткости с моющими веществами (мыло, стиральные порошки, шампуни) происходит образование «мыльных шлаков» в виде пены. Это приводит не только к значительному перерасходу моющих средств. Такая пена после высыхания остается в виде налета на сантехнике, белье, человеческой коже, на волосах (неприятное чувство «жестких» волос хорошо известное многим). Главным отрицательным воздействием этих шлаков на человека является то, что они разрушают естественную жировую пленку, которой всегда покрыта нормальная кожа и забивают ее поры.
Признаком такого негативного воздействия является характерный «скрип» чисто вымытой кожи или волос. Оказывается, что вызывающее у некоторых раздражение чувство «мылкости» после пользования мягкой водой является признаком того, что защитная жировая пленка на коже цела и невредима. Именно она и скользит. В противном случае, приходится тратиться на лосьоны, умягчающие и увлажняющие кремы и прочие хитрости для восстановление той защиты кожи, которой нас и так снабдила природа.
Вместе с тем, необходимо упомянуть и о другой стороне медали. Мягкая вода с жесткостью менее 2 мг-экв/л имеет низкую буферную емкость (щелочность) и может, в зависимости от уровня рН и ряда других факторов, оказывать повышенное коррозионное воздействие на водопроводные трубы. Поэтому, в ряде применений (особенно в теплотехнике) иногда приходится проводить специальную обработку воды с целью достижения оптимального соотношения между жесткостью воды и ее коррозионной активностью.
Вот мы и узнали подробнее про жёсткость воды. Осталось определиться со способами борьбы 🙂

По материалам http://dino-trade.ru/index.php/2010-01-21-11-16-24/205-2010-10-31-16-41-39
interesko.info
Жесткость воды

Каждый из нас хотя бы раз в жизни слышал термин «жесткость воды». Под ним подразумевается присутствие в воде, которая у людей в квартирах поступает из крана, солей магния и кальция, но в растворенном виде. Жесткость воды будет напрямую зависеть от региона проживания.
Отличие временной и постоянной жесткости
Временная жесткость – это примесь в водопроводной воде соединений магния и кальция, которые носят название гидрокарбонатов и карбонатов. При проведении процедуры кипячения этой воды соединения распадаются, тем самым оседая на стенках чайника в виде накипи. Получается, что при кипячении жесткость самоустраняется, поэтому и носит название временной.
Постоянная жесткость – когда в воде наличие солей магния и кальция образуют соединения с сильными кислотами, такими как азотная, серная или соляная. Как бы сильно хозяйки не кипятили чайник, эти примеси в воде после кипячения никуда не исчезнут.
Временная и постоянная жесткость в других источниках могут именоваться карбонатная и не карбонатная жесткость воды соответственно. Одна и та же вода может обладать сразу двумя этими характеристиками, а их сумма носит название «суммарной жесткости».
Причины повышенной жесткости воды
Дело в том, что вода перед попаданием в квартиры проделывает огромный путь. В природе вода считается идеальным растворителем, она насыщается магнием и кальцием, когда проникает через известковые и другие горные породы. В итоге вода приобретает разную жесткость, для выражения которой была придумана система единиц измерения жесткости воды.
Система единиц измерения жесткости воды
Данная система измерения, как и другие, в разных странах различные единицы измерения жесткости, но для большинства общепринятыми считаются российские стандарты, где за единицу измерения взят один моль на кубический метр воды.
Стандарты жесткости воды
Существует огромное количество мнений по поводу того, какая вода является жесткой, а какая мягкой. В среднем показатели разделяются следующим образом:
- Очень мягкая вода: 0 – 1,5
- Мягкая вода: 1,5 – 3
- Умеренная: 3 – 6
- Жесткая вода: 6 – 9
- Очень жесткая вода: более 12.
Характеристики жесткой воды
Для организма человека жесткая вода с большим содержанием кальция становится даже полезной, так как она наполняет его жизненно важным для костей элементом. Но помимо этого жесткая вода может спровоцировать формирование камней в мочевыводящих каналах и в почках, а мягкая – повышает риск возникновения сердечнососудистой патологии
При умывании кожи жесткой водой она начинает сушиться, а при использовании мыла оно плохо пенится. На трубах и чайниках быстро образуется накипь. Но и мягкая вода не так полезна, как кажется – её использование может спровоцировать коррозию труб и других устройств.
Для бытовых приборов большая жесткость воды часто оказывается губительной, особенно для стиральных машин. Для предупреждения поломки машинки или электрического чайника необходимо использовать в быту фильтры для воды. При поломке ремонт будет стоить недешево, поэтому лучше заранее уберечься от ненужных растрат.

В высокоминерализованной воде концентрация ионов магния может равняться нескольким граммам, а в соленой воде – даже десяткам грамм на литр воды.
Что касается сравнения подземных и поверхностных вод, то у последних жесткость намного меньше, зато она подвергается изменениям погоды, максимально увеличиваясь в конце зимы, а уменьшаясь – во время половодья, когда разбавляется дождевыми и талыми водами. Максимальная жесткость отмечена в воде морей и океанов.
oskada.ru
Жёсткая вода — Всё самое интересное!
В разделе: Вода | и в подразделах: виды воды. | Автор-компилятор статьи: Лев Александрович Дебаркадер
Продолжаем раздел "Вода" и подраздел "Виды воды" статьёй Жёсткая вода. Где разберёмся с тем, что же это такое, и что с ней делать. А главное, в каких случаях ничего с жёсткой водой можно НЕ делать.
Жёсткая вода — достаточно интересный термин. Что же он обозначает? От чего зависит? Давайте разберёмся — ведь эти данные действительно могут пригодиться, причём во многих об ластях: от стирки и мытья посуды, до чистоты в доме, экономии на электроэнергии и газе и многих других.
Итак, вы наливаете воду в чайник. Закипячиваете. И так раз пятьдесят. Что образуется на стенке чайника? Образуется накипь. Такой себе прочный налёт, который можно соскребать ножом (с большим трудом) или залить лимонной кислотой и услышать шипение (выделяется газ).
Накипь — следствие жёсткой воды. И проявляется не только на чайниках, а и на любых других нагревательных элементах, которые соприкасаются с горячей водой. Например, на батареях. Из-за чего работа батареи как отопительного прибора ухудшается в разы. А это означает — больше расходов на нагрев воды, и многие другие проблемы, связанные с жёсткой водой.
Видели ли вы на упаковках для стиральных порошков надписи: если вода меньше 20 d, то сыпать 1 мерную ложечку; если вода больше 20 d, то полторы-две. Вот эти 20 d — единицы измерения жёсткости воды. Во многих городских квартирах этот показатель выше, чем 20 d. Соответственно, расход порошка в 1,5-2 раза выше, чем в мягкой воде. Кстати, для очень мягкой воды порошка требуется в десятки раз меньше, чем обычно. Чем не экономия?
Ну, и, в конце концов, иногда, когда вы пьёте хорошую воду из хорошего родника или из глубокой скважины, то она кажется намного вкуснее, чем обычная водопроводная. Почему? Потому что в ней мало солей, в частности — низкая жёсткость воды.
Жёсткость воды — достаточно вредная штука. Что же это такое?
Жёсткость воды — это растворённые в воде соли кальция и магния. Соли кальция, магния и карбонаты (соли уклекислого газа) при нагревании выпадают в осадок и образуют накипь. Или, другими словами, соли кальция, магния и карбонаты образуют при нагревании новое химическое соединение — мел. Мел, известняк, мрамор, накипь — это по сути одно и то же вещество, карбонаты кальция и магния, в различном состоянии.
Из за того, что соли кальция и магния обуславливают жёсткость воды, они называются солями жёсткости. А поскольку карбонаты кальция и магния выпадают в осадок при нагревании, вода становится менее жёсткой (и более мягкой), а карбонаты кальция и магния называются временной жёсткостью. Временной — потому что она удаляется кипячением.
Однако, разнообразие солей жёсткости на этом не заканчивается. Существует ещё одна группа солей жёсткости — которые при нагревании не образуют осадок, накипь. Поэтому (потому что они не выпадают в осадок при нагревании), эти соли образуют группу постоянной жёсткости.
Для бытовых приборов, труб, чайников, форсунок душей и аэраторов кранов и т.д. опасность представляет только временная жёсткость. То есть, карбонаты кальция и магния. Почему? Потому что эти приборы имеют дело с горячей водой — и при наличии солей временной жёсткости выпадают в осадок, образуя корку накипи. Из-за которой впоследствии возникают многочисленные про блемы. Соответственно, постоянная жёсткость не опасна для этой группы приборов.
Поэтому ВНИМАНИЕ — обращайте внимание на анализ вашей воды на предмет временной жёсткости
Возможно, вы сделали анализ воды, и увидели, что ваша вода очень жёсткая. То есть, напротив показателя "Общая жёсткость" стоит какое-нибудь громадное значение. Или просто значение, даже небольшое — сейчас это не важно. Важно то, что это общая жёсткость. А общая жёсткость — это сумма постоянной и временной жёсткости. И есть вероятность того, что вся (или большая часть) жёсткой воды — не временная, а постоянная. То есть, не вредит (или очень мало вредит) вашим техническим приборам.
Как с помощью анализа воды увидеть не только общую жёсткость, но и временную жёсткость? Очень просто. В анализе воды, который делает, в частности, Санэпидемстанция, есть такой показатель, как щёлочность. Так вот, он численно равен временной жёсткости воды. Щёлочность может превышать общую жёсткость — но это означает лишь то, что ВСЯ общая жёсткость является временной. Плюс в воде остаются свободные гидрокарбонаты.
Но нас больше интересует другой вариант — когда щёлочность воды меньше общей жёсткости. Вот в этом случае можно гарантированно сказать, какая часть жёсткости является временной — то есть, самой опасной и вредной, с которой и нужно бороться с помощью умягчителя.
И ЕСЛИ щёлочность (то есть, временная жёсткость) меньше 1-2 мг-экв/л, то особо беспокоиться вам не о чем.
Разве что о внезапном и непредсказуемом изменении состава воды (что, кстати, случается не так редко, как кажется). Если временная жёсткость воды меньше единицы, то процессы образования накипи происходят достаточно медленно. Накипь образуется, но она выводит из строя теплообменники или тены медленно. Чем при желании можно пренебречь. А уж если щёлочность меньше 0,5, то в принципе можно об умягчителях забыть.
Также вы можете узнать подробнее про жёсткость воды, разобраться, что откуда берётся — и почему.
Таким образом, ПЕРЕД выбором умягчителя обязательно делайте анализ воды по показателям щёлочность и жёсткость воды, определяя, действительно ли жёсткая вода для вас опасна.

По материалам http://calmat.com.ua/hard-water.shtml
interesko.info
Жесткая вода, признаки жесткой воды, умягчение воды
Жесткая вода, признаки жесткой воды, мягкая вода
Жесткая вода — это вода, в которой содержится большое количество солей кальция и магния (соли жесткости).
Термин «жесткая вода» первоначально применяли к воде, в которой трудно было отстирать вещи. Связано это с тем, что ткань, постиранная с использованием мыла на основе жирных кислот в жёсткой воде — более жёсткая на ощупь.
Это объясняется, с одной стороны, отложением на поверхности ткани кальциевых и магниевых солей жирных кислот, образующихся в процессе стирки. С другой стороны, волокна ткани обладают ионообменными свойствами, и, как следствие, свойством сорбировать многовалентные катионы — на молекулярном уровне.
Основной источник солей кальция и магния в жесткой воде – залежи гипса, известняков и доломитов, которые размываются природными водами. Ионов кальция больше всего в маломинерализированных водах. Чем больше степень минерализации воды, тем меньше в ней содержится ионов кальция. Что касается ионов магния, то в минерализованных водах их количество может достигать нескольких граммов на литр, а в соленых водах – до нескольких десятков г/л.
Жёсткость воды в природе измененяется в течение года: она увеличивается при испарении в жару и уменьшается весной и осенью (талые и дождевые воды очень мягкие). Зимой уровень жёсткости самый высокий в году. В колодцах и артезианских скважинах концентрация солей постоянна, если они правильно изготовлены и изолированы от верхних стоков.
Характерные признаки жесткой воды
- После стирки на одежде остаются белые подтеки;
- После кипячения воды, на стенках кастрюль остается налет;
- На поверхности заваренного чая или кофе можно разглядеть белую пленку;
- Мыло и порошки плохо пенятся;
- Чай и кофе не имеют своего ярко выраженного аромата;
- Фильтры в кофемашине забиваются очень быстро;
- Овощи тушатся в воде очень долго, а мясо при варке остается жестким.
На вкус жесткую воду можно распознать благодаря легкой горьковатости. В остальном ощутить какое-либо отличие жесткой воды от мягкой весьма затруднительно, особенно если всю жизнь Вы пьете только жесткую воду.
Вредное влияние жесткой воды на здоровье:
- В первую очередь страдает кожа. Поры закупориваются, исчезает естественная защитная жировая пленка, появляется сухость, раздражения, дерматиты, высыпания и другие проблемы.
- Жесткая вода обязательно скажется и на состоянии волос и кожи головы. Это будет приводить к появлению сухости, зуда, перхоти, а волосы будут жесткими, непослушными и выглядеть не слишком чистыми даже сразу после мытья.
- Нерастворимые соли, содержащиеся в жесткой воде, накапливаются в организме, приводя к появлению камней в почках и закупоривая сосуды.
Вред жесткой воды для бытовой техники
Современная бытовая техника с нагревательными элементами: котлы в системах отопления и горячего водоснабжения, стиральные и посудомоечные машины, водосчетчики, чайники, кофеварки, джакузи, проточные и ёмкостные водонагреватели серьёзно страдают от повышенной жёсткости. Накипь на ТЭНе существенно увеличивает время нагрева, что приводит к быстрому износу деталей и перерасходу электроэнергии.
Жесткая вода vs мягкая вода?
Плюсы от применения в быту мягкой воды
- Экономия на моющих средствах составит 30-50%, так как в мягкой воде мыло, порошки и другие средства будут лучше пениться;
- Отсутствие испорченной одежды и поломанной бытовой техники и сантехники сэкономят вам круглую сумму;
- Улучшение качества еды и напитков;
- Улучшение состояния кожи и волос;
- Снижается угроза возникновения мочекаменной болезни и других заболеваний внутренних органов.
Мягкая вода поможет сэкономить значительную часть вашего бюджета и сделает вашу жизнь более комфортной и приятной.
Медики подтверждают, что высокое содержание в питьевой воде солей кальция действительно может провоцировать отложение конкрементов в почках.
Однако использование в пищу слишком мягкой воды способствует дефициту в организме ионов Ca и Mg. Это ослабит опорно-двигательный аппарат, нервную и сердечно-сосудистую систему, и даже может спровоцировать инфаркт. Употребление воды с низким содержанием солей, приведет к вымыванию нужных минеральных веществ из организма, следствием чего может стать ломкость костей у взрослых, рахит у детей, а общая сопротивляемость организма ощутимо понизится.
Кроме того, группой ученых было доказано, что основной причиной образования камней является вовсе не жесткость воды, а нехватка кальция в принимаемой пище. Для компенсации недостатка кальция, организм добывает его из костей. Большая часть этого кальция не может усвоиться организмом, а откладывается в виде конкрементов.
Диетологи говорят, что мягкая вода улучшает вкусовые качества приготовленных на ней кофе и чая, но она абсолютно безвкусна и утолить ею жажду невозможно. Можно было бы, конечно, попробовать восполнить этот недостаток добавлением поваренной соли в мягкую воду, но появится неприятный привкус, а вот гидрокарбонат кальция придает воде чуть сладковатый, очень приятный вкус и жесткая вода прекрасно справляется с утолением жажды.
Итак, пагубное влияние на организм человека оказывает все-таки не жесткость воды, а ее избыток. Главная рекомендация медиков – не употреблять ни очень мягкую, ни очень жесткую воду. Абсолютно во всем должен быть баланс.
Однозначно не рекомендуется употреблять дистиллированную воду с низким содержанием солей длительное время, в результате этого происходит вымывание минеральных веществ из организма. Медики рекомендуют не употреблять как слишком жёсткую, так и слишком мягкую воду.
rapresol.ru
Умягчение воды
«Жесткая» вода - одна из самых распространенных проблем, причем как в загородных домах с автономным водоснабжением, так и в городских квартирах с централизованным водопроводом. Степень жесткости зависит от наличия в воде солей кальция и магния (соли жесткости) и измеряется в миллиграмм — эквиваленте на литр (мг-экв/л). По американской классификации (для питьевой воды) при содержании солей жесткости менее 2 мг-экв/л вода считается «мягкой», от 2 до 4 мг-экв/л — нормальной (повторяем, для пищевых целей!), от 4 до 6 мг-экв/л — жесткой, а свыше 6 мг-экв/л — очень жесткой.
Для многих применений жесткость воды не играет существенной роли (например, для тушения пожаров, полива огорода, уборки улиц и тротуаров). Но в ряде случаев жесткость может создать проблемы. При принятии ванны, мытье посуды, стирке, мытье машины жесткая вода гораздо менее эффективна, чем мягкая. И вот почему:
При использовании мягкой воды расходуется в 2 раза меньше моющих средств;
Жесткая вода, взаимодействуя с мылом, образует «мыльные шлаки», которые не смываются водой и оставляют малосимпатичные разводы на посуде и поверхности сантехники; «Мыльные шлаки» также не смываются с поверхности человеческой кожи, забивая поры и покрывая каждый волос на теле, что может стать причиной появления сыпи, раздражения, зуда;
При нагревании воды, содержащиеся в ней соли жесткости кристаллизуются, выпадая в виде накипи. Накипь является причиной 90% отказов водонагревательного оборудования. Поэтому к воде, подвергаемой нагреву в котлах, бойлерах и т.п., предъявляются на порядок более строгие требования по жесткости;
Во многих промышленных процессах соли жесткости могут вступить в химическую реакцию, образовав нежелательные промежуточные продукты.
Понятие жесткости
Жесткость воды принято связывать с катионами кальция (Са2+) и в меньшей степени магния (Mg2+). В действительности, все двухвалентные катионы в той или иной степени влияют на жесткость. Они взаимодействуют с анионами, образуя соединения (соли жесткости) способные выпадать в осадок. Одновалентные катионы (например, натрий Na+) таким свойством не обладают.
В данной таблице приведены основные катионы металлов, вызывающие жесткость, и главные анионы, с которыми они ассоциируются
| Катионы | Анионы |
| Кальций (Ca2+) | Гидрокарбонат (HCO3-) |
| Магний (Mg2+) | Сульфат (SO42-) |
| Стронций (Sr2+) | Хлорид (Cl-) |
| Железо (Fe2+) | Нитрат (NO3-) |
| Марганец (Mn2+) | Силикат (SiO32-) |
На практике стронций, железо и марганец оказывают на жесткость столь небольшое влияние, что ими, как правило, пренебрегают. Алюминий (Al3+) и трехвалентное железо (Fe3+) также влияют на жесткость, но при уровнях рН, встречающихся в природных водах, их растворимость и, соответственно, «вклад» в жесткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва2+).
Виды жесткости
Общая жесткость. Определяется суммарной концентрацией ионов кальция и магния. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
Карбонатная жесткость. Обусловлена наличием в воде гидрокарбонатов и карбонатов (при рН>8.3) кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью. При нагреве воды гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок карбоната кальция и гидроксида магния.
Некарбонатная жесткость. Обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется (постоянная жесткость).
Единицы измерения
В мировой практике используется несколько единиц измерения жесткости, все они определенным образом соотносятся друг с другом. В России Госстандартом в качестве единицы жесткости воды установлен моль на кубический метр (моль/м3).
Один моль на кубический метр соответствует массовой концентрации эквивалентов ионов кальция (1/2 Ca2+) 20.04 г/м3 и ионов магния (1/2Mg2+) 12.153 г/м3. Числовое значение жесткости, выраженное в молях на кубический метр равно числовому значению жесткости, выраженному в миллиграмм-эквивалентах на литр (или кубический дециметр), т.е. 1моль/м3=1ммоль/л=1мг-экв/л=1мг-экв/дм3.
Кроме этого в зарубежных странах широко используются такие единицы жесткости, как немецкий градус (do, dH), французский градус (fo), американский градус, ppm CaCO3.
Соотношение этих единиц жесткости представлено в следующей таблице:
| Единицы жесткости воды | ||||
| Моль/м3(мг-экв/л) | Немецкий градус, do | Французский градус, fo | Американский градус | ppm мг/дм3 СаСО3 |
| 1.000 | 2.804 | 5.005 | 50.050 | 50.050 |
Примечание: Один немецкий градус соответствует 10 мг/дм3 СаО или 17.86 мг/дм3 СаСО3 в воде. Один французский градус соответствует 10 мг/дм3 СаСО3 в воде. Один американский градус соответствует 1 мг/дм3 СаСО3 в воде.
Происхождение жесткости
Ионы кальция (Ca2+) и магния (Mg2+), а также других щелочноземельных металлов, обуславливающих жесткость, присутствуют во всех минерализованных водах. Их источником являются природные залежи известняков, гипса и доломитов. Ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов могут служить также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
Жесткость воды колеблется в широких пределах и существует множество типов классификаций воды по степени ее жесткости.
Обычно в маломинерализованных водах преобладает (до 70%-80%) жесткость, обусловленная ионами кальция (хотя в отдельных редких случаях магниевая жесткость может достигать 50—60%). С увеличением степени минерализации воды содержание ионов кальция (Са2+) быстро падает и редко превышает 1 г/л. Содержание же ионов магния (Mg2+) в высокоминерализованных водах может достигать нескольких граммов, а в соленых озерах — десятков граммов на один литр воды
В целом, жесткость поверхностных вод, как правило, меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость (десятки и сотни мг-экв/дм3)
Влияние жесткости
С точки зрения применения воды для питьевых нужд, ее приемлемость по степени жесткости может существенно варьироваться в зависимости от местных условий. Порог вкуса для иона кальция лежит (в пересчете на мг-эквивалент) в диапазоне 2—6 мг-экв/л, в зависимости от соответствующего аниона, а порог вкуса для магния и того ниже. В некоторых случаях для потребителей приемлема вода с жесткостью выше 10 мг-экв/л. Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное действие на органы пищеварения
Всемирная Организация Здравоохранения не предлагает какой-либо рекомендуемой величины жесткости по показаниям влияния на здоровье. В материалах ВОЗ говорится о том, что хотя ряд исследований и выявил статистически обратную зависимость между жесткостью питьевой воды и сердечно-сосудистыми заболеваниями, имеющиеся данные не достаточны для вывода о причинном характере этой связи. Аналогичным образом, однозначно не доказано, что мягкая вода оказывает отрицательный эффект на баланс минеральных веществ в организме человека
В месте с тем, в зависимости от рН и щелочности, вода с жесткостью выше 4 мг-экв/л может вызвать в распределительной системе отложение шлаков и накипи (карбоната кальция), особенно при нагревании. Именно поэтому нормами Котлонадзора вводятся очень жесткие требования к величине жесткости воды, используемой для питания котлов (0.05—0.1 мг-экв/л).
месте с тем, в зависимости от рН и щелочности, вода с жесткостью выше 4 мг-экв/л может вызвать в распределительной системе отложение шлаков и накипи (карбоната кальция), особенно при нагревании. Именно поэтому нормами Котлонадзора вводятся очень жесткие требования к величине жесткости воды, используемой для питания котлов (0.05—0.1 мг-экв/л).
Кроме того, при взаимодействии солей жесткости с моющими веществами (мыло, стиральные порошки, шампуни) происходит образование «мыльных шлаков» в виде пены. Это приводит не только к значительному перерасходу моющих средств. Такая пена после высыхания остается в виде налета на сантехнике, белье, человеческой коже, на волосах (неприятное чувство «жестких» волос хорошо известное многим). Главным отрицательным воздействием этих шлаков на человека является то, что они разрушают естественную жировую пленку, которой всегда покрыта нормальная кожа и забивают ее поры. Признаком такого негативного воздействия является характерный «скрип» чисто вымытой кожи или волос. Оказывается, что вызывающее у некоторых раздражение чувство «мылкости» после пользования мягкой водой является признаком того, что защитная жировая пленка на коже цела и невредима. Именно она и скользит. В противном случае, приходится тратиться на лосьоны, умягчающие и увлажняющие кремы и прочие хитрости для восстановления той защиты кожи, которой нас и так снабдила матушка Природа.
Вместе с тем, необходимо упомянуть и о другой стороне медали. Мягкая вода с жесткостью менее 2 мг-экв/л имеет низкую буферную емкость (щелочность) и может, в зависимости от уровня рН и ряда других факторов, оказывать повышенное коррозионное воздействие на водопроводные трубы. Поэтому, в ряде применений (особенно в теплотехнике) иногда приходится проводить специальную обработку воды с целью достижения оптимального соотношения между жесткостью воды и ее коррозионной активностью.
Под жесткостью воды понимают свойство, обусловленное присутствием в воде растворенных солей, в основном кальция и магния. Жесткость воды подразделяется па карбонатную (присутствие в ней гидрокарбонатов магния и кальция) и некарбонатную (наличие солей сильных кислот - хлоридов или сульфатов кальция и магния). Сумма карбонатной и некарбонатной жесткости определяет общую жесткость.
Карбонатную жесткость называют временной, так как при длительном кипячении подобной воды гидрокарбонаты разлагаются с образованием осадка карбоната кальция и выделением углекислого газа:
Ca(HCO3)2 = СаСО3+СO2↑ + Н2O
Mg(НСО3)2 = Mg(ОН)2↓ + 2СO2↑
Жесткость воды, обусловленная наличием сульфатов магния и кальция, называется постоянной. Она может быть устранена лишь химическим путем:
CaSO4+Na2CO3=CaCO3↓+Na2SO4.
В настоящее время для устранения жесткости используют также ионообменные смолы.
Способы устранения жесткости воды
В природной воде растворены соли кальция и магния. Это гидрокарбонаты и сульфаты. Покажем два способа осаждения гидрокарбонатов для уменьшения жесткости воды. Первый способ – кипячение. При кипячении* растворимые гидрокарбонаты переходят в нерастворимые карбонаты, и жесткость воды уменьшается.
Сa(HCO3)2 = CaCO3 ↓ + h3O + CO2↑
Второй способ – добавление известковой воды. При добавлении известковой воды гидрокарбонаты переходят в карбонаты и вода становится более мягкой.
Сa(HCO3)2+ Ca(OH)2 = CaCO3 ↓ +2 h3O
Но жесткость воды зависит еще и от сульфатов кальция и магния. Сульфаты кальция и магния можно удалить с помощью карбоната натрия. При добавлении карбоната натрия сульфаты переходят в нерастворимые карбонаты кальция и магния.
CaSO4 + Na2CO3= CaCO3 ↓+ Na2SO4
Устранение из воды солей жесткости, т. е. умягчение её, необходимо производить для питания котельных установок, причем жесткость воды для котлов среднего и низкого давления должна быть не более 0,3 мг-экв/л. Умягчать воду требуется также для таких производств, как текстильное, бумажное, химическое, где вода должна иметь жесткость не более 0,7 -1,0 мг-экв/л. Умягчение воды для хозяйственно-питьевых целей также целесообразно, особенно в случае, если она превышает 7мг-экв/л. Применяют следующие основные методы умягчения воды:
реагентный метод - путем введения реагентов, способствующих образованию малорастворимых соединений кальция и магния и выпадению их в осадок;
катионовый метод, при котором умягчаемая вода фильтруется через вещества, обладающие способностью обменивать содержащиеся в них катионы (натрия или водорода) на катионы кальция и магния, растворенный в воде солей. А результате обмена задерживаются ионы кальция и магния и образуются натриевые соли, не придающие воде жесткость;
термический метод, заключающийся в нагревании воды до температуры выше 100°, при этом почти полностью удаляются соли карбонатной жесткости.
Часто методы умягчения применяют комбинированно. Например, часть солей жесткости удаляют реагентным способом, а оставшуюся часть с помощью катионного обмена. Из реагентных методов содово-известковый способ умягчения является наиболее распространенным. Сущность его сводится к получению вместо растворенных в воде солей Са Mg нерастворимых солей СаСО3 и Mg(OH)2, выпадающих в осадок. Оба реагента - соду Na2CO3 и известь Са(ОН)2 - вводят в умягчаемую воду одновременно или поочередно. Соли карбонатной, временной жесткости удаляют известью, не карбонатной, постоянной жесткости - содой. Химические реакции при удалении карбонатной жесткости протекают следующим образом:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3 + 2Н2О
Гидрат окиси магния Mg(OH)2 коагулирует и выпадает в осадок. Для устранения некарбонатной жесткости в умягчаемую воду вводят Na2CO3. Химические реакции при удалении некарбонатной жесткости следующие:
Na2CO3 + CaSO4 = CaCO3 + Na2SO4;
Na2CO3 + СаС12 = СаСО3 + 2NaCl.
В результате реакции получается углекислый кальций, который выпадает в осадок. Реагенты, применяемые при обработке воды, вводят в воду в следующих местах:
а) хлор (при предварительном хлорировании) - во всасывающие трубопроводы насосной станции первого подъема или в водоводы, подающие воду на станцию очистки;
б) коагулянт - в трубопровод перед смесителем или в смеситель;
в) известь для подщелачивания при коагулировании - одновременно с коагулянтом;
г) активированный уголь для удаления запахов и привкусов в воде до 5 мг/л - перед фильтрами. При больших дозах уголь следует вводить на насосной станции первого подъема или одновременно с коагулянтом в смеситель водоочистной станции, но не ранее чем через 10 мин после введения хлора;
д) хлор и аммиак для обеззараживания воды вводят до очистных сооружений и в фильтрованную воду. При наличии в воде фенолов аммиак следует вводить как при предварительном, так и при окончательном хлорировании.
К специальным видам очистки и обработки воды относятся опреснение, обессоливание, обезжелезивание, удаление из воды растворенных газов и стабилизация.
studfiles.net
Жесткость воды. Как определить в домашних условиях жесткость воды? Способы, рекомендации и отзывы
По телевизору то и дело мелькают сообщения о свойствах жесткой воды и ее вреде не только для бытовой техники, но и организма в целом. Что же это за вода и почему ее называют жесткой? Если удариться в научные факты и прибегнуть к помощи специальной литературы, то станет понятно, что степень жесткости определяют ионы кальция и магния. Чем их меньше, тем мягче и полезнее вода. И здесь справедливо встает вопрос о том, как определить жесткость воды в домашних условиях.
Зачем это нужно
Прежде чем решить поставленную задачу, необходимо разобраться, а нужно ли вообще знать, что такое жесткость воды, как определить в домашних условиях ее степень и что необходимо делать в случае ее превышения.
 Несомненно, каждый принимает решение самостоятельно, однако достаточно посмотреть на последствия применения излишне жесткой воды, и все сразу встает на свои места.
Несомненно, каждый принимает решение самостоятельно, однако достаточно посмотреть на последствия применения излишне жесткой воды, и все сразу встает на свои места.
К чему приводит жесткая вода
Ежегодно бытовая техника страдает от накипи, образовавшейся в результате избытка солей в воде, а это значит, ее эффективность снижается в среднем на 20 %.
 Из-за скопившегося известкового налета отопительные приборы испытывают трудности в теплоотдаче. Начинают расти затраты на электроэнергию.
Из-за скопившегося известкового налета отопительные приборы испытывают трудности в теплоотдаче. Начинают расти затраты на электроэнергию.
Требуется большее количество чистящих средств, в связи с замедлением процесса пенообразования и утраты эффективности удаления загрязнений.
Вступая в связь с моющими веществами шампуней и гелей для душа, жесткая вода образует невидимую пленку на теле, способную вызвать раздражение и сухость.
В связи с вышеизложенным, определение жесткости воды в домашних условиях становится не просто интересным занятием, а одним из действий на пути к здоровью.
Немного истории
Знаете ли вы, почему воду принято называть жесткой или мягкой? Такое понятие пошло еще с давних времен, когда для стирки использовалось мыло, содержащее жирные кислоты. Вступая в связь с тканью, они делали ее жесткой на ощупь. Другой версией является способность участия волокон в ионообменных процессах. Взаимодействуя с водой, они дают эффект жесткой ткани.
Так как определить жесткость воды в домашних условиях?
Способы
1. Самым простым и быстрым способом проверки, по мнению хозяек, является обычный чай. Достаточно заварить листовой чай, дать ему время настояться и спустя несколько минут посмотреть на его оттенок. Если вода жесткая, он будет мутным и темным. В мягкой воде чай приобретает персиковый цвет.
Также можно сравнить вес воды. Жесткая вода более тяжелая. Но для таких экспериментов потребуются высокоточные весы. Обычные вряд ли покажут ту едва уловимую разницу в весе.
2. Моющие средства тоже могут помочь узнать жесткость воды. Как определить в домашних условиях эту величину при помощи подручных средств? Очень просто! Всего-то понадобится намылить руки.

Мыло моментально пенится? Отлично, значит, содержание солей в воде минимально. А вот если пенообразование затягивается, значит, стоит задуматься о качестве воды.
3. Кстати, мыло станет помощником в определении степени жесткости, если его покрошить в воду. Нерастворенные частицы будут свидетельствовать об избыточном содержании кальция и магния.
А еще как измерить жесткость воды в домашних условиях? Среди отзывов о проверке качества воды можно встретить и указанный выше способ, позволяющий определить ее не хуже специального прибора. Правда, придется его немного усложнить и произвести некоторые вычисления.
Итак, нам понадобится хозяйственное 72 % мыло, очищенная бутилированная и обычная вода из-под крана.
Находим у мыла поперечный разрез и с него собираем стружку. Нам понадобится всего 1 грамм. Подогреваем дистиллированную воду (около десяти мл) и добавляем в нее мыльную стружку. После этого наполняем любой удобный сосуд обычной водой. Пол-литра будет достаточно. Берем шприц и добавляем по 1 мл мыльной воды в сосуд с чистой водой, не забывая каждый раз их размешивать. Прекратить данную манипуляцию нужно после появления устойчивых мыльных пузырей.
Теперь отвечаем на вопрос о том, как узнать жесткость воды в домашних условиях. Определите, сколько мл мыльного раствора было потрачено. Полученные данные умножьте на 2. Результат будет равняться степени жесткости.
4. Обратите внимание, как часто образуется накипь на чайнике. Чем чаще это происходит, тем больше в составе воды солей, а также кальция и магния, которые способствуют образованию налета.
5. Замечали ли вы, что брызги на стекле, высыхая, оставляют белые следы?
 Это служит еще одним подтверждением жесткости воды.
Это служит еще одним подтверждением жесткости воды.
6. Отличным помощником в решении этой задачи станет обыкновенная марганцовка. Контактируя с солями жесткости, марганцовка приобретает желтый оттенок. Если такого не произошло, с водой все в порядке.
7. Можно воспользоваться специальным тестом, идентифицирующим жесткость воды.
 Как определить в домашних условиях результат, подскажет индивидуальная инструкция. Зачастую достаточно опустить тестер в воду, подождать несколько секунд и наблюдать за изменением окрашивающейся полоски.
Как определить в домашних условиях результат, подскажет индивидуальная инструкция. Зачастую достаточно опустить тестер в воду, подождать несколько секунд и наблюдать за изменением окрашивающейся полоски.
Как смягчить воду
Итак, способов узнать, насколько жесткая вода, довольно много. Если вы обнаружили, что качество воды вас не устраивает, то воспользуйтесь некоторыми советами.
1. Самый известный метод, которым пользуются все, не задумываясь об истинном предназначении, это кипячение воды. Достаточно прокипятить воду в течение часа, а затем дать ей остыть, как на дне образуется осадок. В дальнейшем убрать его можно путем процеживания. Конечно, таким способом избавиться от солей не удастся, а вот немного смягчить воду представится возможным.
2. Нейтрализовать соль можно щелочью, которая содержится в соде. ¼ чайной ложки на стакан воды - и степень жесткости заметно уменьшена. Многие проверили это на практике!
3. Щелочь можно заменить миндальными отрубями. Они являются конечным продуктом переработки семян миндаля. Столовой ложки на стакан воды вполне хватит.
4. Наиболее простым вариантом является покупка специального фильтра. Однако исследование мнений пользователей на основе отзывов показало, что эффективности в использовании фильтров не наблюдается. Более того, необходимо постоянно следить за системой очистки воды и периодически менять некоторые элементы. Зачастую своевременно это сделать не представляется возможным, и вредные вещества снова оказываются в воде.
Заключение
Теперь вы знаете, что такое жесткость воды, как определить в домашних условиях ее степень и смягчить при помощи подручных средств. Несомненно, в вопросах качества питьевой воды стоит довериться профессиональным разработкам: специальным полоскам или измерительным устройствам, показывающим количество жестких солей. Однако если такая возможность не представляется, то решить проблему можно самостоятельно, не выходя из дома.
fb.ru