Урок 27. Состав и физические свойства воды. 4 свойства воды
1.4. Особые свойства воды
Известно, что в понятие «вода» следует включать вещества, состоящие не только из молекул Н2О16. Различные комбинации изотопов водорода и кислорода обусловливают существование 36 разновидностей воды. В природной воде 99,7 % молекул Н2О16, на долю остальных разновидностей молекул воды приходится лишь 0,3 %. Это не означает, что влияние других разновидностей молекул на свойства воды пропорционально их доле в общем объеме воды.
Вода - аномальное вещество. Прежде всего, при различных температурах и давлениях вода может находиться в одном из трех агрегатных состояний: твердом (лед), жидком и газообразном (пар).
При уменьшении температуры от 4 до 0 °С объем воды не уменьшается (как у всех других веществ, кроме висмута), а увеличивается. Плотность воды, имеющая максимальное значение при 4 °С, при этом уменьшается. При замерзании объем воды увеличивается примерно на 10 %. Температура замерзания воды с увеличением давления (до 19,6 МПа) понижается, а затем повышается.
Известно, что конвекция в водоемах (с пресной водой) прекращается при 4 °С. При этой температуре в нижних слоях находится вода с большей плотностью, чем в верхних слоях.
Морская вода замерзает при температуре минус 1,9 °С. Вода в капиллярах в почве иногда может замерзать и при температуре +4,4 °С.
Вода обладает чрезвычайно большой теплоемкостью, например в 10 раз большей, чем железо, в 33 раза большей, чем ртуть, в 3,3 раза большей, чем спирт и глицерин, и т. д. При этом обычно теплоемкость других жидкостей с увеличением температуры увеличивается. Вода характеризуется минимальным значением теплоемкости при 35 °С, а с ростом температуры теплоемкость вновь растет. Появление этого минимума объясняется разрушением ассоциаций (групп) молекул воды примерно при этой температуре.
Вода обладает очень высокой теплотой испарения и скрытой теплотой плавления. Например, теплота испарения воды в 8 раз, а скрытая теплота плавления в 27 раз больше, чем спирта. При атмосферном давлении для перехода воды в пар из окружающей среды требуется в 6,75 раза больше теплоты, чем при плавлении льда при том же давлении.
При конденсации влаги (образовании тумана) выделяется значительное количество теплоты. Это используется в установках, создающих искусственный туман; такие установки помимо орошения могут использоваться для предохранения растений от заморозков.
Электропроводность сухого льда и снега гораздо меньше электропроводности воды, причем электропроводность воды сильно зависит от наличия примесей, а на электропроводность льда они влияют очень мало. Электропроводность воды, естественно, зависит от количества растворенных в ней солей. Поэтому электропроводность морской воды на 2-3 порядка больше, чем электропроводность пресной речной воды, а по сравнению с химически чистой водой при 18 С - примерно в 12000 раз.
Вода является сильным растворителем. Эта способность воды характеризуется относительной диэлектрической проницаемостью, которая довольно высока и при 0°С равна около 87, а с ростом температуры уменьшается до 55,7 при 100 °С Таким образом, по сравнению с воздухом и водяным паром, диэлектрическая проницаемость которых равна 1, эта характеристика воды гораздо больше (для льда она равна 3,2),
В связи с наличием в воде растворенного воздуха, богатого кислородом, и ряда агрессивных компонентов вода воздействует на материалы, из которых возведены сооружения. При этом может происходить коррозия. Растворенные в воде соли и взвешенные в ней твердые частицы могут привести к «зарастанию» стенок, например трубопровода, вследствие чего пропускная способность таких труб может существенно уменьшиться.
Влияние магнитного поля на свойства воды. Магнитная обработка воды применяется для борьбы с накипеобразованием и для предотвращения коррозии в котлах и опреснительных установках, а также для ускорения осаждения взвесей при очистке води. В результате проведенных опытов получены данные об увеличении скорости фильтрации воды, прошедшей обработку в магнитном поле, об ускорении сроков схватывания бетонов, в состав которых входит такая вода. Однако механизм влияния магнитного поля на свойства воды пока изучен недостаточно.
studfiles.net
1. 4. Необычные свойства воды.
В Библии сказано, что Воду на Земле Бог создал до света, до создания тверди земной, даже до времени. Воду Бог создал в первый день Творения. Недаром на протяжении тысячелетий вода символизировала саму сущность жизни. Еще на заре цивилизации люди осознавали: вода - нечто живое, имеющее душу, способное развиваться и реагировать на окружающий мир.
Сегодня опытным путём доказано, что вода способна воспринимать, хранить и передавать информацию. Это свойство воды было названо «структурной памятью». Вода способна хранить информацию обо всех веществах, которые были в ней растворены – причём, хранит даже тогда, когда все примеси из неё удалены.
Структура воды – это организация её молекул.
На уроке окружающего мира мы узнали, что вода состоит из молекул. Изучая этот вопрос самостоятельно, мы нашли интересную информацию, о том что молекулы воды (рисунок 1), объединяясь между собой, образуют кластерные ячейки (рисунок 2 и 3), каждая из которых представляет собой как бы миниатюрный компьютер.
Рисунок 1.Молекула воды Рисунок 2. Кластер воды Рисунок 3.
Кластеры и являются своеобразными ячейками памяти, на которых вода хранит воспринимаемую информацию.
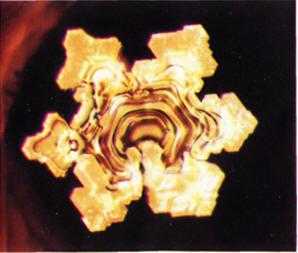
Под воздействием внешних факторов, молекулы воды перестраиваются. Особенно наглядно изменчивость воды продемонстрировали японские исследователи. Подвергая воду различным воздействиям, они замораживали ее, фотографировали и сравнивали изменения.1
Оказалось, что молекулярную структуру воды меняют вибрации человеческой энергии, мыслей, слов, идей и звуков (рисунок 4, 5, 6)1
Рисунок 4 Рисунок 5 Рисунок 6
Кристалл дистиллированной Антарктический лёд Ключевая вода
воды, не подвергнутый
никакому воздействию.
Влаборатории доктора Масару Эмото провели много экспериментов с целью найти то слово, которое сильнее всего очищает воду, и в результате обнаружили, что это не одно слово, а сочетание двух слов: "Любовь и Благодарность"(рисунок 7,8)1
Рисунок 7. Рисунок 8.
Слова любовь и Слова любовь и
благодарность благодарность
на английском. на японском.
Структура воды делает ее настоящим чудом природы и причиной, по которой на Земле, единственной из всех известных нам планет, есть жизнь в той форме, в которой она известна нам. Вспомните об этом в следующий раз, когда возьмете в руку стакан с водой.
2. Наши эксперименты.
Для определения качества воды взяли 4 образца и провели несколько опытов. Для опытов была взята: родниковая вода, взятая с освященного родника; Крещенская (святая) вода, освещенная в церкви в крещение; артезианская вода из магазина; водопроводная вода, взятая из под крана.
Опыт 1. Больше двух месяцев у нас в классе были налиты в баночках разные виды воды. Регулярно мы проверяли её состояние.
Таблица 1. Результаты проделанного опыта.
| Дата | Родниковая вода из источника | Крещенская родниковая вода | ||||
| Вкус | Цвет | Запах | Вкус | Цвет | Запах | |
| 10.10.15 | + | нет | нет | + | нет | нет |
| 25.11.15 | + | нет | нет | + | нет | нет |
| 15.12.15 | + | нет | нет | + | нет | нет |
| 11.01.16 | Появились изменения | нет | нет | + | нет | нет |
| 22.01.16. | Изменился | Небольшое помутнение | нет | + | нет | нет |
Выводы:
-за четыре месяца запаха от той и другой воды мы не почувствовали.
- через месяц артезианская вода стала неприятной, а крещенская вкус сохранила.
- через 4 месяца артезианская немного помутнела, а крещенская осталась прозрачной.
В результате проделанной работы мы пришли к выводу, что крещенская вода имеет свои особенности. Значит наша гипотеза о том, что крещенская вода отличается от простой воды и может много времени сохранять свои свойства - подтвердилась.
Опыт 2.
Определение водной среды.
Взято четыре образца воды.
В каждый образец была опущена индикаторная полоска и проверена среда жидкостей.
Вывод:
Все полоски имели одинаковую окраску, обозначающую нейтральную среду, значит содержит одинаковое количество щёлочи.
Опыт 3. Определение жёсткости с помощью химического реактива.
Для проведения опыта, налили в четыре колбы строго по 5 мл каждого вида воды. Капали реактив по одной капле в воду и тщательно перемешивали жидкость. Продолжали капать, пока вода не окрасилась в зелёный цвет. Чем больше капель реактива - тем жёстче вода.
Святая вода из источника - 10 капель реактива = 3,5 мл/литр. Вода средней жёсткости.
Крещенская вода - 9 капель реактива = 3,2 мл/лт. Вода средней жёсткости.
Водопроводная вода - 13 капель = 4,62 мл/лт. Вода средней жёсткости.
Артезианская вода - 2 капли = 0,71 мл/лт. Вода очень мягкая
Опыт 4.
Определение жесткости с помощью мыла. Натерли на мелкой терке хозяйственное мыло и добавили в каждую воду и размешать. Если в воде плохо пенится мыло и образуются хлопья - вода жесткая.
Родниковая вода - жесткая, очень плохо растворилось мыло и появились белые хлопья, вода мутная.
Крещенская (святая) вода - мягкая, мыло растворилось, нет белых хлопьев на поверхности, вода пенится, светлая.
Артезианская вода - мягкая, мыло растворилось, нет белых хлопьев на поверхности, хорошо пенится, вода светлая.
Водопроводная вода - жесткая, мыло плохо пенится, образовались хлопья, вода мутная.
Опыт 5.
Определение количества кислорода с помощью железа.
/Вода, в которой гвоздь покроется ржавчиной быстрее - насыщена большим количеством кислорода./
С помощью железных гвоздиков решили посмотреть, в каком образце они покроются ржавчиной быстрее остальных.
Опустили в каждый сосуд по гвоздику и поставили их в тёмное место на 2 дня.
Утром мы увидели, что гвоздики покрылись ржавчиной неравномерно, из чего мы можем сделать вывод, что святая (родниковая) вода и крещенская меньше всего насыщены кислородом. В водопроводной воде кислорода немного больше. В артезианской воде самое большое количества кислорода, так как ржавчины больше всего.
Вывод: В результате проведённых опытов, мы выяснили, что все образцы имеют нейтральную среду; самая мягкая вода - это вода из артезианской скважины. Она же насыщена более всех кислородом, поэтому лучше всего годится для питья и приготовления пищи.
Родниковая вода и водопроводная вода пригодны для бытовых нужд.
Заключение.
В результате проведённых опытов, мы не выявили существенного отличия по составу Святой воды от воды из других источников. За исключением того факта, что она долго не портится.
Феномен Богоявленской воды изучен мало и исследователям, похоже, еще не скоро удастся разгадать ее секрет. Она не проходила научные исследования, которым подвергают лекарственные средства, и никаких медицинских заключений о свойствах крещенской воды пока нет. Но есть многовековой опыт огромного количества людей. И, наверное, не так важно, что излечивает – вода или твердая вера человека в то, что это ему поможет. Главное – результат.3
Мы много узнали об уникальных свойствах воды, нашли фотоматериалы, иллюстрирующие красоту этого совершенного вещества, её целебные свойства. Вода – колыбель жизни, собственно воде наша планета Земля обязана возникновением и развитием всего живого. Её не заменить ни одними сокровищами мира. Воде дана волшебная сила – быть соком жизни на Земле. И если обычная вода дала жизнь биологическую, смертную, то святая вода дает жизнь без смерти. Это – вода вечной жизни. И для нее неважно, сколько времени прошло – день, год или век. Вот почему она не портится. Исследование святой воды, будет длиться еще долгие годы и вызывать разные споры и разногласия. Но собственные заключение мы уже сделали – верь в силу Святой воды, обращайся к Святым источникам, и как написано на плите Прощёного колодца «Всяк приходящий сюда обретёт благость».
Список источников:
1. Загадки воды//www.hram-feodosy.kiev.ua
2. Крещенская вода: научные доказательства чудесных свойств Крещенской воды//pravsobor.kz
3. О Святой воде. http://daranig.kz/ru/voda.php
4. Священники о святой воде. http://www.celitelstvo.su/news/uchjonye_i_svjashhenniki_o_svjatoj_vode/2010-01-18-106
5. "Закон Божий руководство для семьи и школы" составил протоиерей Серафим Слободской.
6. . Эмото Масару «Любовь и вода» – М.: София, 2008
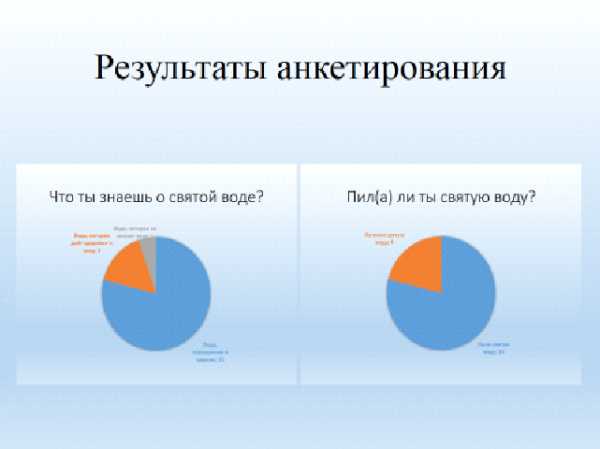
3Приложений 1.
Что ты знаешь о святой воде?Пил(а) ли ты святую воду?
13
studfiles.net
1.4 Физические свойства воды
Температура кипения воды (и все другие жидкости) зависит от атмосферного давления. Например, на вершине гор на Эвересте вода кипит при 68 ° C (154 ° F), по сравнению с 100 ° C (212 ° F) на уровне моря. Наоборот, глубокие воды в океане вблизи геотермальных жерла температура может достигать сотен градусов и оставаться жидкой. Вода обладает вторым по величине удельной теплоемкости любого известного вещества, после аммиака, а также высокая теплота испарения (40,65 кДж / моль -1), оба из которых являются результатом обширных водородных связей между молекулами. Эти два необычных свойств воды, чтобы позволить умеренным климатом Земле буферизации больших колебаний температуры [8-11].
Максимальная плотность воды происходит при 3,98. ° С (39,16 ° F). Вода становится еще менее плотное при замерзании, расширяя 9%. Это приводит к необычным явлениям: твердые формы вода, лед плавает на воде, что позволяет организму выжить внутри частично-замороженного тела воду, поскольку вода на дне, имеет температуру около 4 ° C (+39 ° F).
АДР этикетки для перевозки реактивной воды Вода смешивается со многими жидкостями, например этанол, в любых соотношениях, образуя одну однородную жидкость. Как газ, пары воды полностью смешивается с воздухом.Кругооборот водыполностью перемешивает всю воду на планете. Вода образует азеотропе со многими другими растворителями. Воду можно разделить путем электролиза на водород и кислород. Как окиси водорода, образуют воду, когда водород или водородсодержащих соединений сжечь или реагировать с кислородом или кислородсодержащих соединений. Вода не топливо, оно является конечным продуктом сгорания водорода. Энергии необходимы для расщепления воды на водород и кислород путем электролиза или любых других средств больше, чем энергия, выделяющаяся при водороде и кислороде рекомбинации. Элементы, которые являются более электроположительный, чем водород, таких как литий, натрий, кальций, калий и цезий вытеснять водород из воды, образуя гидроксиды. Будучи горючий газ, водород выделяется опасно и реакции воды с более электроположительным из этих элементов может быть взрывоопасной силой. При сверхвысоких давлениях вода содержится в глубокой части планет-гигантов Урана и Нептуна. Вода может стать металлический, который будет иметь важные последствия для генерации магнитного поля этих планет.
1.5 Химические свойства воды
Вода является химическое вещество с химической формулой h3O [8]: одна молекула воды состоит из двух водородных атомов ковалентно связан с одним атомом кислорода. Вода появляется в природе во всех трех общих состояний материи и может принимать различные формы на Земле: водяной пар и облака в небе, морская вода и айсберги в полярных океанов; ледниками и реками в горах, и жидкости в водоносных горизонтов в почва. Основные химические и физические свойства воды: Вода является вкуса, запаха жидкости при стандартной температуре и давлении. Цвет воды и льда, по своей природе, очень легкий голубой оттенок, хотя вода появляется бесцветное в небольших количествах. Кроме того, лед появляется бесцветное и водяного пара в основном как невидимый газ.
Вода является прозрачным, и, следовательно, водные растения могут жить в воде, поскольку солнечный свет может достигать их. Только сильные ультрафиолетового света немного поглощается. Поскольку молекулы воды не является линейной и атом кислорода имеет более высокую электроотрицательность, чем атомов водорода, имеют небольшой отрицательный заряд, а атомы водорода слабо положительной. В результате, вода является полярная молекула с дипольным моментом. Чистая взаимодействия между диполей на каждую молекулу причина эффективной скин-эффект на границе воды с другими веществами, или воздуха на поверхности, последний вызвал высокий поверхностное натяжение воды. Это дипольное природа способствует тенденцию молекул воды к образованию водородных связей, которые вызывают много воды специальными свойствами. полярная природа также способствует адгезии с другими материалами. Результатом взаимодействия этих свойств, Капиллярный относится к тенденции воду для перемещения вверх узкой трубе против силы тяжести. Это свойство, на которые ссылается всех сосудистых растений, таких, как деревья.
Вода является хорошим растворителем и часто упоминается как универсальный растворитель. Вещества, которые растворяют в воде, например, соли, сахара, кислоты, щелочи и некоторые газы - особенно кислорода, углекислого газа (сатурации) известны как гидрофильные (любящие воду) вещества, а те, что не хорошо смешать с водой (например, жиры и масла), известные как гидрофобные веществ. Все основные компоненты клетки (белки, ДНК и полисахаридов), также растворенный в воде.
studfiles.net
Урок окружающего мира по теме "Свойства воды. Как человек использует свойства воды". 4-й класс
Разделы: Начальная школа, Конкурс «Презентация к уроку»
Презентация к уроку
Загрузить презентацию (11,7 МБ)
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели урока:
- Расширить знания о свойствах воды.
- Развивать навыки практической деятельности (опыты), наблюдательность, внимание, аккуратность, любознательность.
- Формировать представление учащихся о применении свойств воды в жизни человека.
Задачи урока:
- Организовать наблюдение и на основе исследовательской деятельности и практической работы коллективно “открыть” свойства воды.
Оборудование урока:
- Презентация в программе PowerPoint.
- Карточки для каждой группы детей.
- Лабораторное оборудование для проведения опытов.
Ход урока
I. Организационный момент
- Ребята, сегодня на уроке мы будем разбирать очень интересные вопросы и делать открытия, но сначала вспомним, какую тему мы изучали на прошлом уроке?
- Разделитесь на группы по цвету карточек и выполните задание в группах по этой теме.
На карточках листы для самооценки. В течение урока вы их будете заполнять.
(Делятся на группы и выполняют задание, затем проверяем) (Слайд 2)
II. Актуализация знаний и постановка учебной проблемы.
- Ребята, подойдите ко мне и посмотрите, я сегодня на наш урок принесла вазу с водой и цветные шарики.
(Учитель берет стеклянную прозрачную банку и цветные шарики)
Учитель: - Павел, помоги мне, пожалуйста. Опусти эти цветные шарики на дно банки.
Ученик: - Что-то не получается! Посмотрите, вода как будто с силой выталкивает шарики, и они плавают на поверхности!
Как вы думаете, случайно ли это? (Вы правы, действительно, это одно из свойств воды.)
- Как вы думаете, чему будет посвящен наш урок? (на доске)
- Сравните свой вариант с мнением автора.
- Но прежде чем мы начнем работать по данной теме, давайте вспомним:
1. Для чего нужна вода живым организмам? (Слайд 3)
2. В каких состояниях вода встречается в природе? (Слайд 4)
3. Какие природные явления связаны с переходом воды из одного состояния в другое? Отгадайте загадки. (Слайд 5)
Он пушистый, серебристый, Но рукой его не тронь: Станет капелькою чистой, Как поймаешь на ладонь. (Снег)
Без досок, без топоров Через речку мост готов. Мост, как синее стекло,- Скользко, весело, светло! (Лед)
Без пути и без дороги Ходит самый длинноногий. В тучах прячется, во мгле, Только ноги на земле. (Дождь)
Утром бусы засверкали, Всю траву собой заткали, А пошли искать их днем, Ищем, ищем- не найдем. (Роса)
- А еще это туман, иней, облака. (Слайд 6)
4. А какие уже свойства воды вы знаете? (Слайд 7)
III. Поиск решения.
- А для того, чтобы еще больше узнать о свойствах воды, вам предстоит стать настоящими исследователями и провести наблюдения и опыты.
В ходе нашей работы мы будем заполнять таблицу (на доске, только шапка и пустые ячейки).
| Свойства | Использование человеком |
| Выталкивающая сила | Плавание. Водный транспорт. |
| Закон сообщающихся сосудов | Водопровод, фонтан, чайник, лейка, водонапорная башня. |
| Текучесть | Водяное колесо на водяной мельнице, турбина на гидроэлектростанции. |
| Растворитель | Стирка белья, приготовление пищи и напитков |
| Несжимаемость | Гидравлический пресс, домкрат |
Лабораторный опыт № 1. (О выталкивающей силе воды показывает учитель)
- На штативе вы видите пружинку, на ней гиря, пружинка растянута. Я поднимаю снизу гирю, что при этом делает пружинка? Сжимается, значит, я гирю выталкиваю снизу, применяя силу. А теперь я гирю погружаю в воду и вижу, что часть воды вытиснилась, а пружинка сжалась, значит, на груз действует какая – то сила. А теперь найдите ответ на вопрос : Что это за сила? (Работа со статьёй учебника с.83)
Вывод: Вода обладает выталкивающей силой. Она направлена вверх и равна весу вытесненной воды. (Слайд 8)
- Как человек может в жизни использовать это свойство воды? (Выслушиваем ответы детей.) Прекрасно! Давайте запишем это в таблицу.
Это свойство открыл известный Древнегреческий ученый Архимед. (Слайд 9)
- У Даши к этому уроку было свое задание. Она расскажет нам легенду про Архимеда. (Фрагмент мультфильма “Коля, Оля и Архимед”)
Давайте проверим это опытным путем. Кристина, помоги мне. (Кристина выходит и демонстрирует опыт под руководством учителя).
Проведём опыты:
Перед вами стакан с водой, кусок дерева, камень.
- опусти в стакан с водой кусок дерева. Что произошло? (он не тонет)
- опусти в стакан с водой камень. Что произошло? (он тонет)
Делают вывод: дерево выталкивается на поверхность, потому что весит меньше вытесненной воды, камень тонет, так как его вес больше, чем выталкивающая сила.
- Тогда возникает вопрос, а почему не тонет корабль, корпус которого сделан из железа? (Слайд 10)
- Давайте проверим ваши предположения и прочитаем второй абзац на с.84.
- Архимедом было замечено ещё одно свойство воды, о котором нам расскажет ученица 10 класса. (Выступление ученицы 10 класса. Представление фонтана.)
(Слайд 11,12)
- Кто понял, где человек использует это свойство? (Работа со статьёй учебника)
Делают вывод: на нем основана работа фонтанов и водопровода.
- Ребята, а хотите ли вы стать настоящими учеными и провести исследования?
Для этого вам необходимо разделиться на группы.
- Перед вами инструкция по проведению опытов. Вам необходимо подробно ее изучить и провести исследование пошагово в соответствии с ней. Затем вы должны обсудить и представить полученный результат.
Группа №1. Текучесть воды.
1.Возьмите пипетку, наберите в неё немного воды и капните на стекло несколько раз.
2.Что вы наблюдаете?
3.Вывод.
План ответа.
1.Расскажите, что делали, что наблюдали, вывод.
2.Дополнительная информация из учебника (стр.84 последний абзац).
3.Где человек использует свойство текучести воды?
(Слайд 13, 14)
Группа №2. Несжимаемость воды.
1.Возьмите шприц и наберите в него воду.
2.Аккуратно закрыв отверстие указательным пальцем, попробуйте сжать воду в шприце.
3.Что вы наблюдаете?
4.Вывод.
План ответа.
1.Расскажите, что делали, что наблюдали, вывод.
2.Дополнительная информация из учебника (стр.85-86).
3.Где человек использует свойство несжимаемости воды?
(Слайд 15, 16)
Группа №3. Вода – растворитель.
Сказка: Недавно мне на глаза попалась сказка, в которой содержался вопрос, на который вы, я думаю, поможете мне ответить. Два осла шли по дороге с кладью. Один был навьючен солью, а другой ватой.
Первый осел, едва передвигал ноги, так тяжела была его ноша. Второй осел шел весело и легко. Вскоре животным пришлось переходить речку. Осел, навьюченный солью, зашел в воду и стал купаться: он то ложился в воду, то снова становился на ноги. Когда осел вышел из воды, ноша его стала гораздо легче. Другой осел, глядя на первого, тоже стал купаться. Но чем дольше он купался, тем тяжелее становилась его поклажа. Почему же ноша первого осла после купания стала легче?
Выдвигаем гипотезы.
1.Возьмите кусок сахара, положите в стакан с водой, размешайте ложкой.
2.Во второй стакан положите речной песок, размешайте ложкой.
2.Что вы наблюдаете?
3.Вывод.
План ответа.
1.Расскажите, что делали, что наблюдали, вывод.
2.Дополнительная информация из учебника (стр.85).
3.Где человек использует свойство растворимости воды.
(Слайд 17, 18)
- Растворить соль легко, труднее сделать воду снова пресной. Рассмотрите картинку и скажите, как можно получить пресную воду? (для этого её нужно нагреть до кипения и превратить в пар, а затем охладить в другом сосуде) - Верно, такая вода, совершенно лишённая солей, очень ценится в химии и медицине. (Слайд 19)
- А мы попробуем профильтровать воду, в которой пытались растворить песок. (Все группы).
Возьмите колбы с воронкой, вставьте бумагу для фильтрации. Давайте попробуем профильтровать воду с песком. Что наблюдаем?
Молодцы! Вы очень хорошо поработали. Садитесь на свои места.
(Фрагмент фильма “Загадочные свойства воды)
-На следующем уроке мы продолжим изучение этой темы.
А сейчас проверим, насколько вы усвоили свойства воды, исследованные нами сегодня на уроке.
IV. Самостоятельное применение знаний.
Тест. (Слайд 20)
- Прочитайте утверждения. Поставьте (+) если вы согласны с утверждением и (-) если не согласны.
Вопросы.
1.Воду можно сжать.
2.Вода – хороший растворитель.
3.Железо и камень тонут в воде т. к. их вес больше чем выталкивающая сила.
4.Вода – прозрачна.
5.Держаться на воде и плавать человеку помогает сила тяжести.
6.Выталкивающая сила направлена вниз.
7.Закон сообщающихся сосудов открыл Архимед.
8.На планете Земля большую часть занимает вода, а не суша.
- Проверим правильность ответов. (Слайд 21)
Работа в тетрадях. С.33 №2, №6 (в парах)
Обсуждение.
V. Итог урока.
Оцените себя с помощью листа самооценки. (Ставят оценки за урок, объясняют)
Закончите предложения, поработав в парах (Слайд 22)
- Самое интересное задание для меня...
- Самое трудное задание для меня...
- Ты преодолел трудность?
- У меня возникло желание...
xn--i1abbnckbmcl9fb.xn--p1ai
Урок 27. Состав и физические свойства воды – HIMI4KA
В уроке 27 «Состав и физические свойства воды» из курса «Химия для чайников» узнаем, что из себя представляет вода, выясним её состав, а также физические свойства.

Наиболее распространенным оксидом на Земле является оксид водорода h3O, или вода. Без воды, как и без кислорода, невозможна жизнь человека, животных и растений.
Вода — единственное вещество, существующее на Земле одновременно в трех агрегатных состояниях: жидком, твердом и газообразном. Она является основным компонентом морей и океанов, ледников и айсбергов, облаков и тумана.
Около 70 % поверхности Земли покрыто океанами, морями, реками и озерами — природными хранилищами воды. Из космоса толстый слой воды имеет голубой цвет (рис. 104), вот почему нашу планету называют голубой. Вода входит в состав всех живых организмов, а также очень многих минералов.

Состав и строение воды
Как вы уже знаете, молекула воды состоит из трех атомов — двух атомов водорода и одного атома кислорода (рис. 105). Относительная молекулярная масса воды равна:
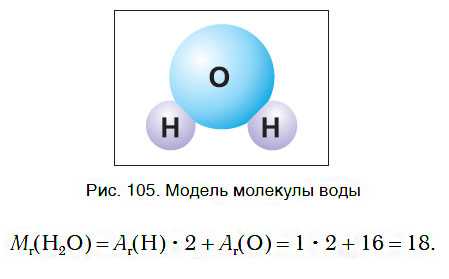
Следовательно, молярная масса воды равна:
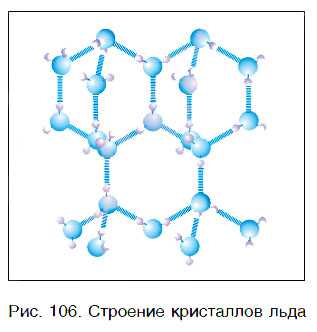
Вода — это вещество с молекулярным строением. В твердом (рис. 106) и жидком агрегатных состояниях молекулы воды прочно связаны друг с другом. Этим во многом объясняется целый ряд удивительных физических свойств воды.
Физические свойства воды
При комнатных условиях вода представляет собой жидкость без вкуса и запаха. В тонком слое вода не имеет цвета. Однако при толщине более 2 м она имеет голубой цвет. Совершенно чистая вода очень плохо проводит электрический ток.
На заметку: По тому, как проводит электрический ток вода, можно судить о ее чистоте — чем ниже электропроводность, тем чище вода.
У большинства веществ в твердом состоянии плотность выше, чем в жидком. В отличие от них вода в твердом агрегатном состоянии (лед) имеет более низкую плотность, чем в жидком. При 0 °С плотность льда равна примерно 0,92 г/см3, а плотность жидкой воды — примерно 1,00 г/см3. Это означает, что лед легче воды, поэтому он не тонет в ней (рис. 107). Такая особенность воды объясняет, почему водоемы начинают замерзать не со дна, а с поверхности и очень редко промерзают до самого дна. Это защищает живые организмы, обитающие в реках и морях, от гибели.
У воды высокая теплоемкость, поэтому она медленно нагревается, но и медленно остывает. Это позволяет морям и океанам накапливать тепло летом (и днем) и высвобождать его зимой (и ночью), что предотвращает резкие колебания температуры воздуха на нашей планете в течение года (и суток). Моря и океаны служат своеобразными аккумуляторами тепла на нашей планете.

При нормальном давлении (101,3 кПа) температура кипения воды равна 100 °С. При понижении давления температура кипения воды понижается. Например, в горах на высоте около 5000 м давление существенно ниже нормального (примерно в два раза), поэтому вода закипает в этих условиях при температуре около 84 °С. Понятно, что варить продукты до готовности в горах необходимо более длительное время. И наоборот, в скороварке, где создается высокое давление, вода закипает при температуре выше 100 °С, что позволяет быстрее приготавливать пищу.
Вода как растворитель
С совершенно чистой водой, не содержащей никаких других веществ, большинство людей никогда не встречается. Такая вода используется только в специальных целях.
Почти все жидкости, с которыми мы сталкиваемся в повседневной жизни и деятельности, представляют собой растворы различных веществ.
Раствор — это однородная смесь двух и более веществ.
Одно из веществ, входящих в состав раствора, называется растворителем, а остальные — растворенными веществами. Очень часто растворителем является вода. Вода может растворять твердые, жидкие и газообразные вещества.
Все природные воды содержат растворенные соли. Их легко обнаружить экспериментально, выпарив воду на часовом стекле. Кроме солей, вода может растворять различные газы. Их присутствие (правда, не всегда) можно обнаружить экспериментально. Например, поместив пробирку с холодной водой из-под крана в теплое место, через некоторое время можно заметить у стенок пробирки пузырьки. Это растворенные газы (преимущественно кислород) выделяются из раствора при его нагревании до комнатной температуры (рис. 108).

Многие жидкости также хорошо растворимы в воде. Например, серная кислота и спирт неограниченно растворяются в воде. В таком случае говорят, что вещество смешивается с водой в любых соотношениях. Из-за хорошей растворимости многих веществ в воде ее иногда называют универсальным растворителем.
Краткие выводы урока:
- Вода не имеет вкуса, цвета (в тонком слое) и запаха, кипит при 100 °С, а переходит в твердое состояние при 0 °С.
- Плотность твердой воды меньше, чем жидкой.
- Раствор — это однородная смесь двух и более веществ.
- Вода является универсальным растворителем — она хорошо растворяет многие твердые, жидкие и газообразные вещества.
Надеюсь урок 27 «Состав и физические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 27. Состав и физические свойства воды
Оценкаhimi4ka.ru