Что такое алюминий: формула, реакции, свойства и применение. Свойства воды и алюминия
Химические и физические свойства алюминия. Физические свойства гидроксида алюминия :: SYL.ru
Этот легкий металл с серебристо-белым оттенком в современной жизни встречается почти повсеместно. Физические и химические свойства алюминия позволяют широко использовать его в промышленности. Самые известные месторождения – в Африке, Южной Америке, в Карибском регионе. В России места добычи бокситов имеются на Урале. Мировыми лидерами по производству алюминия являются Китай, РФ, Канада, США.
Добыча Al
В природе этот серебристый металл в силу своей высокой химической активности встречается лишь в виде соединений. Наиболее известные геологические породы, содержащие алюминий, – это бокситы, глиноземы, корунды, полевые шпаты. Промышленное значение имеют бокситы и глиноземы, именно месторождения этих руд позволяют добывать алюминий в чистом виде.
Свойства
Физические свойства алюминия позволяют легко вытягивать заготовки этого металла в проволоку и прокатывать в тонкие листы. Этот металл не является прочным, для повышения данного показателя при выплавке его легируют различными добавками: медью, кремнием, магнием, марганцем, цинком. Для промышленного назначения важно еще одно физическое свойство вещества алюминия – это его способность быстро окисляться на воздухе. Поверхность изделия из алюминия в естественных условиях обычно покрыта тонкой оксидной пленкой, которая эффективно защищает металл и препятствует его коррозии. При уничтожении этой пленки серебристый металл быстро окисляется, при этом его температура заметно повышается.
Внутреннее строение алюминия
Физические и химические свойства алюминия во многом зависят от его внутреннего строения. Кристаллическая решетка этого элемента является разновидностью гранецентрированного куба. 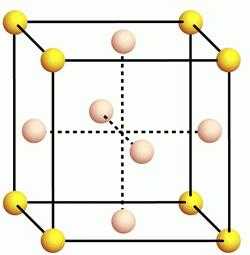 Данный тип решетки присущ многим металлам, таким, как медь, бром, серебро, золото, кобальт и другие. Высокая теплопроводность и способность проводить электричество сделали этот металл одним из самых востребованных в мире. Остальные физические свойства алюминия, таблица которых представлена ниже, раскрывают полностью его свойства и показывают сферы их применения.
Данный тип решетки присущ многим металлам, таким, как медь, бром, серебро, золото, кобальт и другие. Высокая теплопроводность и способность проводить электричество сделали этот металл одним из самых востребованных в мире. Остальные физические свойства алюминия, таблица которых представлена ниже, раскрывают полностью его свойства и показывают сферы их применения.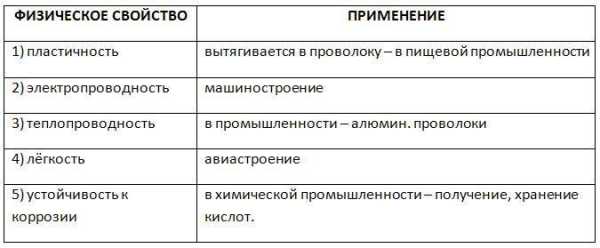
Легирование алюминия
Физические свойства меди и алюминия таковы, что при добавлении к алюминиевому сплаву некоторого количества меди его кристаллическая решетка искривляется, и прочность самого сплава повышается. На этом свойстве Al основано легирование легких сплавов для повышения их прочности и стойкости к воздействию агрессивной среды.
Объяснение процесса упрочнения лежит в поведении атомов меди в кристаллической решетке алюминия. Частицы Cu стремятся выпасть из кристаллической решетки Al, группируются на ее особых участках. 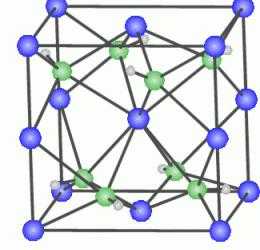 Там, где атомы меди образуют скопления, образуется кристаллическая решетка смешанного типа CuAl2 , в которой частицы серебристого металла одновременно входят в состав и общей кристаллической решетки алюминия, и в состав решетки смешанного типа CuAl2. Силы внутренних связей в искаженной решетке гораздо больше, чем в обычной. А значит, и прочность новообразованного вещества гораздо выше.
Там, где атомы меди образуют скопления, образуется кристаллическая решетка смешанного типа CuAl2 , в которой частицы серебристого металла одновременно входят в состав и общей кристаллической решетки алюминия, и в состав решетки смешанного типа CuAl2. Силы внутренних связей в искаженной решетке гораздо больше, чем в обычной. А значит, и прочность новообразованного вещества гораздо выше.
Химические свойства
Известно взаимодействие алюминия с разбавленными серной и соляной кислотой. При нагревании этот металл в них легко растворяется. Холодная концентрированная или сильно разбавленная азотная кислота не растворяет этот элемент. Водные растворы щелочей активно воздействуют на вещество, в процессе реакции образуя алюминаты – соли, в составе которых имеются ионы алюминия. Например:
Al2O3 +3h3O+2NaOH=2Na[Al(OH)4]
Получившееся в результате реакции соединение носит название тетрагидроксоалюминат натрия.
Тонкая пленка на поверхности алюминиевых изделий защищает этот металл не только от воздуха, но и от воды. Если эту тонкую преграду убрать, элемент станет бурно взаимодействовать с водой, выделяя из нее водород.
2AL+6h3O= 2 AL (OH)3+3Н2↑
Образовавшееся вещество называется гидроксидом алюминия.
AL (OH)3 реагирует с щелочью, образуя кристаллы гидроксоалюмината:
Al(OH)2+NaOH=2Na[Al(OH)4]
Если это химическое уравнение сложить с предыдущим, получим формулу растворения элемента в щелочном растворе.
Al(OH)3+2NaOH+6h3O=2Na [Al(OH)4]+3h3↑
Горение алюминия
Физические свойства алюминия позволяют ему вступать в реакцию с кислородом. Если порошок этого металла или алюминиевую фольгу нагреть, то она вспыхивает и горит белым ослепительным пламенем. В конце реакции образуется оксид алюминия Al2O3.
Глинозем
Полученный оксид алюминия имеет геологическое название глинозем. В естественных условиях он встречается в виде корунда – твердых прозрачных кристаллов. Корунд отличается высокой твердостью, в шкале твердых веществ его показатель составляет 9. Сам корунд бесцветен, но различные примеси могут окрасить его в красный и синий цвет, так получаются драгоценные камни, которые в ювелирном деле называются рубинами и сапфирами.
Физические свойства оксида алюминия позволяют выращивать эти драгоценные камни в искусственных условиях. Технические драгоценные камни используются не только для ювелирных украшений, они применяются в точном приборостроении, для изготовления часов и прочего. Широко используются искусственные кристаллы рубина и в лазерных устройствах.
Мелкозернистая разновидность корунда с большим количеством примесей, нанесенная на специальную поверхность, известна всем как наждак. Физические свойства оксида алюминия объясняют высокие абразивные свойства корунда, а также его твердость и устойчивость к трению.
Гидроксид алюминия
Al2 (OH)3 является типичным амфотерным гидроксидом. В соединении с кислотой это вещество образует соль, содержащую положительно заряженные ионы алюминия, в щелочах образует алюминаты. Амфотерность вещества проявляется в том, что он может вести себя и как кислота, и как щелочь. Это соединение может существовать и в желеобразном, и в твердом виде.  В воде практически не растворяется, но вступает в реакцию с большинством активных кислот и щелочей. Физические свойства гидроксида алюминия используются в медицине, это популярное и безопасное средство снижения кислотности в организме, его применяют при гастритах, дуоденитах, язвах. В промышленности Al2 (OH)3 используется в качестве адсорбента, он прекрасно очищает воду и осаждает растворенные в ней вредные элементы.
В воде практически не растворяется, но вступает в реакцию с большинством активных кислот и щелочей. Физические свойства гидроксида алюминия используются в медицине, это популярное и безопасное средство снижения кислотности в организме, его применяют при гастритах, дуоденитах, язвах. В промышленности Al2 (OH)3 используется в качестве адсорбента, он прекрасно очищает воду и осаждает растворенные в ней вредные элементы.
Промышленное использование
Алюминий был открыт в 1825 году. Поначалу данный металл ценился выше золота и серебра. Это объяснялось сложностью его извлечения из руды. Физические свойства алюминия и его способность быстро образовывать защитную пленку на своей поверхности затрудняли исследование этого элемента. Лишь в конце 19 века был открыт удобный способ плавки чистого элемента, пригодный для использования в промышленных масштабах.
Легкость и способность сопротивляться коррозии – уникальные физические свойства алюминия. Сплавы этого серебристого металла применяются в ракетной технике, в авто-, судо-, авиа- и приборостроении, в производстве столовых приборов и посуды.
Как чистый металл Al используется при изготовлении деталей для химической аппаратуры, электропроводов и конденсаторов. Физические свойства алюминия таковы, что его электропроводность не так высока, как у меди, но этот недостаток компенсируется легкостью рассматриваемого металла, что позволяет делать провода из алюминия более толстыми. Так, при одинаковой электропроводности алюминиевый провод весит в два раза меньше медного.
Не менее важным является применение Al в процессе алитирования. Так называется реакция насыщения поверхности чугунного или стального изделия алюминием с целью защиты основного металла от коррозии при нагревании.
В настоящее время изведанные запасы алюминиевых руд вполне сопоставимы с потребностями людей в этом серебристом металле. Физические свойства алюминия могут преподнести еще немало сюрпризов его исследователям, а сферы применения этого металла гораздо шире, чем можно представить.
www.syl.ru
Химические свойства алюминия.
Алюминий — амфотерный металл. Электронная конфигурация атома алюминия 1s22s22p63s23p1. Таким образом, на внешнем электронном слое у него находятся три валентных электрона: 2 — на 3s- и 1 — на 3p-подуровне. В связи с таким строением для него характерны реакции, в результате которых атом алюминия теряет три электрона с внешнего уровня и приобретает степень окисления +3. Алюминий является высокоактивным металлом и проявляет очень сильные восстановительные свойства.
Взаимодействие алюминия с простыми веществами
с кислородом
При контакте абсолютно чистого алюминия с воздухом атомы алюминия, находящиеся в поверхностном слое, мгновенно взаимодействуют с кислородом воздуха и образуют тончайшую, толщиной в несколько десятков атомарных слоев, прочную оксидную пленку состава Al2O3, которая защищает алюминий от дальнейшего окисления. Невозможно и окисление крупных образцов алюминия даже при очень высоких температурах. Тем не менее, мелкодисперсный порошок алюминия довольно легко сгорает в пламени горелки:
4Аl + 3О2 = 2Аl2О3
с галогенами
Алюминий очень энергично реагирует со всеми галогенами. Так, реакция между перемешанными порошками алюминия и йода протекает уже при комнатной температуре после добавления капли воды в качестве катализатора. Уравнение взаимодействия йода с алюминием:
2Al + 3I2 =2AlI3
С бромом, представляющим собой тёмно-бурую жидкость, алюминий также реагирует без нагревания. Образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
2Al + 3Br2 = 2AlBr3
Реакция между алюминием и хлором протекает при внесении нагретой алюминиевой фольги или мелкодисперсного порошка алюминия в заполненную хлором колбу. Алюминий эффектно сгорает в хлоре в соответствии с уравнением:
2Al + 3Cl2 = 2AlCl3
с серой
При нагревании до 150-200 оС или после поджигания смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с выделением света:
— сульфид алюминия
с азотом
При взаимодействии алюминия с азотом при температуре около 800 oC образуется нитрид алюминия:
с углеродом
При температуре около 2000oC алюминий взаимодействует с углеродом и образует карбид (метанид) алюминия, содержащий углерод в степени окисления -4, как в метане.
Взаимодействие алюминия со сложными веществами
с водой
Как уже было сказано выше, стойкая и прочная оксидная пленка из Al2O3 не дает алюминию окисляться на воздухе. Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
2Al + 6h3O = 2Al(OH)3 + 3h3↑
с оксидами металлов
После поджигания смеси алюминия с оксидами менее активных металлов (правее алюминия в ряду активности) начинается крайне бурная сильно-экзотермическая реакция. Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000оС. В результате этой реакции образуется высокочистое расплавленное железо:
2AI + Fe2O3 = 2Fe + Аl2О3
Данный метод получения металлов из их оксидов путем восстановления алюминием называется алюмотермией или алюминотермией.
с кислотами-неокислителями
Взаимодействие алюминия с кислотами-неокислителями, т.е. практически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
а) 2Аl + 3Н2SO4(разб.) = Аl2(SO4)3 + 3h3↑
2Аl0 + 6Н+ = 2Аl3+ + 3h30;
б) 2AI + 6HCl = 2AICl3 + 3h3↑
с кислотами-окислителями
-концентрированной серной кислотой
Взаимодействие алюминия с концентрированной серной кислотой в обычных условиях, а также низких температурах не происходит вследствие эффекта, называемого пассивацией. При нагревании реакция возможна и приводит к образованию сульфата алюминия, воды и сероводорода, который образуется в результате восстановления серы, входящей в состав серной кислоты:
Такое глубокое восстановление серы со степени окисления +6 (в h3SO4) до степени окисления -2 (в h3S) происходит благодаря очень высокой восстановительной способности алюминия.
— концентрированной азотной кислотой
Концентрированная азотная кислота в обычных условиях также пассивирует алюминий, что делает возможным ее хранение в алюминиевых емкостях. Так же, как и в случае с концентрированной серной, взаимодействие алюминия с концентрированной азотной кислотой становится возможным при сильном нагревании, при этом преимущественно протекает реакция:
— разбавленной азотной кислотой
Взаимодействие алюминия с разбавленной по сравнению с концентрированной азотной кислотой приводит к продуктам более глубокого восстановления азота. Вместо NO в зависимости от степени разбавления могут образовываться N2O и Nh5NO3:
8Al + 30HNO3(разб.) = 8Al(NO3)3 +3N2O↑ + 15h3O
8Al + 30HNO3(оч. разб) = 8Al(NO3)3 + 3Nh5NO3 + 9h3O
со щелочами
Алюминий реагирует как с водными растворами щелочей:
2Al + 2NaOH + 6h3O = 2Na[Al(OH)4] + 3h3↑
так и с чистыми щелочами при сплавлении:
В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия:
Аl2О3 + 2NaOH + 3h3O = 2Na[Al(OH)4]
Аl2О3 + 2NaOH = 2NaAlO2 + Н2О
В случае водного раствора алюминий, очищенный от защитной оксидной пленки, начинает реагировать с водой по уравнению:
2Al + 6h3O = 2Al(OH)3 + 3h3↑
Образующийся гидроксид алюминия, будучи амфотерным, реагирует с водным раствором гидроксида натрия с образованием растворимого тетрагидроксоалюмината натрия:
Al(OH)3 + NaOH = Na[Al(OH)4]
scienceforyou.ru
Алюминий: свойства химические и физические
Одними из самых удобных в обработке материалов являются металлы. Среди них также есть свои лидеры. Так, например, основные свойства алюминия известны людям уже давно. Они настолько подходят для применения в быту, что данный металл стал очень популярным. Каковы же свойства алюминия как простого вещества и как атома, рассмотрим в данной статье.

История открытия алюминия
Издавна человеку было известно соединение рассматриваемого металла - алюмокалиевые квасцы. Оно использовалось как средство, способное набухать и связывать между собой компоненты смеси, это было необходимо и при выделке кожаных изделий. О существовании в чистом виде оксида алюминия стало известно в XVIII веке, во второй его половине. Однако при этом чистое вещество получено не было.
Сумел же выделить металл из его хлорида впервые ученый Х. К. Эрстед. Именно он обработал амальгамой калия соль и выделил из смеси серый порошок, который и был алюминием в чистом виде.
Тогда же стало понятно, что химические свойства алюминия проявляются в его высокой активности, сильной восстановительной способности. Поэтому долгое время с ним никто больше не работал.

Однако в 1854 году француз Девиль смог получить слитки металла методом электролиза расплава. Этот способ актуален и по сей день. Особенно массовое производство ценного материала началось в XX веке, когда были решены проблемы получения большого количества электроэнергии на предприятиях.
На сегодняшний день данный металл - один из самых популярных и применяемых в строительстве и бытовой промышленности.
Общая характеристика атома алюминия
Если характеризовать рассматриваемый элемент по положению в периодической системе, то можно выделить несколько пунктов.
- Порядковый номер - 13.
- Располагается в третьем малом периоде, третьей группе, главной подгруппе.
- Атомная масса - 26,98.
- Количество валентных электронов - 3.
- Конфигурация внешнего слоя выражается формулой 3s23p1.
- Название элемента - алюминий.
- Металлические свойства выражены сильно.
- Изотопов в природе не имеет, существует только в одном виде, с массовым числом 27.
- Химический символ - AL, в формулах читается как "алюминий".
- Степень окисления одна, равна +3.
Химические свойства алюминия полностью подтверждаются электронным строением его атома, ведь имея большой атомный радиус и малое сродство к электрону, он способен выступать в роли сильного восстановителя, как и все активные металлы.
Алюминий как простое вещество: физические свойства
Если говорить об алюминии, как о простом веществе, то он представляет собой серебристо-белый блестящий металл. На воздухе быстро окисляется и покрывается плотной оксидной пленкой. Тоже самое происходит и при действии концентрированных кислот.

Наличие подобной особенности делает изделия из этого металла устойчивыми к коррозии, что, естественно, очень удобно для людей. Поэтому и находит такое широкое применение в строительстве именно алюминий. Свойства вещества также еще интересны тем, что данный металл очень легкий, при этом прочный и мягкий. Сочетание таких характеристик доступно далеко не каждому веществу.
Можно выделить несколько основных физических свойств, которые характерны для алюминия.
- Высокая степень ковкости и пластичности. Из данного металла изготовляют легкую, прочную и очень тонкую фольгу, его же прокатывают в проволоку.
- Температура плавления - 660 0С.
- Температура кипения - 2450 0С.
- Плотность - 2,7 г/см3.
- Кристаллическая решетка объемная гранецентрированная, металлическая.
- Тип связи - металлическая.
Физические и химические свойства алюминия определяют области его применения и использования. Если говорить о бытовых сторонах, то большую роль играют именно уже рассмотренные нами выше характеристики. Как легкий, прочный и антикоррозионный металл, алюминий применяется в самолето- и кораблестроении. Поэтому эти свойства очень важно знать.
Химические свойства алюминия
С точки зрения химии, рассматриваемый металл - сильный восстановитель, который способен проявлять высокую химическую активность, будучи чистым веществом. Главное - это устранить оксидную пленку. В этом случае активность резко возрастает.
Химические свойства алюминия как простого вещества определяются его способностью вступать в реакции с:
- кислотами;
- щелочами;
- галогенами;
- серой.
С водой он не взаимодействует при обычных условиях. При этом из галогенов без нагревания реагирует только с йодом. Для остальных реакций нужна температура.

Можно привести примеры, иллюстрирующие химические свойства алюминия. Уравнения реакций взаимодействия с:
- кислотами - AL + HCL = AlCL3 + h3;
- щелочами - 2Al + 6h3O + 2NaOH = Na[Al(OH)4] + 3Н2;
- галогенами - AL + Hal = ALHal3;
- серой - 2AL + 3S = AL2S3.
В целом, самое главное свойство рассматриваемого вещества - это высокая способность к восстановлению других элементов из их соединений.
Восстановительная способность
Восстановительные свойства алюминия хорошо прослеживаются на реакциях взаимодействия с оксидами других металлов. Он легко извлекает их из состава вещества и позволяет существовать в простом виде. Например: Cr2O3 + AL = AL2O3 + Cr.
В металлургии существует целая методика получения веществ, основанная на подобных реакциях. Она получила название алюминотермии. Поэтому в химической отрасли данный элемент используется именно для получения других металлов.
Распространение в природе
По распространенности среди других элементов-металлов алюминий занимает первое место. Его в земной коре содержится 8,8 %. Если же сравнивать с неметаллами, то место его будет третьим, после кислорода и кремния.
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико.

Самые распространенные вещества, содержащие рассматриваемый металл:
- полевые шпаты;
- бокситы;
- граниты;
- кремнезем;
- алюмосиликаты;
- базальты и прочие.
В небольшом количестве алюминий обязательно входит в состав клеток живых организмов. Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
Получение
Физические и химические свойства алюминия позволяют получать его только одним способом: электролизом расплава соответствующего оксида. Однако процесс этот технологически сложен. Температура плавления AL2O3 превышает 2000 0С. Из-за этого подвергать электролизу непосредственно его не получается. Поэтому поступают следующим образом.
- Добывают бокситы.
- Очищают их от примесей, оставляя лишь оксид алюминия.
- Затем плавят криолит.
- Добавляют туда оксид.
- Данную смесь элекролизуют и получают чистый алюминий и углекислый газ.

Выход продукта составляет 99,7 %. Однако возможно получение и еще более чистого металла, который используется в технических целях.
Применение
Механические свойства алюминия не столь хороши, чтобы применять его в чистом виде. Поэтому чаще всего используются сплавы на основе данного вещества. Таких много, можно назвать самые основные.
- Дюралюминий.
- Алюминиево-марганцевые.
- Алюминиево-магниевые.
- Алюминиево-медные.
- Силумины.
- Авиаль.
Основное их отличие - это, естественно, сторонние добавки. Во всех основу составляет именно алюминий. Другие же металлы делают материал более прочным, стойким к коррозии, износоустойчивым и податливым в обработке.
Можно назвать несколько основных областей применения алюминия как в чистом виде, так и в виде его соединений (сплавов).
- Для изготовления проволоки и фольги, используемой в быту.
- Изготовление посуды.
- Самолетостроение.
- Кораблестроение.
- Строительство и архитектура.
- Космическая промышленность.
- Создание реакторов.

Вместе с железом и его сплавами алюминий - самый важный металл. Именно эти два представителя периодической системы нашли самое обширное промышленное применение в руках человека.
Свойства гидроксида алюминия
Гидроксид - самое распространенное соединение, которое образует алюминий. Свойства химические его такие же, как и у самого металла, - он амфотерный. Это значит, что он способен проявлять двойственную природу, вступая в реакции как с кислотами, так и со щелочами.
Сам по себе гидроксид алюминия - это белый студенистый осадок. Получить его легко при взаимодействии соли алюминия с щелочью или гидроксидом аммония. При взаимодействии с кислотами данный гидроксид дает обычную соответствующую соль и воду. Если же реакция идет с щелочью, то формируются гидроксокомплексы алюминия, в которых его координационное число равно 4. Пример: Na[Al(OH)4] - тетрагидроксоалюминат натрия.
fb.ru
Характеристика алюминия. Алюминий: общая характеристика
Каждый химический элемент можно рассмотреть с точки зрения трех наук: физики, химии и биологии. И в этой статье мы постараемся как можно точнее дать характеристику алюминию. Это химический элемент, находящийся в третьей группе и третьем периоде, согласно таблице Менделеева. Алюминий - металл, который обладает средней химической активностью. Также в его соединениях можно наблюдать амфотерные свойства. Атомная масса алюминия составляет двадцать шесть грамм на моль.
Физическая характеристика алюминия
При нормальных условиях он представляет собой твердое вещество. Формула алюминия очень проста. Он состоит из атомов (не объединятся в молекулы), которые выстроены с помощью кристаллической решетки в сплошное вещество. Цвет алюминия - серебристо-белый. Кроме того, он обладает металлическим блеском, как и все другие вещества данной группы. Цвет алюминия, используемого в промышленности, может быть различным в связи с присутствием в сплаве примесей. Это достаточно легкий металл. Его плотность равняется 2,7 г/см3, то есть он приблизительно в три раза легче, чем железо. В этом он может уступить разве что магнию, который еще легче рассматриваемого металла. Твердость алюминия довольно низкая. В ней он уступает большинству металлов. Твердость алюминия составляет всего два по шкале Мооса. Поэтому для ее усиления в сплавы на основе данного металла добавляют более твердые.
Его плотность равняется 2,7 г/см3, то есть он приблизительно в три раза легче, чем железо. В этом он может уступить разве что магнию, который еще легче рассматриваемого металла. Твердость алюминия довольно низкая. В ней он уступает большинству металлов. Твердость алюминия составляет всего два по шкале Мооса. Поэтому для ее усиления в сплавы на основе данного металла добавляют более твердые.
Плавление алюминия происходит при температуре всего в 660 градусов по шкале Цельсия. А закипает он при нагревании до температуры две тысячи четыреста пятьдесят два градуса по Цельсию. Это очень пластичный и легкоплавкий металл. На этом физическая характеристика алюминия не заканчивается. Еще хотелось бы отметить, что данный металл обладает самой лучшей после меди и серебра электропроводностью.
Распространенность в природе
Алюминий, технические характеристики которого мы только что рассмотрели, достаточно часто встречается в окружающей среде. Его можно наблюдать в составе многих минералов. Элемент алюминий - четвертый среди всех по распространенности в природе. Его массовая доля в земной коре составляет почти девять процентов. Основные минералы, в составе которых присутствуют его атомы, это боксит, корунд, криолит. Первый - это горная порода, которая состоит из оксидов железа, кремния и рассматриваемого металла, также в структуре присутствуют молекулы воды. Он имеет неоднородную окраску: фрагменты серого, красновато-коричневого и других цветов, которые зависят от наличия различных примесей. От тридцати до шестидесяти процентов данной породы - алюминий, фото которого можно увидеть выше. Кроме того, очень распространенным в природе минералом является корунд.

Это оксид алюминия. Его химическая формула - Al2O3. Он может обладать красным, желтым, голубым либо коричневым цветом. Его твердость по шкале Мооса составляет девять единиц. К разновидностям корунда относятся всем известные сапфиры и рубины, лейкосапфиры, а также падпараджа (желтый сапфир).
Криолит - это минерал, имеющий более сложную химическую формулу. Он состоит из фторидов алюминия и натрия - AlF3•3NaF. Выглядит как бесцветный или сероватый камень, обладающий низкой твердостью - всего три по шкале Мооса. В современном мире его синтезируют искусственно в лабораторных условиях. Он применяется в металлургии.
Также алюминий можно встретить в природе в составе глин, основным компонентов которых являются оксиды кремния и рассматриваемого металла, связанные с молекулами воды. Кроме того, данный химический элемент можно наблюдать в составе нефелинов, химическая формула которых выглядит следующим образом: KNa3[AlSiO4]4.
Получение
Характеристика алюминия предусматривает рассмотрение способов его синтеза. Существует несколько методов. Производство алюминия первым способом происходит в три этапа. Последним из них является процедура электролиза на катоде и угольном аноде. Для проведения подобного процесса необходим оксид алюминия, а также такие вспомогательные вещества, как криолит (формула - Na3AlF6) и фторид кальция (CaF2). Для того чтобы произошел процесс разложения растворенного в воде оксида алюминия, нужно его вместе с расплавленным криолитом и кальция фторидом нагреть до температуры минимум в девятьсот пятьдесят градусов по шкале Цельсия, а затем пропустить сквозь эти вещества ток силой в восемьдесят тысяч ампер и напряжением в пять-восемь вольт. Таким образом, вследствие данного процесса на катоде осядет алюминий, а на аноде будут собираться молекулы кислорода, которые, в свою очередь, окисляют анод и превращают его в углекислый газ. Перед проведением данной процедуры боксит, в виде которого добывается алюминия оксид, предварительно очищается от примесей, а также проходит процесс его обезвоживания.

Производство алюминия способом, описанным выше, является очень распространенным в металлургии. Также существует метод, изобретенный в 1827 году Ф. Велером. Он заключается в том, что алюминий можно добыть с помощью химической реакции между его хлоридом и калием. Осуществить подобный процесс можно, только создав специальные условия в виде очень высокой температуры и вакуума. Так, из одного моль хлорида и такого же объема калия можно получить один моль алюминия и три моль хлорида калия как побочного продукта. Данную реакцию можно записать в виде такого уравнения: АІСІ3 + 3К = АІ + 3КСІ. Указанный метод не приобрел большой популярности в металлургии.
Характеристика алюминия с точки зрения химии
Как уже было сказано выше, это простое вещество, которое состоит из атомов, не объединенных в молекулы. Подобные структуры формируют почти все металлы. Алюминий обладает достаточно высокой химической активностью и сильными восстановительными свойствами. Химическая характеристика алюминия начнется с описания его реакций с другими простыми веществами, а далее будут описаны взаимодействия со сложными неорганическими соединениями.
Алюминий и простые вещества
К таковым относится, в первую очередь, кислород - самое распространенное соединение на планете. Из него на двадцать один процент состоит атмосфера Земли. Реакции данного вещества с любыми другими называются окислением, или горением. Оно обычно происходит при высоких температурах. Но в случае с алюминием возможно окисление в нормальных условиях - так образуется пленка оксида. Если же данный металл измельчить, он будет гореть, выделяя при этом большое количество энергии в виде тепла. Для проведения реакции между алюминием и кислородом нужны эти компоненты в молярном соотношении 4:3, в результате чего получим две части оксида.
Данное химическое взаимодействие выражается в виде следующего уравнения: 4АІ + 3О2 = 2АІО3. Также возможны реакции алюминия с галогенами, к которым относятся фтор, йод, бром и хлор. Названия данных процессов происходят от названий соответствующих галогенов: фторирование, йодирование, бромирование и хлорирование. Это типичные реакции присоединения.
Для примера приведем взаимодействие алюминия с хлором. Такого рода процесс может произойти только на холоде.
Так, взяв два моль алюминия и три моль хлора, получим в результате два моль хлорида рассматриваемого металла. Уравнение этой реакции выглядит следующим образом: 2АІ + 3СІ = 2АІСІ3. Таким же способом можно получить фторид алюминия, его бромид и йодид.
С серой рассматриваемое вещество реагирует только при нагревании. Для проведения взаимодействия между этими двумя соединениями нужно взять их в молярных пропорциях два к трем, и образуется одна часть сульфида алюминия. Уравнение реакции имеет такой вид: 2Al + 3S = Al2S3.
Кроме того, при высоких температурах алюминий взаимодействует и с карбоном, образуя карбид, и с азотом, образуя нитрид. Можно привести в пример следующие уравнения химических реакций: 4АІ + 3С = АІ4С3; 2Al + N2 = 2AlN.
Взаимодействие со сложными веществами
К ним относятся вода, соли, кислоты, основания, оксиды. Со всеми этими химическими соединениями алюминий реагирует по-разному. Давайте разберем подробнее каждый случай.
Реакция с водой
С самым распространенным на Земле сложным веществом алюминий взаимодействует при нагревании. Происходит это только в случае предварительного снятия пленки из оксида. В результате взаимодействия образуется амфотерный гидроксид, а также в воздух выделяется водород. Взяв две части алюминия и шесть частей воды, получим гидроксид и водород в молярных пропорциях два к трем. Записывается уравнение этой реакции так: 2АІ + 6Н2О = 2АІ(ОН)3 + 3Н2.
Взаимодействие с кислотами, основаниями и оксидами
Как и другие активные металлы, алюминий способен вступать в реакцию замещения. При этом он может вытеснить водород из кислоты либо катион более пассивного металла из его соли. В результате таких взаимодействий образуется соль алюминия, а также выделяется водород (в случае с кислотой) либо выпадает в осадок чистый металл (тот, который менее активен, чем рассматриваемый). Во втором случае и проявляются восстановительные свойства, которые упоминались выше. В пример можно привести взаимодействие алюминия с соляной кислотой, при котором образуется хлорид алюминия и выделяется в воздух водород. Подобного рода реакция выражается в виде следующего уравнения: 2АІ + 6НСІ = 2АІСІ3 + 3Н2.
Примером взаимодействия алюминия с солью может служить его реакция с сульфатом меди. Взяв эти два компонента, в итоге мы получим сульфат алюминия и чистую медь, которая выпадет в виде осадка. С такими кислотами, как серная и азотная, алюминий реагирует своеобразно. К примеру, при добавлении алюминия в разбавленный раствор нитратной кислоты в молярном соотношении восемь частей к тридцати образуется восемь частей нитрата рассматриваемого металла, три части оксида азота и пятнадцать - воды. Уравнение данной реакции записывают таким образом: 8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15h3O. Указанный процесс происходит только при наличии высокой температуры.
Если же смешать алюминий и слабый раствор сульфатной кислоты в молярных пропорциях два к трем, то получим сульфат рассматриваемого металла и водород в соотношении один к трем. То есть произойдет обыкновенная реакция замещения, как и в случае с другими кислотами. Для наглядности приведем уравнение: 2Al + 3h3SO4 = Al2(SO4)3 + 3h3. Однако с концентрированным раствором этой же кислоты все сложнее. Здесь так же, как и в случае с нитратной, образуется побочный продукт, но уже не в виде оксида, а в виде серы, и вода. Если мы возьмем два необходимых нам компонента в молярном соотношении два к четырем, то в результате получим по одной части соли рассматриваемого металла и серы, а также четыре - воды. Данное химическое взаимодействие можно выразить с помощью следующего уравнения: 2Al + 4h3SO4 = Al2(SO4)3 + S + 4h3O.  Кроме того, алюминий способен реагировать с растворами щелочей. Для проведения подобного химического взаимодействия нужно взять два моль рассматриваемого металла, столько же гидроксида натрия или калия, а также шесть моль воды. В результате образуются такие вещества, как тетрагидроксоалюминат натрия либо калия, а также водород, который выделяется в виде газа с резким запахом в молярных пропорциях два к трем. Данную химическую реакцию можно представить в виде следующего уравнения: 2АІ + 2КОН + 6Н2О = 2К[АІ(ОН)4] + 3Н2.
Кроме того, алюминий способен реагировать с растворами щелочей. Для проведения подобного химического взаимодействия нужно взять два моль рассматриваемого металла, столько же гидроксида натрия или калия, а также шесть моль воды. В результате образуются такие вещества, как тетрагидроксоалюминат натрия либо калия, а также водород, который выделяется в виде газа с резким запахом в молярных пропорциях два к трем. Данную химическую реакцию можно представить в виде следующего уравнения: 2АІ + 2КОН + 6Н2О = 2К[АІ(ОН)4] + 3Н2.
И последнее, что нужно рассмотреть, это закономерности взаимодействия алюминия с некоторыми оксидами. Самый распространенный и используемый случай - реакция Бекетова. Она, так же, как и многие другие из рассмотренных выше, происходит только при высоких температурах. Итак, для ее осуществления необходимо взять два моль алюминия и один моль оксида феррума. В результате взаимодействия этих двух веществ получим оксид алюминия и свободное железо в количестве один и два моль соответственно.
Использование рассматриваемого металла в промышленности
Отметим, что применение алюминия - очень частое явление. Прежде всего, в нем нуждается авиационная отрасль. Наряду со сплавами магния, здесь используются и сплавы на основе рассматриваемого металла. Можно сказать, что среднестатистический самолет на 50% состоит из сплавов алюминия, а его двигатель - на 25%. Также применение алюминия осуществляется в процессе изготовления проводов и кабелей благодаря его отличной электропроводности. Кроме того, данный металл и его сплавы широко применяются в автомобилестроении. Из этих материалов состоят корпусы автомобилей, автобусов, троллейбусов, некоторых трамваев, а также вагонов обычных и электропоездов. Также его используют и в менее масштабных целях, например, для производства упаковок для пищевых и других продуктов, посуды. Для того чтобы изготовить серебристую краску, необходим порошок рассматриваемого металла. Такая краска нужна для того, чтобы защитить железо от коррозии. Можно сказать, что алюминий - второй по частоте использования в промышленности металл после феррума. Его соединения и он сам часто применяются в химической промышленности. Это объясняется особыми химическими качествами алюминия, в том числе его восстановительными свойствами и амфотерностью его соединений. Гидроксид рассматриваемого химического элемента необходим для очистки воды. Кроме того, он используется в медицине в процессе производства вакцин. Также его можно найти в составе некоторых видов пластика и других материалов.
Также его используют и в менее масштабных целях, например, для производства упаковок для пищевых и других продуктов, посуды. Для того чтобы изготовить серебристую краску, необходим порошок рассматриваемого металла. Такая краска нужна для того, чтобы защитить железо от коррозии. Можно сказать, что алюминий - второй по частоте использования в промышленности металл после феррума. Его соединения и он сам часто применяются в химической промышленности. Это объясняется особыми химическими качествами алюминия, в том числе его восстановительными свойствами и амфотерностью его соединений. Гидроксид рассматриваемого химического элемента необходим для очистки воды. Кроме того, он используется в медицине в процессе производства вакцин. Также его можно найти в составе некоторых видов пластика и других материалов.
Роль в природе
Как уже было написано выше, алюминий в большом количестве содержится в земной коре. Он особенно важен для живых организмов. Алюминий участвует в регуляции процессов роста, формирует соединительные ткани, такие, как костная, связочная и другие. Благодаря данному микроэлементу быстрее осуществляются процессы регенерации тканей организма. Его нехватка характеризуется следующими симптомами: нарушения развития и роста у детей, у взрослых - хроническая усталость, пониженная работоспособность, нарушение координации движений, снижение темпов регенерации тканей, ослабевание мышц, особенно в конечностях. Такое явление может возникнуть, если вы употребляете слишком мало продуктов с содержанием данного микроэлемента.
Однако более частой проблемой является избыток алюминия в организме. При этом нередко наблюдаются такие симптомы: нервозность, депрессия, нарушения сна, снижение памяти, стрессоустойчивости, размягчение опорно-двигательного аппарата, что может привести к частым переломам и растяжениям. При длительном избытке алюминия в организме часто возникают проблемы в работе практически каждой системы органов.
К такому явлению может привести целый ряд причин. В первую очередь это алюминиевая посуда. Учеными уже давно доказано, что посуда, изготовленная из рассматриваемого металла, непригодна для приготовления в ней пищи, так как при высокой температуре часть алюминия попадает в пищу, и вследствие этого вы употребляете намного больше этого микроэлемента, чем нужно организму.
Вторая причина - регулярное применение косметических средств с содержанием рассматриваемого металла или его солей. Перед применением любого продукта нужно внимательно читать его состав. Не исключением являются и косметические средства.
Третья причина - прием препаратов, в которых содержится много алюминия, на протяжении длительного времени. А также неправильное употребление витаминов и пищевых добавок, в состав которых входит данный микроэлемент.
Теперь давайте разберемся, в каких продуктах содержится алюминий, чтобы регулировать свой рацион и организовывать меню правильно. В первую очередь это морковь, плавленые сыры, пшеница, квасцы, картофель. Из фруктов рекомендуются авокадо и персики. Кроме того, богаты алюминием белокочанная капуста, рис, многие лечебные травы. Также катионы рассматриваемого металла могут содержаться в питьевой воде. Чтобы избежать повышенного или пониженного содержания алюминия в организме (впрочем, так же, как и любого другого микроэлемента), нужно тщательным образом следить за своим питанием и стараться сделать его как можно более сбалансированным.
fb.ru
Алюминий. Свойства - Знаешь как
Страницы Список страниц 33 34 35 36 37 · · · 45
Содержание страницы
§ 104. Алюминий. Свойства
Из элементов главной подгруппы III группы мы рассмотрим лишь алюминий как элемент, имеющий наиболее важное практическое значение. Алюминий — элемент третьего периода. Заряд ядра атома +13. Электроны располагаются на трех энергетических уровнях: 2, 8, 3. Электронная конфигурация атома алюминия (1s22s22p63s23р1):
Алюминий принадлежит к семейству р-элементов.Валентные электроны алюминия располагаются на s-оболочке и р-оболочке внешнего электронного слоя. Этих электронов три, поэтому алюминий может образовывать три валентных связи, что для него наиболее типично. Единственная степень окисления алюминия, которую он может проявлять, не считая нейтрального состояния, равна +3. Таким образом, в окислительно-восстановительных процессах алюминий ведет себя как восстановитель.
■ 73. Почему алюминий относится к р-элементам? (См. Ответ) 74. Какие степени окисления возможны для алюминия? 75. Начертите схему строения Аl+3. 76. Каково поведение алюминия в окислительно-восстановительных реакциях?(См. Ответ)
Алюминий Al — серебристо-белый металл. Его атомный вес 26,98. Плотность алюминия 2,7, температура плавления 660°, температура кипения 2060°. Алюминий принадлежит к группе легких металлов. Алюминий обладает высокой электропроводностью, равной 0,6 электропроводности меди, поэтому при большем сечении алюминиевых проводов электропроводность их равна медным, а вес гораздо меньше.Впервые алюминий был получен в 1827 г. Велером и стоил весьма дорого, так как методы его получения еще не были разработаны и уровень развития электротехники был еще слишком низок для массового получения этого металла. В настоящее время это один из самых дешевых и широко распространенных металлов.
По химическим свойствам алюминий принадлежит к числу весьма активных металлов, обладающих амфотерньми свойствами. В ряду активности он занимает место за щелочноземельными металлами. Но в чистом виде как на воздухе, так и в воде он может храниться очень долго, так как его поверхность со временем покрывается тонким и очень прочным слоем окиси, которая предохраняет его от окисления.Для того чтобы наблюдать окисление алюминия на воздухе, необходимо сначала освободиться от защитной пленки. Для этого алюминий сначала протирают наждачной шкуркой, а затем кипятят в щелочи. Окись алюминия, как и сам металл, проявляет амфотерные свойства, а потому растворяется в щелочи. После этого алюминий опускают в раствор какой-либо соли ртути, например нитрата ртути Hg(NO3)2. Алюминий как более активный металл вытесняет ртуть из ее соли:2Аl + 3Hg(NO3)2 = 2Al(NO3)3 + 3HgРтуть отлагается на поверхности алюминия, образуя сплав алюминия с ртутью — алюминиевую «амальгаму» (сплавы ртути с металлами называются амальгамами). Такой сплав не способен образовывать защитную пленку окиси, а алюминий в амальгаме постепенно окисляется до окиси алюминия по уравнению:4Аl + 3O2 = 2Аl2O3Но поскольку амальгама покрывает алюминий неравномерно, окисление идет местами и окись алюминия заметна на поверхности металла в виде пушистой щетки (рис. 80).
Рис. 80. Образование окиси алюминия на амальгированной поверхности металл
Интересно взаимодействие алюминия с галогенами — с бромом и йодом. Для реакции используются порошкообразный алюминий и жидкий бром, а для реакции с йодом— смесь порошка йода с алюминием (см. § 38). Во всех случаях алюминий ведет себя как восстановитель.При высокой температуре алюминий вытесняет некоторые металлы из их окислов. Это свойство нашло применение. Если смешать окись железа с алюминиевым порошком и поджечь с помощью магниевой вспышки, то произойдет реакция:Fe2О3 + 2Аl = Аl2O3 + 2Fe.которая сопровождается выделением большого количества тепла. За счет этого тепла образующееся свободное железо плавится и может быть выпущено из тигля, в котором происходит реакция, через находящееся внизу отверстие. Такая выплавка металлов называется алюминотермией; в технике она применяется очень широко. Некоторые металлы можно получить только алюминотермическим путем. Этот процесс был впервые осуществлен Н. Н. Бекетовым.
Алюминий является амфотерным металлом. В различных условиях он ведет себя по-разному. В растворе щелочи алюминий вытесняет из воды водород, образуя соль алюминиевой кислоты — алюминат натрия (или калия), в котором он играет роль кислотообразующего элемента:2Аl + 2NaOH + 2Н2O = 2NaAlO2 + 3h3↑
Из кислоты алюминий вытесняет водород:
2Аl + 6НСl = 2АlСl3 + 3h3↑В этом случае он проявляет металлические свойства.Концентрированные азотная и серная кислоты на алюминий не действуют, так как на его поверхности образуется защитная пленка, предохраняющая металл от дальнейшего окисления. В разбавленном виде азотная кислота на алюминий также не действует, а серная действует в слабой степени.
■ 77. Перечислите химические свойства алюминия и обоснуйте свой ответ уравнениями реакций. (См. Ответ) 78. Почему ртуть называют «алюминиевым ядом»? 79. Почему бытовые изделия из алюминия служат длительное время и не подвергаются окислению? 80. Что такое алюминотермия? 81. Сухая смесь состоит из порошков алюминий, железа и угля. При обработке 6 г этой смеси соляной кислотой выделилось 4,48 л водорода, а при обработке того же количества смеси раствором едкого кали — 3,36 л водорода. Определите состав смеси в граммах. 82. Имеется 200 г пиролюзита, содержащего 87% двуокиси марганца. Сколько алюминия потребуется для восстановления из него марганца алюминотермическим путем. 83. Как следует обработать алюминий, чтобы он окислялся на воздухе? 84. В трех пробирках находятся разбавленные кислоты — соляная, серная и азотная. Как, имея кусочки алюминия, определить, в какой пробирке какая кислота? 85. Сколько алюмината натрия получится при взаимодействии со щелочью 27 г алюминия? (См. Ответ)
§ 105. Соединения алюминия. Алюминий в природе
Окись и гидроокись алюминия являются ярко выраженными амфотерными соединениями. Они легко вступают во взаимодействие как со щелочами, так и с кислотами. Молекулу гидроокиси алюминия можно представить в двух формах — в форме основания Аl(ОН)3 и в форме кислоты Н3АlO3. В тех случаях, когда гидроокись алюминия попадает в кислоту, она ведет себя как основание:Аl(ОН)3 + 3HCl = АlСl3 + 3Н2OПри взаимодействии с сильными щелочами гидроокись алюминия реагирует как кислота:Н3АlO3 + 3NaOH = Na3AlO3 + 3Н2O
• Оба уравнения напишите в ионной форме
Получается соль трехосновной ортоалюминиевой кислоты, называемая ортоалюминатом натрия. Но такой состав у солей бывает редко. Чаще всего ортоалюминиевая кислота в щелочной среде распадается по уравнению:Н3АlO3 = Н2O + НАlO2образуя одноосновную метаалюминиевую кислоту НАlO3. Соли этой кислоты называются метаалюминатами, или просто алюминатами. Реакция между метаалюминиевой кислотой и щелочью выражается следующим уравнением:НАlO2 + NaOH = NaAlO2 + Н2ОСовершенно так же ведет себя окись алюминия. В кислотах как основной окисел она образует соли алюминия:Аl2O3 + 6НСl = 2АlСl3 + 3Н2Oв щелочах же — как кислотный окисел и образует алюминаты щелочных металлов:Аl2O3 + 2NaOH = 2NaAlO2 + Н2OАлюминат натрия, попадая в кислую среду, претерпевает немедленное превращение:2NaAlO2 + h3SO4 = Na2SO4 + 2НАlO2
НАlO2 + Н2О = Аl(ОН)3
2Аl(ОН)3 + 3h3SO4 = Al2(SO4)3 + 6Н2OТаким образом, в конечном итоге получаются следующие продукты:2NaAlO2 + 4h3SO4 = Na2SO4 + Al2(SO4)3 + 4h3O
• Напишите приведенные уравнения реакций в ионной форме.
■ 86. Напишите уравнения реакций, с помощью которых можно осуществить превращения: Аl → АlСl3 → Аl(ОН)3 → NaAlO2 → Al2(SO4)3 (См. Ответ) (все уравнения записывайте в полной и сокращенной ионной форме). 87 Имеются алюминий, соляная кислота, едкий натр. Как можно получить гидроокись алюминия? 88. Какова нормальность раствора едкого натра, если на растворение 39 г гидроокиси алюминия израсходовано 200 мл этого раствора? 89. Докажите при помощи уравнений реакций, что окись и гидроокись алюминия — амфотерные соединения. 90. Получится ли алюминат натрия, и если да, то в каком количестве, если на 15 г сульфата алюминия подействовать 50 г едкого натра? (См. Ответ)
Среди соединений алюминия выделяются лишь некоторые его соли. Особенно важен хлорид алюминия АlCl3, незаменимый в промышленности органического синтеза, где он играет роль катализатора во многих процессах. Сульфат алюминия Al(SO4)3 · 18Н2О применяется как коагулянт при очистке водопроводной воды, а также в производстве бумаги. Двойная соль алюминия и калия — алюмокалиевые квасцы KAl(SO4)2 · 12Н2O обладает высокими вяжущими свойствами и применяется при дублении кожи, а также в медицинской практике как кровоостанавливающее средство.В природе алюминий встречается очень широко и по распространенности элементов стоит на третьем месте. Вследствие высокой химической активности алюминий в природе встречается только в виде соединений. Он входит в состав алюмосиликатов — глины, слюды, полевого шпата, каолина и др. Главной алюминиевой рудой является боксит АlO3 · nН2O, из которого получают алюминий при участии другого соединения алюминия — криолита AlF3 · 3NaF.Твердая кристаллическая окись алюминия, окрашенная примесью окиси железа в желто-бурый цвет, называется корундом. Корунд обладает высокой твердостью, поэтому применяется для изготовления шлифовальных кругов, брусков и т. д. Прозрачные кристаллы корунда, окрашенные незначительными примесями, представляют собой драгоценные камни: рубин — красного, сапфир — синего цвета.
§ 106. Производство и применение алюминия
Металлический алюминий получают электролизом раствора окиси алюминия, называемой глиноземом, в расплавленном криолите. Окись алюминия добывают из боксита путем длительной очистки, а криолит получают либо из природного минерала, либо искусственным путем, причем последний способ в настоящее время даже дешевле. Процесс ведут в электрических печах при температуре около 1000°, силе тока около 50 000 а и напряжении 4—5 в (рис. 81).
Применяется алюминий главным образом в виде сплавов с другими металлами, так как он слишком мягок. Наиболее распространенными сплавами являются силумин — сплав алюминия с кремнием, дюралюминий, в состав которого, помимо алюминия, входят небольшие количества магния, железа, меди, марганца, магналий — сплав алюминия с магнием. Все эти сплавы легкие и прочные. Силумин применяется главным образом для литья, дюралюминий и магналий — в самолетостроении, машиностроении, судостроении, для изготовления посуды.Алюминием покрывают поверхность стальных и железных изделий, что предохраняет их от коррозии. Для этого стальное изделие выдерживают некоторое время в расплавленном алюминии или нагревают в порошке алюминия, который образует на поверхности сплав с металлом.
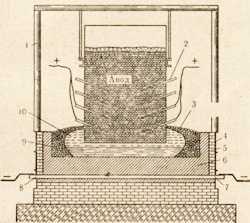
Рис. 81. Схема промышленной установки для получения алюминияэлектролизом.1 — крепление для анода; 2— штырь для подключения к сети угольного анода; 3 —корка застывшего электролита; 4 — наружный кожух; 5 — кирпичные стенки; 6 —графитовая обкладка; 7, 8 —катод; 9 — расплавленный алюминий; 10 — расплавленный электролит
Такие изделия не окисляются даже при высокой температуре. Этот способ предохранения металлов от окисления называется алитированием.Алюминий широко применяется для изготовления проводов в электротехнике и алюминиевых выпрямителей, алюминиевая пыль — как краска для имитации под серебро, алюминиевый порошок —при алюминотермической сварке металлов.
■ 91. Глинозем содержит 91,8% окиси алюминия. Сколько можно получить алюминия из 2 т глинозема, если выход алюминия составляет 80% теоретического? 92. Используя материал § 104 и 106, составьте и заполните таблицу. (См. Ответ)
| Свойства аллюминия | Использование алюминия, с учетом его свойств |
93. Используя материал § 105, составьте и заполните таблицу.
| Формула соединения | Встречается ли в природе и в виде какого минерала | Наиболее важное свойство | ||
35
34 36
znaesh-kak.com
Химические свойства алюминия и основные реакции
Нахождение в природе
Алюминий впервые получен химическим путем немецким химиком Ф. Велером в 1827 г., а в 1856 г. французский химик Сен-Клер Девиль выделил его электрохимическим методом.. Алюминий является самым распространенным в природе металлом. Содержание его в земной коре составляет 7,45% (по массе). Важнейшие природные соединения алюминия — алюмосиликаты, боксит, корунд и криолит.Алюмосиликаты составляют основную массу земной коры. Продукт их выветривания — глина и полевые шпаты (ортоклаз, альбит, анортит). Основной состав глин (каолин) соответствует формуле Аl2O3•2SiO2•2Н2O. Боксит — горная порода, из которой получают алюминий. Состоит главным образом из гидратов оксида алюминия Аl2O3•nН2O.
Физические свойства
Физические свойства алюминия хорошо изучены. Это — серебристо-белый легкий металл, плавящийся при 660°С. Он очень пластичен, легко вытягивается в проволоку и раскатывается в листы. Из алюминия можно изготовить фольгу толщиной менее 0,01мм. Алюминий обладает очень большой тепло- и электропроводностью. Сплавы алюминия с различными металлами обладают большой прочностью и легкостью.
Химические свойства
.Алюминий очень активный металл. В ряду напряжений он стоит после щелочных и щелочноземельных металлов. Однако на воздухе он довольно устойчив, так как его поверхность покрывается очень плотной пленкой оксида, предохраняющей его от дальнейшего контакта с воздухом. Если с алюминиевой проволоки снять защитную оксидную пленку, то алюминий начнет энергично взаимодействовать с кислородом и водяными парами воздуха, превращаясь в рыхлую массу гидроксида алюминия. Эта реакция сопровождается выделением тепла. Очищенный от защитной оксидной пленки алюминий взаимодействует с водой с выделением водорода:
2Аl + 6Н2O = 2Аl(OН)3 + 3h3↑
Алюминий хорошо растворим в разбавленных серной и соляной кислотах:
2Al + 6НС1= 2AlС13 + 3h3↑
2AI + 3h3SO4 = Al2(SO4)3 + 3h3↑
Разбавленная азотная кислота на холоду пассивирует алюминий, но при нагревании алюминий растворяется в ней с выделением монооксида азота, гемиоксида азота, свободного азота или аммиака, например:
8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15Н2O
Концентрированная азотная кислота пассивирует алюминий.Так как оксид и гидроксид алюминия обладают амфотерными свойствами, то алюминий легко растворяется в водных растворах всех щелочей, кроме гидроксида аммония:
2AI + 6NaOH + 6Н2O = 2Na3[A1ОН)6] + 3h3↑
Порошкообразный алюминий легко взаимодействует с галогенами, кислородом и всеми неметаллами. Для начала реакций необходимо нагревание. В дальнейшем реакции протекают очень интенсивно и сопровождаются выделением большого количества тепла:
2Al + ЗВr2 — 2AlBr3 (бромид алюминия)
4Al + 3O2 = 2Al2O3 (оксид алюминия)
2Al + 3S = A12S3 (сульфид алюминия)
2Al + N2 = 2A1N (нитрид алюминия)
4Al + ЗС = Al4С3 (карбид алюминия).
Сульфид алюминия может существовать только в твердом виде. В водных растворах он подвергается полному гидролизу с образованием гидроксида алюминия и сероводорода:
A12S3 + 6h3O = 2A1(OН)3 + 3h3S.
Алюминий легко отнимает кислород и галогены у оксидов и солей других металлов. Реакция сопровождается выделением большого количества тепла:
8Al + 3Fe3O4 = 9Fe + 4Al2O3
Процесс восстановления металлов из их оксидов алюминием называется алюмотермией. Алюмотермией пользуются при получении некоторых редких металлов, которые образуют прочную связь с кислородом (ниобий, тантал, молибден, вольфрам и др.).Смесь мелкого порошка алюминия и магнитного железняка называется термитом. После поджигания термита с помощью специального запала реакция протекает самопроизвольно и температура смеси повышается до 3500°С. Железо при такой температуре находится в расплавленном состоянии. Эту реакцию используют для сваривания рельсов.
Получение
.Впервые алюминий был получен восстановлением хлорида алюминия металлическим натрием:
AlС13 + 3Na = Al + 3NaCl
В настоящее время его получают электролизом расплавленных солей. В качестве электролита служит расплав, содержащий 85— 90% комплексной соли 3NaF • A1F3 (или Na3AlFe) — криолита и 10–15% оксида алюминия Al2O3 — глинозема. Такая смесь плавится при температуре около 1000°С. При растворении в расплавленном криолите глинозем ведет себя как соль алюминия и алюминиевой кислоты и диссоциирует на катионы алюминия и анионы кислотного остатка алюминиевой кислоты:
Al2O3 ⇔ Al3+ + АlO33−
Криолит диссоциирует:
Na3 [AlF6]⇔ 3Na+ + [A1F6]
При пропускании электрического тока катионы алюминия и натрия движутся к катоду — графитовому корпусу ванны, покрытому на дне слоем расплавленного алюминия, получаемого в процессе электролиза. Так как алюминий менее активен, чем натрий, то он восстанавливается в первую очередь. Восстановленный алюминий в расплавленном состоянии собирается на дне ванны, откуда его периодически выводят.Анионы AlO33− и A1F63− движутся к аноду — графитовым стержням или болванкам. На аноде в первую очередь разряжается анион AlO33−:
AlO33− — 12е = 2Al2O3 + 3O2
Оксид алюминия вновь диссоциирует, и процесс повторяется. Расход глинозема все время восполняется. Количество криолита практически не меняется. Незначительные потери криолита происходят вследствие образования на аноде тетрафторида углерода CF4 . Электролитическое производство алюминия требует больших затрат электроэнергии (на получение 1 т алюминия расходуется около 20 тыс. квт • ч электроэнергии), поэтому алюминиевые заводы строят вблизи электростанций.
Применение
Алюминий находит самое широкое применение. Он используется в электротехнике, его сплавы, отличаясь большой легкостью и прочностью, применяются в самолето- и машиностроении, он все больше вытесняет стали в производстве теплообменных аппаратов, из него изготовляют фольгу, применяемую в радиотехнике и для упаковки пищевых продуктов. Алюминием покрывают стальные и чугунные изделия в целях предохранения их от коррозии: изделия нагревают до 1000° С в смеси алюминиевого порошка (49%), оксида алюминия (49%) и хлорида аммония (2%). Этот процесс называется алитированием. Алитированные изделия выдерживают нагревание°С, не подвергаясь коррозии.
Оксид алюминия Al2O3
Представляет собой белое вещество, обладающее высокой температурой плавления (2050°С). В природе оксид алюминия встречается в виде корунда и глинозема. Иногда встречаются прозрачные кристаллы корунда красивой формы и окраски. Корунд, окрашенный соединениями хрома в красный цвет, называют рубином, а окрашенный соединениями титана и железа в синий цвет — сапфиром. Рубин и сапфир являются драгоценнымикамнями. В настоящее время их довольно легко получают искусственно.Оксид алюминия обладает амфотерными свойствами, но он не растворяется в воде, кислотах и щелочах. При кипячении оксида алюминия в концентрированном растворе щелочи он частично переходит в раствор. Оксид алюминия переводят в растворимое состояние сплавлением со щелочами или с пиросульфатом калия:
Al2O3 + 2NaOH = 2NaA1O2 + Н2O
Al2O3 + 3K2S2O7 = Al2(SO4)3 + 3K2SO4.
Полученные сплавы растворяются в воде. При сплавлении оксида алюминия с поташом или содой образуются алюминаты, которые легко растворяются в воде:
Al2O3 + Na2CO3 = 2NaA1O2 + CO2,
Природный корунд — очень твердое вещество. Он применяется для изготовления наждачных кругов и шлифовальных порошков. Рубин используют для изготовления втулок часовых и других точных механизмов.Глинозем используется как сырье для получения алюминия. Обезвоженный оксид алюминия применяется как адсорбент при очистке и разделении органических веществ методом хроматографии.
Гидроксид алюминия Al (ОН)3
Представляет собой белое вещество, которое при нагревании теряет воду, превращаясь оксид алюминия. Гидроксид алюминия обладает амфотерными свойствами. Свежеосажденный гидроксид легко растворяется в кислотах и щелочах (кроме гидроксида аммония):
Al(ОН)3 + ЗНС1 = AlС13 + ЗН2O
Al(ОН)3 + 3NaOH= Na3 [Al(OH)6].
Гидроксид алюминия является слабым основанием и еще более слабой кислотой, поэтому соли алюминия находятся в растворе только в присутствии избытка кислоты, а алюминаты — только в присутствии избытка щелочи. При разбавлении растворов водой эти соединения сильно гидролизуют.Высушенный гидроксид алюминия теряет часть воды, не растворяется ни в кислотах, ни в щелочах и этим напоминает оксид алюминия.Гидроксид алюминия обладает свойством поглощать различные вещества, поэтому его применяют при очистке воды.
www.metmk.com.ua
формула, реакции, свойства и применение :: SYL.ru
Алюминий – элемент третьего периода периодической таблицы Менделеева с атомным номером 13. По распространенности является первым среди металлов и третьим среди химических элементов земной коры (после кислорода и кремния). Давайте узнаем более детально, что такое алюминий и какими свойствами он обладает.
Общая характеристика
Итак, что такое алюминий? Прежде всего, это легкий парамагнитный металл бело-серебристого цвета, который очень податлив для обработки (литье, формовка, механическая обработка и прочее). Химическая формула алюминия известна всем из школьного курса химии – Al. Он обладает высокой электро- и теплопроводностью, а также устойчивостью к коррозионным процессам. Последнее свойство обуславливается способностью алюминия к быстрому образованию оксидных пленок, которые защищают его поверхность.

Историческая справка
Мировая общественность узнала, что такое алюминий, в 1825 году, благодаря датскому физику Гансу Эрстеду. Ученый провел взаимодействие амальгамы калия с хлоридом алюминия, с последующим извлечением ртути. Свое название химический элемент получил от латинского слова alumen, которое переводится как «квасцы».
До того как был открыт промышленный метод получения алюминия, данный металл ценился больше, чем золото. В 1889 году, желая почтить роскошным подарком Д.И. Менделеева, британцы вручили ему весы, сделанные из золота и алюминия.
Получение
Металл образует прочную связь с кислородом – оксид алюминия. По сравнению с другими известными металлами, его восстановление из руды более трудоемко. Причина тому кроется в высокой реакционной способности и высокой температуре плавления алюминия, а точнее его руд. Метод прямого восстановления углеродом не применяется, так как у этого металла восстановительная способность выше, нежели у углерода. Непрямое восстановление возможно. Оно предполагает получение промежуточного продукта Al4C3, подвергающегося при температуре порядка 2000°С разложению с образованием алюминия. Пока что это метод находится в разработке, но уже известно, что он будет требовать меньше энергозатрат, чем способ Холла - Эру.
Методика Холла - Эру, которая на сегодняшний день является самой широко используемой, была разработана в 1886 году параллельно двумя учеными – американцем Ч. Холлом и французом П. Эру. Ее суть заключается в растворении Al2O3 (оксида алюминия) в Na3AlF6 (расплав криолита) и последующем электролизе с применением анодных электродов (коксовых или графитовых). Так как этот метод является весьма затратным, он получил широкое применение лишь в двадцатом веке.
На производство одной тонны чернового алюминия уходит 1,92 т глинозема, 0,6 т электродов, 0,065 т криолита, 0,035 т фторида алюминия и порядка 61 ГДж электроэнергии.
Что касается лабораторного метода получения алюминия, то он был придуман в 1827 году Фридрихом Велером. Суть метода состоит в восстановлении безводного хлорида алюминия металлическим калием. Реакция проходит при нагреве, без доступа воздуха.

Место в природе
Массовая концентрация данного вещества в земной коре оценивается в 7,45-8,14%. По этому показателю алюминий занимает первое место среди металлов и третье среди химических элементов в целом.
В природе, в связи с химической активностью металла, он встречается в основном в виде соединений. Основные минералы алюминия: бокситы, корунд, нефелины, глиноземы, алуниты, полевые шпаты, берилл, каолинит и хризоберилл. В жерлах вулканов, в которых созданы специфические восстановительные условия, были найдены малые количества самородного металла.
В природных водах алюминий представлен в виде малотоксичных соединений, к примеру фторида. На вид катиона или аниона влияет главным образом кислотность среды. В пресной воде концентрация раствора алюминия может составлять от 0,001 до 10 мг/л, а в соленой – порядка 0,01 мг/л.
В составе природного алюминия преобладает стабильный изотоп 27Al и наблюдаются ничтожные следы 26Al.
Физические свойства
Основные физические свойства материала:
- Плотность – 2712 кг/м3.
- Температура кипения – 2500°С.
- Температура плавления – 660°С.
- Удельная теплоемкость – 897 Дж/кг*K.
- Твёрдость по Бринеллю – от 24 до 32 кгс/мм².
- Пластичность чистого материала – 50%.
- Модуль Юнга – 70 Гпа.
- Электропроводность – 37*106 См/м.
- Теплопроводность – 203,5 Вт/(м*К).
Алюминий может образовывать сплавы практически со всеми металлами. Наибольшее распространение получили дюралюминий (сплав с медью и магнием) и силумин (сплав с кремнием).

Химические свойства
В нормальных условиях данный металл покрыт тонкой, но очень прочной оксидной пленкой, что обуславливает его стойкость к воздействию стандартных окислителей: воды, кислорода, а также азотной и серной кислот. Вместе с тем, алюминий реагирует с соляной кислотой. Благодаря этим свойствам, металл не подвержен коррозии и очень востребован в промышленности.
При разрушении пленки алюминий может выступить в роли активного металла-восстановителя. Чтобы избежать образования пленки, к нему добавляют галлий, олово или индий.
Рассмотрим основные уравнения алюминия.
С простыми веществами этот металл образует следующие соединения:
- С кислородом – оксид. 4Al+3O2=2Al2O3.
- С галогенами (кроме фтора) – хлорид, иодид и бромид. 2Al+3Hal2=2AlHal3 (Hal = Cl, Br, I).
- С фтором (при нагревании) – фторид. 2Al+3F2=2AlF3.
- С серой (при нагревании) – сульфид. 2Al+3S=Al2S3.
- С азотом (при нагревании) – нитрид. 2Al+N2=2AlN.
- С углеродом (при нагревании) – карбид. 4Al+3C=Al4C3.
Сульфиды и карбиды алюминия могут полностью гидролизоваться.
Реакции алюминия со сложными веществами выглядят таким образом:
- С водой – после удаления защитной пленки. 2Al+6h3O=2Al(OH)3+3h3.
- Со щелочами – образует алюминаты. 2Al+2NaOH+6h3O=2Na[Al(OH)4]+3h3.
- С соляной и разбавленной серной кислотами – растворяется в них. 2Al+6HCl=2AlCl3+3h3.
- С кислотами-окислителями, образующими растворимые соли – растворяется в них при нагревании. 8Al+15h3SO4=4Al2(SO4)3+3h3S+12h3O.
- С оксидами металлов – восстанавливает из них металлы (алюминотермия). 8Al+3Fe3O4=4Al2O3+9Fe.

Производство
До конца 19-го века алюминий не производился в промышленных масштабах. Анри Сент-Клер Девиль, работу которого финансировал Наполеон Третий (он рассчитывал на использование материала для нужд армии), изобрел первый метод промышленного получения металла лишь в 1854 году. Суть метода состояла в вытеснении алюминия из двойного натриево-алюминиевого хлорида с помощью металлического натрия. В 1855 году был произведен первый слиток, масса которого составила порядка 7 кг. За последующие 36 лет по этому методу было произведено 200 тонн алюминия. Это при том, что уже 1856 году тот же ученый разработал новый способ, основанный на электролизе расплава указанного выше хлорида.
В 1885 году в городе Гмелингеме (Германия) был построен завод по производству алюминия по технологии Николая Бекетова. Это способ мало отличался от того, что разработал Девиль, но был несколько проще. Он базировался на взаимодействии между криолитом и магнием. За пять лет работы завод произвел 58 тонн алюминия – более 25% от мирового производства за 1854-1890 годы.
Метод Холла - Эру положил начало более технологичному и современному получению металла. С тех пор, с развитием электротехники, развивались и технологии производства алюминия. Заметный вклад в развитие этого направления внесли в том числе и русские ученые: Байер, Пеняков, Кузнецов, Жуковский, Яковкин и многие другие.
В России первое предприятие по производству алюминия было построено в городе Волхове в 1932 году. В 1939 металлургическая промышленность СССР производила практически 50 тысяч тонн этого металла в год.
Вторая мировая война стала стимулом для выпуска многих материалов, в том числе и алюминия. Так, к 1943 году мировое производство составило почти 2 млн тонн. С каждым годом, даже после окончания войны, этот показатель возрастал. В 1980-м году он составил 16 млн т., в 1990-м – 18 млн т., в 2008-м – уже около 40 млн т., а в 2016-м – почти 60 млн т.
Рейтинг стран, массово выпускающих алюминий, выглядит следующим образом:
- Китай.
- Россия.
- Канада.
- США.
- Австралия.
Мировой запас бокситов практически безграничен и несоизмерим с динамикой спроса. В будущем многие из линий по производству алюминия могут быть переориентированы на выпуск, к примеру, композитных материалов. Цена данного металла на торгах всемирных сырьевых бирж за последние десять лет колебалась в пределах 1250-3300 долларов за тонну.

Использование
Алюминий широко используется в качестве конструкционного материала. Его основные достоинства – легкость, коррозионная стойкость, податливость штамповке, высокая тепловодность и безвредность. Последние свойства сделали материал очень популярным в производстве кухонной утвари и пищевой пленки. Благодаря первым трем свойствам, алюминий стал основным сырьем космической и авиационной промышленности. Главным недостатком данного конструктивного материала является его малая прочность. Для упрочнения его обычно используют в сплавах с малыми количествами меди и магния (дюралюминий).
По электропроводности алюминий в 1,7 раз уступает меди, но за счет того, что его плотность в 3,3 раза меньше, для получения приблизительно равного сопротивления его требуется в два раза меньше по весу. Кроме того, алюминий примерно в 4 раза дешевле, чем медь. Этим обусловлено широкое применение данного материала в электротехнике (изготовление и экранирование проводников) и микроэлектронике (напыление проводников на поверхность микросхем). Главным недостатком алюминия как материала для электротехники является образование прочной диэлектрической пленки на его поверхности. Она затрудняет пайку и вызывает нагревание в местах соединений, что снижает качество контакта и надежность изоляции. Чтобы нивелировать данную особенность, используют алюминиевые проводники большого сечения.
Кроме того, алюминий используют в таких направлениях:
- Ювелирные изделия. Конечно, речь идет в основном о временах, когда алюминий был очень дорог. Сегодня его используют в бижутерии, а в Японии этот материал заменяет серебро в производстве традиционных украшений.
- Столовые приборы. В этом направлении алюминий использовался еще во времена Наполеона 3-го, однако и сейчас в заведениях общепита можно встретить столовые приборы из него.
- Стекловарение. В этой области используют фосфат, фторид и оксид алюминия.
- Пищевая промышленность. Данный металл зарегистрирован как пищевая добавка Е173.
- Военная промышленность. Благодаря дешевизне и небольшой массе алюминия, он используется в производстве пистолетов и автоматов.
- Ракетная техника. Алюминий и его соединения нашли применение в качестве ракетного горючего в 2-компонентных ракетных топливах.
- Энергетика. Алюминий используют как вторичный энергоноситель.
В качестве восстановителя алюминий используется в таких областях:
- Как компонент смесей для алюмотермии.
- Как восстановитель редких металлов из их оксидов и галогенидов.
- В пиротехнике.
- При анодной защите, в качестве протектора.

Использование сплавов
В качестве конструктивного материала часто используют не чистый алюминий, а сплавы на его основе.
Алюминиево-магниевые сплавы. Характеризуются сочетанием высокой пластичности, удовлетворительной прочности, коррозионной стойкости, хорошей свариваемости и высокой вибростойкости. Чаще всего в промышленности используют сплавы, в которых содержание магния колеблется в приделах 1-5%. Чем больше этот показатель, тем надежнее сплав. Каждый процент дает дополнительные 30 МПа к пределу прочности.
Сплавы, содержащие по массе до 3% магния, отличаются структурной стабильностью при нормальной и повышенной температуре, даже в нагартованном состоянии. С ростом содержания магния стабильность снижается. При увеличении его количества до 6% ухудшается коррозионная стойкость сплава. Поэтому для дальнейшего повышения прочностных характеристик, системы алюминий-магний легируют титаном, марганцем, хромом, ванадием или кремнием. Попадание меди и железа в такие сплавы нежелательно. Оно приводит к снижению свариваемости и коррозионной стойкости.
Алюминиево-марганцевые сплавы. Обладают высокими показателями прочности, пластичности, технологичности, коррозионной стойкости и свариваемости. В системах алюминий-марганец основными примесями являются железо и кремний. Эти элементы снижают степень растворимости марганца в алюминии. Чтобы получить мелкозернистую структуру, такие сплавы легируют титаном. Достаточное количество марганца обеспечивает стабильную структуру нагартованного металла, при любой температуре.
Алюминиево-медные сплавы. По своим механическим свойствам в термоупрочненном состоянии, эта система может обойти низкоуглеродистые стали. Такие сплавы очень технологичны. Их единственный недостаток – низкая коррозионная стойкость. С этой проблемой борются путем использования защитных покрытий.
В качестве легирующих добавок используют железо, магний, марганец и кремний. Сильнее всего на свойства сплава влияет магний, заметно повышая пределы текучести и прочности системы. Кремний повышает способность сплава к искусственному старению, а железо с никелем – его жаропрочность. Нагартовка этих систем после закалки приводит к ускорению искусственного старения, а также увеличивает их сопротивление коррозии и прочность.
Сплавы системы алюминий-цинк-марганец. Ценятся за высокие показатели прочности и технологичности. Высокое упрочнение достигается благодаря хорошей растворимости компонентов при повышенных температурах, которая резко уменьшается при охлаждении. Главным и очень существенным недостатком таких систем является их низкое сопротивление коррозии. Для повышения этого показателя применяют легирование медью. Также еще в 60-е годы прошлого века было выявлено, что присутствие лития в системах алюминий-цинк-марганец позволяет замедлить естественное и ускорить искусственное старение. Кроме того, литий уменьшает вес сплава и увеличивает его модуль прочности.
В промышленности используются также силумины (алюминиево-кремниевые сплавы), из которых отливают корпуса всяческих механизмов, и комплексные сплавы (авиали).

Токсичность
Отвечая на вопрос о том, что такое алюминий, стоит упомянуть о токсичности этого металла. Несмотря на широкое распространение в природе, алюминий является мертвым веществом, то есть не используется живыми существами в метаболизме. Сам по себе металл имеет незначительное токсическое действие, однако многие из его неорганических соединений, растворимых в воде, могут оказать вредное воздействие на теплокровных жвачных и человека. Для человека токсическое действие оказывают такие дозы соединений металла (мг/кг массы тела):
- Ацетат – 0,2-0,4.
- Гидроксид – 3,7-7,3.
- Квасцы – 2,9 .
При попадании в организм с водой соединения алюминия действуют на нервную систему, что может привести к ее тяжелым расстройствам. Положительным является тот факт, что накоплению металла в организме препятствует механизм выведения. За сутки с мочой может быть выведено до 15 мг элемента. Таким образом, негативный эффект от соединений алюминия может коснуться только людей, страдающих нарушением выделительной функции почек.
www.syl.ru