Презентация на тему: Физические свойства воды. Физические свойства воды презентация
Презентация по Химии "Физические свойства воды"
Презентация на тему: Физические свойства водыСкачать эту презентацию
Скачать эту презентацию
№ слайда 1 Описание слайда:Липатова Яна Класс 11АШкола МОУ СОШ № 68Учитель информатики Гунер Людмила НиколаевнаПредмет физикаТема урока-презентации Физические свойства воды
№ слайда 2 Описание слайда:Физические свойства воды
№ слайда 3 Описание слайда: № слайда 4 Описание слайда:Цель факультативного урока-презентации:Обобщить и систематизировать знания о физических свойствах воды, накопленные в науке на сегодняшний день.
№ слайда 5 Описание слайда:Введение Что же такое вода? Каковы ее строение, физические свойства, благодаря которым, как писал академик В.И.Вернадский: «…она стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы сравниться с ней по влиянию на ход основных, самых грандиозных геологических процессов. Нет земного вещества-минерала, горной породы, живого тела, которое ее не заключало бы. Все земное вещество…ею проникнуто и охвачено».
№ слайда 6 Описание слайда:Вода - самая известная и самая загадочная из всех жидкостей, существующих на Земле. Не случайно поэты посвящали ей удивительные строки, вот некоторые из них:В кружева будто одетыДеревья, кусты, провода.И кажется сказкою это,А, в сущности - только вода. Безбрежная ширь океанаИ тихая заводь пруда,Струя водопада и брызги фонтана,И все это – только вода.
№ слайда 7 Описание слайда:Древние философы Платон и Аристотель считали воду одним из четырех начал всего существующего. Эти начала – земля, вода, огонь и воздух. Хотя некоторые представления о воде претерпевали определенные изменения, но воду продолжали считать простым, единым веществом вплоть до конца 18 века.Вода – это не только реки, моря, океана, ледники, облака и дождь, снег. На первый взгляд, вода кажется очень простым соединением, состоящим из атомов водорода и кислорода. На самом деле это самое аномальное вещество в мире.
№ слайда 8 Описание слайда:Четыре стихии Аристотеля ЗемляОгоньВоздухВода
№ слайда 9 Описание слайда:На первый взгляд, вода кажется очень простым соединением, состоящим из атомов водорода и кислорода. На самом деле это самое аномальное вещество в мире.
№ слайда 10 Описание слайда:Физические свойства воды Большое поверхностное натяжениеСпособность смачивать поверхность твердого тела, «прилипать» к ней (адгезия)Вода – весьма подвижная жидкостьАномальное значение диэлектрической проницаемостьВода обладает свойствами твердых телЗависимость между давлением и температурой замерзанияТройная точка воды
№ слайда 11 Описание слайда:Зависимость плотности воды от температуры Плотность воды при переходе из твердого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает.Плотность воды в интервале от 0 до 40С повышается. Примерно при 40С плотность воды достигает максимума, что приводит к той самой «двойственности»: например, при температуре –100С и +200С плотность воды одинаковая.
№ слайда 12 Описание слайда:Зависимость удельной теплоемкости от температуры С ростом температуры вещества его удельная теплоемкость, как правило, возрастает. Но вода и здесь ведет себя особо. Так, с повышением температуры от 00 до 370С удельная теплоемкость воды падает, а в интервале от 370 до 1000С – растет. Поэтому она одинакова, например, при температуре 250 и 450, 100и 740.
№ слайда 13 Описание слайда:Зависимость температур кипения и замерзания от молекулярной массы При какой температуре вода закипает? Вода кипит при 1000С. Вода по химическому составу может быть названа гидридом кислорода. h3Te, h3Se и h3S- химические аналоги воды. Если проследить за температурами их кипения и сопоставить, как изменяются температуры кипения гидридов в других группах периодической системы, то можно довольно точно определить
№ слайда 14 Описание слайда:температуру кипения любого гидрида, так же как и любого другого соединения. Сам Менделеев таким способом предсказал свойства химических соединений еще не открытых элементов.Если же определить температуру гидрида кислорода по положению его в периодической таблице, то окажется, что вода должна кипеть при -800С. Следовательно, вода кипит на 1800С выше, чем должна кипеть. Температура кипения воды – это наиболее обычное ее свойство – оказывается необычным и удивительным.При какой температуре вода замерзает? Ну, кто же не знает, что вода замерзает при 00С? Это вторая опорная точка термометра. Это самое обычное свойство воды. Но ведь и в этом случае можно спросить, при какой температуре вода должна замерзать в соответствии со своей химической природы. Оказывается, гидрид кислорода на основании его положения в таблице Менделеева должен был бы затвердевать при -1000С.
№ слайда 15 Описание слайда:Зависимость температуры кипения от давления С увеличением давления температура кипения растет. Это свойство раньше использовалось для определения высоты местности в горах. Температура кипения повышается также с увеличением содержания в воде растворимых веществ.
№ слайда 16 Описание слайда:Выводы Вода – это удивительное вещество, физические свойства которого необычны, своеобразны.Многие свойства воды аномальны:Плотность воды при переходе из твердого состояния в жидкое не уменьшается, а возрастает.Удельная теплоемкость и плотность имеют одинаковые значения при двух разных значениях температур.
№ слайда 17 Описание слайда:Выводы Молекула воды обладает аномально большим электрическим дипольным моментом и это создает аномально большую диэлектрическую проницаемость.Температура кипения и замерзания аномальны по сравнению с теми же величинами для схожих по структуре молекул.
№ слайда 18 Описание слайда:Именно эти аномальные свойства воды позволяют нам жить в столь разнообразном мире, восхищаться красками осени и весны, любоваться льдами и водопадами, облаками на небе и росой на траве.
№ слайда 19 Описание слайда: № слайда 20 Описание слайда:Источники информации 1. Детская энциклопедия том 3 издание 2. Издательство «Просвещение». Москва 1966г. (стр.511-523).2. Марк Колтун - «Мир физики». Издательство «Детская литература». Москва 1984г. (стр.54).3. Л.В.Тарасов – «Физика в природе». Издательство «Просвещение». Москва 1988г. (стр.50).4. Я.И.Перельман – «Занимательная физика» книга 1,2. Издательство «Наука». Москва 1986г. (стр.142, 145, 147).5. О.К.Костко – «Мировой океан» (приложение к журналу «Физика в школе») (стр.1-3).6. Журнал «Физика в школе» №7 2001г. 7. М.С.Волынский – «Необыкновенная жизнь обыкновенной капли». Издательство «Знание». Москва 1986 (стр.46).
ppt4web.ru
Презентация по Химии "Физические свойства воды"
Презентация на тему: Физические свойства водыСкачать эту презентацию
Скачать эту презентацию
№ слайда 1 Описание слайда:
Описание слайда: Липатова Яна Класс 11А Школа МОУ СОШ № 68 Учитель информатики Гунер Людмила Николаевна Предмет физика Тема урока-презентации Физические свойства воды 900igr.net
№ слайда 2 Описание слайда:
Описание слайда: Физические свойства воды
№ слайда 3 Описание слайда: № слайда 4
Описание слайда: № слайда 4  Описание слайда:
Описание слайда: Цель факультативного урока-презентации: Обобщить и систематизировать знания о физических свойствах воды, накопленные в науке на сегодняшний день.
№ слайда 5 Описание слайда:
Описание слайда: Введение Что же такое вода? Каковы ее строение, физические свойства, благодаря которым, как писал академик В.И.Вернадский: «…она стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы сравниться с ней по влиянию на ход основных, самых грандиозных геологических процессов. Нет земного вещества-минерала, горной породы, живого тела, которое ее не заключало бы. Все земное вещество…ею проникнуто и охвачено».
№ слайда 6 Описание слайда:
Описание слайда: Вода - самая известная и самая загадочная из всех жидкостей, существующих на Земле. Не случайно поэты посвящали ей удивительные строки, вот некоторые из них: В кружева будто одеты Деревья, кусты, провода. И кажется сказкою это, А, в сущности - только вода. Безбрежная ширь океана И тихая заводь пруда, Струя водопада и брызги фонтана, И все это – только вода.
№ слайда 7 Описание слайда:
Описание слайда: Древние философы Платон и Аристотель считали воду одним из четырех начал всего существующего. Эти начала – земля, вода, огонь и воздух. Хотя некоторые представления о воде претерпевали определенные изменения, но воду продолжали считать простым, единым веществом вплоть до конца 18 века. Вода – это не только реки, моря, океана, ледники, облака и дождь, снег. На первый взгляд, вода кажется очень простым соединением, состоящим из атомов водорода и кислорода. На самом деле это самое аномальное вещество в мире.
№ слайда 8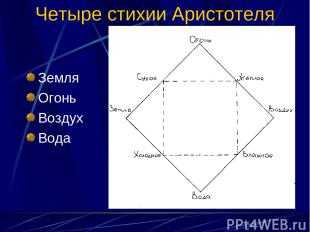 Описание слайда:
Описание слайда: Четыре стихии Аристотеля Земля Огонь Воздух Вода
№ слайда 9 Описание слайда:
Описание слайда: На первый взгляд, вода кажется очень простым соединением, состоящим из атомов водорода и кислорода. На самом деле это самое аномальное вещество в мире.
№ слайда 10 Описание слайда:
Описание слайда: Физические свойства воды Большое поверхностное натяжение Способность смачивать поверхность твердого тела, «прилипать» к ней (адгезия) Вода – весьма подвижная жидкость Аномальное значение диэлектрической проницаемость Вода обладает свойствами твердых тел Зависимость между давлением и температурой замерзания Тройная точка воды
№ слайда 11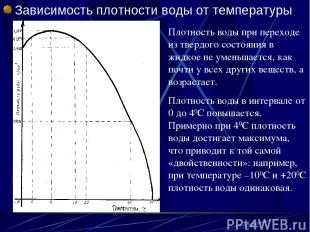 Описание слайда:
Описание слайда: Зависимость плотности воды от температуры Плотность воды при переходе из твердого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает. Плотность воды в интервале от 0 до 40С повышается. Примерно при 40С плотность воды достигает максимума, что приводит к той самой «двойственности»: например, при температуре –100С и +200С плотность воды одинаковая.
№ слайда 12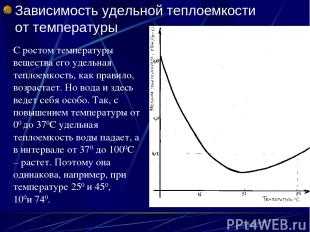 Описание слайда:
Описание слайда: Зависимость удельной теплоемкости от температуры С ростом температуры вещества его удельная теплоемкость, как правило, возрастает. Но вода и здесь ведет себя особо. Так, с повышением температуры от 00 до 370С удельная теплоемкость воды падает, а в интервале от 370 до 1000С – растет. Поэтому она одинакова, например, при температуре 250 и 450, 100и 740.
№ слайда 13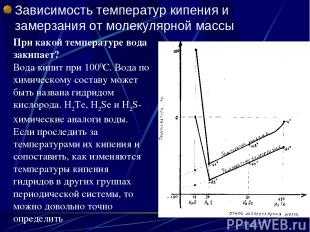 Описание слайда:
Описание слайда: Зависимость температур кипения и замерзания от молекулярной массы При какой температуре вода закипает? Вода кипит при 1000С. Вода по химическому составу может быть названа гидридом кислорода. h3Te, h3Se и h3S- химические аналоги воды. Если проследить за температурами их кипения и сопоставить, как изменяются температуры кипения гидридов в других группах периодической системы, то можно довольно точно определить
№ слайда 14 Описание слайда:
Описание слайда: температуру кипения любого гидрида, так же как и любого другого соединения. Сам Менделеев таким способом предсказал свойства химических соединений еще не открытых элементов. Если же определить температуру гидрида кислорода по положению его в периодической таблице, то окажется, что вода должна кипеть при -800С. Следовательно, вода кипит на 1800С выше, чем должна кипеть. Температура кипения воды – это наиболее обычное ее свойство – оказывается необычным и удивительным. При какой температуре вода замерзает? Ну, кто же не знает, что вода замерзает при 00С? Это вторая опорная точка термометра. Это самое обычное свойство воды. Но ведь и в этом случае можно спросить, при какой температуре вода должна замерзать в соответствии со своей химической природы. Оказывается, гидрид кислорода на основании его положения в таблице Менделеева должен был бы затвердевать при -1000С.
№ слайда 15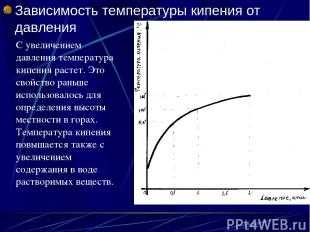 Описание слайда:
Описание слайда: Зависимость температуры кипения от давления С увеличением давления температура кипения растет. Это свойство раньше использовалось для определения высоты местности в горах. Температура кипения повышается также с увеличением содержания в воде растворимых веществ.
№ слайда 16 Описание слайда:
Описание слайда: Выводы Вода – это удивительное вещество, физические свойства которого необычны, своеобразны. Многие свойства воды аномальны: Плотность воды при переходе из твердого состояния в жидкое не уменьшается, а возрастает. Удельная теплоемкость и плотность имеют одинаковые значения при двух разных значениях температур.
№ слайда 17 Описание слайда:
Описание слайда: Выводы Молекула воды обладает аномально большим электрическим дипольным моментом и это создает аномально большую диэлектрическую проницаемость. Температура кипения и замерзания аномальны по сравнению с теми же величинами для схожих по структуре молекул.
№ слайда 18 Описание слайда:
Описание слайда: Именно эти аномальные свойства воды позволяют нам жить в столь разнообразном мире, восхищаться красками осени и весны, любоваться льдами и водопадами, облаками на небе и росой на траве.
№ слайда 19 Описание слайда: № слайда 20
Описание слайда: № слайда 20  Описание слайда:
Описание слайда: Источники информации 1. Детская энциклопедия том 3 издание 2. Издательство «Просвещение». Москва 1966г. (стр.511-523). 2. Марк Колтун - «Мир физики». Издательство «Детская литература». Москва 1984г. (стр.54). 3. Л.В.Тарасов – «Физика в природе». Издательство «Просвещение». Москва 1988г. (стр.50). 4. Я.И.Перельман – «Занимательная физика» книга 1,2. Издательство «Наука». Москва 1986г. (стр.142, 145, 147). 5. О.К.Костко – «Мировой океан» (приложение к журналу «Физика в школе») (стр.1-3). 6. Журнал «Физика в школе» №7 2001г. 7. М.С.Волынский – «Необыкновенная жизнь обыкновенной капли». Издательство «Знание». Москва 1986 (стр.46).
ppt4web.ru
Презентация по химии "Химические и физические свойства воды"


Цели и задачи
- Разработать комплект компьютерных слайдов для демонстрации на уроке химии в 8 классе
- Рассмотреть основные физические и химические свойства воды, состав молекулы воды
- Изучить дополнительный материал по теме
- Показать значение воды в природе, для человека, наиболее интересные области применения воды
- Изучить материал мультимедийных учебных пособий по химии


Единственное вещество в природе, которое существует
в трех агрегатных состояниях
жидкое состояние
твердое состояние
газообразное состояние
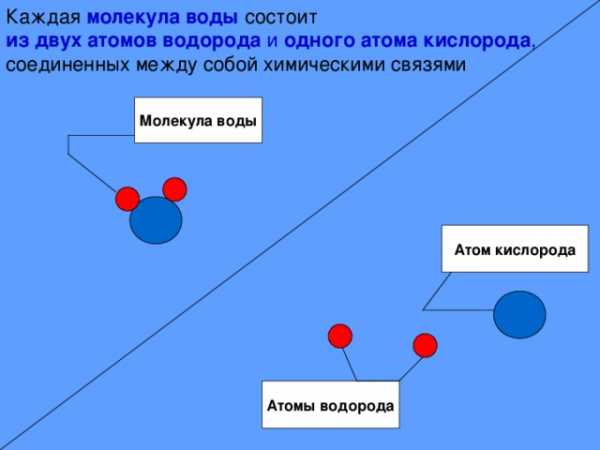
Каждая молекула воды состоит
из двух атомов водорода и одного атома кислорода ,
соединенных между собой химическими связями
Молекула воды
Атом кислорода
Атомы водорода

Агрегатные состояния воды
Твердое
Газообразное
Жидкое
(лед)
(пар)
( вода)
- без цвета, без вкуса, без запаха, прозрачная
- обладает слабой электропроводностью
- t кип = 100 о С, t пл = 0 о С

вода
Молекула соли
Молекула воды

1. Взаимодействие воды с активными металлами
Li + H 2 O
Li OH + H 2
2Na OH + H 2
2Na + H 2 O
Гидроксид натрия
КОН + Н 2
K + H 2 O

2. Взаимодействие воды с неметаллами
CO + H 2
С + H 2 O
Водяной газ
3. Взаимодействие воды с основными оксидами
Na 2 O + H 2 O
2NaOH
Гидроксид натрия
Оксид натрия
4 . Взаимодействие воды с кислотными оксидами
H 2 CO 3
CO 2 + H 2 O
Угольная кислота
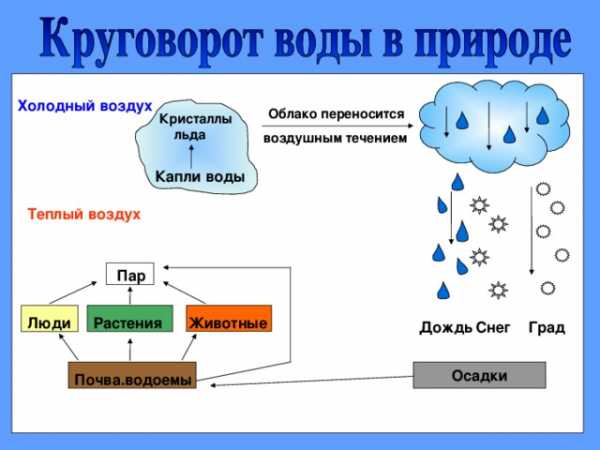
Холодный воздух
Облако переносится
Кристаллы
льда
воздушным течением
Капли воды
Теплый воздух
Пар
Животные
Растения
Люди
Град
Дождь
Снег
Осадки
Почва.водоемы
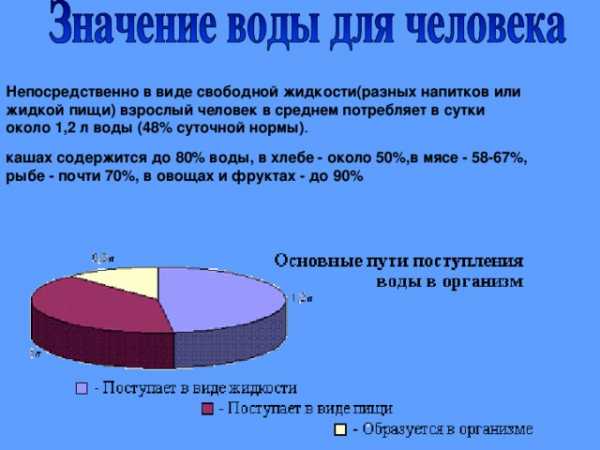
Непосредственно в виде свободной жидкости(разных напитков или
жидкой пищи) взрослый человек в среднем потребляет в сутки
около 1,2 л воды (48% суточной нормы) .
кашах содержится до 80% воды, в хлебе - около 50%,в мясе - 58-67%,
рыбе - почти 70%, в овощах и фруктах - до 90%

В основном вода выводится из организма через почки,
в среднем 1,2 л в сутки - или 48% общего объема,
а также посредством потоотделения (0,85 л.- 34%).
Часть воды удаляется из организма при дыхании (0,32л в сутки - около 13%)
и через кишечник (0,13 л - 5%).
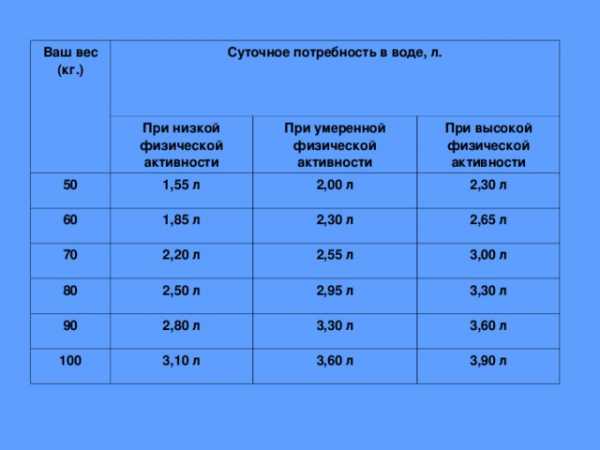
Ваш вес (кг.)
Суточное потребность в воде, л.
При низкой физической активности
50
При умеренной физической активности
1,55 л
60
70
При высокой физической активности
2,00 л
1,85 л
80
2,20 л
2,30 л
2,30 л
2,65 л
2,55 л
2,50 л
90
3,00 л
2,95 л
2,80 л
100
3,30 л
3,30 л
3,10 л
3,60 л
3,60 л
3,90 л

Научно-фантастическое будущее медленно, но верно пробирается в наши дома. И вот вы ужу запросто можете приобрести себе часы, которые получают электроэнергию для своей работы из обыкновенной воды.
Как же работают эти чудо -часы? Внутри находится конвертер, который «извлекает»электроны из молекул жидкости, и работает как топливная ячейка для часов. Расход воды очень небольшой. Сообщается что одной заправки резервуара хватит на «несколько недель» бесперебойной работы.

Японский исследователь Масару Эмото (Masaru Emoto) приводит удивительные доказательства информационных свойств воды. За время работы он сделал более 10000 фотографий, некоторые из них опубликованы в его книгах «The Messages from Water» 1, 2 и «Water knows the answer.» Доктор Эмото использовал Анализатор Магнитного Резонанса (MRA) для нескольких функций, включая качественный анализ воды. Он заметил, что никакие два образца воды не образуют абсолютно похожых кристаллов, и что форма кристаллов отражает свойства воды .
Антарктический лед
Гимн Москвы
Гимн России

Вода после Крещения
Вода перед Крещением
Ключевая вода
Тяжелый рок
Музыка Бетховена
Родник в Тропарево

Список литературы
- Гузей Л.С., Суровцева Р.П., Сорокин В.В., «Химия-8», М.,Дрофа, 2003
- Мультимедийное учебное пособие «Химия» 8 класс,М., Просвещение, 2002
- Образовательная коллекция 1С «Химия для всех- XXI »,М.,2004
videouroki.net
Физические свойства воды - презентация к уроку Окружающий мир
Презентация на тему: Физические свойства водыСкачать эту презентацию
Скачать эту презентацию
№ слайда 1 Описание слайда:
Описание слайда: 2 900igr.net
№ слайда 2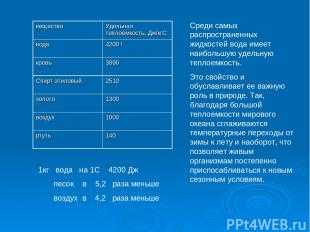 Описание слайда:
Описание слайда: 1кг вода на 1С 4200 Дж песок в 5,2 раза меньше воздух в 4,2 раза меньше Среди самых распространенных жидкостей вода имеет наибольшую удельную теплоемкость. Это свойство и обуславливает ее важную роль в природе. Так, благодаря большой теплоемкости мирового океана сглаживаются температурные переходы от зимы к лету и наоборот, что позволяет живым организмам постепенно приспосабливаться к новым сезонным условиям. вещество Удельная теплоемкость, Дж/кгС вода 4200 ! кровь 3890 Спирт этиловый 2510 золото 1300 воздух 1000 ртуть 140
№ слайда 3 Описание слайда:
Описание слайда: Вода стоит на первом месте среди веществ, которые входят в состав клетки, что способствует поддержанию стабильности температуры тела живых организмов. Человек на 2/3 своей массы (60%) состоит из воды. Чем объяснить, что из известных нам 110 химических элементов в состав клеток живых организмов входят только 24: водород- 60% кислород – 255 С – 10% N, Са, Р, Сl, S, Nа, Мg… – 3%.
№ слайда 4 Описание слайда:
Описание слайда: Лед 0 С Вода 0 С Одинаков ли запас внутренней энергии? Разница между ними по запасу внутренней энергии так же велика, как между водой при 0С и при 80С. Что является следствием данного факта? вещество Удельная теплота плавления, дж/кг лед 330 000 сталь 82 000 свинец 25 000
№ слайда 5 Описание слайда:
Описание слайда: То, что у воды рекордно большая, по сравнению с другими веществами, удельная теплота замерзания, приводит к тому, что водная поверхность не «спешит» одеваться льдом при первых заморозках, но и не «торопится» сбросить ледяной панцирь в самом начале весны. Этим можно объяснить то факт, что во время весеннего ледохода у реки прохладно, а во время снегопада – тепло.
№ слайда 6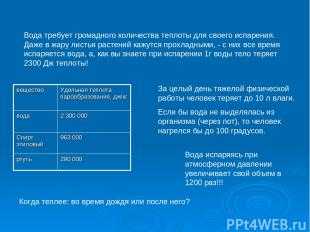 Описание слайда:
Описание слайда: Вода требует громадного количества теплоты для своего испарения. Даже в жару листья растений кажутся прохладными, - с них все время испаряется вода, а, как вы знаете при испарении 1г воды тело теряет 2300 Дж теплоты! За целый день тяжелой физической работы человек теряет до 10 л влаги. Если бы вода не выделялась из организма (через пот), то человек нагрелся бы до 100 градусов. Когда теплее: во время дождя или после него? Вода испаряясь при атмосферном давлении увеличивает свой объем в 1200 раз!!! вещество Удельная теплота парообразования, дж/кг вода 2 300 000 Спирт этиловый 963 000 ртуть 290 000
№ слайда 7 Описание слайда:
Описание слайда: Аномально и изменение плотности воды. Плотность других жидкостей, как правило, при понижении температуры постепенно возрастает и становится максимальной при замерзании. А плотность воды при охлаждении «нормально» возрастает лишь до +4С, достигая 1г/куб см. От 4 градусов Цельсия до 0 – она уменьшается. Плотность же льда резко, скачком уменьшается до 0,9г/куб.см.Это имеет очень большое значение в жизни природы. При охлаждении пресных водоемов зимой, по мере понижения температуры поверхностных слоев более плотные массы воды опускаются вниз, а на их место поднимаются снизу теплые и менее плотные. Так происходит до тех пор, пока вода в глубинных слоях не достигнет температуры 4 градусов. При этом конвекция прекращается, т.к. внизу находится более тяжелая вода. Дальнейшее охлаждение воды происходит только с поверхности, чем и объясняется образование льда в поверхностном слое водоемов. Благодаря этому подо льдом не прекращается жизнь, т.к. водоем не промерзает полностью.
№ слайда 8 Описание слайда:
Описание слайда: Что мы знаем о воде? Вода Н2О Наибольшая теплоёмкость С = 4200 Дж/кг С среди жидкостей Бесцветна, без запаха Плотнее чем лёд удельная теплота парообразования удельная теплота отвердевания
№ слайда 9 Описание слайда:
Описание слайда: Строение молекулы воды. О О )!105 Н Н - Н + О * * Н Н диполь НО 2 В молекуле воды один атом кислорода ковалентно связан с двумя атомами водорода. Молекула воды нелинейна; угол между связями О – Н равен примерно 105 градусов. Связи эти не только ковалентны, но и полярны. Атомы Н несут на себе некоторый положительный заряд, атомы О – отрицательный. Поэтому и полярна молекула в целом; она представляет собой диполь.
№ слайда 10 Описание слайда:
Описание слайда: Дипольные молекулы взаимодействуют сильнее, чем молекулы неполярные. Но молекулы воды связаны между собой гораздо прочнее, чем можно было ожидать, учитывая лишь физическое взаимодействие диполей. Это объясняется существованием водородных связей. В водородной связи участвуют атом О одной молекулы и атом Н – другой. Такие связи гораздо менее прочны(в15- 20 раз) чем ковалентные, и все же именно благодаря им взаимодействие молекул в воде гораздо сильнее, чем во многих других жидкостях. Н Н . . . Н О Н О
№ слайда 11 Описание слайда:
Описание слайда: Молекулярная структура агрегатного состояния воды(жидкость) Именно повышенная прочность связей между молекулами Н2О служит причиной аномально высокой температуры кипения воды. Сильное межмолекулярное взаимодействие затрудняет переход молекул из жидкости в пар. Поскольку тепловая энергия при нагревании воды расходуется не только на ускорение движения молекул воды, но и на разрыв водородных связей между ними, то теплоемкость воды оказывается столь большой.
№ слайда 12 Описание слайда:
Описание слайда: С высокой полярностью молекул воды связано большое значение ее диэлектрической проницаемости и почти не имеющая себе равных способность растворять другие полярные соединения и вызывать электролитическую диссоциацию кислот, оснований и солей. вещество вода 81 Спирт этиловый 25 бензин 2
№ слайда 13 Описание слайда:
Описание слайда: Строение льда. В кристаллах льда также существуют водородные связи. Но здесь система таких связей статична, а следовательно, еще более прочна, чем в жидкой воде. В этом причина аномально высокой температуры плавления и удельной теплоты плавления льда. В кристаллах льда каждая молекула воды соединена водородными связями с четырьмя соседними. Такая структура ажурна – в ней много «пустот». Вот почему плотность льда сравнительно низка. При плавлении льда часть «пустот» заполняется «одиночными» и «сдвоенными» молекулами Н О, уже освободившимися из кристаллической решетки. Поэтому плотность воды выше, чем у льда. Объем льда на 10% больше объема воды. 2
№ слайда 14 Описание слайда:
Описание слайда: Существование воды на нашей планете в трех агрегатных состояниях – газообразном, жидком и твердом – обязано одному важному счастливому обстоятельству: вращению Земли вокруг Солнца на среднем расстоянии 150 млн км. Если бы путь от Земли до Солнца составлял менее 134 млн км, то вся вода океанов, морей и рек испарилась бы. Увеличение расстояния между Землей и Солнцем более чем на 166 млн км привело бы к исчезновению жидкой воды на нашей планете – она полностью превратилась бы в лед.
ppt4web.ru