Из чего состоит вода: из каких молекул и атомов. Свойства молекулы воды
Свойства молекулы воды | Дистанционные уроки
12-Янв-2014 | Нет комментариев | Лолита Окольнова
Размышления ( не учебный материал !!!) на тему
свойств молекулы воды
Автор статьи — Саид Лутфуллин
Самое распространенное вещество на нашей планете. Без нее не было бы жизни. Все живые структуры, за исключением вирусов, по большей части состоят из воды. На ее примере детям в школе объясняют строение молекул, химические формулы. Свойства, характерные только для воды, используются в живой природе, а так же в хозяйственной жизни человека.
С детства нам знакомое вещество, никогда не вызывавшее каких-то вопросов. Ну вода, и что? А в таком простом, казалось бы, веществе скрыто много загадок.
Общие
-
Вода — основной природный растворитель. Все реакции в живых организмах так или иначе протекают в водной среде, вещества реагируют в растворенном состоянии.
-
У воды отличная теплоемкость, но довольно малая теплопроводность. Это позволяет использовать воду как транспорт тепла. На этом принципе основан механизм охлаждения многих организмов. А в атомной энергетике и воду, благодаря этому свойству, используют в качестве теплоносителя.
-
В воде не только протекают реакции, она сама вступает в реакции. Гидратация, фотолиз и т. д.
Это только некоторые свойства, ни одно вещество не может похвастаться таким наборов свойств. Поистине это вещество уникально.
Ну а теперь ближе к теме.
Всегда, везде, даже в школе на уроках химии ее называют просто «вода».
А вот какое химическое называние и свойства молекулы воды?
На просторах интернета и учебной литературы можно встретить такие называния: оксид водорода, гидроксид водорода, гидроксильная кислота. Это самые наиболее часто встречающиеся.
Так к какому все таки классу неорганических веществ относится вода?
Давайте разберемся в этом вопросе.
Ниже приведена схема:
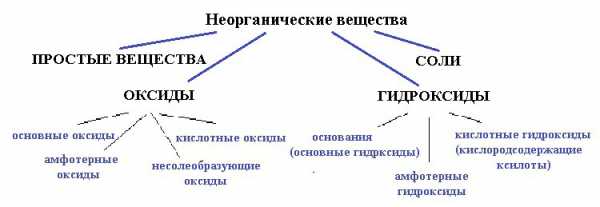
-
вода — точно не простое вещество, так как образована атомами разных элементов;
-
и не соль, так как связь в солях между катионом и анионом должна быть ионной, катионом должен быть металл, а в молекуле воды связи только ковалентные и катион — водород (неметалл).
Для начала разберемся — оксид это или гидроксид. Что с уверенностью можно сказать, так это то, что вода — это точно не оксид.
Хотя, если поверхностно посмотреть, то вода, в принципе, попадает под определение оксида водорода. Образуется в результате реакции полного окисления водорода: 2h3 + O2 → 2h3O, кислород в низшей степени окисления.
Рассмотрим по свойствам :
Свойства основных оксидов:
-
Взаимодействие с кислотами.
-
Взаимодействие с кислотными оксидами.
-
Взаимодействие с амфотерными оксидами.
Молекула воды обладает только одним свойством основного оксида — это взаимодействие с кислотными оксидами.
Свойства кислотных оксидов:
-
Взаимодействие со щелочами.
-
Взаимодействие основными оксидами.
-
Взаимодействие амфотерными оксидами.
Молекула воды так же проявляет только одно свойство: взаимодействие основными оксидами.
По свойствам молекула воды проявляет двойственную природу: реагирует с кислотными и основными оксидами.
Но воду нельзя отнести к амфотерным оксидам, так как амфотерные оксиды образуют металлы, а водород — неметалл.
Выходит, если вода — все таки оксид, значит несолеобразующий.
Но, может это будет сенсацией, ВОДА ОБРАЗУЕТ СОЛИ!
Но об этом немного позже.
Из приведенных выше доказательств следует, что вода — не оксид. Еще один аргумент «против оксида»: ни один оксид не диссоциирует на ионы, а одно из свойств молекулы воды — частичная диссоциация на катион H+ и анион OH—.
Исходя из предыдущего: в воде два «разных» водорода. Один в катионе, другой — в анионе.
И формулу воды следует писать не так как мы привыкли: h3O, а
HOH
Следовательно, вода — это гидроксид.
Эта версия более правдоподобна: гидроксильная группа явно намекает на что-то подобное. Но какой гидроксид? Давайте опять разберем по свойствам гидроксиды:
Свойства основных гидроксидов (оснований):
Для растворимых оснований (щелочей):
-
Для растворимых оснований (щелочей) характерны реакции ионного обмена.
-
Взаимодействие растворимых оснований (щелочей) с кислотными основаниями.
-
Взаимодействие с амфотерными гидроксидами.
-
Нерастворимые основания разлагаются при нагревании.
Молекула воды не проявляет ни одного свойства, только разве что, при сильном нагревании, она подвергнется разложению, ну а это со всеми веществами так — есть определенный порог температуры, выше которого связи не могут больше существовать и разрушаются.
Так же аргумент, «против» амфотерного и основного гидроксида — основные и амфотерные гидроксиды образуют только металлы.
Теперь подходим к самой интересной части. Выходит, что вода — это
кислотный гидроксид, то есть кислородосодержащая кислота.
Рассмотрим по свойствам.
Для кислотных гидроксидов характерны:
-
Реакции с металлами.
-
Реакции с основными и амфотерными оксидами.
-
Реакции с основаниями и амфотерными гидроксидам.
-
Реакции с солями.
-
Для сильных кислот так же реакции ионного обмена.
-
Вытеснение более слабых, а так же летучих кислот из солей.
Для молекулы воды характерны почти все эти свойства.
Разберем подробно.
- Реакции с металлами. Не все металлы способны реагировать с водой. Вода как кислота — очень слабая, но, тем не менее, это свойство она проявляет:
HOH + Na → NaOH + h3↑ — из воды вытесняется водород — вода ведет себя, как большинство кислот.
- Реакции с основными и амфотерными оксидами. С амфотерными оксидами не реагирует, так как кислотные свойства слабые, но реагирует с основными оксидами (не со всеми правда, это объясняется слабыми кислотными свойствами):
HOH + Na2O → 2NaOH
- Реакции с основаниями и амфотерными гидроксидам. Тут вода не может похвастаться такими реакциями — из-за своей слабости как кислоты.
- Реакции с солями. Некоторые соли подвергаются гидролизу — как раз таки реакции с водой.
Al2S3 + HOH → Al(OH)3↓ + h3S↑
Эта реакция так же иллюстрирует последнее свойство — вытеснение кислоты, у воды получается вытеснить сероводород.
Из определения: «кислота — это сложное вещество, состоящее из водорода и кислотного остатка, при диссоциирующее на катион H+ и катион кислотного остатка«.
Все подходит. И получается, что кислотный остаток — это гидроксильная группа OH.
И, как я и говорил раньше, вода образует соли, выходит, что соли воды-кислоты — это основные и амфотерные гидроксиды: металл, соединенный с кислотным остатком (OH).
И схемы реакций:
кислота + металл → соль + водород (в общем случае)
HOH + Na → NaOH + h3↑
кислота + основный оксид → соль вода
HOH + Na2O → 2NaOH (соль образуется, только воды не образуется, да и с чего бы это вдруг в результате реакции с водой, должна образовываться вода)
соль + кислота → другая кислота + другая соль
Al2S3 + HOH → Al(OH)3↓ + h3S↑
Итак, мы пришли к выводу, что амфотерные и основные гидроксиды — это соли воды — кислоты.
Тогда как их называть?
Весть термин «гидроксид» также применим к кислородосодержащим кислотам. По правилам получается:
название иона + ат = Гидрокс + ат.
Соли воды — гидроксаты.
Вода настолько слабая кислота, что проявляет некоторые амфотерные свойства, например реакции с кислотными оксидами.
И в воде нейтральная среда, а не кислая, как во всех кислотах — это исключение из правила.
Но в конце концов, как говорил замечательный русский химик-органик «Неосуществимых реакций нет, а если реакция не идет, то еще не найден катализатор».
Подведем итог.
Сформулируем основные положения теории «Вода — кислота»:
-
Молекула воды по свойствам — слабая (очень слабая) кислота.
-
Вода настолько слабая, что проявляет амфотерные свойства и у нее нейтральная реакция среды.
-
Вода как кислота образует соли — гидроксаты.
-
К гидроксатам относятся амфотерные и основные гидроксиды.
-
Формула воды: HOH.
-
Правильные названия воды: гидроксид водорода, гидроксильная кислота.
Еще на эту тему:
Обсуждение: "Свойства молекулы воды"
(Правила комментирования)distant-lessons.ru
из каких молекул и атомов
Вода — главная составляющая всего живого на Земле. Она является и средой обитания организмов, и главным элементом в их строении, а, следовательно, и источником жизни. Ее применяют в промышленности всех направлений. Поэтому представить себе жизнь с отсутствием воды весьма непросто.
Что входит в состав воды
Все прекрасно осведомлены о том, что вода состоит из водорода и кислорода. Это действительно так. Но помимо этих двух элементов, вода в своем составе имеет еще огромный перечень химических компонентов.
Из чего состоит вода?
Ей свойственно преобразовываться, проходя при этом гидрологический цикл: испарение, конденсацию и выпадение в виде осадков. В процессе протекания этих явлений вода соприкасается со множеством соединений органической природы, с металлами, газами, в результате чего жидкость дополняется различными элементами.
Элементы, входящие в состав воды, подразделяются на 6 категорий:
- Ионы. К ним относятся: катионы Na, K, Mg, Ca, анионы: Cl, HCO3 и SO4. Эти компонентынаходятся в воде в наибольшем, по сравнению с другими, количестве. В жидкость они поступают из почвенных слоев, природных минералов, горных пород, а также как элементы распада продуктов промышленной деятельности.
- Растворенные газы: кислород, азот, сероводород, углекислый газ и прочие. Количество каждого газа в воде напрямую зависит от ее температуры.
- Биогенные элементы. Главными из них являются фосфор и азот, которые поступают в жидкость из осадков, сточных и сельскохозяйственных вод.
- Микроэлементы. Их насчитывается около 30 видов. Показатели их в составе воды очень малы и колеблются от 0,1 до микрограмма на 1 литр. К ним относятся: бром, селен, медь, цинк и т. д.
- Органические вещества, растворенные в воде, и азотосодержащие вещества. Это спирты, углеводы, альдегиды, фенолы, пептиды и прочее.
- Токсины. Это в основном тяжелые металлы и продукты нефтепереработки.
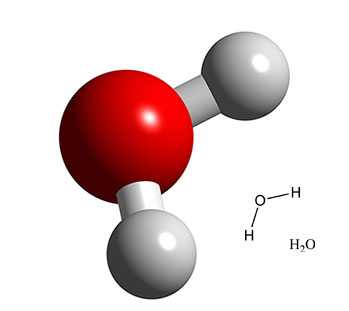
Молекула воды
Итак, из каких молекул состоит вода?
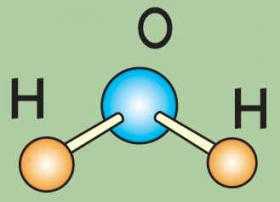
Формула воды тривиальна — Н2О. И она показывает, что молекула воды состоит из атомов водорода и кислорода. Между ними установлена устойчивая связь.
Масса молекулы равна 18,016 г/моль, где на долю водорода приходится 11,19%, а кислорода - 88,81%.
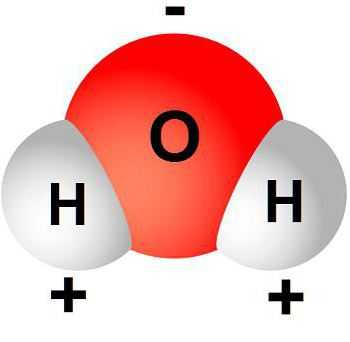
Молекула воды является полярной, поскольку она не имеет конкретного центра, вокруг которого сосредоточены положительные и отрицательные заряды, а имеет два противоположно заряженных полюса.
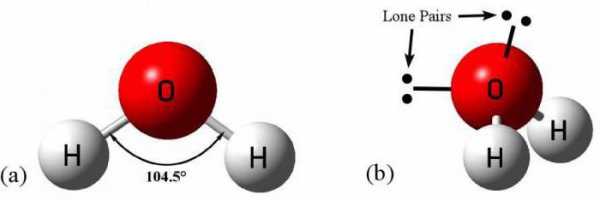
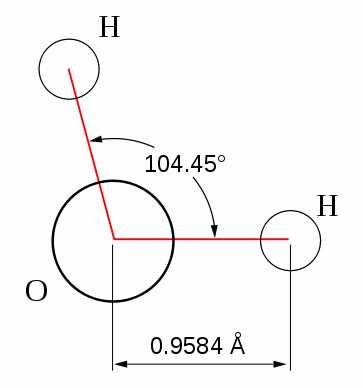
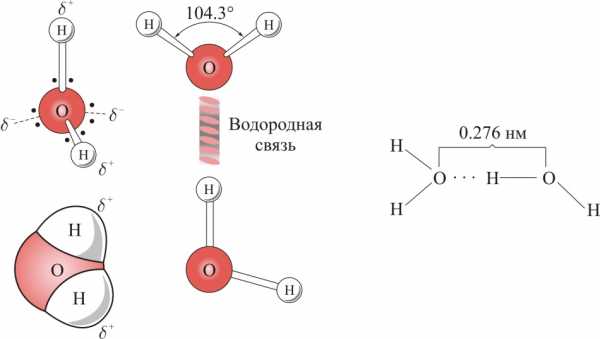
Вода состоит из атомов, угол между которыми меняется в зависимости от агрегатного состояния жидкости. Так, когда она находится в состоянии газа, угол между водородом и кислородом составляет 104о, в твердом состоянии - 109о. На эти показатели, а также на расстояние между атомами влияют также присутствующие компоненты.
Строение молекулы
Ранее было рассмотренно, из каких атомов состоит вода. Это водород и кислород. Главенствующую роль выполняет кислород. Вокруг этого элемента размещены отрицательно заряженные электроны, а положительно заряженные протоны сосредоточены вблизи атомов водорода. Такое соотношение полюсов молекулы влияет на характер молекулярной связи - она полярная.
Поскольку два атома водорода являются одноименно заряженными, то, соответственно, они друг от друга отдаляются. Это влияет на образующийся угол между атомами кислорода и водорода, он составляет 104,5о. Из-за разноименности полюсов молекула воды именуется диполем. Это ее свойство обуславливает необычные характеристики молекулы.
Как же выглядит молекула воды в пространстве? Чтобы определить форму молекулы, соединяют прямыми линиями центры атомов, в результате чего вырисовывается объемная фигура - тетраэдр. Таково строение воды.
Форма молекулы воды способна изменяться в зависимости от ее агрегатного состояния. Для газообразного состояния характерен угол между атомами кислорода и водорода в 104,27о, для твердого состояния - 109,5о, для жидкого - 105,03о.
Те молекулы, из которых состоит вода, занимают определенный объем в пространстве, при этом их оболочки покрыты электронным облаком в виде вуали. Вид водной молекулы, рассмотренной в плоскости, сравнивают с Х-образной хромосомой, которая служит для передачи генетической информации, а, следовательно, дает начало новой жизни. От такой формы проводится аналогия хромосомы и воды как источников жизни.
В пространстве молекула выглядит как объемный треугольник, тетраэдр. Такая форма является очень устойчивой и изменяется только из-за влияния на воду внешних физических факторов.
Из чего состоит вода? Из тех атомов, которые подвержены влиянию Ван-дер-Ваальсовых сил, образовыванию водородных связей. В связи с этим между кислородом и водородом соседних молекул образуются случайные ассоциаты и кластеры. Первые - это неупорядоченные структуры, вторые - упорядоченные ассоциаты.
В привычном состоянии воды количество ассоциатов составляет 60%, кластеров - 40%.
Между соседними водными молекулами возможны образования водородных мостиков, которые способствуют образованию различных структур - кластеров.
Кластеры способны взаимодействовать между собой посредством водородных связей, а это приводит к появлению структур нового порядка - шестигранников.
Электронное строение молекулы воды
Атомы - это то, из чего состоит вода, и каждый атом имеет свое электронное строение. Так, графическая формула электронных уровней выглядит так: 8О 1s22s22p4, 1Н 1s1.
Когда происходит процесс формирования молекулы воды, происходит перекрывание электронных облаков: два неспаренных электрона кислорода перекрываются с 1 неспаренным электроном водорода. В результате перекрывания образуется угол между атомами в 104о.
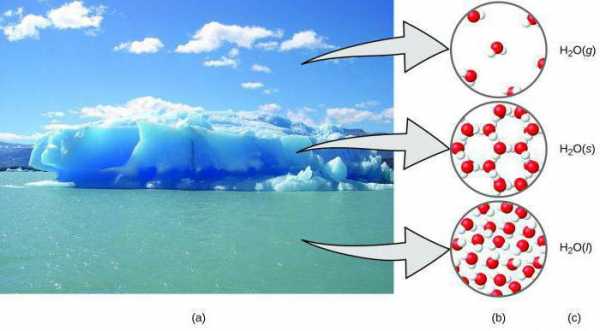
Агрегатное состояние воды
Как уже говорилось, молекулы воды - это диполи, и данный факт влияет на необычные свойства вещества. Одним из таких свойств является то, что вода может присутствовать в природе в трех агрегатных состояниях: жидком, твердом и парообразном.
Переход от одного состояния в другое обусловлен следующими процессами:
- Кипение - из жидкости в пар.
- Конденсация - переход их пара в жидкость (осадки).
- Кристаллизация - когда жидкость превращается в лед.
- Плавление - процесс таяния льда и получения жидкости.
- Сублимация - превращение льда в парообразное состояние.
- Десублимация - обратная реакция сублимации, то есть переход пара в лед.
От состояния воды зависит и строение ее молекулярной решетки.
Заключение
Таким образом, можно сказать, что вода - это сложное вещество с простым строением, которое может меняться в зависимости от ее состояния. И нам стало понятно, из каких молекул состоит вода.
fb.ru
|
Перейти к оглавлению сайта Ячейка МэйераВода вместо бензина Как работает ячейка Мэйера Резонансный контур молекул воды Строение молекул воды, свойства Разрыв молекул воды и закон Ома Выбор типа СВЧ-колебаний Разрыв молекул воды и ЗСИ Модели молекул воды, водорода и кислорода Плазмо- электролитический реактор Канарёва Электролиз обыкновенной воды Анализ патентов Ячейки Мэйера Импульсный генератор для ячейки Мэйера Производительность ячейки Мэйера |
Забежав немного вперёд напишу:Задача, выполняемая Ячейкой Мэйера - «лёгкое» разложение молекул воды под действием электрического тока, сопровождаемого электромагнитным излучением. Для её решения разберёмся, что же вода из себя представляет? Каково строение молекул воды? Что известно о молекулах воды и их связях? В статье, я использовал различные публикации, имеющиеся в достаточном количестве в Интернете, но они размножены в большом количестве, поэтому, кто их автор, мне не понятно и ссылаться на источник с моей стороны глупо. Мало того, эти публикации «запутаны» до безобразия, что затрудняет восприятие, и значительно увеличивает время изучения. Анализируя статьи, я извлёк то, что может направить Вас на понимание того, с чем мы будем иметь дело в процессе добычи дешёвой энергии, а точнее в процессе разрыва молекул воды на составляющие – водород и кислород. Итак, рассмотрим наиболее весомые понятия о строении молекул воды!Вода - вещество, основной структурной единицей которого является молекула h3O, состоящая из одного атома кислорода и двух атомов водорода. Молекула воды имеет структуру как бы равнобедренного треугольника: в вершине этого треугольника расположен атом кислорода, а в основании его — два атома водорода. Угол при вершине составляет 104°27, а длина стороны — 0,096 нм. Эти параметры относятся к гипотетическому равновесному состоянию молекулы воды без ее колебаний и вращений. Геометрия молекулы воды и её электронные орбиты изображены на рисунке. Молекула воды представляет собой диполь, содержащий положительный и отрицательный заряды на полюсах. Если "свободную" молекулу воды - не связанную с другими молекулами, поместить в электрическое поле, то она "повернётся" отрицательными полюсами в сторону положительной пластины электрического поля, а положительными полюсами в сторону отрицательной пластины. Именно этот процесс изображён на рисунке 1, позиция - 3В, поясняющем работу Ячейки Мэйера в статье "Вода вместо бензина". Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура - правильный тетраэдр. Таково строение самой молекулы воды. Благодаря наличию водородных связей каждая молекула воды образует водородную связь с 4-мя соседними молекулами, образуя ажурный сетчатый каркас в молекуле льда. Именно такое упорядоченное состояние молекул воды можно назвать «структурой». Каждая молекула может одновременно образовывать четыре водородные связи с другими молекулами под строго определенными углами, равными 109°28', направленных к вершинам тетраэдра, которые не позволяют при замерзании создавать плотную структуру. Когда лёд плавится, его тетрагональная структура разрушается и образуется смесь полимеров, состоящая из три-, тетра-, пента-, и гексамеров воды и свободных молекул воды. В жидком состоянии вода – неупорядоченная жидкость. Эти водородные связи - спонтанные, короткоживущие, быстро рвутся и образуются вновь. Группируясь, тетраэдры молекул воды образуют разнообразные пространственные и плоскостные структуры. И из всего многообразия структур в природе базовой является гексагональная (шестигранная) структура, когда шесть молекул воды (тетраэдров) объединяются в кольцо. Такой тип структуры характерен для льда, снега и талой воды, которую из-за наличия такой структуры, называют "Структурированной водой". О полезных свойствах структурированной воды пишут много, но не это тема нашей статьи. Логично будет, что структурированная вода - образующая гексагональные структуры является наихудшим вариантом структуры воды, которую возможно использовать для разложения на водород и кислород. Поясню почему: Молекулы воды, группируясь по шесть в гексамер, имеют электронейтральный состав - у гексамеров нет положительных и отрицательных полюсов. Если поместить гексамер структурированной воды в электрическое поле, то он не будет никак на него реагировать. Поэтому логически можно заключить, что необходимо, чтобы в воде было как можно меньше организованных структур. На самом деле, всё наоборот, гексамер - это не завершённая структура, есть ещё более интересное понятие - кластер. Структуры объединённых молекул воды называют кластерами, а отдельные молекулы воды - квантами. Кластер - объёмное соединение молекул воды, в том числе гексамеров, у которого имеются и положительные и отрицательные полюса. В дистиллированной воде кластеры практически электронейтральны, потому что в результате испарения, произошло разрушение кластеров, а в результате конденсации, сильные связи между молекулами воды не появились. Однако, их электропроводность можно изменить. Если дистиллированную воду помешать магнитной мешалкой, связи между элементами кластеров будут частично восстановлены и электропроводность воды изменится. Другими словами, дистиллированная вода – это вода, у которой минимальное количество связей между молекулами. В ней диполи молекул находятся в разориентированном состоянии, поэтому диэлектрическая проницаемость дистиллированной воды очень высока, и она плохо проводит электрический ток. В то же время, для повышения управляемости кластерами воды, в неё добавляют кислоты или щёлочи, которые участвуя в молекулярных связях, не позволяют молекулам воды образовывать гексагональные структуры, образуя при этом электролиты. Дистиллированная вода является противоположностью структурированной воде, в которой связей между молекулами воды в кластеры огромное количество.На моём сайте имеются, и будут появляться статьи, которые, на первый взгляд «отдельные» и не имеют никакого отношения к другим статьям. На самом деле, большинство статей сайта имеет взаимосвязь в одно целое. В данном случае, описывая свойства дистиллированной воды, я использую Дипольную теорию электрического тока, это альтернативное понятие об электрическом токе, которое подтверждается и наукой и практикой лучше, чем классическое понятие. При воздействии энергии источника электрического тока, все диполи атомов воды (как проводника) поворачиваются, ориентируясь своими одноимёнными полюсами в одном направлении. Если молекулы воды до появления внешнего электрического поля создавали кластерную (взаимно ориентированную) структуру, то для ориентации во внешнем электрическом поле потребуется минимальное количество энергии источника электрического тока. Если же структура была не организованной (как у дистиллированной воды), то потребуется большое количество энергии. Заметьте, «в народе» бытует мнение, что дистиллированная вода и талая вода должны обладать одинаковыми электропроводными свойствами, ведь что у одной, что у другой отсутствуют химические примеси (как правило – соли), их химический состав одинаков, да и строение молекул воды что в талой воде, что в дистиллированной одинаково. На самом деле всё выглядит наоборот, отсутствие примесей совсем не говорит о свойствах электропроводности воды. Не понимая этого, некоторые люди, «убивают» аккумуляторные батареи ещё на этапе их заправки электролитом, подменяя дистиллированную воду на талую, или просто очищенную через угольный фильтр. Как правило, заправленный аккумулятор, который куплен на автомобильном рынке служит меньше, чем тот, который вы купили сухозаряженным и разбавив серную кислоту дистиллированной водой, заправили его сами. Это лишь потому, что «готовый» электролит, или заправленный аккумулятор – это в наше время средство заработка, а чтобы определить какая вода использовалась, надо провести дорогую экспертизу, никто этим не заморачивается. Торгашу не важно, сколько прослужит аккумулятор на твоём авто, а Вам тоже, возиться с кислотой не очень хочется. Зато, я Вас уверяю, аккумулятор, над которым попотеете Вы, при минусовых температурах будет намного бодрее, чем заправленный из уже готового бутылочного электролита. Продолжим!В воде кластеры периодически разрушаются и образуются снова. Время перескока составляет 10-12 секунд. Так как, строение молекулы воды несимметрично, то центры тяжести положительных и отрицательных зарядов ее не совпадают. Молекулы имеют два полюса - положительный и отрицательный, создающие, как магнит, молекулярные силовые поля. Такие молекулы называют полярными, или диполями, а количественную характеристику полярности определяют электрическим моментом диполя, выражаемым произведением расстояния l между электрическими центрами тяжести положительных и отрицательных зарядов молекулы на заряд e в абсолютных электростатических единицах: p = l·e Для воды дипольный момент очень высокий: p = 6,13·10-29 Кл·м. Кластеры воды на границах раздела фаз (жидкость-воздух) выстраиваются в определенном порядке, при этом все кластеры колеблются с одинаковой частотой, приобретая одну общую частоту. При таком движении кластеров, учитывая, что входящие в кластер молекулы воды являются полярными, то есть, имеют большой дипольный момент, следует ожидать появления электромагнитного излучения. Это излучение отличается от излучения свободных диполей, так как диполи являются связанными и колеблются совместно в кластерной структуре. Частота колебаний кластеров воды и соответственно, частота электромагнитных колебаний может быть определена по следующей формуле: где a - поверхностное натяжение воды при заданной температуре; М - масса кластера. где V - объем кластера.Объем кластера определяется с учетом размеров фрактальной замкнутой структуры кластера или по аналогии с размерами домена белка. При комнатной температуре 18°С частота колебаний кластера f равна 6,79·109 Гц, то есть длина волны в свободном пространстве должна составлять λ = 14,18 мм. Но что, же будет происходить при воздействии на воду внешнего электромагнитного излучения? Поскольку вода является самоорганизованной структурой и содержит как упорядоченные в кластеры элементы, так и свободные молекулы, то при воздействии внешнего электромагнитного излучения будет происходить следующее. При сближении молекул воды (расстояние изменяется от R0 до R1) энергия взаимодействия изменяется на большую величину, чем при их взаимном удалении (расстояние изменяется от R0 до R2). Но, поскольку молекулы воды имеют большой дипольный момент, то в случае внешнего электромагнитного поля, они будут совершать колебательные движения (например, от R1 до R2). При этом в силу приведенной зависимости приложенное электромагнитное поле будет больше способствовать притяжению молекул и тем самым организованности системы в целом, т.е. образованию гексагональной структуры. При наличии же примесей в водной среде, они покрываются гидратной оболочкой таким образом, что общая энергия системы стремится принять минимальное значение. И если общий дипольный момент гексагональной структуры равен нулю, то в присутствие примесей гексагональная структура вблизи них нарушается таким образом, чтобы система приняла минимальное значение, в ряде случаев шестиугольники преобразуются в пятиугольники, и гидратная оболочка имеет форму близкую к шару. Примеси (например, ионы Na+) могут стабилизировать структуру, делать ее более устойчивой к разрушению. Самоорганизованная система воды при воздействии электромагнитного излучения не будет перемещаться как единое целое, но каждый элемент гексагональной, а в случае примесей локально и другого вида, структуры будет смещаться, т.е. будет происходить искажение геометрии структуры, т.е. возникать напряжения. Такое свойство воды очень напоминает полимеры. Но полимерные структуры обладают большими временами релаксации, которые составляют не 10-11–10-12 с, а минуты и больше. Поэтому энергия квантов электромагнитного излучения, переходя во внутреннюю энергию организованной водной структуры в результате её искажений, будет накапливаться ею, пока не достигнет энергии водородной связи, которая в 500–1000 раз больше энергии электромагнитного поля. При достижении этой величины происходит разрыв водородной связи, и структура разрушается. Это можно сравнить со снежной лавиной, когда происходит постепенное, медленное накапливание массы, а затем стремительный обвал. В случае с водой происходит разрыв не только слабой связи между кластерами, но и более сильных связей - в строении молекул воды. В результате этого разрыва могут образовываться Н+, ОН–, и гидратированный электрон е–. Голубой цвет чистой воды обязан наличию именно этих электронов, а не только рассеянию естественного света. ЗаключениеТаким образом, при воздействии электромагнитного излучения с водой происходит накапливание энергии в кластерной структуре до некоторого критического значения, затем происходит разрыв связей как между кластерами, так и других, происходит лавинообразное освобождение энергии, которая может затем трансформироваться в другие типы. В следующей статье"Разрыв молекул воды на водород и кислород. Закон Ома и Ячейка Мэйера", мы определимся с условиями разрыва молекул воды и разберёмся, как Закон Ома препятствует "нашим желаниям". |
Самое популярное на сайте за декабрь
Что такое электрический ток? Графическое обозначение радиоэлементов на схеме. Основные элементы Выбор сечения кабеля проводки электрической сети Биполярный транзистор, расчёт транзисторного каскада Простые стабилизаторы напряжения и их расчёт Самое новое на сайтеТехнический шпионаж. Часть 3. Технический шпионаж. Часть 2. Технический шпионаж Отчёт о деятельности за 2017 год |
1. Строение молекулы воды
Поведение воды "нелогично". Получается, что переходы воды из твёрдого состояния в жидкое и газообразное происходит при температурах, намного более высоких, чем следовало бы. Этим аномалиям найдено объяснение. Молекула воды h3О построена в виде треугольника: угол между двумя связками кислород - водород 104 градуса. Но поскольку оба водородных атома расположены по одну сторону от кислорода, электрические заряды в ней рассредоточиваются. Молекула воды полярная, что является причиной особого взаимодействия между разными её молекулами. Атомы водорода в молекуле h3О, имея частичный положительный заряд, взаимодействуют с электронами атомов кислорода соседних молекул. Такая химическая связь называется водородной. Она объединяет молекулы h3О в своеобразные полимеры пространственного строения; плоскость, в которой расположены водородные связи, перпендикулярны плоскости атомов той же молекулы h3О. Взаимодействием между молекулами воды и объясняются в первую очередь незакономерно высокие температуры её плавления и кипения. Нужно подвести дополнительную энергию, чтобы расшатать, а затем разрушить водородные связи. И энергия эта очень значительна. Вот почему, кстати, так велика теплоёмкость воды.
2. Физические свойства воды
Чистая вода представляет собой бесцветную прозрачную жидкость. Плотность воды при переходе ее из твердого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает. При нагревании воды от 0 до 4°С плотность ее также увеличивается. При 4°С вода имеет максимальную плотность, и лишь при дальнейшем нагревании ее плотность уменьшается.
Если бы при понижении температуры и при переходе из жидкого состояния в твердое плотность воды изменялась так же, как это происходит у подавляющего большинства веществ, то при приближении зимы поверхностные слои природных вод охлаждались. бы до 0°С и опускались на дно, освобождая место более теплым слоям, и так продолжалось бы до тех пор, пока вся масса водоема не приобрела бы температуру 0°С. Далее вода начинала бы замерзать, образующиеся льдины погружались бы на дно и водоем промерзал бы на всю его глубину. При этом многие формы жизни в воде были бы невозможны. Но так как наибольшей плотность вода достигает при 4 °С, то перемещение ее слоев, вызываемое охлаждением, заканчивается при достижении этой температуры. При дальнейшем понижении температуры охлажденный слой, обладающий меньшей плотностью, остается на поверхности, замерзает и тем самым защищает лежащие ниже слои от дальнейшего охлаждения и замерзания.
Большое значение в жизни природы имеет и тот факт, что вода. обладает аномально высокой теплоемкостью [4,18 Дж/(г К)], поэтому в ночное время, а также при переходе от лета к зиме вода остывает медленно, а днем или при переходе от зимы к лету так же медленно нагревается, являясь, таким образом, регулятором температуры на земном шаре.
В связи с тем, что при плавлении льда объем, занимаемый водой, уменьшается, давление понижает температуру плавления льда. Эта вытекает из принципа Ле Шателье. Действительно, пусть лед и жидкая вода находятся в равновесии при 0°С. При увеличении давления равновесие, согласно принципу Ле Шателье, сместится в сторону образования той фазы, которая при той же температуре занимает меньший объем. Этой фазой является в данном случае жидкость. Таким образом, возрастание давления при 0°С вызывает превращение льда в жидкость, а это и означает, что температура плавления льда снижается.
Молекула воды имеет угловое строение; входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине - ядро атома кислорода, Межъядерные расстояния О-Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно примерно 0,15 нм. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды две электронные пары образуют ковалентные связи О-Н, а остальные четыре электрона представляют собой две неподеленных электронных пары. Молекулярная масса парообразной воды равна 18 и отвечает ее простейшей формуле. Однако молекулярная масса жидкой воды, определяемая путем изучения ее растворов в других растворителях оказывается более, высокой. Это свидетельствует о том, что в жидкой воде происходит ассоциация молекул, т. е. соединение их в более сложные агрегаты. Такой вывод подтверждается и аномально высокими значениями температур плавления и кипения воды. Ассоциация молекул воды вызвана образованием между ними водородных связей.
В твердой воде (лед) атом кислорода каждой молекулы участвует в образовании двух водородных связей с соседними молекулами воды согласно схеме, в которой водородные связи показаны пунктиром.
Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются друг с другом своими разноименными полюсами. Молекулы образуют слои, причем каждая из них связана с тремя молекулами, принадлежащими к тому же слою, и с одной - из соседнего слоя. Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры наименее плотным структурам, в ней существуют пустоты, размеры которых несколько превышают размеры молекулы. При плавлении льда его структура разрушается. Но и в жидкой воде сохраняются водородные связи между молекулами: образуются ассоциаты - как бы обломки структуры льда, - состоящих из большего или меньшего числа молекул воды. Однако в отличии от льда каждый ассоциат существует очень короткое время: постоянно происходит разрушение одних и образование других агрегатов. В пустотах таких “ледяных” агрегатов могут размещаться одиночные молекулы воды; при этом упаковка молекул воды становится более плотной. Именно поэтому при плавлении льда объем, занимаемый водой, уменьшается, а ее плотность возрастает.
По мере нагревания воды обломков структуры льда в ней становится все меньше, что приводит к дальнейшему повышению плотности воды. В интервале температур от 0 до 4°С этот эффект преобладает над тепловым расширением, так что плотность воды продолжает возрастать. Однако при нагревании выше 4°С преобладает влияние усиления теплового движения молекул и плотность воды уменьшается. Поэтому при 4°С вода обладает максимальной плотностью.
При нагревании воды часть теплоты затрачивается на разрыв водородных связей (энергия разрыва водородной связи в воде составляет примерно 25 кДж/моль). Этим объясняется высокая теплоемкость воды. Водородные связи между молекулами воды полностью разрываются только при переходе воды в пар.
studfiles.net
Строение молекулы и свойства воды
Аномальные свойства воды предполагают существование прочных сил между молекулами воды. Это можно объяснить уже при рассмотрении природы единичной молекулы воды, а затем и группы молекул. Шесть валентных электронов кислорода в молекуле воды гибридизированы в четырех Sp3-орбиталях, которые вытянуты к углам, образуя тетраэдр.
Две гибридные орбитали образуют О—Н ковалентные связи с углом 105°, тогда как другие две орбитали имеют неподеленные электронные пары. Ковалентные О—Н связи, благодаря высокой электроотрицательности кислорода, частично (на 40%) имеют ионный характер.
Таким образом, молекула воды имеет два отрицательных и два положительных заряда по углам тетраэдра. Вследствие этого, каждая
465
молекула воды тетраэдричес-ки координирована с четырьмя другими молекулами воды благодаря водородным связям (см. рис. 10.2). Энергия диссоциации водородной связи ~25 кДж/моль.
Рис. 10.2. Тетраэдрическая координация молекул воды
Одновременное присутствие в молекуле воды двух доноров и двух акцепторов делает возможной ассоциацию в трехмерную сеть, стабилизированную водородными связями, что обеспечивает большую силу взаимодействия между молекулами. Эта структура объясняет особые физические свойства воды, необычные для малых молекул. Так, например, спирт и соединения с изоэлектрическими диполями, такие как HF или Nh4, образуют, в отличие от воды, только линейную или двухмерную ассоциацию.
Частичная поляризация Н—О связи в дальнейшем усиливается за счет образования водородных связей. Поэтому дипольный момент комплекса, состоящего из увеличенного числа водных молекул (мультимолекулярный диполь), тем больше, чем больше молекул ассоциировано и, естественно, больше дипольного момента единичной молекулы. Как следствие, диэлектрическая постоянная воды оказывается большой и превышает величину, которая может быть вычислена на основе дипольного момента единичной молекулы.
Транспорт (перенос) протона осуществляется вдоль водородной связи. Это поистине прыжок протона от одной молекулы воды к соседней молекуле воды. Независимо от того, получен ли протон путем диссоциации воды или будет получен от кислоты, он будет погружаться в орбита-ли неподеленных электронов молекулы, образуя гидратированный ион водорода Н3О+(ион гидроксония) с исключительно сильной водородной связью (энергия диссоциации — 100 кДж/моль):
Подобный механизм действует и в транспорте ионов ОН-, который осуществляется вдоль водородных связей:
466
Переход протона от одного атома кислорода к другому осуществляется чрезвычайно быстро (V>1012c-1), поэтому подвижность протона весьма велика. Она превышает подвижность других ионов в 4—5 раз и соизмерима только с подвижностью ионов ОН-, которая, однако, примерно на 40% меньше. При этом скорость протонов во льду примерно в 100 раз больше, чем в воде.
Способность воды образовывать трехмерные водородные связи, для разрушения которых необходима дополнительная энергия, объясняет рассмотренные выше необычные свойства воды, например высокие значения теплоемкости, точек плавления и кипения, поверхностного натяжения и теплот фазовых переходов.
Вода может влиять на конформацию макромолекул, если там имеют место какие-либо нековалентные связи, которые стабилизируют конформацию большой молекулы. Эти нековалентные связи могут быть трех видов: водородные, ионные и неполярные связи. В белках существует конкуренция между CO...HN водородными связями и вода-амид водородными связями. Чем больше способность растворителя к образованию водородных связей, тем слабее CO...HN связь. В водной среде теплота образования или разрыва этой связи равна 0. Это означает, что CO...HN водородная связь не может обеспечить стабилизацию в водном растворе. Конкурирующая водородная связь от Н2О ослабляет термодинамическую тенденцию к образованию CO...HN водородных связей. Водные молекулы вокруг неполярных групп (молекул) становятся более упорядоченными, приводя к потере энтропии, и в результате возникает тенденция к ассоциации отдельных неполярных групп в водной среде с другими, большими чем водные, молекулами (гидрофобное взаимодействие). Концепция гидрофобной связи схематично показана на рис. 10.3.
Рис. 10.3. Образование гидрофобной связи
С химической точки зрения вода является весьма реакционноспособным веществом. Она соединяется со многими оксидами металлов и неметаллов,
467
взаимодействует с активными металлами и вступает в различные другие реакции самого разнообразного характера.
Превращения белков, Липидов, углеводов с участием воды имеют важное значение в пищевых технологиях.
Помимо химических реакций, в которые вступает вода, при растворении веществ в воде имеют место взаимодействия физико-химического характера. Ниже мы кратко рассмотрим взаимодействие воды с ионами и ионными группами, группами, обладающими способностью к образованию водородных связей, и с неполярными веществами (группами). Эти взаимодействия необходимо принимать во внимание при рассмотрении классификации видов влаги в пищевых продуктах и ее причастности к химическим, биохимическим и микробиологическим изменениям в продукте при хранении (см. раздел 10.3).
468
465::466::467::468::Содержание
468::469::470::Содержание
studfiles.net
Вода / Полезная информация / Компания "Айвер"
Вода
 Вода - это неорганическое соединение с химической формулой h30. Представляет собой прозрачную жидкость, без цвета (в малом объёме), запаха и вкуса. В твёрдом состоянии называется льдом, а в газообразном— водяным паром.
Вода - это неорганическое соединение с химической формулой h30. Представляет собой прозрачную жидкость, без цвета (в малом объёме), запаха и вкуса. В твёрдом состоянии называется льдом, а в газообразном— водяным паром.
Вода. Строение молекулы.
Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью.
Самая простая модель молекулы воды предсталяет собой тетраэдр. На самом деле одиночные молекулы воды при нормальных температуре и давлении не существуют, все они соединены друг с другом водородными связями. Можно сказать, все молекулы связаны в одну пространственную сетку – макромолекулу. Каждая молекула воды может участвовать максимум в четырёх водородных связях (каждый атом водорода в одной и атом кислорода - в двух). В таком состоянии молекулы находятся в кристалле льда. При таянии льда часть связей рвётся, и молекулы воды располагаются плотнее. При нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4°С этот эффект становится слабее, чем тепловое расширение. А при испарении рвутся все оставшиеся связи.
Вода имеет несколько химических названий: оксид водорода, монооксид дигидрогена, гидроксид водорода (соединение гидроксильной группы OH- и катиона H+), гидроксильная кислота (воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «кислотного остатка» OH- оксидан дигидромонооксид.)
Кислород и водород в молекуле воды имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода выделяют следующие виды воды: лёгкая вода Н2О, тяжёлая вода (дейтериевая) D2O и сверхтяжёлая вода (тритиевая) T2O.
Вода. Важные свойства.
Вода – самое необычное вещество природы. Это связано с тем, что свойства воды во многом не соответствуют физическим законам, которым подчиняются другие вещества. Рассмотрим какими удивительными физическими свойствами обладает вода. Большинство веществ находясь в твердом состоянии обладают более высокой плотностью чем в жидком. А вода наоборот в твердом состоянии (лед) обладает более низкой плотностью чем в жидком. Наибольшая плотность воды достигается при температуре +4оС, что обеспечивает жизнь в воде зимой. В замерзающих водоёмах, когда температура падает ниже +4°C, более холодная вода, как менее плотная остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура. Еще одно аномальное свойство воды – расширение объема на 10% при замерзании обеспечивает плавание льда, и как следствие сохранение жизни подо льдом.
Важное свойство воды – это большое поверхностное натяжение (72мН/м при 25 ОС). Так как у воды силы межмолекулярного взаимодействия очень велики, то каждая расположенная на поверхности воды молекула как бы втягивается внутрь слоя воды.


Вода это хороший растворитель полярных веществ. В связи со своими малыми размерами молекулы воды в большом количестве могут окружить каждую молекулу растворяемого вещества. Положительно заряженные части молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные - атомы водорода.
Чистая вода (без примесей) - хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация ионов гидроксония h4O+ и гидроксид-ионов HO- составляет 0,1 мкмоль/л. А так как вода - хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту. Чем ниже будет уровень электропроводности, тем чище вода.
Вода сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60% парникового эффекта. Благодаря большому дипольному моменту молекул воды, она также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Вода медленно нагревается благодаря высокой теплоемкости, но процесс остывания происходит намного медленнее. Это дает возможность в летнее время года накапливать тепло на нашей планете посредством океанов и морей, а затем постепенно высвобождать тепло в зимний период. Таким образом, океаны и моря – это оригинальный и природный аккумулятор тепла на территории нашей планеты. Теплоемкость воды более чем в два раза превышает теплоемкость любого другого химического соединения, поэтому именно воду используют в качестве рабочего тела в энергетик.
Читайте также:
voda70.ru
Свойство - молекула - вода
Свойство - молекула - вода
Cтраница 1
Свойства молекул воды заслуживают внимания, ибо вода, хоть и не относится непосредственно к органическим веществам, составляет главную часть всех живых организмов. [1]
Многие свойства молекулы воды установлены в результате анализа полосатых спектров испускания или поглощения молекул воды в газовой фазе. [2]
С другой стороны, энергетическая неоднородность поверхности, присутствие обменных катионов приводят к различию в свойствах связанной воды. Свойства молекул воды, связанных обменными ионами поверхности твердой частицы, отличаются от свойств воды в объеме тем больше, чем выше плотность заряда иона. В глинистых минералах количество воды, связанной наиболее прочно, больше при наличии поливалентных катионов в обменном комплексе. [4]
Таким образом, взаимодействие истинных и потенциальных электролитов с водой является химическим, приводящим к разрушению ионных или молекулярных кристаллов или молекул и образованию гидратированных ионов. Для реализации электролитической диссоциации особое значение имеют донорно-акцепторные свойства молекулы воды. [5]
Обнаружено, что даже при снижении средней, макроскопической диэлектрической проницаемости в ЗО раз и более путем введения в воду неорганических солей микроскопическая полярность меняется очень слабо в противоположность сильному влиянию добавок спиртов. Низкая макроскопическая диэлектрическая проницаемость концентрированных растворов солей отражает усредненные свойства молекул воды, связанных с ионами, и свободных молекул воды. Для ближних взаимодействий между ионами в ионных парах и на поверхности раздела наиболее важна полярность ближайшего окружения ( в сольвагной оболочке), и присутствие гидратированных ионов, по-видимому, влияет лишь в незначительной мере. [6]
Что касается пряного спектроскопического подтверждения существования Hjd в разбавленных растворах сильных кислот, то оно затруднительно. Белл [38] указал, что характерные свойства гид-роксониевого иона будут незначительно отличаться от свойств молекул воды, всегда присутствующей в избытке, и что скорость обмена протонами между молекулами воды может быть так велика, а время жизни Hj О настолько мало, что свойства Н3 О будут совершенно незаметны, особенно в методе ИКС. Тем не менее ряд авторов при исследовании водных растворов кислот полосы, обнаруженные в области 2900, 1700, 1200 см 1, отнесли, на основании колебательных спектров HjO кристаллического, к иону НзО в водном растворе. [7]
Этот механизм представляет собой специфический кислотный-общеосновной катализ реакции в прямом направлении. В обратном направлении катализатор должен действовать, отдавая протон уходящей гидроксильной группе, с тем чтобы частично придать ей свойства молекулы воды и тем самым увеличить ее способность к удалению. Это и есть непосредственный общекислотный катализ. [8]
Уже из этих примеров видно, какие различные функции в структуре вещества могут выполнять молекулы воды и продукты ее диссоциации. Весьма вероятно, что в большом разнообразии свойств веществ, содержащих воду, которые обычно объясняются исключительно строением самих этих веществ, в действительности не меньшую роль играют свойства молекулы воды. Поэтому при изучении структуры и реакционной способности вещества факт обнаружения в нем молекул воды, продуктов ее диссоциации или каких-либо их комплексов, иначе говоря обнаружение в веществе группировок, построенных из атомов водорода и кислорода ( OmHn-группировок) - будем называть их оксигидрильными группировками - еще ничего не говорит о их свойствах, которые могут оказаться самыми различными и часто весьма неожиданными. Иллюстрацией разнообразия свойств ОН-групп могут служить хорошо известные свойства ОН-групп кислот и щелочей. [9]
Движущиеся частицы газа мы называем молекулами. Название это пришло из химии, где оно означает мельчайшие частицы вещества, которые могут еще существовать самостоятельно. Так, молекула воды, Н2О, дает Два атома водорода и один кислорода, свойства которых отличны от свойств молекулы воды. Предоставленные самим себе отдельные атомы группируются в пары Н2 и 02 - молекулы газов водорода и кислорода. В кинетической теории газов мы имеем дело с молекулами и предполагаем, что они не расщепляются при соударениях. Кроме того, мы считаем, что молекулы действуют друг на друга лишь в момент соударения; когда они оказываются достаточно близко друг к другу, они испытывают действие отталкивающей силы, но на очень короткое время. В этом фактически и заключается соударение. [10]
Во всех случаях спонтанный повал диполей приводит к появлению дипольного момента у системы. Из рис. 2 видно, что составляющая диполь-иого момента вдоль оси цилиндра намного превосходит по своей величине составляющие, ортогональные к оси. Это указывает на то, что направление равновесного дипольного момента практически совпадает с направлением их длинных геометрических осей. Ограниченные возможности ЭВМ не позволяют в настоящее время провести расчет со значительно большим количеством диполей. При расчете не были должным образом учтены сте-рические свойства молекул воды, а также силы близкодействия, возникающие при сближении диполей. [12]
Первостепенную роль в теории колебательных спектров играют свойства симметрии и операции симметрии молекул. Поскольку атомы в молекулах ( точнее, ядра атомов) расположены в определенном порядке и образуют вполне определенную конфигурацию, то, очевидно, можно говорить о той или иной симметрии молекул. Характеризуется симметрия молекул так же, как и любое другое геометрическое тело, одним или несколькими элементами симметрии, а именно осью, плоскостью и центром симметрии. Каждому элементу симметрии соответствует операция симметрии - такое перемещение системы ( отражение или вращение), которое не приводит к изменению конфигурации и свойств молекулы. Зеркальное отражение всех атомов в этих плоскостях не меняет ни структуры, ни свойств молекулы воды. Операция отражения во второй плоскости меняет местами атомы водорода. [14]
Страницы: 1
www.ngpedia.ru