Физические свойства воды. Молекулы воды свойства
Физические свойства воды
Чистая природная вода – жидкость без запаха, вкуса и цвета (лишь в слое толщиной более 2 м голубоватая). Основные физические характеристики воды (при давлении 0,1 МПа) приведены в таблице 1.
Таблица 1 – Основные физические характеристики воды (при давлении 0,1 МПа) [4]
| Константа | Значение |
| Температура: | замерзания, плавления – 0 кипения – 100 |
| Плотность при: | 0 – 0,99984 г/см3 3,98 – 0,99997 г/см3 20 – 0,9982 г/см3 100 – 0,95835 г/см3 |
| Скрытая теплота: | плавления льда – 330 кДж/кг испарения при - 2250 кДж/кг |
| Удельная теплоемкость: | льда - 2,035 Дж/(гК) воды при - 4,178 Дж/(гК) |
| Теплопроводность при | 4,18 Вт/(мК) |
| Вязкость при: | 0 – 0,001793 Пас 25 – 0,000895 Пас |
| Удельная электростатическая проводимость при | 4,2 10-6 см/м |
| Относительная диэлектрическая постоянная при | 81 |
| Поверхностное натяжение при | 7310-3 Н/м |
| Критические константы: | температура – 374,2 С давление – 22,12 МПа плотность – 0,324 кг/л |
По сравнению с другими химическими соединениями вода обнаруживает необычные отклонения по ряду физических свойств – плотности, удельной теплоемкости, вязкости и др.
При нагревании воды происходит разрыв водородных связей и уменьшается степень ассоциации молекул воды. В интервале температур от 0 до 4увеличение плотности, вследствие повышения плотности упаковки молекул, преобладает над тепловым расширением и при температуре 3,98вода имеет максимальную плотность. При дальнейшем нагревании от 4 до 100наблюдается нормальное снижение плотности воды. Эта аномалия обуславливает возможность жизни в водоемах, замерзающих в зимнее время. Поскольку лед легче воды (его плотность меньше), то он располагается на поверхности и защищает лежащие ниже слои воды от промерзания. При дальнейшем понижении температуры увеличивается толщина слоя льда, но температура воды подо льдом остается на уровне 4, что позволяет водным организмам, включая ихтиофауну, сохранить жизнь.
Большое значение в жизни природы имеет также и тот факт, что вода обладает аномально высокой теплоемкостью – 4,18 Дж/(гК). Высокая теплоемкость воды есть следствие расхода части теплоты на разрыв водородных связей. В природных условиях вода медленно остывает и медленно нагревается, являясь регулятором температуры на земле.
Еще одна аномалия заключается в том, что при увеличении давления температура плавления льда не повышается, а понижается. Если же после замерзания давление превышает определенную величину, то образуются другие модификации льда, плотнее обычного и даже обычно плотнее жидкой воды. Поэтому плотно закрытый сосуд с замерзшей в нем водой не разорвется, если перед замерзанием вода уже находилась под высоким давлением [4].
Давление паров воды в зависимости от температуры имеет следующие значения:
Таблица 2 – Зависимость давления паров воды от температуры
| t, | 0 | 20 | 40 | 60 | 80 | 100 |
| , кПа | 0,61 | 2,33 | 7,39 | 19,9 | 47,3 | 101,3 |
Температура кипения воды находится в прямой зависимости от давления – чем она выше, тем выше температура кипения.
Таблица 3 – Зависимость температуры кипения воды от давления [4]
| ,кПа | 6 | 7 | 7,5 | 7,6 | 7,7 | 7,8 | 7,9 | 8 |
| t, | 93,48 | 97,71 | 99,63 | 100 | 100,39 | 100,73 | 101,09 | 101,45 |
Вязкость (способность жидкости оказывать сопротивление различным формам движения) воды закономерно изменяется в зависимости от температуры: уменьшается с ее возрастанием. С повышением концентрации растворенных в воде солей вязкость увеличивается. В то же время действие давления на вязкость воды довольно специфично: с понижением температуры при умеренном давлении вязкость воды снижается, хотя логично было бы ожидать ее повышения, а если давление увеличить значительно, то поведение воды подчиняется общему правилу.
Поверхностное натяжение воды с увеличением температуры уменьшается: при оно составляет 7310-3 Н/м, а при - 52,510-3 Н/м. При добавлении солей поверхностное натяжение воды возрастает, но незначительно. Поверхностно-активные вещества (ПАВ) обладают способностью сильно снижать поверхностное натяжение.
Вследствие асимметричного строения молекула воды обладает резко выраженным дипольным характером, т.е. в молекуле не совпадают центры тяжести положительных и отрицательных зарядов. Дипольный характер молекул воды способствует образованию так называемых продуктов присоединения: к молекулам воды присоединяются молекулы веществ ионного строения или же не иного, но с выраженным дипольным характером [4].
Относительная диэлектрическая постоянная воды равна 80 – это очень высокая величина, чем и объясняется такая большая ионизирующая сила воды.
Оптические свойства воды оцениваются по ее прозрачности, которая, в свою очередь, зависит от длины волны луча, проходящего через воду. Ультрафиолетовые лучи легко проходят через воду, а инфракрасные проникают только в поверхностный слой и в незначительной степени. Вследствие поглощения оранжевых и красных компонентов видимого света вода приобретает голубоватую окраску.
Тяжелая вода D2O по своим физическим свойствам отличается от обычной: некоторые константы обычной и тяжелой воды приведены в таблице 4.
Таблица 4 – Константы обычной и тяжелой воды [4]
| Константа | Н2О | D2O |
| Молекулярная масса | 18,016 | 20 |
| Температура: замерзания, кипения, | 0 100 | 3,8 101,4 |
| Плотность при 20 , г/см3 | 0,9982 | 1,105 |
| Температура при максимальной плотности, | 3,98 | 11,6 |
studfiles.net
Вода, её состав, строение молекулы, физические и химические свойства... на Сёзнайке.ру
Вода, её состав, строение молекулы, физические и химические свойства (разложение, отношение к натрию, оксидам кальция, серы(IV)). Основные загрязнители природной воды, очистка природных и сточных вод.
В состав молекулы воды входят два атома водорода и один атом кислорода, атомы связаны ковалентной полярной связью, валентный угол составляет 104,5о. Говорят, молекула воды является диполем. Н · + · О · + · Н ® Н ·· О ·· Н.
Вода – бесцветная летучая жидкость, в толстом слое – голубая, без запаха, плотность – 1г/см3(при 40С), tпл. = 00С, tкип. = 1000С. вода является хорошим растворителем.
Химические свойства:
При пропускании через подкисленный раствор электрического тока вода разлагается на простые вещества: кислород и водород: 2Н2О ? 2Н2 + О2.
Вода вступает во взаимодействие со щелочными и щелочноземельными металлами при обычных условиях, при этом в молекуле воды один атом водорода замещается на атом металла и образуются щёлочь и водород. Реакция протекает с выделением большого количества теплоты. 2Na + 2h3O = 2NaOH + h3
При взаимодействии основных оксидов с водой образуется щёлочь. Например, при взаимодействии оксида кальция (негашёной извести) с водой образуется гидроксид кальция (гашёная известь): CaO + h3O = Ca(OH)2.
Кислотные оксиды растворяются в воде с образованием кислот, например, оксид серы(IV) при растворении в воде образует сернистую кислоту: SO2 + h3O = h3SO3.
Загрязнителями природных вод являются ядовитые отходы, которые в течение многих лет захоранивались в шахтах и скважинах и продолжают захораниваться сейчас, подземные хранилища нефти и продуктов её переработки, пестициды, применяемые в сельском хозяйстве. Главным и постоянным загрязнителем природных вод являются сточные воды, которые текут из городов, с заводов, шахт, сельских ферм. Они образуются разными путями, но в общем-то у все у них один и тот же путь – в ближайшую реку или озеро или море.
Органические загрязнители из сточных вод способны вызвать цепную реакцию, которая лишает воду нормального содержания кислорода, быть ядовитыми для организмов, живущих в воде и способствовать развитию менее желательных видов и захвату ими господствующего положения. Азот и фосфор, содержащиеся в сточных водах вызывают бурный рост микроскопических водных растений, что приводит к явлению «цветения» воды и постепенному заболачиванию водоёма. Борьба с загрязнением воды – это комплекс методов очистки сточных вод до такой степени, чтобы их сбрасывание в природные воды не вызывало проблем. Сточные воды подлежат очистке перед сбросом их в природные водные источники. Сначала они проходят через систему решёток и сеток, затем попадают в песколовку, затем в отстойник – первичная очистка – очистка от различных размеров нерастворимых примесей. Вторичная очистка – удаление растворённых примесей – это биохимическая очистка, при этом используются микроорганизмы и бактерии, разрушающие органические вещества. Третичная очистка сточных вод проводится для удаления из неё соединений азота и фосфора. Соединения фосфора удаляют путём осаждения их солями железа, алюминия и известью. Соединения азота удаляют с помощью специальных штаммов микроорганизмов. Последним этапом в очистке сточных вод является её хлорирование.
Очистка природных вод (для бытовых нужд).
В 1872 году было обнаружено, что фильтрование воды через слой песка является хорошим способом её очистки и делает её относительно безопасной для питья. Песчаные фильтры также эффективны для удаления из воды болезнетворных микроорганизмов (холеры, брюшного тифа, дизентерии). Уже в начале 20-го века в практику было введено химическое «обеззараживание» воды посредством хлора или его соединений. При очистке природных вод используют аэрацию (для удаления запаха), активированный уголь(для обесцвечивания воды и улучшения её вкуса), алюминиевые и железные квасцы (для удаления взвешенных в воде частиц), фильтрование через песчаный фильтр (для удаления из воды бактерий, вирусов и других микроорганизмов), хлорирование (для полного обеззараживания воды). альтернативой хлорированию является озонирование воды, но при озонировании не остаётся следов свободного озона и потребитель не может быть уверен в полном уничтожении бактерий и вирусов в воде.
www.seznaika.ru
Строение молекулы и свойства воды
Аномальные свойства воды предполагают существование прочных сил между молекулами воды. Это можно объяснить уже при рассмотрении природы единичной молекулы воды, а затем и группы молекул. Шесть валентных электронов кислорода в молекуле воды гибридизированы в четырех Sp3-орбиталях, которые вытянуты к углам, образуя тетраэдр.
Две гибридные орбитали образуют О—Н ковалентные связи с углом 105°, тогда как другие две орбитали имеют неподеленные электронные пары. Ковалентные О—Н связи, благодаря высокой электроотрицательности кислорода, частично (на 40%) имеют ионный характер.
Таким образом, молекула воды имеет два отрицательных и два положительных заряда по углам тетраэдра. Вследствие этого, каждая
молекула воды тетраэдричес-ки координирована с четырьмя другими молекулами воды благодаря водородным связям (см. рис. 10.2). Энергия диссоциации водородной связи ~25 кДж/моль.
Рис. 10.2.Тетраэдрическая координация молекул воды
Одновременное присутствие в молекуле воды двух доноров и двух акцепторов делает возможной ассоциацию в трехмерную сеть, стабилизированную водородными связями, что обеспечивает большую силу взаимодействия между молекулами. Эта структура объясняет особые физические свойства воды, необычные для малых молекул. Так, например, спирт и соединения с изоэлектрическими диполями, такие как HF или Nh4, образуют, в отличие от воды, только линейную или двухмерную ассоциацию.
Частичная поляризация Н—О связи в дальнейшем усиливается за счет образования водородных связей. Поэтому дипольный момент комплекса, состоящего из увеличенного числа водных молекул (мультимолекулярный диполь), тем больше, чем больше молекул ассоциировано и, естественно, больше дипольного момента единичной молекулы. Как следствие, диэлектрическая постоянная воды оказывается большой и превышает величину, которая может быть вычислена на основе дипольного момента единичной молекулы.
Транспорт (перенос) протона осуществляется вдоль водородной связи. Это поистине прыжок протона от одной молекулы воды к соседней молекуле воды. Независимо от того, получен ли протон путем диссоциации воды или будет получен от кислоты, он будет погружаться в орбита-ли неподеленных электронов молекулы, образуя гидратированный ион водорода Н3О+(ион гидроксония) с исключительно сильной водородной связью (энергия диссоциации — 100 кДж/моль):
Подобный механизм действует и в транспорте ионов ОН-, который осуществляется вдоль водородных связей:
Переход протона от одного атома кислорода к другому осуществляется чрезвычайно быстро (V>1012c-1), поэтому подвижность протона весьма велика. Она превышает подвижность других ионов в 4—5 раз и соизмерима только с подвижностью ионов ОН-, которая, однако, примерно на 40% меньше. При этом скорость протонов во льду примерно в 100 раз больше, чем в воде.
Способность воды образовывать трехмерные водородные связи, для разрушения которых необходима дополнительная энергия, объясняет рассмотренные выше необычные свойства воды, например высокие значения теплоемкости, точек плавления и кипения, поверхностного натяжения и теплот фазовых переходов.
Вода может влиять на конформацию макромолекул, если там имеют место какие-либо нековалентные связи, которые стабилизируют конформацию большой молекулы. Эти нековалентные связи могут быть трех видов: водородные, ионные и неполярные связи. В белках существует конкуренция между CO...HN водородными связями и вода-амид водородными связями. Чем больше способность растворителя к образованию водородных связей, тем слабее CO...HN связь. В водной среде теплота образования или разрыва этой связи равна 0. Это означает, что CO...HN водородная связь не может обеспечить стабилизацию в водном растворе. Конкурирующая водородная связь от Н2О ослабляет термодинамическую тенденцию к образованию CO...HN водородных связей. Водные молекулы вокруг неполярных групп (молекул) становятся более упорядоченными, приводя к потере энтропии, и в результате возникает тенденция к ассоциации отдельных неполярных групп в водной среде с другими, большими чем водные, молекулами (гидрофобное взаимодействие). Концепция гидрофобной связи схематично показана на рис. 10.3.
Рис. 10.3.Образование гидрофобной связи
С химической точки зрения вода является весьма реакционноспособным веществом. Она соединяется со многими оксидами металлов и неметаллов,
взаимодействует с активными металлами и вступает в различные другие реакции самого разнообразного характера.
Превращения белков, Липидов, углеводов с участием воды имеют важное значение в пищевых технологиях.
Помимо химических реакций, в которые вступает вода, при растворении веществ в воде имеют место взаимодействия физико-химического характера. Ниже мы кратко рассмотрим взаимодействие воды с ионами и ионными группами, группами, обладающими способностью к образованию водородных связей, и с неполярными веществами (группами). Эти взаимодействия необходимо принимать во внимание при рассмотрении классификации видов влаги в пищевых продуктах и ее причастности к химическим, биохимическим и микробиологическим изменениям в продукте при хранении (см. раздел 10.3).
Похожие статьи:
poznayka.org
1 Молекула воды
Лекция 1. ВОДА И ЕЕ СВОЙСТВА
1 Молекула воды
2 Свойства воды
3 Вода как растворитель
4 Диаграмма состояния воды и правило фаз
Вода – одно из самых распространенных веществ на нашей планете. Она имеет огромное значение в эволюции как живой, так и неживой природы. На земле происходит непрерывный круговорот воды. В результате испарения воды в поверхности океанов и суши и выделения влаги растениями и живыми существами атмосфера насыщается парами воды. Неравномерное нагревание атмосферы вызывает в ней крупномасштабные перемещения воздушных масс над поверхностью земного шара, а вследствие конденсации вода снова возвращается на землю в виде росы, дождя, града и снега.
Часть воды испаряется непосредственно с почвы и покрывающей ее растительности сразу же после выпадения на землю. Другая часть просачивается в почву, где она либо задерживается и используется растениями, либо проникает в подпочвенные горизонты, где соединяется с грунтовыми, а затем через них и с поверхностными водами. Наконец, некоторое количество воды остается на поверхности почвы, постепенно стекая в поверхностные водотоки.
Вследствие постоянного контакта с окружающей средой и включения в эту среду вода всегда содержит какие-либо вещества и практически никогда не бывает химически чистой. В то же время характер процессов, протекающих с участием воды, во многом определяется ее свойствами как индивидуального вещества.
Вода, или оксид водорода Н2О, имеет молекулярную массу 18,016. На водород приходится 11,19 % массы, на кислород – 88,81 %.
В природе встречаются три изотопа водорода: 1Н – протий, 2Н – дейтерий и 3Н – тритий и три изотопа кислорода 16О, 17О и 18О, образующих 9 устойчивых изотопных модификаций молекул воды. В природной воде на долю 1Н216О по массе приходится 99,73%. на долю 1Н218О – 0,2%, на 1Н217О – 0,04% и на 1Н2Н16О – около 0,03 %. Остальные пять разновидностей содержатся в ничтожных количествах. Помня о многообразии состава воды, мы, тем не менее, пользуемся привычной формулой Н2О, так как она является символом основного компонента.
В молекуле воды ядра водорода и кислорода образуют равнобедренный треугольник, в основании которого находятся два мелких ядра водорода, в вершине – более крупное ядро кислорода. Валентный угол у центрального атома кислорода, образованный связями Н–О–Н, составляет 104o27' (рис. 1, а). Структура электронного облака молекулы схематично показана на рис. 1, б. Две внешние пары электронов, образующих связи О–Н, смещены к атому кислорода, поэтому вблизи ядер атомов водорода создается избыток положительного заряда. Две неподеленные пары электронов также смещены относительно ядра атома кислорода, и их отрицательные заряды остаются частично нескомпенсированными. Условно можно представить, что лепестки электронного облака направлены к вершинам частично искаженного тетраэдра, что иллюстрируется рис. 1, в. Ассиметричность распределения электрических зарядов обусловливает ярко выраженные полярные свойства молекулы воды, которая представляет собой диполь с очень высоким электрическим моментом.
а – угол между валентными связями О–Н; б – структура электронного облака;
в – расположение зарядов
Рисунок 1 – Строение молекулы воды
Измерения молекулярной массы жидкой воды показали, что она выше молекулярной массы воды в парообразном состоянии; это свидетельствует об ассоциации молекул – объединении их в сложные агрегаты. Вследствие тетраэдрической направленности электронного облака каждая молекула воды может образовать четыре водородные связи, которые обусловливают ассоциацию молекул воды и способствуют возникновению ее упорядоченной внутренней структуры.
Водородные связи непрочны, легко разрушаются и образуются даже при обычных тепловых движениях молекул.
Полностью все четыре водородные связи реализуются при замерзании воды. В твердом состоянии каждая молекула тетраэдрически окружена четырьмя другими – тремя из того же слоя и одной их соседнего слоя молекул. Схема взаимодействия молекул воды в структуре льда показана на рисунке 2. Структура льда является наиболее упорядоченной и наименее плотной. Ее особенность заключается в наличии пустот, размеры которых превышают размеры молекул.
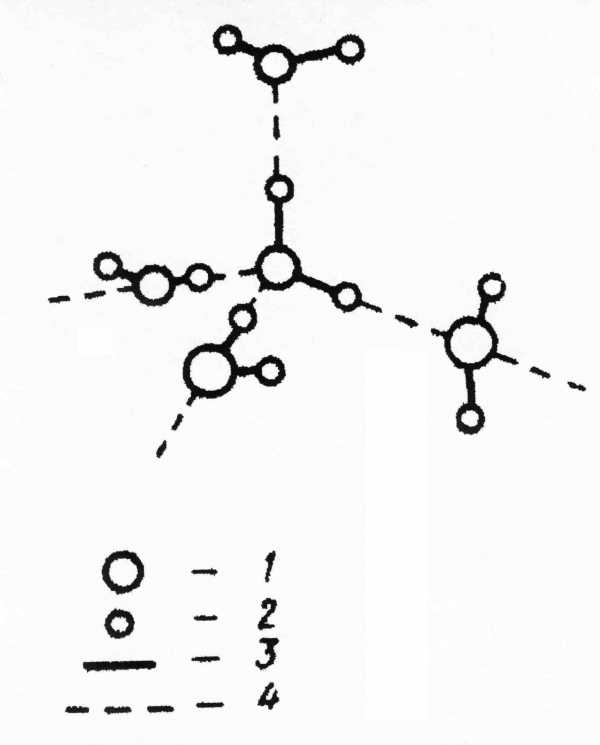
1 – кислород; 2 – водород; 3 – химические связи; 4 – водородные связи
Рисунок 2 – Схема взаимодействия молекул воды в структуре льда
2 Свойства воды
Чистая вода – жидкость без запаха, вкуса и цвета (лишь в слое толщиной более 2 м голубоватая). Основные физические характеристики воды (при давлении 0,1 МПа) представлены в таблице 1.
Таблица 1 – Основные физические характеристики воды
| Показатель | Значение |
| Температура: | |
| замерзания, плавления | 0 °С |
| кипения | 100 °С |
| Плотность при температуре, °С: | |
| 0 | 0,99984 г/см3 |
| 3,98 | 0,99997 г/см3 |
| 20 | 0,9982 г/см3 |
| Удельная теплоемкость воды при t = 20°C | 4,178 Дж/(г.К) |
| Вязкость при температуре, °С: | |
| 0 | 0,001793 Па·с |
| 25 | 0,000895 Па·с |
| Удельная электрическая проводимость при t = 20°С | 4,2·10-6 см/м |
| Относительная диэлектрическая постоянная воды при t = 20°С | 81 |
| Поверхностное натяжение при t = 18 °С | 73·10-3 Н/м |
По сравнению с другими химическими соединениями вода обнаруживает необычные отклонения по ряду физических свойств — плотности, удельной теплоемкости и др. Эти аномалии воды в значительной степени связаны с ассоциацией ее молекул.
Уникальным свойством воды является ее способность при обычных температурах и давлении находиться в трех агрегатных состояниях: твердом (лед), жидком и газообразном (пар).
Повышение температуры воды действует двояко: вызывает нарушение регулярной структуры и приводит к тепловому расширению. В интервале температур от 0 до 4 °С (плавление льда) происходит разрушение части водородных связей, т.е. нарушается структура льда, достигается более плотная упаковка молекул в результате размещения отдельных молекул воды в пустотах оставшихся агрегатов. В этом интервале температур фактор нарушения структуры преобладает над тепловым расширением, и плотность воды повышается, достигая максимального значения при 3,98 °С. При 3,98 °С оба фактора взаимно уравновешиваются. Дальнейшее нагревание воды до 100 °С сопровождается нормальным снижением плотности, так как преобладает действие теплового расширения. Эта аномалия обусловливает возможность жизни в водоемах, замерзающих в зимнее время. Поскольку лед легче воды (его плотность меньше), то он располагается на поверхности и защищает лежащие ниже слои воды от промерзания. При дальнейшем понижении температуры увеличивается толщина слоя льда, но температура воды подо льдом остается на уровне 4 °С, что позволяет водным организмам сохранять жизнь.
Большое значение в жизни природы имеет также и тот факт, что вода обладает аномально высокой теплоемкостью – 4,18 Дж/(г·К). Высокая теплоемкость воды есть следствие расхода части теплоты на разрыв водородных связей. В природных условиях вода медленно остывает и медленно нагревается, являясь регулятором температуры на Земле.
Вязкость – способность жидкости оказывать сопротивление различным формам движения. Вязкость воды закономерно изменяется в зависимости от температуры: уменьшается с ее возрастанием. С повышением концентрации растворенных в воде солей вязкость увеличивается. В то же время действие давления на вязкость воды довольно специфично: с понижением температуры при умеренном давлении вязкость воды снижается, хотя логично было бы ожидать ее повышения, а если давление увеличить значительно, то поведение воды подчиняется общему правилу.
Относительная диэлектрическая постоянная воды равна 81 – это очень высокая величина, чем и объясняется такая большая ионизирующая сила воды.
Вода имеет максимальное для жидкостей (кроме ртути) поверхностное натяжение, благодаря чему обеспечивается возможность движения соков в растениях, крови в сосудах животных и человека. С повышением температуры поверхностное натяжение воды уменьшается.
Оптические свойства воды оцениваются по ее прозрачности, которая в свою очередь зависит от длины волны луча, проходящего через воду. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоемов, инфракрасные лучи проникают только в поверхностный слой и в незначительной степени. Вследствие поглощения оранжевых и красных компонентов видимого света вода приобретает голубоватую окраску.
Химически чистая вода очень плохо проводит электрический ток, но, все же, обладает некоторой электропроводимостью, так как она способна в очень незначительной степени диссоциировать на ионы водорода и гидроксид-ионы
Н2О ↔ Н+ + ОН-
Вода – весьма реакционно-способное соединение. Она реагирует с оксидами многих металлов (Na20, CaO и др.) и неметаллов ClO2, CO2 и др.), образует кристаллогидраты с некоторыми солями [Al2(S04)3·18h30], вступает во взаимодействие с активными металлами (Na, К и др.).
Вода – катализатор многих химических реакций, и иногда для прохождения реакции необходимы хотя бы ее следы. Взаимодействуя с некоторыми солями, вода вызывает процесс обменного разложения их – гидролиз. Вода – участник и среда для протекания множества биохимических реакций в живых организмах. Жизнь человека, растений, животных и микроорганизмов связана с водными растворами. В частности, процессы питания включают перевод вещества в раствор.
studfiles.net
Строение молекулы воды
Вода - драгоценный дар природы, котрую академик Карпинский назвал живой кровью, которая создает жизнь там, где ее не было.
«Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло сравниться с ней по влиянию на ход основных, самых грандиозных геологических процессов» (В.И.Вернадский).
Формула воды - Н2О (предложена в 1805 г Гумбольдтом и Гей-Люсаком), т.е. состоит из 1 атома кислорода и 2-х атомов водорода.
1). Молекула воды асимметрична, образует равнобедренный треугольник.
2). Молекула воды обладает полярностью, поэтому является электрическим диполем.
3). Молекулярная структура воды: вода находится в трех состояниях и осуществляет фазовые переходы.
Гидроль (пар) - состоит из одиночных молекул Н2О, поэтому водородные связи не реализуются; (Н2О)
Дигидроль (жидкость) - строение как у льда, а пустоты заполнены одиночными молекулами; (2Н2О) Тригидроль (лёд) - упорядоченное строение, гексагональная система с прочными водородными связями, имеет наибольший объем. (3Н2О)
4) Водородные связи в 10 раз прочнее, чем связи межмолекулярного взаимодействия.
5) В 1932 г. Юри и Осборн открыли, что водород и кислород имеют природные изотопы, т.е. вода имеет переменный изотопный состав и
атомы вещества с разной молекулярной массой. -
Н=1 – Н20 - протий - «легкая, живая вода», талая вода;
Н=2 - D2O - дейтерий - «тяжелая, мертвая вода», содержащая соли тяжелых металлов;
Н=3 - Т2О - тритий - «сверхтяжелая вода», образующаяся при термоядерных реакциях.
Химически чистая вода состоит по весу из 11,19% водорода и 88,81 % кислорода.
Физические свойства воды
1). Молекулы воды осуществляют переходы из одного состояния в другое (фазовые переходы). Переходы сопровождаются выделением или поглощением энергии (скрытая теплота парообразования).
Испарение - из жидкости в пар - поглощение тепла.
Конденсация - из пара в жидкость - выделение тепла.
Замерзание - из жидкости в лед - выделение тепла.
Таяние - из льда в жидкость - поглощение тепла.
Возгонка - из льда в пар (испарение с поверхности льда)- поглощение тепла.
Сублимация - из пара в лед (конденсация в твердую фазу), например, иней - выделение тепла. При увеличении температуры воды скрытая теплота парообразования уменьшается.
2). При нормальном давлении температура плавления льда и замерзания воды равна 0°С. При повышении давления лед плавится при отрицательных температурах.
3). С увеличением солености понижается температура замерзания воды. Следует помнить, что при увеличении солености на 10%о температура замерзания воды понижается на 0,54°С.
4). Плотность воды в твердом состоянии меньше, чем в жидком. Следовательно, лед образуется на поверхности водоемов и не опускается на дно.
5). В диапазоне температуры воды от 0 до 4°С плотность воды не уменьшается, а увеличивается. Это аномальное свойство воды, вследствие которого образуется лед и водоемы не промерзают, потому что при температуре воды менее 4°С пресная вода становится менее плотной.
6). Аномальное изменение плотности приводит к аномальному изменению объёма воды. С увеличением температуры от 0 до 4°С объём химически чистой воды уменьшается; лишь при дальнейшем увеличении температуры объём увеличивается.
Объём льда всегда больше объема воды. Примеры в природе - морозное выветривание, образование наледей, бугров бучения и т.д.
7). Высокая удельная теплоемкость воды (ср). ср при 15°С = 4190 Дж/кгС0.
ср минимальна при температуре равной 33°, увеличивается при увеличении и уменьшении температуры. Высокая ср и очень высокая удельная температура плавления и испарения, что ведет к регулированию тепловых процессов на всей планете.
8). Очень малая теплопроводность. При понижении температуры и давления понижается и теплопроводность. С понижением температуры и понижением плотности уменьшается теплопроводность. Поэтому происходит медленный нагрев и охлаждение водной массы. Проявляется это свойство в том, что снег предохраняет почву от промерзания, а лед - водоемы от промерзания.
9). Вязкость воды невелика, поэтому вода подвижна. При увеличении температуры вязкость уменьшается, поэтому в холодное время года вязкость воды больше, чем в теплое.
10). Очень высокое поверхностное натяжение. Поэтому происходит:
• размыв фунтов водой;
• очень большая разрушительная деятельность дождевых капель;
• перемещение воды по порам и капиллярам в земной коре.
11). Свет частично поглощается и преломляется, поэтому проникает лишь на небольшую глубину. Именно здесь протекает фотосинтез.
12). Вода хорошо проводит звук (в 4-5 раз больше, чем в воздухе). Скорость звука увеличивается при повышении температуры воды, солености и давления.
13). Низкая электропроводность, которая увеличивается при повышении минерализации количества ионов хлора и калия.
Химические свойства воды
1). Вода - слабый электролит.
2). Вода - универсальный растворитель. В зависимости от размера частиц образуются чистые и коллоидные
растворы.
Природные воды содержат 45 главных химических элементов. Все вещества, входящие в состав воды делятся на 6 групп:
• Растворимые газы (О2, N2, СО2, ионы Н). Растворимость зависит от их природы, давления, температуры и минерализации.
• Главнейшие ионы. Их восемь: четыре положительных (катионы) и четыре отрицательных (анионы).
Катионы - Na, Ca, Mg, К;
Анионы - С1 (хлорит), SO4 (сульфат), СО3 (карбонат), НСО3 (гидрокарбонат).
• Биогенные вещества - N2, P, Si;
• Микроэлементы - Вr, Сu, В и т.д.; тяжелые металлы - Li, Ba, Fe, Ni, Zn, Co, Pb, Hg, Ra;
• Органические вещества - углеводороды, белки, липиды, гуминовые вещества идр.;
• Загрязнители - нефтепродукты, ядохимикаты, удобрения, ПАВ, Pb, Hg, Zn.
Совокупность проявления химических и некоторых физических свойств определяет качество воды.
biofile.ru