БУФЕРНЫЕ СВОЙСТВА (буферное действие и растворы). Буферные свойства воды
БУФЕРНЫЕ СВОЙСТВА (буферное действие и растворы)
БУФЕРНЫЕ СВОЙСТВА, способность многих веществ ослаблять изменение активной реакции раствора, которое без них произошло бы при прибавлении к раствору кислот или щелочей. Это стабилизирующее влияние на реакцию раствора называется буферным действием.
Буферное действие
Если к десяти кубических см децинормального раствора уксусной кислоты постепенно добавлять раствор едкого натра такой же концентрации, то кислотность раствора, определяемая концентрацией содержащихся в нем свободных водородных ионов, будет уменьшаться. При прибавлении 10 кубических см NaOH процесс связывания кислоты щелочью, процесс нейтрализации, окажется законченным, вся уксусная кислота превратится в соответствующую соль – уксуснокислый натрий, а соединившиеся Н и ОН-ионы дадут молекулы воды. Дальнейшее добавление NaOH даст преобладание свободным гидроксильным ионам – щелочную реакцию. Помещаемая здесь кривая (смотрите рисунок 1, сплошная линия) передает изменения реакции, выраженной через рН (водородный показатель, – смотрите Водородные ионы), наблюдаемые при нейтрализации уксусной кислоты.
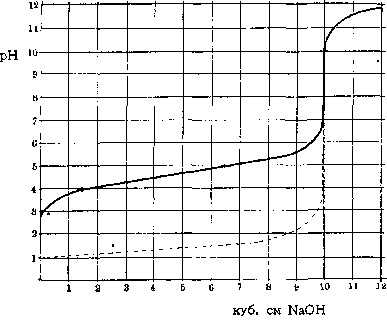
Рисунок 1. Изменение реакции (буферные свойства в действии)
Прерывистая линия на том же рисунке изображает соответствующее изменение реакции (рН) при прибавлении NaOH к децинормальной соляной кислоте. Если сравнить обе кривые и посмотреть, сколько потребовалось щелочи для одинакового изменения реакции, напр., для изменения рН от 4 до 5, то результаты окажутся весьма различными: в первом случае – около 5 кубических см NaOH, во втором – едва уловимые следы последнего. Количество щелочи (или соответственно кислоты), которое требуется для определенного изменения реакции, и является мерилом устойчивости реакции раствора, величины его буферного действия. В первом случае оно весьма значительно, во втором – совершенно ничтожно. Если количество грамм-эквивалентов щелочи (или, соответственно, кислоты), прибавленной к литру испытуемого раствора, обозначить знаком ДВ, а вызванное этим изменение реакции через ДрН, то, по Ван-Слайку (Van-Slyke), буферное действие будет равно отношению этих величин: Буферное действие = отношение ДВ к ДрН. Различие в хорде кривых для обоих рассмотренных выше растворов обусловлено свойствами обеих кислот. Соляная кислота принадлежит к сильным кислотам, полностью диссоциированным на свои ионы. Напротив, уксусная кислота сравнительно слабо диссоциирована: только небольшая часть ее молекул (в децинормальном растворе около 1,3%) распадается и дает водородные ионы, определяющие кислую реакцию раствора. Поэтому, уксусная кислота имеет значительно менее кислую реакцию (больший рН), чем соляная в одинаковой молекулярной концентрации. При прибавлении NaOH гидроксильные ионы щелочи связывают водородные ионы. Но в силу общих условий химическом равновесия удаление продуктов диссоциации вызывает распад новых, прежде недиссоциированных молекул, освобождая все новые количества Н-ионов на место связываемых щелочью. Таким образом, уксусная кислота (в отличие от полностью диссоциированной соляной), кроме свободных, активных Н-ионов, обусловливающих активную реакцию раствора, обладает еще в своих недиссоциированных молекулах запасными, резервными водородными ионами, резервной кислотностью, способной быстро пополнять убыль свободных ионов. Эти кислотные резервы (или щелочные, если раствор может освобождать запасные ОН-ионы и связывать прибавляемые кислоты) и обусловливают его буферное действие; оно тем значительнее, чем больше резервных ионов мобилизуется при данном изменении реакции. Самое название (буферное действие) было дано по аналогии с железнодорожными буферами, смягчающими резкость механических толчков. Более правильным было бы сравнение с сосудами различной емкости, в которых прибавление одинакового количества жидкости вызывает различное изменение уровня. Чем значительнее емкость сосуда, тем больше требуется жидкости для определенного повышения уровня; подобным же образом от количества резервных Н – или О Н-ионов («буферной емкости») зависит количество щелочи (или кислоты), необходимое для данного изменения «уровня» реакции.
Буферные растворы
Электролитическая диссоциация слабых кислот и щелочей резко понижается в присутствии солей, имеющих общий с ними ион. Напр., уксусная кислота значительно слабее диссоциирована в присутствии своей натриевой соли (уксуснокислого натрия, дающего, подобно уксусной кислоте, ацетат-ион) и дает значительно меньше водородных ионов, чем в чистом растворе. Концентрация водородных ионов прямо пропорциональна концентрации молекул уксусной кислоты и обратно пропорциональна концентрации ацетат-ионов. Так как нейтральные соли принадлежат к сильным электролитам, почти полностью диссоциированным на свои ионы, можно с достаточным приближением, вместо концентрации ацетат-ионов, взять просто концентрацию соответствующей соли. Концентрация водородных ионов в таком растворе, содержащем слабую кислоту и ее соль, выразится тогда простой формулой (в которой прямоугольные скобки обозначают концентрацию стоящих в них веществ): [Н']=К [кислота] / [соль] (1).
Подобным же образом в смеси слабой щелочи и ее соли концентрация гидроксильных ионов (по которой точно так же легко вычислить тесно связанную с ней концентрацию Н-ионов и реакцию раствора) определяется аналогичным выражением: [Н']=К [щелочь] / [соль] (2).
Для более точного расчета необходимо было бы в обеих формулах несколько уменьшить знаменатель, умножив его на степень диссоциации соли (величину меньшую единицы). Такие смеси имеют особенно большие количества резервных, легко мобилизуемых Н- и ОН-ионов и соответственно особенно большое буферное действие. При этом они делают реакцию раствора устойчивой одновременно по отношению и к щелочам и к кислотам. Так, напрример, смесь уксусной кислоты с уксуснокислым натрием (получающаяся при частичной нейтрализации уксусной кислоты едким натром, смотрите рисунок), как мы видели, сравнительно мало изменяет свою реакцию при подщелачивании. Точно так же при прибавлении сильной кислоты, напр., соляной, действие ее ослабляется благодаря тому, что она соединяется с натрием, вытесняя эквивалентное количество слабой уксусной кислоты из ее соли. Растворы подобных смесей слабой кислоты или щелочи с соответствующей солью, так называемые буферные растворы, приобрели особенное значение благодаря той легкости, с которой по приведенным формулам (1) и (2) может быть вычислена их реакция. Постоянная К в этих формулах представляет характерную для каждой кислоты или щелочи константу – т. н. константу диссоциации. Если кислота и ее соль присутствуют в равной (эквивалентной) концентрации, то, очевидно, концентрация водородных ионов делается численно равной константе диссоциации ([Н']=К). Таким образом, константа диссоциации кислоты (или, соответственно, щелочи) непосредственно указывает среднюю реакцию, в районе которой проявляется буферное действие данной смеси. В этой точке буферное действие более чем особенно велико. В следующей таблице приведен водородный показатель нескольких буферных растворов: смеси уксусной кислоты и уксуснокислого натрия (ацетатная смесь), однометаллического (первичного) и двуметаллического (вторичного) фосфата натрия (Nah3PO4 и Na2HPO4) и аммиака с хлористым аммонием.
Таблица рН буферных смесей.Уксусная кислотаМолярное соотношениеУксусно- кисл. Na32:1 3,2 16:1 3,5 8:1 3,8 4:1 4,1 2:1 4,4 1:1 4,7 1:2 5,0 1:4 5,3 1:8 5,6 1:16 5,9 1:32 6,2 Первичный фосфатВторичный фосфатХлор. аммонийАммиан1 4 7 0 3 7 3,3 8,0 8,3 8,6 8,9 9,2 9,5 9,8 10,1 10,4 10,7 11,0
Из формул (1) и (2) можно непосредственно вывести одно очень важное свойство буферных растворов: реакция, даваемая буферной смесью, зависит (в первом приближении) исключительно от соотношения и её компонентов, а не от их абсолютной концентрации. Поэтому и в приведенной таблице можно было, не приводя концентрации кислоты (или щелочи) и соли, ограничиться указанием их соотношения. Разбавление буферного раствора не влияет на его реакцию. Конечно, того же нельзя сказать о буферном действии. При данной реакции оно тем значительнее, чем выше концентрация буферов. Рассмотренные свойства буферных растворов определяют их важнейшие практические применения:
- Очень многие биохимические и биологические процессы в высокой степени чувствительны даже к незначительным изменениям реакции (смотрите Активная реакция и Водородные ионы). В самом ходе этих процессов часто вырабатываются большие количества кислых или щелочных продуктов, которые могли бы изменить или даже совершенно остановить их дальнейшее течение. Для точного изучения подобных процессов необходимо их проводить в условиях, исключающих возможность сколько-нибудь значительных колебаний реакции. Для этого служат буферные растворы, применяемые здесь как регуляторы реакции. Этот метод был применен Серенсеном (Sorensen, 1909 г.) для изучения влияния активной реакции на деятельность ферментов. В зависимости от количества вырабатываемых кислых или щелочных продуктов, с одной стороны, от желательной степени постоянства реакции – с другой, приходится применять растворы с более или менее значительным буферным действием.
- В других случаях величина буферного действия не имеет особенно существенного значения, а применение буферных растворов основано на даваемой ими возможности готовить стойкие растворы любой желательной реакции (смотрите таблицу). При помощи индикаторов – веществ, меняющих свою окраску в зависимости от активной реакции раствора, можно сравнивать исследуемый раствор с серией буферных растворов известной реакции. Устанавливая, в каком из этих растворов данный индикатор принимает такую же окраску, как и в испытуемом, можно определить реакцию последнего. Таким образом, буферы применяются здесь как стандартные растворы, путем сравнения с которыми измеряется реакция. Применение таких стандартных буферных растворов лежит в основе индикаторного, или колориметрического метода измерения реакции. Другие буферные системы. Другие хим. системы также могут оказывать более или менее значительное буферное действие. Оно может зависеть, например, от выпадения в осадок прибавляемой щелочи или кислоты. Так, если к морской воде прибавлять едкий натр, раствор будет подщелачиваться до тех пор, пока его рН не сделается равным, приблизительно 8,6. При этой реакции начнет осаждаться Mg(OH)2, образующийся из магниевых солей и прибавляемого NaOH; дальнейшее увеличение щелочности приостановится, пока весь магний не выпадет из раствора. Далее, даже нерастворимые вещества (например, животный уголь) могут захватывать прибавляемые кислоты или щелочи путем адсорпции. Наконец, очень сильным буферное действием отличаются белки и другие амфотерные вещества (смотрите Амфолиты). Благодаря своей двойственной («амфотерной») природе, они могут связывать как кислоты, так и щелочи. Амфотерный характер клеточных коллоидов имеет большое значение для постоянства внутриклеточной реакции.
Буферы морской воды
Изменения реакции оказывают огромное влияние на жизненные явления; жизнь возможна лишь в определенном, для большинства организмов сравнительно узком, интервале концентраций Н- и ОН-ионов. Поэтому в природе буферы играют большую роль в поддержании необходимого для жизни постоянства реакции. Морская вода, представляющая естественную внешнюю среду большинства водных организмов, обладает весьма значительным буферное действием, которое зависит от содержащейся в ней бикарбонатной смеси – сочетания углекислоты и двууглекислого натрия (бикарбоната натрия). Благодаря наличию этого буфера, сохраняется обычная слабощелочная реакция морской воды и умеряются колебания реакции, которые производят водные организмы, поглощающие при фотосинтезе CO2 или выделяющие кислые продукты обмена веществ.
Буферные свойства крови
Особенный интерес представляют буферные свойства внутренней среды организма, в частности, крови. Кровь имеет слабощелочную реакцию, отличающуюся большим постоянством. Даже in vitro кровь стойко удерживает свою реакцию и обладает весьма большим буферным действием. К ней приходится прибавлять в несколько десятков раз больше едкого натра, чем к дистиллированной воде, чтобы вызвать одинаковое подщелачивание раствора, и в несколько сот раз больше НС1 для одинакового подкисления. Так же, как и в морской воде, главным буфером кровяной сыворотки является бикарбонатная смесь – сочетание CO2 и NaHCO3. Даваемая ею концентрация Н-ионов приближенно определяется так: [Н']=К [СO2] / [NaHCO3] (3), где К равняется, приблизительно, 3 * 10-7. В сыворотке содержатся также фосфаты, однако, по сравнению с бикарбонатами, их количество и их роль невелики. В отношении буферного действия бикарбонатный раствор вполне сходен с кровяной сывороткой.
Так, например, обе жидкости растворяют одинаковое количество CO2, пропорциональное ее парциальному давлению в окружающем воздухе. При изменении этого давления, как показывает формула (3), во столько же раз изменяется в них концентрация водородных ионов. Цельная кровь со своими форменными элементами обнаруживает при тех же условиях заметно большее постоянство реакции. Это добавочное, по сравнению с сывороткой, Буферное действие зависит от амфотерных белковых веществ крови, в частности – от находящегося в эритроцитах НЬ. Последний представляет очень слабую кислоту, настолько слабую, что его кислый характер не может проявиться при избытке CO2. Но, когда давление последней понижено, например, в артериальной крови, оксигемоглобин, как кислота, разлагает некоторое количество бикарбоната, вытесняя из него CO2. В результате уменьшается знаменатель в формуле (3) и отчасти компенсируется влияние пониженного содержания CO2.
Таким образом, НЬ оказывает существенное влияние на кривую связывания углекислоты, а тем самым и на реакцию крови. В частности, он умеряет различия, связанные с различным давлением CO2 в артериальной и в венозной крови. Во всяком случае, в конечном итоге реакция крови вполне определяется соотношением углекислоты и бикарбоната, т. е. отношением свободной (растворенной) CO2 и CO2 химически связанной. Первая легко выделяется из крови, вторая может быть вытеснена путем разложения бикарбонатов кислотами. Обе эти величины – количество свободной и связанной CO2 – совместно характеризуют буферные свойства и реакцию крови. Их измерение получило в последнее время большое распространение и значение.
В отношении своей реакции кровь обладает теми же свойствами, что и другие буферные растворы. Мы видели, что реакция буферной смеси определяется соотношением кислоты и ее соли, а не их абсолютной концентрацией. Соответственно этому и реакция крови остается практически неизменной даже при многократном разбавлении ее изотоническим раствором NaCl (или любым другим безбуферным раствором). Этим свойством крови нередко пользуются при измерении ее реакции, применяя с этой целью небольшое количество крови, разбавленной раствором NaCl. Оно же делает безвредным внутривенное вливание различных так наз. «физиологических растворов», нередко имеющих ненормальную реакцию, которая оказалась бы гибельной для организма, если бы уже небольшая примесь крови не приближала ее к физиологической норме. При прибавлении к крови in vitro щелочи эта последняя нейтрализуется углекислотой; напротив, всякая кислота реагирует с бикарбонатом и, образуя нейтральную соль, заменяется эквивалентным количеством вытесненной ею из бикарбоната CO2. Этим объясняется замечательный факт, не раз уже обращавший на себя внимание исследователей: путем введения в кровь (in vivo) различных кислот – от наиболее слабых до самых сильных – оказывается совершенно невозможным добиться различного (соответственно силе применяемой кислоты) изменения реакции крови.
Пока в крови остается некоторое количество бикарбонатного буфера, изменения реакции оказываются во всех случаях одинаково ничтожными. Затем, одновременно с резким нарушением реакции, наступает смерть. Эти грубые экспериментальные воздействия дают наглядное представление о том, что происходит в организме в естественных условиях. Огромное большинство продуктов обмена веществ имеет кислый характер (фосфорная, угольная, молочная, масляная и другие кислоты). От этих непрерывно поступающих из тканей кислот и должны буферы крови предохранить ее нормальную реакцию. Последняя является слабощелочной, то есть характеризуется небольшим избытком активных гидроксил-ионов. Водородный показатель (рН) крови равняется, в среднем, 7,4, концентрация Н-ионов – 0,44 * 10-7, концентрация ОН-ионов – около 7 * 10-7 (при 37°). По сравнению с этой незначительной концентрацией свободных ОН-ионов количество резервных ионов, которое может быть освобождено для связывания прибавляемых кислот, весьма велико (около 2 * 10-2). Их количество, однако, далеко не отличается таким постоянством, как активная реакция крови, и может подвергаться сильным изменениям, особенно в патологических условиях.
Щелочные растворы представляют лишь первый барьер против вводимых извне или вырабатываемых в организме кислых продуктов. Производимое последними нарушение реакции во много раз ослабляется буферами крови, но не может быть ими совершенно устранено: связывание части молекул бикарбоната и освобождение CO2 смещает первоначальное соотношение этой основной буферные смеси. Более тонкая регуляция реакции совершается легкими. Всякое увеличение концентрации водородных ионов служит возбудителем дыхательного центра и немедленно усиливает вентиляцию легких (смотрите Дыхание). Благодаря высокой чувствительности дыхательного центра к Н-ионам, аппарат легочной регуляции работает необычайно точно: удаляя из крови, в зависимости от существующей в ней активной реакции, большие или меньшие количества CO2, он автоматически восстанавливает нормальное соотношение между нею и бикарбонатом.
Буферы крови защищают организм от резких колебаний реакции, которые были бы для него гибельны; дыхательный аппарат обеспечивает постоянное соотношение компонентов буферной смеси (даже при резких изменениях их абсолютной концентрации) и тем самым – точное постоянство активной реакции. Особенно значительное патологическое накопление нелетучих кислот и соответствующее уменьшение резервной щелочности наблюдаются при ацидозах. Однако, и оно обычно не ведет к изменению активной реакции крови: путем усиленной вентиляции легких достигается уменьшение содержания CO2, компенсирующее в большинстве случаев понижение концентрации бикарбоната («компенсированный ацидоз»). Противоположное явление представляет компенсированный алкалоз, при котором увеличение щелочных резервов компенсируется пропорциональным повышением давления CO2. Изменения содержания СО 2 в альвеолярном воздухе легких может служить в обоих случаях прямым показателем изменений концентрации бикарбонатов в крови. Общее количество буферов в крови в первом случае уменьшается, во втором увеличивается, но активная реакция остается практически постоянной.
Литература: Мiсhаеlis L., Die Wassers offionen-konzentration, Т. 1, Aufl. 2, B„ 1922; Кора-cuwsly W., Les ions d’hydrogene, P., 1926; Kolthoff J. M., Der Gebraueh von Farbenindi-katoren, 3 Aufl., В., 1926; Van Slyke D., The carbon dioxide carriers of the blood, Physical Review, v. I, p. 141, 1921. Д. Рубинштейн. В.
Изучайте:
- КОННРЕМЕНТЫКОННРЕМЕНТЫ (от лат. concrementum— сросток), камни, сростки—плотные, нередко каменистые образования, встречающиеся при ...
- PAVOR NOCTURNUSPAVOR NOCTURNUS, ночной испуг, нередко встречающееся у детей в возрасте 2—8 лет своеобразное расстройство сна. Ребенок,...
- ТАХОГРАФИЯТАХОГРАФИЯ (от греч. tachys—быстрый и gra-pho—пишу), графический метод регистрации скорости движения жидкостей, применя...
- ВУЛЬПИУСВУЛЬПИУС, Оскар (Oskar Vulpius, род. в 1867 г.), выдающийся германский ортопед. Мед. образование получил в Гейдельберге...
- ОВОЩИОВОЩИ, различные части специально культивируемых (огородных) травянистых растений, к-рые в сыром виде или после соответ...
medencped.ru
БУФЕРНЫЕ СИСТЕМЫ. ИЗУЧЕНИЕ СВОЙСТВ БУФЕРНЫХ И НЕБУФЕРНЫХ СИСТЕМ.ОПРЕДЕЛЕНИЕ БУФЕРНОЙ ЕМКОСТИ РАСТВОРА.ОПРЕДЕЛЕНИЕ рН ПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ В БИОЛОГИЧЕСКИХ ОБЪЕКТАХ.
Вода – основа жизни на Земле. Она играет исключительно важную роль в биохимических процессах, являясь основной составной частью (от 58 до 97 %) всех клеток и тканей человека, животных, растений и простейших организмов. Вода – это среда, в которой протекают самые разнообразные биохимические процессы.
Вода обладает хорошей растворяющей способностью и вызывает электролитическую диссоциацию многих растворенных в ней веществ.
Вода является слабым электролитом и диссоциирует на катионы водорода и анионы гидроксила по уравнению:
Н2О Û Н+ + ОН-
Согласно закону действующих масс константа диссоциации воды будет равна:
К =
Диссоциация воды очень мала (при 25°С она равна 1.8 10-9), поэтому знаменатель в приведенном уравнении можно считать практически постоянным, и соотношение можно записать следующем образом:
[Н+ ]× [ОН-] =К ×[Н2О] = Кw = 10 -14
где Кw – ионное произведение воды. Таким образом, произведение концентрации ионов водорода и ионов гидроксилав любом водном растворе есть величина постоянная, называемая ионным произведением воды
Так как компоненты рассматриваемой системы сопряжены, то увеличение концентрации одного иона неизбежно связано с уменьшением концентрации другого. При этом из водного раствора не могут совершенно исчезнуть ни водородные, ни гидроксильные ионы. И при любой их концентрации ионное произведение останется постоянным – 10-14.
Концентрация ионов водорода в растворах представляет важный физико-химический фактор, определение ее имеет большое значение при изучении самых разнообразных физических, химических и биологических процессов.
В природных растворах и биологических жидкостях, которые количественно характеризуются как разбавленные растворы (С £ 0,1 М), активность ионов водорода колеблется примерно в пределах 10-3 £ С £ 10-9М, т.е. она очень мала и для практической работы ее удобно выражать через отрицательный десятичный логарифм активности и обозначать рН:
рН = -lg аН+
Таким образом, водородным показателем – рН – называют величину, численно равную отрицательному десятичному логарифму активности (концентрации) ионов водорода. Логарифмируя ионное произведение воды, получаем:
рН + рОН = 14
В разбавленных водных растворах 0£ рН £14, 0£ рН £7 – в кислых растворах, рН = 7 – в нейтральных и 7 £ рН £14 – в щелочных растворах.
Уравнения для расчета рН в разбавленных растворах различных классов соединений приведены ниже:
Сильные кислоты: рН = - lg aH+.
Сильные основания: pH = 14 – pOH.
Слабые кислоты: pH = ½ (pKк – lgC).
Слабые основания: pH = 14 – 1/2pKо + ½ lgC.
Гидролитически кислые соли: pH = 7 –1/2pKосн – 1/2lgC.
Гидролитически щелочные соли: pH = 7 + 1/2pKкисл + 1/2lgC.
Буферные растворы: pH = pKa + lg[соль] – lg[кислота].
рH = pKa + lg[основание] - lg[соль].
Буферные системы
Одним из характерных свойств внутренней системы организмов является постоянство концентрации водородных ионов (изогидрия). Так, например, рН крови человека – 7,36. Сохранение этого показателя обеспечивается совместным действием ряда физико-химических и физиологических механизмов, из которых очень важная роль принадлежит буферным системам.
Буферными системами называются растворы, обладающие свойством достаточно стойко сохранять постоянство концентрации водородных ионов как при добавлении к ним небольшого количества сильных кислот или щелочей, так и при разведении.
Буферные системы (смеси или растворы) по составу бывают двух основных типов:
а) кислотные - слабая кислота и ее соль, образованная этой кислотой с сильным основанием;
б) основные - слабое основание и его соль, образованная этим основанием и сильной кислотой.
На практике часто применяются следующие буферные смеси:
СН3 СООН
СН3СООNa - ацетатный буфер;
Н2СО3
NaHCO3 - бикарбонатный буфер;
Nh5OH
Nh5Cl - аммиачный буфер
КН2PO4
Na2HPO4 - фосфатный буфер
Pt – COOH – белок-кислота
Pt – COONa – белок-соль - белковый буфер (Pt – протеин-белок).
Каждая из буферных смесей характеризуется определенной концентрацией водородных ионов, которую буферная система и стремится сохранить при добавлении кислот или щелочей. Рассмотрим, что определяет постоянство рН, например, ацетатной буферной смеси
СН3СООН Û Н+ +СН3СОО -
СН3СООNa ÞСН3СОО- + Na+
В ацетатном буферном растворе концентрация водородных ионов будет зависеть от степени диссоциации молекул кислоты. Согласно закону действия масс, константа диссоциации уксусной кислоты будет:
К = , откуда
[H+ ] = К×
При добавлении к слабодиссоциированной уксусной кислоте (К = 1,86× 10-5) ее сильнодиссоциированной соли происходит резкое увеличение концентрации общего аниона (СН3СОО -). В соответствие с законом действия масс это вызывает смещение равновесия влево, т.е. приводит к увеличению недиссоциированных молекул кислоты:
СН3СООН Ü СН3СОО - + Н+
Слабая диссоциация уксусной кислоты еще в большей степени будет подавлена и концентрация недиссоциированных молекул кислоты может быть принята равной общей концентрации кислоты. Так как соль полностью диссоциированна на ионы, то общая концентрация анионов может быть принята за общую концентрацию соли в буферном растворе. Исходя из этого, концентрацию ионов водорода в буферной смеси можно представить в следующем виде:
[H+ ] = Кк×
Для основного буфера, каким является, например аммиачный, соответственно будет
[OH -] = Ко×
Данные выражения являются основным уравнением буферных растворов. В логарифмической форме эти уравнения принимают вид:
pH = pKк + lg[соль] – lg[кислота].
рH = pKо + lg[основание] - lg[соль].
Таким образом, рН буферных смесей зависит от константы диссоциации кислоты или основания и от соотношения концентрации компонентов буферных смесей. Используя основное уравнение буферного раствора, можно вычислить рН любого буферного раствора, зная константу электролитической диссоциации кислоты или основания и концентрации кислоты и соли, а при одинаковых концентрациях их объемные отношения.
Предел, в котором проявляется буферное действие буферной системы характеризуется буферной емкостью. Численное значение буферной емкости (Б) определяется числом моль сильной кислоты или сильного основания, которое необходимо добавить к 1 л буферной смеси, чтобы изменить значение рН на 1:
,
где: DрН – изменение рН при титровании буфера кислотой или щелочью, наиболее близкое к 1 (DрН = рН1 – рН0).
Похожие статьи:
poznayka.org
БУФЕРНЫЕ СИСТЕМЫ (буферы) — Большая Медицинская Энциклопедия
БУФЕРНЫЕ СИСТЕМЫ (буферы) — совокупность нескольких веществ в растворе, сообщающих последнему буферные свойства, т. е. способность сопротивляться изменению активной реакции среды, или водородного показателя (pH), при разбавлении раствора или при добавлении к нему нек-рого количества кислоты или щелочи.
Б. с. широко распространены в природе: они находятся в водах мирового океана, почвенных растворах и особенно в организмах, где действуют как регуляторы, поддерживающие активную реакцию среды (см.) на определенных уровнях, необходимых для нормального протекания жизненных процессов (см. Кислотно-щелочное равновесие).
Б. с., как правило, представляют собой смесь слабой кислоты с ее солью, образованной сильным основанием (напр., уксусной к-ты Ch4COOH с ацетатом натрия Ch4COONa), или смесь слабого основания с его солью, образованной сильной кислотой (напр., гидроокиси аммония Nh5OH с хлористым аммонием Nh5Cl). Многие важные Б. с., содержащиеся в тканевых жидкостях и тканях организмов, относятся к системам первого типа.
Соотношение, с помощью к-рого можно рассчитать [H+] или pH в растворе, содержащем Б. с.. зная состав последней и концентрацию ее компонентов, называется уравнением Б. с. В водных растворах компоненты ацетатной Б. с. подвергаются электролитической диссоциации:
Ch4COOH ⇄ Ch4COO- + H+ , (1)
Ch4COONa ⇄ Ch4COO- + Na+ . (2)
По закону действующих масс (см. Действующих масс закон) константа диссоциации уксусной к-ты равна
K = [H+][Ch4COO-]/[Ch4COOH], (3)
где [H+], [Ch4COO-], [Ch4COOH] - равновесные концентрации водородных и ацетатных ионов и недиссоциированных молекул уксусной к-ты в Б. с. соответственно. Из уравнения (3) получаем
[H+] = K[Ch4COOH]/[Ch4COO-]. (4)
Поскольку степень диссоциации слабой уксусной к-ты значительно понижается в присутствии ее соли, а соль как сильный электролит диссоциирована нацело, то [Ch4COO-] и [Ch4COOH] можно заменить практически им равными, но более легко определяемыми величинами — аналитическими концентрациями ацетата натрия [соль] и уксусной к-ты [кислота] соответственно. Тогда из уравнения (4) следует:
[H+] = K [кислота]/[соль], (5)
или, переходя к pH.
pH = pK + lg([соль]/[кислота]), (6)
где pK = -lgK.
Уравнения (5) и (6) справедливы не только для ацетатного буфера, но и для любой Б. с., представляющей собой смесь слабой к-ты и ее соли, образованной сильным основанием. Они являются приближенными, но вполне достаточны для многих практических расчетов. Для более точных расчетов величину [соль] в уравнениях (5) и (6) следует умножить на кажущуюся степень диссоциации соли а, к-рую для данной концентрации каждой соли находят в соответствующих таблицах. Уравнения Б. с., состоящей из слабого основания и его соли, образованной сильной кислотой, имеют следующий вид:
где Kh3O — ионное произведение воды, Косн — константа электролитической диссоциации слабого основания, [соль] и [основание] — аналитические концентрации основания и соли,
Из уравнений (5), (1) и (2) непосредственно вытекают важнейшие свойства Б. с. Так, из уравнения (5) следует, что pH раствора, содержащего Б. с., зависит только от величины константы диссоциации К слабой кислоты и от величины отношения [кислота] : [соль]. Т. к. при разбавлении раствора К в соответствии с законом действующих масс не изменяется, а величина отношения меняется лишь в той мере, в какой изменяется кажущаяся степень диссоциации соли, то pH Б. с. при разбавлении ее практически остается постоянной. При добавлении к Б. с., напр, ацетатному буферу, нек-рого количества сильной кислоты водородные ионы, образуемые последней, соединяются с ацетатными ионами (1), находящимися в больших количествах в Б. с., вследствие практически полной диссоциации ацетата натрия. В результате образуется нек-рое количество уксусной к-ты, исчезает эквивалентное количество ацетата натрия и pH буфера изменяется незначительно — лишь в такой степени, в какой меняется при этом величина отношения [соль] : [кислота]. При добавлении к ацетатному буферу нек-рого количества сильной щелочи образуемые ею ионы OH- соединяются с H-ионами, находящимися в буфере, в молекулы крайне слабого электролита — воды. Однако убыль Н-ионов тотчас пополняется за счет дальнейшей диссоциации молекул уксусной к-ты (1), которые в буфере имеются в большом количестве. В конечном счете происходит лишь незначительное увеличение pH в сравнении с тем, какое имело бы место при добавлении того же самого количества щелочи к незабуференному раствору.
Среди Б. с., играющих большую роль в сохранении постоянства pH в тканевых жидкостях организмов, в первую очередь следует отметить белковые вещества, которые, будучи типичными амфолитами (см.), ведут себя как слабые кислоты или слабые основания и вместе со своими солями образуют Б. с., состав которых схематически можно представить следующим образом:
1) белок — слабая кислота:
НБ ⇄ Н+ + Б-МБ <-> М+ + Б-
2) белок — слабое основание:
БOH ⇄ Б+ + OH-БА ⇄ Б+ + А-
где Б — белок, М+ — катион щелочного металла (Na+ или K+), А- — анион сильной кислоты (напр., Cl-). В цельной крови млекопитающих ок. 80% ее буферной емкости обусловлено белками, гл. обр. гемоглобином.
Большое значение в жизненных процессах имеет бикарбонатная Б. с., состоящая из угольной к-ты — h3CO3 и бикарбоната щелочного металла — Na или K. Бикарбонатная Б. с. является одним из важнейших буферов плазмы крови. Уравнение бикарбонатной Б. с., называемое уравнением Гендерсона — Гассельбальха, имеет следующий вид:
где [CO2] — общая молярная концентрация свободной углекислоты в виде h3CO3 и CO2, а [бикарбонат] — общая молярная концентрация всех бикарбонатов, к-рая в плазме крови приблизительно в 18 раз больше, чем [CO2]. При t° 38° значение рК для плазмы крови человека равно 6,10.
Фосфатная Б. с., содержащаяся в плазме крови, а также в тканевых жидкостях, представляет собой смесь одноосновных и двухосновных фосфатов щелочных металлов:
где М — щелочной металл (К или Na). В этой Б. с. слабой кислотой является однозарядный фосфатный ион h3PO4-.
См. также Буферные растворы, Водородный показатель.
Библиография: Бейтс Р. Определение pH, теория и практика, пер. с англ., с. 94, Д., 1968, библиогр.; Бладергрён В. Физическая химия в медицине и биологии, пер. с нем., с. 190, М., 1951; Winters R. W., Engel K. a. Dell R. B. Acid base physiology in medicine, Cleveland — L., 1967.
В. П. Мишин.
xn--90aw5c.xn--c1avg
|
Как Вы наверное знаете рыбы не летают и не ходят - они плавают. И естественно живут в воде. Какая же это вода - в которой живут рыбы ? Какие у неё параметры и свойства ? Какая собственно говоря должна быть вода в аквариуме для Ваших рыбок ? Об этом и многом другом мы расскажем в этом разделе. Нам всем известно, что вода может быть разного качества и обладать разными свойствами. Ну конечно за исключением дистиллированной воды. В различных природных условиях свои параметры воды. Любой живой организм на протяжении всей своей жизни неразрывно связан с окружающей средой, что оказывает влияние не его внешний вид, строение тела, особенности поведения. Рыбы, являясь обитателями водной среды, испытывают на себе воздействие таких факторов, как температура, свет, концентрация кислорода и углекислого газа, осмотическое давление, кислотность, жёсткость и солевой состав воды. Ниже мы познакомимся со всеми вышеперечисленными параметрами подробнее. Сама вода является жизненным пространством аквариумных рыб и растений и в зависимости от своих свойств способствует развитию в них жизненных процессов или тормозит их. Она содержит различные вещества, придающие ей такие интересующие аквариумиста свойства, как цвет, прозрачность, запах, а также значения жёсткости DH и водородного показателя PH. Для аквариума пригодна чистая, прозрачная, содержащая все необходимые для жизни растений вещества водопроводная вода с DH=5-20 градусов, KH=2-15 градусов, PH=6,5-7,5 . Каждому аквариумисту в первую очередь должна быть известна, по крайней мере, жёсткость воды в его домашнем водопроводе. А как узнать иначе, подходящую ли воду он наливает в аквариум для своих питомцев? Вообще-то говоря, можно позвонить на водопроводную станцию и получить общие сведения по этому вопросу. Но в настоящее время во всех специализированных магазинах имеются в продаже тесты, с помощью которых Вы можете без труда произвести замеры Вашей воды. Итак, начнём разбираться подробнее, какие параметры есть у воды. КИСЛОТНОСТЬ ВОДЫ (ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ) PHЛюбые типы воды мы различаем по содержанию кислот и оснований. Показатель PH и есть мера содержания кислоты или основания. Кислотность воды оказывает большое влияние на биохимические и биологические процессы и имеет важное значение для рыб. Ионы в воде являются носителями кислотных или щелочных свойств. Если щелочные и кислотные ионы содержатся в ней в равных количествах, то вода реагирует "нейтрально", как и происходит (или по крайней мере должно происходить) с дистиллированной водой. В любой воде содержится определённое количество молекул h3O, разделённых на H+ - катионы (положительно заряженные ионы водорода) и OH - анионы (отрицательно заряженные ионы гидроокисла). Общее содержание H+ и OH- ионов в литре воды имеет постоянный показатель: 10-14 моль/литр (моль - молекулярный вес в граммах), измеренный при 25 градусах С. Когда концентрации обоих ионов равны, содержание каждого из них составляет 10 -7 моль/литр. Итак, нейтральная вода обладает концентрацией водородных ионов 10 -7 граммов на литр, то есть в ней содержатся 0,0000001 г. Н-ионов и ровно столько же ОН-ионов. Сложно и не наглядно, не правда ли. Это число называют показателем PH (Pondus Hydrogenii). Именно для наглядности пишут полностью не его, а только логарифм водородного показателя без отрицательного знака, то есть просто "7". И соответственно водородный показатель нейтральной среды сокращённо обозначается как "PH 7". В кислой воде этот показатель ниже, чем 7; в щелочной выше, чем 7. В зависимости от кислотности вода классифицируется следующим образом:
Для сведения кислотность водопроводной воды, а также воды в проточных водоёмах приближается к PH=7. Следует также учесть, что диссоциация молекул воды, а вместе с ней и PH зависят от температуры. Этот факт часто упускается из виду даже опытными аквариумистами. Между тем, если измеренный при 18 градусах С PH=7, то такую воду нельзя считать нейтральной, так как нейтральной реакции при этой температуре соответствует другое значение PH. Водородный показатель имеет важное общебиологическое значение, в связи с чем в процессе эволюции у большинства живых организмов выработался ряд механизмов, обеспечивающих относительное постоянство этого показателя в клетке. Роль этого фактора определяется в первую очередь его влиянием на активность ферментов и состояние других белковых молекул. Кроме того, поскольку большинство реакций в клетках протекает в водной среде, избыток или недостаток ионов может существенно влиять на протекание также различных неферментативных реакций. Сказанное является основной причиной того, что большинство клеток, принадлежащих самым разным организмам, способно жить в узком диапазоне PH - от 6,0 до 8,0. Однако даже начинающие аквариумисты обычно знают, что многие рыбы вполне безболезненно переносят гораздо более значительные отклонения от нейтральной реакции воды. Объясняется это тем, что организм имеет целых ряд буферных систем, сглаживающих резкие колебания PH среды.. Буферными свойствами обладают не только жидкости организма. Значительную роль в обеспечении относительно стабильной кислотность пресных вод играет их карбонатная система. Углекислый газ не только растворяется в воде, но, вступив в реакцию с ней, образует слабую кислоту HCO3 . Присутствие в воде солей усиливает её буферные свойства, в связи с чем одинаковое подкисление мягкой и жёсткой воды вызовет в первом случае значительно более заметный сдвиг PH. Ещё более сильными, чем у жёсткой воды, буферными свойствами, или, как говорят, ещё большей буферной ёмкостью, обладает морская вода. Активная реакция воды в значительной мере зависит от интенсивности фотосинтеза и заселённости водоёма растительными организмами. В процессах фотосинтеза, протекающих на свету, растения потребляют углекислый газ, что вызывает повышение PH. Ночью PH понижается, что связано не только с отсутствием фотосинтеза, но и с выделением CO3 при дыхании растений. Всё это приводит к весьма значительным колебаниям активной реакции среды в водоёме в течение суток. Особенно велики эти колебания в водоёме с большим содержанием растений. Чтобы снизить резкие колебания кислотности воды, рекомендуется постоянная аэрация воды воздухом. Практический совет: Чтобы понизить PH воды, т.е. сделать её более кислой, можно добавить в неё торф, взятый не возвышенностях. Можно также добавить отфильтрованный экстракт, полученный после кипячения торфа. Будьте внимательны, т.к. избыток торфа может оказаться вредным, поскольку в нём содержится много дубильных веществ. Щелочную воду можно тоже подкислить, добавив в неё бифосфат натрия. Практический совет: Чтобы повысить PH воды, т.е. сделать её более щелочной, можно добавить в неё обычной питьевой соды. Ну а чтобы подщелочить кислую воду, нужно добавить немного бикарбоната натрия или смешать кислую воду со щелочной водопроводной водой, т.е. разбавить. Последний способ наиболее приемлем и выгоден, потому что при добавлении свежей водопроводной воды в воду попадает множество природных гуминовых кислот и изменение PH происходит не так резко. Ещё стоит запомнить, что для содержания аквариумных рыб не годится сильнокислая, кислая, щелочная и сильнощелочная вода. Вода должна быть либо очень слабокислой, либо нейтральной, либо очень слабощелочной. Можно также воспользоваться фирменными препаратами для уменьшения PH - мы говорим именно об уменьшении т.к. этого добиться гораздо труднее, чем повысить PH. Так вот будьте внимательны при использовании PH down, т.к. последние часто изготавливаются на базе ортофосфорной кислоты. А как известно из практики эта кислота сохраняет PH на уровне около 6.5, естественно в зависимости от того, сколько Вы использовали кислоты. К огромному несчастью, да именно несчастью для всех аквариумистов, использование ортофосфорной кислоты имеет побочный эффект - подъем уровня фосфатов в аквариуме. А как мы знаем из практики фосфаты в воде стимулируют рост простейших водорослей. Ещё один способ уменьшения PH - это использование соляной кислоты. Точное количество кислоты, добавляемой в воду, будет всегда зависеть от буферной ёмкости воды. Попросту Вы добавляете кислоту до тех границ, когда будет исчерпан весь буфер воды. Как только Вы этого добьётесь то впоследствии уменьшать PH будет легко. Только помните, что вода с низкой PH имеет более меньшую буферную емкость, чем вода с повышенной PH. А о буфере воды Вы уже знаете, читали выше. Так что делайте выводы. Будьте внимательны с применением этого метода, тем более он связан с использованием кислоты - школьную химию наверное помните, с кислотами надо быть осторожными. Практический совет: Если Вы обнаружили, что PH воды в Вашем аквариуме резко изменился в одну или другую сторону, не в коем случае не добавляйте в воду сразу большое количество соды или торфа. Запомните: Резкое изменение кислотности воды может привести к гибели рыб. Всё необходимо делать постепенно. И ещё по этому же поводу. Чтобы избежать резкого изменения PH меняйте воду в аквариуме не большими порциями. Лучше понемногу и чаще, чем реже и сразу больше половины аквариума ! Теперь перейдём к не менее важному параметру воды - её жёсткости. ЖЁСТКОСТЬ ВОДЫ (DH)Жёсткость воды - является одним из важнейших параметров пресной воды, от которого зависит возможность содержания и разведения в ней рыб и культивирования растений в аквариуме. Следует отметить, что её значения для аквариумных рыб и растений могут значительно отличаться от значений в природных водоёмах, потому что рыбы и растения обладают громадной приспосабливаемостью к условиям окружающей среды, особенно в процессе смены поколений. Любая пресная или солёная вода из естественных водоёмов содержит большее или меньшее количество ионов кальция. Это один из самых необходимых элементов: у водных ракообразных и моллюсков он обеспечивает твёрдость панциря или раковины, у рыб костной системы. Ионы кальция играют также важную роль в регуляции осмотического давления, о котором мы расскажем ниже, и многих других процессов в организме. Так, у некоторых рыб содержание Ca в крови зависит от степени зрелости половых желёз. Согласно принятой у нас системе стандартизации, жёсткость выражают в ммоль-эквивалентах ионов кальция (Ca++) или магния (Mg++), содержащихся в 1 литре воды. 1 ммоль-экв. соответствует содержанию в воде 20,04 мг Ca++ или 12,16 мг Mg++. В аквариумной практике жёсткость обозначают в градусах. Одному градусу жёсткости (русскому или немецкому) соответствует содержание 10 мг оксида кальция (CaO) или 7,19 мг окиси магния (MgO) в 1 литре воды и он равен 0,35663 ммоль-экв. Жёсткость подразделяют на временную (карбонатную) и постоянную (некарбонатную). Карбонатная жёсткость обусловлена присутствием гидрокарбонатов кальция и магния. При кипячении гидрокарбонаты разрушаются, а ионы Ca2+ и Mg2+ выпадают в осадок в виде малорастворимых карбонатов. С течением времени часть выпавших в осадок карбонатов вновь растворяется, особенно в щелочной воде с показателем PH=8,3, что приводит к повышению временной жёсткости. Жёсткость, сохраняющаяся после кипячения воды, называется постоянной. В основном все тесты для определения жёсткости воды сделаны для измерения жёсткости в градусах. Не будем и мы здесь расписывать в иных единицах измерения, запишем сразу в градусах. Итак, в зависимости от жёсткости вода подразделяется:
В литературе по аквариумистике чаще всего при указании жёсткости используют "немецкие градусы жёсткости". Ниже приведена таблица перевода из немецких градусов в градусы других стран и наоборот.
Данные в ppm (раrts per million) при условии, масса 1 литра воды равна 1 кг. Жёсткость природных вод может варьироваться в довольно широких пределах и в течение года непостоянна. Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда. Наибольшей жёсткостью отличаются воды морей и океанов, а также водоёмов с грунтом, состоящим из кальциевых пород. Наименее жёсткая вода содержится в водоёмах, которые питаются исключительно атмосферными осадками (при условии, если в их грунтах не содержится кальций), в водоёмах тундры и тайги, в лесных водоёмах и в реках, протекающих в местностях с торфяными грунтами. Практический совет: Обратите внимание не предыдущий абзац вверху - данный природный способ можно использовать и в аквариумном хозяйстве. Чтобы содержать и разводить аквариумных рыб, нужно поддерживать определённую жёсткость воды. Если в качестве грунта использовать крупнозернистый песок и речную гальку, тогда вода аквариума будет иметь более или менее постоянную жёсткость. Надо запомнить и то, что в аквариумах, где содержатся рыбы и моллюски, жёсткость постепенно снижается, ведь кальций расходуется на построение моллюсками своих раковин, он усваивается растениями и рыбами. Какие же имеются способы снижения жёсткости: Практический совет: 1. Прежде всего в аквариум можно добавлять дистиллированную, дождевую или талую воду.2. Можно использовать такие аквариумные растения, как элодея и роголистник.3. С помощью вымораживания. Воду наливают в низкий таз и ставят на мороз или в морозильник. После того, как вода наполовину высоты сосуда замёрзнет, пробивают лёд, воду выливают, а лёд растапливают.4. Путём смешивания с более мягкой водой. Это тоже ясно.5. Путём кипячения воды. Воду кипятят в течении часа в эмалированной посуде. Затем охлаждают и сливают 2/3 верхнего слоя, у которого жёсткость будет снижена за счёт понижения временной жёсткости. Несколько способов повышения жёсткости: Практический совет: 1. Путём кипячения. Воду кипятят, как описано выше, но используют нижний слой.2. Путём смешивания с более жёсткой водой.3. Добавление небольших кусочков известняка, мела, мраморной крошки, ракушек, цветного стекла.4. Путём добавления в воду хлорида магния и кальция, соды.5. Добавление в аквариум раковин рапанов, коралловой крошки (необходимо длительно выварить) ЭЛЕКТРОПРОВОДНОСТЬ(микросименс)Отправляясь в путешествие по тропикам, каждый профессионал непременно берёт с собой электронный тестер для измерения электропроводности: на свете очень мало вод, чистых настолько, чтобы они не проводили электричество. Но в Южной Америке они встречаются всё-таки довольно часто! Чтобы вода проводила электричество, в ней должны содержаться ионы (электрически заряженные частицы). Электропроводность воды определяет также “осмотическое соотношение” (содержание электролита) в аквариумной воде. Осмотическое давление имеет решающее значение для биологических показателей нерестовой воды. В большинстве случаев размножение рыб удаётся лишь тогда, когда искусственные условия насколько возможно приближены к естественным. В тропиках, на родине аквариумных рыб, вода чаще всего очень мягкая и бедная минеральными солями. Как уже упоминалось выше о жёсткости воды, в бассейне Амазонки нередко встречаются столь экстремальные водные показатели, что только удивляешься, как рыбы вообще могут там существовать, - например, при показателе PН 4,5 - 4,9. Как известно, в этой воде живёт, в частности, красный неон (Рaracheirodon axelrodi) и вплоть до самых последних лет эту маленькую жемчужину аквариумистики никак не удавалось заставить размножаться в наших условиях, как и некоторые виды расборы из Юго-Восточной Азии. Достигнутые в недавнее время успехи в этой области связаны в первую очередь с научными выводами о взаимосвязи между электропроводностью аквариумной воды и осмотическим давлением. Электропроводность воды измеряется с помощью маленького карманного прибора: транзисторного тестера. Этот прибор стоит относительно недорого и даёт заинтересованному аквариумисту точные показания.
Определять электропроводность следует при 20° С. Если измерение надо провести на открытом воздухе, где нет возможности довести воду до этой температуры, то надо задать действительную температуру. Тогда результат окажется, к примеру, нS26. Температура воды оказывает решающее воздействие на результат. Идеальны для размножения рыб показатели от 25 до 140 нS. Но следует подчеркнуть еще раз, что дистиллированная вода хоть и может иметь 0° жёсткости, но почти никогда 0 нS электропроводимости. Практика показывает, что градусы проводимости дистиллированной воды всегда достаточно высоки. Если заселить рыб в резервуар, где вода имеет другие показатели, могут возникнуть проблемы. Поэтому при слишком резких изменениях проводности аквариумисты из предосторожности пересаживают производителей постепенно. Таким образом им можно помочь приспособиться к новым жизненным условиям. Сообразно своей природе, рыбы, происходящие из очень бедных минералами вод, для выведения молодняка нуждаются в такой же воде, даже если множество их поколений содержались в воде более жёсткой, а значит - богатой минералами. Причина этого - структура рыбьей яйцеклетки. Икринки, как и спермии, состоят из клеток, заключенных в очень тонкую оболочку, так называемую мембрану. Клетки содержат, в частности, воду, а в ней находятся минеральные вещества. Сама икринка тоже окружена водой, и в ней опять-таки растворены минеральные соли. Таким образом, здесь сталкиваются друг с другом два элемента, разделенные одной только упомянутой выше тоненькой мембраной и кажущиеся одинаковыми, но на самом деле зачастую не являющиеся таковыми.
Выше уже говорилось о том, что определение электропроводности и результат измерений зависят от температуры. Как только температура повышается хотя бы на 1° С, измеряемая величина тоже увеличивается приблизительно на 2 %. Чаще всего её пересчитывают по отношению к 20° С. Как это делается, вы можете понять из таблицы.
Теперь рассмотрим ещё один показатель воды: СОЛЕВОЙ СОСТАВ И РЕГУЛЯЦИЯ ОСМОТИЧЕСКОГО ДАВЛЕНИЯОдной из основных проблем всех водных обитателей, независимо от сложности их организации, является регуляция осмотического давления. Осмотическое давление развивается в результате диффузии молекул воды через полупроницаемую мембрану живых клеток. В его основе лежит свойство мембран избирательно пропускать молекулы одних веществ и задерживать молекулы других. При разной концентрации солей по обе стороны мембраны, например внутри клетки и вне её, диффузия молекул воды в область большей концентрации солей возрастает. Так как концентрация растворимых веществ и белков в клетке больше, чем в пресной воде, пресноводные организмы вынуждены проделывать огромную работу по удалению избытка проникающей в их тело воды. Одним из эволюционных приспособлений, направленных на ограничение проникновения воды в ткани пресноводных рыб, является меньшая, чем у морских рыб, концентрация солей в их крови и тканевых жидкостях. Кроме того, пресноводные рыбы обладают развитыми почками, обеспечивающими удаление избытка воды из организма. Моча этих животных содержит меньше солей, чем кровь и тканевые жидкости. Достаточно часто функция растворённых в воде солей сводится к их косвенному влиянию на рыб через пищевые цепи. К основным минеральным компонентам среды относятся фосфорные и азотные соли. Это связано с той ролью, которую в живых клетках играют молекулы, содержащие атомы фосфора и азота. Меньшее значение имеют калий и кальций, а также сера и магний. В последнем, кроме животных, огромную потребность испытывают растения, так, как этот элемент совершенно необходим для биосинтеза хлорофилла. Действие солей усиливается с повышением температуры, что связано с возрастанием интенсивности обменных процессов. В меньших количествах, но не в меньшей мере необходимы так называемые микроэлементы - кобальт, марганец, медь, цинк, бор, йод, кремний и некоторые другие. На рыбах болезненно отражается чрезмерное содержание в воде солей кальция и железа. Даже незначительная примесь последних вызывает у взрослых рыб заболевания глаз, а у мальков - поражение жабр, сопровождаемое массовой гибелью. Многие вещества, растворённые в воде, можно отнести к ядовитым или вредным. Это сероводород, углекислый газ и аммиак - естественные продукты, образующиеся в водоёмах, а также соединения тяжёлых металлов, неорганические и органические продукты стоков промышленных предприятий. Последняя группа ядов в условиях аквариума не встречается. Количество солей в пресной воде ничтожно (не превышает десятых долей грамма на литр) и меняется в пресноводном аквариуме в зависимости от грунта, содержания продуктов распада, испаряемости воды. Изменения эти невелики, и рыбы и растения легко к ним приспосабливаются. В отдельных случаях аквариумисты намеренно несколько повышают солёность добавлением поваренной соли. Теперь немного о свете, т.е. об освещённости воды. ОСВЕЩЁННОСТЬ ВОДЫДалее хотелось бы немного остановиться на таком параметре, как осещённость воды, но совсем коротко. Здесь мы только хотели коснуться этого вопроса в общих чертах. И так: Существование жизни на Земле возможно благодаря энергии Солнца. Свет представляет собой один из самых изменчивых и в тоже время самый регулярный в своём воздействии фактор внешней среды. Он является необходимым условием для существования растительных организмов, а также для поедающих их животных. Рыбам свет необходим для ориентирования в пространстве, нахождения пищи и своевременной реакции на приближение хищника. Для животных, обитающих в воде, основным источником света является солнечная радиация, которая поступает из атмосферы в поверхностные слои воды. Количество проникающего света определяется не только временем суток или прозрачностью атмосферы, но и состоянием водной поверхности: гладкая поверхность отражает значительно меньше солнечных лучей. Определённая часть солнечной радиации поглощается водой, причём меньше других поглощаются синие лучи; красные лучи поглощаются значительно сильнее. Основным органом восприятия света у рыб является глаз. Большая часть рыб различает цвет. Спектр цветов, воспринимаемых рыбами, во многом определяется экологическими особенностями мест обитания. Естественно, что обитатели верхних слоёв воды, как и рыбы мелководья и прибрежных зон, различают значительно больше цветов, чем глубоководные рыбы. В сумерках рыбы воспринимают только коротковолновые лучи. Окраска тела большинства рыб самым тесным образом связана с особенностями освещения, зависящими, в свою очередь, от условий мест обитания и биологии животных. Она изменчива и в процессе индивидуального развития может претерпевать значительные перемены. Часто она изменяется в течение суток. Значительную роль играет освещённость и в развитии рыб, регулируя половое созревание и особенности полового цикла. Для нормальной жизнедеятельности рыб и растений в аквариуме требуется различная потребность в освещении. На практике продолжительность светового дня необходима от 8 до 10 часов в сутки. Свет бывает естественный, смешанный и искусственный. Если аквариум находится недалеко от окна, то он будет в полной мере обеспечен естественным светом. Смешанное освещение обычно используется осенью и зимой, а также, если стремятся к декоративному эффекту или когда выращиваются преимущественно водные растения. Искусственное освещение зависит от силы освещения из окна и от конструкции аквариума. Для содержания, а часто и для разведения большинства различных видов рыб и растений, не имеет большого значения, будет ли аквариум освещаться естественным или искусственным светом. Однако преимущество последнего в том, что его силу легко регулировать. Освещение аквариума солнечным светом имеет свои недостатки, главный из которых - трудность регулирования интенсивности и продолжительности естественного освещения. Кроме того, при установке аквариума у окна рыбы смотрятся невыразительно. Интенсивность освещения в аквариуме должна соответствовать интенсивности освещения, свойственной рыбам и растениям в природных водоёмах. Она регулируется опытным путём. При этом следует учитывать объём аквариума и количество живых организмов, его населяющих. Теперь немного о температуре воды. ТЕМПЕРАТУРА ВОДЫДиапазон известных нам температур очень велик - от многих тысяч градусов на Солнце и других звёздах до близкого к абсолютному нулю холода космического пространства. В условиях биосферы Земли разница между максимальными и минимальными температурами гораздо меньше и не достигает даже нескольких сотен градусов. В значительно меньшем интервале, измеряемом несколькими десятками градусов, способны расти, развиваться и размножаться большинство известных нам живых существ. Для некоторых организмов этот диапазон бывает ещё более узким. В водной среде колебания температуры выражены значительно меньше, чем в атмосфере, что связано с высокой удельной теплоёмкостью воды. Верхним пределом для подавляющего большинства видов рыб является +40 градусов С, а нижний предел близок к температуре замерзания воды, и такую температуру переносят большинство видов. На организм рыб температура влияет двояко. В первую очередь это прямое воздействие, особенно существенное для рыб, как животных с непостоянной температурой тела. У большинства рыб температура тела лишь на 0,5-1 градус С выше температуры водной среды. Если учесть, что большинство обменных процессов в организме контролируется ферментами, активность которых очень зависит от температуры, то связь между температурой водной среды и интенсивностью обмена веществ станет совершенно очевидной. Для каждого вида рыб существует определённый верхний и нижний предел температуры воды; если этот предел нарушается, рыба гибнет. Конечно, бывают случаи, когда при значительном понижении температуры воды рыбы не погибают, а просто становятся вялыми, однако без вредных последствий (например потеря способности к размножению, различные заболевания). С повышением температуры в указанных для водной среды пределах обменные процессы в организме рыбы усиливаются, что вызывает увеличение потребления кислорода. Известно, однако, что с повышением температуры растворимость в воде газов и, в частности кислорода, уменьшается. Таким образом осуществляется косвенное влияние повышения температуры на рыб, когда вопреки возрастающим потребностям организма обеспечение кислородом снижается, и животные в конечном итоге погибают от удушья. Следует отметить однако, что усиление обмена веществ (в частности, скорости переваривания пищи) наблюдается лишь в области оптимальных для данного вида рыб температур. По превышении определённого порога включаются различные физиологические и биохимические защитные механизмы, благодаря чему, например, холодноводные рыбы на действие высоких температур отвечают снижением интенсивности питания и резким снижением активности. Если пересадить рыб из тёплой воды в холодную, у них наступит шоковое состояние, которое внешне проявляется в том, что рыбы плавают медленно, вяло шевеля плавниками и жабрами, или неподвижно лежат на дне. В конце концов они гибнут. Если пересадить рыб из холодной воды в тёплую, они, напротив, мечутся по аквариуму, пытаются выпрыгнуть из воды. Практический совет: Чтобы избежать этого, пересаживать рыб необходимо только тогда, когда температура в обоих сосудах будет одинаковой или не превышать 2 градусов С при пересадке из более тёплой воды в более холодную и 4 градусов С - из более холодной воды в более тёплую. При пересадке мальков эта разница должна быть в два раза меньшей. Тропических рыб вообще не рекомендуется пересаживать из более тёплой воды в более холодную. Температура воды в значительной мере регулирует такие важные стороны жизненного цикла рыб, как созревание половых продуктов и развитие оплодотворённой икры. Ускорение созревания икры или спермы связано с общим повышением интенсивности обмена веществ. Кроме того, на эти процессы оказывает влияние обеспеченность пищей самих производителей и подрастающей молоди. Этим, в частности, объясняется порционный нерест многих тропических видов рыб, молодь которых почти круглый год может найти себе необходимый корм. В природе наблюдаются колебания температуры воды, вызываемые её дневным прогревом и ночным охлаждением. Амплитуда этих колебаний иногда может достигать 10 градусов С и более. Если в естественной водной среде рыбы могут подниматься или опускаться в слои с оптимальной для них температурой, то в аквариуме у них такая возможность отсутствует. В связи с этим для большинства рыб амплитуда между максимальной и минимальной температурой не должна превышать 2-3 градусов С, а в период нереста - 1 градуса С. Поддержание температуры на необходимом для конкретного вида или группы видов уровне является обязательным. Каким образом добиться постоянной температуры. Практический совет: Несмотря на то, что все рыбы безболезненно переносят недолгое пребывание в воде, температура которой оказалась ниже оптимальной, не в коем случае не следует, обнаружив своё упущение, стремиться к быстрому повышению температуры - достаточно устранить неисправность, способствуя плавному установлению температуры на необходимом уровне. И ещё один короткий совет в заключении: Приобретая рыб, прежде всего выясните при какой температуре они жили на прежнем месте. Знать это необходимо для того, чтобы постепенно приучить их к температуре воды в данных условиях. Также следует поступать, приобретая и водные растения. Ну и в заключении темы о свойствах и параметрах воды, необходимо немного рассказать о содержании в воде кислорода, углекислого газа, сероводорода и азота. КИСЛОРОД, УГЛЕКИСЛЫЙ ГАЗ, СЕРОВОДОРОД, АЗОТ В ВОДЕУсвоение животными кислорода и удаление углекислого газа столь же необходимо, как пищеварение и усвоение пищи, и является основой всех процессов жизнедеятельности. Потребность в кислороде определяется энергетическими затратами организма на движение, работу внутренних органов, обеспечение потребностей каждой клетки тела. Следует различать физиологические процессы обмена кислородом и углекислым газом между организмом а внешней средой (газообмен) и биохимические процессы использования кислорода и образования углекислого газа в клетках (тканевое или клеточное дыхание). Газообмен - очень важный для организма процесс, эффективность которого обеспечивает в конечном итоге его выживание. И кислород, и углекислый газ (СО3, другое название - диоксид углерода) представляют собой газоообразные вещества, именно в таком виде они усваиваются или выделяются наземными животными. Их соотношение в атмосферном воздухе составляет в среднем 700:1, что создаёт благоприятные возможности для дыхания. В воде это соотношение совершенно иное. Вследствие ограниченной растворимости максимальное содержание кислорода в воде приблизительно в 20 раз меньше, чем в воздухе. Углекислый газ в отличие от кислорода способен не только растворяться, но и реагировать с водой химически, образуя угольную кислоту. Физический процесс растворения углекислого газа протекает главным образом в кислой среде. В нейтральной и особенно щелочной среде значительная часть диоксида углерода вступает в химические реакции с содержащимися в воде солями. Худшая (по сравнению с наземными животными) обеспеченность водных животных кислородом в известной мере компенсируется лёгкостью отдачи диоксида углерода, обусловленной его химическим связыванием. Хотя таким образом и облегчается газообмен, в специфических условиях водной среды остаётся нерешённой главная проблема - доступность кислорода. Это послужило причиной возникновения самых различных приспособлений организмов. Известно, например, что на разных стадиях своего индивидуального развития животные по-разному переносят дефицит кислорода. Так, у рыб, обитающих и размножающихся в озёрах с пониженным содержанием кислорода, часто встречается мелкая икра. Это приводит к увеличению отношения поверхности икринки к её объёму, что облегчает газообмен. Икра других рыб имеет приспособления, обеспечивающие её развитие на богатой кислородом поверхности или в толще воды. Кажущееся на первый взгляд непонятным наличие у многих рыб проточных вод придонной икры связано с гораздо лучшей обеспеченностью их кислородом в сравнении с придонными зонами стоячих вод. Таким образом, для большинства рыб (как и для других водных животных) кислород очень часто является фактором, лимитирующим их развитие и расселение. Как уже говорилось, углекислый газ является одним из конечных продуктов обмена веществ живых клеток. Газообмен гидробионтов, а также растворённый в воде углекислый газ воздуха - основные источники диоксида углерода в водоёмах. Растворение СО3 сопровождается образованием и диссоциацией угольной кислоты и способствует подкислению водной среды. В свою очередь, поглощение СО2 растениями в процессе фотосинтеза уменьшает активную реакцию водной среды (PH), которая при значительном развитии фитопланктона в период цветения водоёмов смещается в щелочную сторону. При этом растения не только полностью потребляют растворённый СО2, но и способствуют переходу гидрокарбонатов в карбонаты. Растения, в отличие от животных, страдающих от повышения содержания СО3 в воде, отзываются на это усилением фотосинтеза. Углекислота, или двуокись углерода, при растворении в воде образует слабую кислоту (в литературе её часто называют также угольной кислотой). Но аквариумист не должен путать разные термины, когда они записаны в виде химических формул: Уголь - С (от Саrboneum, уголь). Окись углерода, угарный газ - СО. Двуокись углерода, углекислый газ - СО (газ без запаха и цвета, содержится также в подкормках для растений). Угольная кислота - h3CO3 (растворённая в воде двуокись углерода; слабая кислота). Первый вывод: углекислота делает воду кислой. Это и есть та самая причина, по которой на водопроводных станциях у воды перед пуском её в потребительскую сеть понижают кислотность. Кислота агрессивна и могла бы воздействовать на систему трубопроводов. Любая природная вода содержит углекислоту в разных количествах, в растворённой или связанной форме. Углекислота связывается с соединениями кальция и магния, иными словами: чтобы в воде был кальций, там должно быть и некоторое количество свободной углекислоты. Если содержание углекислоты избыточно, ее называют свободной или растворённой. Чем выше доля бикарбоната кальция в воде, тем выше и доля связанной углекислоты. Под удобрением CO2 в аквариумистике подразумевается подкормка аквариумных растений углекислым газом с помощью диффузора. Чтобы усваивать углекислоту, растениям нужно много света. Только благодаря свету может начаться процесс ассимиляции, а основательное поглощение CO2 листья растений доказывают тем, что выпускают крошечные пузырьки кислорода. Если подача углекислоты в аквариумную воду чрезмерна, это скажется на понижении показателя PН. Слишком сильный приток углекислоты мешает свободному дыханию рыб и приносит вред: рыбы зависают прямо под поверхностью воды и пытаются пропустить через свои жабры богатую кислородом воду. В нарушенной аквариумной среде на верхней стороне листьев растений иногда появляются известковые отложения. Это явление, называемое “биогенным отложением извести” или "бикарбонатной ассимиляцией”, проявляется тем сильнее, чем выше карбонатная жёсткость воды при одновременном мощном освещении. В таком случае из-за недостатка углекислоты процесс идет в обратном порядке. Так как свободной или растворённой углекислоты нет, то растения поглощают нижней стороной листа бикарбонат кальция, растворяют внутри листа связанную углекислоту и выпускают с верхней стороны гидроокись кальция - Са(ОН)2. При этом карбонатная жёсткость воды уменьшается, а показатель PН возрастает. На листьях виден сероватый налёт, и поверхность их на ощупь становится довольно жёсткой (как бы посыпанной порошком). Многим аквариумистам известно, что в мягкой воде растения развиваются плохо. В первую очередь это связано с тем, что отсутствие извести - это отсутствие амортизатора для углекислоты. С другой стороны, при использовании так называемого удобрения CO2 вполне достаточно небольшой добавки углекислоты, чтобы обильно подпитать растения. В ночное время процесс ассимиляции приостанавливается, а потому подкормку растений CO2 тоже надо прекратить. Источник кислорода для аквариумных рыб - водные растения и атмосферный воздух. Если поверхность аквариума достаточно велика, а уровень постоянно перемешиваемой воды низок, в этом случае значительное количество кислорода поступает из воздуха. Такой тип аквариума обычно применяется как нерестилище; в них не должно находиться большое количество рыб. В обычном аквариуме, где поверхность воды небольшая, а уровень высок, атмосферного кислорода поступает в воду немного. Для насыщения воды кислородом существует два способа: механический и биологический. Первый - это аэрация аквариума с помощью компрессора. Поступающий при помощи распылителя воздух из нижних слоёв воды в аквариуме выходит на поверхность в виде пузырьков, при этом вода соприкасается с воздухом и обогащается кислородом. Второй способ - это выделение кислорода водными растениями. При отсутствии в аквариуме водных растений, рыбам не хватает кислорода; в таком случае они держатся на поверхности воды под углом 45 градусов и усиленно хватают воздух ртом. Такое кислородное голодание часто приводит к заболеванию и гибели рыб. Если в аквариуме избыток растений, он должен хорошо освещаться, чтобы происходил процесс фотосинтеза и выделения кислорода, иначе рыбы также могут погибнуть от удушья. Кислород должен быть растворен в любом аквариуме в возможно большем количестве. Кислород - это газ, чья растворимость в воде зависит от температуры: чем теплее вода, тем быстрее улетучивается кислород. Его нельзя рассматривать только как элемент, необходимый для жизни рыб: очищение воды от ядов тоже зависит от кислорода, потому что разложение ядовитых веществ обеспечивают в первую очередь кислородозависимые бактерии. Вода может поглощать кислород повсюду, но в природных водах (реки, озера, пруды) это происходит почти исключительно на поверхности. Вода колодцев и источников кислородом поэтому бедна. Если аквариумная вода активно обогащается кислородом за счёт подачи внешнего воздуха, то он может вытеснить имеющуюся углекислоту. В литературе по аквариумистике часто используется термин “насыщение кислородом”. Да, действительно можно достичь не только насыщения, но и перенасыщения воды кислородом, если за счёт ассимиляции растений он скапливается в избыточном количестве. Поглощение кислорода определяется температурой воды. Чем холоднее вода (над точкой замерзания), тем больше кислорода она может принять. Это касается и других газов, например, углекислого, хотя и в ином масштабе. В дальнейшей практике Вы можете использовать следующую таблицу:
О чём же эта таблица сообщает аквариумисту? Если для размножения рыб или из-за необходимости терапии (лечения болезни) температура воды превосходит норму, соответственно нужно увеличить и подачу кислорода. Опытный аквариумист узнает по частоте дыхания своих рыб, когда наступил этот момент, Правда, если рыбы вдыхают быстрее, чем обычно, не надо делать вывода исключительно о недостатке кислорода. В этом могут быть повинны и другие вещи, например, отравление или жаберные паразиты. Содержание кислорода в воде измеряется с помощью индикаторов, которые можно приобрести в специализированных магазинах. Практический совет: Избежать этих неприятностей можно, если установить оптимальный световой режим, проводить аэрацию воды с помощью компрессора, еженедельно заменять 1/5 часть воды со дна на свежую, сифонить грунт. В высоких аквариумах без искусственной аэрации воды в придонных слоях возникает недостаток кислорода. В этом случае не съеденные рыбами остатки пищи, опустившиеся на дно, не окисляются, а гниют. Это происходит в том случае, если аквариумист даёт рыбам избыточное количество живого и сухого корма. В процессе гниения происходит выделение сероводорода, который может привести к гибели рыб. Такая же ситуация возникает и тогда, когда грунт в аквариуме состоит из очень мелкого песка, что препятствует проникновению кислорода внутрь грунта. Признаками присутствия сероводорода служат потемнение верхнего слоя грунта и запах протухших яиц со дна аквариума, из которого слита вода. В случае появления в воде сероводорода, необходимо регулярно аэрировать аквариум воздухом; также следует заменить песок на более крупный. Азот плохо растворяется в воде и поэтому мало опасен для рыб. Однако в случае чрезмерной аэрации аквариума, под избыточным давлением пузырьки азота могут скапливаться и приводить к закупорке кровеносных сосудов рыб. Более опасны для них соединения азота, которые являются продуктами разложения органических веществ, таких, как остатки корма, экскременты и т.п. К таким соединениям следует отнести аммиак (Nh4 ) и аммоний (Nh5 ), которые могут проникать в ткани рыб. Соотношение этих веществ зависит от кислотности воды. При этом при высоком PH аммиак более ядовит, чем аммоний; при низком содержании кислорода в воде токсичность соединений азота увеличивается. Содержание аммония в количестве 0,2 мг/л допустимо, а такое же количество аммиака приводит к гибели рыб. Практический совет: При смене воды в аквариуме не доливайте сразу большое количество воды, поскольку в случае повышения уровня PH воды может произойти реакция, в результате которой аммоний может перейти в аммиак. Под действием нитрифицирующих бактерий аммиак и аммоний окисляются сперва до азотистой (HNO2), а затем до азотной (HNO3) кислоты. Соли азотистой кислоты - нитриты неустойчивы, но даже малое их количество опасно для рыб, так как отрицательно влияет на гемоглобин крови, на ткани и сосудистую систему рыб; соли же азотной кислоты - нитраты менее ядовиты. При отсутствии в аквариуме растений, а также при перенаселении аквариума рыбами происходит избыточное скапливание нитратов, что, в свою очередь, приводит к превращению нитратов в нитриты. Практический совет: Чтобы избежать таких неприятностей следует каждую неделю менять 10-15% воды, а также не допускать перенаселения аквариума. | |||||